Elektronen - fst
Werbung

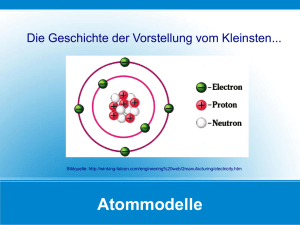
Fachschule für Technik Aufbau der Stoffe . Dipl.FL D.Strache Fachschule für Technik Teilchenmodell: Festkörper: In Festkörpern liegen die Atome dicht an dicht. Jedes dieser Atome wird von den umgebenen anderen Atomen an seinen Platz gehalten. Die Atome sind jedoch nicht in Ruhe, sondern führen um ihren Platz Schwingungen (Zappelbewegungen) herum aus. Sie können ihren Platz nicht verlassen Flüssigkeiten: In Flüssigkeiten liegen die Atome ebenfalls dicht an dicht. Sie können aber problemlos ihre Plätze untereinander tauschen. Auch ohne Einfluss von außen, bewegen sie sich dauernd um einander herum. Die Flüssigkeit können sie aber nicht ohne weiteres verlassen. Wegen der leichten Verschiebbarkeit der Atome, lassen sich Flüssigkeiten gießen, nehmen jede Gefäßform an, weichen beim Eintauchen fester Körper aus und neigen dazu eine waagerechte Oberfläche zu bilden. Gase: In Gasen bewegen sich die Atome mit großer Geschwindigkeit völlig unabhängig voneinander. Sie nehmen deshalb jeden verfügbaren Raum ein. Stoßen sie auf Nachbaratome, werden sie wie Billardkugeln in eine andere Richtung geworfen. Diese Eigenschaft lassen Gase im freien Raum schnell verflüchtigen. Dipl.FL. D.Strache Fachschule für Technik Atome, Elektronen und Ionen Um 500 vor Christus (v. Chr.) hat der griechische Naturphilosoph Leukipp den Begriff Atom eingeführt. Das Atom wird vom griechischen Atomos abgeleitet, was unteilbar bedeutet. Heute wissen wir, dass Atome nicht unteilbar sind und aus einer Anordnung von Neutronen, Protonen und Elektronen bestehen. Atommodelle Damals, zur Zeit Leukipps, wie auch heute, sind fast alle Definitionen und Erklärungen um Atome und Atommodelle eher theoretischer Natur. Nicht selten werden Atommodelle dazu benutzt unerklärbare Effekte oder Mechanismen eines Atoms plausibel zu erklären. Beispielsweise hat 1911 Rutherford das Atommodell mit Kern und Hülle entwickelt. Seiner Annahme zufolge bestand der Atomkern aus der gesamten positiven Ladung und die negativ geladenen Elektronen umkreisen in einer Hülle den Kern. Die Fliehkraft der kreisenden Elektronen sollte die Anziehungskraft durch den Kern auflösen und so die Elektronen in ihrer Bahn halten.1913 berechnete der dänische Physiker Niels Bohr die verschiedenen Energiestufen in einem Atom. Er entwickelte das Bohrsche Atommodell. Mit Rutherford stimmte er überein, dass Atome aus Kern und Hülle bestehen. Nur mit dem Unterschied, dass die Elektronen auf mehreren Bahnen, auch Schalen genannt, kreisen. Ein Atom ist der kleinste Baustein der chemischen Elemente. Es gibt über 100 verschiedene Atome, die ähnlich aufgebaut sind. Atome setzen sich aus einem Atomkern und einer Atomhülle zusammen. Der Aufbau ist mit einem Planetensystem vergleichbar: Eine Sonne, das soll der Atomkern sein, um die sich die Planeten drehen (Atomhülle). Der Atomkern befindet sich im Zentrum des Atoms. Er ist positiv geladen und enthält fast die gesamte Masse des Atoms. Er setzt sich aus Protonen und Neutronen zusammen. Dipl.FL D.Strache . Fachschule für Technik Atom / Atome Das hier dargestellte Atommodell ist das BohrAtommodell. Es ist eine Sicht, wie Elektronen, Protonen und Neutronen zueinander stehen. Dabei geht man davon aus, dass sich Elektronen auf einer festen Bahn um den Atomkern drehen. Neutronen sind elektrisch neutrale Teilchen. Sie kommen nur im Atomkern vor, weil sie in freiem Zustand nicht stabil sind. Die Anzahl der Protonen im Atomkern ist immer auch die gleiche Anzahl an Elektronen in der Atomhülle. Protonen existieren auch im freien Zustand. Elektronen Die Atomhülle ist aus Elektronen aufgebaut. Die Elektronen sind elektrisch negativ geladene Teilchen. Die Elektronen auf dem äußersten Ring (Schale) des Atoms werden Valenzelektronen genannt. Das Fließen des elektrischen Stroms in leitendem Material entspricht der Bewegung der Valenzelektronen. Ein Atom ist nach außen hin elektrisch neutral. Der Atomkern und die Atomhülle haben die gleiche Anzahl elektrischer Ladungen (Protonen und Elektronen). Dipl.FL D.Strache Fachschule für Technik Ionen: Atome mit mehr Elektronen als Protonen oder mehr Protonen als Elektronen werden Ionen genannt. Das Wort Ion stammt aus dem griechischen und bedeutet der Wandernde. Atome, die positiv oder negativ, also nicht elektrisch neutral, geladen sind, können sich gegenseitig anziehen oder abstoßen. Das heißt, sie können bewegt werden. Bei Atomen mit negativer Ladung spricht man von einem Elektronenüberschuss. Bei Atomen mit positiver Ladung spricht man von einem Elektronenmangel. Wird einem neutralen Atom Elektronen entnommen, so besitzt das Atom mehr positive als negative Ladungen. Das Atom zieht negative Ladungen an, und stößt positive Ladungen ab. Wird einem neutralen Atom Elektronen zugeführt, so besitzt das Atom mehr negative als positive Ladungen. Das Atom zieht positive Ladungen an, und stößt negative Ladungen ab. . Dipl.FL D.Strache Fachschule für Technik Ladungsträger Ladungsträger sind für den elektrischen Strom sehr wichtig. Ein elektrischer Strom kann nur fließen, wenn genug freie Ladungsträger vorhanden sind. Ladungsträger können Elektronen (metallische Ladungsträger) und Ionen (flüssige Ladungsträger) sein. Dipl.FL D.Strache Fachschule für Technik Die Welt des ganz Kleinen Dipl. FL D.Strache Vorstellungen über den Bau der Materie Demokrit denkt sich das Unteilbare, das Atom Dalton entwirft ein Atommodell Rutherford formuliert das Kern-Hüllenmodell Bohr spricht von Elektronenschalen Kimball postuliert Elektronenwolken Schrödinger und Heisenberg entdecken Orbitale ... Jedes Modell erklärt auf seine Weise Naturerscheinungen, aber noch niemand hat je ein Atom sehen können! Dipl. FL D.Strache Unsere Ziele: Wir wollen vor allem mit den Atommodellen von Bohr und Kimball umgehen können. Mit Hilfe dieser Modelle können wir einfache Bindungen, wie z.B. Wasser, erklären Wir können einfache Bindungen mit Mol- und mit Strukturformeln darstellen. Dipl.FL D.Strache Gedankenexperimente... Der griechische Philosoph Demokrit überlegte sich: Wenn ich eine Stoffprobe halbiere und dann wieder halbiere und wieder halbiere und so fort, so gelange ich zu einem kleinsten, nicht mehr teilbaren Teilchen. Alle Stoffe müssen aus solchen unteilbaren Atomen bestehen ... und das vor fast 2400 Jahren! John Dalton‘s Entdeckung... Dalton, John (1766-1844), britischer Chemiker und Physiker, entwickelte die Atomtheorie, auf der die moderne physikalische Wissenschaft beruht. Dalton wurde 1766 in Eaglesfield als Sohn eines Webers geboren. Unterricht erhielt er von seinem Vater. Dalton stellte sich die Atome als kleinste Kugeln verschiedener Grösse vor. Je nach Atomgewicht gehören diese Kugeln verschiedenen Elementen an. Elemente sind die Grundbaustoffe, aus denen alle Materie besteht: Rutherford dringt ins Innere ein... Rutherford, Ernest, Lord of Nelson and Cambridge (1871-1937), britischer Physiker, der für seine bahnbrechende Arbeit in der Kernphysik und für seine Theorie zur Atomstruktur den Nobelpreis erhielt. Anhand von Strahlungsuntersuchungen stellte Rutherford seine Theorie der Atomstruktur auf, in der das Atom erstmalig als dichter Kern mit ihn umkreisenden Elektronen beschrieben wurde. Bohr gliedert die Hülle in Schalen... Niels Bohr (1885-1962), dänischer Physiker und Nobelpreisträger, lieferte wichtige und grundlegende Beiträge zur Kernphysik sowie zum Verständnis des atomaren Aufbaus. Nach Bohr umlaufen die Elektronen den Kern in verschieden grossen Bahnen. Diese nennt er Elektronenschalen und gibt ihnen den Namen K-Schale, L-Schale, M-Schale, N-Schale usw. Bohr‘sches Atommodell... Neutronen elektrisch neutral Protonen positiv geladen Atomkern Atomhülle Bohr‘sches Atommodell... Neutronen elektrisch neutral Protonen positiv geladen Atomkern K-Schale Elektronen negativ geladen L-Schale M-Schale Atomhülle Bohr‘sches Atommodell... Merke dir folgende Begriffe rund um das Atommodell: Atomhülle Proton Neutron Symbol Nukleonen Atomkern Name Ladung positiv neutral Schalenname Anordnung Machen fast das gesamte Gewicht des Atoms aus! Elektron negativ K-Schale max. 2 Elektron negativ L-Schale max. 8 Elektron negativ M-Schale max. 18 Bohr‘sches Atommodell... Jede Schale kann nur eine ganz bestimmte, höchste Anzahl Elektronen aufnehmen. Diese Elektronenzahl lässt sich sehr einfach berechnen: Maximale E- Zahl = 2 * (Schalennummer) 2 Schale K L M N O P Q Schalennummer 1. 2. 3. 4. 5. 6. 7. Schale Schale Schale Schale Schale Schale Schale Formel = = = = = = = 2 2 2 2 2 2 2 * * * * * * * 1 2 3 4 5 6 7 max. Elektronenzahl 2 2 2 2 2 2 2 = 2 Elektronen = 8 Elektronen = 18 Elektronen = 32 Elektronen = 50 Elektronen = 72 Elektronen = 98 Elektronen Die Elemente unterscheiden sich durch die Masse ihrer Atome.... MZ Massenzahl 27 ( + 13 = 14 OZ Ordnungszahl ) 27 Chem. Symbol für Aluminium Al 13 und jedes Proton.... ... kann genau ein Elektron halten! Wir bauen das Modell für Aluminium: - 27 13 Al ..enthält 27 Nukleonen ..davon sind 13 Protonen, die je 1 Elektron festhalten 14 Nukleonen sind also Neutronen K-Schale max. 2 e13 14 L-Schale max. 8 eM-Schale also noch 3 e Diese Schale heisst auch Valenzschale Edelgaskonfiguration? Na ja... Atome sind dann „zufrieden“, wenn sie ihre Valenzschale mit 8 Elektronen gefüllt haben. Dies erreichen sie, indem sie fehlende Elektronen stehlen oder überzählige abgeben. Die Valenzschale von Argon ist mit 8 e- voll! Hückel-Regel: 8 wäre schön... Atome haben das Bestreben, ihre äusserste Schale voll besetzt zu haben: K-Schale: 2 eL-Schale: 8 eM- Schale: 8 eDies erreichen sie durch Bindungen! Sauerstoffatom Valenzschale: 6 e- Gemeinsame Benützung von je 2 e - Vom Atom zum Molekül... Zwei Sauerstoffatome binden sich chemisch zu einem Molekül Sauerstoff. Beide Atome können so zeitweise 8 Elektronen benützen. Das Molekül ist der kleinste Teil einer Verbindung! Molformel, was ist das? 1 Atom O + 1 Atom O 1 Molekül O2 O + O Die tiefgestellte 2 bedeutet, dass das Molekül aus 2 Sauerstoffatomen besteht! O2 MOLFORMEL Molformel, wie geht das jetzt? Was passiert, wenn du Kohle verbrennst? Also: Für jede Verbrennung (Oxidation) braucht es Sauerstoff. Kohle und Sauerstoff verbrennen zu Kohlendioxid. Kurz: Kohle 12 Beteiligte Stoffe: 6 + C + Sauerstoff 16 8 K-Schale: Valenzschale: Fehlende e- 2 e4 e4 e- *2 Reaktionsschema: C + Kohlendioxid O 2e6 e2 e- Hückel-Regel: 8 wäre schön... O2 ???? CO2 Molformeln für Sauerstoff- und Kohlendioxidmoleküle Wie habe ich mir CO2 nach Bohr vorzustellen? 1 Atom Kohlenstoff und 2 Atome Sauerstoff bilden zusammen 1 Molekül Kohlendioxid Kohlenstoff möchte 2 x 2 e- vom Sauerstoff Sauerstoff möchte je 2 e- vom Kohlenstoff Sauerstoff Sauerstoff Kohlenstoff Wie sehen die Bindungen in CO2 vereinfacht aus? Ein Molekül nach Bohr zu zeichnen gibt recht viel Arbeit! Wir vereinfachen, indem wir nur noch die Bindungen darstellen (Strukturformel): O C O Bindungen haben einen Namen: Beispiel Molformel Strukturformel CO2 O C O Bindungsart Doppelbindung Kohlendioxid Wasserstoffmolekül Stickstoffmolekül H2 N2 H N H Einfachbindung N Dreifachbindung Alle drei sind Atombindungen! Zusammenfassung: Der Chemiker beschäftigt sich in erster Linie mit den Valenzelektronen. Atommodelle helfen uns, Reaktionen zwischen Stoffen und deren Bindungen zu verstehen. Dalton und Bohr wurden hier vorgestellt. Wir arbeiten mit Mol- und Strukturformeln und sprechen von folgenden Atombindungen: Einfach-, Doppel- und Dreifachbindungen Einschränkung: Das Bohr‘sche Atommodell erklärt nicht alles! Für einfache Moleküle genügt es hinreichend Bindungswinkel werden hingegen nicht berücksichtigt. Sie vereinfacht das neue Modell zur Kurzschreibweise nach Kimball Die Strukturformeln bekommen eine Bindungsrichtung Ausblick: Das Wissen um Bohr und Kimball ist wichtig. Mit Hilfe der Ordnungszahlen lassen sich die Bindungszahlen ermitteln und daraus die Strukturformeln der Moleküle: Stoffname Stoff 1 BindungsStoff 1 Stoff 2 BindungsStoff 2 Mol formel Strukturformel Wasserstoffmolekül H I H I H2 H-H Sauerstoffmolekül O II O II O2 O=O Wasser H I O II H2O O Kohlendioxid C IV O II CO2 O=C=O Ammoniak H I N III NH3 N H H H H H Modell nach Kimball: Kimball Elektronen bewegen sich auf bestimmten Energiestufen. Elektronen bewegen sich (innerhalb dieser Stufen) in Kugelwolken. Jede Kugelwolke fasst maximal zwei Elektronen. Die äußere Energiestufe enthält maximal 8 Elektronen in 4 Kugelwolken. Kugelwolken werden zunächst einzeln und dann doppelt besetzt. Kimball - Kugelwolken Modellvorstellung am Beispiel ausgewählter Atome: Wasserstoff: Helium: Lithium: Der Pfeil steht für das Elektron eines Wasserstoffatoms. Die grüne Kugel beschreibt den Bereich um den Atomkern in dem das Elektron des Wasserstoffatoms mit 99% Wahrscheinlichkeit anzutreffen ist. Die Kugelwolke ist mit zwei Elektronen belegt. Die Elektronen unterscheiden sich in ihrem "Drehsinn". Die Kugelwolke des tiefsten Energieniveaus ist mit zwei Elektronen voll besetzt. Das dritte Elektron des Lithium belegt eine neue Kugelwolke, die weiter vom Atomkern entfernt ist. In der zweiten Periode erweitert sich der Raum (Aufenthaltsbereich der Kugelwolken) so, dass insgesamt vier weitere Platz haben. Kohlenstoff: Da die Elektronen einerseits von den Protonen im Atomkern angezogen werden, sich andererseits aber die Elektronen gegenseitig abstoßen werden Kugelwolken eines Hauptenergieniveaus zunächst einfach besetzt. Stickstoff: Die vier Kugelwolken des Stickstoffatoms richten sich in die Ecken eines Tetraeders aus. Vom Zentrum aus gemessen beträgt der Winkel 109°. Eine Kugelwolke ist mit zwei Elektronen doppelt besetzt. Dipl.FL. D.Strache