Ein Blick in die molekularen Vorgänge beim Lernen A first glimpse
Werbung

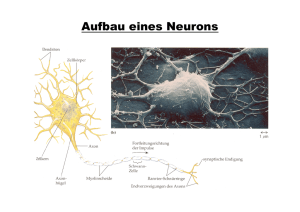
Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen Ein Blick in die molekularen Vorgänge beim Lernen A first glimpse at the molecular processes underlying learning Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael Max-Planck-Institut für Entw icklungsbiologie, Tübingen Korrespondierender Autor E-Mail: michael.kiebler@meduniw ien.ac.at Zusammenfassung Lernen und Gedächtnis sind elementare Eigenschaften höher entw ickelter Organismen. Unter Lernen versteht man die Fähigkeit, sich Kenntnisse anzueignen. Gedächtnis bezeichnet die Fähigkeit, die erlernten Inhalte zu speichern und in neuen Kontexten w ieder abzurufen. In den letzten 50 Jahren stellte sich heraus, dass sich verschiedene Arten von Gedächtnis bestimmten Regionen des Gehirns zuordnen lassen. Eine Region, die als Hippocampus bezeichnet w ird, spielt hierbei eine besondere Rolle: Sie beherbergt Zellen, die für das so genannte explizite Gedächtnis verantw ortlich sind. Unter dieser Form des Gedächtnis versteht man das bew usste W issen über die Welt - im Gegensatz zu Gedächtnisformen, die uns bei unbew ussten Handlungen leiten. Ziel unserer Forschung ist es, die zellulären und molekularen Grundlagen zu verstehen, die Lernen und Gedächtnis ermöglichen. Summary Learning and memory are fundamental properties of higher organisms. W hile learning is the ability to acquire know ledge, memory refers to the ability to store acquired information and recall it in a novel context. In the last 50 years, it became clear that different forms of memories can be attributed to distinct regions w ithin the brain. A region called hippocampus plays a crucial role in this process: it contains cells w hich are responsible for explicit forms of memories. Explicit memory represents conscious know ledge about the w orld, objects and people. Implicit memory, in contrast, represents unconscious procedures. Primarily w e are interested in understanding the molecular mechanisms underlying learning and memory. Einleitung und Fragestellung Die Kontaktstellen zw ischen Nervenzellen (Abb. 1) spielen bei der Bildung von Gedächtnisinhalten eine zentrale Rolle. Erlerntes w ird dabei auf unterschiedliche Arten gespeichert: Zum einen bilden sich beim Lernen neue Kontaktstellen, so genannte Synapsen. Zum anderen w erden bereits bestehende Synapsen für Signale leichter durchgängig. Erlerntes w ird initial im Kurzzeitgedächtnis gespeichert, indem Moleküle an existierenden Synapsen kurzfristig modifiziert w erden, z.B. durch eine Phosphorylierung von Proteinen. Eine langfristige Speicherung erfolgt hingegen immer durch eine Neubildung von Synapsen oder eine lang anhaltende Verstärkung der Signalübertragung. Diese Verstärkung beruht unter anderem auf der Synthese neuer © 2005 Max-Planck-Gesellschaft w w w .mpg.de 1/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen Proteine in der „lernenden“ Nervenzelle. Normalerw eise findet die Synthese von Proteinen im Zellkörper statt. In differenzierten Nervenzellen gibt es jedoch noch einen anderen Mechanismus: Anstatt fertige Proteine aus dem Zellkörper an die mitunter w eit entfernten Synapsen in den Ausläufern der Nervenzellen, den Dendriten, zu transportieren, w erden einige Proteine bei Bedarf direkt an der aktivierten Synapse hergestellt. Dieser Mechanismus bedingt aber, dass die Boten-RNAs (mRNAs), die für diese Proteine kodieren, in die Dendriten transportiert w erden müssen. Diesen mRNA-Transport w ie auch die lokale Proteinsynthese und deren Rolle bei der synaptischen Plastizität genauer zu untersuchen, ist unser Hauptinteresse [1]. Hierbei verw enden w ir sow ohl molekulare, genetische als auch biochemische Methoden. Ele k trone nm ik rosk opische s Bild (e inge fä rbt) isolie rte r Ne rve nze lle n. Im Ve rba nd m it Millia rde n von we ite re n Ne rve nze lle n sche nk e n sie uns ne be n vie le n a nde re n Fä higk e ite n a uch da s Erinne rungsve rm öge n. © Jürge n Be rge r Die letzten Jahre haben erste Einblicke in den zugrunde liegenden Mechanismus ermöglicht. In der Vergangenheit gelang es uns zusammen mit anderen Arbeitsgruppen nachzuw eisen, dass die mRNA in Zellen in Form von Ribonukleoprotein-Partikeln (RNPs) – einer Mischung aus mRNA mit assoziierten Proteinen – transportiert w ird [2]. In verschiedenen experimentellen Systemen w urden Proteine der mRNA- Transportmaschinerie identifiziert. Ein Vergleich dieser Faktoren zeigte einen erstaunlich hohen Grad an Konservierung der RNA-bindenden Proteine (Staufen, hnRNPs sow ie ZBPs) [3]. Im Gegensatz zu den Proteinen ergab eine Analyse der transportierten mRNAs bisher keine konservierten Sequenzmotive. Offenbar sind die Transportsignale der mRNA komplexer Natur – w ahrscheinlich handelt es sich um konservierte Sekundär- bzw . Tertiärstrukturen im so genannten 3’-UTR Bereich, die über die Sortierung der mRNAs in verschiedene Regionen der Zelle bestimmen. Je nach Zelltyp erfolgt der Transport der RNPs entlang unterschiedlicher Komponenten des Zytoskeletts: über Aktinfilamente (z. B. in Hefe und Fibroblasten) oder über Mikrotubuli (z. B. in Neuronen und Oligodendrozyten). Es gibt Hinw eise darauf, dass die mRNAs an ihren Zielorten verankert und bei Bedarf lokal in Proteine übersetzt w erden können. W ir haben in der Vergangenheit verschiedene Aspekte dieser Vorgänge – Verpackung und Transport von RNPs sow ie lokale Translation von mRNAs – untersucht. Im Folgenden sind © 2005 Max-Planck-Gesellschaft w w w .mpg.de 2/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen einige ausgew ählte Beispiele aufgeführt, die unsere Arbeit illustrieren. Ergebnisse Erste experimentelle Hinw eise, dass die beiden an Doppelstrang-RNA bindenden Proteine Staufen1 [4] und Staufen2 [5] eine Rolle beim Transport von mRNAs in Dendriten spielen könnten, entstanden aus einer Zusammenarbeit mit Luc DesGroseillers (Montreal, Kanada) und Juan Ortín (Madrid, Spanien). Mittels Videomikroskopie in lebenden, transient transfizierten Neuronen ließ sich der Staufen-abhängige, dendritische mRNA-Transport in Partikeln erstmals sichtbar machen ( Abb. 2). Dieser erfolgte diskontinuierlich entlang von Mikrotubuli mit einer mittleren Geschw indigkeit von 6,4 µm pro Minute vom Zellkörper in die Dendriten und zurück [6]. Übe re x prim ie rte s Sta ufe n1-HA-P rote in in e ine r hippoca m pa le n Ne rve nze lle . Die k le ine n grüne n P unk te in de n Fortsä tze n de r Ne rve nze lle (sie he Ka ste n) ste lle n R NA-P rote in-P a rtik e l da r. © Fa bia n Tübing und Ma ssim o Ma lla rdo Nachfolgend galt es, die molekulare Zusammensetzung dieser Staufen-enthaltenden RNPs zu analysieren, die w ahrscheinlich Transportintermediate darstellen. Dazu haben w ir vor kurzem ein biochemisches Protokoll zur Anreicherung solcher RNPs entw ickelt, das uns erlaubt, Staufen1-enthaltende RNPs aus Rattenhirnextrakten zu isolieren [7]. Im Gegensatz zu den größeren, membrangebundenen Aggregaten [8] enthält diese Fraktion w eder endoplasmatisches Retikulum (ER) noch Ribosomen, sondern kofraktioniert mit dem molekularen Motorprotein Kinesin, das den Transport von RNPs entlang von Mikrotubuli vermitteln könnte. Des Weiteren gelang es nachzuw eisen, dass zahlreiche, meist unbekannte mRNAs in den Staufen1-Partikeln angereichert sind. Eine in diesen Fraktionen hoch angereicherte mRNA ist BC1, ein RNA Polymerase II Transkript, das keinen offenen Leserahmen (ORF) besitzt und offensichtlich eine w ichtige Rolle bei der Translationskontrolle spielt [9]. Das dendritisch lokalisierte BC1 ist neben der alpha-Untereinheit der Ca 2+/Calmodulin-abhängigen Kinase II (CaMKIIalpha) ein erster Kandidat für RNAs, der von Staufen1 in Säugerzellen gebunden und transportiert w ird [7]. Weitere, viel versprechende Kandidaten für dendritisch lokalisierte RNAs aus dieser Präparation w erden zur Zeit intensiv von uns untersucht. Mittlerw eile haben mehrere Labors detaillierte Proteomics© 2005 Max-Planck-Gesellschaft w w w .mpg.de 3/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen Studien von RNA-Transportgranula unternommen. Diese legen nahe, dass RNPs aus einem begrenzten Satz von Proteinen aufgebaut sind [10 und Referenzen in diesem Artikel; G. Evira & W. Sossin, unveröffentlicht]. Leider haben diese Versuche noch nicht zur Identifizierung viel versprechender mRNA-Kandidaten geführt. Daher hoffen w ir, mit unserer Analyse der mit Staufen-RNPs angereicherten Fraktion w ichtige Erkenntnisse über die molekulare Zusammensetzung der dendritischen mRNA-Transportmaschinerie in differenzierten Neuronen zu erhalten. In einem w eiteren Projekt gelang es uns – in Zusammenarbeit mit Daniel St Johnston (Cambridge, UK) – mit Barentsz (Btz) neben Staufen ein w eiteres, am mRNA-Transport beteiligtes Protein zu identifizieren. Btz ist ein Adapterprotein, das in Drosophila-Eizellen Staufen vorübergehend bindet und für den Transport der oskar mRNA an den posterioren Pol der Eizelle verantw ortlich ist [11]. Es gelang uns, das homologe Btz-Protein in Säugern zu identifizieren und zu zeigen, dass es nach w ie vor an Drosophila Staufen binden kann. Allerdings w ird es nicht mehr an das posteriore Ende der Eizelle transportiert und kann daher den Phänotyp der Drosophila btz1 Mutante nicht komplementieren. In Immunfällungen aus doppelt transfizierten Fibroblastenextrakten interagiert das Säuger-Btz mit Staufen1 in einer RNA-abhängigen Weise. Basierend auf diesem Experiment ließ sich die Staufen-Interaktionsdomäne in Säuger-Btz auf einen ca. 200 Aminosäuren langen Bereich eingrenzen, hierbei handelt es sich interessanterw eise um die einzige konservierte Domäne zw ischen Drosophila und Säuger-Btz [12; Zusammenarbeit mit Andrei Lupas, MPI für Entw icklungsbiologie, Tübingen]. In Dendriten hippocampaler Neurone co-lokalisieren Staufen und Btz in einzelnen Partikeln. Diese Daten legen nahe, dass Btz eine w eitere w ichtige Komponente der Staufen1-enthaltenden, neuronalen RNPs darstellt. Eine w eitere w ichtige Frage ist, in w elchem Zellkompartiment Staufen an mögliche cargo RNAs bindet und in RNPs verpackt w ird. Dazu haben w ir Staufen2-GFP als Reporterprotein verw endet und Punktmutationen eingeführt, die die RNA-Bindeaktivität von Drosophila-Staufen drastisch reduzierten, ohne die Faltung des Proteins zu beeinflussen. Praktisch alle der ausgew ählten und durch die Punktmutationen geänderten Aminosäuren w aren in Säuger-Staufen2 konserviert. W ährend W ildtyp-Staufen2 vorherrschend im Zytoplasma von Säugerzellen vorkam, sammelten sich mutierte Staufen2 Proteine in den Nukleoli an [13]. W ie könnte es zu dieser Anreicherung im Zellkern kommen? Staufen2 besitzt nahe der Doppelstrang-RNA-Bindedomäne 3 (dsRBD3) ein Kernimportsignal (NLS), aber es enthält kein klassisches Kernexportsignal (NES). Außerdem ist der Export von Staufen aus dem Zellkern resistent gegen eine Behandlung mit Leptomycin B – eine Substanz, die den NES-erkennenden Exportrezeptor CRM1 hemmt. Diese Daten legen nahe, dass Staufen bestimmte zu lokalisierende RNAs schon im Zellkern bindet und anschließend mit diesen ins Zytosol der Zelle transportiert w ird. Im Zellkern bindet möglicherw eise zusätzlich ein spezifischer Exportfaktor an RNA-beladenes Staufen, nicht aber an mutiertes Staufen. W ir haben seit kurzem Hinw eise darauf, dass es sich dabei um den kürzlich identifizierten tRNA Exportfaktor Exportin-5 handeln könnte. Diese Vermutung ließ sich durch folgendes Experiment bestätigen: Inhibiert man Exportin-5 durch RNA-Interferenz in HeLa-Zellen oder hippocampalen Neuronen, so kommt es zu einer Akkumulation von W ildtyp-Staufen2 im Nukleolus [13]. Exportin-5 w urde vor kurzem als der Exportrezeptor für mikroRNAs identifiziert [14]. Dies erlaubt die attraktive Hypothese, dass zumindest eine der Staufen2-Isoformen unter bestimmten Bedingungen in den Zellkern importiert w ird, dort möglicherw eise mikroRNAs bindet und anschließend über einen Exportin-5-abhängigen Export in das Zytoplasma transportiert w ird [15]. Zukünftig möchten w ir die Rolle von Staufen2 beim möglichen Export bestimmter RNAs aus dem Zellkern näher untersuchen und den zugrunde liegenden Exportkomplex biochemisch isolieren, um nähere Aufschlüsse über die Reifung der Staufen-RNPs im Zellkern von Neuronen zu erhalten. © 2005 Max-Planck-Gesellschaft w w w .mpg.de 4/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen Gibt es eine funktionelle Beteiligung des hirnspezifischen Staufen2-Proteins bei der Synapsenbildung? Trotz zahlreicher Hinw eise auf eine Beteiligung der Staufen-Proteine beim dendritischen RNA- Transport ist deren Rolle in Säugerzellen bisher nicht klar. Daher haben w ir begonnen, die Funktion des hirnspezifischen Staufen2 Proteins in differenzierten Nervenzellen zu untersuchen. Mittels RNA-Interferenz w urde Staufen2 in reifen Nervenzellen inaktiviert und der Effekt auf die Polarisation bzw . die Synapsenbildung untersucht. Dabei erhielten w ir zw ei w ichtige Ergebnisse: Zum einen spielt Staufen2 eine w ichtige Rolle bei der Ausbildung von Dendriten unreifer hippocampaler Neurone (B. Götze, Y. Xie und P. Macchi, unveröffentlicht). Zum anderen fehlten reifen Nervenzellen, die normalerw eise nach 10 Tagen in Zellkultur Synapsen ausbildeten, so genannte dendritic spines (Götze et al., zur Veröffentlichung eingereicht). Stattdessen beobachtete man lange Filopodien mit einem gestörten Aktin-Zytoskelett. Zudem w ar die Anzahl der funktionellen Synapsen in Staufen2-defizienten Neuronen signifikant reduziert, w as über eine reduzierte Anzahl von PSD-95 positiven Clustern, einem Marker für funktionelle Synapsen, an den Fortsätzen nachw eisbar w ar. Dieser Phänotyp w ird auch beobachtet, w enn man eine dominant-negative Form von Staufen2 in reifen hippocampalen Neuronen überexprimiert. Zudem haben w ir Hinw eise darauf, dass auch der Transport der in Dendriten lokalisierten beta-Aktin mRNA in diesen Neuronen gestört ist. Eine elektrophysiologische Analyse der Synapsenfunktion (Kollaboration mit U. Pehl und O. Klink; Naturw issenschaftliches Medizinisches Institut, Reutlingen) ergab eine deutlich reduzierte mEPSC (miniature excitatory postsynaptic current) Amplitude, jedoch keine Veränderung in der mEPSC-Frequenz. Diese Ergebnisse sind konsistent mit Chih et al. [16], die einen ähnlichen Phänotyp für Neuroligin-defiziente Neurone, einem für Synapsen w ichtigen Protein, beschrieben haben. Zusammenfassend legen diese Daten nahe, dass Staufen2 eine w ichtige Rolle bei der Ausbildung und der Aufrechterhaltung der dendritic spines spielt – beides Vorgänge, von denen man annimmt, dass sie einen w ichtigen Beitrag zur langfristigen Speicherung von Gedächtnisinhalten darstellen. Die Ergebnisse liefern die ersten experimentellen Hinw eise für eine Beteiligung von bestimmten Molekülen am dendritischen mRNA Transport und an der anschließenden lokalen Proteinsynthese, die w ichtig sind für so komplexe Vorgänge w ie Lernen und Erinnern. Alle bisherigen Projekte betrafen den Transport von RNAs in die Dendriten differenzierter Nervenzellen. Eine w ichtige Frage zum Verständnis der Plastizität von Nervennetzw erken ist, w ie beim Lernen eine Veränderung der Effizienz der neuronalen Kontakte, den Synapsen, stattfindet. Wenn eine Nervenzelle nicht nur an einer einzelnen Synapse erregt w ird (elektrische Aktivität), sondern gleichzeitig noch an einer w eiteren, unabhängigen Synapse eine spezifische Erregung erfährt, kommt es zu langfristigen Veränderungen: Ein bislang unbekannter Mechanismus erkennt die synchrone Erregung der beiden Synapsen und verbindet die Signale miteinander – die Zelle hat „gelernt“, dass die beiden Reize zusammenhängen. Der Pawlow´sche Hund aus der molekularen Perspektive Ein klassisches Beispiel für eine solche Kopplung von Reizen sind die Versuche von Iw an Paw low : Kurz bevor er seinen Hunden zu fressen gab, läutete er eine Glocke. Nach kurzer Zeit reichte bereits das Ertönen der Glocke, um den Hunden – im w ahrsten Sinne des Wortes – das Wasser im Mund zusammen laufen zu lassen. Sie hatten gelernt, die Glocke mit einer Nahrungsaufnahme zu verbinden. Ein Ziel unserer Forschung ist es, die molekularen Vorgänge in Nervenzellen zu verstehen, die diese Verknüpfung von Reizen und so die Bildung von Erinnerungen zu ermöglichen. Der molekulare Mechanismus, der die gleichzeitige Erregung einer Nervenzelle an zw ei unterschiedlichen Synapsen erkennt, ist zw ar noch unbekannt, aber die nachfolgenden Vorgänge, die zu einer Verstärkung der © 2005 Max-Planck-Gesellschaft w w w .mpg.de 5/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen synaptischen Effizienz der betroffenen Kontaktstellen führen, erhellen sich langsam. Zusätzlich zu den bekannten intrazellulären Signalkaskaden spielt die lokale Synthese von Proteinen an Synapsen auch hier eine w ichtige Rolle: Die von einem entsprechenden Gen im Zellkern kopierten mRNAs w erden zu den örtlichen Proteinfabriken in den Dendriten ausgew achsener Nervenzellen transportiert. Molekulare "Adressaufkleber" sorgen dafür, dass die mRNAs an der richtigen Stelle abgeliefert w erden. Spezielle Erkennungsproteine w ie Staufen oder Barentsz spielen dabei eine w ichtige Rolle. Koppelt man nun einen solchen dendritischen Adressaufkleber, z.B. ein Element in der 3'-untranslatierten Region der alpha-Untereinheit der Ca 2+/Calmodulin-abhängigen Kinase II (CaMKIIalpha), an eine mRNA, so findet man diese chimäre mRNA an den Synapsen. Zudem haben w ir in dieses Konstrukt die Sequenz für das grün-fluoreszierende Protein (GFP) sow ie einen von Matthias Hentze et al. [18] entdeckten molekularen Schalter eingebaut, der auf Eisenionen anspricht. Auf diese Weise steht uns ein neuartiges GFP-Reporterprotein zur Verfügung, das gleich drei w ichtige Voraussetzungen erfüllt: i.) Die für dieses Fusionsprotein kodierende RNA w ird in Dendriten transportiert, ii.) die Proteinsynthese lässt sich auf einfache Weise durch Eisen einschalten und kann iii.) durch das Auftreten grüner Fluoreszenz in jenen Stellen in der Zelle nachgew iesen w erden, an denen GFP hergestellt w urde [17]. Tatsächlich gelang uns auf diese Weise der Nachw eis der Proteinsynthese in einzelnen, aus dem Gehirn von Nagern kommenden Nervenzellen. Diese fand, w ie von uns erw artet, nicht nur (vorw iegend) im Zellkörper, sondern auch zu einem gew issen Teil in den Dendriten reifer Neuronen statt. Interessanterw eise bedurfte es aber nicht nur einer lokalen Zugabe von Eisen, sondern auch neuronaler Aktivität. Dies stellt eine w eitere, w ichtige Komponente der Regulation der Translation an der Synapse dar. Im Moment gilt es, noch ein technisches Problem zu überw inden: Die freie Eisenkonzentration im Zytoplasma muss lokal an einzelnen Synapsen erhöht w erden. Dies w ollen w ir durch lokale Perfusion, gekoppelt mit elektrischer bzw . chemischer Stimulation, erreichen. W ir versprechen uns von diesem experimentellen Ansatz, die lokale Proteinsynthese an den aktivierten Synapsen direkt nachzuw eisen und besser zu verstehen, w ie dieser Mechanismus funktioniert. Gerade dies stellt einen w ichtigen Aspekt für das Verständnis komplexer Vorgänge w ie Langzeitpotenzierung (LTP) und der Konsolidierung von Gedächtnisinhalten dar. Originalveröffentlichungen Nach Erw eiterungen suchenBilderw eiterungChanneltickerDateilisteHTML- Erw eiterungJobtickerKalendererw eiterungLinkerw eiterungMPG.PuRe-ReferenzMitarbeiter Editor)Personenerw eiterungPublikationserw eiterungTeaser (Employee mit BildTextblockerw eiterungVeranstaltungstickererw eiterungVideoerw eiterungVideolistenerw eiterungYouTubeErw eiterung [1] Kiebler MK & DesGroseillers L Molecular insights into mRNA transport and local translation in the mammalian nervous system. Neuron (2002) 25, 19-28. [2] Jansen RP mRNA localization: message on the move. Nat. Rev. Mol. Cell Biol. (2001) 2, 247-256. [3] Schnapp BJ A glimpse of the machinery. Curr. Biol. (1999) 9, R725-727. © 2005 Max-Planck-Gesellschaft w w w .mpg.de 6/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen [4] Kiebler MA, Hemraj I, Verkade P, Kohrmann M, Fortes P, Marion RM, Ortin J, and Dotti CG The mammalian Staufen protein localizes to the somatodendritic domain of cultured hippocampal neurons: implications for its involvement in mRNA transport. J. Neurosci. (1999) 19, 288-297. [5] Duchaine TF, Hemraj I, Furic L, Deitinghoff A, Kiebler MA and DesGroseillers L Staufen2 isoforms localize to the somatodendritic domain of neurons and interact with different organelles. J. Cell Sci. (2002) 115, 3285-3295. [6] Köhrmann M, Luo M, Kaether C, DesGroseillers L, Dotti CG and Kiebler MA Microtubule-dependent recruitment of Staufen-GFP into large RNA-containing granules and subsequent dendritic transport in living hippocampal neurons. Mol. Biol. Cell (1999) 10, 2945-2953. [7] Mallardo M, Deitinghoff A, Müller J, Goetze B, Macchi P, Peters C and Kiebler MA Isolation and characterization of Staufen-containing ribonucleoprotein particles from rat brain. Proc. Natl. Acad. Sci. USA (2003) 100, 2100-2105. [8] Krichevsky AM, Kosik KS. Neuronal RNA granules: a link between RNA localization and stimulation-dependent translation. Neuron (2001) 32, 683-696. [9] Wang H, Iacoangeli A, Popp S, Muslimov IA, Imataka H, Sonenberg N, Lomakin IB, and Tiedge H Dendritic BC1 RNA: functional role in regulation of translation initiation. J. Neurosci. (2002) 22, 10232-10241. [10] Kanai Y , Dohmae N and Hirokawa N Kinesin transports RNA: isolation and characterization of an RNA-transporting granule. Neuron (2004) 43, 513-525. [11] van Eeden FJ, Palacios IM, Petronczki M, Weston MJ, and St Johnston D Barentsz is essential for the posterior localization of oskar mRNA and colocalizes with it to the posterior pole. J. Cell Biol. (2001) 154, 511-523. [12] Macchi P, Kroening S, Palacios IM, Baldassa S, Grunewald B, Ambrosino C, Goetze B, Lupas A, St Johnston D, and Kiebler M Barentsz, a new component of the Staufen-containing ribonucleoprotein particles in mammalian cells, interacts with Staufen in an RNA-dependent manner. J. Neurosci. (2003) 23, 5778-5788. [13] Macchi P, Brownawell AM, Grunewald B, DesGroseillers L, Macara IG and Kiebler MA The brain-specific double-stranded RNA-binding protein Staufen2: nucleolar accumulation and isoformspecific exportin-5-dependent export. J. Biol. Chem. (2004) 279, 31440-31444. © 2005 Max-Planck-Gesellschaft w w w .mpg.de 7/8 Jahrbuch 2004/2005 | Macchi, Paolo; Götze, Bernhard; Tübing, Fabian; Mallardo, Massimo; Köhrmann, Martin; Kiebler, Michael | Ein Blick in die molekularen Vorgänge beim Lernen [14] Lund E, Guttinger S, Calado A, Dahlberg JE, and Kutay U Nuclear export of microRNA precursors. Science (2004) 303, 95-98. [15] Kiebler MA, Jansen RP, Dahm R, and Macchi P A putative nuclear function for mammalian Staufen. Trends Biochem. Sci. (2005) 30, 228-231. [16] Chih B, Engelman H, and Scheiffele P Control of excitatory and inhibitory synapse formation by neuroligins. Science (2005) 307, 1324-1328. [17] Macchi P, Hemraj I, Goetze B, Grunewald B, Mallardo M, Kiebler MA A GFP-based system to uncouple mRNA transport from translation in a single living neuron. Mol. Biol. Cell (2003) 14, 1570-1582. [18] Hentze MW, Caughman SW, Rouault TA, Barriocanal JG, Dancis A, Harford JB and Klausner RD Identification of the iron-responsive element for the translational regulation of human ferritin mRNA. Science (1987) 238, 1570-1573. © 2005 Max-Planck-Gesellschaft w w w .mpg.de 8/8