Ernährungstag-2016_AM-Update_Smollich
Werbung

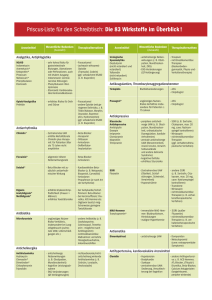
Arzneimittel-Update 2016 Prof. Dr. rer. nat. Martin Smollich Klinische Pharmakologie und Pharmakonutrition Studiengang Clinical Nutrition, praxisHochschule Rheine Teduglutid Kurzdarmsyndrom Rifaximin Reisediarrhö/HE Prucaloprid chronische Obstipation Naloxegol Opioid-induzierte Obstipation Netupitant Chemotherapie-ind. Emesis Evolocumab, Alirocumab Hypercholesterinämie Dulaglutid DM Typ 2 Teduglutid (Revestive®) ► IND Kurzdarmsyndrom bei Erw. erster zugelassener Wirkstoff für diese Indikation ► AW s.c. Injektion, 1x tgl. ► WM Analogon des Glucagon-like Peptid-2 (GLP-2) intestinaler Blutfluss Mukosaproliferation Darmzottenhöhe Darmkryptentiefe Resorptionssteigerung Reduktion der TPN intestinale L-Zellen GLP-2Rezeptor GLP-2 Dipeptidylpeptidase-4 (DPP4) Teduglutid Teduglutid (Revestive®) ► KI Krebserkrankung maligne GI-Erkrankungen in der Anamnese Überempfindlichkeit gegen Tetrazyklin ► UAW abdominale Schmerzen (49%) Stoma-Komplikationen (38%) Atemwegsinfektionen (26%) Übelkeit/Erbrechen (27%) ► IA keine Daten Begleitmedikation: Resorption 4 © Prof. Dr. M. Smollich Teduglutid (Revestive®) ► CAVE - Therapiebeginn erst nach intestinaler Adaptation - trophische Effekte an der Darmmukosa initial: Koloskopie & Entfernung von Polypen individuell engmaschige Folgekontrollen Berichte über Mukosaproliferation/Ileus Auftreten von Malignität: Therapie beenden - Flüssigkeitsabsorption CAVE: Herzinsuffizienz, Hypertonie, Ödeme CAVE: bei Absetzen Dehydrierungsgefahr! - Begleitmedikation: Resorption bei enger therapeutischer Breite: Spiegelbestimmung! 5 © Prof. Dr. M. Smollich Teduglutid (Revestive®) ► Zulassungsstudie STEPS-Studie (n = 86) - Teduglutid vs. Placebo - Endpunkt: Reduktion PE um mind. 20% in 20 Wochen Placebo: 30% der Patienten Teduglutid: 54% der Patienten G-BA: Zusatznutzen gering Therapiekosten pro Patient: 29.000 EUR/Monat ► Offene Fragen ? Identifikation prognostischer Faktoren (Patientenselektion)? Bleibt intestinale Adaptation nach Absetzen von Teduglutid erhalten oder muss lebenslang therapiert werden? langfristige unerwünschte Wirkungen? 6 © Prof. Dr. M. Smollich Rifaximin (Xifaxan®) ► IND - Reisediarrhö bei Erwachsenen nicht-invasive enteropathogene Bakterien NICHT: Prävention der Reisediarrhö - Prävention akuter Episoden einer manifesten hepatischen Enzephalopathie ► AW Filmtabletten ► WM Hemmung der bakteriellen RNA-Polymerase nicht resorbierbares Rifampicin-Derivat (BV: 0,4%) lokal antibiotische Wirkung im Darm Breitspektrum-Antibiotikum bakterizide Wirkung (gram-positiv und gram-negativ) Ammoniak-bildende Bakterien Hyperammonämie 7 © Prof. Dr. M. Smollich Rifaximin (Xifaxan®) ► KI Überempfindlichkeit gegen Rifampicin intestinale Obstruktionen ► UAW gastrointestinale Beschwerden (ink. AAD) rot verfärbter Urin (Patient informieren!) ► IA unwahrscheinlich östrogenhaltige orale Kontrazeptiva 8 © Prof. Dr. M. Smollich Rifaximin (Xifaxan®) ► CAVE - Reisediarrhö nicht anwenden: invasive Enteritis praktisch unwirksam in Asien & Südamerika präventive Anwendung (off-label) Gefahr: Selektion multiresistenter E. coli guter Effekt nur bei Hersteller-finanzierten Studien - Reserve bei CDAD (off-label, wirksam1) - Hepatische Enzephalopathie Dehydratation als UAW 1Nelson Gefahr akuter Episoden et al. 2011 9 © Prof. Dr. M. Smollich Rifaximin (Xifaxan®) ► Zulassungsstudie Reisediarrhö - placebokontrolliert wirksam1 - Nicht-Unterlegenheit gegenüber Ciprofloxacin2 ? Hepatische Enzephalopathie - placebokontrolliert wirksam (Bass-Studie, n = 299)3 Inzidenz akuter Episoden: -58% Sepsis , Gesamtmortalität 4 > 90% der Patienten erhielten parallel Laktulose ► Offene Fragen 1Steffen klinischer Stellenwert bei Reisediarrhö? Einsatz bei Reizdarmsyndrom? et al. 2003, 2Dupont et al. 2001, 3Bass et al. 2010, 4Liu et al., 2015 10 © Prof. Dr. M. Smollich Prucaloprid (Resolor®) ► IND symptomatische Behandlung chron. Obstipation „wenn andere Laxanzien nicht ausreichend wirksam“ ► AW Filmtabletten ► WM selektiver 5-HT4-Rezeptor-Agonist enteroprokinetische Wirkung (v.a. am Kolon) ► KI - dialysepflichtige Nierenfunktionseinschränkung - CED, Ileus, toxisches Megakolon ► UAW - gastrointestinale Beschwerden - Kopfschmerzen, Schwindel, Somnolenz ► IA sehr geringes IA-Potenzial 11 © Prof. Dr. M. Smollich Prucaloprid (Resolor®) ► CAVE - Dosisreduktion bei Nierenfunktionsstörung - Dosisreduktion bei geriatrischen Patienten - Fachinformation: Vorsicht bei… kardiovaskulären Erkrankungen neuropsychiatrischen Erkrankungen aber: UAW unwahrscheinlich durch sehr hohe Rezeptorselektivität - wirksame Alternative bei Magenentleerungsstörungen (off-label, Synergismus mit Domperidon)1 - Tagestherapiekosten Prucaloprid Lactulose Macrogol 1Kessing et al. 2014 3,20 EUR 0,55 EUR 1,20 EUR 12 © Prof. Dr. M. Smollich Prucaloprid (Resolor®) ► Zulassungsstudien 3 Zulassungsstudien (n = 1.960)1-3 - 88% Frauen, durchschnittliche Obstipationsdauer: 20 Jahre - Interventionszeitraum: 12 Wochen ABER: UAW nur in den ersten 4 Wochen erfasst - primärer Endpunkt: mind. 3 spontane Darmentleerungen/Wo. Placebo: 11% der Patienten Prucaloprid: 24% der Patienten ► Offene Fragen ? 1Camilleri Langzeitwirksamkeit/Gewöhnung? langfristige unerwünschte Wirkungen (kardial/neurologisch)? Stellenwert bei RDS-O? et al. 2008, 2Tack et al. 2009, 3Quiegly et al. 2009 13 © Prof. Dr. M. Smollich Naloxegol (Moventig®) ► IND Opioid-induzierte Obstipation „wenn andere Laxanzien nicht ausreichend wirksam“ ► AW Filmtabletten ► WM µ-Rezeptor-Antagonist (PAMORA) intestinale Antagonisierung der Opioid-Wirkungen Methylnaltrexon Morphin Naloxon Naloxegol Naloxegol (Moventig®) ► KI intestinale Obstruktionen (Perforationsgefahr ) Malignome mit erhöhter GI-Perforationsgefahr Malignome GI, Peritoneum, Ovar Therapie mit VEGF-Inhibitor CO-Medikation starke CYP3A4-Inhibitoren Azole, Clarithromycin, HIV-Protease-Inhibitoren, Grapefruit ► UAW abdominale Schmerzen, Diarrhö Kopfschmerzen, Hyperhidrose ► IA CYP3A4-Inhibitoren (BV ) und -Induktoren (BV 15 © Prof. Dr. M. Smollich ) Naloxegol (Moventig®) ► CAVE - Vorsicht bei erhöhtem GI-Perforationsrisiko! M. Crohn, peptische Ulzera, Divertikulitis, peritoneale Metastasen… - Vorsicht bei beeinträchtigter Blut-Hirn-Schranke! zentraler Opioid-Antagonismus Hirntumoren, ZNS-Metastasen, aktive MS, fortgeschrittener M. Alzheimer… - kardiovaskuläres Risiko unklar Patienten mit kardiovaskulärer Erkrankung aus Studien ausgeschlossen - Tagestherapiekosten Naloxegol Macrogol 1Kessing et al. 2014 4,10 EUR 1,20 EUR 16 © Prof. Dr. M. Smollich Naloxegol (Moventig®) ► Zulassungsstudien 2 Zulassungsstudien (n = 1.352)1 - Test nur gegen Placebo (nicht: Standard-Therapie) - ausschließlich nicht-onkologische Patienten (Alter: Ø 52 Jahre) - durchschnittlich 138 mg/d Morphin-Äquivalent - primärer Endpunkt: 1 zusätzliche Darmentleerungen/Wo. Placebo: 29% der Patienten Naloxegol: 40% der Patienten ► Offene Fragen ? 1Chey Vorteil gegenüber (prophylaktischem) Standard-Laxans? Vorteil gegenüber anderen PAMORA? Langzeitsicherheit? 17 et al. 2014 © Prof. Dr. M. Smollich Netupitant (Akynzeo®) ► IND Prävention von Übelkeit/Erbrechen bei stark oder mäßig emetogener Chemotherapie ► AW Hartkapseln (Kombinationspräparat) ► WM Netupitant: Neurokinin-1-Rezeptor-Antagonist me-too-Wirkstoff (Aprepitant, Fosaprepitant) Palonosetron: 5-HT3-Rezeptor-Antagonist mono bereits im Handel 18 © Prof. Dr. M. Smollich Netupitant (Akynzeo®) Netupitant Brechzentrum NK1 Subst anz P 5-HT3 H1 D2 Area postrema Palonosetron TOXIN N. vagus 5-HT3 5HT3 TOXIN enterochromaffine Zelle 19 © Prof. Dr. M. Smollich Netupitant (Akynzeo®) ► KI Schwangerschaft ► UAW Obstipation, Kopfschmerzen ► IA ► CAVE Docetaxel, Etoposid (deren BV SSRI (Serotonin-Syndrom) ) Wirksamkeit nur bei Einnahme vor Beginn der Chemotherapie 20 © Prof. Dr. M. Smollich Netupitant (Akynzeo®) ► Zulassungsstudie HEC-Studie (n = 694) - Patienten unter Cisplatin-Therapie - primärer Endpunkt: keine Emesis innerhalb von 120 h nach Cisplatin-Applikation Akynzeo®-Gruppe: 90% der Patienten Kontrollgruppe: 76% der Patienten Zusatznutzen nicht belegt Akynzeo®-Gruppe Kontrollgruppe Palonosetron 0,5 mg + Netupitant 300 mg + Dexamethason 12 mg Palonosetron 0,5 mg + Dexamethason 20 mg Cisplatin: 3er-Kombination ohnehin Leitlinienempfehlung! keine zweckmäßige Vergleichstherapie! 21 © Prof. Dr. M. Smollich Evolucumab (Repatha®), Alirocumab (Praluent®) ► IND - primäre Hypercholesterinämie - gemischte Dyslipidämien - homozygote familiäre Hypercholesterinämie (nur Evolucumab) ► AW Injektionslösung (Fertigpen), s.c. Inj. 1-2x/Monat ► WM monoklonarer AK gegen PCSK9 Inaktivierung von PCSK9 LDL-Rezeptor-Expression 22 © Prof. Dr. M. Smollich Evolucumab (Repatha®), Alirocumab (Praluent®) LDL-cholesterol metabolism in the presence or absence of PCSK9 Dadu, R. T. & Ballantyne, C. M. (2014) Lipid lowering with PCSK9 inhibitors Nat. Rev. Cardiol. doi:10.1038/nrcardio.2014.84 23 © Prof. Dr. M. Smollich Evolucumab (Repatha®), Alirocumab (Praluent®) ► KI Überempfindlichkeit gegen Bestandteile ► UAW Infektionen obere Atemwege, Nasopharyngitis, Urtikaria, Übelkeit, Arthralgie ► IA keine Daten ► CAVE Kostenvergleich (Therapiekosten pro Jahr) Repatha®, Praluent® 10.000 - 14.000 EUR Simvastatin 40 mg 60 EUR 24 © Prof. Dr. M. Smollich Evolucumab (Repatha®), Alirocumab (Praluent®) ► Zulassungsstudien 6 Zulassungsstudien (n = 4.096) - Vorteil: bei unzureichender LDL-Senkung durch Statine (> 100 mg/dl) weitere LDL-Senkung möglich um 30-45% - Nachteil: keine Daten zur kardiovask. Morbidität & Mortalität Zulassung nur aufgrund des Surrogat-Parameters „LDL-Senkung“ IQWiG: Zusatznutzen nicht belegt (keine ausreichenden Daten) ► Offene Fragen ? Langzeitdaten Morbidität, Mortalität, kognitive Endpunkte? Langzeitsicherheit? LDL-Senkung ist nicht alles: pleiotrope Effekte der Statine LDL: „the lower – the better?“ – klinisch nicht belegt 25 © Prof. Dr. M. Smollich Dulaglutid (Trulicity®) ► IND Diabetes mellitus Typ 2 - Monotherapie: bei Metformin-Unverträglichkeit/KI - Kombinationstherapie bei nicht ausreichender BZ-Kontrolle (auch in Kombination mit Insulin) ► AW Injektionslösung (Fertigpen), s.c. Inj. 1x wöchentlich ► WM GLP-1-Rezeptor-Agonist (mee-too, 5. GLP-1-Agonist) β-Zelle GLP-1-Rez. Insulin + Dulaglutid Ca2+ K+ PKA cAMP AC 26 © Prof. Dr. M. Smollich Dulaglutid (Trulicity®) ► KI ► UAW ► IA Überempfindlichkeit gegen Bestandteile Übelkeit/Erbrechen, Diarrhö, GERD (sehr häufig) Hypoglykämien akute Pankreatitis keine Daten 27 © Prof. Dr. M. Smollich Dulaglutid (Trulicity®) ► CAVE - CAVE: Patienten mit (diabetischer) Gastroparese! - Körpergewicht Hauptursache: UAW Werbung: frühe Sättigungsgefühle - G-BA-Bewertung Monotherapie Kombitherapie Zusatznutzen gering Zusatznutzen gering/ kein Zusatznutzen 28 © Prof. Dr. M. Smollich Dulaglutid (Trulicity®) ► Zulassungsstudien 6 Zulassungsstudien (n = 4.990) - primärer Endpunkt: HbA1c nach 26 bzw. 52 Wochen Monotherapie vs. Metformin bessere HbA1c-Senkung als Metformin mono (-0,2%) Metformin + Dulaglutid vs. Metformin + Sitagliptin bessere HbA1c-Senkung (-0,5%) ? - sekundärer Endpunkt: Gewichtsverlust kein Unterschied zu Metformin (0,9 – 3 kg/Jahr) ► Offene Fragen Langzeitsicherheit? Effekt auf diabetische Folgeerkrankungen? 29 © Prof. Dr. M. Smollich Dulaglutid (Trulicity®) Victoza® (Liraglutid) hat es vorgemacht… neue Indikation als Saxenda® „Therapie von Übergewicht & Adipositas (BMI ≥ 27 kg/m²)“ Zulassung USA seit 2014 „Diätspritze“ positives Votum der EMA EU-Zulassung im Laufe von 2016 laufende Studien für Dulaglutid 30 © Prof. Dr. M. Smollich Ausblick 2016 Voraussichtlich: 60 – 70 neue Wirkstoffzulassungen ► Onkologie Lungenkrebs (NSCLC) Multiples Myelom Leukämien ► Antiinfektiva Hepatitis C, MRSA, multiresistente gram-negative Erreger ► Impfstoffe HPV, Milzbrand ► Wirkstoffe gegen seltene erbliche Stoffwechselkrankheiten