14 Hals, Schilddrüse und Ösophagus
Werbung
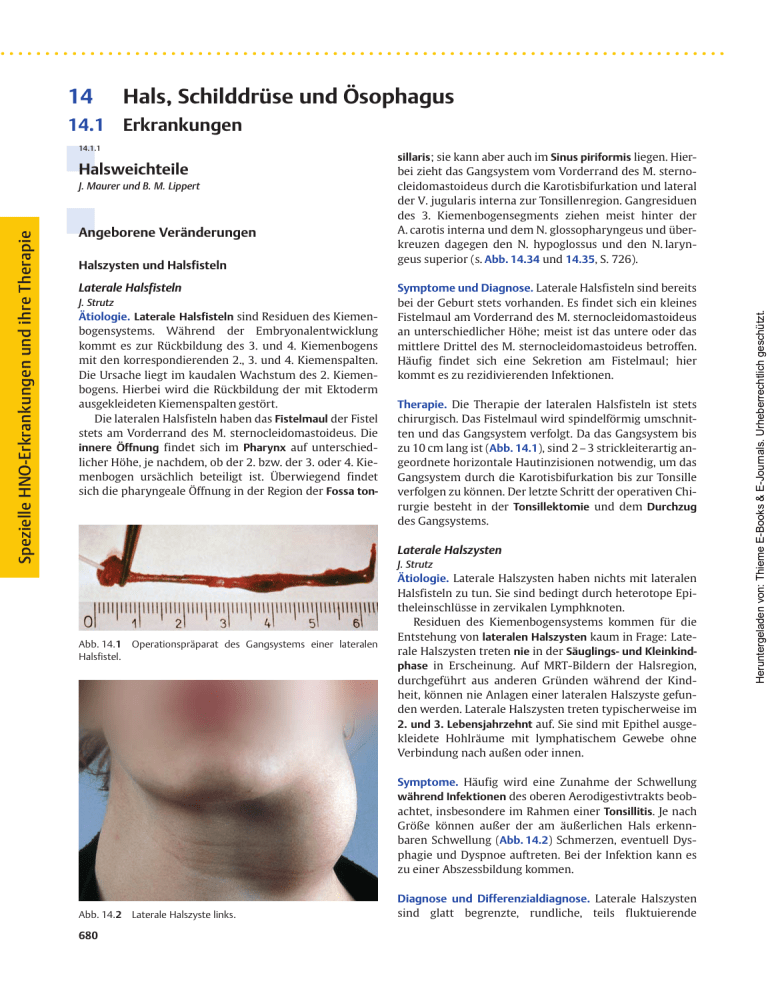
................................................................................. 14 Hals, Schilddrüse und Ösophagus 14.1 Erkrankungen Halsweichteile Spezielle HNO‑Erkrankungen und ihre Therapie J. Maurer und B. M. Lippert Angeborene Veränderungen Halszysten und Halsfisteln Laterale Halsfisteln J. Strutz Ätiologie. Laterale Halsfisteln sind Residuen des Kiemenbogensystems. Während der Embryonalentwicklung kommt es zur Rückbildung des 3. und 4. Kiemenbogens mit den korrespondierenden 2., 3. und 4. Kiemenspalten. Die Ursache liegt im kaudalen Wachstum des 2. Kiemenbogens. Hierbei wird die Rückbildung der mit Ektoderm ausgekleideten Kiemenspalten gestört. Die lateralen Halsfisteln haben das Fistelmaul der Fistel stets am Vorderrand des M. sternocleidomastoideus. Die innere Öffnung findet sich im Pharynx auf unterschiedlicher Höhe, je nachdem, ob der 2. bzw. der 3. oder 4. Kiemenbogen ursächlich beteiligt ist. Überwiegend findet sich die pharyngeale Öffnung in der Region der Fossa ton- sillaris; sie kann aber auch im Sinus piriformis liegen. Hierbei zieht das Gangsystem vom Vorderrand des M. sternocleidomastoideus durch die Karotisbifurkation und lateral der V. jugularis interna zur Tonsillenregion. Gangresiduen des 3. Kiemenbogensegments ziehen meist hinter der A. carotis interna und dem N. glossopharyngeus und überkreuzen dagegen den N. hypoglossus und den N. laryngeus superior (s. Abb. 14.34 und 14.35, S. 726). Symptome und Diagnose. Laterale Halsfisteln sind bereits bei der Geburt stets vorhanden. Es findet sich ein kleines Fistelmaul am Vorderrand des M. sternocleidomastoideus an unterschiedlicher Höhe; meist ist das untere oder das mittlere Drittel des M. sternocleidomastoideus betroffen. Häufig findet sich eine Sekretion am Fistelmaul; hier kommt es zu rezidivierenden Infektionen. Therapie. Die Therapie der lateralen Halsfisteln ist stets chirurgisch. Das Fistelmaul wird spindelförmig umschnitten und das Gangsystem verfolgt. Da das Gangsystem bis zu 10 cm lang ist (Abb. 14.1), sind 2 – 3 strickleiterartig angeordnete horizontale Hautinzisionen notwendig, um das Gangsystem durch die Karotisbifurkation bis zur Tonsille verfolgen zu können. Der letzte Schritt der operativen Chirurgie besteht in der Tonsillektomie und dem Durchzug des Gangsystems. Laterale Halszysten J. Strutz Abb. 14.1 Halsfistel. Operationspräparat des Gangsystems einer lateralen Ätiologie. Laterale Halszysten haben nichts mit lateralen Halsfisteln zu tun. Sie sind bedingt durch heterotope Epitheleinschlüsse in zervikalen Lymphknoten. Residuen des Kiemenbogensystems kommen für die Entstehung von lateralen Halszysten kaum in Frage: Laterale Halszysten treten nie in der Säuglings- und Kleinkindphase in Erscheinung. Auf MRT-Bildern der Halsregion, durchgeführt aus anderen Gründen während der Kindheit, können nie Anlagen einer lateralen Halszyste gefunden werden. Laterale Halszysten treten typischerweise im 2. und 3. Lebensjahrzehnt auf. Sie sind mit Epithel ausgekleidete Hohlräume mit lymphatischem Gewebe ohne Verbindung nach außen oder innen. Symptome. Häufig wird eine Zunahme der Schwellung während Infektionen des oberen Aerodigestivtrakts beobachtet, insbesondere im Rahmen einer Tonsillitis. Je nach Größe können außer der am äußerlichen Hals erkennbaren Schwellung (Abb. 14.2) Schmerzen, eventuell Dysphagie und Dyspnoe auftreten. Bei der Infektion kann es zu einer Abszessbildung kommen. Abb. 14.2 680 Laterale Halszyste links. Diagnose und Differenzialdiagnose. Laterale Halszysten sind glatt begrenzte, rundliche, teils fluktuierende Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14.1.1 ................................................................ Erkrankungen ......... Schwellungen. Sie treten meist im oberen Drittel des Halses auf und zeigen im Ultraschall ein charakteristisches Erscheinungsbild. Es handelt sich um glatt begrenzte, rundliche bis ovale Strukturen mit meist geringer Echogenität. Entzündungen führen zu sonographisch nachweisbaren Veränderungen des Zysteninhalts. Weitere bildgebende Verfahren sind bei unkomplizierten Fällen nicht erforderlich. Mögliche Differenzialdiagnosen sind Lymphome, Lymphangiome, Glomus-caroticum-Tumoren, Neurofibrome und ektopisches Schilddrüsengewebe. Mediale Halszysten und ‑fisteln Ätiologie. Die mediale Halszyste entwickelt sich aus embryonalen Überbleibseln des Ductus thyroglossus. Ab dem 17. Entwicklungstag wandert die Schilddrüse vom Foramen caecum am Boden des primitiven Pharynx aus nach kaudal. Ihre normale Position erreicht sie etwa in der 7. embryonalen Entwicklungswoche. Bis zur 10. Entwicklungswoche bildet sich dann gewöhnlich der Ductus thyroglossus zurück, der die Verbindung mit dem Foramen caecum während der Kaudalwanderung der Schilddrüse herstellte. Bleibt ein Teil des Gangs mit seinem Epithel erhalten, bildet sich eine Zyste, die mit kolloidartigem Material gefüllt sein kann. Gewöhnlich besteht eine sehr enge Lagebeziehung zum Zungenbein, weshalb Gangüberbleibsel vor, innerhalb und hinter dem Zungenbein liegen können. Histologisch handelt es sich bei den medialen Halszysten um mit Platten- oder zilientragendem Epithel ausgekleidete Zysten und Gangsysteme. Gelegentlich finden sich auch muköse Drüsen oder ektopisches Schilddrüsengewebe. Mediale Halsfisteln entstehen sekundär, z. B. spontan oder nach chirurgischer Entlastung bei Infektion einer medialen Halszyste. Symptome. Die meisten medialen Halszysten treten überwiegend vor dem 5. Lebensjahr in Erscheinung. Sie zeigen sich als in der Mittellinie gelegene Schwellungen, die gelegentlich auch die Zunge verdrängen können. In ⅔ der Fälle liegen die Zysten oberhalb des Zungenbeins; sie befinden sich meist in der Mitte, gelegentlich können sie jedoch auch nach lateral abweichen. Mediale Fisteln zeigen sich durch eine Fistelöffnung mit Sekretion und Entzündungen (Abb. 14.3). 14 Abb. 14.3 Mediale Halszyste mit Fistelbildung. Diagnose und Differenzialdiagnose. Die Diagnose wird anhand der Inspektion und Palpation gestellt. Reizlose Zysten sind in der Regel schluckverschieblich. Der sonografische Befund kann die Verdachtsdiagnose bekräftigen. Typischerweise zeigt sich eine glatt begrenzte, ovaläre, echoarme bis echoleere Raumforderung mit dorsaler Schallverstärkung. Eine enge Lagebeziehung zum Zungenbein ist häufig. Weitere bildgebende Verfahren sind in unkomplizierten Fällen nicht erforderlich. Differenzialdiagnostisch müssen eine Laryngozele, entzündliche Lymphknotenveränderungen, Dermoidzysten, Lipome, Hämangiome, zystische Schilddrüsenknoten, ektopische Speicheldrüsen- und Schilddrüsengewebe sowie laterale Halszysten in Betracht gezogen werden. Therapie. Die Behandlung der Wahl ist die chirurgische Exzision. Dabei muss der mittlere Anteil des Zungenbeins mitentfernt werden, um Epithelreste im oder am Knochen zu erfassen. Die Rezidivrate liegt bei Teilresektion des Zungenbeins nur bei 3 – 5%. Bei medialen Halsfisteln sollte der Fistelmund umschnitten und die Zyste mit Fistelgang vollständig exstirpiert werden. Zur besseren Darstellung empfiehlt sich die Anfärbung des Fistelgangs mit einem Farbstoff. Gefäßanomalien Weder Lymphangiome noch Hämangiome noch venöse Malformationen sind echte Neoplasien. Sie gehören vielmehr zu den häufigsten angeborenen und frühkindlichen Weichgewebsfehlbildungen. Unter den verschiedenen Klassifikationen hat sich die von Mulliken und Glowacki erarbeitete bewährt, die physikalische Befunde, klinisches Verhalten und zelluläre Reaktionen berücksichtigt. Sie 681 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Therapie. Die Behandlung der lateralen Halszysten ist immer die komplette chirurgische Exstirpation. Diese sollte möglichst im infektionsfreien Intervall erfolgen. Bei einer akuten Entzündung mit Abszedierung kann die Punktion mit begleitender breiter antibiotischer Therapie zunächst ausreichen; ggf. sind auch eine Inzision und Drainage erforderlich. Die chirurgische Sanierung erfolgt in diesen Fällen dann sekundär. Operative Komplikationen sind selten. Hier ist insbesondere der N. accessorius, seltener der N. hypoglossus betroffen. Liegt eine chronische Tonsillitis vor, empfiehlt sich die gleichzeitige oder 2-zeitige Tonsillektomie. 14 Hals, Schilddrüse und Ösophagus ................................................................................. Klassifikation vaskulärer Anomalien. Hämangiome Spezielle HNO‑Erkrankungen und ihre Therapie vaskuläre Malformationen Tabelle 14.2 l Schleimhauthämangiome (oberflächlich, tief, gemischt) l dermale Hämangiome (oberflächlich, tief, gemischt) l Syndrome (z. B. Kasabach-MerrittSyndrom; benigne neonatale Hämangiomatose) l Low-Flow-Läsionen: l kapilläre Malformationen (Naevus flammeus, Naevus simplex) l Lymphangiome l venöse Malformationen l gemischte Malformationen l High-Flow-Läsionen: l arteriovenöse Malformationen l arterielle Malformationen l arteriovenöse Fisteln Abb. 14.4 l Syndrome (z. B. Klippel-TrenaunaySyndrom) sind schmerzlose kompressible Raumforderungen. Häufig kommt es während Infektionen im Bereich des oberen Aerodigestivtrakts zu einem Wachstumsschub, so dass sie bei solchen Infektionen oft klinisch in Erscheinung treten. Die Schwellung tritt meist im hinteren Halsdreieck auf. Bei intraoraler oder pharyngealer Ausdehnung kann es zu Störungen der Atmung und des Schluckvorgangs kommen. Die histologische Unterteilung in kapilläre (einfache), kavernöse und zystische Lymphangiome ist klinisch nicht relevant und wurde daher von einem Staging-System abgelöst (Tab. 14.2), welches die zervikalen Lymphome nach anatomischen Gesichtspunkten in 5 Stadien unterteilt. Einteilung zervikofazialer Lymphangiome. Stadium Lokalisation des Lymphangioms I unilateral infrahyoidal II unilateral suprahyoidal III unilateral infra- und suprahyoidal IV bilateral suprahyoidal V bilateral supra- und infrahyoidal wurde auch von der International Society for the Study of Vascular Anomalies (ISSVA) anerkannt (Tab. 14.1). Vaskuläre Malformationen Vaskuläre Malformationen sind bereits zum Zeitpunkt der Geburt vorhanden. Im Gegensatz zu den Hämangiomen zeigen sie keine Spontanremission. Das Geschlechterverhältnis ist ausgeglichen. Der Zeitpunkt des Auftretens wird von den Flussparametern bestimmt. Kapilläre, lymphatische und venöse Malformationen gehören zu den Low-Flow-Läsionen, während arterielle und arteriovenöse Malformationen und arteriovenöse Fisteln als High-FlowLäsionen bezeichnet werden. Das klinische Erscheinungsbild variiert. Vaskuläre Malformationen zeigen sich als verstärkte Venenzeichnung, als verfärbte Weichteilschwellung oder führen zu rezidivierenden, teils lebensbedrohlichen Blutungen. Lymphatische Malformationen sind am häufigsten in der Kopf-Hals-Region lokalisiert. Etwa 40% der Lymphangiome sind bereits im Neugeborenenalter manifest; bis zum Ende des 2. Lebensjahrs werden 90 % der Lymphangiome erkennbar. Sie können aber auch noch bis zum 40. oder 50. Lebensjahr auftreten. Lymphangiome (Abb. 14.4) 682 Zervikales Lymphangiom. Diagnose. Für oberflächlich gelegene Lymphangiome ist die Ultraschalluntersuchung zur Bestimmung der Größenausdehnung und der Beziehung zu den umgebenden Strukturen ausreichend. Im Ultraschall ist eine dünnwandige zystische, meist echoarme bis echoleere Raumforderung zu erkennen, die septiert sein kann. Insbesondere bei Entzündungen kann aber auch eine gemischte Echogenität auftreten, die dann die Differenzialdiagnose erschwert. Bei größeren Raumforderungen, insbesondere wenn sie sich zur Tiefe und nach kaudal ausbreiten, ist eine MRT indiziert. In die differenzialdiagnostischen Erwägungen müssen mediale und laterale Halszysten, Lymphome, Hämangiome und andere Neoplasien miteinbezogen werden. Therapie. Da Lymphangiome höchst selten zu einer Spontanheilung neigen, besteht die Therapie der Wahl in der chirurgischen Resektion unter Zuhilfenahme mikrochirurgischer Techniken. Für eine frühzeitige Operation spricht die Tatsache, dass die Resektion ohne vorausgegangene Infektionen einfacher durchzuführen ist. Bei der Operation sollte in jedem Fall eine komplette Exstirpation unter Schonung umgebender Strukturen angestrebt werden. Dies kann insbesondere bei den oft fingerförmig verzweigten und mit der Muskulatur verklebten Lymphangiomen der Submandibularregion erschwert sein. Bleiben Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 14.1 Tumorreste zurück, werden Rezidive in bis zu 15 % der Fälle beobachtet. Eine durchaus erfolgversprechende Alternative zur Operation stellt die Sklerotherapie mit Picibanil (OK-432) dar. Picibanil ist eine lyophilisierte inaktivierte Mixtur aus Streptococcus pyogenes der Gruppe A, die zu einer Zerstörung des Zystenepithels mit nachfolgender Verklebung und Schrumpfung führt. Hämangiome Hämangiome entwickeln sich typischerweise wenige Tage oder Wochen nach der Geburt. Mädchen sind etwas häufiger als Jungen betroffen. Nach einer initialen Wachstumsphase setzt eine langsame, spontane Rückbildung ein. Im Alter von 9 Jahren ist die Involution zu ca. 90 % abgeschlossen. Allerdings können bei bis zu 50 % der betroffenen Kinder Residuen im Form von Teleangiektasien, Narben oder atrophen Hautveränderungen beobachtet werden. Hämangiome sind überwiegend an der Hautoberfläche lokalisiert, können aber auch an den Schleimhäuten auftreten. Sie manifestieren sich zu ca. 60 % im Kopf-Hals-Bereich. Am häufigsten sind sie an der Haut der Schädeldecke lokalisiert, gefolgt von Hals- und Gesichtshaut. Diagnose. Die Diagnose kann in den überwiegenden Fällen anhand des charakteristischen klinischen Erscheinungsbilds und der Ultraschalldiagnostik einschließlich Farbduplexsonografie verlässlich gestellt werden. Eine MRT‑Untersuchung ist bei größeren und der Ultraschalldiagnostik nicht sicher zugänglichen Hämangiomen erforderlich. Bei multiplen kutanen Hämangiomen sollten gehäuft auftretende viszerale oder zerebrale Hämangiome ausgeschlossen werden. Eine Angiografie kann erforderlich werden, wenn eine Embolisation therapeutisch in Betracht gezogen wird. Therapie. Bei kleinen, oberflächlichen und nicht proliferierend wachsenden Hämangiomen ist zunächst eine abwartende Haltung angezeigt, da sich viele angeborene Hämangiome spontan zurückbilden. Wichtig ist allerdings eine regelmäßige und engmaschige Befundkontrolle mit objektivierbarer Bilddokumentation. Der entscheidende Faktor zur Therapieindikation ist das Wachstumsverhalten. Bei plötzlich einsetzendem und schnellem Wachstum, bei Blutungen oder wiederholten Infektionen sollte eine definitive Therapie angestrebt werden. Hierdurch können insbesondere in der Gesichtsregion schwere kosmetische und funktionelle Komplikationen vermieden oder reduziert werden. Die Wahl des Therapieverfahrens ist individuell und wird wesentlich von Lokalisation, Größe sowie Tiefenausdehnung der Läsion beeinflusst. Die Kryotherapie hat sich vor allem zur Behandlung von kleinen, überwiegend oberflächlich wachsenden Hämangiomen bewährt. Kortikosteroide (Methylprednisolon oder Prednison) werden bevorzugt bei rasch proliferierenden Hämangiomen eingesetzt und können zu einer Wachstumsverlangsamung und/oder Rückbildung führen. Die Dosierung liegt bei 2 – 5 mg/kg Körpergewicht und Tag über einen Zeitraum von 3 – 4 Wochen. Stellt sich aller- Erkrankungen dings nach der 1. Behandlungswoche kein wachstumshemmender Effekt ein, ist insbesondere bei rasch proliferierenden Hämangiomen eine Fortsetzung nicht sinnvoll. Es muss dann rasch eine chirurgische Therapie erfolgen. In den letzten Jahren hat die Laserbehandlung bei Hämangiomen immer mehr an Bedeutung gewonnen (Näheres s. S. 728). Chirurgische Therapien, alleine oder in Kombination mit Embolisation und/oder Lasertherapie, sind meist bei stark proliferierenden Hämangiomen indiziert, die sich mit anderen Behandlungen nicht ausreichend haben beherrschen lassen. Auch chemo- und immuntherapeutische Behandlungen mit Interferon sollten nur bei Versagen anderer Therapieansätze als Therapie der letzten Wahl Anwendung finden. Alle genannten therapeutischen Optionen haben ihre Vor- und Nachteile. Vielfach sind Kombinationstherapien und mehrere Behandlungsschritte erforderlich. Wegen des oft unvorhersehbaren Verlaufs muss aber eine Flexibilität in den Behandlungsoptionen erhalten bleiben. Bei komplizierteren Hämangiomen ist eine interdisziplinäre Versorgung sinnvoll. Raumfordernde Missbildungen Teratome Ätiologie, Symptome und Diagnose. Bei Teratomen handelt es sich um Entwicklungsfehlbildungen, die Elemente aller 3 Keimblätter enthalten. Sie kommen ubiquitär vor; ca. 2 – 9% sind in der Kopf-Hals-Region lokalisiert. Die Zellen können in allen Differenzierungsstadien angetroffen werden. Sehr unreife Zellen sollen für eine mögliche maligne Entartung sprechen, die jedoch sehr selten vorkommt. Teratome werden gewöhnlich im Verlauf des 1. Lebensjahrs festgestellt. Dabei fallen sie entweder als sichtbare Schwellung am äußeren Hals auf oder dadurch, dass sie durch Kompression zu einer Einengung der Atemwege führen. Gelegentlich treten auch Schluckstörungen auf. Bei der ultrasonografischen Untersuchung zeigen sich Strukturen mit Abschnitten erhöhter und erniedrigter Echogenität. Bei der Röntgenuntersuchung können in bis zu 50 % der Fälle verkalkte Strukturen beobachtet werden. Im Allgemeinen ist das Auftreten von Teratomen nicht mit dem anderer angeborener Anomalien verbunden. Differenzialdiagnose. Differenzialdiagnostisch sind die Teratome von zystischen Hygromen, lateralen und medialen Halszysten, kavernösen Hämangiomen, Laryngozelen und Lipomen abzugrenzen. Therapie. Nach Diagnosestellung ist die Exstirpation erforderlich, um eine Obstruktion der Atemwege zu verhindern. Ohne frühzeitige Behandlung sterben die meisten Patienten an dieser Komplikation. Epidermoidzysten Epidermoidzysten (epidermale Zysten, Atherome) sind subepidermale zystische Tumoren, die oft mit der bedeckenden Epidermis durch eine enge Öffnung oder einen 683 ......... 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................ 14 Hals, Schilddrüse und Ösophagus dilatierten Haarfollikel in Verbindung stehen. Sie sind mit einem orthokeratotisch verhornenden Plattenepithel ausgekleidet und enthalten geschichtete Hornlamellen. Gut ¼ der Epidermoidzysten sind im Mundbodenbereich lokalisiert. Eine submental lokalisierte Epidermoidzyste kann klinisch als prall-elastische Schwellung im Bereich des vorderen Mundbodens imponieren, so dass neben einer Lymphknotenschwellung differenzialdiagnostisch auch eine Ranula in Erwägung gezogen werden muss. Sonografisch imponieren derartige Raumforderungen als zystisch abgekapselt, mit zentral soliden, kugelförmigen Anteilen ohne Vaskularisierungszeichen in der Duplexsonografie. Bei der Punktion zeigt sich typischerweise ein dickes, zähes, teilweise fötide riechendes Sekret. Eine frühzeitige Exstirpation sollte zur Vermeidung entzündlicher Komplikationen angestrebt werden. Raumforderungen des Thymus Raumforderungen, die vom Thymus ausgehen, sind sehr selten und gewöhnlich benigne. Sie müssen bei Kindern in Erwägung gezogen werden, die einen zystischen Tumor im unteren medialen Halsbereich haben. Dieser ist palpatorisch fest und rund und liegt in der supraklavikulären Region. Husten und Dyspnoe können auftreten. Bei größeren Thymuszysten können die Atemstörungen gravierend sein. Bei 50 % der Patienten mit einem Thymom besteht gleichzeitig eine Myasthenia gravis. Differenzialdiagnostisch müssen Thymushyperplasien, Thymome und, sehr selten, vom Thymus ausgehende Lymphosarkome in Erwägung gezogen werden. Da diese Raumforderungen das anteriore Mediastinum miteinbeziehen, ist eine CT- und/ oder MRT‑Untersuchung erforderlich. Die operative Therapie erfolgt in Zusammenarbeit mit den Thoraxchirurgen. Dermoide Dermoide sind benigne, reife Teratome. Es handelt sich um eingekapseltes Gewebe mit ektodermaler Dominanz. Infolgedessen enthalten Dermoide unterschiedliche Anhängsel, wie Haarfollikel, Talg-, Schweiß- und Speicheldrüsen, und sind mit einer kleisterartigen Masse ausgefüllt. Die Tumoren sind meist subkutan gelegen und gut verschieblich. Sonografisch stellen sie sich als echoarme bis echoleere Raumforderungen dar. Sie sind glatt begrenzt und von rundlicher bis ovalärer Form. Je nach Flüssigkeitsanteil zeigt sich eine dorsale Schallverstärkung. Eine Echogenitätszunahme bei gleichzeitiger Abnahme der scharfen Abgrenzbarkeit liegt bei zunehmender Entzündung vor. Eine Beziehung zu Blutgefäßen oder zu den tiefen Halsstrukturen besteht in der Regel nicht. Eine komplette Exzision ist erforderlich. Laryngozelen Ätiologie. Laryngozelen sind ein- oder doppelseitige, sackartige Ausstülpungen der endolaryngealen Schleimhaut des Sinus Morgagni. Sie sind mit normalem respiratorischem Epithel mit schleimbildenden Zellen ausgekleidet. Entsprechend ihrer Ausdehnungsrichtung unterscheidet man innere, äußere und kombinierte Laryngozelen. Sie können angeboren und erworben sein und treten häufig erst in der 5. – 6. Lebensdekade klinisch in Erscheinung. Als pathogenetische Faktoren sind eine mangelhafte Rückbildung des embryonalen Sacculus laryngis, ein erhöhter intralaryngealer Druck, eine übermäßige Schlaffheit der Weichteile sowie auch Traumen zu nennen. Symptome. Äußere Laryngozelen treten als schmerzlose, weiche oder prall-elastische Raumforderung durch die Membrana thyreohyoidea seitlich zwischen Zungenbein und oberem Schildknorpelrand durch. Bei einem Valsalva-Manöver kann die Vorwölbung deutlicher hervortreten. Die Zysten können sowohl mit Flüssigkeit als auch mit Luft gefüllt sein. Häufig werden sie erst bei Infektionen bemerkt. Durch Schleimeinlagerung und nachfolgende Entzündung kann klinisch das Bild einer infizierten medialen oder lateralen Halszyste entstehen. In Abhängigkeit von der Größe treten neben der äußerlich sichtbaren Raumforderung Globusgefühl und Dysphagie oder Heiserkeit bis hin zum Stridor auf. Diagnose. Die Diagnose kann ergänzend zur typischen Symptomatik anhand des Ultraschallbefunds leicht gestellt werden. Zusätzlich sollte aber eine Dünnschicht-CT durchgeführt werden (Abb. 14.5), da mit dieser Technik das knöchern-knorpelige Kehlkopfskelett am besten zur Darstellung kommt. Abb. 14.5 684 Axiale CT einer Laryngozele. Therapie. Eine chirurgische Therapie ist dann erforderlich, wenn funktionelle Beeinträchtigungen wie Atemnot, Stimmstörungen oder Schwierigkeiten bei der Ernährung auftreten. Intralaryngeale Zysten können endoskopisch, meist lasermikrochirurgisch, exzidiert oder marsupiali- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ Entzündliche Erkrankungen Unkomplizierte Infektionen der Halsweichteile Entzündungen der Haut und der Hautanhangsgebilde Furunkel sind von den Haarbälgen ausgehende eitrige Entzündungen. Sie kommen im gesamten Bereich des Gesichts und Halses, hier insbesondere im Nacken, vor. Karbunkel entstehen bei konfluierenden Entzündungen mehrerer Haarbälge. Es handelt sich fast immer um Infektionen durch Staphylokokken. Ebenfalls durch Staphylokokken werden Entzündungen von Atheromen verursacht. Die Therapie derartiger Infektionen besteht in der Gabe eines gegen Staphylokokken wirksamen Antibiotikums sowie der Inzision und Drainage. Atherome werden im entzündungsfreien Intervall in toto entfernt. Beim Skrofuloderm handelt es sich um zunächst blaurötliche Nodi in der Haut, die im Verlauf einschmelzen und zur Fistelbildung neigen. Sie kommen bei Kindern und Erwachsenen vor und werden als tuberkulöse Hauterkrankung angesehen. Die Aktinomykose entsteht durch die zur normalen Schleimhautflora gehörenden Actinomyces israeli als eitrig einschmelzende Entzündung. Bei der zervikofazialen Form kommt es meist am Hals zu sehr harten, subkutanen Indurationen, später zur Eiterbildung und spontanen Eröffnung. Eine längere antibiotische Therapie führt in der Regel zur Ausheilung. Lymphadenopathie Die unspezifische Lymphadenitis ist die häufigste benigne Lymphknotenerkrankung. Vergrößerungen der Lymphknoten sind häufig Ausdruck einer reversiblen Aktivierung des Immunsystems aufgrund akuter oder subakut ablaufender viraler oder bakterieller Infektionen. Sie kommen besonders häufig im Kindesalter vor. Symptome. Die ein- oder beidseitig auftretenden Lymphknotenschwellungen sind schmerzlos oder druckdolent und je nach Größe auch bei der Inspektion gut sichtbar. Eine Rötung oder Überwärmung deutet auf eine beginnende Abszedierung hin. Diagnose. Die Diagnose kann vielfach aufgrund der Anamnese und des Palpationsbefunds gestellt werden. So tritt die unspezifische Lymphadenitis colli bei primären Entzündungslokalisationen im Bereich von Oropharynx und Tonsillen, Nasopharynx, Mundschleimhaut, Zähnen, Kopfhaut, Ohrmuschel und Gehörgang auf. Die Lymphknoten- ......... schwellungen finden sich im primären Lymphabflussgebiet der Eintrittspforte. In der Ultraschalluntersuchung finden sich mehrere, häufig in Ketten liegende, echoarme, rundliche bis ovale und bis 2 cm große Lymphknoten. Im Blut werden erhöhte Entzündungswerte (Leukozyten, C‑reaktives Protein und Blutkörperchensenkungsgeschwindigkeit) angetroffen. Differenzialdiagnose. Wenn bei der initialen Untersuchung keine eindeutige Ursache zu finden ist und ein längeres Fortbestehen im Sinne einer chronischen Lymphadenitis colli vorliegt, sind Serumtiteruntersuchungen auf EBV, Toxoplasmose und HIV‑Erkrankung zu veranlassen. Auch die Katzenkratzkrankheit, die Bruzellose sowie die Tularämie müssen in Erwägung gezogen werden. Differenzialdiagnostisch sollte immer an eine Lymphknotentuberkulose, maligne Lymphome und Lymphknotenmetastasen gedacht werden. Aus diesem Grund ist im Zweifel eine histologische Abklärung anzustreben. Therapie. Die isolierte unspezifische Lymphadenopathie muss in der Regel nicht behandelt werden und bildet sich spontan zurück. Bei stärkeren Entzündungen kann es in den Lymphknoten zu eitrigen Einschmelzungen im Sinne einer Abszessbildung kommen. Hier werden dann neben der antibiotischen Therapie, die auch anaerobe Keime erfassen sollte, eine Abszessinzision und Drainage erforderlich. Halslymphknotentuberkulose Bei Lymphknotentuberkulose unterscheidet man Infektionen mit dem klassischen Mycobacterium tuberculosis, seltener auch Mycobacterium bovis, von Entzündungen durch sog. atypische Mykobakterien. Klassische Halslymphknotentuberkulose. Bei der klassischen Halslymphknotentuberkulose handelt es sich fast immer um eine postprimäre hämatogene Lymphknotentuberkulose, die überwiegend durch das Mycobacterium tuberculosis verursacht wird. Sie gilt als geschlossene Tuberkulose und tritt in ca. 80% der Fälle als isolierte Manifestation auf. Die Lymphknotenschwellungen können ein- oder beidseitig auftreten und liegen im unteren jugulären, im supraklavikulären und im lokalen Lymphknotenabflussgebiet. Es können einzelne Lymphknoten befallen sein, aber auch ganze Gruppen. In späteren Stadien kommen Fistelbildungen sowie Fistelnarben vor. Die Diagnosestellung ist häufig schwierig. Zur Lokalisation der zervikalen Lymphknoten ist die B‑Sonografie ausreichend. Die Diagnosesicherung erfolgt aufgrund der Histologie und des mikrobiologischen Erregernachweises in der Kultur. Wesentlich verbessert und zeitlich verkürzt hat sich die Diagnostik durch den molekularbiologischen Nachweis von Mykobakterien mittels Polymerasekettenreaktion (PCR). Darüber hinaus gehören die Abklärung der Lunge (Röntgenthorax, Sputumuntersuchungen) und der Tuberkulintest zur Basisdiagnostik. 685 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. siert werden. Bei äußeren Laryngozelen, die sich in die Halsweichteile ausbreiten, muss ein externer Zugang unter Erhalt aller neurovaskulären Strukturen gewählt werden. Sind Laryngozelen infiziert, kann neben der antibiotischen Therapie eine Inzision und Drainage erforderlich sein. Die endgültige Exzision erfolgt dann in einem 2. Schritt. Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. Atypische Halslymphknotentuberkulose. Durch atypische Mykobakterien verursachte Lymphknotenschwellungen kommen besonders bei Kleinkindern vor. Als bevorzugte Eintrittspforte wird die orale Mukosa angesehen. Häufig zeigt sich eine über Wochen trotz Anwendung verschiedener Antibiotika persistierende oder progrediente Lymphknotenschwellung, die typischerweise submanibulär oder im Kieferwinkel lokalisiert ist. Nicht selten findet sich eine entzündliche Rötung und Infiltration der Haut. Neben Inspektion und Palpation (schlechte oder aufgehobene Verschieblichkeit) ist die B‑Sonografie ausreichend. Die Diagnosestellung gelingt nur durch histologischen und mikrobiologischen Erregernachweis (meist Tbc avium). Da eine medikamentöse Behandlung nur selten zu einer dauerhaften Heilung führt, ist vielfach eine chirurgische Sanierung des zervikalen Lymphabflussgebiets im Sinne einer selektiven Neck Dissection indiziert. Postoperativ sollte noch eine systemische antibiotische Therapie über Monate erfolgen. Eine Kooperation mit dem Pädiater ist zu empfehlen. Sarkoidose, Morbus Boeck Ätiologie. Die Sarkoidose ist eine epitheloidzellige, ebenfalls granulomatöse Entzündung, die sich im gesamten retikulohistiozytären System ausbreitet. Sie kann sich in nahezu allen Organen manifestieren. Der Pathomechanismus dieser Systemerkrankung ist bisher nicht sicher geklärt. Bevorzugte Manifestationsorte sind die Lunge sowie mediastinale und zervikale Lymphknoten. Durch die Entzündungsreaktion und Granulombildung entstehen Nekrosen und Narben, die in dem befallenen Organsystem zu irreversiblen Schäden führen. Symptome. Es wird eine akute von einer chronischen Verlaufsform unterschieden. Die akute Sarkoidose hält einige Wochen an und ist durch Allgemeinsymptome wie Fieber, Abgeschlagenheit, Gelenkbeschwerden und ein Erythema nodosum charakterisiert. Es werden 2 Sonderformen unterschieden: l Morbus Boeck: Dieser ist durch bilaterale Lymphknotenschwellung, Arthritis und ein Erythema nodosum gekennzeichnet. l Heerfordt-Syndrom: Typische Symptome sind eine meist bilaterale Schwellung der Glandulae parotis, eine Fazialisparese und Uveitis. 686 Die chronische Sarkoidose verläuft über Monate und äußert sich verstärkt in pulmonalen Symptomen, wie Husten, Dyspnoe oder Pleuraergüssen. Extrapulmonale Manifestationen treten als zervikale Lymphknotenschwellungen oder Befall anderer Organe auf. Diagnose und Differenzialdiagnose. Die radiologische Diagnostik ist wegweisend. Charakteristisch ist die doppelseitige, schmetterlingsförmige Lymphknotenschwellung im Bereich der Lungenhili. Die histologische Bestätigung erfolgt durch einen Biopsie aus dem Bronchialsystem oder auch nach erfolgter Lymphknotenexstirpation. Folgende Laborparameter sind zur Abklärung der Sarkoidose hilfreich: CAP, ACE, SIL2R (s. S. 570). Therapie. Die Therapie der akuten Form erfolgt mittels nicht steroidaler Antiphlogistika, die der chronischen Form durch die Gabe von Kortikosteroiden zur Immunsuppression. Die Therapie wird in enger Kooperation mit dem Pulmologen und dem Immunologen vorgenommen. Komplizierte Infektionen Anatomie der Halsweichteile Die Halsweichteile sind durch ihre Faszien und die GefäßNerven-Scheiden in verschiedene Räume aufgeteilt, in denen sich entzündliche Veränderungen abspielen und auf die sie zunächst begrenzt bleiben (Abb. 14.6). Parapharyngealraum. Der Parapharyngealraum enthält lockeres Bindegewebe und liegt lateral der Faszie des M. buccinator und medial der Faszie der Pterygoidmuskulatur des Unterkiefers und des Gefäß-Nerven-Bündels. Nach oben reicht er bis unter die Schädelbasis und wird nach unten in Höhe des Zungenbeins durch die Vereinigung der Faszienumhüllungen der Glandula submandibularis, des M. stylohyoideus und des hinteren Bauches des M. digastricus begrenzt. Nach hinten und medial besteht eine mögliche Kommunikation mit dem retropharyngealen Raum, nach vorne und unten kommuniziert der parapharyngeale Raum mit dem submandibulären und sublingualen Raum. Durch die zentrale Lage und die vielen Verbindungen ist der Parapharyngealraum die am häufigsten an komplizierten Halsinfektionen beteiligte Region und erlaubt außerdem die Ausbreitung von Infektionen von einer Region zur anderen. Von besonderer Bedeutung ist dabei das Übergreifen auf das Gefäß-Nerven-Bündel mit der Umhüllung der A. carotis und auf den retropharyngealen Raum. Am häufigsten ist der Parapharyngealraum bei entzündlichen Erkrankungen der Zunge und ihrer lymphatischen Abflusswege, der Glandula submandibularis, der Tonsillen und des Peritonsillarraums sowie der Kaumuskelregion und der Regio parotidea beteiligt. Submandibularraum. Der Submandibularraum besteht eigentlich aus 2 nur teilweise durch den M. mylohyoideus getrennten Kompartimenten. Unterhalb des M. mylohyoideus liegt der submaxilläre Raum, dessen vorderer Ab- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Im Vordergrund der Therapie steht eine medikamentöse tuberkulostatische Therapie (Kombination aus den Medikamenten Ethambutol, Isoniacid, Rifambicin, Pyrazinamid und Streptomycin). Bei Befall der Haut, Fistelbildung oder ausgeprägter Lymphknotenschwellung kann ergänzend eine chirurgische Resektion bis hin zur Neck Dissection erforderlich sein. ................................................................ Erkrankungen ......... Abb. 14.6 Anatomie der Faszienräume des Halses (schematisch). a Sagittaler Schnitt. b Koronarer Schnitt. c Horizontaler Schnitt. c Wirbelkörper prävertebral retropharyngeal präpharyngeal parapharyngeal M. longus colli M. scalenus anterior perivasal Gefäßscheide Pharynx Larynx Schilddrüse mittlere Halsfaszie M. sternothyroideus oberflächliche Halsfaszie M. sternocleidomastoideus tiefe Halsfaszie substernal prätracheal 687 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus schnitt auch noch als submentaler Raum bezeichnet wird. Oberhalb des M. mylohyoideus befindet sich der sublinguale Raum. Sowohl der submaxilläre als auch der sublinguale Raum sind jeweils ohne größere Abtrennung mit der Gegenseite verbunden. Der submandibuläre Raum insgesamt wird nach oben und medial durch die orale Mukosa und die Zunge sowie die Mandibula begrenzt, nach lateral durch die Lamina superficialis der tiefen Halsfaszie, mit ihrer Befestigung an der Mandibula und am Zungenbein. Entzündungen, die den submandibulären Raum betreffen, gehen vom Mundboden, von den Glandulae sublinguales und submandibulares, von der Zunge oder auch von Zähnen oder Zahnwurzeln des Unterkiefers aus. Ausbreitungen entzündlicher Veränderungen können nach hinten zur Gefäß-Nerven-Scheide oder zum retropharyngealen Raum über den parapharyngealen Raum erfolgen. Raumfordernde Wirkungen nach oben und lateral zum Unterkiefer und zum oberflächlichen Blatt der tiefen Halsfaszien können die Zunge nach oben und hinten verlagern. Dies kann bei schweren Entzündungen auch zu einer Obstruktion der Atemwege führen. Raum mit Kaumuskulatur. Der Raum, der die Kaumuskulatur enthält, wird durch eine Aufteilung des oberflächlichen Blattes der tiefen Halsfaszie gebildet, die die Mandibula und die primären Kaumuskeln umscheidet. Dieser Raum enthält den M. masseter, den medialen und lateralen M. pterygoideus, den Unterkiefer und den Ansatz des M. temporalis. Die Begrenzung dieses Raumes erfolgt durch die Ansätze der Halsfaszie am Jochbein, an der Mandibula, an der Pterygoidmuskulatur und an der Schädelbasis. Nach oben und medial besteht eine Verbindung zum Subtemporalraum medial des Jochbogens. Häufigste Ursache für Infektionen in diesem Gebiet sind Komplikationen bei Erkrankungen der Zähne. Parotisloge. Die Parotisloge liegt zwischen der oberflächlichen und tiefen Parotiskapsel, die aus einer Aufteilung des oberflächlichen Blattes der tiefen Halsfaszie besteht. Die oberflächliche Kapsel ist relativ dick und fest mit den darunter liegenden Anteilen der Drüse verwachsen. Von ihr ausgehend verlaufen einige bindegewebige Septen in die Drüse und bilden so zahlreiche intraglanduläre Kompartimente. Dagegen ist die mediale Kapsel eher dünn und grenzt an den parapharyngealen Raum. Infektionen innerhalb der Drüse breiten sich daher eher nach medial in das Spatium parapharyngeum aus. Von hier können sie dann zum retropharyngealen Raum oder in die GefäßNerven-Scheide und so auch per continuitatem zum Mediastinum voranschreiten. Retropharyngealer Raum. Der retropharyngeale Raum liegt zwischen der tiefen Schicht der tiefen Halsfaszie (Fascia praevertebralis) und der bukkopharyngealen Faszie über der Konstriktormuskulatur im Pharynxbereich bzw. der ösophagealen Faszie weiter unten. Dieser Raum wird oberhalb des 2. thorakalen Wirbels noch einmal in 2 Faszienräume unterteilt: Der nach anterior gelegene Fas688 zienraum ist der eigentliche retropharyngeale Raum, während der dahinter gelegene Raum als prävertebraler Raum bezeichnet wird. Die meisten infektiösen Prozesse betreffen nur den weniger gefährlichen retropharyngealen Raum. Prozesse, die zum prävertebralen Raum fortschreiten, sind bei Weitem gefährlicher, da sich der prävertebrale Raum ohne weitere Unterteilung bis zum Zwerchfell fortsetzt, so dass sich entzündliche Prozesse von hier aus schnell und leicht ins Mediastinum ausbreiten können. Der retropharyngeale Raum wird bei Ausbreitung von Infektionen aus dem parapharyngealen Raum, aus dem Bereich der Kaumuskulatur, aus der Parotisregion und auch von abszedierenden Halslymphknoten oder nach verletzungsbedingten Perforationen (Fremdkörper, Endoskopie) betroffen. Der retropharyngeale und der prävertebrale Raum sind wichtige Ausbreitungsstraßen für Infektion des Kopf-Hals-Bereichs in das Mediastinum. Schwere Infektionen Ätiologie. Infektionen der tiefen Halsweichteile können Folge einer Lymphadenitis sein, die selbst wieder Folge einer entzündlichen Erkrankung im oberen Aerodigestivtrakt sein kann. Während in der präantibiotischen Ära etwa 70 % dieser Infektionen durch Erkrankungen des Pharynx und der Tonsillen verursacht waren, dürften heute von den Zähnen ausgehende Infektionen die häufigste bekannte Ursache sein. Weitere Ursachen können eine iatrogene oder durch Fremdkörper verursachte perforierende Verletzung im oberen Aerodigestivtrakt sein. Bei Patienten mit chronischem Drogenmissbrauch ist eine Halsabszedierung auch infolge von Injektionen in die Halsvenen möglich. Allerdings kann bei über 50 % der Patienten mit einer zervikalen Abszessbildung keine eindeutige Eintrittspforte identifiziert werden. Zusammenfassend sind mögliche Eintrittspforten bzw. Ursachen tiefer Halsinfektionen: l Zahninfektion l peritonsilläre Entzündungen/Abszesse l Lymphadenitis l Trauma (Fremdkörper, iatrogen) l Sialadenitis l Mastoiditis l infizierte laterale oder mediale Halszysten/-fisteln l Tuberkulose der Halswirbelsäule l Drogenmissbrauch (Injektion am Hals) Erregerspektrum. Häufige Erreger bei Abszessen im Halsbereich sind Streptokokken und Staphylokokken. Es handelt sich jedoch vielfach um Mischinfektionen mit einem breiten Erregerspektrum, das auch gramnegative und anaerobe Keime einschließt. Eine besonders aggressive Form der tiefen Halsinfektion ist die nekrotisierende Fasziitis, bei der neben β‑hämolysierenden Streptokokken auch anaerobe Keime eine besondere Rolle spielen. Hier werden auch gasbildende Bakterien beobachtet, die nicht zur Clostridiumfamilie gehören. Die wechselnde bakteriologische Resistenzlage und eine zunehmende Zahl immuninkompetenter Patienten (nach immunsupprimie- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ Erkrankungen ......... render Therapie oder bei HIV‑Infektion) stellt ein besonders problematisches Patientengut bei der Behandlung von Infektionen im tiefen Halsbereich dar. Diagnose. Inspektion und klinisches Bild weisen auf die Diagnose hin. Zur allgemeinen Untersuchung gehört eine Laboruntersuchung mit der Bestimmung von Differenzialblutbild, C‑reaktivem Protein, Blutkörperchensenkungsgeschwindigkeit, Elektrolyten, Gerinnungsparametern und bei septischem Verlauf die Anlage von Blutkulturen. Bei der endoskopischen Untersuchung können ein Speichelsee als Hinweis auf Schluckbehinderungen auffallen, außerdem Schwellungen der lateralen Pharynxwand oder der Zunge. Bildgebend kommt als erstes eine Ultraschalluntersuchung in Betracht, mit deren Hilfe der entzündliche Prozess lokalisiert werden kann. Das sonomorphologische Bild ermöglicht es, eine Abszedierung frühzeitig zu erkennen und sonografisch kontrolliert eine Feinnadelpunktion durchzuführen. Somit kann Sekret für die mikrobiologische Untersuchung gewonnen werden. In vielen Fällen ist eine CT oder MRT der Halsweichteile (Abb. 14.7) von der Schädelbasis zum oberen Mediastinum erforderlich. Die Entscheidung über die adäquate Therapie kann durch bildgebende Untersuchungen erleichtert werden, stützt sich aber im Zweifelsfall auf die klinische Beurteilung. Therapie. Liegt noch keine Abszessbildung vor, kann unter klinischer Beobachtung eine alleinige antibiotische Behandlung ausreichen. Dies trifft bei 15 – 20% der Erwachsenen und bei etwa 50 % der betroffenen Kinder zu. Bei Vorliegen eines Abszesses ist immer eine chirurgische Therapie erforderlich. Die antibiotische Behandlung sollte aus einem Breitspektrumantibiotikum bestehen, das anaero- 14 Abb. 14.7 Abszess in den tiefen Halsweichteilen rechts, dargestellt in der MRT (koronare Ebene). be und β‑lactamaseresistente Keime einschließt. Heute müssen zunehmend auch methicillinresistente Staphylokokken bei der Therapieplanung mit in Betracht gezogen werden. Bei vorliegender Abszessbildung oder nicht greifender konservativer Behandlung ist eine Halsexploration mit Drainage des Prozesses erforderlich. Patienten mit nekrotisierender Fasziitis müssen möglichst früh einer aggressiven operativen Therapie zugeführt werden. Dabei werden das nekrotische Gewebe entfernt und alle betroffenen Halsräume offen gelassen (Abb. 14.8). Auch die Hautwunden werden nicht verschlossen. Die intravenöse Antibiose besteht aus einer Mehrfachkombination und wird nach Vorliegen des Antibiogramms entsprechend angepasst. Sie beginnt z. B. mit der 4er-Kombination aus Penizillin, Clindamycin, Ceftacidin und Gentamicin. Komplikationen. Leider werden auch heute noch lebensbedrohliche Komplikationen beobachtet. Dazu gehört die Ausbreitung ins Mediastinum und auf die Gefäß-NervenScheide. Eine septische Thrombophlebitis der V. jugularis interna führt zu wiederholten Fiebergipfeln und möglicherweise zur septischen Embolie der Lungengefäße. Neben der konservativen antibiotischen Therapie kann eine Halsexploration mit Ligatur und Exzision der betroffenen Abschnitte der V. jugularis interna erforderlich sein. Die Ausbreitung zur A. carotis kann Pseudoaneurysmen oder eine Gefäßarrosion mit lebensbedrohlicher Blutung nach sich ziehen. In diesen Fällen ist eine rasche Angiografie in diagnostischer und therapeutischer Intention oder auch eine Gefäßdarstellung mit Unterbindung notwendig. Das Nichterkennen derartiger Komplikation ist für den Patienten lebensgefährlich. 689 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Symptome. Allgemeine Symptome sind Schmerz, Fieber und eingeschränkte Beweglichkeit des Halses oder auch des Unterkiefers. Meist wird darüber hinaus eine Schwellung beobachtet, die bereits einen 1. Hinweis auf die beteiligte Loge und damit auf eine mögliche Ursache gibt. Im weiteren Verlauf können sich eine zunehmende Dysphagie, eine kloßige Sprache oder sogar eine Dyspnoe entwickeln. Eine mediastinale Ausbreitung wird im Allgemeinen von Schmerzen im Bereich des Brustkorbs und bei entsprechender Größe auch von Dyspnoe begleitet. Das Fieber verläuft gewöhnlich mit einem initialen Temperaturgipfel. Danach bleibt die Temperatur erhöht; weitere Gipfel treten bei periodischen Septikämien auf, müssen aber auch an die Möglichkeit einer septischen Thrombophlebitis der V. jugularis interna oder einer mediastinalen Ausbreitung denken lassen. Fluktuierende Schwellungen sind typisch bei submandibulären Prozessen. Bei Befall der Kaumuskulaturregion ist die äußere Schwellung eher gering; führend ist ein deutlicher Trismus. Bei retro- oder parapharyngealen Prozessen sind äußere Schwellungen selten, während eine deutliche schmerzhafte Einschränkung von Mundöffnung und Halsbeweglichkeit zu beobachten ist. 14 Hals, Schilddrüse und Ösophagus Abb. 14.8 Schwere nekrotisierende Fasziitis links zervikal. a Initialbefund. Tumoren Benigne Tumoren der Halsweichteile Paragangliome Pathogenese. Paragangliome im Kopf-Hals-Bereich sind eher seltene Tumoren. Sie werden auch als Glomustumoren, nicht chromaffine Paragangliome und Chemodektome bezeichnet. Sie entstehen aus nicht adrenergen Paraganglien. Ihre genauere Bezeichnung resultiert aus dem Paraganglion ihrer Entstehung. Sie haben eine langsame Wachstumsrate, können lokal invasiv wachsen und in seltenen Fällen auch metastasieren. Häufig treten sie in jüngerem Lebensalter auf. Die Tumoren können multizentrisch und familiär gehäuft vorkommen. Die Diagnose wird durch bildgebende Verfahren und die farbkodierte Duplexsonografie erleichtert (Abb. 14.9, s. auch S. 278 f). Begriffsbestimmung. Die Bezeichnung „nicht chromaffine Paragangliome“ wird verwendet, um diese Tumoren von dem chromaffinreagierenden Gewebe der adrenergen Medulla zu unterscheiden. Diese chromaffine Reaktion ist unspezifisch und wenig sensitiv, um Katecholamine anzufärben. Die adrenerge Medulla weist einen hohen Katecholamingehalt auf, aber auch die Zellen der branchiomeren Paraganglien und die sich von ihnen ableitenden Tumoren speichern Katecholamine. Daher ist die Bezeichnung „nicht chromaffine Paragangliome“ etwas irreführend. Die Bezeichnung „Chemodektome“ wurde diesen Tumoren hauptsächlich mit dem Gedanken an die Chemorezeptorfunktion der Zellen des in der Karotisgabel liegenden Paraganglioms und der hieraus hervorgehenden Tumoren gegeben. Einteilung und Lokalisation. Es werden die extraadrenergen Paraganglien von den adrenergen Paraganglien unterschieden und nach ihrer anatomischen Lokalisation und 690 b Situs nach Abtragung der Nekrosen und Einlage von Laschen. Innervation als branchiomer, intravagal, aortiksympathisch und viszeroautonom bezeichnet. Die branchiomeren Paraganglien haben eine Beziehung zu den Hirnnerven. Dazu gehören die jugulotympanalen, die karotidealen, die subklavikulären, die laryngealen, die koronaren, die aortopulmonaren und die pulmonaren Paraganglien. Diese Paraganglien haben auch engere Beziehungen zu größeren Arterien und werden deswegen von den orbitalen und intravagalen Paraganglien unterschieden, die keine sehr enge Gefäßbeziehung aufweisen. Im Os temporale kommen gewöhnlich 3 Paraganglien vor, deren Durchmesser nur 0,1 – 1,5 mm beträgt. Sie liegen in der Nachbarschaft des R. tympanicus des N. glossopharyngeus (Jacobson-Nerv) und des R. auricularis des N. vagus (Arnold-Nerv). Etwa 50 % der jugulotemporalen Paragangliome liegen in der Fossa jugularis, 10 % in der Mukosa des Promontoriums und 20 % im Canaliculus tympanicus inferior, in dem auch der R. tympanicus des N. glossopharyngeus von der Fossa jugularis her zur Paukenhöhle zieht. Die hauptsächliche Blutversorgung kommt aus der A. pharyngea ascendens mit ihrem R. tympanicus inferior. Die intravagalen Paraganglien sind im Perineurium des N. vagus verstreute Zellgruppen. Sie können im Ganglion jugulare oder im Ganglion nodosum, gelegentlich auch darunter liegen. In sehr seltenen Fällen können Paragangliome auch im Kehlkopf und in der Orbita vorkommen. Klinisches Erscheinungsbild und Erbgang. Bei zufällig auftretenden Tumoren kommt multizentrisches Wachstum in 2 – 10% der Fälle vor, bei familiär gehäuftem Auftreten in 25 – 50% der Fälle. Beidseitige Karotisparagangliome sind die häufigste Kombination, aber alle Kombinationen von temporojugulären, vagalen, karotidealen und thorakalen Tumoren sind möglich. Beim familiären Typ handelt es sich um einen autosomal dominanten Erbgang. Das Gen liegt wahrscheinlich auf dem langen Arm des Chromosoms Nr. 11. Die phänotypische Expression Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ Erkrankungen ......... Abb. 14.9 Tumoren. Bildgebende Diagnostik von Glomus-caroticum- a Duplexsonografie eines Glomus-caroticum-Tumors (schnelle Flussrate; ACE = A. carotis externa, ACI = A. carotis interna, RF = Raumforderung). b MRT eines Glomus-caroticum-Tumors (T1-Bild mit Kontrastmittel). c Angio-MR eines beidseitigen Glomus-caroticum-Tumors. des Genes wird durch das Geschlecht des übertragenden Elternteils bestimmt, d. h. Kinder von weiblichen Genträgern entwickeln keine Tumoren, sind aber zu 50% Genträger, wohingegen Kinder von männlichen Trägern des Genes zu 50% Tumoren entwickeln werden. Somit kann das Gen von weiblichen Genträgern über mehrere Generationen ohne das phänotypische Auftreten der Erkrankung weitergegeben werden. Im Allgemeinen haben Paragangliome eine langsame Wachstumsrate. Die Tumoren weisen ein geringes Potenzial zur malignen Entartung auf. Maligne Paragangliome sind durch das Auftreten metastatischer Tumoren an Lokalisationen, an denen keine Paraganglien liegen, gekennzeichnet. Meist handelt es sich um einen regionalen Lymphknotenbefall; sehr selten kommt es zur Ausbreitung in Lunge, Leber, Knochenmark und Milz. Symptome und Diagnose. Paragangliome sind reich vaskularisierte Tumoren, die sowohl Katecholamine als auch Neuropeptide produzieren können, die als Neurotransmitter, Neurohormone, Hormone und Parahormone wirken können. In der Praxis hat sich jedoch gezeigt, dass dies in der Regel keine klinische Bedeutung hat, da Symp- tome erst ab einem 3- bis 5-fach erhöhten Norepinephrinspiegel auftreten. Weil den jugulotympanalen und intravagalen Paraganglien bisher keine sichere physiologische Funktion zugeordnet werden konnte, werden symptomatische Ausscheidungen von Katecholaminen bei Paragangliomen dieser Lokalisation auch nicht beobachtet. Die karotidealen Paraganglien haben dagegen sehr genau definierte Aufgaben hinsichtlich der Steuerung des Sauerstoff- und Kohlendioxidpartialdrucks sowie des pH‑Werts im Blut und mithilfe der Barorezeptoren in der Regulation des Blutdrucks. Entsprechend können hier klinisch sehr schwerwiegende Störungen auftreten. Die MRT ist zur Diagnosestellung bzw. Größen- und Lagebestimmung eines Paraganglioms das bildgebende Verfahren der Wahl. Im Bereich der Schädelbasis und des Felsenbeins sollte ergänzend eine CT durchgeführt werden. Am Hals ist die B‑Mode- in Verbindung mit der farbkodierten Duplexsonografie ein der MRT gleichwertiges Verfahren. Die Diagnostik sollte zudem eine konventionelle oder eine MR‑Angiografie einschließen. Die Symptomatik der Paragangliome wird ganz wesentlich von ihrer Lokalisation bestimmt: Glomus-caroticum-Tumoren treten als nicht schmerzhafte Raumforde691 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus ................................................................................. Differenzialdiagnose. Die Differenzialdiagnose von Karotis- und jugulotympanalen Paragangliomen beinhaltet alle Möglichkeiten zervikaler und parapharyngealer Raumforderungen, wie Meningeome, Karzinome, primäre Cholesteatome, und seltenere Läsionen, wie Rhabdomyosarkome, Plasmozytome, Melanome, Osteoblastome, Chondrosarkome und Histiozytose. Neurinome und Neurofibrome Abb. 14.10 Axiale MRT‑Aufnahme eines Vagusneurinoms links. rungen in der Karotisbifurkation auf. Befinden sich die Paragangliome im parapharyngealen Raum, kann sich bei entsprechender Größe eine Schwellung im Bereich der seitlichen Pharynxwand bzw. der Gaumenbögen zeigen. Bei Paragangliomen mit Ausdehnung ins Foramen jugulare können Ausfallserscheinungen der Hirnnerven IX, X und XI auftreten. Zum Ausschluss sezernierender Paragangliome ist eine Untersuchung des 24-h-Sammelurins und des Serums zur Erkennung erhöhter Katecholaminspiegel erforderlich. Bei Karotisparagangliomen werden zum Zeitpunkt der Diagnosestellung bei 4 % der Patienten Lähmungen des N. hypoglossus und bei 11% Lähmungen des N. vagus festgestellt. Deutlich seltener kommt das Horner-Syndrom vor. Bei jugulotympanalen Tumoren geben über 80 % der Patienten als Erstsymptome einen pulsatilen Tinnitus sowie eine Hörminderung an. In diesen Fällen ist typischerweise bei der Ohrmikroskopie ein bläulicher bis rötlicher, manchmal auch pulsierender Tumor erkennbar. Blutungen aus dem äußeren Gehörgang sind selten und werden bei 3% der Patienten beobachtet. Bei Tumoren mit Ursprung im Bulbus jugularis treten sehr häufig Paresen der Hirnnerven IX – XII auf. Eine Ausdehnung ins Mastoid kann auch zu einer Fazialisparese führen. Ein intrakranielles Tumorwachstum führt möglicherweise zu Zeichen eines erhöhten intrakraniellen Druckes und einer zerebellären Fehlfunktion. Vagale Paragangliome sind sehr viel seltener. Wie bei allen anderen Paragangliomen auch, wird das weibliche Geschlecht bei sporadischem Auftreten etwas bevorzugt. Bei der Untersuchung imponiert meist eine schmerzlose Schwellung des Halses. Weitere Symptome können Heiserkeit, Schluckstörungen oder eine eingeschränkte Schulterbeweglichkeit als Folge einer Lähmung des N. vagus, des N. accessorius und des N. hypoglossus sein. Bei der Inspektion findet sich häufig eine Vorwölbung der mittleren oropharyngealen Wand. Ein Horner-Syndrom wird beobachtet, wenn der zervikale sympathische Ner692 Neurinome sind typischerweise solitär auftretende Tumoren. Sie kommen im Verlauf eines peripheren Nervs vor. Typischerweise werden sie nicht von den Axonen durchquert, die an ihrer Oberfläche verlaufen. Neurologische Defizite sind gewöhnlich nicht nachweisbar. Mit zunehmender Größe treten aber Schmerzen auf. Als Ursprung kommen am Hals die Hirnnerven, der zervikale Sympathikus, der Plexus cervicalis und der Plexus brachialis in Betracht. Sie können in der Nähe der Foramina liegen und sich auch in den Spinalkanal ausdehnen. Wenn sie vom N. glossopharyngeus, N. vagus (Abb. 14.10), N. accessorius, N. hypoglossus oder dem zervikalen Sympathikus ausgehen, ist auch eine Lokalisation im parapharyngealen Raum möglich. Die Verdachtsdiagnose ergibt sich in der Regel durch die bildgebende Diagnostik und kann durch eine Feinnadelpunktion bzw. durch die definitive Histologie nach operativer Sanierung bestätigt werden. Im Gegensatz zu den Neurinomen haben Neurofibrome keine Kapsel, und die Nervenfasern laufen durch den Tumor. Sehr häufig kommen sie beim Morbus Recklinghausen (Neurofibromatose) vor. Zervikal lokalisierte Neurofibrome weisen auf den Typ I des Morbus Recklinghausen hin. Neurome Neurome entstehen durch den Versuch verletzter Nerven, sich zu regenerieren. Sie werden selten größer als 2 cm. Parästhesien und unangenehme Gefühle bis hin zu Schmerzen um den Tumor herum sind auftretende Symptome. Sie werden typischerweise nach radikaler Neck Dissection hinter der A. carotis im Bereich des 2. zervikalen Nervs gefunden, können aber auch nach kleinen Halseingriffen auftreten. Lipome Lipome sind gutartige, gekapselte, subkutan gelegene Fettgewebsansammlungen. Dabei ist es noch nicht klar, ob es sich hier um echte Neoplasien, Malformationen oder um Hyperplasien von adipösem Gewebe handelt. Sehr selten kommen infiltrierende, nicht gekapselte Lipome vor, die auch nach ihrer Entfernung eine größere Tendenz zur Rezidivbildung haben. Ebenfalls sehr selten kommt es zur malignen Entartung von Lipomen. Beim Morbus Madelung handelt es sich um eine gutartige Lipomatose, bei der es aus bisher unklarer Ursache Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie venstrang beteiligt ist. Zu einer intrakraniellen Ausdehnung kann es über die Pars nervosa des Foramen jugulare kommen. ................................................................ Erkrankungen ......... zu einer massiven Vermehrung von Fettgewebe am Hals kommt. Sie unterscheidet sich von der hereditären multiplen Lipomatose dadurch, dass die Fettgewebsvermehrung nicht zusätzlich auch an Armen, Beinen und Körperstamm auftritt. Extrakranielle Meningeome Als sehr ungewöhnliche Tumoren des Halses treten extrakranielle Meningeome in Erscheinung. Am häufigsten werden sie bei einer Ausbreitung primär intrakranieller Meningeome durch die Schädelbasis beobachtet. Sie können auch als Metastasen von ansonsten eher gutartig erscheinenden intrakraniellen Meningeomen auftreten. Extrakranielle zervikale Meningeome werden auch vollkommen unabhängig von intrakraniellen und spinalen Läsionen beobachtet; Ursprung soll in diesen Fällen ein embryonaler Zellrest sein. Sie könnten sich aber auch aus Meningozyten entwickeln, die mit den Nerven während der embryonalen Entwicklung nach peripher wandern. Abb. 14.11 Extranodale Manifestation eines Non-Hodgkin-Lymphoms im linken Zungengrund. Maligne Lymphome Maligne Lymphome sind in der Regel generalisierte Erkrankungen, die sich nicht nur im lymphatischen System, sondern auch in anderen Organen manifestieren können, häufig an den zervikalen Lymphknoten. Bei der extranodalen Manifestation stellt der Kopf-Hals-Bereich nach dem Gastrointestinaltrakt die zweithäufigste Lokalisation dar. Besonders betroffen ist der Waldeyer-Rachenring (Abb. 14.11), am häufigsten die Tonsille, gefolgt vom Nasopharynx. Aber auch in Nase und Nasennebenhöhlen, im Mund, in der Orbita, im Larynx und in der Schilddrüse können Manifestationen auftreten. Somit kommt dem HNO‑Arzt eine wichtige Rolle in der Diagnostik, in der Stadienbestimmung (Tab. 14.3) und ggf. bei der Einleitung erster therapeutischer Schritte zu. Ätiologie. Maligne Lymphome sind durch eine Proliferation lymphatischer Zellen sowie deren Vorläufer gekennzeichnet. Histologisch unterscheidet man 2 Hauptgruppen, den Morbus Hodgkin und die Non-Hodgkin-Lymphome, die entsprechend der Kiel-Klassifikation in B- und T‑Zelllymphome sowie niedrig und hoch maligne differenziert werden. Symptome. Die klinische Symptomatik hängt sehr vom Ort des Auftretens der Erkrankung ab und kann zwischen sehr langsam wachsenden Lymphknoten bis zu rasch progredienten, aggressiven Tumoren variieren. Die Lymphome beim Morbus Hodgkin sind bevorzugt im unteren Halsbereich bzw. der supraklavikulären Region lokalisiert. Sie imponieren teilweise wie entzündlichen Reaktionen. Bei etwa der Hälfte der Patienten bestehen mediastinale Lymphome. Fieber, Nachtschweiß oder Gewichtsabnahme können begleitend auftreten (sog. B‑Stadium). NonHodgkin-Lymphome hingegen kommen in allen zervikalen Lymphknotenregionen vor. Nicht selten sind auch – Tabelle 14.3 Stadieneinteilung von malignen Lymphomen. Stadium Beteiligte Lymphknotenregionen 1 Beteiligung einer Lymphknotenregion oder eines extranodalen Organs 2 Beteiligung von 2 oder mehreren Lymphknotengruppen nur ober- oder unterhalb des Diaphragmas oder eine extranodale Manifestation mit einer oder mehreren Lymphknotenregionen auf derselben Diaphragmaseite 3 Beteiligung von mehreren Lymphknotenregionen beidseits des Diaphragmas, eventuell mit extranodaler Manifestation oder Milzbeteiligung 4 diffuse oder disseminierte Beteiligung eines oder mehrerer extranodaler Organe (Knochenmark, Leber, Lunge, Pleura, Milz, Haut) mit oder ohne Lymphknotenbeteiligung nuchal gelegene Lymphknotengruppen befallen. Eine bilaterale Lymphknotenbeteiligung wird zum Zeitpunkt der Diagnosestellung bei etwa 25% der Patienten beobachtet. Bei extranodalem Sitz können beispielsweise Schluckbeschwerden, eine kloßige oder nasale Sprache, Tubenfunktionsstörungen mit Hörminderung, Nasenatmungsbehinderung, Nasenbluten oder auch eine Wangenschwellung auftreten. Diagnose. Bei Verdacht auf ein Lymphom umfasst sie neben der Ultraschalluntersuchung des Halses und den entsprechenden endoskopischen Untersuchungen der KopfHals-Region weitere Staging-Untersuchungen. So sind 693 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Maligne Tumoren der Halsweichteile 14 14 Hals, Schilddrüse und Ösophagus eine CT bzw. MRT von Schädel, Hals und Thorax sowie ein Differenzialblutbild und die Bestimmung von alkalischer Phosphatase und Laktatdehydrogenase, eine Liquorpunktion bei neurologischen Symptomen sowie eine Endoskopie bei intestinalem Befall bzw. eine Szintigrafie bei ossärer Beteiligung durchzuführen. Die Vornahme einer Knochenmarksbiopsie ist obligat. Im Vordergrund steht aber die histologische Sicherung, die in der Regel die Entnahme eines Lymphknotens erfordert. Feinnadelpunktionen werden von den Pathologen nicht als ausreichend erachtet, da eine Subtypisierung damit nicht sicher möglich ist. Bei der Lymphknotenexstirpation sollte darauf geachtet werden, dass Lymphknoten aus dem unteren Halsbereich eher befallen sind als solche aus dem oberen, die manchmal nur reaktiv vergrößert sind. Wünschenswert ist außerdem die Entnahme eines größeren Knotens aus einer Lymphknotengruppe. Der Lymphknoten sollte dabei möglichst in toto mit intakter Kapsel herauspräpariert werden. Bei extranodaler Manifestation ist ebenfalls auf eine ausreichend große Biopsie zu achten. Therapie. Die Auswahl der Therapie wird wesentlich von der Ausbreitung und vom histologischen Typ bestimmt. Bei Vorliegen eines Morbus Hodgkin wird eine Chemound/oder Strahlentherapie durchgeführt. Bei der Lokalbehandlung niedrig maligner Non-Hodgkin-Lymphome kommt die Radiatio als kurative Therapie, bei symptomatischen disseminierten Lymphomen eine Polychemotherapie zur Anwendung. Bei aggressiven, hoch malignen Lymphomen ist die Polychemotherapie die Behandlung der Wahl, die heute zunehmend durch monoklonale Antikörper ergänzt wird. Halslymphknotenmetastasen bei unbekanntem Primärtumor (CUP‑Syndrom) Metastatische Absiedelungen können als erste erkennbare Zeichen maligner Tumoren auftreten. Die Metastasierung kann dabei ihren Ursprung von einem unbekannten Tumor der oberen Luft- und Speisewege, der Schilddrüse oder der Haut des Kopf-Hals-Bereichs nehmen. Die Metastasen können aber auch von einem bisher unbekannten, infraklavikulär lokalisierten Malignom herstammen. Der Begriff CUP‑Syndrom (Cancer of unknown Primary) ist erst dann gerechtfertigt, wenn eine oder mehrere histologisch gesicherte Metastasen eines malignen Tumors vorliegen, dessen Lokalisation trotz intensiver Diagnostik nicht bestimmt werden kann. Ätiologie. Ca. 3 – 5 % der malignen Neuerkrankungen der Kopf-Hals-Region sind Halslymphknotenmetastasen eines unbekannten Primärtumors. Etwa 37 % der Metastasen eines CUP‑Syndroms manifestieren sich zunächst in den Lymphknoten, wobei der Anteil der zervikalen Lymphknotenmetastasen 84 % beträgt. Das mittlere Erkrankungsalter liegt bei 60 Jahren; Männer sind doppelt so häufig betroffen wie Frauen. Der überwiegende Anteil (bis zu 70 %) sind Lymphknotenmetastasen unbekannter 694 Plattenepithelkarzinome, gefolgt von den Adenokarzinomen. Diagnose. Die Diagnosestellung eines CUP‑Syndroms setzt definitionsgemäß eine intensive Suche nach dem möglichen Primärtumor voraus. Grundsätzlich muss für das weitere diagnostische Vorgehen geklärt werden, ob bei Patienten mit unklaren Halsschwellungen diese durch ein malignes Geschehen verursacht sind. Die ärztlichen Maßnahmen beginnen mit einer ausführlichen Erhebung der Anamnese. Folgende Faktoren erhöhen die Möglichkeit eines malignen Prozesses: l Alter > 40 Jahre l langjähriger Alkohol- und Tabakkonsum l relativ schnell wachsender Halstumor l Dysphagie l Otalgie l Dyspnoe Weitere Fragen zielen auf Symptome vonseiten der Lunge oder des Gastrointestinaltrakts, wie Dyspepsie, Hämatemesis, Hämoptoe, Stuhlunregelmäßigkeiten oder Blut im Stuhl. Auch nach möglichen Erkrankungen der Haut und stattgefundenen Operationen sollte gefragt werden. Allgemeinsymptome wie Gewichtsverlust, Fieber und Nachtschweiß können auf systemische Ursachen einer Halslymphknotenschwellung hindeuten. Es folgt dann eine komplette HNO-ärztliche Untersuchung einschließlich der Haut. Bei Patienten mit Metastasen ausgehend von einem Primärtumor des oberen Aerodigestivtrakts kann der Primärtumor in etwa 90 % der Fälle durch eine sorgfältige Untersuchung gefunden werden. Dabei kann die Lokalisation der betroffenen Lymphknoten bereits einen Hinweis auf den Ort des Primärtumors geben, die bei der Primärtumorsuche Beachtung finden sollten. Die wichtigsten Metastasierungsrichtungen von Plattenepithelkarzinomen sind in Tab. 14.4 zusammengestellt. Zur Untersuchung gehört die sorgfältige Inspektion der Mundhöhle einschließlich Mundboden, Alveolarkamm, Tabelle 14.4 Typische Halslymphknotenmetastasierung in Abhängigkeit von der Lokalisation des Primärtumors. Level Lokalisation I Lippe, vorderer Mundboden, Nase- und Nasennebenhöhlen, Wange II Mundhöhle, Oropharynx, Larynx (supraglottisch, glottisch) III Zungengrund, Larynx (glottisch), Hypopharynx IV Larynx (subglottisch), Hypopharynx, Schilddrüse, Ösophagus und Trachea V Nasopharynx, dorsale Kopfhaut, Gastrointestinaltrakt, Lunge VI Schilddrüse, Larynx (subglottisch), Trachea Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ ......... 14 Abb. 14.12 Teilnekrotische Lymphknotenmetastase (B‑sonografisches Bild). Positronenemissionstomografie wird das Glukoseanalogon 18-Fluorodesoxyglukose (18FDG) verwendet. Dieses Radionuklid wird in die sich schnell teilenden Tumorzellen aufgenommen, weshalb sich das Tumorgewebe durch seinen höheren 18FDG‑Gehalt von dem normalen umgebenden Gewebe unterscheidet. Die Methode ist sensitiv und lässt in Ergänzung mit anderen bildgebenden Verfahren eine recht genaue Detektion und Lokalisation von malignem Gewebe zu. Andererseits ist die Spezifität der 18 FDG‑Positronenemissionstomografie gering. Insbesondere entzündliche Prozesse mit Gewebsazidose und überwiegend anaerobem Stoffwechsel können falsch-positive Resultate verursachen. So wurden falsch-positive Ergebnisse bei Patienten mit Sarkoidose, reaktiver Lymphadenopathie und granulomatöser Lymphadenitis beschrieben. Zur Erkennung regionaler Halslymphknotenmetastasen weist die Positronenemissionstomografie eine ähnliche Trefferquote wie die CT oder MRT auf. Beim CUP‑Syndrom kann mithilfe der Positronenemissionstomografie in 30 – 50 % der Fälle ein Primärtumor detektiert werden (Abb. 14.13). Zudem ermöglicht die 18FDG‑Positronenemissionstomografie eine simultane Darstellung aller Körperregionen, was insbesondere beim CUP‑Syndrom von Nutzen ist, da bis zu 40 % der okkulten Primärtumoren außerhalb der Kopf-Hals-Region lokalisiert sind. Ein weiterer Einsatz der 18FDG‑Positronenemissionstomografie scheint die Verlaufskontrolle nach erfolgter Tumortherapie zu sein, da es in diesen Fällen häufig schwierig ist, Narbengewebe sicher von aktivem Tumorgewebe zu unterscheiden. Durch die Kombination von PET und CT konnte in jüngster Zeit eine deutlich verbesserte räumliche Auflösung erreicht werden. Dadurch hat die PET-CT in der Diagnostik des CUP-Syndroms einen deutlich verbesserten Stellenwert gegenüber der alleinigen PET-Untersuchung. 695 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Zunge, hartem und weichem Gaumen und Mundvorhof. Bei Oropharynx, Zunge, Vallekula und Tonsillenregion sowie weichem Gaumen muss neben der Inspektion auch eine Palpation vorgenommen werden. Die Untersuchung der kaudalen Oropharynxabschnitte, des Hypopharynx und des Larynx erfolgt mithilfe der 90°-Optik transoral oder mit der flexiblen Optik transnasal. Die Untersuchung mit der flexiblen Optik erlaubt auch die Betrachtung der Nasenhaupthöhle und des Nasopharynx, bevor das Endoskop dann zur Untersuchung des Oropharynx, Hypopharynx und Larynx sowie der subglottischen Region und der Trachea weiter eingeführt wird. Die Bestätigung eines malignen Halstumors sollte zunächst durch eine Feinnadelaspiration mit anschließender zytopathologischer Begutachtung erfolgen. Hierdurch können die Nachteile einer offenen Biopsie vermieden werden. Leider werden auch heute noch häufig offene Biopsien durchgeführt, bevor systematisch nach dem Primärtumor gesucht wird. Dies kann zur Folge haben, dass durch die Metastaseneröffnung die definitive operative Behandlung schwieriger und ggf. eine Strahlentherapie unvermeidlich wird. Die diagnostische Aussagekraft der Feinnadelpunktion beschränkt sich häufig auf die Unterscheidung zwischen benigne und maligne und beeinflusst die weitere Diagnostik zur Suche des Primärtumors. Das Ergebnis der Feinnadelpunktion hängt ganz wesentlich von der Art und der Menge der Materialgewinnung, aber auch von der Erfahrung des die Gewebeprobe beurteilenden Zytopathologen ab. Es ist zu empfehlen, die Feinnadelpunktion von kleineren Knoten oder von Knoten, die in unmittelbarer Nähe der großen Gefäßen lokalisiert sind, ultraschallgeführt vorzunehmen, wodurch das Ergebnis deutlich verbessert werden kann. Lässt sich mit der Feinnadelpunktion keine ausreichende Beurteilung erzielen, kann eine histologische Gewebeuntersuchung erforderlich werden. Dabei sind die Gewinnung eines Gewebezylinders mittels Grobnadelpunktion oder besser eine Lymphknotenentnahme einer offenen Biopsie vorzuziehen. Insbesondere bei Verdacht auf ein malignes Lymphom ist die vollständige Entnahme eines befallenen Lymphknotens sinnvoll, um eine exakte histologische Klassifikation vornehmen zu können. Bei der Suche nach dem Primärtumor, aber auch bei der Beurteilung der Halslymphknotenmetastase bezüglich der Lokalisation und Beziehungen zu Nachbarstrukturen sind bildgebende Verfahren, wie die B‑Sonografie, CT oder MRT, notwendig. Methode der 1. Wahl ist die Ultraschalluntersuchung (Abb. 14.12). Die Beurteilung ist bei ausgedehnten, hoch und tief zervikal sitzenden Metastasen jedoch häufig eingeschränkt, so dass in diesen Fällen eine CT oder MRT sinnvoll erscheint. Vorteil beider Verfahren ist, dass neben der Lymphknotendarstellung gleichzeitig auch nach einem möglichen Primärtumor gesucht werden kann. In den letzten Jahren wird zur Primärtumorsuche zunehmend die Positronenemissionstomografie (PET) eingesetzt. Maligne Tumoren weisen im Vergleich zu Normalgewebe eine gesteigerte Stoffwechselaktivität auf. Für die Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. In der Diagnostik des CUP‑Syndroms kommt bei Vorliegen eines Plattenepithelkarzinoms oder auch eines undifferenzierten Karzinoms der Panendoskopie (Nasenund Nasopharynxendoskopie, Meso- und Hypopharyngoskopie sowie Ösophago-, Laryngo- und Tracheoskopie) eine besondere Bedeutung zu. Dabei werden eine Tonsillektomie sowie tiefe Biopsien aus dem Nasopharynx und dem Zungengrund durchgeführt. Es hat sich bewährt, die Schleimhautproben aus dem Zungengrund flächig und seitengetrennt mit dem CO2-Laser zu entnehmen. Mit diesem Vorgehen kann die Nachweisrate okkulter Karzinome deutlich gesteigert werden. Bei Verdacht auf eine zervikal lokalisierte Metastase eines Adenokarzinoms sollten zusätzlich Untersuchungen der Mamma, der Prostata und des Rektums eingeleitet werden. Weiterführende Untersuchungen werden durch bereits vorliegende Ergebnisse bestimmt. tastasierung, die zunächst im regionären Drainagegebiet des Primärtumors erfolgt. Mit fortschreitendem Tumorwachstum sind zunehmend weitere zervikale Lymphknotenstationen betroffen. Die Metastasierung erfolgt zunächst ipsilateral; bei mittelliniennahem Tumorwachstum tritt vielfach eine bilaterale Lymphknotenmetastasierung auf. Das Ausmaß der Halslymphknotenmetastasierung ist für die Prognose des Patienten und für die Planung des therapeutischen Vorgehens von großer Bedeutung. Die möglichst frühzeitige und zuverlässige Detektierung von Halslymphknotenmetastasen ist daher von essenzieller Wichtigkeit. Die international anerkannte Klassifikation der zervikalen Lymphknotenmetastasen erfolgt nach den Kriterien des American Joint Commitee on Cancer (AJCC) und der International Union against Cancer (UICC). Therapie und Prognose. Behandlungsstrategien und Gesamtprognose der Patienten werden unmittelbar vom histologischen Typ der Lymphknotenmetastase beeinflusst. So ist die Prognose bei Plattenepithelkarzinommetastasen besser als bei anderen Histologietypen. Weitere prognostisch relevante Parameter sind die Anzahl und Lokalisation der Metastasen oder der Nachweis eines Kapseldurchbruchs. Bei hoch zervikal sitzenden Lymphknotenmetastasen liegt die tumorspezifische 5-Jahres-Überlebensrate bei 60 %, wohingegen sie bei tief zervikalen Metastasen mit weniger als 15 % angegeben wird. Die Strahlentherapie nimmt bei der Behandlung des CUP‑Syndroms einen zentralen Platz ein, da sie den Lymphabfluss und die unbekannte Primärtumorlokalisation gemeinsam behandeln kann. Die besten Ergebnisse bezüglich der Überlebenszeit ergeben sich aus einer Kombination aus Chirurgie (Neck Dissection) und anschließender Strahlentherapie. Allerdings gibt es bezüglich des Ausmaßes der Neck Dissection und den Protokollen der Strahlentherapie (mit/ohne Chemotherapie, Bestahlungsarten, Zielvolumina) erhebliche Variationen. Diagnose und Staging. Viele Jahre lang war die Palpation der Standard für das Staging eines Halses. Die Ungenauigkeit war auch bei erfahrenen Untersuchern hoch, da einerseits der Palpationsbefund aufgrund individueller anatomischer Gegebenheiten oft schwer zu erheben ist und andererseits vergrößerte Halslymphknoten erst ab einer Größe von über 10 mm sicher tastbar sind. Heute gehören zum Staging daher bildgebende Verfahren. Als Methode der Wahl ist die Ultraschalluntersuchung zu nennen, aber auch die CT und MRT. Über den hohen Stellenwert der B‑Bildsonografie als momentan sensitivstem Verfahren zur Erkennung von Lymphknotenmetastasen im Rahmen des Primär-Stagings und auch in der Tumornachsorge besteht in der Literatur Einigkeit. Die B‑Sonografie ist der Palpation eindeutig überlegen und, je nach Studie und Zugrundelegung der Vergleichsparameter, auch der CT und MRT ebenbürtig oder überlegen. Unter Einbeziehung der sonografisch kontrollierten Feinnadelpunktion wird in der Literatur die Sensitivität mit 93 – 95 % und die Spezifität mit 87 – 100 % angegeben. Gelegentlich werden auch andere Methoden, wie Lymphografie, Lymphoszintigrafie und Immunoszintigrafie mit radioaktiv markierten monoklonalen Antikörpern, eingesetzt. Ihre Anwendungsmöglichkeiten sind jedoch eingeschränkt und die Aussagekraft nicht oder noch nicht gesichert. Weitere wichtige Informationen für die Therapieplanung ergeben sich aus den Beziehungen der metastastisch Halslymphknotenmetastasen bei bekanntem Primärtumor Das Plattenepithelkarzinom ist der häufigste maligne Tumor der oberen Luft- und Speisewege. Charakteristisch für diese Tumorentität ist die frühzeitige lymphogene Me696 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Abb. 14.13 a, b PET-CT eines Hypopharynxkarzinoms (Sinus piriformis rechts) mit 1 großen und 2 kleinen Lymphknotenmetastasen rechts. Primärtumor und Halsmetastase zeichnen sich durch einen hohen Glukoseumsatz und damit hoher Aktivität in diesen Strukturen aus. Abb. 14.14 Zervikale Lymphknotenmetastase (Ultraschall-B‑Bild) mit nicht verschieblicher Bindegewebsschicht zum Gefäß (Wandinfiltration, Stadium 3; CCA = A. carotis communis, LN = Metastase). Abb. 14.15 Halslymphknotenmetastase mit Gefäßeinbruch (Ultraschall-B‑Bild), der an der unregelmäßigen Wandstruktur der längs dargestellten A. carotis communis erkennbar wird (Stadium 4). befallenen Lymphknoten zu den umgebenden Strukturen (Muskulatur, Gefäße). Hierdurch wird das Ausmaß der Neck Dissection bestimmt. Besonders wichtig ist das Verhältnis großer Lymphknotenmetastasen zur A. carotis communis und zur A. carotis interna. Durch die Sonopalpation kann geklärt werden, ob eine chirurgische Trennung von Tumor und Arterie möglich ist. Die ultrasonografische Sonopalpation hat sich dabei in mehreren Studien der MRT- und CT‑Untersuchung in den für die Ultraschalluntersuchung zugänglichen Regionen als überlegen erwiesen. Dabei macht man sich die Möglichkeit der dynamischen Untersuchung im B‑Bildverfahren zunutze, bei der im Gegensatz zur CT und MRT Bewegungsabläufe fest- Erkrankungen gehalten und beurteilt werden können. Bei der Untersuchung wird vor allem auf die Gefäßwand geachtet. Gegebenenfalls empfiehlt es sich daher, die Untersuchung ohne Farbkodierung vorzunehmen. Wenn die Arterienwand deutlich und ununterbrochen in 2 Ebenen dargestellt werden kann, darf der Untersucher davon ausgehen, dass keine Gefäßbeteiligung vorliegt. Als indirekte Zeichen eines Tumoreinbruchs in ein arterielles Gefäß können eine Kontaktlänge von mehr als 3 cm und eine Ummauerung des Gefäßes von mehr als 150° gewertet werden. Des Weiteren wird die Beweglichkeit der Gefäße gegenüber dem Tumor beurteilt (Abb. 14.14 und Abb. 14.15). Direkte Zeichen eines Tumoreinbruchs sind ein intraluminal festgestelltes Tumorwachstum sowie eine Unterbrechung des Wandechos und eine sonopalpatorisch nicht nachweisbare Verschieblichkeit des Tumors gegenüber dem Gefäß und umgekehrt. Die erhobenen Befunde werden in 4 Stadien eingeteilt: l Stadium 1: Unabhängige Pulsationen der A. carotis communis bzw. interna und deutliche Verschieblichkeit zwischen Tumor und Gefäß. l Stadium 2: Noch erkennbare unabhängige Bewegung zwischen Arterie und Tumor ohne deutliche Verschieblichkeit. l Stadium 3: Verlust der unabhängigen Bewegung der Arterien gegenüber dem Tumor, eventuell mit Kompression des Lumens; die Grenzen der Gefäße sind nicht mehr erkennbar und eine zirkuläre Tumorumwachsung des Gefäßes kann vermutet werden. l Stadium 4: Deutliche Gefäßinfiltration der Arterie mit oder ohne intraluminalem Tumor; in diesem Stadium kann in der Farbduplexsonografie eine verlangsamte Blutflussgeschwindigkeit festgestellt werden. Die Ultraschallsonografie ist die einzige dynamische Untersuchungsmethode, die es dem Untersucher erlaubt, Beziehungen der großen Gefäße zu den Nachbarschaftsstrukturen und vor allem zum Tumor darzulegen. Findet sich bei der Sonopalpation eine Tumor-Gefäß-Beziehung des Stadiums 3 oder 4, muss mittels weiterführender Untersuchungen geklärt werden, ob eine Resektion möglich ist. Auf jeden Fall sollte bei der Operation ein möglicher Gefäßersatz eingeplant werden. Bösartige Tumoren des Halses, vor allem metastatische Lymphknoten, entwickeln im späteren Stadium Kapselrupturen mit extrakapsulärer Tumorausbreitung. Zunächst kommt es an den Nachbarstrukturen zu Adhäsionen, später zu Infiltrationen. Dies betrifft neben den großen Arterien auch die V. jugularis interna, den M. sternocleidomastoideus, den N. vagus, den Pharynxschlauch und die tiefe Halsmuskulatur. Ab einer Größe von 4 cm erscheinen Tumoren häufig palpatorisch nicht trennbar vom M. sternocleidomastoideus, der V. jugularis interna oder der A. carotis. Eine Adhärenz an die V. jugularis interna lässt sich bereits ab einer Tumorgröße von etwa 2,5 cm beobachten. Die Ultraschalluntersuchung erlaubt auch in diesen Fällen eine recht genaue Diagnostik und damit Operationsplanung. 697 ......... 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................ 14 Hals, Schilddrüse und Ösophagus ................................................................................. Schilddrüse Anderson PE, Shah JP, Cambronero E et al. The role of comprehensive neck dissection with preservation of the spinal accessory nerve in the clinically positive neck. Amer J Surg 1994; 168: 499 – 502 Byers RM, Clayman GL, Guillamondegui OM et al. Resection of advanced cervical metastasis prior to definitive radiotherapy for primary squamous carcinomas of the upper aerodigestive tract. Head Neck Surg 1992; 14: 133 – 138 Davidson BJ, Spiro RH, Patel S et al. Cervical metastases of occult origin: the impact of combined modality therapy. Amer J Surg 1994; 168: 395 – 399 Demir H, Berk F, Raderer M et al. The role of nuclear medicine in the diagnosis of cancer of unknown origin. Q J Nucl Med Mol Imaging 2004; 48: 164 – 173 Dünne AA, Kim-Berger HS, Zimmermann S et al. Atypical mycobacterial tuberculosis – a diagnostic and therapeutic dilemma? Case reports and review of the literature. Otolaryngol Pol 2003; 57: 17 – 23 Joshi N, Caputo GM, Weitekamp MR et al. Infections in patients with diabetes mellitus. New Engl J Med 1999; 16: 1906 – 1912 Kirschner MJ, Fietkau R, Walsfahrer F et al. Zur Therapie von zervikalen Lymphknotenmetastasen bei unbekanntem Primärtumor. Strahlenther Onkol 1997; 137: 362 – 368 Knipping S, Goetze G, Neumann K et al. Sclerotherapy of cervical cysts with picibanil (OK‑432). Eur Arch Otorhinolaryngol 2007; 264: 423 – 427 Langford FP, Moon RE, Stolp BW et al. Treatment of cervical necrotizing fasciitis with hyperbaric oxygen therapy. Otolaryngol Head Neck Surg 1995; 112: 274 – 278 McCaffrey TV, Meyer FB, Michels VV et al. Familial paragangliomas of the head and neck. Arch Otolaryngol 1994; 120: 1211 – 1216 Mulliken JB, Glowacki J. Hemangiomas and vascular malformations of infants and children: a classification based on endothelial charactersistics. Plast Reconstr Surg 1982; 69: 412 – 422 Papaspyrou K, Rossmann H, Fottner C et al. Malignant paraganglioma caused by a novel germline mutation of the succinate dehydrogenase D‑gene – a case report. Head Neck 2008; 30: 964 – 969 Van der May AGL, Frijns JHM, Cornelisse CJ et al. Does intervention improve the natural course of glomus tumors? A series of 108 patients seen in a 32-years period. Ann Otol 1992; 101: 635 – 642 Waner M, Suen JY. Hemangiomas and vascular malformations of the head and neck. New York: Wiley-Liss; 1999 Werner JA, Dünne AA. Halslymphknotenmetastasen bei unbekanntem Primärtumor. In: Werner JA, ed. Lymphknotenerkrankungen im Kopf-Hals-Bereich. Onkologie und Differenzialdiagnostik. Berlin: Springer; 2002: 273 – 285 Werner JA, Eivazi B, Folz BJ et al. „State of the Art“ zur Klassifikation, Diagnostik und Therapie von zervikofazialen Hämangiomen und vaskulären Malformationen. Laryngo Rhino Otol 2006; 85: 883 – 891 Woods CI, Strasnick B, Jackson CG. Surgery for glomus tumors: the Otology Group experience. Laryngoscope 1993; 103: 65 – 70 H. J. Neumann 698 Die Vergrößerung der Schilddrüse wird symptomatisch als Struma bezeichnet. Diese morphologischen Veränderungen können diffus (Struma diffusa) oder nodös (Struma nodosa; einknotig, mehrknotig) sein. Neben diesen entopen Lokalisationen kommen auch dystope Lokalisationen (intrathorakale, mediastinale Ausbreitungen und Zungengrundstrumen) vor. Die klinische Stadieneinteilung erfolgt zur Bestimmung der altersabhängigen Grenzvolumina hinreichend exakt mit der sonografischen Volumetrie (Tab. 14.5). Die Stadieneinteilung nach WHO (Struma Grad I – III) ist bei der palpatorischen Untersuchung der Schilddrüse zweckmäßig. Eine hohe Prävalenz für Autonomien der Schilddrüse (unifokal, mulitifokal, disseminiert) besteht bei älteren Menschen. Diagnostisch müssen benigne von malignen Erkrankungen abgegrenzt werden. Ursachen für die Erkrankungen der Schilddrüse zeigt die Tab. 14.6. Schilddrüsenerkrankungen kommen in Deutschland häufig vor. Etwa 50 % der Bevölkerung haben eine vergrößerte Schilddrüse; davon sind 20 – 30 % behandlungsbedürftig (ca. 20 Mio. Personen). Mitteleuropa und insbesondere Deutschland ist durch den meist chronischen Jodmangel ein Strumaendemiegebiet. Durch die letzte Eiszeit vor rund 20 000 Jahren wurden beim Abschmelzen der Gletscher wichtige Spurenelemente nahezu vollständig aus dem Boden gewaschen. Deshalb können derzeit mit der Nahrung täglich nur ca. 70 μg Jod aufgenommen werden, obwohl ca. 150 – 300 μg für eine reguläre Stoffwechselfunktion notwendig wären. Das zu geringe Jodangebot in der Nahrung führt zunächst zu einer kompensatorischen Hyperplasie der Schilddrüse. Dieser Veränderung folgen knotiger Umbau, Zystenbildung, Verkalkungen und die Bildung von funktionell autonom wirkenden Arealen. Die meisten Patienten mit einer Struma haben eine normale Schilddrüsenfunktion. Hyperthyreote Stoffwechselsituationen bei einer funktionellen Autonomie oder immunogene Reaktionen beim Morbus Basedow sowie Hypothyreosen kommen wesentlich seltener vor. Tabelle 14.5 Kinder Jugendliche Schilddrüsenvolumen. 8 Jahre < 4 ml 10 Jahre < 8 ml 15 – 18 Jahre < 15 ml Frauen < 18 ml Männer < 25 ml Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie 14.1.2 Literatur ................................................................ Mögliche Ursachen einer Struma. Häufigkeit Mögliche Ursachen häufig (ca. 90 %) l alimentärer Jodmangel seltener l Autonomie der Schilddrüse l Morbus Basedow l Hashimoto-Thyreoiditis l andere Thyreoiditiden (z. B. subakute Thyreoiditis de Quervain) l Tumoren, Zysten l Schwangerschaft l Medikamente (Thyreostatika, Lithium) l angeborene Enzymdefekte l TSH‑Rezeptormutation l TSH‑produzierender Hypophysentumor l Schilddrüsenhormonresistenz l Riedel-Struma l Akromegalie l Hodentumoren l Amyloidose l strumigene Nahrungsfaktoren (Thiozyanat, Perchlorat, Nitrat) l Selen-, Zinkmangel sehr selten TSH = thyreoideastimulierendes Hormon, Thyreotropin Pathophysiologische Grundlagen Anatomie der Schilddrüse Aus einer unpaarigen Anlage am Boden der Schlundtasche entwickelt sich der follikuläre Anteil der Schilddrüse. Dieser entodermale Epithelwulst (Tuberculum thyreoideum) senkt sich in das anliegende Mesenchym, wird nach kaudal verlagert bis zur endgültigen Position vor der Trachea und bleibt anfänglich durch den Ductus thyreoglossus mit seinem Ursprungsort am Zungengrund (Foramen caecum) verbunden. Der Ductus thyreoglossus obliteriert in der weiteren Entwicklung. In seinem Bereich kann sich dystopes Schilddrüsengewebe als Zungengrundstruma entwickeln. Die kaudalen Reste können einen Lobus pyramidalis am Oberrand des Schilddrüsenisthmus bilden. In der 10. Schwangerschaftswoche erfolgt bereits die erste Jodaufnahme diaplazentar, und nach kurzer Zeit werden Schilddrüsenhormone synthetisiert und sezerniert. In diesem Zeitraum entwickelt sich die fetale hypothalamischhypophysäre Funktion – fetales thyreoideastimulierendes Hormon (TSH) wird nachweisbar. Auch mütterliche Schilddrüsenhormone können auf den Fötus permeieren, aber auch Thyreostatika und maternale Autoantikörper. Beim Neugeborenen wiegt die Schilddrüse ca. 2 g. Die Schilddrüse besteht aus dem rechten und linken Schilddrüsenlappen und ist nahezu symmetrisch in Höhe der oberen Trachea in die paratracheale Region eingebettet. Der Schilddrüsenisthmus verbindet beide zu einer schmetterlingsartigen Nervenfaser Follikellumen mit Kolloid ......... Blutgefäß 14 Thyreozyt Lymphgefäß Schilddrüsenkapsel 50 μm Abb. 14.16 Mikroanatomie der Schilddrüse. Figur. Das Parenchym der Schilddrüse besteht aus Thyreozyten, die Schilddrüsenfollikel bilden und eine Größe von ca. 50 – 200 μm haben. Das in den Follikeln vorhandene Kolloid besteht hauptsächlich aus Thyreoglobulin. Zwischen den einzelnen Zellen und den Follikeln befinden sich die kalzitoninbildenden C‑Zellen. Die Schilddrüsenfollikel, die in ihrer Form und Größe sehr unterschiedlich sein können, sind von Nerven, Lymph- und zahlreichen Blutgefäßen umgeben (Abb. 14.16). Die Blutzufuhr erfolgt über die Arteria thyreoidea superior et inferior beiderseits und beträgt im Normalfall 4 – 6 ml Blut/min und g Gewebe. Eine erhebliche Mehrdurchblutung kann bei Hyperthyreosen vorhanden sein (schwirrende, rauschende Struma). Der Lymphabfluss aus der prälaryngealen und paratrachealen Region wird in die tiefen zervikalen und weiter in die mediastinalen Lymphknoten abgeleitet. Von besonders großer klinischer Bedeutung sind die topografisch-anatomischen Beziehungen der Schilddrüse bzw. Struma zu den arteriellen und venösen Polgefäßen, den Nebenschilddrüsen, den oberen und unteren Kehlkopfnerven sowie die Beziehungen zur Trachea, zum Larynx, zum Ösophagus, zur Nerven-GefäßScheide und zum vorderen oberen Mediastinum. Schilddrüsenhormonstoffwechsel Die Schilddrüse hat die Aufgabe, für den Organismus in ausreichender Menge die Schilddrüsenhormone Tetrajodthyronin (Thyroxin, T4) und Trijodthyronin (T3) zu synthetisieren. 699 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 14.6 Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. Bedeutung der Schilddrüsenhormone für die verschiedensten Stoffwechselprozesse. Fettstoffwechsel Spezielle HNO‑Erkrankungen und ihre Therapie Kohlenhydratstoffwechsel Eiweißstoffwechsel Knochenstoffwechsel ZNS, neuromuskuläre Übertragung, Muskulatur l Steigerung der Fettmobilisation l Abbau von Speicherfetten l Lipidsynthese geringfügig erhöht l Hyperthyreose → Abfall der Cholesterinwerte l Hypothyreose → Anstieg der Cholesterinwerte l intestinale Resorption der Kohlenhydrate wird beschleunigt; Steigerung der Glukoneogenese mit verstärktem Kohlenhydratabbau l Verstärkung der Insulinwirkung bei gleichzeitig verstärktem Insulinabbau; Insulinbedarf ↑ l anabole Wirkung bei physiologischen Dosen, katabole Wirkung bei erhöhten Schilddrüsenhormonkonzentrationen l Hypothyreose im Kindesalter → Minderwuchs l Hyperthyreosen bedingen ein verstärktes Wachstum mit einem verzögerten Schluss der Epiphysenfugen l normale Reifung des Skelettsystems bei Euthyreose l bei Schilddrüsenhormonmangel disproportionierter Minderwuchs bei verzögerter Skelettreifung l Aktivierung von Osteoblasten und Osteoklasten beim Erwachsenen l normale Reifung des Gehirns l bei Schilddrüsenhormonmangel in der Fetalzeit → irreversible Schäden (Kretinismus) l beim Erwachsenen bedingt ein Mangel oder Überschuss an Schilddrüsenhormonen Störungen des ZNS, der neuromuskulären Übertragung (Reflexe) und der Muskulatur l Schilddrüsenhormone steigern die Kontraktilität des Myokards, erhöhen das Schlagvolumen und die Herzfrequenz und führen zu einer Zunahme der Blutdruckamplitude l Sauerstoffverbrauch und Erregbarkeit ↑ l bei Hyperthyreosen sind kardiale Komplikationen (Extrasystolen, Vorhofflimmern, Angina pectoris) möglich Das Spurenelement Jod ist ein zentraler Baustein. Das mit der Nahrung aufgenommene anorganische Jodid gelangt über den Dünndarm in die Blutbahn und wird zur Schilddrüse transportiert. Hier wird das Jodid unter Mitwirkung der Schilddrüsenperoxidase in das Thyreoglobulin eingebaut, das in den Thyreozyten gebildet wird. Die Synthese von Tetra- und Trijodthyronin erfolgt über die Kopplungsreaktion von Mono- bzw. Dijodthyrosin. Die Speicherung der jodierten Thyreoglobulinmoleküle erfolgt in Abhängigkeit vom Jodangebot in den Follikellumen. Die Schilddrüse kann auch im extrazellulären Raum Hormone speichern. Die Hypophyse steuert den Bedarf an Schilddrüsenhormonen über die Blutbahn durch das Thyreotropin (TSH). Durch enzymatische Prozesse wird aus dem Thyreoglobulin Thyroxin und Trijodthyronin gebildet und über die Basalmembran der Schilddrüsenfollikel in die Blutbahn abgegeben. Die Schilddrüse sezerniert beim Gesunden täglich ca. 100 µg Thyroxin. Das entspricht einem Hormonanteil von mehr als 90 %. Dagegen wird das Trijodthyronin vorwiegend extrathyreoidal in der Leber aus T4 gebildet – ca. 30 μg. Die Schilddrüsenhormone (T4) sind zu 99,9 % an Transportproteine gebunden und kommen nur etwa zu 0,03 % 700 in freier Form vor. Beim T3 liegt der freie Anteil bei ca. 0,3 %. Transportproteine sind das thyroxinbindende Globulin (TBG), das Transthyretin (TTR) und das Albumin. Das thyroxinbindende Globulin ist mit seiner großen Bindungsaffinität das wichtigste Transportprotein. Für die Hormonwirkung stehen in der Körperperipherie nur die freien Hormone zur Verfügung. Die Konzentration und die Zusammensetzung der Transportproteine bestimmen die Gesamthormonkonzentration. Erkrankungen, die die Konzentration an thyroxinbindendem Globulin beinflussen, müssen bei der Beurteilung der Gesamthormonkonzentration berücksichtigt werden. Die Tab. 14.7 zeigt die Bedeutung der Schilddrüsenhormone für die verschiedensten Stoffwechselprozesse. Anhand der pathophysiologischen Auswirkungen bei einem gestörten Schilddrüsenhormonstoffwechsel wird deutlich, welche klinisch relevanten Folgen – z. B. nach einer ablativen chirurgischen Intervention – zu erwarten sind, wenn nicht eine entsprechende medikamentöse Substitution erfolgt. Das Thyreotropin (TSH) und die intrathyreoidalen autoregulatorischen Prozesse der Schilddrüsenhormonsynthese regulieren die bedarfsgerechte Bereitstellung von Schilddrüsenhormonen für die einzelnen Stoffwechsel- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 14.7 ................................................................ Diagnostik von Schilddrüsenerkrankungen Anamnese Die Beschwerden bei Schilddrüsenerkrankungen resultieren einerseits aus den funktionellen Veränderungen (Hyper- und Hypothyreose) und andererseits aus der Größe (Struma) sowie dem Zeitraum des Auftretens. Bei der Erhebung der Anamnese sollten gezielte Fragen gestellt werden nach: l familiärer Belastung durch Schilddrüsenerkrankungen l Vergrößerung des Halsumfangs, Dysphagie, „Kloß im Hals“, Engegefühl → Luftnot l schnellem Wachstum, ggf. mit Heiserkeit → Schilddrüsenmalignom, Thyreoiditis l bei Befall der Schilddrüse durch extrahyreoidale bzw. systemische Erkrankungen, Tumorinfiltration anderer Genese l Vergrößerung der regionalen Lymphknoten → Malignomverdacht l Radiatio der Halsregion l Schlafstörungen l verminderter Temperaturtoleranz (frieren/schwitzen) l Gereiztheit, innerer Unruhe, kardialen Beschwerden l Müdigkeit, verminderter Leistungsfähigkeit l Verdauungsstörungen, Durchfall/Verstopfung l Medikamente (jodhaltige Medikamente, Östrogenpräparate [Kontrazeptiva]) l Pubertät, Schwangerschaft, Wechseljahren l Schmerzen in der Regio thyreoidea (Blutungen) l Veränderungen an Haut (trocken), Haaren (stumpf), Fingernägeln (brüchig) l Akromegalie Palpatorische Untersuchung der Schilddrüse Die palpatorische Untersuchung der Schilddrüse kann am sitzenden Patienten von vorn und von hinten vorgenommen werden. Folgende Palpationsbefunde sollen erhoben werden: l Konsistenz l Schluckverschieblichkeit l Größe: Einteilung nach WHO: l Oa: keine Struma l Ob: Struma nicht sichtbar, aber tastbar l I: Struma tastbar, bei rekliniertem Hals gerade sichtbar l II: Struma sichtbar l III: große sichtbare Struma, ggf. mit Komplikationen l l l l ......... Lokalisation der knotigen Veränderungen Atemgeräusche Halslymphknotenschwellungen Druckschmerzhaftigkeit (Thyreoiditis de Quervain) Klinische Untersuchungsbefunde Beim Verdacht auf eine Schilddrüsenfunktionsstörung sollten folgende klinische Befunde beachtet werden: l Hyperthyreose: Tachykardie, vergrößerte Blutdruckamplitude, feinschlägiger Tremor, feuchte warme Haut, gesteigerte Muskelreflexe l endokrine Orbitopathie: → Morbus Basedow, ggf. mit Kopfschmerzen, Druckgefühl hinter dem Bulbus, Lichtempfindlichkeit, Epiphora, auch Doppelbilder l Hypothyreose: Verlangsamung, myxomatöse Hautveränderungen, Stimm- und Sprachstörungen (heisere, raue, kloßige Sprache), Bradykardie, verlangsamte Muskelreflexe In-Vitro-Diagnostik Thyreotropin-, Thyreotropin-releasing-Hormontest Das Glykoprotein Thyreotropin (TSH) wird in spezifischen basophilen Zellen des Hypophysenvorderlappens gebildet. Seine Freisetzung durch die Hypophyse stellt den zentralen Regulationsmechanismus der biologischen Schilddrüsenhormonwirkung dar. Das Thyreotropin stimuliert alle Stufen der thyreoidalen Hormonbildung und übt einen proliferativen Effekt aus. Der Thyreotropintest steht wegen seiner hohen Sensitivität und Spezifität am Anfang der Schilddrüsendiagnostik und ist besonders für den frühen Nachweis bzw. Ausschluss von Störungen des zentralen Regelkreises zwischen Hypothalamus. Hypophyse und Schilddrüse geeignet. Die Schilddrüsenfunktion wird durch eine hoch sensitive In-Vitro-Diagnostik (Thyreotropin-Elecsys-Test) analysiert. Mit diesem immunhistochemischen Verfahren kann eine zuverlässige Unterscheidung zwischen erniedrigten und normalen Thyreotropinspiegeln vorgenommen werden. Der normale Wert des basalen Thyreotropins liegt zwischen 0,4 und 4 mU/l. Bei Hypothyreosen ist der Thyreotropinspiegel erhöht (> 4 mU/l) und bei Hyperthyreosen erniedrigt (< 0,05 mU/l). Bei einem normalen Thyreotropinspiegel kann auf die Bestimmung des Thyreotropin-releasing-Hormonwerts in der Regel verzichtet werden. Bei schweren extrathyreoidalen Erkrankungen, z. B. der Hypophyse oder des Hypothalamus, kann auch die Bestimmung des Thyreotropin-releasing-Hormonwerts notwendig werden. Schilddrüsenhormone Da für die Beurteilung der Schilddrüsenhormonkonzentration die biologisch wirksamen freien Hormone fT4 und fT3 notwendig sind, erfolgt die Funktionsdiagnostik auf der Basis der freien Schilddrüsenhormonspiegel. Bei alleiniger Bestimmung der Gesamtschilddrüsenhormone sind 701 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. vorgänge. Das Thyreotropin (TSH) wird in den basophilen thyreotropen Zellen des Hypophysenvorderlappens gebildet. Seine Freisetzung wird zum einen durch das Thyreotropin-releasing-Hormon des Hypothalamus und zum anderen durch die Konzentration der freien Schilddrüsenhormone im Serum gesteuert. Das Thyreotropin stimuliert auch das Wachstum von Schilddrüsenzellen. Erkrankungen 14 Hals, Schilddrüse und Ösophagus Fehlinterpretationen möglich, wenn es z. B. zu Veränderungen der Konzentrationen oder der Bindungsfähigkeit der Transportproteine (thyroxinbindendes Globulin, thyroxinbindendes Präalbumin, Transthyretin und Albumin) kommt. Die Hormondiagnostik erfolgt mit Elektrochemilumineszenzimmunoassays für die Hormone TT4, fT4, TT3 und fT3. Das Trijodthyronin (T3) ist entscheidend für die Wirksamkeit der Schilddrüsenhormone an den unterschiedlichen Zielorganen. Es wird überwiegend extrathyreoidal in der Leber aus Thyroxin gebildet, vorwiegend durch enzymatische Dejodierung. Die Serumkonzentration gibt somit eher einen wichtigen Hinweis zum Funktionszustand des peripheren Gewebes als über die Sekretionsleistung der Schilddrüse. Vermindert sich die Umwandlung von Thyroxin zu Trijodthyronin (durch Medikamente: Propanolol, Glukokortikoide, aber auch bei schweren nicht thyreoidalen Allgemeinerkrankungen) kann es zur Senkung der Trijodthyroninkonzentration im Serum kommen. Trijodthyronin ist, wie auch das Thyroxin, fast 100%ig an Transportproteine gebunden, aber mit einer deutlich geringeren Affinität. Schilddrüsenautoantikörper Die Bestimmung von Autoantikörpern gegen Schilddrüsenantigene hat bei der Differenzialdiagnostik von Immunthyreopathien eine große Bedeutung erlangt. Es werden die Antikörper gegen folgende Proteine bestimmt: l Thyreotropinrezeptor (TSH‑R‑AK): Mit dessen Bestimmung kann eine Abgrenzung zwischen einem Morbus Basedow und einer nicht immunogen bedingten Hyperthyreose erreicht werden. l Schilddrüsenperoxydase (TPO‑AK): Mit der Bestimmung der TPO‑AK kann der Verdacht auf eine chronische Immunthyreoiditis erhärtet werden. Die Bestimmung der Antikörper muss im Zusammenhang mit anderen immunometrischen Verfahren erfolgen, da aus dem Anstieg und der Höhe der TPO‑AK nicht auf die Schwere der Immunthyropathie geschlossen werden kann. l Thyreoglobulin (TG‑AK): Die Bestimmung der TG‑AK wird beim Verdacht auf eine Autoimmunthyreopathie vorgenommen. Thyreoglobulin Das Thyreoglobulin (TG) nimmt im Schilddrüsenhormonstoffwechsel eine zentrale Stellung ein. Die Synthese und Freisetzung erfolgt durch das Thyreotropin. Eine besondere Bedeutung hat die Bestimmung des Thyreoglobulins als Tumormarker nach ablativer Therapie des differenzierten Schilddrüsenkarzinoms, d. h. die gesamte Schilddrüse (Tumor und gesundes Gewebe) muss entfernt werden. Sollte nach einer ablativen Therapie ein Schilddrüsenrest in situ verbleiben, ist eine Unterscheidung zwischen benignen und malignen Veränderungen nicht möglich. Die Thyreoglobulinbestimmung liefert zuverlässige Aussagen bei der Differenzialdiagnose der konnatalen Hypothyreose sowie der Hyperthyreosis factitia. Bei anderen benignen Schilddrüsenerkrankungen ist der diagnostische Stellenwert 702 eher als gering zu bewerten. Dagegen sind hohe Thyreoglobulinwerte bei großen Knotenstrumen, beim floriden Morbus Basedow oder der subakuten Thyreoiditis de Quervain nachweisbar. Kalzitonin Kalzitonin wird von den C‑Zellen gebildet und ist ein wichtiger Tumormarker bei der Diagnose und Verlaufskontrolle des medullären Schilddrüsenkarzinoms, aber auch beim Familien-Screening (multiple endokrine Neoplasie Typ 2) bzw. dem familiären medullären Schilddrüsenkarzinom. Titeranstiege weisen sehr spezifisch auf das Vorhandensein eines medullären Schilddrüsenkarzinoms bzw. auf ein Rezidiv hin. Die Bestimmung der Kalzitoninkonzentration im Serum erfolgt mit radioaktiven und nicht radioaktiven Verfahren. Die Sensitivität der Bestimmung kann durch den Pentagastrintest verbessert werden. Beim medullären Schilddrüsenkarzinom ist häufig das karzinoembryonale Antigen (CEA) erhöht. Referenzwerte: Männer 2 – 48 pg/ml, Frauen 2 – 10 pg/ml. Molekulargenetische Diagnostik Gendefekte können als angeborene Störungen die Synthese der Schilddrüsenperoxidase (TPO) und das Thyreoglobulin betreffen. Des Weiteren treten Mutationen des Thyreotropinrezeptorgens, der Schilddrüsenhormonbindungsproteine, des Gens für den nukleären Schilddrüsenhormonrezeptor und somatische Gendefekte in benignen und malignen Schilddrüsentumoren auf. Etwa 25 % der medullären Schilddrüsenkarzinome treten familiär im Rahmen einer multiplen endokrinen Neoplasie (MEN 2) auf. Die Subtypen des MEN 2 sind durch die Kombination mehrerer endokriner Störungen ausgewiesen: l MEN 2A: medulläres Schilddrüsenkarzinom, Phäochromozytom, Hyperparythyreoidismus l MEN 2B: medulläres Schilddrüsenkarzinom, Phäochromozytom, Schleimhautneurinome, marfanoider Habitus, Ganglionneuromatosen) Das familiäre medulläre Schilddrüsenkarzinom (FMTC) ist dadurch charakterisiert, dass kein Phäochromozytom und kein Hyperparythyreoidismus bestehen. Als Ursache dieser Krankheitsbilder wurde eine Keimbahnmutation des RET‑Protoonkogens nachgewiesen. Die Bestimmung sollte in speziellen Labors erfolgen. Sonografie Die Schilddrüsensonografie ist eine einfach durchführbare Methode ohne Belastung für den Patienten. Es werden hochauflösende Schallköpfe mit einer Frequenz von 7,5 – 10 Mhz verwendet. Die Sonografie kann beliebig oft wiederholt werden und ermöglicht eine objektive Untersuchung der Schilddrüse: l zur Bestimmung der Volumina (Referenzwerte: Frauen < 18 ml, Männer < 25 ml) l zur Angabe von Länge, Breite und Tiefe für jeden Schilddrüsenlappen; Besonderheiten zur Lage und Form Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. l l l l l l zur Binnenstruktur (Echomuster: homogen – inhomogen, echonormal – echoarm) zur diffusen Echoarmut → Verdacht auf Autoimmunthyreopathie zum Nachweis von Knoten bzw. fokalen Veränderungen: Größe, Struktur: solide – zystisch, scharf oder unscharf begrenzt, mit und ohne Randsaum zu Verkalkungen zur Beurteilung der Halslymphknoten (Lymphknotenkompartimente der Schilddrüse), der Nebenschilddrüsen, der Trachea und des Ösophagus sowie der Gefäßscheide zur Durchblutung (Duplexsonografie) Szintigrafie Die Szintigrafie liefert Informationen über den allgemeinen und lokalen Funktionszustand der Schilddrüse. Die kombinierte Beurteilung mit der Sonografie und den klinischen, laborchemischen und zytologischen Befunden ermöglicht eine hinreichende Befundbeurteilung. Bei der Szintigrafie wird ein Radiopharmakon nach intravenöser Gabe von der Schilddrüse aufgenommen (Uptake) und die globale Anreicherung über der Regio thyreoidea als Gesamt-Uptake gemeinsam mit der regionalen Aktivitätsverteilung gemessen. Damit können Aussagen über autonome Bezirke in der Schilddrüse nachgewiesen werden, ebenso funktionell inaktive, nicht speichernde Areale (kalte Knoten). Für die szintigrafischen Untersuchungen werden vorwiegend 2 Radiopharmakons eingesetzt. Die Wahl des verwendeten Radionuklids richtet sich nach den physikalischen Emissionseigenschaften und der Halbwertszeit. l 99 mTc-Pertechnetat-Szintigrafie: Nach i. v. Gabe Anreicherung in den Thyreozyten, maximale Konzentration bereits nach 15 – 20 min, wird nicht in organische Jodverbindungen eingebaut. Nach 30 min erfolgt bereits wieder die Ausscheidung in der ursprünglichen Form. Die Aufnahme von 99mTc-Pertechnetat erfolgt nicht spezifisch in Schilddrüsenzellen, sondern in anderen Geweben (z. B. Speicheldrüsen). Das 99mTc-Pertechnetat ist für die Szintigrafie der Schilddrüse besonders deshalb gut geeignet, weil es eine reine γ‑Strahlung emittiert und die Halbwertszeit mit ca. 6 h eine höhere Radioaktivitätsmenge zulässt. Damit wird die Detaildarstellung im Szintigramm wesentlich verbessert. Die Strahlenexposition beträgt 3,4 mGy und ist um den Faktor 300 niedriger als bei der Anwendung von 131I. Indikationen: l Struma nodosa (kalte u. warme Knoten) l Verdacht auf Autonomie der Schilddrüse: diffus, unifokal, multifokal, disseminiert (Uptake-Messung), ggf. Supressionsszintigrafie (Aussage zur globalen bzw. regionalen Regulation der thyreoidalen Jodaufnahme); Zunahme der Autonomien bei älteren Patienten l Jodszintigrafie: Die physikalische Halbwertszeit von 123I wird mit 13 h angegeben. Das 123I hat für die Szintigrafie Erkrankungen ähnlich gute Eigenschaften wie das 99mTc-Pertechnetat (fehlender β‑Strahlenanteil). Vorteilhaft ist der größere thyreoidale Uptake mit einer besseren Abgrenzung der Schilddrüse. Der Nachteil von 123I ist die eingeschränkte Verfügbarkeit, weil es im Zyklotron hergestellt werden muss. Das 131I wird wegen seiner ungünstigen physikalischen Eigenschaften (Halbwertzeit 8,1 Tage, β‑Strahler, Energie 362 kV) nur noch bei der Nachsorgediagnostik des Schilddrüsenkarzinoms und zur Radiojodtherapie eingesetzt. Indikationen (123I): l Verdacht auf dystopes Schilddrüsengewebe l Differenzialdignose bei mediastinalen Raumforderungen Die 123I‑Szintigrafie sollte nicht bei der juvenilen, diffusen euthyreoten Struma eingesetzt werden. Kontraindiziert ist diese Methode in der Schwangerschaft und der Stillperiode. Punktionszytologie Die Punktionszytologie hat bei der Differenzialdiagnose von regressiven und malignen Veränderungen in der Schilddrüse einen hohen Stellenwert. Die Beurteilung des Punktats sollte durch einen erfahrenen Zytopathologen (Angabe von klinisch relevanten Befunden) erfolgen. Das Verfahren ist durch eine hohe Sensitivität und Spezifität ausgewiesen. Indikationen: l Schilddrüsenknoten ≥ 1 cm, klinisch suspekte Knoten, echoarme Knoten > 1 cm, kalte Knoten l Abklärung der befunddominanten Seite (Operationsplanung) l große Knoten bei sonst normalem Schilddrüsenparenchym l Knoten nach Bestrahlung der Halsregion (Malignomrisiko ↑) l Differenzialdiagnose Thyreoiditis – Malignom Bei einer ausgeprägten hämorrhagischen Diathese ist die Punktionszytologie kontraindiziert. Ergänzende Untersuchungen Bei großen Strumen sind häufig bereits Komplikationen durch die Beeinträchtigung der Nachbarorgane eingetreten. In diesem Fall können folgende diagnostische Maßnahmen weiterhelfen: l Tracheazielaufnahme (Trachealkompression, Verlagerung, Abb. 14.17) l Thoraxröntgenaufnahme (retrosternale, retrotracheale, mediastinale Ausbreitung der Struma, ggf. CT des Thorax) l endoskopische Untersuchung der Trachea (Tracheomalazie) l Lungenfunktionsprüfung (Beurteilung einer Ventilationsstörung bei Trachealeinengung) l Untersuchung des Ösophagus (Breischluck, Endoskopie, Differenzialdiagnose der Dysphagie) 703 ......... 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................ 14 Hals, Schilddrüse und Ösophagus Abb. 14.17 l l l Struma multinodosa III mit Trachealverlagerung und ‑kompression. Cave: jodhaltige Kontrastmittel, wenn die Gefahr einer jodinduzierten Hyperthyreose besteht ophthalmologische Untersuchungen bei endokriner Orbitopathie kardiale Untersuchungen l Funktionsstörungen der Schilddrüse Euthyreote Struma Diagnose. Bei einem Strumaverdacht mit Euthyreose sind bei der Erstuntersuchung folgende Untersuchungen erforderlich: l Klinische Untersuchung. l Schilddrüsensonografie: Beim Echoverhalten wird die Schilddrüse mit der angrenzenden Halsmuskulatur verglichen. Im Normalfall stellt sich die Schilddrüse deutlich heller dar; man nennt dies echodicht und im Vergleich zur normalen Schilddrüse echonormal. Als echoarm wird eine Struktur bezeichnet, wenn sie ähnlich wie die Halsmuskulatur und damit dunkler erscheint. Echonormale und echoreiche Knoten – auch im Bereich des Randsaums – und echofreie Anteile sind häufig nachweisbar und entsprechen meist gutartigen Veränderungen. Das Risiko eines bösartigen Tumors ist bei diesen Knoten sehr gering. Der echofreie Randsaum entspricht meist einer Zone vermehrter Durchblutung und findet sich häufiger bei gutartigen Knoten. Diese Zeichen schließen jedoch ein Schilddrüsenkarzinom nicht aus. Schilddrüsenkarzinome weisen meistens eine echoarme Binnenstruktur auf. Eine sichere Unterscheidung zwischen gut- und bösartigen Knoten ist mit der Sonografie nicht möglich. l Bestimmung des basalen Thyreotropins (TSH) zum Nachweis einer peripheren euthyreoten Stoffwechsellage (Ausschluss einer Schilddrüsenfunktionsstörung; Hyper-/Hypothyreose). Beurteilung: Liegen die basalen Messwerte im Referenzbereich (0,3 – 4,0 mU/l), so ist eine Schilddrüsenfunktionsstörung nahezu ausge704 l schlossen – ggf. Bestimmung der Schilddrüsenhormone fT3 und fT4, um seltene Funktionsstörungen zu erkennen. Schilddrüsenszintigrafie: Die Schilddrüsenszintigrafie kann zum Nachweis eines kalten Knotens (funktionelle Charakterisierung, Differenzierung der Hyperthyreose) eingesetzt werden. Sie ist bei allen tastbaren oder sonografisch nachweisbaren Knoten indiziert. Bei der Untersuchung wird Technetium (99 mTc04) intravenös appliziert und selektiv in die Schilddrüse transportiert – auch bei einem Karzinom –, und nach 10 – 20 min werden die radioaktiven Impulse mit einer Kamera aufgezeichnet (Quantifizierung: Aufnahme im Schilddrüsengewebe = Uptake). Radioakives Jod (123J) ist nur dann erforderlich, wenn eine stark vergrößerte Schilddrüse bis in das Mediastinum reicht. Punktionszytologie: Der Punktionszytologie gehen in der Regel die Sonografie und die Szintigrafie voraus. Der hypofunktionelle Schilddrüsenknoten stellt die häufigste Indikation zur Punktionszytologie dar. Wenn klinische und sonografische Kriterien für einen bösartigen Prozess fehlen, kann auf die Punktion verzichtet werden. Da sie ultraschallgestützt durchgeführt wird, sind Komplikationen extrem selten. Erfahrenen Zytopathologen können bösartige Tumoren in bis zu 90 % der Fälle nachweisen. Hyperthyreote Struma Pathogenese. Bei einer hyperthyreoten Funktionsstörung der Schilddrüse werden vom Körper vermehrt Schilddrüsenhormone produziert. Die erhöhte Konzentration von freien Schilddrüsenhormonen führt zu einer gesteigerte Wirkung auf die verschiedensten Stoffwechselprozesse. Diese Funktionsstörung ist nach der Jodmangelstruma im Erwachsenenalter mit etwa 5 % die zweithäufigste Schilddrüsenerkrankung. Neben dem klinischen Verdacht ist bei der paraklinischen Diagnostik zwischen einer latenten (Thyreotropin im Serum erniedrigt) und einer manifesten Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ Erkrankungen ......... 14 Autonomes Adenom der Schilddrüse. a Sonografie. b Suppressionsszintigrafie. Hyperthyreose (zusätzlich Schilddrüsenhormone T3, T4 im Serum erhöht) zu unterscheiden. Die funktionelle Autonomie (50 – 70 % der Fälle) und die Immunthyreopathie des Morbus Basedow (30 – 50 %) sind die häufigsten hyperthyreoten Funktionsstörungen. Untersuchungschema l Anamnese. l Körperliche Untersuchung. l Laborparameter: Wichtigster Parameter ist die basale Thyreotropinbestimmung. Eine erhöhte Konzentration von freien Schilddrüsenhormonen führt bei einem funktionstüchtigen Regelkreis zu einer Thyreotropinsuppression (Referenzbereich: 0,3 – 4 mU/l). Liegt der Thyreotropinwert in diesem Bereich, kann eine Hyperthyreose ausgeschlossen werden. Bei einem supprimierten Thyreotropinwert ist von einer subklinischen oder manifesten Hyperthyreose auszugehen. Die Bestimmung der Schilddrüsenhormone erhärtet den Verdacht auf eine Hyperthyreose unter Berücksichtigung des klinischen Bildes (Referenzwerte: freies Thyroxin [fT4] 0,8 – 2,0 ng/dl, Gesamtthyroxin [T4] 4,5 – 12 μg/dl, freies Trijodthyronin [fT3] 2,1 – 5,3 pg/ml, Gesamttrijodthyronin [T3] 0,8 – 2,0 ng/dl). Für den differenzialdiagnostischen Nachweis einer immunogenen Form der Hyperthyreose ist die Bestimmung der Schilddrüsenantikörper erforderlich. Allgemeine Laborwerte: Blutkörperchensenkungsgeschwindigkeit und CRP (stark erhöht bei Thyreoiditis de Quervain), Blutzucker, Leberwerte, alkalische Phosphatase, Blutbild (thyreostatische Therapie), Cholesterin. l Sonografie: l Morbus Basedow: diffuse Echoarmut und große Tiefenausdehnung – charakteristisch, aber nicht spezifisch (ähnlich bei Autoimmunthyreoiditis mit Hypothyreose). l Autonomie: häufig ein oder mehrere Schilddrüsenknoten – nicht bei disseminierter Autonomie (Abb. 14.18). l Szintigrafie/Suppressionsszintigrafie: Die Schilddrüsenszintigrafie ermöglicht in Korrelation zur Sonogra- l l l l l fie die Beurteilung der funktionellen Aktivität. Eine erhöhte Aufnahme des verabfolgten Radionuklids mit diffuser Anreicherung ist typisch für den Morbus Basedow und die disseminierte Autonomie. Bei der uniund multifokalen Autonomie dagegen stellen sich fokale Mehranreicherungen dar. Kalte Knoten speichern nur sehr vermindert oder gar nicht. Fachophthalmologische Untersuchung: Bei endokriner Orbitopathie. Orbitasonografie: Beurteilung der Augenmuskelverdickung; Differenzialdiagnose zu anderen Erkrankungen. Orbita-CT: Koronare Schnittführung. MRT: Abgrenzung zu anderen Erkrankungen (Tumoren, Myositis). Oktreotidszintigrafie: Beurteilung der entzündlichen Veränderungen. Therapie. Bei der Behandlung einer manifesten Hyperthyreose steht die medikamentöse thyreostatische Therapie mit Substanzen aus der Thionamidgruppe an erster Stelle. Bei leichteren Formen kann die alleinige Gabe von β‑Rezeptorenblockern oder eine hoch dosierte Jodidvorbehandlung (Plummerung) erfolgen. In seltenen Fällen von konservativ nicht beherrschbaren jodinduzierten Thyreotoxikosen oder bei schweren Nebenwirkungen einer thyreostatischen Therapie (Knochenmarksdepression) ist eine Operation unter hyperthyreoten Bedingungen indiziert. Vor der Einleitung einer thyreostatischen Therapie ist deshalb die Untersuchung des peripheren Blutbilds, der γ‑Glutamyltranspeptidase und der Glutamat-PyruvatTransaminase notwendig. Morbus Basedow Pathogenetisch ist der Morbus Basedow dadurch gekennzeichnet, dass der hypophysäre Rückkopplungsmechanismus zugunsten einer unkontrollierten Stimulation durch das genetisch determinierte autoaggressive Immunsystem gestört ist. Durch verschiedene endogene und exogene Faktoren wird der Immundefekt verstärkt, mit der Folge, dass die Selbstkontrolle gegen thyreoidale Antikörper nicht mehr funktioniert. Die Antikörper sind vorwiegend 705 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 14.18 14 Hals, Schilddrüse und Ösophagus ................................................................................. Spezielle HNO‑Erkrankungen und ihre Therapie Autonomie der Schilddrüse Im Gegensatz zum Morbus Basedow wird die Hyperthyreose bei einer Autonomie nicht durch eine exogene Überstimulation bedingt, sondern durch endogenes hyperaktives Schilddrüsengewebe hervorgerufen. Diese Vorgänge sind von der hypophysären Regulation abgekoppelt und funktionell autonom. Diese Störungen der normalen Schilddrüsenfunktion werden mit einer Mutation der Gensequenzen des Thyreotropinrezeptors und der G‑Proteine erklärt. Der Jodmangel scheint die somatische Mutation zu begünstigen. Folgende klinische Manifestationen werden bei der Autonomie unterschieden: l unifokale Autonomie (solitärer heißer Knoten; Abb. 14.19) l multifokale Autonomie (mehrere mehrspeichernde Knoten) l disseminierte Autonomie (diffuse Mehrspeicherung in der Schilddrüse) Jodinduzierte Hyperthyreose Die funktionelle Autonomie ist eine Folge des Jodmangels. Die Entstehung einer funktionell wirksamen Autonomie nimmt mit der Größe der Struma zu. Die Verabreichung von hohen Jodmengen kann zur Entstehung einer Hyperthyreose führen, da die Schutzmechanismen der gesunden Schilddrüse gegen eine Jodüberflutung nicht mehr wirksam sind (Wolff-Chaikoff-Effekt, Blockade des Jodid- Abb. 14.19 Autonomes Adenom mit Hyperthyreose. Szintigramm. 706 transports) – ebenso der Plummer-Effekt (Hemmung der Hormonfreisetzung). Erhöhte Jodmengen sind u. a. enthalten in: l jodhaltigen Röntgenkontrastmitteln l Desinfizienzien (Betaisodona) l Dermatika l Lugol-Lösung Thyreotoxische Krise Die thyreotoxische Krise als akuter, lebensbedrohlicher Zustand wird häufig durch einen Jodexzess, durch Operationen, fieberhafte Infekte, schwere Allgemeinerkrankungen oder lange bestehende unerkannte Erkrankungen ausgelöst. Als Grunderkrankung überwiegt die Autonomie der Schilddrüse. Die Diagnose wird zunächst durch das klinische Bild gestellt und nicht durch die Höhe des Schilddrüsenhormonspiegels. Die klinischen Leitsymptome sind: l Übelkeit l Erbrechen l akute abdominelle Beschwerden l Tachykardie l Beeinträchtigung der Bewusstseinslage l Hyperthermie l Herzrhythmusstörungen l Zeichen einer kardialen Dekompensation l Hypertonie l psychotische Symptome l Krämpfe l Koma Endokrine Orbitopathie Die endokrine Orbitopathie wird als extrathyreoidale Lokalisation des Morbus Basedow (bei 60 % der Patienten) aufgefasst. Pathohistologisch stellt sich eine lymphozytäre Infiltration des Retrobulbärraums mit Beteiligung des Bindegewebes und der Augenmuskeln dar. Ursächlich führt eine autoaggressive Immunreaktion in der Orbita bei genetischer Disposition zu dieser Erkrankung. Klinische Symptome: l Exophthalmus eines oder beider Augen l retrobulbäre Druckempfindung l Epiphora l Lichtempfindlichkeit l lymphozytäre Infiltration des Retrobulbärraums bis zum malignen Exophthalmus mit Konjunktivitis l Keratitis l Doppelbilder bis zum Visusverlust (Kompression der N. opticus) Stadieneinteilung der endokrinen Orbitopathie: l Klasse 0: keine Symptome l Klasse I: seltener Lidschlag l Klasse II: Lidschwellung, Chemosis, Konjunktivitis l Klasse III: Exophthalmus l Klasse IV: Augenmuskelveränderungen l Klasse V: Hornhautläsion l Klasse VI: Beteiligung des N. opticus Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. gegen den Thyreotropinrezeptor, die Schilddrüsenperoxidase und das Thyreoglobulin gerichtet. Durch die Aktivierung intrazellulärer Signalwege infolge Rezeptorbindung kommt es beim Morbus Basedow häufig zum Strumawachstum. ................................................................ Erkrankungen ......... Abb. 14.20 Struma parenchymatosa (mit freundlicher Genehmigung von Herrn Priv.-Doz. Dr. Buchmann, Halle). a Ohne regressive Veränderungen. Hypothyreote Struma Die hypothyreote Stoffwechsellage ist durch eine verminderte Wirkung der Schilddrüsenhormone an den Zielorganen gekennzeichnet. Je nach Ausmaß des hormonellen Defizits wird das Krankheitsbild als latente (subklinische) oder als manifeste Hypothyreose bezeichnet. Mit einer Prävalenz von 6 – 10 % bei der latenten und 1 – 3% bei der manifesten Hypothyreose zählen diese Funktionsstörungen zu den häufigen Schilddrüsenerkrankungen. Frauen sind etwa 4-mal häufiger betroffen als Männer. Hypothyreosen entstehen durch eine nicht bedarfsadaptierte Synthese und Sekretion von Schilddrüsenhormonen. Der Beginn der Erkrankung ist meist schleichend und entwickelt sich über Jahre. Mit zunehmendem Alter treten diese Erkrankungen häufiger auf. Ursachen l primäre Hypothyreose bei einem Defekt in der Schilddrüse: Autoimmunthyreoiditis, Schilddrüsenentzündungen, Medikamente, Radiojodtherapie, Operationen l sekundäre Hypothyreose (verminderte oder ausgefallene Thyreotropinstimulation): bei Hypophysenvorderlappeninsuffizienz, Hypophysentumoren, Hypophysitis l tertiäre Hypothyreose (ausgefallene Thyreotropin-releasing-Hormonstimulation): Erkrankungen des Hypothalamus l Resistenzsyndrome: Thyreotropinrezeptorresistenz, generalisierte und periphere Schilddrüsenhormonresistenz Symptome l Herabsetzung zahlreicher Stoffwechselprozesse l Einschränkung vieler Körperfunktionen: Antriebslosigkeit, Müdigkeit, allgemeine Leistungsminderung, Kälteintoleranz, Hypothermie, Haarausfall, Gewichtszunahme, Appetitlosigkeit, Obstipation, depressive Stimmungen, sexuelle Störungen (Periode, Libido, Potenz) b Mit regressiven Veränderungen/Kalk. l l l l l Lidödeme bei aufgedunsenem Gesicht blasse, trockene Haut Sprache heiser, verlangsamt kardiale Symptome bis zur Herzinsuffizienz Störung des Lipidstoffwechsel (LDL‑Cholesterinanstieg, HDL‑Cholesterinabfall) Therapie von euthyreoter Struma, Hyper- und Hypothyreose Euthyreote Struma Die Therapie der euthyreoten Struma richtet sich nach der Ätiologie, den morphologischen Veränderungen (Größe, Konsistenz, Knoten, mechanische Komplikationen), der Schilddrüsenstoffwechsellage, dem Alter des Patienten sowie den Begleiterkrankungen (Abb. 14.20). Je nach Befund stehen verschiedene Behandlungsmöglichkeiten zur Verfügung: l medikamentöse Therapie: Jodidtherapie, Schilddrüsenhormone, Verabreichung von Kombinationspräparaten aus Jodid und Schilddrüsenhormonen l chirurgische Therapie l Radiojodtherapie: in ausgewählte Situationen, z. B. Versagen der medikamentösen Therapie, Kontraindikation gegen eine Operation, Multimorbidität Der Strumaprophylaxe bzw. der frühzeitigen Behandlung kommt eine besondere Bedeutung zu. Da die Rückbildungsfähigkeit einer vergrößerten Schilddrüse begrenzt ist, muss das Therapieziel auf die Verhinderung von Folgeerkrankungen des Jodmangels ausgerichtet sein. Um einen dauerhaften Behandlungserfolg zu erreichen, ist eine Rezidivprophylaxe unbedingt notwendig. Hyperthyreose Die Therapie der Hyperthyreose setzt den laborchemischen Beleg voraus – auch von den Hyperthyreosenformen, die keiner spezifischen Behandlung bedürfen (Hyperthyreosis factitia, Postpartumthyreoiditis, Schwangerschaftshyperthyreose, Thyreoiditis de Quervain). 707 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus Für die spezifische Therapie der Hyperthyreose stehen mehrere Möglichkeiten zur Verfügung: Das Ziel der medikamentösen Behandlung ist die Unterdrückung der Hyperthyreose (Operationsvorbereitung, Euthyreose, zur Remission bei Morbus Basedow, Langzeitbehandlung, wenn definitive Therapie nicht möglich ist). Indikation sind Morbus Basedow, Autonomie der Schilddrüse, jodinduzierte Hyperthyreose und Hyperthyreose in der Schwangerschaft. Kontraindiziert ist diese Therapie bei frühzeitig auftretenden Nebenwirkungen: l selten: Agranulozytose, Thrombozytopenie, Hypoglykämie l häufiger: Kopfschmerzen, Leukopenie, allergische Reaktionen, Leberenzymerhöhung drüsengewebe von 3 – 5 ml ausgeführt werden, auch unter Inkaufnahme einer postoperativen substitutionspflichtigen Hypothyreose. Im Rahmen einer funktionellen Strumachirurgie bei Autonomie müssen alle erkrankten Gewebeanteile entfernt werden, bei weitgehender Erhaltung der gesunden Areale. Komplikationen l Mortalität: ca. 0,1 % l Nachblutungen: 1 – 5% l Rekurrensparesen beim Ersteingriff: 1 – 3% l Zweiteingriff: bis 10% l Hypoparathyreoidismus: 1 – 3% Hypothyreose Die Radiojodtherapie wird in Abhängigkeit von der Ätiologie angewendet, und zwar primär bei der Autonomie der Schilddrüse und beim Morbus Basedow, wenn die thyreostatische Therapie versagt hat. Voraussetzung für eine operative Intervention ist eine euthyreote Stoffwechsellage (seltene Ausnahme: Notfallthyreoidektomie bei thyreotoxischer Krise). Indikationen hierfür sind: l Primärtherapie des Morbus Basedow l thyreotoxische Krise l jodinduzierte, thyreostatisch nicht behandelbare Hyperthyreose l große Struma > 60 ml l Malignomverdacht l Sekundärtherapie beim Morbus Basedow l Rezidivhyperthyreose l bei Kontraindikation für Radiojodtherapie l Primärtherapie bei Schilddrüsenautonomie, Struma > 60 ml l Vorhandensein von zusätzlichen größeren kalten Knoten Operationsziele sind die Beseitigung der Hyperthyreose und die Vermeidung eines Hyperthyreoserezidivs. Die Strumektomie sollte bis auf ein Restvolumen an Schild- Abb. 14.21 a Übersicht. 708 Die Therapie der Hypothyreose erfolgt durch die Substitution mit Levothyroxin zum Ausgleich des Hormonmangels und zur Wiederherstellung einer euthyreoten Stoffwechsellage. Die Therapie ist gut verträglich und von hoher Wirksamkeit. Die Dosierung erfolgt individuell und wird am Serumthyreotropinspiegel ausgerichtet, mit dem Ziel der Senkung des Thyreotropinspiegels in den Normalbereich. Schilddrüsentumoren Einteilung und Prognose In Deutschland erkranken jährlich etwa 4000 Personen an einem Malignom der Schilddrüse. An allen krebsbedingten Todesfällen sind die Schilddrüsenkarzinome mit 0,2 – 0,3 % beteiligt. Die Inzidenz beträgt für Frauen 6,3 und ist doppelt so hoch wie bei Männern, bei insgesamt weltweit steigenden Erkrankungszahlen. Ätiologisch führen mutagene und initiierende Faktoren in Verbindung mit einer erhöhten Thyreotropinwirkung zur malignen Entartung. Strahlenbelastungen (z. B. Tschernobyl, externe Bestrahlung der Halsregion) sind gesicherte Risikofaktoren für die Papilläres Mikrokarzinom (mit freundlicher Genehmigung von Herrn Priv.-Doz. Dr. Buchmann, Halle). b Tumorkapsel. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ................................................................ Einteilung Tumoren Schilddrüsenkarzinom l papilläres Karzinom l follikuläres Karzinom l l l Einteilung und Prognose der Schilddrüsenkarzi- Einteilung Prognose 10-JahresÜberlebensrate in % gering differenziertes Karzinom differenziertes Karzinom (DTC): sehr gut ca. 93 undifferenziertes (anaplastisches) Karzinom l papilläres Karzinom (PTC) l Mikrokarzinom l Mikrokarzinom mit lymphogener Metastasierung l großzellige (Tall-Cell-) Variante Plattenepithelkarzinom l Mukodermoidkarzinom l sklerosierendes Mukodermoidkarzinom mit Eosinophilie l muzinöses Karzinom l medulläres Karzinom (C‑Zellkarzinom) l gemischtes medulläres und Follikelzellkarzinom l Spindelzelltumor mit thymusähnlicher Differenzierung l Tabelle 14.9 nome. Karzinom mit thymusähnlicher Differenzierung Schilddrüsenadenome und verwandte Tumoren l follikuläres Adenom l hyalinisierender trabekulärer Tumor andere Schilddrüsentumoren l Teratom l primäres Lymphom und Plasmozytom l ektopisches Thymom l Angiosarkom l Tumoren der glatten Muskulatur l periphere Nervenscheidentumoren l Paragangliom l solitärer fibröser Tumor l Tumor der follikulären dentrischen Zellen l Langerhans-Zellhistiozytose l Metastasen Entstehung eines Schilddrüsenkarzinoms mit einer Latenzzeit von 5 – 30 Jahren. Dagegen stellt die therapeutische Radiojodtherapie kein erhöhtes Krebsrisiko dar. Die histologische Klassifikation der Schilddrüsentumoren nach WHO (Pfannenstiel et al. 1997) zeigt die Tab. 14.8. Am häufigsten gehen die Schildrüsenkarzinome von den Follikelzellen (95 – 97 %) oder den parafollikulären kalzitoninproduzierenden C‑Zellen (3 – 5 %) aus. In der WHO‑Klassifikation werden die Schilddrüsenkarzinome mit Follikelzellursprung unter Berücksichtigung von prognostischen Aspekten in 3 Gruppen unterteilt (Tab. 14.9). Das papilläre Schilddrüsenkarzinom metastasiert vorwiegend lymphogen in die zervikomediastinalen Lymphknoten, wobei die Inzidenz der Lymphknotenmetastasen ab einer Primärtumorgröße > 2 cm signifikant ansteigt (Abb. 14.21). Bei lokal destruierendem Wachstum kann der Tumor in die Trachea einwachsen (Abb. 13.31, S. 647). ......... 14 schlechter 80 – 90 follikuläres Karzinom (FTC): l minimalinvasives FTC (gekapseltes follikuläres Karzinom) l grobinvasives FTC l onkozytäres FTC 85 50 schlechter 75 C‑Zellkarzinom (MTC) gut 25 – 35 gering differenzierte Karzinome (PDTC) deutlich schlechter Überleben meist < 12 Monate undifferenzierte (anaplastische) Karzinome extrem schlecht Lymphknotenmetastasen treten beim follikulären Karzinom durch hämatogene Metastasierung in 10 – 20 % der Fälle auf. Im Allgemeinen ist die Prognose des Schilddrüsenkarzinoms als gut zu bezeichnen. Die C‑Zellkarzinome (medulläre Schilddrüsenkarzinome) können sporadisch (75 %) oder familiär gehäuft (25%) auftreten. Klinische Symptome und diagnostisches Vorgehen Schilddrüsenkarzinome weisen in der Regel keine spezifischen Frühsymptome auf. Malignomverdächtige Befunde sind: l rasches Knotenwachstum (bestehende oder neue Knoten) l einzelner Knoten in einer diffusen Struma l Kinder und Jugendliche (< 14 Jahre), ältere Personen (> 60 Jahre) l Geschlecht: männlich l auffällige zervikale Lymphknoten l nicht schluckverschieblicher Tastbefund l Rekurrensparese Bei kleinen Schilddrüsenkarzinomen gibt es außer bei dem medullären Schilddrüsenkarzinom (erhöhte Kalzitoninkonzentration) keine geeigneten Verfahren zur Frühdiagnose. Bei einer multinodösen Struma besteht außerdem die Schwierigkeit der Differenzierung verdächtiger Befunde. Spezielle Verfahren zur Diagnostik des Schilddrüsenkarzinoms sind: 709 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 14.8 Histologische Klassifikation der Schilddrüsentumoren (nach: Pfannenstiel et al. 1997). Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. l l l l l Sonografie: Echoarmut, unscharfe Begrenzung Szintigrafie: kalter Knoten Feinnadelpunktion Labor: Kalzitonin erhöht, Pentagastrintest Nachweis einer Mutation im RET‑Protoonkogen 14.1.3 Ösophagus V. Bonkowsky und J. Schüssler Angeborene Veränderungen Cernea CR, Ferraz AR, Nishio S et al. Surgical anatomy of the external branch of the superior laryngeal nerve. Head Neck 1992; 14: 380 – 383 Hotze L‑A, Schumm-Draeger P‑M. Schilddrüsenkrankheiten: Diagnose und Therapie. Berlin: Berliner Medizinische Verlagsanstalt GmbH; 2003 Lang J, Nachbaur S, Fischer K. N. laryngei, Verzweigungen im Kehlkopfinneren. Gegenbaurs Morphol Jahrb 1986; 132: 723 – 736 Mann K. Praxisbezogene Schilddrüsendiagnostik: Klinische Befunde. Med Welt 2001; 52: 18 – 23 Moller AR. Monitoring other cranial Motor Nerves. In: Moller AR. Intraoperative neurophysiologic monitoring. Australia Austria, China et al.: Harwood academic publishers; 1995: 190 Neumann H – J. Intraoperatives neurophysiologisches Monitoring (IONM) des Nervus recurrens und Mikrodissektion. Laryngo Rhino Otol 2000; 79: 290 – 296 Pfannenstiel P, Hotze L‑A, Saller B. Schilddrüsenkrankheiten: Diagnose und Therapie. Berlin: Berliner Medizinische Verlagsanstalt GmbH; 1997 Randolph GW. Surgery of the Thyroid and Parathyroid Glands. Philadelphia: Saunders; 2003 Röher HD, Allenberg JR. Chirurgische Operationslehre. Bd. 1: Chirurgie Kopf und Hals. München: Urban & Schwarzenberg; 1990 Stelzner F. Die chirurgische Anatomie der Grenzlamellen der Schilddrüse und die Nervi laryngei. Langenbecks Arch Chir 1988; 373: 355 – 366 Timmermann W, Hamelmann WH, Meyer T et al. Identification and surgical anatomy of the external branch of the superior laryngeal nerve. Zentralbl Chir 2002; 127/5: 425 – 428 Timmermann W, Hamelmann WH, Thomusch O et al. Zuverlässigkeit und Konsequenzen des intraoperativen Neuromonitorings in der Schilddrüsenchirurgie. Stellungnahme der „Interdisziplinären Studiengruppe ‚Intraoperatives Neuromonitoring Schilddrüsenchirurgie‘“. Chirurg 2004; 75/9: 916 – 922 Typ A 710 Typ B Typ C Typ D Ösophagusatresie und tracheoösophageale Fisteln Die Ösophagusatresie ist die häufigste kongenitale Ösophagusanomalie (1 : 3000 bis 1 : 5000). Sie ist in der Mehrzahl der Fälle mit einer ösophagotrachealen Fistel kombiniert. Die häufigsten Atresietypen sind in Abb. 14.22 zusammengefasst. In 85 % der Fälle findet sich ein proximaler Blindsack mit einer distalen ösophagotrachealen Fistel (Typ C), in 8% liegt ein Blindsack ohne Fistel vor (Typ A), in 4 % der Typ E. Häufig bestehen zusätzliche Fehlbildungen wie Duodenal- und Analatresie. Ätiologie und Pathogenese. Differenzierungsstörungen in der 4. – 6. Gestationswoche führen zu einer inkompletten Teilung des embryonalen Vorderdarms in die Trachea und den Ösophagus. Als auslösende Ursachen werden exogene Faktoren diskutiert. Symptome. Während oder kurz nach der Geburt kommt es zu schaumigem Speichelfluss aus Nase und Mund. Die Nahrung wird regurgitiert, es treten Hustenanfälle und Zyanose auf. Beim Schreien des Säuglings tritt Luft durch die tracheoösophageale Fistel und führt zu einer Überblähung des Magens. Durch Aspiration via Fistel kommt es zu Pneumonie und Atelektase. Ein Polyhydramnion der Mutter kann bereits ein Hinweis auf eine Ösophagusatresie sein, da der Fötus das Fruchtwasser nicht schlucken kann. Diagnose. Bei jedem auffälligen Neugeborenen ist die Sondierung der Speiseröhre obligat. Typischerweise stößt man nach 10 – 12 cm auf einen Widerstand. Eine Röntgenübersichtsaufnahme von Thorax und Abdomen im Hängen (luftgefüllter Blindsack, ggf. mit Spiegelbildung) ermöglicht eine Klassifikation der Ösophagusatresie. Zur raTyp E Abb. 14.22 Schema der häufigsten Formen einer angeborenen Ösophagusatresie mit einer ösophagotrachealen Fistel. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Literatur ................................................................ Tabelle 14.10 primäre Ursachen Therapie. Zur Vermeidung von pulmonalen Komplikationen muss der ösophageale Atresiesack regelmäßig abgesaugt werden; die Lagerung des Kindes ist dabei in halbsitzender Position. Die Ernährung erfolgt parenteral. Die operative Therapie sollte baldmöglichst durchgeführt werden; die Methode der Wahl ist die End-zu-End-Anastomose des Ösophagus mit Verschluss einer ösophagotrachealen Fistel. sekundäre Ursachen Risiken und Komplikationen. An erster Stelle stehen postoperative Stenosen im Anastomosenbereich, die durch Bougieren meist zu beseitigen sind. Weiterhin sind Anastomoseninsuffizienzen möglich. l Duplikaturen Komplette oder inkomplette Duplikaturen des Gastrointestinaltrakts sind selten; sie bevorzugen das Ileum. Am zweithäufigsten treten Duplikaturen im Ösophagus auf, bevorzugt im unteren Drittel (60 % der Fälle). Rein deskriptiv lassen sich tubuläre und zystische Duplikaturen differenzieren. Symptome. Durch Kompression des Ösophagus kommt es zu Dysphagien und Regurgitation sowie durch Kompression der Trachea zu Dyspnoe mit Stridor. Diagnose und Therapie. Der Ösophagusbreischluck mit Barium ist weiterführend. Die chirurgische Resektion ist bei einer klinischen Symptomatik indiziert. l l Funktionelle Erkrankungen des Ösophagus. l Achalasie l diffuser Ösophagusspasmus/Nussknackerspasmus l nicht spezifische Störungen des unteren Ösophagussphinkters l verminderte Amplitude der ösophagealen Peristaltik l Bindegewebserkrankungen (Sklerodermie) l Diabetes mellitus l Alkoholismus l Störung des ZNS l Presby-Ösophagus l Chagas-Krankheit 14 Dysphagie retrosternales Brennen oder Schmerz Probleme beim Nahrungstransport oder bei der Regurgitation Eine Dysphagie, die auf Motilitätsstörungen des Ösophagus beruht, ist eher intermittierend, schreitet, wenn überhaupt, sehr langsam voran und tritt bei flüssiger und fester Nahrung auf. Für obstruktive Ösophaguserkrankungen dagegen ist eine konstante und zunehmende Dysphagie typisch, die zuerst bei festen Speisen und erst bei fortschreitender Erkrankung auch flüssige Nahrung betrifft. Zunächst werden die funktionellen Störungen der Ösophagusmotilität dargelegt; diese können in primäre und sekundäre Funktionsstörungen eingeteilt werden (Tab. 14.10). Primäre Motilitätsstörungen Dysphagia lusoria Die häufigste zugrunde liegende Gefäßanomalie ist eine linksseitig entspringende A. subclavia dextra, die in 80 % der Fälle dorsal des Ösophagus, in 15 % zwischen Trachea und Ösophagus und in 5% ventral der Trachea verläuft. Selten findet sich ein gedoppelter Aortenbogen. Eine klinisch relevante Dysphagie entsteht selten; sie wird allenfalls im mittleren und höheren Alter auffällig. Diagnose und Therapie. Im Ösophagusbreischluck zeigt sich eine Impression der Speiseröhre von außen. Ein MRT stellt die Gefäßanomalie dar. Eine operative Therapie ist nur bei entsprechend ausgeprägter Dysphagie indiziert. Funktionelle Störungen Im Prinzip treten bei allen Ösophaguserkrankungen (funktionelle Störungen, entzündliche oder tumoröse Erkrankungen) ähnliche Leitsymptome auf: ......... Achalasie Ätiologie und Pathogenese. Die Achalasie ist durch eine inkomplette Relaxation des unteren Ösophagussphinkters mit fehlender ösophagealer Peristaltik charakterisiert; dies führt zu einer Stase und einer Dilatation des Ösophagus. Die Achalasie stellt eine neuromuskuläre Erkrankung der glatten Ösophagusmuskulatur mit degenerativen Veränderungen der Neurone im Bereich des dorsalen Vaguskerns, des vagalen Trunkus und des Auerbach-Plexus (Plexus myentericus) dar. Dies führt zu der fehlenden Peristaltik im tubulären Ösophagus sowie zu einem Nichtauslösen der schluckreflektorischen Erschlaffung des unteren Ösophagussphinkters. Die Ursache dieser Neuronendegeneration ist unbekannt. Diskutiert werden infektiöse, toxische, ischämische oder genetische Ursachen. Die Erkrankung manifestiert sich im mittleren Lebensalter (3. – 5. Lebensjahrzehnt). Symptome. Leitsymptome sind Dysphagie, Regurgitation und krampfartige Schmerzen. Die Patienten deuten oft auf das Xiphoid als Ort der stärksten Dysphagie. 711 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. diologischen Bestätigung sollten wegen der Gefahr der Aspiration nur geringe Mengen eines wasserlöslichen, isotonischen Kontrastmittels verwendet werden (z. B. Iotrolan). Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. Diagnose. Der Ösophagusbreischluck zeigt ein typisches Bild mit einer spitz zulaufenden Stenose im distalen Ösophagus mit prästenotisch weitgestelltem, atonischem Ösophagus (Abb. 14.23). Die Ösophagoskopie mit Biopsie ist zum Ausschluss eines Karzinoms obligat (Häufigkeit eines sekundären Karzinoms bei lang bestehender Achalasie: 5 – 10%). Durch die Speiseretention finden sich Zeichen einer Retentionsösophagitis im tubulären Ösophagus. Die Ösophagusmanometrie zeigt am unteren Ösophagussphinkter einen deutlich erhöhten Ruhedruck (35 mmHg höher als der Druck im Magen) und ein Ausbleiben der Relaxation beim Schluckvorgang. Weiterhin zeigt sie, entsprechend den 3 Erscheinungsformen der Achalasie (amotil, motil oder hypermotil), eine fehlende, schwache oder überschießende Kontraktion bei fehlender Peristaltik. Als weiterer charakteristischer Befund findet sich eine gesteigerte Empfindlichkeit des Ösophagus und des unteren Sphinkters auf cholinerge Stimuli (Mecholyltest). Therapie. Kalziumantagonisten (Nifedipin) und Nitrate sind in der Lage, den Tonus des unteren Ösophagussphinkters zu senken. Langzeitresultate sind allerdings enttäuschend. Die Methode der Wahl bei symptomatischen Patienten im Stadium 1 und 2 ist die endoskopische BallonDilatation des unteren Sphinkters. Bei nicht eintretendem Erfolg (max. 3 Dilatationen) oder symptomatischen Patienten im Stadium 3 ist die extramuköse Kardiomyotomie nach Gottstein-Heller die Therapie der Wahl. 712 Abb. 14.24 Tertiäre Ösophagusmotilitätsstörung (Nussknackerösophagus). Eine Alternative zur pneumatischen Dilatation ist die direkte endoskopische intraspinktere Botulinustoxininjektion. Die Wirkung einer einzelnen Behandlung hält jedoch lediglich ca. 6 Monate an. Da Patienten mit Achalasie ein erhötes Risiko für ein Ösophaguskarzinom haben (5 – 10%), sind engmaschige Kontrollendoskopien notwendig! Diffuser Ösophagusspasmus Tertiäre, abnormal starke, simultane Kontraktionen des tubulären Ösophagus bei normaler Funktion des unteren Ösophagussphinkters werden als idiopathischer diffuser Ösophagusspasmus bezeichnet. Eine regelrechte propulsive Peristaltik fehlt. Die Ätiologie ist unbekannt, degenerative Veränderungen der vagalen Innervation werden diskutiert. Symptome und Diagnose. Dysphagie und retrosternale Schmerzen stehen im Vordergrund, teilweise mit Ausstrahlung der Schmerzen in Arme und Rücken. Der Ösophagusbreischluck zeigt tertiäre Kontraktionen des Ösophagus mit Pseudodivertikelbildung (Korkenzieherösophagus). Die flexible Endoskopie lässt direkt die pathologisch gesteigerten Kontraktionen erkennen. Die Mehrpunktmanometrie objektiviert diesen Befund. Differenzialdiagnose. Bei der Funktionsstörung des hyperkontraktilen Ösophagus (Nussknackerösophagus, Abb. 14.24) finden sich normal fortgeleitete Kontraktionen mit Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Abb. 14.23 Ösophagusbreischluck bei Achalasie. ................................................................ Erkrankungen ......... Abb. 14.25 Dysphagie bei Morbus Forrestier. überhöhten Amplituden (über 120 mmHg). Bei der hypermotilen Form der Achalasie weist der untere Ösophagussphinkter einen erhöhten Tonus auf. Therapie. Ein Behandlungsversuch mit Kalziumantagonisten und Nitraten steht am Anfang einer Therapie. Bei Schmerzanfällen wird N‑Butylscopolamin eingesetzt. Krikopharyngeale Achalasie An der pharyngealen Hinterwand in einem muskelschwachen Dreieck zwischen Pars obliqua und Pars fundiformis des M. cricopharyngeus kann es zur Ausbildung eines Hypopharynxdivertikels (Zenker-Divertikel) kommen (s. S. 714 f und Kap. 11.1.2 „Erkrankungen des Meso- und Hypopharynx“). Sekundäre Motilitätsstörungen Motilitätsstörungen können auch im Rahmen verschiedener Grunderkrankungen, wie z. B. Bindegewebserkrankungen (Sklerodermie, systemischer Lupus erythematodes, Dermatomyositis), gefunden werden. Diabetes mellitus und Alkoholabusus führen zu einer peripheren und enteralen Neuropathie mit verminderter ösophagealer Peristaltik. In diese Gruppe gehört auch die Dysphagie durch Nachbarschaftsprozesse: So führen eine Skoliose und Halswirbelsäulenhyperostosen (Morbus Forrestier) zu einer Dysphagie (Abb. 14.25). Weiterhin sind ein Aortenaneurysma, mediastinale und Schilddrüsentumoren zu berücksichtigen. Ösophagusdivertikel Bei Divertikeln handelt es sich definitionsgemäß um pathologische Ausstülpungen eines Hohlorgans. Man unterscheidet: l echte Divertikel: Ausstülpungen aller Wandschichten l falsche Divertikel (= Pseudodivertikel): Ausstülpung der Tunica mucosae und der Submukosa Ösophagusdivertikel sind am häufigsten unmittelbar oberhalb des oberen Ösophagusspinkters lokalisiert (Zenker-Divertikel), seltener im mittleren (tubulären) Ösophagusdrittel und vor dem unteren Ösophagusspinkter (epiphrenische Divertikel; Abb. 14.26 a). Betroffen sind hauptsächlich Patienten im mittleren bis höheren Lebensalter (Geschlechterverhältnis Männer : Frauen = 3 : 1). Ätiopathogenese. Das zervikale (= Zenker-, Hypopharynxdivertikel) sowie das epiphrenische Divertikel gehören zu den sog. Pulsionsdivertikeln. Hierbei führt ein erhöhter intraluminaler Druck, aufgrund einer Funktionsstörung des oberen oder unteren Ösophagusspinkters, zur Ausstülpung von Schleimhaut durch eine Muskellücke oder ein muskelschwaches Areal. Dieses liegt beim Zenker-Divertikel typischerweise zwischen der Pars obliqua und der Pars fundiformis der Pars cricopharyngea des M. constrictor pharyngis inferior (= Kilian-Dreieck). Hierbei entsteht zwischen dem Lumen des Ösophagus und dem Divertikel ein Septum (Schwelle), das die Nahrungspassage behindert. Klassischerweise entwickelt sich das Zenker-Divertikel nach links lateral, wohingegen sich das 713 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus ................................................................................. Raphe Hypopharynxdivertikel (Zenker-Divertikel) (ca. 70 %) M. constrictor pharyngis inferior Zenker-Divertikel krikopharyngealer Muskel Traktionsdivertikel in Höhe der Trachealbifurkation (ca. 21,5 %) Laimer-Dreieck parabronchiales Divertikel Krikoidknorpel Trachea Längsmuskel des Ösophagus epiphrenisches Divertikel (ca. 8,5 %) epiphrenisches Divertikel a b Abb. 14.26 Ösophagusdivertikel. a Am häufigsten tritt ein Hypopharynxdivertikel (Zenker-Divertikel) auf, gefolgt von einem tubulären Divertikel in Höhe der Trachealbifurkation und einem epiphrenischen Divertikel. b Killian- und Laimer-Dreieck epiphrenische Divertikel nach rechts lateral ausbildet. Der Vollständigkeit halber sei auf das 2. muskelschwache Areal, das Laimer-Dreieck hingewiesen, welches unterhalb der Pars fundiformis der Pars cricopharyngea des M. constrictor pharyngis inferior lokalisiert ist. Dieses ist jedoch praktisch niemals Durchtrittsstelle zervikaler Divertikel (Abb. 14.26 b). Da eine physiologische Muskellücke im distalen Ösophagusabschnitt fehlt, sind die epiphrenischen Divertikel sehr selten. Die vor allem im mittleren Drittel in Höhe der Karina gelegenen tubulären Divertikel (früher Traktions-/parabronchiale Divertikel) wurden früher als Folge einer Tuberkulose angesehen. Heute wird der größte Teil als angeborene Fehlbildung mit unvollständiger Trennung zwischen Ösophagus und Trachea interpretiert (RibbertTheorie). Diagnose. Die Diagnostik erfolgt bei entsprechenden Symptomen durch Röntgenaufnahmen mit Kontrastmittel (Ösophagusbreischluck) und die Endoskopie. Ein Ösophaguskarzinom ist hierbei auszuschließen (sehr selten, 0,5 %). Cave: Die Endoskopie beim Zenker-Divertikel ist gefährlich, weil der Divertikelsack keine muskuläre Komponente hat und so leicht perforiert werden kann. Beim Versuch des Einführens des Ösophagoskops in den Ösophagus kann das Endoskop an der Divertikelschwelle nach dorsal abrutschen, in das Divertikel gleiten und dieses dann aufgrund der Wandschwäche leicht perforieren (Abb. 14.27). Zenker-Divertikel Dabei handelt es sich, wie oben bereits erklärt, eigentlich um ein Hypopharynxdivertikel (s. Abb. 14.26 a). Symptome l Dysphagie/Odynophagie l Regurgitation unverdauter Nahrung l Aspiration (rezidivierende Pneumonien) l Globus-/Fremdkörpergefühl l Foetor ex ore 714 Therapie. Bei Hypopharynxdivertikeln (Zenker-Divertikeln), die zu Schluckstörungen führen, stehen verschiedene Operationsmethoden zur Verfügung: 1. konventionelle Abtragung von außen (linkszervikaler Schnitt) mit zervikaler Myotomie (Rezidivprophylaxe) in Intubationsnarkose 2. endoskopische (starr) Schwellendurchtrennung mithilfe des CO2-Lasers oder diathermischer Scheren in Intubationsnarkose 3. endoskopische (starr) Staplerresektion des Divertikels in Intubationsnarkose (z. B. Endo-GIA‑30-Stapler); Vorteil: Reduktion des Perforations- und Blutungsrisikos durch Wundverschluss mittels Klammernaht 4. endoskopische (flexibel) Schwellendurchtrennung mittels Nadelmesser oder APC‑Sonde in Analgosedierung Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Killian-Dreieck ................................................................ Erkrankungen ......... Abb. 14.27 Zenker-Divertikel. Darstellung der Divertikelschwelle. a Endoskopie. b Ösophagusbreischluck. Die im Rahmen der 2., 3. und 4. Operationsmethode bewirkte Umwandlung des Divertikelsacks in eine Ausbuchtung des Ösophagus ist hinsichtlich der Besserung der Dysphagiesymptome der konventionellen Divertikelabtragung gleichwertig. Das eigentliche Divertikellumen bleibt allerdings bei diesen Verfahren radiologisch weiterhin nachweisbar. Für die Schluckfunktion ist dies jedoch bedeutungslos: Durch das (nach Durchtrennung der Schwelle) nach ventral kollabierende Divertikel kann die Nahrung nun ungehindert in den Ösophagus rutschen. Tubuläre Divertikel sind in der Regel klinisch ohne Bedeutung und bedürfen selten einer chirurgischen Therapie. Bezüglich der Therapie epiphrenischer Divertikel sei auf die Lehrbücher der Chirurgie verwiesen. Hiatushernien Die Verlagerung der Kardia und des oberen Magenabschnitts durch den Hiatus oesophageus in den Brustraum wird als Hiatushernie bezeichnet. Ätiologie und Pathogenese. Eine zunehmende Mesenchymschwäche im Alter führt zu einer Erschlaffung des Bandapparats im ösophagogastralen Übergang und zu einer Ausweitung des Hiatus oesophageus. Begünstigend wirkt die Erhöhung des abdominal-thorakalen Druckgefälles bei Adipositas. Je nach Ausmaß und Inhalt werden axiale, paraösophageale und gemischte Hernien unterschieden: Axiale Hiatushernien sind mit 90 % die häufigste Form. Es kommt zu einem Emporgleiten des gastroösophagealen Übergangs mit Verlagerung von Kardia und Magenfornix durch den Hiatus in den Thorax. Eine Vorstufe ist die Abstumpfung des ösophagogastralen Winkels (His-Winkel). In 10% der Fälle tritt bei der paraösophagealen Hiatushernie eine Verlagerung von Magenanteilen durch den Hiatus (neben dem an normaler Position verbleibenden gastroösophagealen Übergang) auf, im Extremfall eine Verlagerung des ganzen Magens (Upside-down-Stomach). Symptome. Bei einer Gleithernie kommt es selten zu Beschwerden, und wenn, dann meist im Sinne einer Refluxösophagitis. Bei paraösophagealen Hernien sind Passagestörungen oder ‑blockaden festzustellen. Ulzerationen mit chronischen Blutungsanämien können sich entwickeln. Postprandiale Krämpfe im Epigastrium werden häufig als kardiale Symptome fehlinterpretiert. Diagnose und Differenzialdiagnose. Hiatushernien werden mithilfe des Ösophagusbreischlucks erkannt. Als Ergänzung erfolgt eine flexible Ösophagoskopie. Die Untersuchung wird durch Manometrie und pH‑Metrie ergänzt. Refluxösophagitis, aber auch Lungenembolie oder Herzinfarkt müssen differenzialdiagnostisch berücksichtigt werden. Therapie. Die konservative Behandlung besteht in der Gabe von H2-Rezeptorenblockern (z. B. Cimetidin, Ranitidin) und von Protonenpumpenblockern (z. B. Omeprazol, Pantoprazol). Die gemischten Hernienformen und die paraösophagealen Hernien stellen eine Indikation zur operativen Therapie dar. Entzündliche Erkrankungen der Speiseröhre Die Ösophagitis stellt kein eigenes Krankheitsbild dar, sie tritt als Begleit- oder Folgeerscheinung von nicht infektiösen und infektiösen (bakteriellen, mykotischen oder viralen) Erkrankungen sowie mechanischen, chemischen oder physikalischen Schädigungen auf. Divertikel und Stenosen sowie funktionelle Motilitätsstörungen führen zu einer Retentionsösophagitis. Dermatologische Erkrankungen mit Blasenbildung (Pemphigus, Morbus Behçet, Epidermolysis bullosa) können eine Ösophagitis hervorrufen. Eine Strahlentherapie führt zu einer chronischen Strahlenösophagitis. Durch Verschlucken von Medikamenten (Azetylsalizylsäure, Tetrazykline) kann ein lokalisiertes Ulkus entstehen. 715 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus Spezielle HNO‑Erkrankungen und ihre Therapie Abb. 14.28 Soormykose des Ösophagus. Symptome. Neben der Dysphagie, einer Odynophagie oder retrosternalen Schmerzen tritt selten eine Hämatemesis auf. Diagnose. Die flexible Endoskopie erbringt den makroskopischen Nachweis entzündlicher Schleimhautveränderungen. Gleichzeitig werden damit ein Abstrich oder Biopsien gewonnen. Der Ösophagusbreischluck stellt nur ausgeprägte Schleimhautveränderungen dar. Infektiöse Ösophagitiden Soorösophagitis Der häufigste Erreger ist Candida albicans. Dieser wird klinisch besonders bei Antibiotika- und Kortisontherapie sowie bei immunsupprimierten Patienten und bei Patienten mit Immundefizit (HIV‑Erkrankung, Chemotherapie) relevant. Diagnose. Endoskopisch finden sich gelb-weißliche Plaques mit zum Teil rötlichem Rand und Ulzerationen, in schweren Fällen großflächig konfluierend (Abb. 14.28). Eine Biopsie und ein Abstrich sichern die Diagnose. Therapie. An erster Stelle steht die topische Behandlung mit einem Antimykotikum (z. B. Amphotericin B). Bei ausgeprägtem Befund oder ausbleibender Wirkung der Lokaltherapeutika erfolgt zusätzlich die systemische Gabe von Fluconazol. Nicht infektiöse Ösophagitiden Gastroösophageale Refluxkrankheit Die häufigste Ursache einer Ösophagitis ist die gastroösophageale Refluxkrankheit (GERD). Diese Bezeichnung wird für alle Symptome oder histopathologischen Veränderungen verwandt, die durch den Reflux von Magensaft und Magensäure bedingt sind. Dazu gehören die Ösophagitis, aber auch extraösophageale Manifestationen. Inzidenz, Ätiologie und Pathogenese. Ungefähr 20% der Bevölkerung der westlichen Industrieländer sind von GERD betroffen. Es besteht dabei eine Insuffizienz des un716 teren Ösophagussphinkters. Ist die Ursache der Insuffizienz unbekannt, so liegt eine primäre Insuffizienz vor. Bei der sekundären Insuffizienz findet sich z. B. ein Zustand nach Kardiaresektion, Gastrektomie oder Gleithernien, oder es liegt eine Schwangerschaft vor. Eine gewisse Menge an Reflux von Magensaft ist physiologisch und tritt bei Mahlzeiten immer auf. Ob dieser Reflux pathologisch wird, hängt von der Frequenz, vom Volumen und der Dauer der Exposition ab. So ereignen sich Refluxepisoden deutlich öfter tagsüber als nachts, aber die schädigende Wirkung ist nachts viel stärker ausgeprägt. Der Grund dafür ist, dass man nachts viel seltener schluckt (ungefähr 7 × pro Stunde im Vergleich zu 70 × pro Stunde am Tage). Der refluktierte Magensaft verweilt daher nachts viel länger im Ösophagus, weil er sehr langsam wieder abgeschluckt wird; die schädigende Wirkung ist dadurch viel größer. Schutzmechanismen gegen einen gastroösophagealen Reflux sind: l funktionierender unterer ösophagealer Sphinkter l peristaltische Clearance von ösophagealem Refluxvolumen l Widerstandsfähigkeit des ösophagealen Epithels l Funktionsfähigkeit des oberen ösophagealen Sphinkters Obwohl der pH‑Wert des Refluxmaterials wichtig ist, scheint jedoch eher die Pepsinkonzentration für die Schleimhautschädigung verantwortlich zu sein. Pepsin braucht jedoch ein saures Milieu (pH < 4,5), um seine Aktivität zu entfalten. Symptome. Ein brennender, retrosternaler Schmerz (Sodbrennen) tritt besonders nach ausgedehnten Mahlzeiten oder im Liegen auf. Die Schmerzen können in den Rücken, in den Arm oder in den Pharynx ausstrahlen. Regurgitation von Magensaft ist pathognomonisch. Therapieresistente Hustenanfälle und eventuelle Heiserkeit sind im Sinne einer Refluxlaryngitis als extraösophageale Symptome des GERD zu interpretieren. Gleichzeitig können sich ein Kontaktulkus des Kehlkopfs oder eine posteriore Laryngitis (s. Abb. 13.8) entwickeln. Diagnose. Die Verdachtsdiagnose GERD kann durch eine exakte Anamnese und typische Symptome gestellt werden. Eine empirische Therapie mit Protonenpumpenhemmer kann in Absprache mit dem Patienten durchgeführt werden. Wenn der Patient dadurch keine Besserung erfährt oder atypische Symptome zeigt, stehen eine Reihe von diagnostischen Möglichkeiten zur Verfügung: l 24-h – pH‑Metrie: Diese ist als Goldstandard allerdings relativ aufwendig. l Flexible Endoskopie: Sie zeigt charakteristische Schleimhautveränderungen im distalen Ösophagus, die als isolierte Schleimhauterosionen, konfluierende erosive oder zirkuläre Schleimhautdefekte erscheinen können. (Abb. 14.29; hier sei auf die Klassifikation nach Savary und Miller verwiesen). Eine Biopsie ist zu entnehmen! Im Verlauf kann sich eine Zylinderzell- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................................. ................................................................ l metaplasie (Barrett-Ösophagus) entwickeln. Allerdings schließt das Fehlen von endoskopischen Veränderungen eine GERD nicht aus (in bis zu 50% der Fälle zeigt sich bei der Ösophagoskopie eine normale Schleimhaut). HNO-ärztliche laryngoskopische Untersuchung: Posteriore Laryngitis, Kontaktgranulom usw; zum Nachweis extraösophagealer Manifestationen. Barrett-Ösophagus Als Barrett-Ösophagus wird die Auskleidung des terminalen Ösophagus mit Zylinderepithel bezeichnet. Dies ist meist Folge einer Refluxösophagitis, selten dagegen angeboren. Die klinische Bedeutung des Barrett-Ösophagus liegt in der potenziellen Gefahr der malignen Entartung. Das Risiko, an einem Adenokarzinom des distalen Ösophagus zu erkranken, ist 30- bis 100-fach erhöht. Symptome und Diagnose. Die Klinik entspricht der der Refluxkrankheit. Die flexible Ösophagoskopie zeigt die metaplastische Magenschleimhaut. Regelmäßige endoskopische Kontrollen sind alle 6 – 12 Monate zum Ausschluss einer malignen Entartung (Quadrantenbiopsie alle 2 cm sowie aus auffälligen Läsionen) indiziert. Therapie. Die konservative Behandlung ist identisch mit der der Refluxkrankheit. Beim Nachweis von Dysplasien ist eine chirurgische, eventuell aber auch eine fotodynamische Therapie indiziert. Eosinophile Ösophagitis Differenzialdiagnose. Neben Motilitätsstörungen der Speiseröhre, koronarer Herzkrankheit sowie Ulkuserkrankungen des Magens sind insbesondere maligne Erkrankungen des Ösophagus auszuschließen. Therapie l Die Änderung der Essgewohnheiten führt häufig zu einer Normalisierung der Beschwerden. Hierzu gehört auch die Gewichtsreduktion. Bei geringen Refluxbeschwerden sind Antazida (Aluminiumhydroxid) indiziert. l Bei stärkeren Beschwerden steht die Säureblockade im Zentrum der Therapie. Protonenpumpenblocker (Omeprazol, Pantoprazol) als Mittel der Wahl (Step-downTherapie) erreichen eine höhere Säuresuppression als H2-Antagonisten (Cimetidin, Ranitidin). l Wenn eine mindestens 3-monatige konsequente konservative Behandlung eine schwere Refluxösophagitis nicht ausreichend beeinflussen kann, ist eine operative Therapie, d. h. die Fundoplikation, zu diskutieren. Komplikationen. Neben Stenosen kann als Endstadium ein Barrett-Ösophagus oder auch eine maligne Entartung entstehen. GERD ist eine häufige Erkrankung, heutzutage aber auch eine Art „Modediagnose“. Deshalb sollte man sich als HNO‑Arzt hüten, alle unspezifischen Symptome, bei denen eine Ursache oft schwer zu finden ist, wie Globusgefühl, chronischer Husten, Heiserkeit oder Otalgie, auf extraösophageale Manifestationen des GERD zurückzuführen! ......... Ätiologie und Pathogenese. Die eosinophile Ösophagitis ist eine zunehmend diagnostizierte, immunvermittelte, chronisch entzündliche Erkrankung der Speiseröhre. Erstmals wurde sie 1978 von Landres et al. beschrieben. Sie wird sowohl im Kindes- als auch im Erwachsenenalter beobachtet. Bei den meist männlichen Patienten handelt es sich häufig um Atopiker bzw. Patienten mit Inhalations-/ Nahrungsmittelallergien oder Asthma. Ursächlich werden eine intraösophageale Sensibilisierung und Immunreaktion durch Nahrungsmittelproteine, geschluckte Luftallergene sowie eine außerhalb der Speiseröhre stattfindende Immunreaktion diskutiert. Symptome. Klinisch ähnelt die eosinophile Ösophagitis der gastroösophagealen Refluxerkrankung (GERD) und stellt daher eine wichtige Differenzialdiagnose dar. Im Kindesalter stehen bevorzugt rezidivierende Bauchschmerzen, Gedeihstörungen, Übelkeit, Erbrechen, Durchfälle sowie Refluxbeschwerden im Vordergrund. Zusätzlich tritt häufig eine subglottische Trachealstenose auf. Erwachsene klagen hingegen über Sodbrennen, Globusgefühl, retrosternale Schmerzen und vor allem über eine meist jahrelange Dysphagie für feste Nahrung. Ein rezidivierendes Steckenbleiben eines festen Nahrungsbolus ist keine Seltenheit. Mehrfache Krankenhausaufenthalte mit endoskopischer Fremdkörperentfernung und Bougierung sind nicht selten anamnestizierbar. Ein Teil der Patienten wird unter Annahme einer GERD mit Protonenpumpeninhibitoren erfolglos behandelt. Diagnostik. Bei der eosinophilen Ösophagitis handelt es sich um eine histologisch gestellte Diagnose. Sie liegt vor, wenn mehr als 20 eosinophile Granulozyten bei 40-facher 717 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 14.29 Endoskopisches Bild einer Refluxösophagitis im distalen Ösophagus. Erkrankungen 14 Hals, Schilddrüse und Ösophagus Vergrößerung pro hochauflösendem Gesichtsfeld (high power field) nachweisbar sind. Unter physiologischen Bedingungen ist der Ösophagus der einzige Abschnitt des Gastrointestinaltrakts, der nahezu frei von eosinophilen Granulozyten ist. Die Schwierigkeit der Diagnosestellung liegt darin, dass es bei der eosinophilen Ösophagitis zu einer meist punktförmigen Infiltration der Ösophagusmukosa kommt, häufig makroskopisch unauffällige Schleimhautverhältnisse vorliegen und somit nur die Biopsie eines betroffenen Schleimhautareals zur Diagnose führt. Daher ist die diagnostische Methode der Wahl die flexible bzw. starre Ösophagoskopie mit Stufenbiopsien vom proximalen bis zum distalen Ösophagus im Abstand von 5 cm. Typische Endoskopiebefunde sind: l ringförmige Aufwerfung der Ösophagusschleimhaut (= Trachealisierung) l Strikturen l bei Berührung leicht blutende, ödematöse Schleimhaut (= Krepppapiermukosa) l Längsfurchung der Mukosa l weiße, nicht abwischbare Papeln (= Mikroabszesse mit eosinophilen Infiltraten), Differenzialdiagnose Candidiasis l subglottische Trachealstenose Röntgenbreischluckuntersuchung, Gesamt-IgE Spiegelbestimmung, Bluteosinophiliebestimmung, 24-Stunden-2Kanal-pH‑Metrie und Prick-/Patchtestung stellen nur ergänzende Maßnahmen dar. Cave: Bei 10% der Erwachsenen und 34% der Kinder findet man endoskopisch keine Schleimhautveränderungen. Bei klinischem Verdacht auf eine eosinophile Ösophagitis sind multiple Biopsien aus dem proximalen, medialen und distalen Ösophagus indiziert. Therapie. Bei Kenntnis des Allergens ist vor allem bei Kindern die Allergenkarenz die wirksamste Therapie. Im Erwachsenenalter stellt die Einnahme des topischen Steroids Fluticason (geschluckt, nicht inhaliert!), 2-mal täglich über 6 – 12 Wochen, die Therapie der Wahl dar (4 Pumpstöße mit einem 220-μg-Inhaler). Eine 2-stündige Nüchternheit nach Einnahme ist einzuhalten. Bei fehlendem Ansprechen kommen auch systemische Steroide, der Leukotrienantagonist Montelukast sowie Mepolizumab (monoklonaler Antikörper gegen Interleukin-5) zum Einsatz. Die Rezidivrate nach 12 – 18 Monaten beträgt bei Erwachsenen 50 – 60 %, bei Kindern nach 6 Monaten fast 100 %. Differenzialdiagnosen l GERD (≤ 10 eosinophile Granulozyten pro hochauflösendem Gesichtsfeld) l eosinophile Gastroenteritis l hypereosinophiles Syndrom l Pilzinfektionen, parasitäre Erkrankungen l Leiomyomatose der Ösophagus l Sklerodermie 718 Verletzungen des Ösophagus Verätzungen Verätzungen durch Säuren oder Laugen führen zu reversiblen oder irreversiblen Schädigungen von Speiseröhre und Magen. Je nach Konzentration und Menge an freien H+- oder OH−-Ionen tritt eine Schädigung unterschiedlichen Schweregrads auf. Pathogenese. Säure führt zu einer Koagulationsnekrose mit Schorfbildung, die eine Barriere gegen eine weitere Ausdehnung darstellt. Säureverätzungen lösen überwiegend Magenläsionen aus, da es durch einen Pylorusspasmus zu einer verlängerten Verweildauer im Magen kommt. Laugenverätzungen dagegen sind Ursache von Kolliquationsnekrosen mit Verflüssigung des Gewebes und tiefer Penetration der Substanz. Durch einen reflektorischen Kardiospasmus ist bevorzugt der Ösophagus betroffen. In vielen Haushaltsreinigungsmitteln und Abflussreinigern sind als auslösendes Agens Natronlauge und Natriumhypoxid enthalten. Klassifikation. Eine histopathologische Einteilung der Verätzungsgrade erfolgt in Bezug auf die Schädigungstiefe: l Grad 1: oberflächliche Mukosaschädigung mit entzündlichem Schleimhautödem l Grad 2: Zerstörung der Mukosa mit partieller Schädigung von Submukosa und Tunica muscularis mit Ausbildung eines flachen Ulkus; die Abheilung erfolgt narbig l Grad 3: tief greifende Wandnekrose aller Organwandschichten bis zur Organsequestrierung; eine Wandperforation kann zu weiteren Verätzungsfolgen intrathorakaler oder intraabdominaler Organe führen Regeneration und reparative Vorgänge. Diese entwickeln sich in 3 Stadien: 1. Initialstadium (bis zum 4. Tag): Demarkierung der Gewebsnekrose nach bakterieller und hämorrhagischer Infiltration. 2. Granulationsphase (bis zur 4. Woche): Nach einer Abstoßung von nekrotischem Material findet eine Gefäßeinsprossung mit Ausbildung von Granulationsgewebe statt. Es kommt zum Einsprossen von kollagenem Bindegewebe. 3. Vernarbungsphase: Eine Gewebsneubildung mit Narbengewebe beginnt nach ungefähr 4 Wochen mit der Folge von narbigen Stenosen; 90 % der posttraumatischen Stenosen manifestieren sich im 1. Jahr. Symptome. Starke Schmerzen treten in Mund- und Rachenraum sowie retrosternal und im Oberbauch auf. Flache Ulzerationen finden sich im Bereich der Lippen, der Mundhöhle und des Oropharynx. Eine extreme Speichelhypersekretion mit Herauslaufen von Speichel aus dem Mund ist typisch. Ein toxisches Glottisödem mit Heiserkeit oder Stridor kann auftreten. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. Bei Verätzungen 2. und 3. Grades kommt es durch die Intoxikation zur Entwicklung einer Schocksymptomatik mit Kreislauf- und Nierenversagen sowie schließlich einem Multiorganversagen. Ösophagus- und Magenperforationen (3 – 5 % der Fälle) können zu einer akuten Mediastinitis oder einer Peritonitis führen. Perforationen sind mit einer hohen Letalität (50 – 70%) behaftet. Diagnose. Die typische Anamnese eines Unfalls oder eines Suizidversuchs mit Sicherstellung der toxischen Substanz sowie dem Nachweis von Ätzspuren in Mundhöhle und Mesopharynx sind wegweisend. (Informationszentren für Vergiftungsfälle mit 24-h-Dienst sind in der Roten Liste aufgeführt.) Röntgenaufnahmen des Thorax und des Abdomens sind obligatorisch. Ein Röntgenbreischluck mit einem isotonischen Kontrastmittel (z. B. Iotrolan) kann vorhandene Perforationen darstellen. Die flexible Endoskopie zur optischen Kontrolle der Lokalverhältnisse ist die entscheidende Untersuchung zur Beurteilung der Schwere der Verätzung. Sie sollte nur von extrem erfahrenen Endoskopikern möglichst bald nach der Verätzung durchgeführt werden, da das Risiko der iatrogenen Perforation 48 – 72 h nach der Ingestion viel größer wird. Man verwende ein pädiatrisches Endoskop mit minimaler Luftinsufflation. Das Endoskop wird bis zur 1. erkennbaren Läsion eingeführt. Von diesem Punkt an muss man extrem vorsichtig sein, um eine Perforation aller Wandschichten zu vermeiden. Oft kann der Erfahrene aber doch an mäßigen Läsionen vorbeinavigieren und das gesamte Ausmaß der Verätzung beurteilen. Gibt es aber nur geringste Zweifel an der Sicherheit des endoskopischen Vorgehens, sollte man die Untersuchung abbrechen! Verätzungen werden entsprechend der Tiefe der endoskopisch erkennbaren Läsion klassifiziert (Tab. 14.11). Therapie. Die Soforttherapie besteht in einer Volumensubstitution mit Hydroxyäthylstärke, dem Ausgleich einer metabolischen Azidose oder Alkalose sowie der intensivmedizinischen Überwachung. Zur Verdünnung und Neutralisation wird bei leichtgradigen Verätzungen bei Laugeningestion Zitronensaft oder 2 %ige Essigsäure empfohlen. Bei Säureingestion können Antazida verabreicht werden. Bei schwerwiegenden Verätzungen ist neben der intensivmedizinischen Betreuung eine antibiotische Abdeckung mit einem Zephalosporin zu empfehlen. Tabelle 14.11 Erkrankungen Eine Kortisontherapie mit initial hoher Dosis soll zu einer Reduzierung von posttraumatischen Stenosen führen. Zwei neuere große Studien haben jedoch den minimalen Einfluss von Kortison zur Prävention von Stenosen gezeigt (s. Literatur). Eine Früh-Bougierung (Beginn 5 – 6 Wochen nach der Läsion) wird bei Bedarf durchgeführt und muss regelmäßig in bestimmten Abständen wiederholt werden. Die Technik der Dilatation ist außerordentlich wichtig. Um Perforation zu vermeiden, darf sie nur nach Legen eines Führungsdrahts und radiologischer Kontrolle der Lage des Drahtes im Magen durchgeführt werden. Die Dilatation beginnt über den Führungsdraht mit kleinen Bougies (Savary-Dilatator), deren Größe man steigert, bis ein mäßiger Widerstand oder eine leichte Blutung auftreten. Dann muss man stoppen, da wiederholte Dilatationen nach dem Auftreten von Blut zu einem Einriss der Struktur führen. Dies resultiert dann wieder in einer stärkeren Stenose durch die erneute narbige Heilung des Risses. Diese vorsichtigen Dilatationen muss man, je nach Befund, im Abstand von Tagen oder Wochen auf gleiche Weise wiederholen. Hochgradige Stenosen machen eine Dauer-Bougierung notwendig, die vom Patienten selbstständig durchgeführt werden soll. Bei der überwiegenden Mehrheit ist eine Operation nicht notwendig. Auch kleine paraösophageale Perforationen, die wieder ins Ösophaguslumen drainieren, können konservativ kontrolliert werden. Ein Pneumoperitoneum, eine Peritonitis oder eine klinische Befundverschlechterung bedeuten eine Operationsindikation, die je nach Gesamtsituation immer individuell gestellt werden muss. Wenn trotz intensivmedizinischer Maximaltherapie eine Instabilität der Vitalfunktionen droht, werden transmurale Wandschädigungen reseziert. Häufig sind eine totale Ösophagektomie und eine Gastrektomie erforderlich. Die Rekonstruktion erfolgt 2-zeitig mithilfe eines Koloninterponats. Risiken und Komplikationen. Das Risiko einer malignen Entartung im Stenosebereich ist gegenüber der Normalbevölkerung um den Faktor 1000 erhöht. Deshalb müssen endoskopische Kontrollen im jährlichen Abstand erfolgen. Klassifikation von Verätzungen anhand der Tiefe der Läsion. Grad Tiefe Endoskopie 1 mukös Schleimhautschwellung und Ödem 2 transmukös, mit oder ohne Beteiligung der Muskularis; keine Ausdehnung in periösophageales Gewebe hämorrhagische exsudative, ulzeröse Pseudomembranen 3 Läsion aller Wandschichten mit Ausdehnung in periösophageales Gewebe; kann mediastinale oder intraperitoneale Organe betreffen komplette Obliteration des Ösophaguslumens durch massives Ödem und ausgedehnten Verätzungsschorf; Nekrose aller Wandschichten mit Perforation 719 ......... 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................ 14 Hals, Schilddrüse und Ösophagus ................................................................................. Fremdkörper Nahrungsfremde Materialien oder Nahrungsbestandteile, die aufgrund ihrer Größe und Beschaffenheit zu einer Lumenblockade führen und Wandverletzungen verursachen können, werden als Ösophagusfremdkörper bezeichnet. Pathogenese. Das Verschlucken von Fremdkörpern geschieht unabsichtlich oder absichtlich. Bei Kindern treten Ösophagusfremdkörper im Alter von 6 Monaten bis 10 Jahren am häufigsten auf. Die Art der Fremdkörper variiert enorm; am häufigsten sind es Münzen. Bei Erwachsenen sind die häufigsten Fremdkörper vom Fisch (Gräten) oder Huhn und treten vor allem im Alter von > 50 Jahren auf. Häufigster Sitz von Ösophagusfremdkörpern ist die 1. Ösophagusenge, gefolgt von der 2. Ösophagusenge (Impression durch den Aortenbogen und den Hauptstammbronchus) und der 3. Enge (ösophagogastraler Übergang). Symptome. Leitsymptom ist eine akut einsetzende schmerzhafte Dysphagie bis Aphagie nach Nahrungsmittelaufnahme, die bei bewusstseinsklaren Erwachsenen eine einfache Verdachtsdiagnose ist. Nicht so bei alkoholisierten oder verwirrten Erwachsenen und bei Kindern! Gleichzeitig treten erhebliche retrosternale oder epigastrische Schmerzen auf. Ein Halsemphysem ist beweisend für eine Perforation. Kleine Fremdkörper werden häufig via naturalis ausgeschieden. Die Passagezeit bis zur Ausscheidung beträgt 2 – 5 Tage. Diagnose. Die Laryngoskopie zeigt einen Speichelsee in beiden Sinus piriformes, ein Ödem oder eine Rötung der Aryregion. Eine seitliche Weichteilröntgenaufname des Halses sowie eine a.-p. Röntgenaufnahme des Thorax sind obligat und können schattengebende Fremdkörper identifizieren (Abb. 14.30). Bei nicht schattengebenden Fremdkörpern findet man ggf. einen kranial gelegenen Luftschatten. Eine Verbreiterung des prävertebralen Raumes deutet auf eine beginnende Perforation oder eine beginnende Absze720 dierung hin. Kontrastaufnahmen mit Barium sind aus folgenden Gründen kontraindiziert: l Die nachfolgende Endoskopie kann erschwert sein, weil Barium Fremdkörper verschleiert. l Bei einer Perforation besteht das Risiko einer Penetration von Barium ins Mediastinum. l Es besteht ein Aspirationsrisiko von Barium. Eine Gastrografinuntersuchung (wasserlösliches Kontrastmittel) bringt keine zusätzlichen Informationen im Rahmen des klassischen endoskopischen Managements von Fremdkörpern. Jeder Verdacht auf einen Ösophagusfremdkörper erfordert eine Ösophagoskopie, auch wenn die klinische und radiologische Untersuchung negativ ist. Die Fremdkörperendoskopie ist in aller Regel auch gleichzeitig die Therapie (endoskopische Fremdkörperextraktion). Therapie. Der Ösophagusfremdkörper ist ein HNO-ärztlicher Notfall. Die Durchführung einer Ösophagoskopie mit einem starren Endoskop ist die Therapie der Wahl (s. Kap. 6.2.4 „Klinische Diagnostik des Ösophagus“). Sie empfiehlt sich schnellstmöglich, jedoch immer innerhalb der ersten 6 h nach Fremdkörperingestion. Zeigt sich eine Perforation, so ist die Endoskopie mit einem chirurgischen Eingriff (Drainage und Perforationsverschluss) zu kombinieren. Eine absolute Kontraindikation der endoskopischen Extraktion ist das Vorhandensein von schwerer Hämatemesis. Diese kann auf eine mögliche Fistel zu den großen Gefäßen, bedingt durch die Perforation des Fremdkörpers, hindeuten. Die Fremdkörperendoskopie besteht aus 3 Teilschritten: l diagnostische Evaluation l endoskopische Fremdkörperextraktion l Postextraktionsendoskopie Nach der Fremdkörperextraktion wird der Ösophagus nochmals auf Wandläsionen oder Perforationen kontrolliert. Auch der Ösophagus distal des Fremdkörpers muss überprüft werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Abb. 14.30 Ösophagusfremdkörper (Knochen). ................................................................ Komplikationen. Die Lumenobstruktion verhindert das Schlucken von Speichel. Der Speichel kann in den Kehlkopf übertreten und zu einer Aspiration führen. Gleichzeitig kann eine Drucknekrose oder eine Perforation mit Fremdkörperdurchwanderung beobachtet werden. Thorakale Perforationen sind gefährlicher als zervikale. Die Mortalität bei einer eingetretenen Perforation liegt, insgesamt gesehen, bei ca. 20 – 25 %. Kommt es aufgrund des Fremdkörpers zu einer Verlegung des Kehlkopfeingangs mit drohendem Bolustod, ist als lebensrettende Maßnahme der Handgriff nach Heimlich durchzuführen. Kinder werden an den Beinen hochgenommen; ein starkes Klopfen auf den Rücken soll zur Fremdkörperlösung führen. Gegebenenfalls kann versucht werden, den Fremdkörper mit dem tastenden Finger aus dem Hypopharynx zu entfernen. Gelingt dies nicht, muss eine Koniotomie durchgeführt werden. Ist die endoskopische Fremdkörperentfernung nicht möglich oder tritt eine Perforation auf, so wird die Indikation zur operativen Fremdkörperentfernung von außen gestellt. Boerhaave-Syndrom/Mallory-Weiss-Syndrom und Bulimia nervosa Das Boerhaave- bzw. Mallory-Weiss-Syndrom stellt die Spontanruptur des Ösophagus dar. Ätiologie. Ursächlich ist eine durch heftiges Erbrechen hervorgerufene Ruptur. Die Pathogenese ist nicht vollständig geklärt. Das Mallory-Weiss-Syndrom mit longitudinalem Einriss im Bereich der Ösophagusschleimhaut (Mukosa und Submukosa) wird als inkomplettes Boerhaave-Syndrom verstanden. Die Spontanruptur tritt überwiegend bei Männern auf (80 %). Die Lokalisation ist in über 90 % der Fälle subdiaphragmal (links, dorsolateral). Rezidivierende spontane Ösophagusperforationen und parapharyngeale Abszesse bei jungen Frauen müssen an die Möglichkeit der Manipulation bei Bulimia nervosa denken lassen. ......... Symptome. Leitsymptom ist der akut auftretende Vernichtungsschmerz mit heftigem Erbrechen, einhergehend mit einer raschen Verschlechterung des Allgemeinzustands mit Dyspnoe und Kreislaufversagen. Häufig entwickeln sich ein Pneumothorax und ein Mediastinalemphysem mit Übergreifen auf Hals und Thorax. Diagnose. Auf der Thoraxübersichtsaufnahme kann ein Mediastinalemphysem und das sog. V‑Zeichen als eine Luftsichel zwischen mediastinaler und diaphragmaler Pleura verifiziert werden. In 70 % der Fälle kann der Nachweis durch einen Ösophagusbreischluck mit einem wässrigen, isotonischen Kontrastmittel erbracht werden. Therapie. Die sofortige operative Versorgung mit Primärverschluss der Rupturstelle und hoch dosierter Antibiotikatherapie ist notwendig. Die Prognose hängt vom Zeitraum zwischen Diagnose und operativer Behandlung ab. Traumatische Ösophagusperforation Eine traumatische Perforation tritt am häufigsten iatrogen im Rahmen einer Ösophagoskopie, von Bougierungsversuchen und pneumatischer Dilatation oder einer fehlerhaften Intubation auf. Lokalisation. Die häufigsten Perforationsstellen sind der zervikale Ösophagus in Höhe des M. cricopharyngeus und der thorakoabdominale Übergang des Ösophagus am Zwerchfell. Die Perforation im Bereich des Krikopharyngeus geschieht durch unbemerktes Einführen des Ösophagoskops in den Sinus piriformis oder bedingt durch störende Osteophyten. Es können Perforationen am Hiatus auf Zwerchfellhöhe auftreten, wenn der Endoskopiker die Biegung des anterior verlaufenden Ösophagus auf dieser Höhe nicht berücksichtigt. Symptome. Die Symptome variieren abhängig von der Lokalisation der Verletzung. Anhaltende Schmerzen und Fieber nach einer Ösophagoskopie müssen jedoch immer an eine Perforation denken lassen. Perforationen des zervikalen Ösophagus verursachen Halsschmerzen (95 % der Fälle) und ein subkutanes Emphysem (55%). Dysphagie und Hämatemesis können ebenfalls auftreten. Fieber und eine Leukozytose entwickeln sich in den ersten 24 h. Weiter distal gelegene Perforationen verursachen die typischen retrosternalen Schmerzen sowie Schmerzen zwischen den Schulterblättern. Dysphagie, Fieber und Kreislaufversagen sind die späten Leitsymptome der traumatischen Ösophagusperforation. Ungefähr 50% der Patienten sind in den ersten 8 h nach einer iatrogenen Perforation asymptomatisch! Diagnose. Der Ösophagusbreischluck mit einem wasserlöslichen, isotonischen Kontrastmittel ist die 1. Maßnahme. Bei zervikalen Läsionen sind eine paraösophageale Luftansammlung und eine Verbreiterung der prävertebralen Weichteile typisch. Bei der Thoraxübersicht finden sich ein Pneumothorax sowie eine Mediastinalverbreiterung. 721 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Postextraktionsmanagement. Bei einer schwierigen Extraktion mit Läsionen bis zur Muskelschicht, aber ohne endoskopische oder radiologische Hinweise auf eine Perforation, ist das Vorgehen konservativ: Der Patient wird klinisch überwacht und eventuell radiologisch kontrolliert. Wenn endoskopisch eine punktförmige Perforation (z. B. durch einen spitzen Knochen oder eine Stecknadel) ohne ein mediastinales oder zervikales Emphysem diagnostiziert wird, ist das Vorgehen ebenfalls konservativ. Zusätzlich werden Breitspektrumantibiotika gegeben. Bei einer endoskopisch oder radiologisch diagnostizierten Perforation ist eine chirurgische Versorgung innerhalb der nächsten 3 h erforderlich (Vernähen der Perforation und Drainage). In all diesen Fällen wird vor einer oralen Nahrungszufuhr und vor der Entlassung des Patienten ein Gastrografinschluck durchgeführt. Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. Therapie. Kleine zervikale Perforationen können unter parenteraler Ernährung und breiter antibiotischer Abdeckung (z. B. Pipril + Certomycin + Fortum) primär konservativ behandelt werden. Der Kreislauf ist entsprechend zu stabilisieren. Eine Operationsindikation besteht bei größeren Perforationen. Im zervikalen Bereich wird über eine laterale Pharyngotomie die Perforation dargestellt und durch eine Naht verschlossen. Konservatives oder operatives Vorgehen bei einer iatrogenen Perforation wird immer noch kontrovers diskutiert. Eine wichtige Rolle für das entsprechende Vorgehen spielen die Lage und Größe der Perforation, die Zeitdauer, nach der die Perforation erkannt wurde, und der Allgemeinzustand des Patienten. werden. Gelingt eine Blutstillung durch diese Maßnahmen nicht, wird eine Sengstaken-Blakemore-Sonde (bzw. Linton-Nachlas-Sonde bei Varizen im Magenfundus) eingelegt. Tumoren des Ösophagus Benigne Tumoren Etwa 10 % aller Ösophagustumoren sind gutartig. Das Leiomyom ist mit ungefähr 75% der häufigste Speiseröhrentumor. Es handelt sich in der Regel um eine intraluminal liegende, solitäre Raumforderung. Weiterhin treten Lipome und Fibrome auf. Komplikationen. Perforationen im mittleren und unteren Drittel haben eine deutlich höhere Komplikationsrate als zervikale Perforationen und werden daher eher operativ über eine Thorakotomie versorgt. Symptome und Diagnose. Die Symptome sind meist geringgradig und äußern sich als Dysphagie. Die Diagnose wird mittels der flexiblen Ösophagoskopie und entsprechenden radiologischen Untersuchungen gestellt (CT, MRT, Bariumkontrastuntersuchung). Eine Biopsie sollte wegen der Gefahr der Blutung, Infektion oder Perforation zunächst nicht durchgeführt werden. Ösophagusblutung Therapie. Die Behandlung besteht in der endoskopischen Resektion oder chirurgischen Enukleation. Bei Blutungen aus dem Ösophagus handelt es sich meist um Ösophagusvarizenblutungen. Sie machen 10 % der Blutungen im oberen Gastrointestinaltrakt aus. Ätiologie und Pathogenese. Bei fortgeschrittener Leberzirrhose kommt es in 75 % der Fälle zu einer portalen Hypertension mit Entwicklung von Kollateralkreisläufen und Ausbildung gastroösophagealer Varizen. Symptome. Die Hämatemesis kann mit hellrotem Blut auftreten oder kaffeesatzartig aussehen. In Abhängigkeit vom Blutverlust kann es zu einem Herz-Kreislauf-Versagen kommen. Diagnose und Differenzialdiagnose. Die flexible Endoskopie mit Nachweis der Varizen und Darstellung der Blutungsquelle stellt das Diagnoseverfahren der Wahl dar. Ösophagusruptur, Mallory-Weiss-Syndrom, BoerhaaveSyndrom, Magenblutung bei Ulkuserkrankung, Hämoptoe und Epistaxis müssen differenzialdiagnostisch in Erwägung gezogen werden. Therapie. Als Sofortmaßnahme muss eine Kreislaufstabilisierung mit Volumensubstitution vorgenommen werden. Die endoskopische Blutstillung mittels Ligaturen (Multibandligatursysteme) ist die Behandlung der Wahl. Eine Varizensklerosierung in das blutende Gefäß oder die interstitielle Applikation von Fibrinkleber sind als Reservemethoden anzusehen. Eine medikamentöse Senkung der Varizendurchblutung kann mit Terlipressin, Somatostatin oder Somatostatinanaloga (Octreotid) erreicht 722 Maligne Tumoren Mit weitem Abstand ist das Ösophaguskarzinom der häufigste maligne Tumor. Überwiegend sind Männer betroffen; das Geschlechtsverhältnis beträgt 7 : 1. In 15 % (6 %) der Fälle treten Adenokarzinome auf, deren Inzidenz deutlich zunimmt. Epidemiologie und Ätiologie. Geografisch zeigen sich starke Unterschiede des Erkrankungsrisikos mit erhöhter Inzidenz in Südostasien, Indien, Frankreich und Brasilien. Die regional unterschiedliche Inzidenz bösartiger Ösophagustumoren führt man auf eine unterschiedliche Exposition exogener und physikalischer Noxen zurück. Alkohol und Nikotin sind wichtige prädisponierende Faktoren; auch Aflatoxine und Nitrosamine in der Nahrung werden für die Entstehung verantwortlich gemacht. Als Matrix für das Adenokarzinom werden Residuen von Zylinderepithelinseln angenommen. Als Präkanzerosen gelten der Endobrachyösophagus, die Achalasie, Stenosen nach Laugenverätzungen und das Plummer-Vinson-Syndrom. Häufig tritt das Ösophaguskarzinom als Zweitkarzinom nach Hypopharynx- oder supraglottischem Karzinom auf. Metastasierung. Der fehlende Serosaüberzug des extraabdominellen Ösophagus führt zu einer raschen Tumorinfiltration in Nachbarstrukturen (Trachea) sowie einer frühzeitigen Metastasierung in die regionalen Lymphknoten des zervikalen oder thorakalen Ösophagus. Im Bereich der Bifurkation finden sich am häufigsten Metastasen, die Lymphflussrichtung ist hier bidirektional in Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Eine subphrenische Luftsichel ist bei intraabdominaler Ösophagusverletzung typisch. Ein CT des Thorax ist für die Beurteilung der Schwere der Verletzung weiterführend. ................................................................ retrosternaler Schmerz, Heiserkeit durch Läsion des N. recurrens und eine Hämatemesis auf. Diagnose. Im Ösophagusbreischluck (Abb. 14.31) können sich darstellende Schleimhautunregelmäßigkeiten, Füllungsdefekte sowie Stenosen einen ersten Hinweis auf das Vorliegen eines Ösophaguskarzinoms geben. Beweisend ist die Endoskopie mit Probeexzisionen (Histologie). Die Endosonografie erleichtert die Stadieneinteilung. Zur Tumorausdehnung und zum Nachweis der Lymphknotenmetastasen ist das CT das bildgebende Verfahren der Wahl. Die Endosonografie erlaubt ein genaues Staging der TNM‑Klassifikation (Tab. 14.12). Therapie. Als Behandlungskonzepte stehen die chirurgische Exzision, die Strahlentherapie oder die kombinierte Radiochemotherapie (primär, adjuvant oder neoadjuvant) zur Verfügung. Bei der Erstdiagnose sind 40 % der Tumoren inoperabel. Die chirurgische Resektion bietet weiterhin die größtmögliche Heilungschance. Der beste chirurgische Zugang, das Ausmaß der Resektion und die angewandten Rekonstruktionsmöglichkeiten werden jedoch kontrovers diskutiert. Zur Sicherstellung der Ernährung ist die Anlage einer perkutanen, endoskopisch kontrollierten Gastrostomie anzustreben. Bei kompletter Obstruktion muss eine CTgesteuerte Gastrostomie durchgeführt werden. Prognose. Die Prognose des Ösophaguskarzinoms ist schlecht. Eine günstigere Prognose haben lediglich Ösophaguskarzinome, die unterhalb der Trachealbifurkation lokalisiert sind. Im Stadium T3 und T4 verschlechtert sich die Prognose dramatisch. Die 5-Jahres-Überlebensrate aller Patienten liegt unter 10 %! Literatur Tabelle 14.12 TNM‑Klassifikation des Ösophaguskarzinoms. Tis Carcinoma in situ T1 Tumor infiltriert Lamina propria oder Submukosa T2 Tumor infiltriert Muscularis propria T3 Tumor infiltriert Adventitia T4 Tumor infiltriert Nachbarstrukturen den Ductus thoracicus bzw. in die Cisterna chyli. Als Fernmetastasen werden am häufigsten Lungen- und Lebermetastasen, seltener Knochen-, Nieren- und Magenmetastasen beobachtet. Symptome. Initial sind die Krankheitssymptome diskret. Die Folge ist eine verspätete Erstdiagnose in einem späten Tumorstadium. Im fortgeschrittenen Stadium treten progressive Dysphagie mit raschem Gewichtsverlust, ......... Böhme G. Sprach-, Sprech-, Stimm- und Schluckstörungen. Bd. 2: Therapie. 4. Aufl. München: Elsevier; 2006: 440 – 465 Cohen S. Motor disorders of the esophagus. New Engl J Med 1979; 301: 184 – 189 Engel MA, Raithel M, Hahn EG, Konturek PC. Eosinophile Ösophagitis: Neue Standards in Diagnostik und Therapie chronischer Retrosternalschmerzen. Dtsch Med Wochenschr 2008; 133: 966 – 971 Herold G. Innere Medizin. Eigenverlag; 2009 Klauser AN, Schindlbeck N, Müller-Lissner SA. Symptoms of gastroesophageal reflux disease. Lancet 1990; 335: 205 – 208 Müller M. Chirurgie für Studium und Praxis. Breisach/Rh.: Med. Verlags- und Infomationsdienste; 2002/03 Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med 2004; 351: 940 – 941 Reichel O, Ihrler S, Berghaus A, Kramer MF. Die eosinophile Ösophagitis. HNO 2008; 56: 211 – 218 Siewert R. Chirurgie. 7. Aufl. Berlin: Springer; 2001 Silverstein FE, Tytgat GNJ. Gastroenterologische Endoskopie. Stuttgart; Thieme: 1994 Vogelsang A, Schumacher B, Neuhaus H. Behandlung des Zenkerschen Divertikels. Dtsch Arztebl 2008; 105/7: 120 – 126 Wilcox CM. Atlas of Clinical Gastrointestinal Endoscopy. Philadelphia: Saunders: 1995 723 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 14.31 Doppelkontrastdarstellung des Ösophagus mit großem Ösophaguskarzinom. Erkrankungen 14 Hals, Schilddrüse und Ösophagus ................................................................................. 14.2 Chirurgische Therapie 14.2.1 sache berücksichtigen, dass Halsinfektionen durch ein sehr breites grampositives wie auch gramnegatives, aerobes und auch anaerobes Keimspektrum, häufig auch durch Keimgemische, verursacht werden können. Zur Initialtherapie eignen sich z. B. Cefuroxin und Metronidazol. Halsweichteile J. Maurer und B. M. Lippert Bei allen entzündlichen Erkrankungen mit Abszessbildung in den verschiedenen Kompartimenten der Halsfaszien besteht eine dringliche Indikation zur Entlastung der putriden Flüssigkeit. Dies geschieht durch Inzision und Drainage, nachdem klinisch und durch Ultraschalluntersuchung, gelegentlich auch durch weiterführende bildgebende Diagnostik, die Einschmelzung erkannt und lokalisiert wurde. In den meisten Fällen ist zur Abszess-Drainage eine Allgemeinnarkose erforderlich. Nur bei sehr oberflächlich liegenden oder kleineren Prozessen bieten sich eine Inzision in Lokalanästhesie bzw. eine Anästhesie durch Kühlung der Haut mit Chloralhydrat an. Zu Beginn der Operation kann eine Punktion mit einer Nadel und Spritze zur genaueren Lokalisation eines tiefer liegenden Abszesses hilfreich sein. Die weitgehende Abpunktion der eitrigen Flüssigkeit ist bei Kontraindikationen für eine operative Abszessspaltung (z. B. stark reduzierter Allgemeinzustand, Antikoagulation) sinnvoll. Es sollte aus der eitrigen Flüssigkeit immer ein Abstrich für die mikrobiologische Untersuchung (Erregernachweis und Antibiogramm) gewonnen werden. Ebenso empfiehlt es sich, aus der Abszesshöhle eine Gewebeprobe für die histologische Untersuchung zu entnehmen. Zur suffizienten Behandlung einer abszedierenden Entzündung der Halsweichteile muss begleitend eine ausreichende antibiotische Therapie erfolgen. Dies sollte die Tat- a Abszesse der Zunge und des Mundbodens Abszedierungen im Bereich der vorderen Zungenabschnitte und des Mundbodens lassen sich in der Regel von enoral eröffnen. Tiefer und weiter dorsal gelegene Abszesse machen eine Operation von außen erforderlich. So wird eine horizontale Inzision am Unterrand der ggf. auch außen erkennbaren Schwellung durchgeführt (Abb. 14.32 a). Subkutangewebe und Platysma werden durchtrennt. Anschließend erfolgt ein vertikaler Schnitt in der Mittellinie des M. mylohyoideus. Mit einer stumpfen, gebogenen Klemme wird danach die Abszesshöhle eröffnet, so dass die eitrige Flüssigkeit abfließen kann (Abb. 14.32 b). Nach Gewebe- und Abstrichentnahme wird die Abszesshöhle mehrfach gespült, beispielsweise mit Polyvidonjod (Kontraindikationen beachten) oder verdünnter Wasserstoffperoxidlösung und ein DrainageRöhrchen oder ein Lasche eingelegt. Nach Fadenfixierung an der Haut erfolgen ein locker adaptierender Wundverschluss sowie ein steriler Verband. Die liegende Drainage ermöglicht in den folgenden Tagen einen weiteren Sekretfluss sowie das reinigende Spülen der Abszesshöhle. Laterale parapharyngeale Halsabszesse Die Hautinzision liegt mindestens 2 Querfinger unterhalb der Mandibula, um den Mundast des N. facialis nicht zu verletzen (Abb. 14.33 a), möglichst in einer vorhandenen Abb. 14.32 Chirurgisches Vorgehen bei Mundbodenabszessen. b M. digastricus M. mylohyoideus Inzision M. geniohyoideus 724 c a Hautinzision am Unterrand der Schwellung. b, c Eröffnen des Abszesses und Entlastung mit einer stumpfen Klemme. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Chirurgie entzündlicher Erkrankungen ........................................................... a b Chirurgische Therapie ......... Abb. 14.33 Chirurgisches Vorgehen bei lateralen parapharyngealen Halsabszessen. a Hautinzision 2 Querfinger unterhalb der Mandibula. b, c Darstellung des Vorderrands des M. sternocleidomastoideus und Eröffnen des Abszesses. Inzision 14 c Haut- bzw. Halsfalte, . Es wird der Vorderrand des M. sternocleidomastoideus identifiziert und dargestellt. Mit einer stumpfen Klemme wird das Gewebe bei gleichzeitiger Gegenpalpation gespreizt und die Abszesshöhle eröffnet (Abb. 14.33 b, c). Bei ausgedehnten Befunden kann eine Gegeninzision sinnvoll sein, um eine Drainage von 2 Seiten zu ermöglichen. Nach Spülung erfolgen die Einlage eines an der Haut zu fixierenden Drainage-Röhrchens sowie der Wundverschluss. Auch weiter kaudal lokalisierte Halsabszesse, Abszesse mit Ausbreitung im Verlauf des Gefäß-Nerven-Bündels und Abszesse des retropharyngealen Raumes werden von außen eröffnet und drainiert. Postoperativ wird die Abszesshöhle für einige Tage gespült und die Drainage in 2 – 3 Schritten entfernt. Unter dieser Therapie und gleichzeitiger Antibiose sollten sich der Lokalbefund und die Laborparameter (Leukozyten, CRP) normalisieren. Nekrotisierende Infektionen Nekrotisierende bakterielle Infektionen des Weichteilgewebes können durch β-hämolysierende Streptokokken, Clostridien oder andere Keime verursacht werden. Häufig liegen Mischinfektionen vor. Es können Staphylokokken, hämolytische Streptokokken, Proteus, Klebsiella, Enterobacter, Pseudomonas, Bakteroidesspezies, Fusobakterien, Propionibakterien und Peptostreptokokken beteiligt sein. Aufgrund der Gefährlichkeit des Krankheitsbilds muss eine breite antibiotische, aber auch aggressive chirurgische Therapie mit Fasziotomie und ausgiebigem Débridement erfolgen. In vielen Fällen ist zusätzlich eine hyperbare Sauerstofftherapie indiziert. Die antibiotische Therapie (z. B. Clindamycin, Penizillin G, Ceftacidin und Aminoglykosid) sollte frühzeitig ein breites Keimspektrum erfassen und im Verlauf nach Vorlage des Antibiogramms ggf. modifiziert werden. Chirurgie von Halszysten und Halsfisteln Laterale Halszysten und laterale Halsfisteln Prinzipiell besteht für alle lateralen Halszysten und laterale Halsfisteln eine Operationsindikation. Im Verlauf treten rezidivierende Schwellungen und Infektionen sowie bei Fisteln auch Sekretabsonderungen auf. Bei Fisteln erfolgt die Operation überwiegend im Kindesalter, während laterale Halszysten eher in der 2. – 4. Lebensdekade in Erscheinung treten und dann einer Operation zugeführt werden. Liegt eine Infektion vor, so empfiehlt sich zunächst eine antibiotische Behandlung; ggf. sind auch Inzision und Drainage erforderlich. Im entzündungsfreien Intervall kann dann die Operation mit dem Ziel einer totalen Exstirpation der Zyste bzw. Fistel erfolgen. Die Operation wird in Allgemeinanästhesie durchgeführt. Entfernung lateraler Halszysten Operationstechnik. Dazu erfolgt nach Injektion der Haut mit 1 %igem Ultracain + Suprarenin 1 : 200 000 eine ca. 5 cm lange Hautinzision mit Durchtrennung der oberflächlichen Halsfaszie und des Platysmas über der Zyste. Der Schnitt wird möglichst in eine Hautfalte und mindestens 2 Querfinger unterhalb der Mandibula gelegt. Bei der Präparation des oberen Haut-Platysma-Lappens ist auf die Schonung des R. marginalis des N. facialis zu achten. Ein Nerven-Monitoring kann hier sehr hilfreich sein (s. Kap. 7.3 „Intraoperatives Monitoring“). Dann erfolgen die Darstellung des Vorderrands des M. sternocleidomastoideus und die Inzision der Faszie längs des Vorderrands. Eventuell müssen die Vv. jugulares externa und anterior durchtrennt und unterbunden werden. Unter sowohl stumpfer als auch scharfer Präparation wird die Zyste dann vorsichtig von der medialen Seite des M. sternocleidomastoideus 725 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Vorderrand des M. sternocleidomastoideus 14 Hals, Schilddrüse und Ösophagus ................................................................................. Lig. stylohyoideum N. glossopharyngeus Abb. 14.34 Anatomische Beziehungen einer lateralen Halsfistel des 2. Kiemenbogensegments zu wichtigen Gefäß- und Nervenbahnen des Halses. N. hypoglossus N. laryngeus superior Ramus internus des N. laryngeus superior Spezielle HNO‑Erkrankungen und ihre Therapie Ramus externus des N. laryngeus superior Lig. stylohyoideum N. glossopharyngeus Abb. 14.35 Anatomische Beziehungen einer lateralen Halsfistel des 3. Kiemenbogensegments zu wichtigen Gefäß- und Nervenbahnen des Halses. N. hypoglossus N. laryngeus superior Ramus internus des N. laryngeus superior Ramus externus des N. laryngeus superior Hautinsel mit Fistelöffnung abpräpariert. Hierbei ist auf die Schonung des N. accessorius zu achten. Bei der Präparation sollte die Zyste möglichst nicht eröffnet werden. Auch medial wird die Zyste präpariert. Dabei wird die V. facialis dargestellt, die nur selten durchtrennt werden muss. In der Tiefe unter der Zyste befindet sich das Gefäß-Nerven-Bündel des Halses mit V. jugularis interna, N. vagus, A. carotis communis bzw. Aa. carotis externa und interna und dem lateral der Karotisgabel kreuzenden N. hypoglossus. Die Schicht zwischen Zyste und hinterem Bauch des M. digastricus sowie des M. stylohyoideus wird überwiegend stumpf präpariert. Bei der Präparation der kranialen Ausdehnung der Zyste werden gewöhnlich der N. hypoglossus und der N. glossopharyngeus dargestellt. Ein Gangsystem findet sich nicht. Entfernung lateraler Halsfisteln Operationstechnik. Abb. 14.34 zeigt die Beziehungen einer lateralen Halsfistel des 2. Kiemenbogensegments zu den wichtigen Gefäß- und Nervenbahnen des Halses, Abb. 14.35 diejenigen von Fistelgängen des 3. Kiemenbogensegments. 726 Zunächst muss um die Fistelöffnung herum eine kleine Hautinsel mitexzidiert werden. Der Fistelgang wird dann nach kranial verfolgt und freigelegt. Häufig ist zur weiteren Verfolgung des Fistelgangs eine 2., weiter kranial lokalisierte Hautinzision erforderlich (Abb. 14.36). Erstreckt sich der Gang in die Tonsillenregion, erfolgt die Tonsillektomie. Auch bei der Operation von Halsfisteln und ihren Gängen müssen alle wichtigen Gefäß- und Nervenleitungsbahnen des Halses geschont werden (Abb. 14.34, 14.35). Am Ende der Operation werden eine Redon-Drainage eingelegt, das Subkutangewebe mit dem Platysma adaptiert, die Haut verschlossen und ein steriler Verband angelegt. Prognose und Nachbehandlung. Die Rezidivrate liegt bei etwa 3%, bei Revisionen steigt sie bis 20 %. Die Risiken des Eingriffs ergeben sich durch die benachbarten anatomischen Strukturen, die mögliche Komplikationen des Eingriffs erklären (Aa. carotis communis, interna und externa, V. jugularis interna, N. hypoglossus, N. glossopharyngeus, N. laryngeus superior und N. accessorius). Die präoperative Aufklärung muss daher diese Aspekte neben den allge- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Hautinsel mit Fistelöffnung ........................................................... Chirurgische Therapie ......... meinen Operationsrisiken besonders berücksichtigen. Normalerweise ist präoperativ nur eine Single-Shot-Antibiotikaprophylaxe mit einem Zephalosporin der 2. Generation erforderlich. Die Redon-Drainage wird entfernt, wenn sie nur noch geringe Mengen Wundsekret fördert, gewöhnlich am 2. oder 3. postoperativen Tag. Es empfiehlt sich, selbstlösende Fäden zu benutzen. Kongenitale Fehlbildungen des 1. Kiemenbogengangs (Gehörgangsduplikaturen, Ohr-Hals-Fisteln). Diese sind sehr viel seltener als die des 2. und 3. Kiemenbogengangs (weniger als 1 % aller branchiogenen Fehlbildungen). TypI‑Fehlbildungen (nach Work) bestehen nur aus epidermoiden Anteilen. Sie zeigen sich als Duplikaturen des Gehörgangs und kommen dem N. facialis sehr nahe. TypII‑Fehlbildungen des 1. Kiemenbogensegments sind etwas häufiger und enthalten ekto- und mesodermale Anteile. Klinisch treten sie meist als rezidivierende Abszesse in der Kieferwinkelregion auf. Sie ziehen durch die Glandula parotidea medial oder lateral am N. facialis vorbei und enden unterhalb des äußeren Gehörgangs oder im äußeren Gehörgang am Übergang vom knöchernen zum kartilaginösen Abschnitt. Keiner der beiden Typen hat eine Verbindung zum Trommelfell oder zum Mittelohr selbst. Zu ihrer kompletten Entfernung ist eine partielle Parotidektomie mit Darstellung des N. facialis notwendig (s. S. 327 f). Zur Vermeidung von Rezidiven ist eine komplette Entfernung erforderlich. Operationstechnik. Jede mediale Halszyste bzw. ‑fistel sollte operativ entfernt werden. Im infizierten Stadium ist zunächst eine antibiotische Therapie indiziert. Die Operation wird in Intubationsnarkose durchgeführt. Es erfolgt über der Schwellung eine horizontale Hautinzision. Eventuell vorhandene Fistelöffnungen werden umschnitten und mit einer Hautspindel exzidiert. Haut- und Subkutangewebe werden nach oben und unten präpariert. Die infrahyoidale Muskulatur wird zur Seite präpariert und die Zyste dargestellt. Gelegentlich besteht eine Verbindung zum Lobus pyramidalis der Schilddrüse, die durchtrennt wird. Die Zyste wird dann, falls erforderlich, vom Larynx und der Membrana thyrohyoidea freipräpariert, so dass sie nach oben geschlagen werden kann. Das Zungenbein wird häufig vom Zystengang durchzogen, oder der Gang ist am Zungenbein adhärent. Daher muss zur Vermeidung von Rezidiven der mittlere Teil des Zungenbeins immer mitexzidiert werden. Manchmal besteht ein durchgängiger Gang bis zum Foramen caecum in der Vallekula. Nach Darstellung des Ganges wird die Muskulatur am Oberrand des Zungenbeins mit dem elektrischen Messer abgetrennt. Dabei darf das Zungenbein nicht so weit herausgelöst werden, dass ein Zystengang, der zum Foramen caecum zieht, durchtrennt wird und deshalb nicht mehr weiter präpariert werden kann. Mit einer Knochenschere wird der Mittelteil des Zungenbeins von den beiden lateralen Anteilen Abb. 14.36 Strickleiterförmige Hautinzisionen und spindelförmige Umschneidung des Fistelmauls einer lateralen Halsfistel links. getrennt. Dieser Teil wird anschließend von der Membrana thyrohyoidea abgetrennt. Hierbei ist wieder darauf zu achten, dass ein zum Zungengrund ziehender Gang nicht übersehen wird. Falls vorhanden, wird ein solcher Gang bis zum Zungengrund verfolgt und mit der Schleimhaut des Foramen caecum ausgeschnitten. Die Öffnung in der Pharynxwand kann mit resorbierbarem Nahtmaterial verschlossen werden. Beim Wundverschluss wird die Muskulatur adaptiert. Die beiden lateralen Zungenbeinanteile werden nicht approximiert. Eine Redon-Drainage wird eingelegt. Subkutangewebe mit Platysma und Haut werden verschlossen (Abb. 14.37 und Abb. 14.38). Risiken und Komplikationen. Spezifische Operationsrisiken und Komplikationen sind Blutungen, Fistelbildung zum Pharynx und Wundinfektionen. Cave: Bildet sich postoperativ ein Hämatom aus, kann eine Intubation unmöglich und eine Koniotomie notwendig sein. Intraoperativ können der R. internus des N. laryngeus superior und der N. hypoglossus verletzt werden. 727 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Mediale Halszysten und mediale Halsfisteln 14 14 Hals, Schilddrüse und Ösophagus Abb. 14.37 Hautinzision bei medialer Halszyste. Os hyoideum M. mylohyoideus Membrana thyrohyoidea In den letzten Jahren hat die Laserbehandlung bei Hämangiomen immer mehr an Bedeutung gewonnen. Es wurden dabei verschiedene Lasersysteme, wie CO2-, Farbstoff-, KTP-, Argon-, Dioden- und Nd : YAG‑Laser, erfolgreich eingesetzt. Die Wahl des am besten geeigneten Lasersystems wird durch dessen biophysikalische Wirkung am Gewebe, aber auch von der Größe und Beschaffenheit des Hämangioms bestimmt. Somit kommt der Erfahrung des behandelnden Arztes eine große Bedeutung zu. Oberflächliche Prozesse können sehr zufriedenstellend mit einem gepulsten Farbstofflaser behandelt werden. Für größere und tiefer liegende Hämangiome hat sich der Nd : YAG‑Laser bewährt, dessen Licht mit einer Wellenlänge von 1064 nm über flexible Lichtleiter auch intraläsional appliziert werden kann. Die Eindringtiefe in das Gewebe beträgt 6 – 10 mm. Bei voluminösen Hämangiomen erfolgt die Laserlichtapplikation sonografisch kontrolliert. Lymphangiome Die Therapie der Wahl ist die frühzeitige chirurgische Resektion unter Einsatz mikrochirurgischer Techniken. Bei der Operation sollte in jedem Fall eine komplette Exstirpation unter Schonung umgebender Strukturen angestrebt werden. Dabei ist zu beachten, dass die präoperativen bildgebenden Verfahren häufig die Ausdehnung der Lymphangiome nicht richtig einschätzen lassen. Glomus-caroticum-Tumoren Schildknorpel Zyste Abb. 14.38 Zystengang Anatomische Verhältnisse bei medialer Halszyste. Chirurgie der Gefäßanomalien Hämangiome Bei kleinen, oberflächlichen und nicht proliferierend wachsenden Hämangiomen ist zunächst eine „Wait-andsee“-Stategie die Vorgehensweise der Wahl, da sich viele angeborene Hämangiome spontan zurückbilden. Allerdings muss stets eine regelmäßige und engmaschige Befundkontrolle mit objektivierbarer Bilddokumentation durchgeführt werden. Bei plötzlich einsetzendem und schnellem Wachstum, bei Blutungen oder wiederholten Infektionen ist, abhängig von Lokalisation, Größe und Tiefenausdehnung der Läsion, eines der folgenden Therapieverfahren angezeigt (s. S. 683): l Kryotherapie l medikamentöse Therapie (Kortison, β‑Blocker, Interferon) l Embolisation l konventionell-chirurgische Resektion l Lasertherapie 728 Das Glomus caroticum liegt an der Teilungsstelle der A. carotis communis in A. carotis interna und externa. Klinisch manifestieren sich Tumoren des Glomus caroticum als langsam wachsende Schwellungen am Hals. Wie bereits erwähnt, zeigt sich in der Ultraschalluntersuchung ein charakteristisches Bild mit einem Auseinanderspreizen von A. carotis interna und externa. Die chirurgische Entfernung mit Erhalt der Kontinuität der Arterie ist die Methode der Wahl. Falls erforderlich, muss eine Gefäßplastik durchgeführt werden. Die operative Therapie sollte so früh wie möglich angestrebt werden, da kleinere Tumoren leichter als größere zu entfernen sind. Während des Wachstums werden wichtige nervale Strukturen vom Tumor nicht nur verschoben, sondern auch umwachsen. Bei einer Ausdehnung sehr weit nach kranial wird die Zugänglichkeit im Bereich des Kieferwinkels erschwert. Gefäßplastiken sollten nur dann durchgeführt werden, wenn die Tumoren nicht von der Wand der A. carotis abpräpariert werden können. In jedem Fall müssen die dafür notwendigen Instrumente vorhanden und ggf. die Kooperation mit einem Gefäßchirurgen möglich sein. Bei der Operation ist auf eine ausreichende Darstellung der Gefäße proximal und distal des Tumors zu achten. Eine präoperative Embolisation ist anzustreben. Operationstechnik. Der Hautschnitt verläuft 2 Querfinger unterhalb der Mandibula. Bei der Präparation der HautPlatysma-Lappen ist besonders auf Schonung und Erhal- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... Risiken und Komplikationen. In der Hand eines geübten Chirurgen ist die operative Entfernung eines einseitigen Glomus-caroticum-Tumors eine sichere Operation mit kompletter Tumorentfernung in 96 – 98 % der Fälle. Die Hauptrisiken der operativen Tumorentfernung sind starke Blutungen infolge von Gefäßverletzungen und die Schädigung von Hirnnerven. Das Risiko einer Verletzung der A. carotis communis oder interna steht in unmittelbarem Zusammenhang mit der Tumorgröße. Die häufigsten Komplikationen nach Resektion von Glomus-caroticumTumoren sind jedoch Fehlfunktionen von Hirnnerven, die mit Raten zwischen 10 und 40% angegeben werden. Am häufigsten ist der N. hypoglossus betroffen. Zur Vermeidung von Hirnnervenläsionen wird empfohlen, vor der eigentlichen Tumorresektion die Hirnnerven kranial des Tumors darzustellen und zu identifizieren. Eine präoperative Embolisation mit Polyvinylalkoholpartikeln kann Blutungen reduzieren und somit die Operation erleichtern. Während bei einseitigen Glomus-caroticum-Tumoren die chirurgische Entfernung als Therapie der Wahl anerkannt ist, ist die Behandlung bilateraler Glomus-caroticum-Tumoren oder einseitiger Glomustumoren mit einem kontralateralen Glomus-vagale-Tumor problematischer. Durch eine beidseitige Operation ist die Möglichkeit von beidseitigen Hirnnervenschädigungen, insbesondere N. hypoglossus Tumor ......... N. vagus 14 A. carotis communis V. jugularis interna Abb. 14.39 Anatomische Verhältnisse bei Glomus-caroticumTumor links. einer beidseitigen Parese des N. vagus, gegeben. Kommt es bei einer einseitigen Operation zu einer Vagusparese, so sollte bei der Gegenseite eine Strahlentherapie in Erwägung gezogen werden. Eine weitere mögliche Komplikation einer beidseitigen Entfernung von Glomus-caroticum-Tumoren ist die fehlende Funktion der Barorezeptoren in der Karotisgabel, die Blutdruckregulationsstörungen mit schweren hyper- oder hypotensiven Krisen verursachen kann. Des Weiteren wurden Kopfschmerzen und emotionale Instabilität beobachtet. Strahlentherapie. Die Wirksamkeit einer Strahlentherapie bei Glomus-caroticum-Tumoren ist ähnlich wie bei anderen Paragangliomen. Die notwendige Strahlendosis wird mit 40 – 55 Gray angegeben. Chirurgie parapharyngealer Tumoren Tumoren des parapharyngealen Raumes können aus ortsständigem Gewebe entstehen, tumoröse Raumforderungen von Nachbarstrukturen können sich in den Parapharyngealraum ausdehnen, und in seltenen Fällen kann es sich um metastatische Absiedelungen handeln. Die wichtigsten gut- und bösartigen Tumoren des parapharyngealen Raums sind in Tab. 14.13 aufgeführt. In knapp der Hälfte der Fälle handelt es sich um Speicheldrüsentumo729 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. tung des R. marginalis des N. facialis zu achten. Nach Darstellung des Vorderrands des M. sternocleidomastoideus erfolgt die des Gefäß-Nerven-Bündels. Die V. jugularis interna wird nach hinten verlagert; anschließend werden der Tumor, die anliegenden Karotisgefäße sowie der N. vagus dargestellt. Oberhalb und unterhalb des Tumors können die Gefäße jetzt angeschlungen werden, um bei starken Blutungen kurzfristig die Blutzufuhr drosseln bzw. ganz unterbrechen zu können. Der Tumor wird nun vorsichtig und sorgfältig von den umgebenden Strukturen freipräpariert. Dabei ist auf den Erhalt des N. vagus, des N. laryngeus superior mit seinen Ästen sowie der sympathischen Nervenkette zu achten. Der N. hypoglossus wird vom Tumor gewöhnlich verlagert (Abb. 14.39). Bei größeren Tumoren treten häufig Verlagerungen weiterer Nerven auf, die dann ebenfalls den N. accessorius und möglicherweise auch den N. glossopharyngeus betreffen. Die Trennung von Tumor und Gefäß erfolgt in einer Ebene zwischen Adventitia und Media der Gefäßwand. Dabei sollte zunächst von hinten lateral der Tumoranteil präpariert werden, der in der Wand der A. carotis interna und A. carotis communis liegt. Die A. carotis externa bzw. ihre Äste können ggf. geopfert werden. Bei diesem Operationsschritt hat sich die Zuhilfenahme des Operationsmikroskops bewährt. Sollte sich herausstellen, dass eine Tumorentfernung ohne Eröffnung des Gefäßes nicht möglich ist oder es bei der Präparation zu einem Einriss des Gefäßes kommt, muss in Zusammenarbeit mit einem Gefäßchirurgen eine Gefäßplastik durchgeführt werden. Nach vollständiger Tumorentfernung erfolgen die sorgfältige Kontrolle der Blutstillung, die Einlage einer RedonDrainage sowie der Wundverschluss. Chirurgische Therapie 14 Hals, Schilddrüse und Ösophagus ................................................................................. Differenzialdiagnosen parapharyngealer Tumoren. Pathologische Veränderungen Häufigkeit in % Tumoren der Speicheldrüsen 40 – 50 neurogene Tumoren Lymphknotentumoren verschiedene von Muskel- und Bindegewebe ausgehende Tumoren 20 – 25 15 l Glandula parotidea l pleomorphe Adenome l maligne Tumoren l kleine Speicheldrüsen l ektopisches Speicheldrüsengewebe im parapharyngealen Raum l kleine Speicheldrüsen der Pharynxwand l Neurinome l Neurofibrome l Glomus-vagale-Tumoren l primär: Lymphome l sekundär: Metastasen l Rhabdomyome l Leiomyome l Rhabdomyosarkome l Lipome l Fibrome Meningeome angeborene Veränderungen Verschiedenes l Halszysten l Dermoidzysten l Hämangiome l AV‑Malformationen l Abszesse l inflammatorische Pseudotumoren l Aneurysmen l maligne Tumoren, die aus der Nachbarschaft übergreifen l Fernmetastasen maligner Tumoren ren, die ihren Ursprung vom tiefen Lappen der Glandula parotidea nehmen. Auch die kleinen Speicheldrüsen des Pharynx oder ektopes Speicheldrüsengewebe können Ausgangspunkt von gut- und bösartigen Tumoren im parapharyngealen Raum sein (Abb. 14.40). Am zweithäuftigsten treten neurogene Tumoren auf. Es handelt sich meist um Schwannome, die im retrostylohyoidalen Raum von den Hirnnerven IX – XII oder vom sympathischen Nervenstrang ausgehen. In ca. 50 % der Fälle ist der N. vagus der Ursprungsnerv. Ihre Behandlung besteht in der Enukleation, wenn möglich, mit Erhalt des betroffenen Hirnnervs. Vagale Paragangliome sind die häufigsten Paragangliome des parapharyngealen Raumes. Differenzialdiagnostisch müssen auch entzündliche Pseudotumoren und Aneurysmen sowie andere seltene Erkrankungen in Erwägung gezogen werden. 730 Abb. 14.40 MRT eines mehrteiligen pleomorphen Adenoms des parapharyngealen Raums links. Anatomie des parapharyngealen Raums. Zum besseren Verständnis des Tumorwachstums und operativer Maßnahmen ist eine genaue Kenntnis der Anatomie des parapharyngealen Raumes erforderlich. Der parapharyngeale Raum ist ein hypothetischer Raum mit der Form einer umgekehrten Pyramide, die lateral des Pharynx liegt. Ihre Spitze liegt am großen Horn des Zungenbeins, die Basis an der Schädelbasis. Die obere Begrenzung ist das Felsenbein; nach hinten bildet die Fascia praevertebralis die Grenze, nach lateral die Faszie des M. pterygoideus medialis, der aufsteigende Unterkieferast und der tiefe Lappen der Glandula parotidea. Die genannten anatomischen Strukturen sind relativ fest und begrenzen dadurch ein Tumorwachstum mit Ausnahme der medialen Wand, die an den Pharynx grenzt. Genauer handelt es sich um die Faszie des M. tensor veli palatini, des M. constrictor pharyngis superior, des M. styloglossus und des M. stylopharyngeus. Durch den Processus styloideus und die von dort ausgehende Faszie zum M. tensor veli palatini wird der parapharyngeale Raum in ein prästyloidales und ein retrostyloidales Kompartiment unterteilt. Der prästyloidale Raum enthält nur Fett und unterschiedliche Anteile des retromandibulären tiefen Lappens der Glandula parotidea. Daher finden sich in diesem Raum nur Glandula-parotideaTumoren, Lipome und selten neurogene Tumoren. Der retrostyloidale Raum enthält die A. carotis interna und die V. jugularis interna sowie die Hirnnerven IX – XII, Fasern des sympathischen Nervenstrangs und Lymphknoten. Dieses Kompartiment wird vom retropharyngealen Raum nur durch eine dünne Faszie getrennt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie Tabelle 14.13 ........................................................... Chirurgische Therapie Operative Zugangswege. Es stehen 3 operative Zugangswege zur Verfügung: l Der am häufigsten angewendete ist der transzervikale Zugang. l Der intraorale, transpharyngeale Zugang eignet sich für umschriebene, mehr medial gelegene Tumoren. l Tumoren des tiefen Parotislappens werden am besten über einen transparotidealen Zugang mit Darstellung des N. facialis entfernt. Der Tumor wird medial der Nervenäste präpariert und zwischen Nervenästen hindurch entfernt. Neck Dissection Anatomische Vorbemerkungen Um im Rahmen einer Neck Dissection Wundheilungsstörungen und Hautnekrosen mit nachfolgenden Komplikationen zu vermeiden, ist es wichtig, ausreichende Kenntnisse über die Durchblutung der Halshaut zu haben. Die Haut im anterolateralen Bereich des Halses wird aus Ästen der A. facialis, A. submentalis und A. occipitalis mit absteigenden Ästen versorgt, sowie über die Aa. cervicalis trans- 14 hinterer Bauch des M. digastricus N. hypoglossus N. vagus Glandula submandibularis Abb. 14.41 Transzervikaler Zugang zum parapharyngealen Raum (Pfeil). A. und V. facialis werden durchtrennt. versa und suprascapularis mit aufsteigenden Ästen (Abb. 14.42). Diese arteriellen Gefäße ziehen durch das Platysma und bilden dann ein oberflächliches Gefäßnetzwerk, das hauptsächlich in vertikaler Richtung verläuft. Obwohl einige der Hauptarterien bei der Neck Dissection durchtrennt werden können, muss der oberflächliche Gefäßplexus erhalten bleiben, um die Hautlappen zu durchbluten. Das Platysma liegt direkt unterhalb des Subkutangewebes und bildet daher eine ideale Schicht, unter der die Haut-Platysma-Lappen präpariert werden können. Ist aus onkologischer Sicht die Erhaltung des Platysmas nicht möglich, wird in einer oberflächlichen Schicht oberhalb des Muskels präpariert. Im unteren vorderen und im hinteren oberen Halsanteil ist das Platysma häufig nicht oder sehr dünn ausgebildet, so dass im subkutanen Gewebe eine entsprechende Schicht präpariert werden muss. Am hinteren oberen Rand des Platysmas liegen häufig die V. jugularis externa und der N. auricularis magnus. Werden die Lymphknoten des submandibulären Dreiecks mit ausgeräumt, kann es erforderlich sein, den R. marginalis mandibulae des N. facialis darzustellen, um ihn sicher zu schonen. Der Nerv kann unmittelbar am Kieferwinkel identifiziert werden, wenn die oberflächliche Schicht der tiefen Halsfaszie parallel zum Verlauf des Nervs direkt oberhalb der Drüse inzidiert wird (s. S. 595 f). Der Nerv verläuft medial der Faszie, aber lateral der V. facialis. Die submandibulären retrovaskulären Lymphknoten liegen gewöhnlich in der Nähe des Nervs und müssen sorgfältig präpariert werden. Dabei werden A. und V. facialis dargestellt und ggf. durchtrennt. 731 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Operationstechnik. Für den transzervikalen Zugang wird eine Hautinzision etwa 2 Querfinger unterhalb der Mandibula in einer Hautfalte gelegt. Haut, Subkutangewebe und Platysma werden durchtrennt und der R. marginalis mandibulae des N. facialis dargestellt und geschont. Normalerweise müssen A. und V. facialis dargestellt, durchtrennt und unterbunden werden. Die Glandula submandibularis wird nach vorne verlagert. Oberhalb des M. digastricus kann in den parapharyngealen Raum eingegangen werden (Abb. 14.41). Dies wird erleichtert, indem der Processus styloideus durchtrennt wird. Die folgende Präparation hängt von der Art des Tumors ab: So können Tumoren der kleinen Speicheldrüsen gewöhnlich stumpf präpariert und entfernt werden. Ebenso können Neurinome der Hirnnerven IX – XII auf diesem Wege durch intrakapsuläre Enukleation ausgeräumt werden, wobei manchmal sogar die Nervenfunktion erhalten werden kann. Bei Tumoren des tiefen Lappens der Glandula parotidea erlaubt der Zugang leicht die Kombination mit einer partiellen Parotidektomie. Bei größeren Tumoren kann der Zugang durch eine paramediane Durchtrennung und Lateralverlagerung der Mandibula erweitert werden. Paragangliome des N. vagus können über diesen Zugang in Kombination mit einem transmastoidalen Zugang und, falls erforderlich, auch mit einem subokzipitalen Zugang angegangen werden. Neben möglichen vaskulären Komplikationen liegen die Hauptkomplikationen dieser Operation in Funktionsstörungen der Hirnnerven VII, IX, X und XII. Besonders schwerwiegend sind Funktionsstörungen des N. vagus, wenn dieser oberhalb des Ganglion nodosum verletzt wurde, weil dann die pharyngealen Äste und der N. laryngeus superior betroffen sind, was zu Dysphagie und Dysphonie führt. ......... 14 Hals, Schilddrüse und Ösophagus A. occipitalis I II A. facialis III VI IV V A. transversa cervicis A. suprascapularis Abb. 14.42 Hautversorgende Gefäße des Halses. Zwischen diesen Gefäßen besteht oberhalb des Platysmas ein Gefäßnetzwerk mit hauptsächlich vertikaler Verlaufsrichtung. Abb. 14.43 Schematische Darstellung der Einteilung des Halses in 6 lymphknotenhaltige Gebiete (Level). Unterhalb des Foramen jugulare verläuft der R. externus des N. accessorius, medial von M. digastricus und M. stylohyoideus und lateral oder hinter der V. jugularis interna. Danach zieht er schräg nach unten und hinten zur medialen Fläche des M. sternocleidomastoideus. Er erreicht ihn in etwa am unteren Ende des oberen Drittels des Muskels. Meist zieht der Nerv dann durch den Muskel zu dessen Hinterrand, wo er in der Regel etwa 1 cm oberhalb des Erb-Punkts zur Darstellung kommt. Von hier aus verläuft er durch das hintere Halsdreieck zum Vorderrand des M. trapezius. An der Muskelunterfläche zieht er gewöhnlich weiter und muss auch hier dargestellt werden. Vorsicht ist bei der Präparation am Hinterrand des M. sternocleidomastoideus geboten, da der Nerv hier sehr oberflächlich verlaufen kann. Dies ist auch bei der Präparation einzelner Lymphknoten in diesem Gebiet zu beachten (Nerven-Monitoring!). Der Ductus thoracicus verläuft im unteren Halsbereich auf der linken Seite medial und hinter der A. carotis communis und dem N. vagus. Von hier zieht er bogenförmig nach oben, vorne und lateral, hinter der V. jugularis und vor dem M. scalenus anterior und dem N. phrenicus. Dann mündet er in die V. jugularis interna, die V. subclavia oder den Venenwinkel. Der Ductus thoracicus liegt vor dem Truncus cervicalis und der A. cervicalis transversa. Der Ductus thoracicus kann auch in mehrere kleinere Gefäße aufgeteilt in die verschiedenen Venen münden; er erhält gewöhnlich juguläre und subklavikuläre sowie weitere kleinere lymphatische Zuflüsse, die sorgfältig unterbunden werden müssen. Durch die große Variabilität des terminalen Anteils des Ductus thoracicus besteht die Gefahr der Ausbildung einer Chylusfistel. 732 Nomenklatur der Halslymphknoten. Der Hals wird entsprechend der Klassification des Committee for Neck Dissection Classification der American Head and Neck Society in 6 3-dimensionale lymphknotenhaltige Gebiete (Level) unterteilt (Abb. 14.43). Die oberflächliche Begrenzung wird durch das oberflächliche Blatt der tiefen Halsfaszie unterhalb des Platysma gebildet. Die tiefe Begrenzung besteht aus der Fascia praevertebralis und dem mittleren Blatt der tiefen Halsfaszie, die die viszeralen Teile des oberen Aerodigestivtrakts umgibt. l Level I (submentale und submandibuläre Lymphknoten): Er wird begrenzt durch den Unterkiefer, den hinteren Bauch des M. digastricus, das Zungenbein und die Mittellinie. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... l l l l Level II (obere juguläre Lymphknoten): Er dehnt sich vom Zungenbein und der Karotisbifurkation nach oben bis zur Schädelbasis aus; in anterior-posteriorer Richtung reicht er von der Sehne des M. digastricus bis zum Hinterrand des M. sternocleidomastoideus. Level III (mittlere juguläre Gruppe): Er reicht von der Oberkante des Schildknorpels und der unteren Begrenzung des Levels II zwischen Hinterkante des M. omohyoideus und Hinterkante des M. sternocleidomastoideus nach unten bis in Höhe des Ringknorpels. Level IV (untere juguläre Gruppe): Dieser liegt zwischen M. sternohyoideus und dem Hinterrand des M. sternocleidomastoideus, unterhalb des Levels III bis zur oberen Thoraxapertur. Level V (hinteres Halsdreieck): Er wird begrenzt durch die Hinterkante des M. sternocleidomastoideus, den Vorderrand des M. trapezius und die Klavikula. Level VI (vorderes Halsdreieck): Er dehnt sich zwischen den medialen Begrenzungen der Gefäß-Nerven-Scheide beidseits aus und wird oben durch das Zungenbein und unten durch Klavikula und Sternum begrenzt. Zu diesen 6 Lymphknotengruppen kommen noch die retroaurikulären und subokzipitalen Lymphknotengruppen hinzu, außerdem die parotidealen sowie die retropharyngealen Lymphknoten. Klassifikation der Halslymphknotenmetastasen In Abb. 14.44 sind die vorwiegenden Metastasierungsrichtungen des initialen lymphogenen Metastasierungsverhaltens von Karzinomen unterschiedlicher Lokalisation dargestellt. Neben der Tumorgröße (T Stadium) sollte bei allen Patienten mit malignen Tumoren der Kopf-Hals-Region eine Einordnung möglicher zervikaler Lymphknotenmetastasen nach der TNM‑Klassifikation erfolgen. Am Hals besteht dabei folgende Einteilung: l Nx: regionäre Lymphknoten nicht untersuchbar oder noch nicht untersucht l N0: keine regionären Lymphknoten l N1: Metastase in einem einzelnen ipsilateralen Halslymphknoten; größter Durchmesser < 3 cm l N2: l N2a: Metastase in einem einzelnen ipsilateralen Lymphknoten mit größtem Durchmesser zwischen 3 und 6 cm l N2b: multiple ipsilaterale Lymphknoten mit weniger als 6 cm Durchmesser l N2c: bilaterale oder kontralaterale Lymphknoten, von denen keiner größer als 6 cm im größten Durchmesser ist l N3: Lymphknotenmetastase mit einem Durchmesser von mehr als 6 cm im größten Durchmesser ......... Technik der Neck Dissection Klassifikation l l l Radikale Neck Dissection (RDN): En-Bloc-Resektion der ipsilateralen Lymphknotengruppen der Regionen I – V inklusive des M. sternocleidomastoideus, der V. jugularis interna und des N. accessorius. Wegen der deutlich größeren peri- und postoperativen Morbidität wird diese Operation nur noch selten ausgeführt. Modifiziert-radikale Neck Dissection (MRND): Resektion des lymphknotenhaltigen Gewebes der Level I – V unter Erhalt von N. accessorius und/oder V. jugularis interna und/oder M. sternocleidomastoideus. Je nach Erhalt der genannten Strukturen kann die modifiziertradikale Neck Dissection noch in einen Typ I, II oder III unterteilt werden (Tab. 14.14). Die modizifiert-radikale Neck Dissection beruht auf der Erkenntnis, dass sich die lymphatischen Gewebe innerhalb von abgegrenzten Faszienräumen des Halses befinden und die anderen Gewebe des Halses, wie Muskeln, Blut, Nervengefäße, Aerodigestivtrakt und Glandula thyroidea, von Faszien umgeben und dadurch von den Geweben mit Lymphknoten getrennt sind. Selektive Neck Dissection (SND): Entfernung von Lymphknoten bestimmter Level. Es werden verschiedene Formen der selektiven Neck Dissection unterschieden (Tab. 14.14). Im Vergleich zur radikalen oder auch modifiziert-radikalen Neck Dissection weisen diese Formen eine verminderte Morbidität auf. Zudem werden immunkompetente Lymphknoten erhalten. Weitere Sonderformen der selektiven Neck Dissection im Sinne weiter begrenzter Neck-Dissection-Formen sind Tabelle 14.14 Klassifikation der Neck Dissection. Bezeichnung der Neck Dissection (ND) Ausgeräumte Lymphknotenlevel Radikale ND I–V Erhaltene Strukturen Modifiziert-radikale ND Typ I I–V N. XI Typ II I–V N. XI, VII Typ III I–V N. XI, VII, SCM supraomyohyoidal I – III N. XI, VII, SCM lateral II – IV N. XI, VII, SCM posterolateral II – V N. XI, VII, SCM anterior VI N. XI, VII, SCM anterolateral I – IV N. XI, VII, SCM Selektive ND N. XI = N. accessorius SCM = M. sternocleidomastoideus VII = V. jugularis interna 733 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. l Chirurgische Therapie 14 Hals, Schilddrüse und Ösophagus a b c d e f g h i Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. Abb. 14.44 Schematische Darstellung des vorwiegenden initialen lymphogenen Metastasierungsverhaltens von Karzinomen des Kopf-HalsBereichs. Mit zunehmender Schwärzung steigt die Wahrscheinlichkeit initial betroffener Lymphknotenregionen (nach: Werner 1997). a Unterlippe. b Mundboden. c Vordere ⅔ der Zunge. 734 d Nasopharynx. e Tonsilla palatina. f Zungengrund. g Supraglottis. h Glottis. i Sinus piriformis. möglich. Dazu gehören die submentale Neck Dissection mit Ausräumung des Level I, die suprahyoidale Ausräumung mit Entfernung der Lymphknoten der Level I und II, die Dissektion des vorderen Kompartiments (Level VI) sowie die limitiert-laterale Neck Dissection mit Ausräumung der Level II und III. Auswahl der Neck-Dissection-Technik Die Auswahl der „richtigen“ Art der Neck Dissection wird durch verschiedene Faktoren beeinflusst, wie beispielsweise das Ausmaß der lymphogenen Metastasierung, die Tumorgröße und Lokalisation, durch tumorbiologische Parameter, Allgemeinzustand des Patienten sowie eine eventuelle Vorbehandlung des Halses. Die selektiven Formen der Neck Dissection werden vor allem bei einem N0- oder N1-Hals durchgeführt. Ist bereits eine Metastasierung über mehrere Lymphknotenregionen aufgetreten, so sollte eine antero- oder posterolaterale Neck Dissection vorgenommen werden. Bei Patienten mit einem höheren Risiko für Lymphknotenmetastasen (z. B. Karzinom der Zunge, des Zungengrunds, des posterioren Mundbodens, des Hypopharynx und des supraglottischen Larynx) sollte eine selektive Neck Dissection der primären Metastasierungsstationen ab einem T1-Tumor auch bei klinischem N0-Hals durchgeführt werden. Bei ca. 30 % dieser Patienten liegen bereits okkulte Metastasen, teilweise schon mit extrakapsulärer Ausbreitung, vor, die dann operativ erfasst bzw. entfernt werden. Die selektive Neck Dissection berücksichtigt die Level, die in Abhängigkeit von der Lokalisation des Primärtumors am häufigsten von Metastasen betroffen sind (s. Abb. 14.44). Bei Tumoren der Mundhöhle und des Oropharynx sollten die Level I – III ausgeräumt werden, bei Tumoren der Zunge die Level I – IV, da Metastasen im Level IV hier auch auftreten können, wenn die Level I – III nicht betroffen sind. Metastasen von Kehlkopf und Hypopharynx betreffen zu Beginn meist die Level II – IV; subglottische Tumoren und Karzinome des Sinus piriformis metastasieren auch nach Level VI. Level V sollte bei Patien- a d b Chirurgische Therapie ten mit Tumoren des Nasopharynx und der Haut des hinteren Kopfes sowie des Halses ausgeräumt werden. Eine kontralaterale Neck Dissection ist bei Tumoren mit bilateraler lymphatischer Drainage, wie Mittellinientumoren (Zungengrund, weicher Gaumen, supraglottischer Larynx und mediale Wand des Sinus piriformis), zu diskutieren. Bei Tumoren des äußeren Gehörgangs und des Gesichts ist in Abhängigkeit vom Ultraschallbefund eine laterale Parotidektomie indiziert. Bei Tumoren des Nasopharynx, des weichen Gaumens und der lateralen sowie posterioren Wände des Oro- und Hypopharynx ist auf eine Metastasierung in retropharyngealen Lymphknotengruppen zu achten. Ein Auftreten von Metastasen nach vorheriger Operation und/oder Bestrahlung bedeutet eine Verschlechterung der Prognose. Tumorrezidive scheinen aufgrund tumoraler und/oder wirtsbedingter Faktoren aggressiver zu sein, auch wenn es sich um Lymphknotengewebe in nicht ausreichend behandelten Regionen des Halses handelt. Durch eine Vortherapie können eventuelle biologische Schranken zerstört werden und auch die Durchblutung für eine adjuvante Tumortherapie verschlechtert sein. Daher ist bei Rezidiven eine größere Radikalität erforderlich. Oft müssen Hautanteile mitexzidiert und durch regionale gestielte oder freie Lappen wiederhergestellt werden. Operationstechnik Hautschnitt. Für die Neck Dissection wurde eine Vielzahl von Schnittführungen beschrieben. Die gebräuchlichsten Hautschnitte sind in Abb. 14.45 dargestellt. Die Wahl der Hautschnitte wird durch folgende Faktoren beeinflusst: l Lage der Knoten l Vitalität der Haut-Platysma-Lappen l Protektion der A. carotis l Narben vorhergehender Operationen l Primärtumor l geplante rekonstruktive Maßnahmen l präoperative Bestrahlung l kosmetische Gesichtspunkte Abb. 14.45 Verschiedene Hautschnitte für die Neck Dissection (s. Text). c e 735 ......... 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ........................................................... 14 Hals, Schilddrüse und Ösophagus Es ist der Grundsatz zu berücksichtigen, dass Lappen der Halshaut, die hinten und unten ihre Basis haben, einen schlechteren Blutzufluss aufweisen als Lappen, die medial und medial-superior ihre Basis haben. Die in Abb. 14.45 a abgebildete Schnittführung ergibt einen großen Hautlappen mit einer oben gelegenen Basis. Dieser Hautlappen kann auch kürzer gestaltet werden. Er hat eine gute Durchblutung und ermöglicht eine gute Protektion der A. carotis. Außerdem erlaubt er die Entwicklung eines muskulären Platysmalappens. Die in Abb. 14.45 b gezeigte U‑förmige Schnittführung (sog. Schürzenlappen) von einem Mastoid über den Ringknorpel zum anderen ist zur Durchführung einer beidseitigen Neck Dissection geeignet, vor allem in Kombination mit einer Laryngektomie oder auch Schilddrüsenoperationen. Wenn notwendig, kann zusätzlich ein Entlastungsschnitt nach lateral angelegt werden. Weitere Möglichkeiten der Schnittführung sind in Abb. 14.45 c– e dargestellt. Technik der modifiziert-radikalen Neck Dissection. Im Folgenden wird die Technik der modifiziert-radikalen Neck Dissection mit Erhalt des N. accessorius beschrieben. Nach dem Hautschnitt und der Entwicklung entsprechender Haut-Platysma-Lappen wird die Faszie zunächst entlang des Hinterrands des vorderen Bauches des M. omohyoideus und entlang des Vorderrands des M. sternocleidomastoideus eingeschnitten. Medial vom M. sternocleidomastoideus wird das Gefäß-Nerven-Bündel mit V. jugularis interna, A. carotis communis und N. vagus dargestellt. Anschließend wird die mediale Faszie des M. sternocleidomastoideus an dessen Unterseite präpariert und der Muskel unterminiert. Nach vollständiger Unterminierung des Muskels kann dieser mit dem elektrischen Messer etwa 1,5 – 2 cm oberhalb der Klavikula durchtrennt werden. Anschließend wird das Fettbindegewebe von lateral her bis auf die Faszie der Skalenusmuskulatur durchtrennt. Unter dieser Faszie verläuft der N. phrenicus, der geschont wird. Die Äste der A. transversa colli können unterbunden werden. Der obere Pol der Schilddrüse und die Ansa des N. hypoglossus bilden die mediale Begrenzung der Präparation. Medial ist auch darauf zu achten, dass der Ductus thoracicus auf der linken Seite und der Ductus accessorius auf der rechten Seite nicht verletzt werden. Sie liegen hinter dem Gefäß-Nerven-Bündel und ziehen meist bogenförmig von hinten in die Region des Zusammenflusses von V. jugularis interna und V. subclavia. Anschließend werden V. jugularis interna, A. carotis communis und N. vagus dargestellt und die V. jugularis interna nach doppelter Ligatur durchtrennt und unterbunden. Dabei ist sorgfältig auf die sichere Trennung des N. vagus von der Vene zu achten. Mit einem Haken wird die A. carotis communis etwas nach anterior und medial verlagert, und es erfolgt die Darstellung des Truncus sympathicus sowie die Präparation des Fettbindegewebes inklusive der V. jugularis interna auf der tiefen Halsfaszie und entlang der A. carotis nach kranial. Der obere Bauch des M. omohyoideus wird durchtrennt; nach hinten wird die Präparation durch den Vorderrand des M. trapezius 736 begrenzt. Am Hinterrand des M. sternocleidomastoideus, etwa 1 cm oberhalb des Erb-Punkts, kann der N. accessorius dargestellt und durch das Fettbindegewebe nach kaudal verfolgt werden. Nach kranial muss er meist durch den Muskel hindurch und aus dem Fettbindegewebe des Halses herauspräpariert werden. Bei der Präparation nach oben wird darauf geachtet, dass der Plexus brachialis erhalten bleibt, wobei auch die meisten Äste des Plexus cervicalis geschont werden können. Weiter kranial kommt die Karotisbifurkation zur Darstellung. Auch die V. jugularis interna wird weiter nach kranial dargestellt. A. und V. facialis werden in Höhe der Mandibula unterbunden, der R. mandibularis des N. facialis wird dargestellt und möglichst erhalten. Oberhalb der Karotisgabel werden der N. hypoglossus sowie der M. digastricus und der M. stylohyoideus dargestellt. An dieser Stelle kann dann der M. sternocleidomastoideus kranial durchtrennt werden; dabei ist wieder auf den N. accessorius zu achten. Im Anschluss hieran wird die Submandibularloge einschließlich des Fettbindegewebes des submentalen Raumes und der Drüse selbst präpariert. Der N. lingualis und der N. hypoglossus werden identifiziert und erhalten. Der Drüsenausführungsgang und venöse Gefäße werden unterbunden. Bei der weiteren Präparation des Neck-Blocks entlang der A. carotis interna nach kranial werden venöse Zuflüsse zur V. jugularis interna aus der Glandula thyroidea, dem Larynx und der Zunge unterbunden. Dabei wird besonders auf die Schonung des N. hypoglossus geachtet. Ebenso wird der N. laryngeus superior, der medial der A. carotis verläuft, erhalten. Nach hinten stellen sich A. occipitalis und A. auricularis dar und können unterbunden werden. Nach Unterbindung auch des Stammes der A. facialis kurz nach ihrem Abgang aus der A. carotis externa und oberhalb der Sehne des M. digastricus kann jetzt das ganze Fettbindegewebe mit dem M. sternocleidomastoideus nach kranial geschlagen und die V. jugularis interna weiter nach kranial verfolgt werden. Diese wird vom N. accessorius freipräpariert und so weit kranial wie möglich, oberhalb des M. digastricus und zum Foramen jugulare hin präpariert, unterbunden und durchtrennt. Anschließend kann der Neck-Block am noch verbliebenen Gewebe auf der tiefen Halsfaszie abgesetzt werden. Am Ende der Operation erfolgen eine sorgfältige Blutstillung sowie Spülung der Wunde. Die Einlage einer Redon-Drainage sowie eine Subkutan- und Hautnaht beenden den Eingriff. Bei der Einlage der Redon-Drainage ist darauf zu achten, dass diese möglichst nicht die A. carotis berührt, um hier keine mechanischen Alterationen hervorzurufen. Abb. 14.46 zeigt schematisch den Überblick über den Operationssitus nach modifiziert-radikaler Neck Dissection Typ I (Abb. 14.46 a) und modifiziert-radikaler Neck Dissection Typ III (Abb. 14.46 b). Komplikationen Wie bereits oben ausgeführt, sind zur Reduktion operativ bedingter Komplikationen bei der Neck Dissection genaue Kenntnisse zur Halsanatomie erforderlich. Darüber hinaus Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... Komplikationen der Neck Dissection. intraoperative Komplikationen postoperative Komplikationen b Abb. 14.46 l vasovagaler Reflex l Thrombose der V. jugularis interna l Blutungen l Nervenläsionen l Wundheilungsstörungen l Lymphödem l funktionelle Beeinträchtigungen durch Nervenläsionen: l N. hypoglossus l N. accessorius l N. phrenicus l Plexus brachialis l Truncus sympathicus l Chylusfistel/Chylothorax l Ruptur der A. carotis l Visusminderung/Erblindung l endokranieller Druckanstieg 14 Intraoperative Komplikationen Operationsfeld nach Neck Dissection. a Nach modifiziert-radikaler Neck Dissection Typ I. b Nach modifiziert-radikaler Neck Dissection Typ III. sind weitere Faktoren wie Metastasengröße und ‑lokalisation, vorangegangene Strahlentherapie, Diabetes mellitus, Immunsuppression u. Ä. zu beachten und in die Behandlungsplanung einzubeziehen. Die wichtigsten, mit einer Neck Dissection in Zusammenhang stehenden Komplikationen sind in Tab. 14.15 zusammengefasst. ......... Bei den intraoperativen Komplikationen stehen die Verletzungen von Gefäßen im Vordergrund. Die Verletzung großer venöser Gefäße, der V. jugularis interna oder selten auch der V. subclavia, kann einerseits zu einem größeren Blutverlust, andererseits auch zu einer Luftembolie führen. Ist es zu einer Verletzung eines größeren venösen Gefäßes gekommen, so sollte das eröffnete Areal durch sofortige Kompression verschlossen werden. Anschließend erfolgen bei Überdruckbeatmung die weitere Präparation und Versorgung der Gefäßverletzung, möglichst unter Erhalt seiner Kontinuität. Durch Manipulation oder durch Austrocknung besteht die Gefahr der Ausbildung einer Thrombose der V. jugularis interna. Auch Verletzungen größerer arterieller Gefäße können vorkommen, die meist zu einem raschen und erheblichen Blutverlust führen. Äste der A. carotis externa können bei einer Blutung problemlos unterbunden werden. Die A. carotis communis und A. carotis interna sollten jedoch erhalten werden, nötigenfalls in Kooperation mit einem Gefäßchirurgen. Bei einer nicht elektiven Ligatur der A. carotis interna liegt die Rate für einen Apoplex bei über 50 %. Die Präparation im Bulbusbereich der A. carotis ist vorsichtig durchzuführen, da Manipulationen an den Druckrezeptoren zu Herzrhythmusstörungen, Bradykardie und erheblichen Blutdruckschwankungen führen können. Verletzungen des Ductus thoracicus oder sonstiger größerer Lymphgefäße sollten, wenn sie intraoperativ festgestellt werden, direkt durch Ligatur versorgt werden. Häufig werden sie jedoch erst postoperativ bemerkt. Möglich sind auch akzidentelle Verletzungen von Nerven, deren Kontinuität ggf. wiederhergestellt werden sollte. 737 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tabelle 14.15 a Chirurgische Therapie 14 Hals, Schilddrüse und Ösophagus Spezielle HNO‑Erkrankungen und ihre Therapie Postoperative Komplikationen In der direkten postoperativen Phase kann es zu venösen oder arteriellen Nachblutungen kommen, die eine frühzeitige operative Revision erforderlich machen. Wundheilungsstörungen, teilweise mit Ausbildung einer Fistel, oder Nekrosen der Haut-Platysma-Lappen treten vermehrt nach vorangegangener Strahlentherapie oder bei Patienten mit einem schlechten Ernährungszustand oder Diabetes mellitus auf. Besonders gefürchtet ist die Ruptur der A. carotis als letale Komplikation nach radikaler Neck Dissection. Karotis-„Blow-out“-Blutungen entstehen besonders dann, wenn bei einer ausgeprägten Wundheilungsstörung die freiliegende A. carotis mit Speichel benetzt wird. Nach radikaler Neck Dissection liegt das Risiko für das postoperative Auftreten einer Chylusfistel bei 1 – 2 %. Mithilfe einer konservativen Therapie ist in den meisten Fällen eine erfolgreiche Behandlung möglich. Diese beinhaltet eine intravenöse Ernährung, vor allem aber eine konsequente Kompression mittels Druckverband. Kommt es unter den konservativen Maßnahmen nicht zu einem Sistieren der Chylusmenge oder übersteigt gar die tägliche Fördermenge 600 ml, so ist eine chirurgische Revision angezeigt. Ebenfalls in der Folge einer Neck Dissection kann es bei tiefer Präparation bei Verletzung der Pleura zu einem Pneumothorax, bei Verletzung des rechten Ductus thoracicus zu einem bilateralen Chylothorax kommen. Eine entsprechende chirurgische Behandlung mit SaugDrainagen wird dann erforderlich. Die wohl häufigste Spätfolge einer Neck Dissection sind Schulter-/Armschmerzen und Lähmungen infolge des Ausfalls der Funktion oder der Resektion oder akzidentellen Durchtrennung des N. accessorius. Machen sich bei einem Patienten solche Beschwerden bemerkbar, ist eine frühzeitige und langfristige krankengymnastische Behandlung angezeigt. Eine weitere, oft lang anhaltende Komplikation der Neck Dissection sind Lymphödeme, die im Gesicht und am Hals auftreten können. Sie entstehen besonders nach bilateraler Neck Dissection mit beidseitiger Unterbindung der V. jugularis interna, wurden aber auch nach einseitiger Operation beobachtet. Auch eine Zunahme des endokraniellen Drucks mit Kopfschmerzen und Übelkeit ist durch den verminderten venösen Abfluss möglich. Es sollten daher beide V. jugulares internae nicht gleichzeitig entfernt werden. Die genannten Komplikationen werden bei der zunehmend durchgeführten selektiven Neck Dissection erfreulicherweise weniger beobachtet. Literatur Andersen PE, Shah JP, Cambronero E et al. The role of comprehensive neck dissection with preservation of the spinal accessory nerve in the clinically positive neck. Amer J Surg 1994; 168: 499 – 502 Apfelberg DB. Intralesional laser photocoagulation-steroids as an adjunct to surgery for massive hemangiomas and vascular malformations. Ann Plast Surg 1995; 35: 144 – 148 738 Baumann NM, Burke DK, Smith RJ. Treatment of massive or lifethreatening hemangiomas with recombinant alpha(2a)-interferon. Otolaryngol Head Neck Surg 1997; 117: 99 – 110 Clymer MA, Fortune DS, Reinisch L et al. Interstitial Nd:YAG photocoagulation for vascular malformations and hemangiomas in childhood. Arch Otolaryngol 1998; 124: 431 – 436 Davidson BJ, Spiro RH, Patel S et al. Cervical metastases of occult origin: the impact of combined modality therapy. Amer J Surg 1994; 168: 395 – 399 Froehlich P, Stamm D, Floret D et al. Management of subglottic hemangioma. Clin Otolaryngol 1995; 20: 336 – 339 Froehlich P, Seid AB, Morgan A. Contrasting strategic approaches to the management of subglottic hemangiomas. Int J Pediat Otorhinolaryngol 1996; 36: 137 – 146 Gosepath K, Pfeiffer N, Mann W. Die Behandlung kavernöser Hämangiome mit dem Neodymium:YAG‑Laser. Laryngo Rhino 1997; 76: 284 – 288 Hallett JW, Nora JD, Hollier LH et al. Trends in neurovascular complications of surgical management for carotid body and cervical paragangliomas: a fifty-year experience with 153 tumors. J Vasc Surg 1998; 7: 284 – 289 Jacob R, Frommeld T, Maurer J et al. Duplexsonographisch kontrollierte Nd-YAG‑Lasertherapie von Hämangiomen. Ultraschall 1999; 20: 191 – 196 Jackson CG. Basic surgical principles of neurotologic skull base surgery. Laryngoscope 1993; 103 (Suppl. 60): 29 – 44 Langford FP, Moon RE, Stolp BW et al. Treatment of cervical necrotizing fasciitis with hyperbaric oxygen therapy. Otolaryngol Head Neck Surg 1995; 112: 274 – 278 Maran AGD, Amin M, Wilson JA. Radical Neck dissection: A 19year-experience. J Laryngol Otol 1989; 103: 760 – 764 McCaffrey TV, Meyer FB, Michels VV et al. Familial paragangliomas of the head and neck. Arch Otolaryngol 1994; 120: 1211 – 1216 Nussenbaum B, Liu JH, Sinard RJ. Systematic management of chyle fistula: The southwestern experience and review of the literature. Otolaryngol Head Neck Surg 2000; 122: 31 – 38 Pincus RL. Conginental neck masses and cysts. In: Bailey BJ, Johnson JT, eds. Head and Neck Surgery – Otolaryngology. Vol. I. Philadelphia: Lippincott; 1996: 754 – 760 Robbins KT, Denys D, Committee for Neck Dissection Classification, American Head Neck Society. The American Head and Neck Societyʼs revised classification for neck dissection. In: Johnson TT, Shaha AR, eds. Proceedings of the 5th International Conference in Head and Neck Cancer. Madison: Omnipress; 2000: 365 – 371 Werner JA. Aktueller Stand der Versorgung des Lymphabflusses maligner Kopf-Halstumoren. In: Theissing J. Klinik und Therapie in der HNO‑Heilkunde, Kopf- und Halschirurgie im Wandel. Verhandlungsbericht Dtsch. Gesellschaft für HNO‑Heilkunde, Kopf- und Halschirurgie. Berlin: Springer; 1997: 47 – 85 Werner JA, Eivazi B, Folz BJ et al. „State of the Art“ zur Klassifikation, Diagnostik und Therapie von zervikofazialen Hämangiomen und vaskulären Malformationen. Laryngo Rhino Otol 2006; 85: 883 – 891 Woods CI, Strasnick B, Jackson CG. Surgery for glomus tumors: the Otology Group experience. Laryngoscope 1993; 103: 65 – 70 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ................................................................................. ........................................................... Schilddrüse H. J. Neumann Voruntersuchungen Für die Operationsplanung zur chirurgischen Therapie einer Struma sind Voruntersuchungen notwendig, die den pathophysiologischen Befund hinreichend beschreiben: l Strumagröße l Ausdehnung (substernal) l Beziehung zu den Nachbarorganen l Atmung l Dysphagie l laryngologischer Befund l Stoffwechselsituation der Schilddrüse (Laborparameter, medikamentöse Vorbehandlung, Durchblutung, Halslymphknotenschwellung) l Narben durch vorangegangene Operation l ggf. Punktionszytologie Zugang Das Operationsziel besteht in der Beseitigung der morphologischen, funktionellen und onkologischen Veränderungen durch ein morbiditätsarmes Operieren. Der Zugang zum Operationssitus erfolgt über den Kocher-Kragenschnitt. Nach Freilegung der Schilddrüsenkapsel und der perikapsulären Mobilisation der Schilddrüse auf der befunddominanten Seite nach ventral und medial wird zunächst der N. vagus aufgesucht, in dem sich auch die Nervenfasern des N. recurrens befinden. Der N. vagus lässt sich im Bereich der Gefäßscheide zwischen der A. carotis communis und der V. jugularis interna in der Regel problemlos darstellen (Abb. 14.47). Abb. 14.47 Neuromonitoring Wird die Operation unter Anwendung des intraoperativen neurophysiologischen Monitorings durchgeführt, kann bereits in dieser Phase der Operation die Funktionsprüfung des N. recurrens erfolgen. Die Stimulation des N. recurrens über den N. vagus hat den großen Vorteil, dass der gesamte N. recurrens in die Funktionsprüfung einbezogen wird. Damit wird eine wertvolle Verbindung zwischen der topografisch-anatomischen Situation und der Nervenfunktion hergestellt. Die Identifikation des N. recurrens durch das intraoperative neurophysiologische Monitoring ist die konsequenteste Art der Nervendarstellung. Mit der Benutzung einer bipolaren Nadelelektrode, die durch das Lig. cricothyreoidum oder durch den Schildknorpel in den entsprechenden M. vocalis platziert wird, erreicht man für die Erfassung des Summenaktionspotenzials (SAP) eine hohe Sensitivität von 98 – 99%. Bei der Benutzung der Tubuselektroden ist der Komfort bezüglich der Potenzialableitung für den Operateur gegenüber der Nadelelektrode deutlich größer. Der Nachteil der Tubuselektroden besteht derzeit darin, dass das Summenaktionspotenzial, welches als Oberflächenelektromyogramm von der Schleimhaut der Stimmbänder abgeleitet wird, eine deutlich geringere Sensitivität mit ca. 80% zeigt. Die Potenzialhöhe ist gegenüber der Nadelelektrode um den Faktor 5 geringer. Die geringere Sensitivität der Tubuselektrode ist häufig auf eine Deplatzierung der Elektroden im Bereich der Glottis zurückzuführen. Vor der Fixation des Tubus empfiehlt sich deshalb eine endoskopische Kontrolle der Tubuslage. Nach der Mobilisation des Schilddrüsenlappens nach ventral und medial wird der N. recurrens kaudal am unteren Schilddrüsenpol im Bereich der ösophagotrachealen Rinne mit dem intraoperativen neurophysiologischen Monitoring aufgesucht. Hilfreich beim Aufsuchen des N. recurrens ist sein topografischer Verlauf zu den Epithel- Intraoperatives neurophysiologisches Monitoring (IONM). a N. vagus (A. c. c. = A. carotis communis, BE = bipolare Nadelelektrode, Gl.t. = Glandula thyreoidea, N. v. = N. vagus, V. j. i. = V. jugularis interna). ......... b Identifikation des N. recurrens (N. l.rec.) mit IONM durch die protektiven Gewebeschichten. Fensterartige Freilegung. 739 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14.2.2 Chirurgische Therapie 14 Hals, Schilddrüse und Ösophagus Abb. 14.48 Vasa nervorum des N. recurrens. a Langstreckige Freilegung des N. recurrens. b Cave: Glandula thyreoidea (Gl.t.) und faszikulärer N. recurrens (N. r. 1 und 2). des Nervs erforderlich. Langstreckige Freilegungen sollten vermieden werden, um Spätparesen nach ca. 4 – 6 Wochen durch die Narbenbildung zu vermeiden (Abb. 14.48). Rekurrensparese N. recurrens. Der N. recurrens ist mit nahezu 30 verschiedenen anatomischen Variationen in seinem topografischen Verlauf sehr variabel. In der Nachbarschaft der A. thyreoidea inferior besteht für den Nerv ein hohes Verletzungsrisiko, wenn er zwischen ihren Gefäßästen und dem Lig. suspensorium glandulae thyroideae (Lig. Berry) verläuft. Um eine Verletzung des Nervs zu vermeiden, sollten die in die Schilddrüse einstrahlenden Gefäße möglichst kapselnah abgesetzt werden. Eine eindeutige Unterscheidung zwischen Nerv und Gefäßen wird bei blutiger Inhibition des Gewebes durch die auf den Nerv fortgeleiteten arteriellen Pulsationen durch das intraoperative neurophysiologische Monitoring deutlich erleichtert. Abb. 14.49 N. laryngeus non recurrens. körperchen. Die oberen Epithelkörperchen liegen regulär dorsal und die unteren ventral vom Nerv. Unter intraoperativem neurophysiologischem Monitoring mit Sichtschonung des Nervs und der begleitenden, sehr feinen Vasa nervorum wird die Präparation bis zu seiner Einmündung in den Kehlkopf fortgesetzt (Mikrodissektion: Benutzung von optischen Hilfsmitteln wie Lupenbrille oder Operationsmikroskop). Mit dem intraoperativen neurophysiologischen Monitoring können die protektiven Schichten über dem Nerv belassen werden. Für die visuelle Identifikation ist in der Regel nur eine fensterartige Freilegung 740 N. laryngeus non recurrens. In 0,6 – 0,8 % der Fälle wird ein nicht rekurrierender Verlauf des N. laryngeus inferior beschrieben. Diese Verlaufsvariante ist mit dem Vorhandensein einer A. lusoria (Abgangsanomalie der A. subclavia dextra, entspringt aus der Aorta descendens statt aus dem Truncus brachiocephalicus, nimmt einen retrotrachealen aberranten Verlauf) kombiniert und betrifft fast ausschließlich nur die rechte Schilddrüsenseite (Abb. 14.49). Rezidivoperationen. Die Rate an Rekurrensparesen steigt bei Rezidivoperation deutlich an. Verwachsungen des N. recurrens mit der Kapsel des Rezidivs führen zu einer Verlagerung des Nervs nach lateral und, was besonders gefährlich ist, nach ventral – ggf. bis in das Niveau der Tracheavorderwand. Diese erheblichen Veränderungen der topografisch-anatomischen Situation erklären das hohe Verletzungsrisiko. Der Nerv kann zudem sein normales Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... Chirurgische Therapie R. externus des N. laryngeus superior ......... A. thyreoidea superior 1 cm 14 Typ IIa Typ IIb Abb. 14.50 Strumarezidiv mit erheblicher Verlagerung des N. laryngeus recurrens durch Narbenzug. Abb. 14.51 Topografisch-anatomische Beziehung des R. externus des N. laryngeus superior zu den Ästen der A. thyreoidea superior. Aussehen verändern. Damit wird auch die optische Identifikation mit leistungsfähigen Hilfsmitteln erschwert. Nach der Identifikation des Nervs an dem Strumarezidiv sollte eine Neurolyse auch unter optimalen mikrochirurgischen Bedingungen sehr kritisch bewertet werden. Es empfiehlt sich eine Inzision oberhalb der Verwachsung Nerv – Kapsel und ein intrakapsuläres Vorgehen (Abb. 14.50). Abwägung aller Komplikationsmöglichkeiten auf eine Drainage verzichtet werden. R. externus des N. laryngeus superior. Bei der Präparation der oberen Schilddrüsenpole muss der R. externus des N. laryngeus superior geschont werden, um die Funktion des M. cricothyroideus zu erhalten. Der R. externus ist besonders gefährdet, wenn der obere Schilddrüsenpol weit nach kranial reicht (Abb. 14.51). Intraoperativer Signalverlust beim intraoperativen neurophysiologischen Monitoring Tritt intraoperativ ein Signalverlust auf und sind technische und medikamentöse Ursachen (Systemfehler, Relaxation) ausgeschlossen, so muss postoperativ in 40 % der Fälle mit einer passageren und in 12 % mit einer permanenten Rekurrensparese gerechnet werden. Intraoperativ ist zu entscheiden, ob die Operation beendet oder 2-zeitig komplettiert wird, nachdem der laryngologische Befund abgeklärt ist. Es kann sich auch eine andere therapeutische Indikationsstellung ergeben, indem z. B. ein autonomes Adenom auf der Gegenseite radiologisch therapiert werden kann. Die Möglichkeit eines 2-zeitigen operativen Vorgehens sollte vor dem operativen Eingriff mit dem Patienten besprochen werden. Drainagen Redon-Drainagen sollten immer dann verwendet werden, wenn z. B. Hemistrumektomien mit kontralateraler subtotaler Resektion (Dunhill) ausgeführt werden. Erfahrungsgemäß wird ca. 120 ml Wundsekret am 1. postoperativen Tag abgesondert. Die Drainagen müssen so platziert werden, dass sie weder N. recurrens noch Blutgefäße beschädigen. Nur bei einem kleinen Operationssitus kann nach Risiko des postoperativen Hypoparathyreoidismus Zur Schonung der Nebenschilddrüsen müssen sowohl eine direkte Schädigung als auch eine Unterbrechung der Blutversorgung vermieden werden. Die Risikofaktoren für einen frühpostoperativen und permanenten Hypoparathyreoidismus sind abhängig von der Art der Schilddrüsenerkrankung und dem Resektionsausmaß (Odds Ratio [OR]: Verhältnis des Risikos eines postoperativen Hypoparathyreoidismus zu dem eines Struma multinodosa und Schilddrüsenrests; Morbus Basedow: OR 1,7; Rezidivstruma: OR 1,8; Resektionsausmaß Rest 0 ml: OR 5,1). Erscheint die Durchblutung einer Nebenschilddrüse gefährdet, ist eine Autotransplantation in den M. sternocleidomastoideus angezeigt. Eine permanente postoperative Hypokalzämie ist als ernsthafte Komplikation zu werten. Chirurgie von Schilddrüsenkarzinomen Die Primärtherapie als Regeleingriff ist die (totale) Thyreoidektomie mit zentraler Lymphknotendissektion. Sie ist indiziert bei: l papillärem Karzinom mit einem Durchmesser von mehr als 1 cm (ab T2) l multifokalem papillärem Karzinom jeder Größe (jedes T mit Zusatz b) l follikulärem Karzinom l medullärem Karzinom l undifferenziertem Karzinom, sofern kein organüberschreitendes Wachstum vorliegt Ausnahmen: Bei solitärem, papillärem Karzinom mit einem größten Durchmesser von 1 cm oder weniger (pT1a) und fehlendem Hinweis auf Lymphknotenmetastasen ist die Lobektomie oder Hemithyreoidektomie onkologisch adäquat. 741 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Typ I 14 Hals, Schilddrüse und Ösophagus Bei nach beidseitiger subtotaler Schilddrüsenresektion zufällig gefundenem solitärem papillärem Karzinom bis 1 cm (pT1a) ist eine Nachoperation nicht erforderlich, sofern der Tumor im Gesunden reseziert ist und keine Hinweise auf Lymphknotenmetastasen bestehen. Bei gekapseltem follikulärem Karzinom mit einem Größendurchmesser von 1 cm oder weniger (pT1a), das postoperativ nach Lobektomie oder subtotaler Resektion nachgewiesen wird, ist es vertretbar, auf die Entfernung der restlichen Schilddrüse zu verzichten. Bei lokal destruierendem Wachstum kann die Struma maligna in die Trachea einwachsen (s. S. 647). Lymphknotendissektion Das Lymphablaufgebiet der Schilddrüse wird in ein zentrales, ein laterales und ein mediastinales Kompartiment unterteilt. Eine Thyreoidektomie schließt eine Lymphadenektomie der beteiligten Kompartmente mit ein. Minimalinvasive Techniken in der Schilddrüsenchirurgie 1999 wurden von Paolo Miccoli (Italien, Pisa) minimalinvasive Techniken in die Schilddrüsenchirurgie eingeführt, um bei einem geeigneten Patientengut Operationsergebnisse zu erzielen, mit denen die morphologischen, funktionellen und onkologischen Veränderungen im Sinne einer fokussierten Mikropräparation mit einem guten kosmetischen Ergebnis beseitigt werden können. Neben dem minimalinvisiven, videoassistierten Zugang in der Region des Kocher-Kragenschnitts mit einer Länge von nur 2 cm oder einer offenen, miniinzisionalen Technik werden alternativ auch endoskopische Zugänge von der Area mamillaris, der Axilla und der seitlichen hinteren Haargrenze angewendet, um einen narbenfreien Hals zu erreichen. Diese operativen Zugangswege sind wegen ihrer schwierigen technischen Durchführung sehr kritisch zu werten! Die Umsetzung der minimalinvasiven Chirurgie sollte derzeit nur erfolgen, wenn bestimmte Voraussetzungen eingehalten werden können: l Die Operationen werden an Zentren für Schilddrüsenchirurgie mit dem notwendigen endoskopischen und mikrochirurgischen Instrumentarium durchgeführt. l Es sind in der Schilddrüsenchirurgie und anderen endoskopischen Operationen erfahrene Operateure vorhanden, die ein morbiditätsarmes Operieren garantieren. l Die Indikationsstellung für Schilddrüsenerkrankungen, die für minimalinvasive Operationen geeignet sind, ist sehr streng. l Die für die Schilddrüsenchirugie von den Fachgesellschaften erarbeiteten Leitlinien werden eingehalten. l Nach wie vor gilt, dass der Kocher-Kragenschnitt mit einer Länge von 5 – 7 cm den Goldstandard für den Zugang zur Schilddrüse darstellt. Das setzt voraus, dass die Möglichkeiten des atraumatischen Operierens im Hautbereich der Regio thyreoidea angewendet werden. 742 l Narbenkorrekturen nach Schilddrüsenoperation spielen in der plastischen Chirurgie derzeit eine absolut untergeordnete Rolle. Das intraoperative Neuromonitoring wird zur Minimierung von Rekurrensparesen eingesetzt. Drainagen sind in der minimalinvasiven Schilddrüsenchirurgie bei dem geringen Volumen des Operationssitus nur dann erforderlich, wenn primär mit einer verstärkten Blutungsneigung (Hyperthyreosen, Methimazolmedikation) zu rechnen ist. Zusammenfassend muss betont werden, dass gute kosmetische Ergebnisse nicht auf Kosten des eigentlichen Operationsziels – nämlich der Beseitigung der morphologischen, funktionellen und onkologischen Veränderungen – erzwungen werden dürfen. Literatur Cernea CR, Ferraz AR, Nishio S et al. Surgical anatomy of the external branch of the superior laryngeal nerve. Head Neck 1992; 14: 380 – 383 Hotze L‑A, Schumm-Draeger P‑M. Schilddrüsenkrankheiten: Diagnose und Therapie. Berlin: Berliner Medizinische Verlagsanstalt GmbH; 2003 Lang J, Nachbaur S, Fischer K. N. laryngei, Verzweigungen im Kehlkopfinneren. Gegenbaurs Morphol Jahrb 1986; 132: 723 – 736 Mann K. Praxisbezogene Schilddrüsendiagnostik: Klinische Befunde. Med Welt 2001; 52: 18 – 23 Moller AR. Monitoring other cranial Motor Nerves. In: Moller AR. Intraoperative neurophysiologic monitoring. Australia Austria, China: Harwood academic publishers; 1995: 190 Neumann H – J. Intraoperatives neurophysiologisches Monitoring (IONM) des Nervus recurrens und Mikrodissektion. Laryngo Rhino Otol 2000; 79: 290 – 296 Pfannenstiel P, Hotze L‑A, Saller B. Schilddrüsenkrankheiten: Diagnose und Therapie. Berlin: Berliner Medizinische Verlagsanstalt GmbH; 1997 Randolph GW. Surgery of the Thyroid and Parathyroid Glands. Philadelphia: Saunders; 2003 Röher HD, Allenberg JR. Chirurgische Operationslehre. Bd. 1: Chirurgie Kopf und Hals. München: Urban & Schwarzenberg; 1990 Stelzner F. Die chirurgische Anatomie der Grenzlamellen der Schilddrüse und die Nervi laryngei. Langenbecks Arch Chir 1988; 373: 355 – 366 Timmermann W, Hamelmann WH, Meyer T et al. Identification and surgical anatomy of the external branch of the superior laryngeal nerve. Zentralbl Chir 2002; 127/5: 425 – 428 Timmermann W, Hamelmann WH, Thomusch O et al. Zuverlässigkeit und Konsequenzen des intraoperativen Neuromonitorings in der Schilddrüsenchirurgie. Stellungnahme der „Interdisziplinären Studiengruppe ‚Intraoperatives Neuromonitoring Schilddrüsenchirurgie‘“. Chirurg 2004; 75/9: 916 – 922 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... 14.2.3 Chirurgische Therapie ......... Tabelle 14.16 Chirurgische Therapie bei zervikaler Ösophagusperforation: Tipps und Tricks. V. Bonkowsky und J. Strutz Management der Perforation des Hypopharynx oder zervikalen Ösophagus Der entscheidende prognostische Faktor bei pharyngoösophagealen Perforationen ist die Zeit, die zwischen Perforation und Beginn der Therapie liegt. Früher wurde in allen Fällen einer Perforation eine chirurgische Exploration samt Wundverschluss gefordert. In neuerer Zeit gibt es einen Trend zu einem konservativeren Vorgehen, bestehend aus intravenöser Gabe von Breitbandantibiotika (z. B. Clindamycin, Ampicillin-Sulbactam) und Protonenpumpenhemmern, oraler Nahrungskarenz (Ernährung über nasogastrale Sonde für 7 Tage) und eventuell Abszess-Drainage. Chirurgische Therapie Das chirurgische Management beinhaltet die Ösophagoskopie, die zervikale Exploration und den Wundverschluss sowie die Drainage. Die Indikation und der Zeitpunkt des chirurgischen Vorgehens hängen von mehreren Faktoren ab: l Mechanismus und Ausmaß der Verletzung l Zeitdauer zwischen Perforation und Erkennen der Perforation l Erfahrung des Chirurgen Technik. Eine Ösophagoskopie vor dem chirurgischen Zugang von außen erleichtert die Seitenwahl des Zugangs und ermöglicht eine Beurteilung des Ausmaßes der Perforation, auch wenn die Indikation zur Exploration schon klar ist. l Die Schluckuntersuchung mit wasserlöslichen Kontrastmitteln ist sowohl entscheidend für die Diagnose einer Perforation als auch für den Nachweis einer wieder verschlossenen Perforation l Die meisten zervikalen Verletzungen, die frühzeitig diagnostiziert werden (< 24 h), können konservativ mit Breitspektrumantibiotika, oraler Nahrungskarenz und engmaschiger klinischer Überwachung unter Kontrolle gebracht werden l Thorakale Perforationen sind deutlich gefährlicher und müssen, sobald die Diagnose gestellt wird, schnellstmöglich zusammen mit den Chirurgen versorgt werden Der Zugang bei einer zervikalen Ösophagusperforation mit einer mediastinalen Sepsis wird folgendermaßen durchgeführt (Tab. 14.16): Die Inzision erfolgt entlang des unteren Drittels des Vorderrands des M. sternocleidomastoideus auf der Seite der Perforation (wenn eine eindeutige Seitenlokalisation möglich ist). Ansonsten wird der linkszervikale Zugang bevorzugt (Abb. 14.52). A. carotis communis und V. jugularis interna werden nach lateral beiseite gehalten und die mittleren Schildrüsenvenen und die A. thyroidea inferior ligiert (weit lateral ungefähr da, wo sie unter der A. carotis communis verschwindet), damit Trachea und Ösophagus nach medial weggehalten werden können und gleichzeitig der N. recurrens geschont wird. Es folgt die stumpfe Präparation medial der Gefäße. Diese führt in den retroviszeralen Raum und zur prävertebralen Faszie unmittelbar posterior zum Ösophagus (Abb. 14.53). Die Dissektion wird durch die durch die Perforation bedingte Flüssigkeitsansammlung und das Ödem erleichtert. Die Perforation wird aufgesucht und mit resorbierbaren Nähten vernäht. Das Vernähen der Perforation ist jedoch keine M. constrictor pharyngis A., V. thyroideae superiores Abb. 14.52 Zervikale Ösophagotomie. Der Ösophagus wird zwischen der Trachea und der tiefen Halsfaszie aufgesucht, medial der Gefäßscheide. Die Darstellung des N. laryngeus recurrens verhindert die unbeabsichtigte Verletzung. Pars fundiformis des M. cricopharyngeus A. carotis communis V. jugularis interna Ösophagusverletzung N. laryngeus recurrens M. sternocleidomastoideus 743 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Ösophagus 14 Hals, Schilddrüse und Ösophagus Abb. 14.53 Dissektion in den retroviszeralen Raum. Conditio qua non für eine erfolgreiche Therapie, da zervikale Ösophagusperforationen mit einer guten Drainage und ohne distale Obstruktion narbig verheilen. Nun erfolgt die stumpfe Fingerdissektion im retroviszeralen Raum nach kaudal Richtung hinteres Mediastinum. Das Areal wird sorgfältig gespült und eine weiche Saug-Drainage eingelegt. Eine Perforation durch ein externes Trauma erfordert eine zusätzliche Verstärkung mit einem gestielten Lappen der geraden Halsmuskulatur oder des M. omohyoideus. Bei gleichzeitiger Perforation von Trachea und Ösophagus werden beide Perforationen getrennt vernäht, und zwischen Ösophagus und Trachea wird ein gestielter Muskellappen interponiert. Postoperativ wird die intravenöse Antibiotika- und die Protonenpumpenhemmergabe weitergeführt, bis keine Förderung der zervikalen Drainage mehr zu sehen ist (7 – 10 Tage nach operativer Versorgung). Dann erfolgt eine postoperative Kontrolle mit isotonischem Gastrografinschluck. Nach Perforationsausschluss wird mit einem langsamen oralen Nahrungsaufbau begonnen. Dysfunktion oberer Ösophagussphinkter und Zenker-Divertikel Krikopharyngeale Myotomie Indikation. Die Indikationsstellung muss sehr streng erfolgen! Operationstechnik. Der linkszervikale Zugang wird wie oben beschrieben durchgeführt (alternativ: transversale Inzision in Höhe des Krikoidunterrands und linkslastig). Die Muskulatur des oberen ösophagealen Sphinkters wird nach vorsichtiger Freipräparation der bedeckenden 744 Faszie exakt in der Mittellinie dargestellt, um die Nn. recurrentes zu schonen. Eine liegende Magensonde oder ein im Ösophagus liegender Bougie (36 Char.) erleichtern die Identifizierung der Ösophagusmuskulatur erheblich. Der Krikoidknorpel markiert den Krikoidmuskel. Die Muskelfasern des oberen ösophagealen Sphinkters werden in der Mittellinie mit einer Präparierklemme von der Mukosa getrennt (Abb. 14.54) und dann durchtrennt (Skalpell oder bipolare Pinzette), ohne die Mukosa zu verletzen. Die quer verlaufenden Muskelfasern des M. circopharyngeus und die schräg verlaufenden Fasern des M. constrictor pharyngis inferior werden komplett durchtrennt. Diese schrittweise Durchtrennung wird wiederholt, bis die komplette Breite bzw. Höhe des M. cricopharyngeus durchtrennt ist und die angrenzende Muskulatur des Ösophagus kaudal und die des Hypopharynx (M. constrictor pharyngis inferior) kranial miteinbezogen sind. Die Länge der Myotomie beträgt mindestens 3 cm, bei manchen neurologischen Erkrankungen, die eine Myotomie erfordern, sogar bis zu 6 cm. Die Magensonde bleibt 24 h liegen; anschließend kann mit einer flüssigen Diät der Nahrungsaufbau begonnen werden, wenn bei der Operation nicht versehentlich die Schleimhaut eröffnet wurde. Komplikationen. Spezifische Komplikationen sind eine Läsion des N. recurrens, ein retropharyngeales Hämatom und eine Speichelfistel mit Infektion. Zenker-Divertikel Die Therapie des pharyngoösophagealen Divertikels ist operativ. Operation von außen (transzervikaler Zugang) 1. Linkszervikaler Zugang: wie oben beschrieben. 2. Krikopharyngeale Myotomie: mindestens 3 cm. 3. Divertikelexzision oder Divertikulopexie: Das Divertel wird an der Spitze des Divertikelsacks mit einer Klemme gefasst und der Divertikelsack exzidiert (Abb. 14.55). Zu starkes Ziehen muss vermieden werden, um nicht zu viel Hypopharynxmukosa zu entfernen und damit eine Stenose zu erzeugen. Anschließend wird die Naht mit resorbierbaren 3.0- oder 4.0-Nähten oder Stapler ausgeführt. Die Divertikulopexie soll die Risiken vermeiden, die mit der Pharynxeröffnung verbunden sind. Dabei wird der Fundus invertiert und kranial an die prävertebrale Faszie genäht. Die intraoperative Divertikelidentifikation kann deutlich erleichtert werden, wenn unmittelbar vor der Operation endoskopiert, eine nasogastrale Magensonde gelegt und das Divertikel mit einer fortlaufenden Tamponade ausgestopft wird. Endoskopischer Zugang Der endoskopische Zugang ist aus anatomischen Gründen manchmal nicht möglich! Mit einem speziellen Divertikuloskop wird der Übergang Hypopharynx/Ösophagus expo- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... Abb. 14.54 Myotomie. Schilddrüse Chirurgische Therapie ......... Krikopharyngeale Divertikelsack Ösophagus A. carotis communis Myotonie der Pars fundiformis des M. cricopharyngeus Abb. 14.55 niert; das obere Blatt wird in den zervikalen Ösophagus, das untere in das Divertikel eingeführt. Die Divertikelschwelle (entspricht dem M. cricopharyngeus) wird optimal dargestellt (Abb. 14.56). Es folgt die Durchtrennung der Divertikelschwelle entweder mit dem CO2-Laser (1 W) oder mit dem Stapler (En- Exzision des Divertikelsacks. do-GIA‑Stapler). Der Vorteil des Staplers ist das Durchtrennen der Divertikelschwelle und gleichzeitiges Setzen von Klammernahtreihen auf beiden Seiten (Abb. 14.57). Die Tab. 14.17 fasst Tipps und Tricks für die operative Therapie von Zenker-Divertikeln zusammen. 745 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 14 14 Hals, Schilddrüse und Ösophagus Abb. 14.56 Endoskopische Exposition der Divertikelschwelle. Tabelle 14.17 und Tricks. Operative Therapie von Zenker-Divertikeln: Tipps l Läsionen des N. recurrens können vermieden werden, wenn man sich bei der posterioren Myotomie in der Mittellinie hält l Eine Speichelfistel und eine Wundheilungsstörung können immer auftreten, wenn man den Pharynx eröffnet l Wichtig ist die Untersuchung der Schleimhaut des ZenkerDivertikels, um ein Karzinom im Divertikel nicht zu übersehen (sehr selten: < 1 %) l Es sollte immer der bestmögliche Zugang ausgewählt werden, je nach anatomischer Situation und Erfahrung des Operateurs Postoperatives Management Nach der Operation mit Divertikelexzision und Naht von außen wird für 7 Tage eine nasogastrale Sonde belassen. Sodann wird eine Kontrolle auf Dichte der Naht mittels Gastrografinschluck durchgeführt. Für eine weitere Woche nimmt der Patient weiche Nahrung zu sich; anschließend erfolgt der Übergang auf feste Nahrung. Beim endoskopischen Zugang wird die postoperative Nahrungskarenz unterschiedlich gehandhabt. Bei der Divertikeldurchtrennung mit dem Laser wird der Patient 5 – 7 Tage über die Magensonde ernährt; dann erfolgt eine radiologische Kontrolle mit Gastrografinschluck zum Fistelausschluss. Chirurgie maligner Ösophagustumoren Karzinom des zervikalen Ösophagus Ein Karzinom des zervikalen Ösophagus ist ein sehr aggressiver Tumor und geht oft mit einer Beteiligung des Larynx und der Trachea einher. Die operative Therapie ist in aller Regel in ein Gesamtkonzept integriert (neoadjuvante/adjuvante Radiochemotherapie). 746 Abb. 14.57 ler. Durchtrennung der Divertikelschwelle mit dem Stap- Operative Therapiemöglichkeiten: l Laryngopharyngoösophagektomie und Rekonstruktion mit Magenhochzug: Ein Magenhochzug nach Resektion eines zervikalen Ösophaguskarzinoms ist ein verlässliches Single-Stage-Operationsverfahren. l Resektion des zervikalen Ösophagus unter Funktionserhalt der laryngotrachealen Einheit und Rekonstruktion des Schlucktrakts mit freien, mikrovaskulären Lappen: Versuche, den zervikalen Ösophagus unter Erhalt eines funktionsfähigen laryngotrachealen Komplexes zu resezieren, sind schwierig und erfordern sowohl eine nahezu perfekte Kombination von Lage und Ausdehnung des Tumors als auch chirurgische Expertise. Diese Eingriffe sind sehr komplex und erfordern eine Kooperation mit den Chirurgen, bieten aber, eingebettet in ein Gesamttherapiekonzept, die besten Heilungschancen bei insgesamt jedoch schlechter Prognose (5-Jahres-Überlebensrate < 20 %). Die operative Technik ist in speziellen Operationslehren detailliert beschrieben. Karzinom im mittleren und distalen Drittel des Ösophagus Abhängig von der Tumorlokalisation kommen verschiedene chirurgische Verfahren zur Anwendung. Besonders bewährt hat sich die transthorakale En-Bloc-Ösophagektomie mit Resektion der regionalen Lymphknoten. Sie ist bei Tumoren des mittleren und insbesondere des distalen Drittels des Ösophagus indiziert. An die transthorakale Resektion des Ösophagus wird eine Ausräumung des mediastinalen Lymphabflussgebiets angeschlossen. Zusätzlich erfolgt eine transabdominale suprapankreatische Lymphadenektomie. Der Ösophagusersatz wird durch einen Magenhochzug (Gastric Pull-up) vorgenommen. Läsionen der Tracheahinterwand und des linken Hauptbronchus nach scharfer Präparation oder enger Beziehung zwischen Tumor und Trachea sind bei diesem Vorgehen möglich. Die Letalität beträgt 5 – 10 %. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Spezielle HNO‑Erkrankungen und ihre Therapie ................................................................................. ........................................................... Die Thorakotomie wird vom Thoraxchirurgen in der Regel rechtsseitig im 5. oder 7. Interkostalraum durchgeführt; nur bei linksseitiger Perforation erfolgt eine linksseitige Thorakotomie. Nach Abdrängung der Lunge und Spaltung der Pleura mediastinalis schließen sich die Mobilisation und das Anschlingen des terminalen Ösophagussegments an. Liegt ein Fremdkörper vor, so wird der Ösophagus längs gespalten und 2-schichtig wieder verschlossen. Eine Saug-Spül-Drainage beendet den Eingriff. Eine perioperative und postoperative Antibiose mit einem Zephalosporin + Metronidazol ist indiziert. Chirurgie der Hiatushernien Axiale Gleithernien und paraösophageale und gemischte Hernien sollten aufgrund potenzieller Komplikationen operativ versorgt werden. Gemischte und paraösophageale Hernien werden vom Viszeralchirurgen mithilfe einer Gastropexie nach Reposition des Hernieninhalts fixiert. Zusätzlich wird eine Hiatopexie zur Reduktion des erweiterten Hiatusrings durchgeführt. Hiatusgleithernien werden wie die Refluxkrankheit mit einer Fundoplikation nach Nissen oder Rossetti versorgt. Der Magenfundus wird entlang der großen Kurvatur mobilisiert und als spannungsfreie Manschette gebildet. Diese Manschette wird um den Ösophagus geführt und mit dem linken Magenfundus vereinigt. Eine Vagotomie erfolgt in der Regel bei einer zusätzlichen Ulkuskrankheit. ......... Literatur Bonkowsky V. Operative Behandlung der Dysphagie. In: Böhme G, ed. Sprach-, Sprech-, Stimm- und Schluckstörungen. München: Elsevier; 2006: 440 – 453 Goudy SL, Miller FB, Bumpous JM. Neck crepitance: Evaluation and management of suspected upper aerodigestive tract injury. Laryngoscope 2002; 112: 791 – 795 Myers EN. Operative otolaryngology head and neck surgery. 2nd ed. Philadelphia: Saunders Elsevier; 2008 Siewert JR, Liebermann-Meffert D et al. Ösophaguskarzinom. In: Siewert JR, Harder F, Allgöwer M et al. Spezielle chirurgische Gastroenterologie: Ösophagus, Zwerchfell, Kardia, Magen, Dünndarm, Dickdarm, Proktologie, Morbus Crohn, Colitis ulcerosa, Gefäßerkrankungen, Strahlenfolgen. 2. Aufl. Berlin: Springer; 1990: 593 – 660 Silverstein FE, Tytgat GNJ. Gastroenterologische Endoskopie. Stuttgart: Thieme; 1994 Vogel SB, Rout WR, Martin TD et al. Esophageal perforation in adults: aggressive conservative treatment lowers morbidity and mortality. Ann Surg 2005; 241: 1016 – 1023 Weiser HF, Feussner H. Traumatische Perforationen und Fisteln im Bereich von Ösophagus und Magen. In: Siewert JR, Harder F, Allgöwer M et al. Spezielle chirurgische Gastroenterologie: Ösophagus, Zwerchfell, Kardia, Magen, Dünndarm, Dickdarm, Proktologie, Morbus Crohn, Colitis ulcerosa, Gefäßerkrankungen, Strahlenfolgen. 2. Aufl. Berlin: Springer; 1990: 582 – 588 Wilcax CTL. Atlas of clinical gastrointestinal endoscopy. Philadelphia: Saunders; 1995 747 14 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Thorakale Ösophagotomie Chirurgische Therapie Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt.