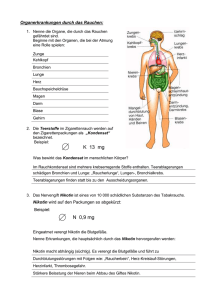
Nikotinabhängigkeit – pharmakologische Möglichkeiten zur
Werbung

Diplomarbeit Nikotinabhängigkeit – pharmakologische Möglichkeiten zur Raucherentwöhnung eingereicht von Johannes Michael Habenbacher zur Erlangung des akademischen Grades Doktor der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut für Experimentelle und Klinische Pharmakologie unter der Anleitung von Univ.-Prof. Dr. med. univ. Josef Donnerer Graz, 16.2.2017 Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am 16.2.2017 Johannes Michael Habenbacher eh II Danksagung Ein besonderer Dank gilt Herrn Univ.-Prof. Dr. Josef Donnerer! Ohne zu zögern erklärte er sich bereit, mich bei dieser Diplomarbeit zu betreuen und stand mir jederzeit mit guten Denkanstößen und Antworten zur Seite. Ich möchte mich an dieser Stelle auch bei allen Personen bedanken, die mir während meines Studiums und dem Verfassen dieser Diplomarbeit mit motivierenden Worten und wertvollen Ratschlägen weitergeholfen haben. Mein ganz besonderer Dank gilt meiner Familie, insbesondere meinen Eltern, Brüdern und Großeltern, die es mir erst ermöglicht haben, zu studieren, und mir jedwede Unterstützung zukommen ließen. Zu guter Letzt möchte ich meiner Partnerin Laura danken, die mir in all den Jahren stets eine Stütze war und mir mit ihrem Verständnis Kraft und Energie gab. III Zusammenfassung Tabakrauch mit seinem Hauptinhaltsstoff Nikotin zählt zu einem der weltweit bedeutendsten Umweltgifte. Den Folgen des Tabakrauches werden weltweit jährlich 5,4 Millionen Todesopfer zugeschrieben. Aktuell rauchen etwa 1,1 Milliarden Menschen regelmäßig Tabakprodukte, wobei sich die Prävalenz der rauchenden Männer mit 38% deutlich von der der rauchenden Frauen mit 22% unterscheidet. Obwohl es zwar im europäischen und nordamerikanischen Raum bereits zu einem deutlichen Prävalenzrückgang kommt, wird für die sogenannten Industrie- und Entwicklungsländer von der WHO eine deutliche Zunahme der Rauchprävalenz bis zum Jahr 2030 mit einer geschätzten Zahl von 8 Millionen jährlichen tabak-assoziierten Todesfällen prognostiziert. Chronisches Tabakrauchen ist maßgeblich an der Entstehung der dort 6 häufigsten Todesursachen (Herzinfarkt, KHK, Herzinsuffizienz, Schlaganfall, COPD und Lungenkrebs) beteiligt. Im Rahmen einer Literaturrecherche wurden die Geschichte des Tabaks, die pharmakologischen Eigenschaften und Wirkungen von Nikotin, die Auswirkungen des Rauchens auf den menschlichen Körper und die Epidemiologie des Tabakrauchens ausführlich dargestellt. Der Fokus dieser Diplomarbeit lag auf den pharmakologischen Möglichkeiten zur Rauchentwöhnung mittels Nikotinersatztherapie und den Wirkstoffen Bupropion und Vareniclin. Ein besonderes Augenmerk wurde dabei auch auf die pharmakologischen Eigenschaften und Wirkungen der beiden Wirkstoffe gelegt. Die klinische Wirksamkeit der 3 Therapieformen wurde anhand von Originalarbeiten verschiedener Autoren miteinander verglichen und in aufgearbeiteter Form dargestellt. Zusammenfassend bieten sich der Medizin also vielfältige Möglichkeiten, die Rauchabstinenz durch medikamentöse Therapie wirksam zu verbessern und so Raucherinnen und Rauchern den Ausstieg aus ihrer Sucht zu erleichtern. IV Abstract Tobacco smoke, with its main substance nicotine, is one of the most important environmental toxins worldwide. 5.4 million annual deaths per year are attributed to the consequences of tobacco smoke. Currently about 1.1 billion people regularly smoke tobacco products, whereby the prevalence of smoking men with 38% clearly differs from the one of smoking women with 22%. Although prevalence is already in decline in Europe and in North America, a distinct increase of smoking prevalence in the so-called industrialized and developing countries is predicted by the WHO until the year 2030, with an estimated number of 8 million annual deaths associated with tobacco. Chronic smoking of tobacco substantially contributes to the development of the 6 most common causes of death (heart attack, coronary heart disease, cardiac failure, stroke, chronical obstructive pulmonary disease and lung cancer). By means of a literature research, the history of tobacco, the pharmacological characteristics and effects of nicotine, the effects of smoking on the human body and epidemiology of smoking tobacco shall be comprehensively depicted. The focus of this diploma thesis is on the pharmacological possibilities for smoking cessation by means of nicotine substitute therapy and the active substances bupropion and varenicline. Special attention shall thereby be paid to the pharmacological characteristics and effects of these two active substances. The clinical effectiveness of the 3 types of smoking cessation therapy is compared by referring to original works of different authors and is presented in reviewed form. It can be concluded that there are several medical possibilities to effectively improve abstinence from smoking by means of drug therapy, and in that way to help smokers quit their addiction. V Inhaltsverzeichnis Zusammenfassung ............................................................................................................... IV Abstract................................................................................................................................. V Inhaltsverzeichnis ................................................................................................................ VI Glossar und Abkürzungen ................................................................................................ VIII Abbildungsverzeichnis ........................................................................................................ IX Tabellenverzeichnis .............................................................................................................. X 1 Einleitung .................................................................................................................. 1 1.1 Geschichte des Nikotins ........................................................................................ 1 1.2 Nikotin ................................................................................................................... 2 1.3 Wirkmechanismus ................................................................................................. 3 1.4 Pharmakokinetik .................................................................................................... 4 1.5 Nikotinabhängigkeit .............................................................................................. 6 1.6 Nikotinsucht: Klassifikation .................................................................................. 7 1.6.1 Biochemische Marker .................................................................................... 9 1.6.2 Fagerström-Test ............................................................................................. 9 1.7 Tabakrauch .......................................................................................................... 11 1.8 Chronische Schädigung durch Tabakrauch ......................................................... 13 1.9 Toxizität ............................................................................................................... 17 1.10 Epidemiologie.................................................................................................. 18 2 Material und Methoden ........................................................................................... 20 3 Ergebnisse – Resultate............................................................................................. 21 3.1 Nikotinersatztherapie ........................................................................................... 21 3.1.1 Nikotinkaugummi ........................................................................................ 22 3.1.2 Nikotin-Lutschtablette ................................................................................. 23 3.1.3 Nikotinpflaster ............................................................................................. 24 VI 3.1.4 Nikotin-Inhaler ............................................................................................ 24 3.1.5 Nikotin-Spray .............................................................................................. 25 3.1.6 Kombinationstherapie.................................................................................. 25 3.2 Bupropion ............................................................................................................ 26 3.2.1 Pharmakologie ............................................................................................. 27 3.2.2 Nebenwirkungen.......................................................................................... 28 3.2.3 Gegenanzeigen / Kontraindikationen .......................................................... 28 3.2.4 Klinische Wirksamkeit ................................................................................ 29 3.3 Vareniclin ............................................................................................................ 33 3.3.1 Pharmakologie ............................................................................................. 34 3.3.2 Nebenwirkungen.......................................................................................... 35 3.3.3 Gegenanzeigen / Kontraindikationen .......................................................... 35 3.3.4 Klinische Wirksamkeit ................................................................................ 36 3.4 Kombinationstherapien........................................................................................ 40 4 Diskussion ............................................................................................................... 41 5 Literaturverzeichnis ................................................................................................. 43 VII Glossar und Abkürzungen ZNS zentrales Nervensystem WHO World Health Organisation ACTH Adrenocortikotropes Hormon g Gramm kg Kilogramm mg Milligramm µg Mikrogramm ng Nanogramm L Liter Ml Milliliter mol Mol ICD-10 Internationale Krankheiten statistische und Klassifikation verwandter der Gesundheits- probleme DSM Diagnostic and Statistical Manual of Mental Disorders cm² Quadratzentimeter µm Mikrometer h Stunde FTZA Fagerström-Test für Zigarettenabhängigkeit COPD Chronische obstruktive Lungenerkrankung KHK Koronare Herzerkrankung CO Kohlenstoffmonoxid ppm parts per million IUPAC International Union of Pure and Applied Chemistry LD50 mittlere letale Dosis EKG Elektrokardiogramm MAO Monoaminooxidase NET Nikotinersatztherapie EU Europäische Union FDA U.S. Food and Drug Administration USDHHS U.S. Department of Health and Human Services VIII Abbildungsverzeichnis ABBILDUNG 1: 2D-STRUKTURFORMEL NIKOTIN [5] .......................................................................... 2 ABBILDUNG 2: PHARMAKOKINETIK NIKOTIN - VERGLEICH DER BLUTPLASMASPIEGEL DER VERSCHIEDENEN DARREICHUNGSFORMEN [11] ........................................................................ 5 ABBILDUNG 3: WIRKUNGEN VON NIKOTIN IM GEHIRN - ENTSTEHUNG DER ABHÄNGIGKEIT ........... 7 ABBILDUNG 4: FAGERSTRÖM-TEST FÜR ZIGARETTENABHÄNGIGKEIT [25] .................................... 10 ABBILDUNG 5: SCHEMA TABAKABBRAND [27] ............................................................................... 11 ABBILDUNG 6: WHO GLOBAL REPORT: TABAK-ASSOZIIERTE TODESFÄLLE (IN %) 2012 [30] ....... 13 ABBILDUNG 7: AUSWIRKUNGEN DES TABAKRAUCHES AUF DIE ATEMWEGE UND DIE LUNGE [37] 16 ABBILDUNG 8: EINFLUSS VON ZIGARETTENRAUCHEN AUF GEBURTSGEWICHT [39] ...................... 17 ABBILDUNG 9: VERGLEICH NIKOTIN-PLASMASPIEGEL VON ZIGARETTE UND NICORETTE®KAUGUMMI 4MG [48] .............................................................................................................. 23 ABBILDUNG 10: STRUKTURFORMEL BUPROPION (OBEN: (S)-FORM, UNTEN: (R)-FORM) [53] ........ 26 ABBILDUNG 11: WIRKMECHANISMUS BUPROPION: SELEKTIVE WIEDERAUFNAHMEHEMMUNG VON NORADRENALIN UND DOPAMIN AM SYNAPTISCHEN SPALT [58] ............................................ 27 ABBILDUNG 12: HURT ET AL. 1997: RAUCHABSTINENZ - BUPROPION IM VERGLEICH MIT PLACEBO NACH 6 WOCHEN [63] .............................................................................................................. 29 ABBILDUNG 13: JORENBY ET AL. 1999: RAUCHABSTINENZ - BUPROPION IM VERGLEICH WÄHREND DER BEHANDLUNG UND LANGZEIT FOLLOW-UP [64] .............................................................. 31 ABBILDUNG 14: AHLUWALIA ET AL. 2002: RAUCHABSTINENZ - BUPROPION IM PLACEBOVERGLEICH, WÄHREND BEHANDLUNG UND LANGZEIT FOLLOW-UP [65] ............................... 32 ABBILDUNG 15: STRUKTURFORMEL VARENICLIN [66] .................................................................... 33 ABBILDUNG 16: VEREINFACHTES SCHEMA DES WIRKMECHANISMUS VON VARENICLIN AM NIKOTINREZEPTOR: [69] .......................................................................................................... 34 ABBILDUNG 17: ONCKEN ET AL. 2006: VERGLEICH UNUNTERBROCHENE, 4-WÖCHIGE ABSTINENZRATE VON VARENICLIN IN UNTERSCHIEDLICHEN DOSIERUNGEN UND PLACEBO IN DER MEDIKAMENTÖSEN RAUCHERINNENENTWÖHNUNG [75]................................................. 37 ABBILDUNG 18: RIGOTTI ET AL. 2010: VERGLEICH RAUCHABSTINENZ VARENICLIN 2MG GEGEN PLACEBO, WÄHREND DES BEHANDLUNGSZEITRAUMES VON 12 WOCHEN UND LANGZEIT FOLLOW-UP [76] ...................................................................................................................... 38 ABBILDUNG 19: TASHKIN ET AL. 2011: VERGLEICH RAUCHABSTINENZ VARENICLIN GEGEN PLACEBO [77] .......................................................................................................................... 39 IX Tabellenverzeichnis TABELLE 1: AUSWERTUNG SUMMENWERT FAGERSTRÖM-TEST FÜR ZIGARETTENABHÄNGIGKEIT 11 TABELLE 2: ERHÖHTES MORTALITÄTSRISIKO (RELATIVE RISIKOERHÖHUNG) VON RAUCHERINNEN IM VERGLEICH [34] .................................................................................................................. 14 TABELLE 3: RAUCHVERHALTEN DER ÖSTERR. BEVÖLKERUNG >15 JAHRE, STATISTIK AUSTRIA – GESUNDHEITSBEFRAGUNG 2014 ............................................................................................. 19 TABELLE 4: LANGZEITRAUCHABSTINENZ - BUPROPION IM VERGLEICH MIT PLACEBO, NACH HURT ET AL. 1997 [63]....................................................................................................................... 30 TABELLE 5: LANGZEITRAUCHABSTINENZ - BUPROPION IM VERGLEICH MIT PLACEBO, NIKOTINPATCH UND BUPROPION + NIKOTIN-PATCH, NACH JORENBY ET AL. 1999 [64] ...................... 31 TABELLE 6: LANGZEITRAUCHABSTINENZ - BUPROPION 300MG IM VERGLEICH MIT PLACEBO, NACH AHLUWALIA ET AL. 2002 [65] ................................................................................................. 33 TABELLE 7: AUFTRETEN VON PSYCHIATRISCHEN NEBENWIRKUNGEN – VARENICLIN IM VERGLEICH ZU PLACEBO, NACH TASHKIN ET AL. 2011 [77] ....................................................................... 39 TABELLE 8: RAUCHABSTINENZRATEN DER GRUPPEN VARENICLIN + BUPROPION (N=249) UND VARENICLIN + PLACEBO (N=257), NACH EBBERT ET AL. 2014 [78] ....................................... 41 X 1 Einleitung Tabak mit seinem Hauptwirkstoff Nikotin nimmt unter den zahlreichen Umweltgiften, von denen der menschliche Körper belastet wird, gemessen an seinen nachweislich erzeugten Schäden, eine sehr wichtige Rolle ein. 1.1 Geschichte des Nikotins Die Tabakpflanze der Pflanzengattung Nicotiana ist ein Vertreter der Nachtschattengewächse. Sie ist auf dem amerikanischen Kontinent heimisch und wird dort seit mehr als 10.000 Jahren von den Eingeborenen zu kultischen Zwecken konsumiert. Zu Zeiten der Entdeckung Amerikas durch Christoph Kolumbus sahen Europäer zum ersten Mal Tabakkonsum zu kultischen Zwecken bei den Eingeborenen, woraufhin Tabak bald aus der neuen Welt nach Europa gebracht wurde. Da der Tabakpflanze anfangs besonders große Heilkräfte, vor allem in der Behandlung von Geschwüren und Kopfschmerzen, zugeschrieben wurden, führte sie der französische Arzt und Medici-Gesandter Jean Nicot de Villemain um 1560 in Frankreich als Heilpflanze ein. [1] Tabak galt um 1600 als eines der bestwirksamen Heilmittel und wurde in verschiedensten Darreichungsformen (Lösungen, Tinkturen, Salben, Pasten, etc.) als Arzneimittel verwendet. Besonders geschätzt waren auch seine beschriebenen Wirkungen auf Psyche und Geist, wie etwa Erfrischung der Sinne, Aktivierung der Lebenskräfte und Zunahme der Konzentrationsfähigkeit. Zu Genusszwecken war in Europa bis vor ungefähr 150 Jahren überwiegend das Tabakschnupfen gebräuchlich. Europäische Soldaten brachten den Gebrauch türkischer und russischer Soldaten, Tabak als Genussmittel in Zigarettenform zu rauchen, zu Zeiten des Krimkrieges um etwa 1850 nach Zentraleuropa.[2] [3] Der Hauptwirkstoff der Tabakpflanze wurde erstmals 1828 aus den Blättern der Pflanze Nicotiana tabacum von Christian Wilhelm Posselt und Karl Ludwig Reimann isoliert und zu Ehren Jean Nicots „Nikotin“ genannt. [4] 1 1.2 Nikotin Abbildung 1: 2d-Strukturformel Nikotin [5] Nikotin ist ein Alkaloid, das vorwiegend in der Tabakpflanze (Pflanzengattung Nicotiana), aber auch in anderen Nachtschattengewächsen vorkommt. Tabakpflanzen erzeugen das Nicotin in ihren Wurzeln. Beim Reifungsprozess wandert der Stoff dann schließlich in die Blätter und dient dort der Abwehr von Fressfeinden der Pflanze. Nicotin und nikotinähnliche Stoffe, sogenannte Nicotinoide, sind naturgemäß also starke Insektizide. Alkaloide sind natürlich vorkommende, stickstoffhaltige organische Verbindungen. Die chemische Struktur des Nikotins basiert auf 2 verbundenen Ringen aus Pyridin und Pyrrolidin. Die daraus resultierende Summenformel lautet C10H14N2, der chemische Stoffname lautet 3-(1-Methyl- 2-pyrrolidinyl) -pyridin und das molekulare Stoffgewicht beträgt 162.23 g/mol [6]. Als nikotin-ähnliche Alkaloide sind außerdem noch Coniin, das in Europa im Schierling (Conium maculatum) zu finden ist und wodurch niemand geringerer als Sokrates den Tod fand, Cytisin, aus dem als Zimmerpflanze beliebten Goldregen (Laburnum anagyroides) und Lobelin, aus dem Indianertabak (Lobelia inflata), einer Pflanze aus der Gattung der Glockenblumengewächse. Reines Nikotin kann bei Zimmertemperatur als ölige, farblose Flüssigkeit mit tabakartigem, pyridinartigem Geruch beschrieben werden. 2 Der pKa-Wert von Nikotin beträgt 7,9, somit liegt der Wirkstoff im Blut zu etwa 25% in lipidlöslicher, nicht-ionisierte freier Basenform vor. [7] [8] 1.3 Wirkmechanismus Die pharmakologische Wirkung von Nikotin ist ziemlich komplex. Nikotin wirkt wie Acetylcholin als Agonist am Nikotinrezeptor. Nikotinische Acetylcholinrezeptoren, kurz Nikotinrezeptoren genannt, sind membranständige Rezeptoren, die in verschiedenen Nervenzellen, in Muskelfasern und in der neuromuskulären Endplatte vorkommen. Sie binden als Substrat den Neurotransmitter Acetylcholin, können jedoch auch direkt durch Nikotin oder ähnliche nikotinerge Substanzen aktiviert werden. Neuronale Nikotinrezeptoren finden sich im menschlichen Körper auf autonomen Ganglienzellen, auf afferenten und efferenten peripheren Nervenendigungen, auf Nervenzellen im Gehirn und Rückenmark und sympathischen Ganglienzellen des Nebennierenmarks. Außerdem kann Nikotin die Blut-Hirn-Schranke passieren und ist somit ZNS-gängig. [7] Herz-Kreislaufsystem: Nikotin kann über mehrere Wirkmechanismen den Herzschlag beschleunigen, etwa über Stimulation sympathischer Ganglien, Blockade parasympathischer Ganglien oder durch Ausschüttung von Katecholaminen aus dem Nebennierenmark. Nikotin kann den Herzschlag aber auch durch Stimulation an parasympathischen Ganglien oder durch Blockade sympathischer Ganglien verlangsamen. Welcher kardiale Effekt sich schlussendlich wirklich darstellt, hängt maßgeblich von der Art der Nikotinapplikation und der verabreichten Dosis ab. Niedrige Nikotindosen, wie sie dem Körper bei mäßigem Zigarettenrauchen zugeführt werden, führen zu einer Steigerung der Herzfrequenz und zu einer Erhöhung des Blutdrucks. Magen-Darmtrakt: Die Nikotinwirkung auf den Magen-Darmtrakt wird zusätzlich durch die Wirkung von Peptidhormonen, Katecholaminen und Acetylcholin verstärkt. Es kommt zu einer Anregung der Peristaltik des Darmtraktes, zur Folge stehen vermehrter Stuhldrang und häufigere Defäkation. 3 Zusätzlich bewirkt Nikotin eine (unregelmäßig) erhöhte Sekretion von Magensaft und eine Tonusabnahme im unteren Ösophagussphinkter. Es kann also von einer indirekten ulzerogenen Wirkung ausgegangen werden, die zusätzlich durch eine Verminderung der Schleimhautdurchblutung verstärkt wird. Außerdem wird dadurch die Entstehung eines gastroösophagealen Refluxes begünstigt. ZNS: In kleinen Dosen wirkt Nikotin auf das Zentralnervensystem stimulierend. Nikotin bewirkt außerdem eine Freisetzung von Dopamin im mesolimbischen Dopaminsystem und führt so zu seiner Abhängigkeit erzeugenden Wirkung. Das Thema Nikotinsucht soll aber noch genauer in einem späteren Kapitel dargestellt werden. Über die Aktivierung von Nikotinrezeptoren in den Glomera aortica und den Glomera carotica, in welchen über Chemorezeptoren der Sauerstoffpartialdruck im Blut überwacht wird, kommt es zu einer Anregung der Atmung. Ein häufiges Symptom der Nikotinwirkung ist Tremor, außerdem wird das so genannte Brechzentrum, eine funktionelle Zusammenfassung von Kerngebieten im Hirnstamm, stimuliert. Zu guter Letzt greift Nikotin über das ZNS in die Sekretion von Hormonen ein und begünstigt so die Hypophysenhinterlappen, Ausschüttung ACTH von Vasopressin (adrenocortikotropes Hormon) aus aus dem dem Hypophysenvorderlappen und β-Endorphin aus dem Hypothalamus. Höhere Dosen des Wirkstoffes wirken krampfauslösend. [7] [9] 1.4 Pharmakokinetik Die Resorption von Nikotin ist bei den unterschiedlichen Möglichkeiten des Tabakkonsums sehr unterschiedlich. Beim Tabakkauen oder -schnupfen werden große Mengen Nikotin langsam und gleichmäßig über die Schleimhäute des Verdauungstraktes, vorwiegend über Mund- und Magenschleimhaut, bzw. über die Nasenschleimhaut, resorbiert. Beim 4 Paffen von Zigarren- oder Pfeifenrauch kommt es ebenfalls zu einer Resorption von Nikotin über die Schleimhäute von Mund- und Nasenhöhle. Beim inhalativen Rauchen von Zigaretten wird quasi das gesamte angebotene Nikotin über die Alveolarwände resorbiert, es kommt unter den verschiedenen Darreichungsformen außerdem zum schnellsten Plasmaspiegelanstieg. Zusätzlich zur fast vollständigen Aufnahme des zugeführten Nikotins erreicht dieses über die alveoläre Aufnahme das linke Herz und das ZNS unter Umgehung des Leberkreislaufes. Diese Umstände führen zu einer intermittierenden Anflutung der Nikotinrezeptoren mit relativ hohen Wirkstoffdosen. [3] Genauso wie bei den unterschiedlichen Tabakprodukten kommt es bei pharmakologischen Nikotinprodukten zu unterschiedlich schneller bzw. guter Resorption, wobei keineswegs der „explosive“ Nikotinplasmaspiegelanstieg wie beim inhalativen Zigarettenrauchen erreicht werden kann. Abbildung 2: Pharmakokinetik Nikotin - Vergleich der Blutplasmaspiegel der verschiedenen Darreichungsformen [9] (Nikotin-Nasalspray 1mg, Zigarette, Nikotin-Inhaler 1mg, Nikotin-Kaugummi 2mg) Nikotin wird mit einer Halbwertszeit von 2 Stunden rasch in der Leber oxidativ über die Cytochrome P450 2 A6 (CYP2A6) und 2 D6 (CYP2D6) metabolisiert. Der oxidative Abbau erfolgt am C5 des Pyrrolidinrings. 5 Die Hauptmetaboliten des Nikotinabbaus im menschlichen Körper, Kotinin, NikotinN-Oxid und Pyridylmethylaminobuttersäure sind pharmakologisch unwirksam. Sie verweilen mit einer Halbwertszeit von etwa 20-30h im Organismus und werden dann langsam renal ausgeschieden. [9] Nur höchstens 10% des resorbierten Nikotins werden unverändert renal eliminiert. 1.5 Nikotinabhängigkeit Die Nikotinabhängigkeit beinhaltet eine psychische und eine physische Komponente und entsteht durch ein Zusammenspiel mehrerer Faktoren. Physische Abhängigkeit: Nikotin bindet an nikotinerge Acetylcholin-Rezeptoren auf dopaminergen Nervenzellen im ZNS, unter anderem im ventralen tegmentalen Areal, einem Bestandteil des mesolimbischen Dopaminsystems, und stimuliert dadurch die Freisetzung von Dopamin im Nucleus accumbens, dem sogenannten Belohnungszentrum des Gehirns. Durch den erhöhten Dopaminausstoß wird ein subjektives Wohlgefühl ausgelöst. [10] Zusätzlich wird dieser Effekt durch die nikotinbedingte Freisetzung der Neurotransmitter GABA (Gammma-Aminobuttersäure) und Glutamat unterstützt. Glutamat erleichtert nämlich ebenso wie GABA die Dopaminausschüttung im Gehirn. [11] Bei wiederholtem Nikotinkonsum stellt sich ein Gewöhnungseffekt des Gehirns ein, da durch die chronische Zuführung des Wirkstoffes die bestehenden Nikotinrezeptoren desensibilisiert werden und es zusätzlich zu einer höheren Rezeptorexpression kommt. Es werden also immer höhere Nikotindosen benötigt, um das Belohnungszentrum zu stimulieren. [12] Psychische Abhängigkeit: Durch die Nikotin-induzierte Dopaminausschüttung im Belohnungszentrum wird über dopaminerge Leitungsbahnen ein Bereich im präfrontalen Kortex angeregt, der an Lernvorgängen beteiligt ist. 6 Hier werden die positiv wahrgenommenen Wirkungen des Rauchens mit Sinneswahrnehmungen, Handlungen, Situationen oder affektiven Zuständen in Verbindung gebracht. Es kommt, durch Wiederholung, zur Veränderung neuronaler Verbindungen im Gehirn, was eine starke und langanhaltende Konditionierung auf diese Reize entstehen lässt. [11] [13] [14] Abbildung 3: Wirkungen von Nikotin im Gehirn - Entstehung der Abhängigkeit Quelle: Deutsches Krebsforschungszentrum Heidelberg [15] 1.6 Nikotinsucht: Klassifikation In beiden weltweit gebräuchlichen diagnostischen Klassifikationssystemen, ICD-10 der WHO und DSM-IV der American Psychiatric Association ist die Tabakabhängigkeit, bzw. die Nikotinabhängigkeit als Krankheit angeführt. Nach ICD-10, welches in Deutschland und Österreich das gebräuchliche Klassifikationsinstrument darstellt, ist die Diagnose Tabakabhängigkeit 7 (Tabakabhängigkeitssyndrom F17.2) in der Rubrik F17, Psychische und Verhaltensstörungen durch Tabak, klassifiziert und kann gestellt werden, wenn in einem Zeitraum von 12 Monaten 3 der folgenden Symptome bestanden haben: Starker Wunsch/Zwang nach Tabakkonsum Toleranzentwicklung Anhaltender Substanzkonsum trotz schädlicher Folgen Entzugserscheinungen bei Verringern oder Absetzen des Tabakkonsums Eingeschränkte Kontrolle über Tabakgebrauch Vernachlässigung anderer Aktivitäten/Interessen, zugunsten des Tabakkonsums [16] [17] [18] Die Kategorie F10-F19 des ICD-10 kodiert für Psychische und Verhaltensstörungen durch psychotrope Substanzen. Unter anderem sind hier die Abhängigkeiten durch Substanzklassen wie Opioide, Cannabinoide, Hypnotika oder Sedativa, Halluzinogene und Alkohol klassifiziert. Aus der PatientInnen-Anamnese können sich außerdem noch weitere Hinweise auf eine mögliche Nikotinabhängigkeit ergeben: starkes Rauchen (>20 Zigaretten/Tag), bereits gescheiterte Ausstiegsversuche und morgendliches Rauchen sind üblicherweise typisch für eine Nikotinsucht. [16] Schädlicher Gebrauch F17.1: Hier wird von einem gelegentlichen Nikotinkonsum ohne Abhängigkeit ausgegangen, bei dem es trotzdem zu einer schädigenden Wirkung der Gesundheit kommt. Es handelt sich quasi um eine Vorstufe zur Tabakabhängigkeit. Generell ist der schädliche Gebrauch als Konsummuster von psychotropen Substanzen, die zu einer Gesundheitsschädigung führen, zusammengefasst. [17] [19] Nikotinentzug F17.3: Nikotinentzugssymptomatik ist hauptsächlich bei starker Nikotinabhängigkeit mit einem Tageszigarettenkonsum von 30 Zigaretten und mehr zu beobachten. 8 In der Regel können hierbei vor allem heftiges Verlangen nach Zigaretten, das sogenannte Craving, Konzentrationsschwächen, Ruhelosigkeit, leichte Erregbarkeit und Angstgefühle beobachtet werden. Zusätzlich kann die Symptomatik durch das Fehlen einer manuellen Beschäftigung, die Zigarettenrauchen für die meisten Raucherinnen und Raucher darstellt, oder durch geringste Anlässe, die über die bereits in Punkt 1.5 erwähnte Konditionierung Rauchverlangen verursachen können, verstärkt werden. [9] Das Spektrum an Entzugserscheinungen kann Wochen bis Monate andauern und ist individuell stark ausgeprägt. 1.6.1 Biochemische Marker Als biochemische Marker für ein Maß der Zigarettensucht stehen die Messung des Nikotin-Plasmaspiegels, des Kotinin-Spiegels in Speichel, Blutplasma oder Urin oder die Messung der CO-Konzentration in der Ausatemluft zur Verfügung. RaucherInnen mit einem Konsum von 20 Zigaretten / Tag weisen hierbei einen Kohlenmonoxid-Wert von 15-30 ppm auf, bei einem täglichen Konsum von 25 oder mehr Zigaretten / Tag kann von CO-Werten von 40 ppm und mehr ausgegangen werden. [16] 1.6.2 Fagerström-Test Genauso wie die Definition der Abhängigkeit mittels verschiedener Kriterien muss auch die Stärke der Abhängigkeit ermittelt werden. Die Stärke der Nikotinabhängigkeit kann mit dem Fagerström-Test für Zigarettenabhängigkeit, kurz FTZA, bestimmt werden. Hierbei kann mittels gezielter Fragen auf das Rauchverhalten der PatientIn eine zuverlässige Prognose für den Erfolg der Zigarettenentwöhnung nach 12 Monaten und eine Klassifizierung der Zigarettensucht getroffen werden. Außerdem stellt der ermittelte Schweregrad der Abhängigkeit weitere Hilfestellungen für die Ermittlung der Dosierung und Dauer von geplanten medikamentösen Therapien sowie zusätzlichen, unterstützenden psychotherapeutischen Maßnahmen dar. Die Testergebnisse korrelieren mit biometrischen Markern, die beim laborchemischen Erfassen und Quantifizieren der Nikotinsucht zur Verfügung stehen, wie zum Beispiel dem Kotininspiegel in Blut und Urin oder dem Kohlenmonoxidgehalt in der Ausatemluft. [20] 9 Besondere Nutzung findet der Test vor allem bei der Planung einer Suchttherapie bei Jugendlichen und Erwachsenen und in der Forschung. Der FTZA ist leicht verständlich und schnell durchführbar. Bei insgesamt 6 Fragen mit jeweils 2-4 Antwortmöglichkeiten kann eine Gesamtpunktezahl von höchstens 10 Punkten erreicht werden. Ein hoher Summenwert im FTZA bedeutet zwar einen hohen Grad der Abhängigkeit, jedoch nicht automatisch abstinenzunfähig zu sein oder an den stärksten Entzugserscheinungen leiden zu müssen. Vielmehr werden gescheiterte Aufhörversuche der RaucherInnen verständlicher. In Deutschland erreicht etwa die Hälfte der Rauchenden einen FTZA-Score von 3, ein Drittel sogar einen Wert von 4 und höher. [16] In Abbildung 4 sind die Fragen- und Antwortmöglichkeiten des Fagerström-Tests für Zigarettenabhängigkeit inklusive der zu ermittelnden Punktzahl dargestellt, Tabelle 1 zeigt die dazugehörigen Abhängigkeitskategorien. Abbildung 4: Fagerström-Test für Zigarettenabhängigkeit [9] 10 Tabelle 1: Auswertung Summenwert Fagerström-Test für Zigarettenabhängigkeit Quelle: Wiener klinische Wochenschrift - Richtlinien der Tabakentwöhnung Stand 2010 [21] Auswertung Summenwert Fagerström-Test für Zigarettenabhängigkeit Punktezahl Abhängigkeitsgrad 0-2 sehr niedrig 3-4 niedrig 5 mittel 6-7 hoch 8-10 sehr hoch Bei Testergebnissen von 0-2 Punkten oder 3-4 Punkten kann von einem sehr niedrigen beziehungsweise niedrigen Abhängigkeitsgrad der RaucherIn ausgegangen werden, wohingegen 5 Punkte eine mittelstarke Abhängigkeit anzeigen und Testergebnisse von 6-7 Punkten oder sogar 8-10 Punkten mit einem hohen beziehungsweise sehr hohen Abhängigkeitsgrad korrelieren. [21] 1.7 Tabakrauch In diesem Kapitel sollen die chemischen und physikalischen Vorgänge des Zigarettenrauchens, welches heutzutage die gängigste Variante des Tabakkonsums darstellt, erläutert werden. Abbildung 5: Schema Tabakabbrand [3] Tabak und Zigarettenpapier werden in der Glutzone, in der durch Sog am Mundstück der Zigarette Temperaturen bis um 900°C erreicht werden, unter reduktiven Bedingungen verbrannt, wobei ein Gemisch aus gasförmigen Reaktionsprodukten entsteht. Es folgt die Destillationszone, in der durch den 11 entstehenden Wasserdampf Nikotin und weitere Inhaltsstoffe des Tabaks destilliert werden. Die freigesetzten Stoffe vermischen sich zu einem Aerosol. Teile dieses Aerosols schlagen sich in der so genannten Kondensationszone, also dem unverbrannten Restteil der Zigarette, nieder, weswegen es mit fortschreitendem Abbrand zu einer stetigen (Neu-)Anreicherung des Destillats kommt. Aus diesem Grund ist es außerdem förderlich, eine Zigarette nie weiter als bis zu zwei Drittel abzurauchen: das letzte Drittel fungiert als natürlicher Filter und enthält außerdem die stärkste Schadstoffkonzentration. [22] Der Hauptstromrauch wird von der RaucherIn über das Mundstück oder den Zigarettenfilter inhaliert, der Nebenstromrauch verdünnt sich, von der RaucherIn „ungenutzt“, in der Umgebungsluft. Da beim Entstehen des Nebenstromrauches in den Zugpausen, beim so genannten Glimmen der Zigarette, niedrigere Temperaturen von nur 500-600°C vorherrschen, findet der Verbrennungsprozess hier unvollständiger Nebenstromrauches ist statt. Die Kohlenmonoxid-Konzentration dementsprechend 2,5-fach höher als die des des Hauptstromrauches, zusätzlich ist die Schadstoffkonzentration höher. Die enthaltenen Schadstoffpartikel, welche bereits im Hauptstromrauch eine Partikelgröße von nur 0,2-1 µm aufweisen und als Feinstaub klassifiziert werden können, weisen nun eine noch geringere Größe auf. So können sie tiefer ins Alveolargewebe vordringen, wo sie dann haften bleiben. Dies stellt die besondere Belastung und Gefährdung, vor allem in geschlossenen Räumen, des Passivrauchens dar. [23] Neben Nikotin sind vor allem Kohlenmonoxid (CO), Stickstoffmonoxid (NO), Stickstoffdioxid (NO2) im Tabakrauch von Bedeutung. Zusätzlich konnten im Tabakrauch bis jetzt mehrere 1000 Substanzen, unzählige davon toxisch oder kanzerogen, identifiziert werden. Vor allem die kanzerogenen Stoffgruppen der polyzyklischen, aromatischen Kohlenwasserstoffe, Nitrosamine und aromatischen Amine spielen hierbei eine bedeutsame Rolle. Außerdem konnten im Tabakrauch Schwermetalle wie Chrom, Arsen, Cadmium und Vanadium nachgewiesen werden. [3] 12 1.8 Chronische Schädigung durch Tabakrauch Im „WHO global report: mortality attributable to tobacco“ aus dem Jahr 2012 werden 12% der weltweiten Todesfälle (16% Männer, 7% Frauen) von über 30-Jährigen den Folgen von Tabakrauch zugeschrieben.[24] Die folgende Abbildung 6 soll einen Überblick über die geografischen Unterschiede hinsichtlich der Tabak-assoziierten Mortalitätsraten liefern. Abbildung 6: WHO global report: Tabak-assoziierte Todesfälle (in %) 2012 [24] Jährlich sterben weltweit rund 5,4 Millionen Menschen an den Folgen von chronischem Tabakkonsum, mehr als ein Drittel davon in sogenannten Industrieländern. Bei gleichbleibender Entwicklung der Rauchprävalenz wird im Jahr 2030 von der WHO sogar von etwa 8 Millionen Todesfällen pro Jahr ausgegangen. [25] Die 6 dort häufigsten Todesursachen (Herzinfarkt, KHK, Herzinsuffizienz, Schlaganfall, COPD und Lungenkrebs) sind allesamt bedeutend durch chronischen Tabakkonsum bedingt. Man spricht bei Krankheiten, die bei TabakkonsumentInnen oder RaucherInnen häufiger auftreten als bei NichtraucherInnen, von tabak-assoziierten Erkrankungen. Etwa ein Drittel der tabak-assoziierten Todesfälle wird durch Karzinomerkrankungen verursacht, ein weiteres Drittel durch kardiovaskuläre Erkrankungen und rund 25% durch chronisch obstruktive Lungenerkrankungen. Die schwerwiegenden Gesundheitsschäden, die durch chronischen Zigarettenkonsum verursacht werden, treten in der Regel erst mit einer Latenz von Jahren oder Jahrzehnten auf. Aus diesem Grund sind RaucherInnen lange nicht zur 13 Abstinenz bereit und können das entstandene Gesundheitsrisiko lange Zeit denunzieren. [26] [27] Tabelle 2: Erhöhtes Mortalitätsrisiko (relative Risikoerhöhung) von RaucherInnen im Vergleich [3] RaucherInnen Alle Krebserkrankungen RaucherInnen (>25 Zig. / Tag) Ex-RaucherInnen 2,2 3,1 1,3 Larynx, Pharynx, Mundhöhle 24 48 3 Lunge 15 25 4,1 Ösophagus 7,5 11,2 4,7 Harnblase 1,6 2,2 3,6 Pankreas 1,4 1,9 3,1 Nieren 1,4 1,3 1,2 COPD 12,7 22,5 5,7 Alle kardiovaskulären Erkrankungen 1,6 1,9 1,2 Herzinfarkt 1,6 1,8 1,2 Arteriosklerose 1,8 3,3 0,8 Aortenaneurysma 4,1 5,4 2,2 Kardiovaskuläre Erkrankungen: Durch die direkte atherogene Gefäßwirkung von Tabakrauch steigt die Inzidenz und Mortalität aller wichtigen kardiovaskulären Erkrankungen (KHK, Herzinfarkt, Apoplex, Aorten-aneurysma, periphere obstruktive Gefäßerkrankungen) mit dem Zigarettenrauchen an. Die relative Risikoerhöhung zur Erkrankung an einer kardiovaskulären Erkrankung liegt für RaucherInnen im Vergleich zu NichtraucherInnen bei 1,6 (vgl. Tabelle 2). Außerdem dürfen arterielle Erkrankungen der unteren Extremitäten, wie zum Beispiel Arteriosklerose oder Thrombangiitis obliterans, die mit dem Ausmaß des Tabakkonsums korrelieren, nicht unerwähnt bleiben. Durch Nikotinwirkungen möglicherweise verursacht oder verstärkt, führen sie zwar nicht zum Tod, machen jedoch mit ihrem Endstadium „Raucherbein“ eine Amputation der betroffenen Extremität oft unumgänglich. [3] 14 Krebserkrankungen: Die relative Risikoerhöhung für RaucherInnen, an einer Krebserkrankung zu versterben, beträgt 2,2. Unter den Tabak-assoziierten Krebserkrankungen stehen Tumoren der Lunge und im Bereich der Mundhöhle oder der oberen Atemwege an 1. Stelle. Bösartige Lungentumore weltweit sind bei Männern zu 90%, bei Frauen zu 75% die Folge von chronischem Tabakkonsum. [28] Bei Tumoren der Mundhöhle sowie der oberen und unteren Atemwege kann auf Grund der chronischen, direkten Schadstoffexposition eine höhere relative Risikoerhöhung beobachtet werden als bei Tumoren von Harnblase, Nieren oder Pankreas, die über den Metabolismus nur einer geringeren Schadstoffbelastung ausgesetzt sind. In Tabelle 2 wird die relative Risikoerhöhung von RaucherInnen im Vergleich zu NichtraucherInnen in Bezug auf tabak-assoziierte Krebserkrankungen dargestellt. [3] Pulmonale Erkrankungen: Tabakrauch enthält zahlreiche Schadstoffe, die lokal inflammatorisch wirken, Lungengewebe schädigen und eine erhöhte Produktion von Bronchialschleim bewirken. Zusätzlich wird durch Tabakrauch der Selbstreinigungsmechanismus der Atemwege zerstört: durch die Destruktion der Flimmerhärchen des respiratorischen Flimmerepithels, die über oralwärts gerichtete Zilienschläge Fremdstoffe gemeinsam mit Bronchialschleim aus den Atemwegen abtransportieren sollen, und einer erhöhten Viskosität des Bronchialschleims kommt es zu einem Sekretstau. Außerdem kommt es durch freie Sauerstoffradikale zu einer Überaktivierung der Immunabwehr, einer Destruktion von Alveolargewebe und einer vermehrten Ausbildung von glatter Muskulatur. In Abbildung 7 ist die Pathophysiologie der schädigenden Wirkung des Tabakrauches auf das Lungengewebe schematisch dargestellt. Durch eine Festsetzung von Teerpartikeln kommt es im Bereich der oberen Atemwege zu lokalen Schleimhautreizungen. Folgen sind vor allem chronische Entzündungen im Bereich von Pharynx und Larynx. Außerdem werden chronische Bronchitiden und COPD fast ausschließlich von Rauchen verursacht. Jeder 4.-5. RaucherIn entwickelt irgendwann eine COPD, die Krankheitsursache ist in Deutschland zu etwa 90% chronisches Tabakrauchen. [29] 15 Abbildung 7: Auswirkungen des Tabakrauches auf die Atemwege und die Lunge [29] Weitere Gesundheitsschädigungen: Durch die Wirkung von Nikotin auf das sympathoadrenale System haben RaucherInnen auf Grund erhöhter Stoffwechselaktivität und einem höheren Grundumsatz ein geringeres Körpergewicht als NichtraucherInnen. Abmagerung, so genannte „Raucherkachexie“, stellt den Extremfall dieses Phänomens bei exzessivem Rauchen und gleichzeitig verminderter Nahrungsaufnahme dar. Durch ein Zusammenspiel von gesteigerter Magensaftproduktion, verminderter Schleimhautdurchblutung, gesteigerter gastrointestinaler Motilität und vermindertem Pylorustonus finden sich bei RaucherInnen häufiger Geschwüre im Bereich des Magens und des Zwölffingerdarmes als bei NichtraucherInnen. Zusätzlich kann es durch chronische Reizung durch Teerbestandteile der Schleimhäute im Bereich von Mund- und Nasenhöhle zu vermindertem Geschmacks- und Geruchsinn oder zu chronischen Zahnfleischentzündungen kommen. Chronisches Rauchen kann auch zur Entstehung von Augenerkrankungen wie zum Beispiel Katarakt oder Retinadegeneration beitragen, die im schlimmsten Fall sogar zur Erblindung führen können. Als verantwortliche Ursachen müssen hier vor allem lokale Ischämie, Vitaminmangel (Folsäure, Vitamin B12) und erhöhte oxidative Schädigung aufgeführt werden. [3] 16 Rauchen in der Schwangerschaft: Nikotin ist plazentagängig, weswegen der Fötus von allen Wirkmechanismen gleichermaßen wie die Mutter betroffen ist. Auf Grund verminderter Plazentadurchblutung und erhöhter Kohlenmonoxid-Konzentration im Blut erleidet der Fötus chronischen Sauerstoffmangel. Die verringerte plazentare Durchblutung führt außerdem zu Wachstumsretardierung einer schlechteren mit Nährstoffversorgung: vermindertem intrauterine Längenwachstum und Geburtsgewichtdefiziten sind die Folge. In Abbildung 8 ist der Einfluss von Rauchen in der Schwangerschaft auf das Geburtsgewicht dargestellt. Bei Föten rauchender Spätschwangerer kann außerdem eine Steigerung der Herzfrequenz beobachtet werden. Durch eine erhöhte Reagibilität im Uterus ist die Frühgeburtenrate unter rauchenden Schwangeren fast doppelt so hoch wie bei NichtraucherInnen, das Risiko für SIDS, plötzlicher Säuglingstod, ist beim Rauchen von 10 Zigaretten täglich um das Siebenfache erhöht. [30] [3] Abbildung 8: Einfluss von Zigarettenrauchen auf Geburtsgewicht [3] 1.9 Toxizität Nikotin ist, neben seinen vielfach stimulierenden, von Rauchern geschätzten Wirkungen, auch ein starkes Gift. Die akute orale Letaldosis beträgt circa 0.5 bis 0.75 mg/kg Körpergewicht, was etwa 40-60mg Nikotin bei einem Erwachsenen entspricht. [31] 17 Obwohl diese tödliche Nikotindosis bereits in 5 Zigaretten oder 1 Zigarre enthalten ist, sind akute Nikotinvergiftungen durch Tabakrauchen sehr selten. Ein Großteil des enthaltenen Nikotins verpufft meistens „wirkungslos“ über den Nebenstromrauch der Zigarette in der Umgebungsluft, ohne eingeatmet zu werden. Bereits höhere Dosen von Nikotin können Krämpfe auslösen. Leichte Nikotinvergiftungen zeigen Symptome wie Kopfschmerzen, Erbrechen, Übelkeit, Tremor der Hände und Durchfall. Bei schweren Vergiftungen kommt es zusätzlich noch Muskelschwäche, zu cholinergen gastrointestinale Symptomen Krämpfe, etc.), (z.B. Hypersalivation, zentralen Krämpfen, Kreislaufversagen, Erregtheit und schließlich dem Tod durch Atemlähmung und Herzstillstand. Die Therapie der Nikotinvergiftung ist, je nach Schwere der Symptomatik, in erster Linie symptomatisch. Krämpfe werden mit Benzodiazepinen behandelt, außerdem wird die Gabe von medizinischer Kohle, Carbo medicinalis, zur weiteren Resorptionsverhinderung empfohlen. Bei Nikotinvergiftungen über die Haut ist zusätzlich die gründliche Reinigung mit viel Wasser und Seife notwendig. [22] [32] Schwere Nikotinvergiftungen können neben der symptomatischen Therapie auch eine Antagonisierung mit Atropin oder Biperiden erforderlich machen. [33] [34] 1.10 Epidemiologie Laut einem Bericht der WHO haben weltweit im Jahr 2015 mehr als 1,1 Milliarden Menschen regelmäßig Tabak geraucht. Die weltweite Prävalenz für das Rauchen liegt bei 38% der Männer und 22% der Frauen. Obwohl die Prävalenz des Tabakrauchens in vielen Ländern rückläufig ist, zeigt sich ein Anstieg in den WHO Regionen Naher Osten, Asien und Afrika. [35] Insgesamt starben laut dem WHO Bericht „Report on the global tobacco epidemic“ aus dem Jahr 2008 im 20. Jahrhundert 100 Millionen Menschen an den Folgen von Tabak, für das 21. Jahrhundert wird sogar insgesamt von ungefähr 1 Milliarde Todesfällen ausgegangen. Aktuell werden den Folgen von Tabak jährlich 5,4 Millionen Todesfälle zugesprochen. Für das Jahr 2030 soll sich die Anzahl sogar auf über 8 Millionen erhöhen, mit über 80% der Todesfälle aus sogenannten Entwicklungsländern. [25] 18 In Österreich haben im Jahr 2014 laut einem Bericht der Statistik Austria etwa 1,8 Millionen Menschen mit einem Alter über 15 Jahren täglich geraucht, wobei hier der Anteil der rauchenden Männer, im Gegensatz zur weltweiten Prävalenz, mit 26,5% nur geringfügig höher ausfällt als der der Frauen (22,1%). In einer Gesundheitsbefragung im Jahre 2014 in Österreich zeigte sich ein Gipfel der täglich rauchenden Menschen in den Altersklassen von 15-30 Jahren (32,2% Männer, 27,8% Frauen) und 30-45 Jahren (33,2 Männer, 27,9% Frauen). Ab einem Alter von 45 Jahren nimmt der Anteil der täglich rauchenden Menschen wieder ab (29,8% Männer, 26,9% Frauen). Vor allem in den Altersklassen 60-75 Jahren (13,6% RaucherInnen) und >75 Jahren (3,6% RaucherInnen) ist Rauchen weniger attraktiv. Tabelle 3: Rauchverhalten der österr. Bevölkerung >15 Jahre, Statistik Austria – Gesundheitsbefragung 2014 Quelle: Statistik Austria – Gesundheitsbefragung 2014: aktueller Raucherstatus [36] Merkmale Raucher täglich gesamt (%) Raucher täglich Männer (%) Raucher täglich Frauen (%) Gesamt 24,3 26,5 22,1 Alter (in vollendeten Jahren) 15-30 30,1 32,2 27,8 30-45 30,6 33,2 27,9 45-60 28,4 29,8 26,9 60-75 13,6 13,8 13,4 >75 3,6 5,5 2,4 Neben dem Geschlechter- und Altersunterschied zeigt sich auch ein starkes sozioökonomisches Gefälle: die Anzahl der RaucherInnen nimmt mit zunehmender Höhe des Bildungsgrades ab. Ebenso kann ein starker Zusammenhang in Bezug auf die Erwerbstätigkeit erkannt werden: Der Anteil der erwerbstätigen RaucherInnen ist erheblich niedriger als der der Arbeitslosen. [37] 19 2 Material und Methoden Bei dieser Diplomarbeit handelt es sich um eine Literaturrecherche zum Thema medikamentöse Therapiemöglichkeiten zur RaucherInnenentwöhnung. Für den allgemeinen Teil der Einleitung wurde hauptsächlich in pharmakologischen und auch suchtmedizinischen Lehrbüchern und darin empfohlenen spezifischen, weiterführenden Fachbüchern sowie Fachzeitschriften recherchiert und Informationen aus Stoffdatenbanken sowie Fachinformationen und Leitlinien ergänzt. Der spezielle Teil der Ergebnisse basiert vor allem auf englischsprachigen Originalarbeiten und auch Reviews aus der medizinischen Datenbank PubMed, zu denen ich über den Account der Bibliothek der Medizinischen Universität Graz Zugang erhielt. Als Suchbegriffe kamen hierbei „nicotine dependence“, „smoking cessation“, „smoking“, „cigarette smoking“, „tobacco“, „varenicline“, „bupropion“, „nicotine replacement therapy“, „efficacy“, „safety“, „adverse effects“ oder Kombinationen aus diesen Suchbegriffen zum Einsatz. Außerdem verwendete ich zur weiteren Recherche noch die Suchmaschine Google Scholar, die Datenbank DrugBank und Websites diverser Gesundheits- und Statistikorganisationen. 20 3 Ergebnisse – Resultate In den „Richtlinien der Tabakentwöhnung Stand 2010“ der Österreichischen Gesellschaft für Pneumologie werden als medikamentöse first-line Therapie zur Raucherentwöhnung mit zuverlässiger Langzeitabstinenz neben den unterschiedlichsten Verabreichungsformen der Nikotinersatztherapie die Wirkstoffe Bupropion und Vareniclin gelistet. Zusätzlich zur medikamentösen Therapie empfiehlt sich auch dringend die Beratung der PatientInnen, da sie nachweislich die Erfolgsrate in der für die Langzeitabstinenz in der Tabakentwöhnung verbessert. Medikamentöse Entwöhnungstherapie ohne vorherige Beratung wird nicht empfohlen. Die oben angeführte Richtlinie besagt, dass Ärztinnen und Ärzte jedem Raucher/jeder Raucherin in Kurzinterventionen zum Aufgeben des Rauchens raten sollen. Bereits kurze Beratungen mit einer Dauer von weniger als 3 Minuten vergrößern die Abstinenzraten. [21] 3.1 Nikotinersatztherapie Unter Nikotinersatztherapie versteht man die kontrollierte Substitution pharmakologischer Nikotinpräparate während der RaucherInnenentwöhnung. Auf Grund des schnellen Metabolismus von Nikotin im menschlichen Körper können Rauchverlangen und erste Anzeichen von Entzugssymptomatik bei starken Raucherinnen und Rauchern bereits nach 90-120 Minuten nach der letzten Zigarette auftreten. Stündliches Rauchen liefert einen Nikotin-Plasmaspiegel von etwa 25-30 ng/ml. [38] Durch das Aufrechterhalten eines konstanten, jedoch niedrigeren NikotinPlasmaspiegels als beim Rauchen sollen die Entzugssymptomatik während der Rauchentwöhnung minimiert und das Rauchverlangen, das sogenannte Craving, gesenkt werden. Medizinisches Nikotin verfügt über die gleiche Pharmakologie wie Nikotin aus Tabakprodukten, auf Grund der verlangsamten Resorption über die verschiedenen Darreichungsformen ist jedoch der stimulatorische Effekt viel geringer. Aus diesem Grund ergibt sich nur ein sehr niedriges Abhängigkeitspotential für Nikotinersatzprodukte. So soll die Raucherentwöhnungstherapie unterstützt und gefördert werden. [38] 21 Metabolismus und Elimination von Nikotin im menschlichen Körper sind unabhängig von der pharmakologischen Darreichungsform und müssen daher bei der Nikotinersatztherapie nicht extra behandelt werden. Als absolute Kontraindikation nikotinhaltiger Arzneimittel ist die Anwendung bei Kindern unter 12 Jahren gelistet, eine relative Kontraindikation wird für Schwangere ausgesprochen. Der Wirkstoff ist plazentagängig, reproduktionstoxikologische Studien an verschiedenen Tierspezies haben unterschiedliche schädigende Wirkungen von Nikotin auf Feten gezeigt (Wachstumsretardierung, verlängerte Trächtigkeitsphase, Fertilitätseinschränkung, Verhaltensanomalien). Zusätzlich geht Nikotin in die Muttermilch über, weswegen die Anwendung bei Stillenden gar nicht, bzw. nur nach 2-stündiger Wirkstoffkarenz vor dem Stillen empfohlen wird. [8] [39] Die klinische Wirksamkeit von Nikotinersatzprodukten bei der Rauchentwöhnung ist wissenschaftlich bewiesen. [21] In den nachfolgenden Kapiteln werden die Nikotinersatztherapie und ihre unterschiedlichen Darreichungsformen anhand der in Österreich erhältlichen Nicorette® Produktpalette erläutert. 3.1.1 Nikotinkaugummi Nicorette® Nikotinkaugummis sind in der Dosierung 2mg oder 4mg pro Einheit erhältlich. Bei der Anwendung kommt es zu einer pH-Wert abhängigen Resorption von Nikotin über die Mund- und Zungenschleimhaut. Für ein besseres Resorptionsergebnis enthalten Nicorette® Kaugummis einen Puffer aus Natriumhydrogencarbonat-Natriumcarbonat, um den pH-Wert des Speichels auf 8,5 einstellen zu können. Nach ungefähr 20-30 Minuten stellt sich die maximale Wirkstoffkonzentration ein. Je nach Stärke der Tabaksucht sollen pro Tag als Richtwert 8-12 Stück der 2mg oder 4mg Kaugummis eingenommen werden. Die maximale Tagesdosis ist mit 16 Stück 4mg Kaugummis beschrieben, was einem Gesamtwert von 64mg Nikotin entspricht. In Abbildung 9 ist die 22 Resorptionsgeschwindigkeit von 4mg Nicorette®-Kaugummi im Vergleich mit einer Zigarette dargestellt. Abbildung 9: Vergleich Nikotin-Plasmaspiegel von Zigarette und Nicorette®-Kaugummi 4mg [39] Die Behandlungsdauer sollte mindestens 3 Monate betragen und einen maximalen Behandlungszeitraum von 12 Monaten nicht überschreiten. Neben den üblichen Nikotinwirkungen kommt es hauptsächlich zu Nebenwirkungen im Bereich des Gastrointestinaltraktes (Übelkeit, Diarrhö, Flatulenz, Dyspepsie, etc.) sowie im Bereich der Mundhöhle (Brennen). Um eine gleichmäßige Wirkstoffresorption zu erreichen, wird in der Fachinformation langsames, gleichmäßiges Kauen mit regelmäßigen Kaupausen empfohlen. [39] [38] 3.1.2 Nikotin-Lutschtablette Nicorette®-Lutschtabletten sind in den Dosierungen 2mg oder 4mg pro Einheit erhältlich. Die enthaltene Nikotinmenge kann über die Mund- und Zungenschleimhaut vollständig resorbiert werden, die Lutschtablette ist nach etwa 16-19 Minuten Verweildauer im Mundraum vollständig aufgelöst. Durch gleichzeitigen Konsum von Lebensmitteln, die den pH-Wert im Mund senken (Kaffee, Kohlensäurehaltige Getränke, Fruchtsäfte, etc.), kann die Resorptionsmenge herabgesetzt werden, da Nikotin am besten, wie bereits in Punkt 3.1.1 erwähnt, in leicht basischem Milieu resorbiert werden kann. 23 Die maximale Nikotin-Plasmakonzentration nach einer Einzeldosis von 2mg beträgt in etwa 5ng/ml, die maximale Tageseinnahmeempfehlung beläuft sich auf 30mg. Ebenso wie bei den anderen Nikotinpräparaten sollte die minimale Anwendungsdauer 3 Monate betragen und eine maximale Behandlungsdauer von 9 Monaten nicht überschritten werden. Das Nebenwirkungsspektrum (Schwindel, Kopfschmerz, gastrointestinale Nebenwirkungen, lokale Reizungen) ähnelt dem der Nikotinkaugummis. [40] [38] 3.1.3 Nikotinpflaster Transdermale Nicorette® Nikotinpflaster sind in den Dosisstärken 10mg, 15mg und 25mg erhältlich. Der Wirkstoff ist auf Matrixpflastern im Verhältnis 1,75 mg/cm² aufgebracht, die Wirkstoffresorption erfolgt über einen Zeitraum von 16h, was gleichzeitig auch der längsten empfohlenen Klebedauer der Pflaster entspricht. Über Diffusion gelangt Nikotin in die Kapillaren der Oberhaut und weiter in das Kreislaufsystem. Bei dieser Applikationsart liegt das Hauptaugenmerk auf einer gleichmäßigen Wirkstoffversorgung des Körpers. Ebenso wie bei den Nikotinkaugummis ist eine maximale Tagesdosis von 64mg Nikotin beschrieben, die maximale, ununterbrochene Behandlungsdauer wird mit 6 Monaten angeben. Als Nebenwirkung dieser Darreichungsform werden die üblichen Nikotinwirkungen sowie lokale Hautunverträglichkeiten (Pruritus, Hautrötung, Urtikaria) angegeben. [41] [38] 3.1.4 Nikotin-Inhaler Nicorette®-Inhaler verfügen über eine austauschbare Wirkstoffkapsel mit 15mg Nikotin. Über diese Darreichungsform wird vor allem die Rauchsensorik und -gestik von Zigaretten nachgeahmt. Über einen Inhalationsstift mit einer aufgesetzten Wirkstoffpatrone wird Nikotin verdampft, welches dann durch Ansaugen von Luft über die Mund- und Rachenschleimhäute resorbiert werden kann. Eine Anwendung sollte ungefähr 20 Minuten dauern, aus ca. 600 paffenden Zügen oder 80 tiefen bestehen, und führt zu einer durchschnittlichen Nikotinfreisetzung von 2mg. 24 Maximale Nikotin-Plasmaspiegel werden ungefähr 25 Minuten nach der Anwendung erreicht. Eine Patrone mit 15mg Nikotin reicht für 7 Anwendungen. Für starke Raucherinnen und Raucher mit einem Tageskonsum von mehr als 20 Zigaretten pro Tag gilt die Empfehlung von 4 bis maximal 6 Patronen pro Tag. Die empfohlene Behandlungsdauer beträgt 3 Monate, wobei ein Behandlungszeitraum von 9 Monaten nicht überschritten werden sollte. Als Nebenwirkungen werden bei dieser Darreichungsform vor allem Übelkeit, Schwindel, Geschmacksstörungen, Husten, Schluckauf und Reizung im Rachen angegeben. [42] [38] 3.1.5 Nikotin-Spray Nicorette®-Spray ist in der Dosierung 1mg Nikotin/Sprühstoß erhältlich und zur oralen Anwendung konzipiert. Die maximal empfohlene Tagesdosis liegt bei 64mg Nikotin (bis 4 Sprühstöße/h, max. 16h/Tag). Da über diese Applikationsart sehr schnell Nikotin über die Mund- und Rachenschleimhaut zugeführt und resorbiert werden kann, ist Nikotin-Spray vor allem als zusätzliche Hilfe zur Rauchentwöhnung in kritischen Situationen, also beim akuten Zigarettenverlangen, angedacht. Nach der Anwendung einer 2mg Dosis kommt es bereits nach 13 Minuten zu einer maximalen NikotinPlasmakonzentration von etwa 5,3 ng/ml. Bei dieser Art der Anwendung zeigen sich Nebenwirkungen vor allem im Gastrointestinaltrakt sowie lokal am Applikationsort (Brennen, Fatigue). [43] [38] 3.1.6 Kombinationstherapie Die Kombination von first-line Medikamenten wie zum Beispiel den unterschiedlichen Nikotinersatzprodukten ist in der Tabakentwöhnung wirksam und empfohlen, da es hierbei durch die unterschiedlichen pharmakokinetischen Eigenschaften der Präparate zu einer wirksameren Unterdrückung von Entzugserscheinungen als bei einer Einzeltherapie kommt. [21] In einer Metaanalyse des USDHHS aus dem Jahr 2008 wird die klinische Wirksamkeit für verschiedene Kombinationstherapien mit Nikotinersatztherapeutika im Placebovergleich beschrieben: die Abstinenzraten nach 6 Monaten 25 Behandlungsdauer liegen für Nikotinpflaster + Nikotin-Inhaler bei 25,8% im Gegensatz zu 13,8% beim Placebovergleich. Für die Kombinationstherapie von Nikotinpflastern und ad libitum Nikotinkaugummi oder Nikotin-Nasalspray werden sogar Abstinenzraten von 36,5% angegeben. [21] 3.2 Bupropion Abbildung 10: Strukturformel Bupropion (oben: (S)-Form, unten: (R)-Form) [44] Bupropion ist ein Wirkstoff aus der Gruppe der Amphetamine und wird als Antidepressivum bei schweren depressiven Episoden sowie zur medikamentösen RaucherInnenentwöhnung verwendet. Die Summenformel für Bupropion- Hydrochlorid (im weiteren Text nur noch Bupropion genannt) lautet C13H18ClNOHCl, der daraus resultierende Stoffname laut IUPAC (RS)-1-(3-Chlorphenyl)-2-tertbutylamino-propan-1-on.[45] Das Stoffgewicht beträgt 276,20 g/mol. [46] Chemisch gesehen ist Bupropion ein β-Ketoamphetamin-Derivat aus der Gruppe der Cathinone und eng verwandt mit den Katecholaminen, besitzt im Gegensatz zu ihnen aber als funktionelle Gruppe eine Ketongruppe. Es existiert als chirales Enantiomer in 2 spiegelbildlichen Varianten ((S)-Enantiomer, (R)-Enantiomer) und kommt als Racemat zur Anwendung. [47] In den USA ist das Medikament seit 1988 als Antidepressivum zugelassen und wurde als solches auch 2007 in den meisten europäischen Ländern eingeführt. 1997 begann in den USA die Ausdehnung der Zulassung auf die medikamentöse 26 Tabakentwöhnung, da bei depressiven PatientInnen, die mit Bupropion behandelt wurden, ein allgemeiner Rückgang des Rauchverlangens beobachtet werden konnte. [48] Bupropion hemmt selektiv die zentrale, neuronale Wiederaufnahme von Katecholaminen wie Dopamin und Noradrenalin, außerdem die Wiederaufnahme von Serotonin (Abbildung 11: schematische Darstellung des Wirkmechanismus von Bupropion am synaptischen Spalt). Abbildung 11: Wirkmechanismus Bupropion: selektive Wiederaufnahmehemmung von Noradrenalin und Dopamin am synaptischen Spalt [49] Der antidepressive Wirkmechanismus ist nach heutiger Studienlage nicht hinlänglich bekannt, jedoch wird vermutet, dass diese Wirkung über dopaminerge oder noradrenerge Mechanismen Raucherentwöhnungstherapie soll verläuft. [50] Bupropion In durch der medikamentösen seine dopaminergen Eigenschaften vor allem die Entzugserscheinung lindern. 3.2.1 Pharmakologie Die maximale Plasmakonzentration nach oraler Einnahme von Bupropion stellt sich nach 5 Stunden mit einer absoluten Bioverfügbarkeit von ungefähr 87% ein. Der Wirkstoff ist ZNS-gängig und bindet an den striatalen Dopamin- Wiederaufnahmetransportern. Bupropion wird in der Leber über das Isoenzym 27 Cytochrom P450 2B6 metabolisiert und seine drei Hauptmetaboliten Hydroxybupropion, Threohydrobupropion und Erythrohydrobupropion renal mit einer Halbwertszeit von 20 Stunden, 37 Stunden und 33 Stunden eliminiert. Nur etwa 0,5% des Wirkstoffes werden unverändert ausgeschieden. [50] [51] 3.2.2 Nebenwirkungen Durch die chemische Verwandtschaft zu den Katecholaminen unterscheidet sich das Nebenwirkungsspektrum von Bupropion deutlich von dem der Antidepressiva und ähnelt eher dem der Psychostimulanzien. So sind als häufigste Nebenwirkungen Mundtrockenheit und Schlaflosigkeit beschrieben, weswegen das Medikament auch nicht abends eingenommen werden sollte. Weitere häufige Nebenwirkungen sind Urtikaria mit Juckreiz, Appetitlosigkeit, Gewichtsverlust, Angst, Agitiertheit, Zittern, Kopfschmerzen, Schwindel, Geschmacksstörungen, Tinnitus, Sehstörungen, Tinnitus, Gesichtsröte, Blutdruckerhöhungen, gastrointestinale Nebenwirkungen oder Asthenie. Als seltene Nebenwirkung mit einer Häufigkeit von 0,1% wird außerdem noch das Auftreten von Krampfanfällen im Sinne von generalisierten, tonisch-klonischen Anfällen, beziehungsweise ein Herabsetzen der Krampfschwelle angegeben. [52] [53] [50] Akute Überdosierungen beim Menschen mit der 10-fach therapeutischen Dosis verursachen, neben dem oben angeführten Nebenwirkungsspektrum, außerdem Schläfrigkeit, Bewusstseinsverlust und kardiale Nebenwirkungen. Zusätzlich zu Arrhythmien und Tachykardien konnten vor allem Veränderungen im EKG (Verbreiterungen QRS-Komplex, QTc-Zeit-Verlängerungen) nachgewiesen werden. [50] 3.2.3 Gegenanzeigen / Kontraindikationen Die Einnahme von Bupropion ist für Kinder und Jugendliche unter 18 Jahren sowie für Schwangere kontraindiziert. Gleichzeitiger Gebrauch von MAO-Hemmern und Bupropion ist nicht empfohlen. Zusätzlich besteht eine Kontraindikation bei bekannter Überempfindlichkeit, Essstörungen, schweren Leber- oder Nierenschäden, Alkohol- oder Benzodiazepinentzug oder bekannter ZNSTumorerkrankung. Auf Grund der erhöhten Krampfneigung darf Bupropion nicht bei 28 einem anamnestischen Krampfleiden oder der gleichzeitigen Verwendung von Medikamenten, die die Krampfschwelle Antipsychotika, Antimalariamittel, herabsetzen sedierenden (Antidepressiva, Antihistaminika, Tramadol, systemische Steroide, Theophyllin) eingenommen werden. [48] [21] 3.2.4 Klinische Wirksamkeit Hurt. et al. verglichen 1997 die Wirksamkeit von Bupropion in der Studie „A Comparison of Sustained-Release Bupropion and Placebo for Smoking Cessation“ mittels einer randomisierten, placebo-kontrollierten Doppelblindstudie mit 615 StudienteilnehmerInnen. Nach einer 7-tägigen Bupropion- oder Placeboeinnahme (Dosierung Bupropion: 100mg/150mg/300mg pro Tag) erfolgte der Rauchstopp mit einer anschließenden 6-wöchigen Medikamenteneinnahme. Abbildung 12: Hurt et al. 1997: Rauchabstinenz - Bupropion im Vergleich mit Placebo nach 6 Wochen [54] 6 Wochen nach dem Rauchstopp gab es in der Placebogruppe eine ununterbrochene Abstinenzrate von nur 10,5%, in der Gruppe mit 100mg Bupropion hingegen eine Abstinenzrate von 13,7%, in der Gruppe mit 150mg Bupropion eine Abstinenzrate von 18,3% und in der Gruppe mit 300mg Bupropion eine Abstinenzrate von sogar 24,4% (siehe Abbildung 12). [54] In Tabelle 4 ist der Vergleich der biochemisch verifizierten (KohlenstoffmonoxidGehalt der Ausatemluft: <10 ppm) Langzeitabstinenzrate der verschiedenen Gruppen dargestellt: Während sie in der Placebogruppe zum Zeitpunkt 6 Wochen nach Rauchstopp und 12 Monate nach Rauchstopp 19,0% und 12,4% betrugen, 29 fanden sich in der Bupropiongruppe mit 300mg 6 Wochen und 12 Monate nach Rauchstopp 44,2% respektive 23,1% NichtraucherInnen. [54] Bupropion zeigt also in der Behandlung der RaucherInnenentwöhnung einen deutlichen Benefit durch eine höhere Langzeitsabstinenzrate. Tabelle 4: Langzeitrauchabstinenz - Bupropion im Vergleich mit Placebo, nach Hurt et al. 1997 [54] Zeit nach Rauchstopp Anzahl der NichtraucherInnen (in %) 6 Wochen Placebo (n = 153) 19,0 100mg Bupropion (n = 153) 28,8 150mg Bupropion (n = 153) 38,6 300mg Bupropion (n = 156) 44,2 3 Monate 14,4 24,2 26,1 29,5 6 Monate 15,7 24,2 27,5 26,9 12 Monate 12,4 19,6 22,9 23,1 Jorenby et al. validierten 1999 die Wirksamkeit von Bupropion in der Studie „A controlled trial of sustained-release bupropion, a nicotine patch, or both for smoking cessation.“ In einer randomisierten, placebo-kontrollierten Doppelblindstudie mit 893 ProbandInnen wurde die Wirksamkeit in Bezug auf die Rauchabstinenz von Bupropion (300mg) im Vergleich zu Placebo, Nikotinpflastern (21mg) und einer Kombination (Bupropion 300mg, Nikotinpflaster 21mg) mit einer Behandlungsdauer von insgesamt 9 Wochen überprüft. Bupropion wurde an den ersten 3 Tagen mit 150mg auftitriert, die Einnahme von 300mg erfolgte ab dem 4. Tag der Studie. Nikotinpflaster wurden ab dem Rauchstopp am 8. Tag mit 21mg täglich appliziert und in Woche 8 mit 14mg und Woche 9 mit 7 mg täglich ausgeschlichen. Am 8. Tag der medikamentösen Behandlung erfolgte der Rauchstopp, gefolgt von einer 8-wöchigen medikamentösen Therapie. In Tabelle 5 und Abbildung 13 ist der Vergleich der biochemisch verifizierten (Kohlenstoffmonoxid-Gehalt Ausatemluft: <10 ppm) Langzeitabstinenzrate der verschiedenen Gruppen dargestellt: 30 Tabelle 5: Langzeitrauchabstinenz - Bupropion im Vergleich mit Placebo, Nikotin-Patch und Bupropion + NikotinPatch, nach Jorenby et al. 1999 [55] Zeit nach Rauchstopp Anzahl der NichtraucherInnen (in %) Placebo (n = 160) Nicotine patch (n = 244) Bupropion (n = 244) Bupropion + Nicotine patch (n = 245) 4 Wochen 33,8 48,0 60,2 66,5 6 Monate 18,8 21,3 34,8 38,8 12 Monate 15,6 16,4 30,3 35,5 Während sie in der Placebogruppe zum Zeitpunkt 4 Wochen, 6 Monate und 12 Monate nach Rauchstopp 33,8%, 18,8% und 15,6% betrug, fand sich in der Bupropiongruppe eine Abstinenzrate von 60,2%, 34,8% und 30,3%. In der Gruppe Bupropion + Nicotine patch war sie mit 66,5%, 38,8% und 35,5% sogar noch höher [55]. Bupropion bewirkte als Monotherapie oder in Kombination mit NET eine deutliche Besserung der Langzeitsabstinenzrate bei der Tabakentwöhnung im Vergleich mit NET oder Placebo (siehe Abbildung 13). Abbildung 13: Jorenby et al. 1999: Rauchabstinenz - Bupropion im Vergleich während der Behandlung und Langzeit follow-up [55] 31 Ahluwalia et al. überprüften 2002 in der Studie „Sustained-release bupropion for smoking cessation in African Americans: a randomized controlled trial.“ ebenfalls die Wirksamkeit von Bupropion bei AfroamerikanerInnen in Bezug auf die Rauchentwöhnung in einer randomisierten, placebo-kontrollierten Doppelblindstudie mit 600 StudienteilnehmerInnen. Nach einer initialen Einnahme von Bupropion 300mg über 1 Woche (Tag 1-3: 150mg) folgten der Rauchstopp und eine weitere Einnahme von 300mg Bupropion für die Dauer von 6 weiteren Wochen. Die Rate der kontinuierlichen Rauchabstinenz, wie in Abbildung 14 dargestellt, war zum Zeitpunkt 1 Woche, 3 Wochen und 6 Wochen nach dem Rauchstopp in der Bupropiongruppe mit einem Signifikanzwert von p<0,001 höher als in der Placebogruppe, zum Zeitpunkt 26 Wochen nach Rauchstopp noch mit einem Signifikanzwert von p<0,01 höher als in der Placebogruppe. [56] Abbildung 14: Ahluwalia et al. 2002: Rauchabstinenz - Bupropion im Placebo-Vergleich, während Behandlung und Langzeit follow-up [56] Die biochemisch verifizierte Abstinenzrate (Kohlenstoffmonoxid-Gehalt der Ausatemluft <10 ppm), wie in Tabelle 6 dargestellt, betrug für die Bupropiongruppe zu den Zeitpunkten 1 Woche, 3 Wochen, 6 Wochen und 26 Wochen nach Rauchstopp 36,3%, 30,7% 36,0% und 21,0%. Die der Placebogruppe zu denselben Zeitpunkten nur 15,7%, 13,7%, 19,0% und 13,7%. 32 Tabelle 6: Langzeitrauchabstinenz - Bupropion 300mg im Vergleich mit Placebo, nach Ahluwalia et al. 2002 [56] Zeit nach Rauchstopp Anzahl der NichtraucherInnen (in %) Bupropion 300mg (n = 300) Placebo (n = 300) 1 Woche 36,3 15,7 3 Wochen 30,7 13,7 6 Wochen 36,0 19,0 26 Wochen 21,0 13,7 Auch hier zeigt sich die deutliche Wirkung von Bupropion bei der medikamentösen Rauchentwöhnung, sowohl während der medikamentösen Behandlung als auch im Langzeit follow-up. 3.3 Vareniclin Abbildung 15: Strukturformel Vareniclin [57] Vareniclin ist ein selektiver, partieller Agonist am Nikotinrezeptor und wird zur medikamentösen RaucherInnenentwöhnung eingesetzt. Chemisch gesehen ist es ein Derivat des Alkaloids Cytisin, welches im Goldregen vorkommt. Die Summenformel von Vareniclin lautet C13H13N3, der daraus resultierende Stoffname laut IUPAC (6R,10S)-7,8,9,10-Tetrahydro-6,10-methano-6H- pyrazino[2,3-h]-[3]benzazepin. Das molekulare Stoffgewicht beträgt 211,26 g/mol [58]. Vareniclin wurde 2006 in der EU als RaucherInnenentwöhnungsmittel zugelassen und wird in Deutschland und Österreich vom Pharmakonzern Pfizer unter dem Namen Champix® vertrieben. [59] 33 Die Wirkung von Vareniclin als Entwöhnungsmittel bei der Nikotinsucht beruht auf seinem selektiven Agonismus an der α4β2-Untereinheit des nikotinischen Acetylcholinrezeptors. Vareniclin bindet mit höherer Affinität, jedoch niedrigerer intrinsischer Aktivität als Nikotin an den Nikotinrezeptor und führt durch seine agonistische Wirkung zu einer Dopaminfreisetzung im Nucleus accumbens, dem Belohnungszentrum des Gehirns [22]. Dadurch werden Entzugserscheinungen und craving bei der Tabakentwöhnung gelindert werden (Siehe Abbildung 16). Zusätzlich wird dadurch verhindert, dass gleichzeitig zugeführtes Nikotin am selben Rezeptor seine Wirkung entfalten kann. [48] Somit ist Vareniclin der erste Wirkstoff zur RaucherInnenentwöhnung, der mit seiner Wirkung die neurobiologische Komponente der Nikotinsucht angreifen und unterbinden soll. [60] [61] Abbildung 16: Vereinfachtes Schema des Wirkmechanismus von Vareniclin am Nikotinrezeptor [60]: A: Freisetzung von Dopamin im Nucleus accumbens durch Nikotinwirkung am Nikotin-Rezeptor, B: Verminderte Dopaminausschüttung durch Nikotinentzug C: Blockade des Nikotinrezeptors durch Vareniclin: als selektiver, partieller Agonist belegt es zwar die N-Rezeptoren, durch induzierte, moderate Dopaminausschüttung werden aber Entzugserscheinungen und Craving herabgesetzt. [60] 3.3.1 Pharmakologie Vareniclin wird bei der oralen Einnahme rasch und fast vollständig resorbiert, maximale Plasmakonzentrationen liegen nach etwa 3-4 Stunden vor. Vareniclin wird nur in geringem Maß metabolisiert, Cytochrom-P450-Enzyme werden nicht gehemmt. Im Kreislauf liegt die Substanz nahezu in unveränderter Form vor, nur 34 circa 10% zirkulieren als Metaboliten (Vareniclin-N-Carbamoylglukuronid, NGlukosylvareniclin). Ungefähr 92% des Wirkstoffes werden mit einer Halbwertszeit von 24 Stunden unverändert renal über die glomeruläre Filtration und aktive tubuläre Sekretion eliminiert. [61] [58] 3.3.2 Nebenwirkungen Als häufige Nebenwirkungen unter der Behandlung mit Vareniclin werden häufig Entzündungen der Atemwege (Nasopharynx, Sinus, Bronchien), Gewichtszunahme, verändertes Appetitgefühl, Schlaflosigkeit, abnorme Träume, Kopfschmerzen, Somnolenz, Schwindel, Dysgeusie, Dyspnoe, Husten, Übelkeit und gastrointestinale Nebenwirkungen, Hautausschlag mit Juckreiz, Arthralgien, Myalgien, Rückenschmerzen, Thoraxschmerzen, Müdigkeit und abnorme Leberfunktionstests genannt. [61] Im Jahr 2009 erstellte die FDA im „Drug Safety Newsletter Volume 2, Number 1“ einen Warnhinweis für die Substanz Vareniclin auf Grund 153 Meldungen von Nebenwirkungen suizidaler Art (Suizidgedanken: 116, Suizide: 37) von überwiegend psychiatrischen PatientInnen, die in Zusammenhang mit der medikamentösen Therapie mit Vareniclin gebracht werden konnten [62]. Im systematischen Review „Varenicline as a Cause of Suicidal Outcomes“ von Hughes aus dem Jahr 2015 konnte beim Vergleich 27 placebokontrollierter klinischer Studien mit Vareniclin jedoch kein Zusammenhang zwischen dem erhöhten Auftreten von Nebenwirkungen suizidaler Art und dem Wirkstoff selbst gefunden werden. [63] Durch das breite Nebenwirkungsspektrum kann Vareniclin die Verkehrstüchtigkeit und die Fähigkeit, schwere Maschinen zu bedienen, beeinflussen. [61] 3.3.3 Gegenanzeigen / Kontraindikationen Die Einnahme von Vareniclin ist bei PatienInnen mit schwerer oder terminaler Niereninsuffizienz auf Grund der hohen renalen Eliminationsrate nicht beziehungsweise nur dosisreduziert empfohlen. Auf Grund der unzureichenden Studienlage der Wirkung von Vareniclin in der Schwangerschaft und bei Kindern und Jugendlichen unter 18 Jahren wird die Einnahme des Wirkstoffes hierbei nicht 35 empfohlen [64]. Zusätzlich kann es bei gleichzeitiger Einnahme mit dem Wirkstoff Cimetidin, einem Wirkstoff der Gruppe H2-Antihistaminika, zu stark erhöhten Blutplasmakonzentrationen von Vareniclin kommen und ist deswegen kontraindiziert [61]. Eine Einnahme bei PatientInnen mit neuropsychiatrischen Erkrankungen oder anamnestischen Krampfgeschehen ist nur unter ärztlicher Observanz empfohlen oder kontraindiziert. [65] 3.3.4 Klinische Wirksamkeit Oncken et al. stellten 2006 die Wirksamkeit von bei der medikamentösen RaucherInnenentwöhnung in der Studie „Efficacy and Safety of the Novel Selective Nicotinic Acetylcholine Receptor Partial Agonist, Varenicline, for Smoking Cessation“ fest. In einer randomisierten, placebo-kontrollierten Doppelblindstudie wurden verschiedene Dosierungen (Tagesdosierung 1mg oder 2mg, titriert oder nicht titriert) von Vareniclin an 647 StudienteilnehmerInnen über einen Behandlungsraum von 12 Wochen getestet. Die ununterbrochene Abstinenzrate über einen Zeitraum von 4 Wochen (Woche 47) betrug für die Vareniclingruppen mit 1mg 36,3%, für die Vareniclingruppen mit 2mg 39,8% und für die Placebogruppe nur 10,9%. Die ununterbrochenen 4wöchigen Abstinenzraten (Woche 9-12) zum Ende der medikamentösen Behandlung betrugen für die verschiedenen Gruppen 44,0%, 49,4% und 11,6% (Siehe Abbildung 17). Des Weiteren konnte festgestellt werden, dass durch anfängliche Auftitration des Wirkstoffes über den Zeitraum der ersten Behandlungswoche das Auftreten der häufigsten Nebenwirkung Übelkeit deutlich reduziert werden konnte. In der Gruppe Vareniclin 2mg, nicht titriert und titriert, wurde Übelkeit von 41,9% und 34,9% der ProbandInnen angegeben und lag somit deutlich über dem Auftreten in der Placebogruppe (14,9%). Die Gruppen Vareniclin 1mg nicht titriert und titriert gaben nur in 22,6% beziehungsweise 16,3% der Fälle Übelkeit als Nebenwirkung an, womit das Auftreten in diesen beiden Gruppen, besonders in der Gruppe mit der titrierten Wirkstoffgabe, mit der Placebogruppe (14,9%) zu vergleichen ist. [66] 36 Abbildung 17: Oncken et al. 2006: Vergleich ununterbrochene, 4-wöchige Abstinenzrate von Vareniclin in unterschiedlichen Dosierungen und Placebo in der medikamentösen RaucherInnenentwöhnung [66] Rigotti et al. publizierten im 2010 die Studie „Efficacy and Safety of Varenicline for Smoking Cessation in Patients With Cardiovascular Disease“. In einer randomisierten, placebo-kontrollierten Doppelblindstudie wurde die klinische Wirksamkeit und Sicherheit von Vareniclin bei der RaucherInnenentwöhnung bei 714 ProbandInnen mit stabilen, kardiovaskulären Erkrankungen überprüft. Die Behandlung erfolgte über einen Zeitraum von 12 Wochen mit einer Tagesdosis von 2mg Vareniclin im Placebovergleich. Nach Ende der medikamentösen Behandlung über 12 Wochen stellte sich in der Vareniclingruppe eine fast dreifach erhöhte Erfolgsrate von 54,1% im Vergleich zur Placebogruppe mit 18,1% Rauchabstinenz dar (biochemisch verifiziert: CO-Gehalt der Ausatemluft <10 ppm). In Woche 24 und Woche 52 betrug sie in der Vareniclingruppe immer noch 34,9% und 27,9%, in der Placebogruppe nur noch 15,9% und 15,9%. Zusätzlich zeigte sich, dass neben der Verbesserung der Rauchabstinenz Vareniclin von PatientInnen mit stabilen kardiovaskulären Erkrankungen gut vertragen wurde und es zu keinem vermehrten Auftreten von kardiovaskulären Nebenwirkungen oder Ereignissen (Veränderung Blutdruck, Herzfrequenz, Tod durch Myokardinfarkt) oder psychiatrischen Nebenwirkungen in der Vareniclingruppe im Vergleich zur Placebogruppe kam. [67] 37 Abbildung 18: Rigotti et al. 2010: Vergleich Rauchabstinenz Vareniclin 2mg gegen Placebo, während des Behandlungszeitraumes von 12 Wochen und Langzeit follow-up [67] Tashkin et al. untersuchten 2011 in der Studie „Effects of Varenicline on Smoking Cessation in Patients With Mild to Moderate COPD“ die Wirksamkeit von Vareniclin in Bezug auf den Erfolg der medikamentösen RaucherInnenentwöhnung bei ProbandInnen mit milder bis moderater COPD (Einschlusskriterien: Schwere der COPD Gold Grad I+II). Die Studie wurde als randomisierte, placebo-kontrollierte Doppelblindstudie mit 504 StudienteilnehmerInnen (Vareniclin N=248, Placebo N=254) über einen Behandlungszeitraum von 12 Wochen (Tagesdosis von 1mg Vareniclin oder Placebo) und nachfolgender 40-wöchiger Langzeitkontrolle ohne Behandlung durchgeführt. Die klinische Wirksamkeit von Vareniclin im Vergleich zu Placebo konnte auch mittels dieser Studie belegt werden: Die Rate der ununterbrochenen Rauchabstinenz (Kriterien: Rauchabstinenz gemeldet von ProbandIn, biochemisch verifiziert durch einen CO-Gehalt der Ausatemluft <10 ppm) über den Zeitraum der letzten 4 Behandlungswochen (Woche 9 – Woche 12), das Zeitintervall Woche 9 – Woche 24 und das Langzeit follow-up (Woche 9 – Woche 52) betrugen in der Vareniclingruppe 42,3%, 25,8% und 18,6%, in der Placebogruppe nur 8,8%, 7,2% und 5,6%. [68] 38 Abbildung 19: Tashkin et al. 2011: Vergleich Rauchabstinenz Vareniclin gegen Placebo [68] Bezugnehmend auf das gehäufte Vorkommen suizidaler Nebenwirkungen (aufgeführt unter Punkt 3.3.2: Nebenwirkungen) konnten bei der Studie von Tashkin et al. keine Auffälligkeiten im Nebenwirkungsprofil des Wirkstoff Vareniclin gefunden werden. Außer den bekannten Vareniclin-Nebenwirkungen Schlafstörungen und dem Auftreten von abnormen Träumen, kam es zu einer annähernd gleichmäßigen Aufteilung psychiatrischer Nebenwirkungen wie Angststörungen, Depressionen oder Dysthymie, Aggressionen, Anpassungsstörungen oder sexuelle Dysfunktion (siehe Tabelle 7). [68] Tabelle 7: Auftreten von psychiatrischen Nebenwirkungen – Vareniclin im Vergleich zu Placebo, nach Tashkin et al. 2011 [68] Art der psychiatr. Nebenwirkungen Vareniclin 1mg (in %) Placebo (in %) 20,6 9,2 4,4 4,8 Schlafstörungen (abnorme Träume, Schlaflosigkeit, Albträume, Schlafstörungen) Angststörungen, -symptome (Agitiertheit, Angst, Nervosität, obsessives Gedankengut, Stress) 39 Depressive Verstimmungen (Depression, depressive Stimmung, depressive Symptome, Dysthymie) 2,8 2,8 2,2 0,8 0 0,4 0 0,4 0,4 0,4 0,4 0 Stimmungsschwankungen (Ärger, Affektlosigkeit, Stimmungsveränderungen) Suizidales und selbstverletzendes Benehmen (Suizid, Suizidgedanken) Anpassungsstörungen Sexuelle Dysfunktion (erhöhte/verringerte Libido) Verhaltensstörungen (Aggression) 3.4 Kombinationstherapien Ebbert et al. publizierten 2014 die Studie „Combination Varenicline and Bupropion SR for Tobacco-Dependence Treatment in Cigarette Smokers“, in welcher sie die klinische Wirksamkeit einer Kombinationstherapie (Bupropion und Vareniclin) im Vergleich zu einer Monotherapie (Vareniclin und Placebo) im Zuge der medikamentösen RaucherInnenentwöhnung überprüften. Es erfolgte über einen Behandlungszeitraum von 12 Wochen eine medikamentöse Behandlung mit einer Tagesdosis von 300mg Bupropion und 2mg Vareniclin im Vergleich zu 2mg Vareniclin und Placebo. Die Studiengruppe mit der Kombinationstherapie zeigte zwar zu den Zeitpunkten 12 Wochen, 26 Wochen und 52 Wochen nach Behandlungsbeginn mit 56,2%, 38,2% und 36,6% höhere Rauchabstinenzraten (biochemisch verifiziert: CO-Ausatemluft <8 ppm, ≥7 Tage Abstinenz vor Messung) im Gegensatz zur Vergleichsgruppe mit der Vareniclin-Monotherapie (48,6%, 31,9% und 29,2%), jedoch war keines dieser Resultate statistisch gesehen signifikant. Nur bei der längerfristigen Rauchabstinenzrate (biochemisch verifiziert und Abstinenz ab Woche 2) für die Zeitpunkte Woche 12 (Kombinationstherapie: 53,0%, Monotherapie: 43,2%, p=0,03) und Woche 26 (Kombinationstherapie 36,6%, Monotherapie: 27,6%, p=0,03) konnten sich statistisch signifikante Vorteile für die Kombinationstherapie finden lassen (siehe Tabelle 8). [69] 40 Tabelle 8: Rauchabstinenzraten der Gruppen Vareniclin + Bupropion (N=249) und Vareniclin + Placebo (N=257), nach Ebbert et al. 2014 [69] 7-Day Point-Prevalence Smoking Abstinence (%) Prolonged Smoking Abstinence (%) Vareniclin + Bupropion 56,2 53,0 Vareniclin + Placebo 48,6 43,2 Vareniclin + Bupropion 38,2 36,6 Vareniclin + Placebo 31,9 27,6 Vareniclin + Bupropion 36,6 30,9 Vareniclin + Placebo 29,2 24,5 Woche 12 Woche 26 Woche 52 4 Diskussion Tabaksucht ist unter dem Begriff Tabakabhängigkeitssyndrom im ICD-10 Katalog als Krankheit klassifiziert. Jährlich sterben aktuell weltweit 5,4 Millionen Menschen an den Folgen des Tabaks [25]. Die 6 häufigsten Todesursachen in den sogenannten Industrieländern (Herzinfarkt, KHK, Herzinsuffizienz, Schlaganfall, COPD und Lungenkrebs) sind allesamt bedeutend durch chronischen Tabakkonsum bedingt und als tabak-assoziierte Erkrankungen bekannt. Die relative Risikoerhöhung zur Entstehung einer Krebserkrankung beträgt bei starken RaucherInnen mit > 25 Zigaretten/Tag 3,1, bei Ex-RaucherInnen immer noch 1,3. Karzinome im Bereich des Pharynx, Larynx oder der Mundhöhle entstehen bei starken RaucherInnen 48-mal häufiger, im Bereich der Lunge 25-mal häufiger und im Bereich des Ösophagus 11,2-mal häufiger als bei NichtraucherInnen. Jährlich fügen Tabakprodukte der Weltwirtschaft einen Schaden von ungefähr 1 Milliarde US-Dollar zu. [70] Tabaksucht mit ihren vielfältigen schwerwiegenden gesundheitlichen Folgen ist eine Krankheit, die ebenso wie andere Krankheiten nach speziellen Schemata behandelt werden muss oder zumindest sollte. Wie der Ergebnisteil zeigt, stehen der Medizin hierfür mit NET, Bupropion und Vareniclin bereits gut erforschte, gut wirksame und vor Allem sichere und meistens gut verträgliche Möglichkeiten zur Verfügung. Dies 41 stellt eine gute Basis dar, um als Ärztin oder Arzt, gemeinsam mit der Patientin oder dem Patienten eine gut verträgliche, wirkungsvolle medikamentöse Entwöhnungstherapie erstellen zu können. Neben der medikamentösen Therapie ist ebenso die gute Beratung und Motivation zum Rauchstopp und vor allem das Sensibilisieren bezüglich der großen gesundheitsschädlichen Wirkung des Rauchens von großer Bedeutung. Das Ziel der medikamentösen RaucherInnenentwöhnung ist die wirkungsvolle Verbesserung der Rauchabstinenzraten, welches bereits als Monotherapie mit NET, Bupropion oder Vareniclin oder in Kombination gut erreicht werden kann. Ein weiteres Problem dieser Thematik ist die tiefe, langjährige gesellschaftliche Verankerung des Rauchens und auch die generelle Akzeptanz gegenüber Tabakprodukten und deren wichtigsten Schadstoff „Tabakrauch“. Präventive Maßnahmen vieler gesundheitspolitischer Organisationen werden dadurch in ihren Effekten abgeschwächt oder fast ganz außer Kraft gesetzt. Ein interessanter epidemiologischer Aspekt wird außerdem die weltweite Entwicklung des Rauchverhaltens in den unterschiedlichen geografischen und wirtschaftlich entwickelten Regionen darstellen. Ausgehend von statistischen Vorhersagen der WHO wird es zu einer starken Zunahme der Rauchprävalenz in den Regionen Naher Osten, Asien und Afrika [35] [25] kommen. Es bleibt also abzuwarten, wie die tatsächliche Entwicklung der Prävalenz in Zukunft stattfinden und vor welche Probleme die Gesellschaft dadurch noch gestellt werden wird. 42 5 Literaturverzeichnis 1 Weller E. In: Viel Rauch für nix: Ein Sparbuch für Zigarettenraucher oder die 1 Cent Zigarette. BoD – Books on Demand, 2014: 145 2 Tabakgeschichte Tabak Geschichte. Available from: http://www.tabakfrei.de/tabakgeschichte.htm 3 Aktories K, Forth W, Allgaier C (eds.). Dekant W., Vamvakas S.: Tabak. In: Allgemeine und spezielle Pharmakologie und Toxikologie. München: Elsevier, Urban & Fischer, 2010: 1077–1083 4 Haustein K-O, Groneberg D. In: Tabakabhängigkeit: gesundheitliche Schäden durch das Rauchen. Berlin: Springer, 2008: 77 5 320px-Nikotin_-_Nicotine.svg.png (320×240). Available from: https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Nikotin__Nicotine.svg/320px-Nikotin_-_Nicotine.svg.png 6 DrugBank (ed.). Nicotine. DrugBank 2017; Available from: https://www.drugbank.ca/drugs/DB00184 7 Starke K. Pharmakologie cholinerger Systeme. In: Aktories K, Förstermann U, Hofmann F, Starke K (eds.). Allgemeine und spezielle Pharmakologie und Toxikologie. München: Elsevier, Urban & Fischer, 2010: 137–160 8 GESTIS-Stoffdatenbank - Nicotin. Available from: http://gestis.itrust.de/nxt/gateway.dll/gestis_de/000000.xml?f=templates$fn=def ault.htm$vid=gestisdeu:sdbdeu$3.0 9 Haustein K-O. Pharmakologie und Pharmakokinetik von Nikotin. In: Tabakabhängigkeit: gesundheitliche Schäden durch das Rauchen ; Ursachen Folgen - Behandlungsmöglichkeiten - Konsequenzen für Politik und Gesellschaft. Köln: Dt. Ärzte-Verl, 2001: 81–101 10 FzR_Gesundheitsrisiko_Nikotin_web.pdf. Available from: http://www.dkfz.de/de/tabakkontrolle/download/Publikationen/FzR/FzR_Gesund heitsrisiko_Nikotin_web.pdf 11 Benowitz NL. Nicotine Addiction. The New England journal of medicine 2010; 362: 2295 Available from: https://www-1ncbi-1nlm-1nih-1gov1pubmed.han.medunigraz.at/pmc/articles/PMC2928221/ 12 Treichel D. Möglichkeiten der Suchtprävention in der Sekundarstufe I am Beispiel Tabak. 2006; Available from: http://content.grin.com/document/v186397.pdf 13 Prochaska JJ, Benowitz NL. The Past, Present, and Future of Nicotine Addiction Therapy. Annual review of medicine 2016; 67: 467 Available from: https://www-1ncbi-1nlm-1nih-1gov1pubmed.han.medunigraz.at/pmc/articles/PMC5117107/ 43 14 Centers for Disease Control and Prevention (US), National Center for Chronic Disease Prevention and Health Promotion (US), Office on Smoking and Health (US). In: How Tobacco Smoke Causes Disease: The Biology and Behavioral Basis for Smoking-Attributable Disease: A Report of the Surgeon General. Atlanta (GA): Centers for Disease Control and Prevention (US), 2010: 116–124 Available from: http://www.ncbi.nlm.nih.gov/books/NBK53017/ 15 FzR_Nikotin.pdf. Available from: https://www.dkfz.de/de/rauchertelefon/download/FzR_Nikotin.pdf 16 Batra A, Lindinger P, Gaßmann R, Deutsche Hauptstelle für Suchtfragen (eds.). In: Tabakabhängigkeit. Hamm: DHS, 2013: 65–73 17 ICD-10-GM deutsche Version 2017: block-f10-f19. Available from: https://www.praxis-wiesbaden.de/icd10-gm-diagnosen/block-f10-f19.php#F17 18 Klassifikation der Tabakabhängigkeit. Available from: http://www.apothekenraucherberatung.ch/de/startseite/rauchstopp/raucherberatung/klassifikation-dertabakabhaengigkeit.html#c522 19 Dilling H, Schulte-Markwort E, Weltgesundheitsorganisation (eds.). Psychische und Verhaltensstörungen durch psychotrope Substanzen. In: Internationale Klassifikation psychischer Störungen: ICD-10 Kapitel V (F) klinischdiagnostische Leitlinien. Bern: Huber, 2014: 107–124 20 Fagerström Test für Nikotinabhängigkeit. Available from: https://www.dkfz.de/de/tabakkontrolle/Fagerstroem.html#section8 21 Lichtenschopf A. Richtlinien der Tabakentwöhnung Stand 2010. 2011 Available from: http://link.springer.com/10.1007/s00508-011-1571-x 22 Mutschler E, Geisslinger G, Kroemer HK, Ruth P, Schäfer-Korting M. In: Mutschler Arzneimittelwirkungen: Lehrbuch der Pharmakologie und Toxikologie. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2008: 1043–1044 23 Batra A, Lindinger P, Gaßmann R, Deutsche Hauptstelle für Suchtfragen (eds.). Schadstoffe im Tabakrauch. In: Tabakabhängigkeit. Hamm: DHS, 2013: 24–25 24 fact_sheet_mortality_report.pdf. Available from: http://www.who.int/tobacco/publications/surveillance/fact_sheet_mortality_report .pdf?ua=1 25 Organisation mondiale de la santé. WHO report on the global tobacco epidemic, 2008 the MPOWER package. Geneva: World health organization, 2008 26 IMABE: Zigarettenrauchen als Kausalfaktor für Gesundheitsschäden. Available from: http://www.imabe.org/index.php?id=469 27 Rauchen - Zahlen und Fakten. Available from: https://www.krebsgesellschaft.de/onko-internetportal/basis-informationenkrebs/bewusst-leben/rauchen-zahlen-und-fakten.html 44 28 HIddemann W, Bartram CR. In: Die Onkologie: Teil 1: Epidemiologie Pathogenese - Grundprinzipien der Therapie; Teil 2: Solide Tumoren Lymphome - Leukämien. Springer-Verlag, 2009: 273–280 29 Siemon G, Loddenkemper R, Raupach T, Schaller K, Pötschke-Langer M. Fakten zum Rauchen - Durch Rauchen und Passivrauchen verursachte Atemwegs- und Lungenerkrankungen. Heidelberg: Deutsches Krebsforschungszentrum, 2008 Available from: http://www.dkfz.de/de/tabakkontrolle/download/Publikationen/FzR/FzR_Atemwe geLunge.pdf 30 Zeitung Ä. Zigaretten in der Schwangerschaft - das Babygift wirkt Jahrzehnte lang. Available from: http://www.aerztezeitung.de/medizin/krankheiten/neuropsychiatrische_krankheiten/suchtkrankheiten/article/505301/zigarettenschwangerschaft-babygift-wirkt-jahrzehnte-lang.html 31 ODDB.org: Open Drug Database, Fachinformation zu Nicotinell® Pflaster. Available from: http://ch.oddb.org/de/gcc/fachinfo/reg/50582 32 Hoffmeister D, Bechthold A. Giftpflanzen, Pflanzengifte. In: Aktories K, Förstermann U, Hofmann F, Starke K (eds.). Allgemeine und spezielle Pharmakologie und Toxikologie. München: Elsevier, Urban & Fischer, 2010: 1098–1111 33 Bönisch H, Graefe KH, Lutz W, Georg Thieme Verlag KG (eds.). Akute Vergiftungen. In: Duale Reihe Pharmakologie und Toxikologie. Stuttgart: Thieme, 2016: 774 34 Müller S. In: Memorix Notfallmedizin. Georg Thieme Verlag, 2011: 535 35 WHO | Prevalence of tobacco smoking. WHO Available from: http://www.who.int/gho/tobacco/use/en/ 36 Rauchen. Available from: http://www.statistik.at/web_de/statistiken/menschen_und_gesellschaft/gesundh eit/gesundheitsdeterminanten/rauchen/105592.html 37 Rauchen. Available from: http://www.statistik.at/web_de/statistiken/menschen_und_gesellschaft/gesundh eit/gesundheitsdeterminanten/rauchen/index.html#index2 38 Mulzer K-H, Lichtenschopf A, Homeier I, Groman E. Rauchausstieg mit Nikotinersatztherapie – ein Update. Wiener Medizinische Wochenschrift 2009; 159: 25–32 Available from: http://link.springer.com/10.1007/s10354-008-0637-5 39 Fachinformation Nicorette® Kaugummi 4 mg. Available from: https://www.gelbe-liste.de/produkte/nicorette-kaugummi-4-mgfreshfruit_481902/fachinformation 40 Fachinformation Nicorette® 2 mg Lutschtabletten | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/nicorette-freshmint-2-mg-lutschtablettengepresst_545365/fachinformation 45 41 Fachinformation Nicorette® TX Pflaster 15 mg | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/nicorette-tx-pflaster-15mg_521023/fachinformation 42 Fachinformation Nicorette® Inhaler 15mg | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/nicorette-inhaler-15mgpatrone_543442/fachinformation 43 Fachinformation Nicorette® Spray 1 mg/Sprühstoß | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/nicorette-spray-1-mg-spruehstossspray-zur-anwendung-in-der-mundhoehle-loesung_832797/fachinformation 44 Bupropion-Enantiomers_Structural_Formulae.png (2229×1990). Available from: https://upload.wikimedia.org/wikipedia/commons/c/c7/BupropionEnantiomers_Structural_Formulae.png 45 DrugBank (ed.). Bupropion. DrugBank 2017; Available from: https://www.drugbank.ca/drugs/DB01156 46 MSDS - B102. Available from: http://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=DE &language=de&brand=SIGMA&productNumber=B102 47 Coles R, Kharasch ED. Stereoselective metabolism of bupropion by cytochrome P4502B6 (CYP2B6) and human liver microsomes. Pharm Res 2008; 25: 1405– 1411 48 Batra A, Lindinger P, Gaßmann R, Deutsche Hauptstelle für Suchtfragen (eds.). Medikamentöse Unterstützung zur Tabakentwöhnung. In: Tabakabhängigkeit. Hamm: DHS, 2013: 112–124 49 Bupropion_2.png (403×343). Available from: http://www.pharmawiki.ch/wiki/media/Bupropion_2.png 50 Fachinformation Elontril® 300 mg Tabletten mit veränderter Wirkstofffreisetzung | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/elontril-300mg-tabletten-mit-veraenderter-wirkstofffreisetzung_496734/fachinformation 51 Brunton LL, Goodman LS, Gilman A, Chabner BA (eds.). In: Goodman & Gilman’s the pharmacological basis of therapeutics. New York, NY: McGraw-Hill Medical, 2011: 398–415 52 Pittner H, Giese F, Lang G, Österreichische Apotheker-Verlagsgesellschaft m.b.H. FI Wellbutrin XR 150mg. In: Austria-Codex Schnellhilfe 2016/17. 2016: 1480 53 Bupropion: MedlinePlus Drug Information. Available from: https://medlineplus.gov/druginfo/meds/a695033.html 54 Hurt RD, Sachs DPL, Glover ED, Offord KP, Johnston JA, Dale LC, Khayrallah MA, Schroeder DR, Glover PN, Sullivan CR, Croghan IT, Sullivan PM. A Comparison of Sustained-Release Bupropion and Placebo for Smoking 46 Cessation. New England Journal of Medicine 1997; 337: 1195–1202 Available from: http://www.nejm.org/doi/abs/10.1056/NEJM199710233371703 55 Jorenby DE, Leischow SJ, Nides MA, Rennard SI, Johnston JA, Hughes AR, Smith SS, Muramoto ML, Daughton DM, Doan K, Fiore MC, Baker TB. A Controlled Trial of Sustained-Release Bupropion, a Nicotine Patch, or Both for Smoking Cessation. New England Journal of Medicine 1999; 340: 685–691 Available from: http://www.nejm.org/doi/abs/10.1056/NEJM199903043400903 56 Ahluwalia JS, Harris KJ, Catley D, Okuyemi KS, Mayo MS. Sustained-release bupropion for smoking cessation in African Americans: a randomized controlled trial. JAMA 2002; 288: 468–474 57 320px-Varenicline.svg.png (320×141). Available from: https://upload.wikimedia.org/wikipedia/commons/thumb/4/49/Varenicline.svg/32 0px-Varenicline.svg.png 58 DrugBank (ed.). Varenicline. DrugBank 2017; Available from: https://www.drugbank.ca/drugs/DB01273 59 Österreichische Apothekerkammer: Vareniclin – eine neue Hilfe zur Raucherentwöhung. Available from: http://www.apotheker.or.at/Internet/OEAK/NewsPresse.nsf/1bd86a866fd269b5c 1256d21002d53da/b2f189ae652487bfc12571f80044454c?OpenDocument 60 Foulds J. The neurobiological basis for partial agonist treatment of nicotine dependence: varenicline. International Journal of Clinical Practice 2006; 60: 571–576 Available from: http://onlinelibrary.wiley.com/doi/10.1111/j.13685031.2006.00955.x/abstract 61 Fachinformation Champix® 0,5 mg/ 1 mg Starterpack. | Gelbe Liste. Available from: https://www.gelbe-liste.de/produkte/champix-0-5-mg-1-mgstarterpack_508468/fachinformation 62 Drug Safety Newsletter Volume 2 Number 1 2009. FDA U.S. Food and Drug Administration Available from: http://www.fda.gov/downloads/Drugs/DrugSafety/DrugSafetyNewsletter/UCM10 7318.pdf 63 Hughes JR. Varenicline as a Cause of Suicidal Outcomes. Nicotine Tob Res 2016; 18: 2–9 Available from: https://academic.oup.com/ntr/article/18/1/2/2583929/Varenicline-as-a-Cause-ofSuicidal-Outcomes 64 ODDB.org: Open Drug Database | Medikamente | Fachinformation. Available from: http://ch.oddb.org/de/gcc/fachinfo/reg/57736 65 Champix ® - compendium.ch. Available from: https://compendium.ch/mpro/mnr/15593/html/de?Platform=Desktop 66 Oncken C, Gonzales D, Nides M, Rennard S, Watsky E, Billing CB, Anziano R, Reeves K. Efficacy and Safety of the Novel Selective Nicotinic Acetylcholine 47 Receptor Partial Agonist, Varenicline, for Smoking Cessation. Arch Intern Med 2006; 166: 1571–1577 Available from: http://jamanetwork.com/journals/jamainternalmedicine/fullarticle/410803 67 Rigotti NA, Pipe AL, Benowitz NL, Arteaga C, Garza D, Tonstad S. Efficacy and Safety of Varenicline for Smoking Cessation in Patients With Cardiovascular Disease: A Randomized Trial. Circulation 2010; 121: 221–229 Available from: http://circ.ahajournals.org/cgi/doi/10.1161/CIRCULATIONAHA.109.869008 68 Tashkin DP, Rennard S, Hays JT, Ma W, Lawrence D, Lee TC. Effects of varenicline on smoking cessation in patients with mild to moderate COPD: a randomized controlled trial. Chest 2011; 139: 591–599 69 Ebbert JO, Hatsukami DK, Croghan IT, Schroeder DR, Allen SS, Hays JT, Hurt RD. Combination Varenicline and Bupropion SR for Tobacco-Dependence Treatment in Cigarette Smokers: A Randomized Trial. JAMA 2014; 311: 155 Available from: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.2013.283185 70 Schmitt P-P. Weltgesundheitsorganisation: Rauchen kostet Weltwirtschaft eine Billion Dollar im Jahr. Frankfurter Allgemeine Zeitung 2017; Available from: http://www.faz.net/aktuell/gesellschaft/gesundheit/rauchen-kostet-weltwirtschafteine-billion-euro-14613183.html 48