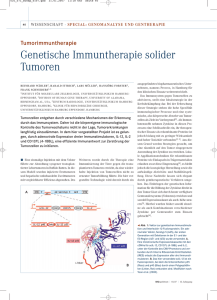
4 Tumoren - Thieme Connect
Werbung

4 4 Tumoren 4.1 Definition und Terminologie der Tumoren Unter Tumor (lat.: Schwellung) im engeren Sinne versteht man eine abnorme umschriebene Gewebemasse, die durch autonome, progressive und überschießende Proliferation körpereigener Zellen entsteht. Das Tumorwachstum hält auch dann noch an, wenn der auslösende Reiz anscheinend nicht mehr wirksam ist. Die Begriffe Tumor, Neoplasie (griech.: Neubildung) oder Blastom (griech.: Spross, Keim) können synonym verwendet werden. Unter dem Begriff „Krebs“ (engl.: cancer) werden bösartige (maligne) Geschwülste zusammengefasst. 4.2 Kausale Tumorigenese Dieser Begriff beschreibt die Interaktion zwischen tumorverursachenden Faktoren (Karzinogene) und dem Organismus, die auf der Basis einer genetischen Schädigung zur Tumorentwicklung führt. Chemische Karzinogene sind exogene (körperfremde) Chemikalien, die bei einem entsprechend exponierten Organismus die Wahrscheinlichkeit der Entstehung von Neoplasien erhöhen und die sich im Tierversuch als kanzerogen erwiesen haben (z. B. Steinkohlenteer, Teerdämpfe, Aflatoxin B1 und Nitrosamine). Als physikalische Ursachen sind ionisierende Strahlen (z. B. Röntgenstrahlen, radioaktive Isotope) und Ultraviolettstrahlen zu nennen. Durch Einwirkung kurzwelliger UV-B-Strahlen bilden sich in der DNS der basalen Epidermiszellen Pyrimidindimere, die von den Zellen normalerweise wieder durch Reparaturmechanismen eliminiert werden können. Man nimmt an, dass bei einer exzessiven Exposition gegenüber UV-B-Strahlen die Reparaturkapazität überschritten wird, sodass aufgrund der Anwesenheit der Pyrimidindimere Fehler in der Transkription der DNS auftreten, die zu Hauttumoren führen können. Auch bei Tieren werden Zusammenhänge zwischen UV-Strahlung und der Entstehung von Tumoren an exponierten Hautstellen mit geringer Behaarung vermutet (z. B. Plattenepithelkarzinome im Bereich der unpigmentierten Ohrmuschelränder bei kurz- bzw. weißhaarigen Katzen). Unter den onkogenen Viren, die bei Tieren als Ursache für Tumoren bekannt sind, wären zum einen die zu den RNS-Viren gehörenden Retroviren zu nennen. Retroviren der Subfamilie Orthoretrovirinae sind als Verursacher von Leukosen bzw. Lymphomen bei Huhn, Rind, Schaf und Katze nachgewiesen worden. Als ein Beispiel für onkogene DNS-Viren sei das zur Gruppe der Papovaviren gehörende Papillomavirus genannt, das Papillomatosen der Haut bzw. der Mundhöhle bei Rind, Hund und Kaninchen verursacht. 4.3 Dignität von Tumoren Zur Beurteilung der Dignität (lat.: Würde) von Tumoren, d. h. ihres biologischen Verhaltens am Entstehungsort, werden herangezogen: Ÿ Differenzierungsgrad Ÿ Proliferationsrate Ÿ lokales Wachstum Ÿ Verschleppung von Tumorzellen (Metastasierung), z. B. über den Lymph- und/oder Blutweg Neoplasien gelten dann als gutartig (benigne), wenn sie langsam und expansiv, d. h. gleichmäßig nach allen Seiten und örtlich verdrängend wachsen, sodass die umgebenden, ortsständigen Zellen druckatrophisch werden. Demgegenüber wachsen bösartige (maligne) Tumoren üblicherweise schnell, dringen in die unmittelbare Tumorumgebung aggressiv ein (Infiltration) und zerstören deren histologische Ordnung (Destruktion). Des Weiteren neigen maligne Tumoren zur Metasta- 24 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. M. Hewicker-Trautwein, A. D. Gruber, P. Wohlsein sierung. Semimaligne Tumoren hingegen (z. B. das equine Sarkoid) wachsen örtlich destruktiv, metastasieren jedoch nicht. 4.4 Klassifikation von Tumoren Die Klassifikation von Tumoren beruht auf ihrer Dignität und ihrem Ursprungsgewebe. Man unterscheidet epitheliale, mesenchymale, neuroektodermale Tumoren einschließlich der Neoplasien des pigmentbildenden Gewebes, Mischtumoren sowie Sonderformen. 4.4.1 Epitheliale Tumoren Epitheliale Tumoren entwickeln sich aus Geweben, die äußere oder innere Körperoberflächen auskleiden (z. B. Plattenepithel der Haut oder kutaner Schleimhäute, Schleimhautepithel, Übergangsepithel), oder aus exo- und endokrinen Drüsen, beispielsweise der Leber und Niere. Terminologisch werden gutartige epitheliale Tumoren durch Angabe der Gewebeart und die Endsilbe -om bzw. -adenom oder -papillom bezeichnet, während bösartige epitheliale Tumoren durch Angabe der Gewebeart und die Endsilbe -karzinom ihren Namen erhalten. Zu den gutartigen epithelialen Tumoren zählen unter anderem Papillome und Adenome. Papillome sind Tumoren, die vom Plattenepithel der Haut, der Schleimhäute oder vom Urothel ausgehen. Histologisch besitzen sie ein fingerförmig verästeltes Stroma mit Epithelüberzug und ähneln dem Muttergewebe weitgehend. Bei multiplem Auftreten in der Haut spricht man von einer Papillomatose. Adenome sind gutartige Tumoren, die vom Epithel endo- oder exokriner Drüsen oder von einem Organparenchym ausgehen. Hierzu gehören das Nebennierenrinden-, Schilddrüsen-, Talgdrüsen- und das Nierenadenom sowie das hepatozelluläre Adenom. Der histologische Aufbau der Adenome erinnert an das Muttergewebe, aus dem sie hervorgegangen sind (organoid). Als Wuchsformen unterscheidet man solide, alveoläre, tubuläre, zystische, trabekuläre, papilläre, polypöse und follikuläre Adenome. Zystadenome zeichnen sich durch sekretgefüllte Hohlraumbildungen aus. Auch das Seminom des Hodens und das Dysgerminom des Ovars zählen zu den epithelialen Tumoren. Zu den bösartigen epithelialen Tumoren gehören unter anderem Plattenepithel-, Adeno- und Übergangszellkarzinome. Plattenepithelkarzinome zeigen unterschiedliche Differenzierungsgrade. Gut differenzierte, maligne Tumoren des Plattenepithels besitzen die Fähigkeit zur Hornbildung, während schlechter differenzierte Varianten hierzu nicht in der Lage sind. Adenokarzinome gehen von den Epithelien exo- und endokriner Drüsen aus. Es gibt solide, azinäre, tubuläre, zystische, trabekuläre, papilläre und schleimbildende Wuchsformen. Übergangszellkarzinome gehen vom Übergangsepithel der ableitenden Harnwege (Urothel) aus. Undifferenzierte (anaplastische) Karzinome lassen keine Differenzierungserscheinungen eines Muttergewebes und somit keinerlei Organähnlichkeit mehr erkennen. Anaplastische Karzinome werden entsprechend dem Verhältnis epithelialer Tumoranteile zum bindegewebigen Stroma in drei Typen eingeteilt. Beim Carcinoma solidum medullare sind die epithelialen Tumorzellen in Form von Strängen oder Inseln angeordnet, zwischen denen nur ein spärliches, bindegewebiges Stroma ausgebildet ist. Das Carcinoma scirrhosum ist durch Vorhandensein von massenhaft kollagenem Bindegewebe gekennzeichnet, in dem sich Nester und Stränge epithelialer Tumorzellen befinden. Beim Carcinoma solidum simplex sind Tumoranteile und Stromaanteile zu gleichen Teilen vorhanden. 4.4.2 Mesenchymale Tumoren Diese Neoplasien bestehen aus Geweben, die sich embryologisch vom mittleren Keimblatt (Mesoderm), insbesondere vom pluripotenten Stützgewebe (Mesenchym) herleiten. Gutartige Tumoren des Binde-, Gefäß- und Stützgewebes werden durch Angabe der Gewebeart und die Endsilbe -om bezeichnet. Maligne mesenchymale Tumoren erhalten durch Angabe der Gewebeart und die Endsilbe -sarkom ihren Namen. Zu den gutartigen mesenchymalen Tumoren gehören unter anderem Fibrome, Myxome und Osteome. Das Fibrom besteht aus Elementen des fibrösen Bindegewebes (Fibrozyten, Fibroblasten, kollagene Fasern). Je nach Fasergehalt unterscheidet man das Fibroma molle, das relativ wenige Kollagenfasern und reichlich Extrazellularsubstanz enthält, und das Fibroma durum, das reichlich dicht gepackte Kollagenfasern enthält. Das 25 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Klassifikation von Tumoren Tumoren Myxom ist aus Zellelementen vom Aussehen embryonaler Bindegewebszellen mit reichlich faserfreier Grundsubstanz aufgebaut. Das Osteom enthält reifes Knochengewebe. Das Chondrom besteht aus Knorpelgewebe (Chondrozyten, Knorpelmatrix). Das Lipom ist aus Läppchen von Fettgewebszellen (Adipozyten) aufgebaut. Das Rhabdomyom ist ein Tumor der quergestreiften Muskulatur. Das Leiomyom stammt histogenetisch von der glatten Muskulatur ab. Das Hämangiom stellt eine gutartige Neoplasie der Blutgefäßendothelzellen dar, die als kapilläre oder kavernöse Variante auftreten kann. Das Lymphangiom ist ein Tumor des lymphgefäßbildenden Gewebes. Zu den bösartigen mesenchymalen Tumoren gehören unter anderem Fibro-, Osteo-, Chondro-, Lipo-, Myxo-, Rhabdomyo-, Leiomyo-, Hämangio-, Lymphangiosarkome. In diesen Tumoren sind neben unreifen Tumorzellen auch noch Zellelemente vorhanden, die den Charakter des Muttergewebes aufweisen, beispielsweise kollagene Fasern, Knochen- und Knorpelgrundsubstanz, Fettzellen, muzinreiche, interzelluläre Grundsubstanz, quergestreifte und glatte Muskelzellen sowie Blut- und Lymphgefäße. Bei den undifferenzierten Sarkomen ist ein Vergleich mit der Ausgangszelle bzw. dem Muttergewebe und die Ableitung der histogenetischen Herkunft nicht mehr möglich. In derartigen Fällen kann mit den Begriffen „spindelzelliges“ (Sarcoma fusicellulare), „rundzelliges“ (Sarcoma globocellulare), „riesenzelliges“ (Sarcoma gigantocellulare) oder „gemischtzelliges“ Sarkom (Sarcoma mixtocellulare) die Neoplasie deskriptiv näher charakterisiert werden. Systemische, neoplastische Proliferationen von Blutzellen bzw. deren Vorstufen, die ebenfalls zu den mesenchymalen Geweben zählen, werden unter der Bezeichnung Leukose zusammengefasst. Die Einteilung basiert auf dem Zelltyp, nach dem man die lymphatische Leukose (malignes Lymphom, Lymphosarkom) und die myeloische Leukose unterscheidet. Beim malignen Lymphom erkranken besonders Lymphknoten, Milz, Thymus, Knochenmark und Leber. Oft sind jedoch auch Labmagen, Darm, Herzmuskel (Rind, Schaf) und Niere (Katze) betroffen. 4.4.3 Mischtumoren Kommen in Tumoren sowohl epitheliale als auch mesenchymale Gewebsbestandteile vor, spricht man von Mischtumoren. Entsprechend ihrer Dignität werden gutartige Mischtumoren und Karzinosarkome unterschieden. Mischtumoren sind besonders häufig unter den Mammatumoren des Hundes zu finden, treten aber auch in der Schilddrüse und den apokrinen Schweißdrüsen auf. 4.4.4 Neuroektodermale Tumoren einschließlich der Neoplasien des pigmentbildenden Gewebes Unter den neuroektodermalen Tumoren des ZNS spielen Gliome (Oligodendrogliome, Astrozytome, Oligoastrozytome) die Hauptrolle, während von Nervenzellen ausgehende Tumoren (Neuroblastome) wesentlich seltener auftreten. Ebenfalls selten ist das Ästhesioneuroblastom, das vor allem bei älteren Hunden und Katzen vorkommt und von der Riechzelle seinen Ursprung nimmt. Vom Ependym der Hirnventrikel oder des Rückenmarkkanals ausgehende Tumoren (Ependymome) treten vorwiegend bei Kalb und Hund auf. Weiterhin wäre das von den Plexus chorioidei der Ventrikel ausgehende Plexuspapillom bzw. -karzinom zu nennen. Melanozyten sind auch Abkömmlinge des Neuroektoderms und die gutartigen Tumoren, die sich von den melaninbildenden Zellen (Melanozyten) ableiten, werden als benigne Melanozytome oder Melanome bezeichnet. Diese Neoplasien sind braun bis schwarzbraun gefärbt und bestehen aus melaninhaltigen Tumorzellen. Die malignen Melanome werden entsprechend dem jeweils vorherrschenden Zelltyp in epitheloidzellige, spindelzellige, dendritische und klarzellige Typen eingeteilt. 4.4.5 Sonderformen Teratome sind Tumoren, die aus pluripotenten Ausgangszellen entstehen und Differenzierungsprodukte aller drei Keimblätter, nämlich des Ento-, Meso- und Ektoderms, enthalten. Sie treten beispielsweise in Ovarien oder Hoden auf. Hamartome stellen nicht neoplastische, tumorartige, überschießende Fehlentwicklungen von Geweben dar, die prinzipiell überall im Körper auftreten können. 26 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 Makroskopische Beurteilung von Tumoren Embryonale Tumoren gehen im Gegensatz zum Teratom aus einer noch nicht differenzierten Organanlage hervor. Zu ihnen zählen unter anderen das Chordom, das sich aus Resten der zurückgebildeten Chorda dorsalis entwickelt, oder das Kraniopharyngeom, das sich aus Resten der embryonalen Kiemengangsauskleidung (Rathke’sche Tasche) herleitet. dass Tumorzellen in Bauch- oder Brusthöhle, Herzbeutel oder Liquorräume einbrechen und nach Verschleppung an anderer Stelle des Hohlraumes weiterwachsen (Implantationsmetastasen). Beispielsweise kann ein Magenkarzinom die Serosa durchbrechen und es kommt zur Aussaat von Tumorzellen mit der Peritonealflüssigkeit. Unter kanalikulärer Metastasierung versteht man die Ausbreitung maligner Tumoren innerhalb anatomisch vorgegebener, epithelial ausgekleideter Kanalwege wie Bronchien, Milchgänge und ableitende Harnwege. 4.6 4.5 Tumormetastasierung Unter Metastasierung versteht man die Verschleppung von Tumorzellen und ihr An- und Weiterwachsen in entfernteren Körperlokalisationen (Metastase). Der Einbruch maligner Tumorzellen in das Lymphgefäßsystem, deren anschließende Verschleppung (Tumorzellembolus) auf dem Lymphwege und ihre Ansiedelung an einem anderen Ort wird als lymphogene Metastasierung bezeichnet. Diese Art der Metastasierung wird besonders bei malignen epithelialen Tumoren gesehen. Bei günstigen Strömungsbedingungen im jeweiligen Lymphgefäß vermehren sich die Tumorzellen bereits in den Lymphgefäßen, verstopfen sie und wachsen an ihnen entlang (Lymphangiosis carcinomatosa). Nach Verschleppung in die regionären Lymphknoten werden diese tumorös durchsetzt (Nahmetastasen). Von dort aus können sie schließlich in den Ductus thoracicus gelangen, durch den die Tumorzellen entfernte Lymphknoten, die Blutbahn und andere Organe erreichen. Ein wichtiges Beispiel hierfür sind Mammakarzinome bei Hund und Katze, bei denen Metastasen in regionären Lymphknoten und lymphohämatogen in der Lunge entstehen. Nach Einbruch von Tumorzellen in Blutgefäße können Einzelzellen oder Zellkomplexe mit dem Blutstrom abgeschwemmt werden (Tumorzellembolus) und in anderen Organen oder Geweben weiterwachsen (hämatogene Metastasierung). Das Verteilungsmuster der hämatogenen Metastasen hängt von der Lokalisation des Primärtumors ab. Die kavitäre Metastasierung entsteht dadurch, Makroskopische Beurteilung von Tumoren Tumoren können exophytisch über die Organoberfläche hinauswachsen oder sie können ein endophytisches Wachstumsverhalten zeigen, d. h. sie wachsen in das Organ hinein. Exophytisches Wachstum tritt vor allem in Haut, Schleimhäuten, serösen Häuten und in Drüsengängen auf. Dabei können knotige (noduläre), mit einem dünnen Stiel der Unterlage aufsitzende (polypöse) oder warzenartige (papillomatöse) Umfangsvermehrungen auftreten. Papillome wachsen zum Beispiel pinsel-, blumenkohl- oder korallenstockartig über die Oberfläche hinaus und sitzen der Unterlage breitbasig oder nur mit einem dünnen Stiel auf. Endophytisch wachsende Tumoren können einerseits als gut abgegrenzte, innerhalb des Organs gelegene Knoten in Erscheinung treten. Ein derartiges Wachstum wird meist bei gutartigen Tumoren, beispielsweise einem inversen, endophytisch wachsenden Papillom beobachtet. Andererseits können endophytische Neoplasien zur lokalen oder diffusen Durchsetzung des Organs bzw. Gewebes (Infiltration) führen. Dieses Proliferationsverhalten tritt vor allem bei malignen Blastomen auf. Häufig ist in Tumoren die Bildung von Zysten oder zystenartigen Hohlräumen zu beobachten, insbesondere in Tumoren, die vom Drüsenepithel ausgehen (Adenome, Adenokarzinome). Bei schnell wachsenden, bösartigen Tumoren kommt es zur Entstehung von Nekrosen. Infolge dieser Gewebeeinschmelzung im Zentrum eines Tumorknotens entsteht ein Gewebekollaps mit Einsenkung der Oberfläche, der als „Krebsnabel“ bezeichnet wird. 27 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Choristome sind aus normalem, ausgereiftem Gewebe zusammengesetzt, befinden sich aber an einer ektopischen Lokalisation, beispielsweise sei das Dermoid im ZNS genannt. 4 Tumoren 4.7 4.7.1 Histologische Beurteilung von Tumoren Zytomorphologie Das wesentliche Ziel der histologischen Beurteilung von Tumoren ist, deren Art bzw. Herkunft (Histogenese) zu ermitteln und festzustellen, ob es sich um einen gutartigen oder bösartigen Tumor handelt. Weiterhin ist von Bedeutung, ob die Neoplasie vollständig entfernt wurde, da dieses Kriterium für die Prognose, Therapie und Nachsorge von besonderer Wichtigkeit ist. In Tabelle 4.1 sind die wichtigsten histologischen Parameter für gutartige und bösartige Tumoren zusammengefasst. Die in der Tabelle dargestellte Zuordnung ist als Anhaltspunkt zu sehen, zu dem es auch Ausnahmen geben kann. Insbesondere für die zytomorphologischen Kriterien ist zu beachten, dass die Grenze zwischen Gut- und Bösartigkeit oft fließend ist. Zur Beurteilung der Zytomorphologie der Tumorzellpopulation gehören Größe und Form des Zellleibes und des Zellkerns, Anfärbbarkeit und Innenstrukturen des Zytoplasmas, Zahl der Kerne pro Zelle (Ein-, Zwei- oder Mehrkernigkeit) und Gestalt der Kerne sowie Zahl, Größe und Verteilung von Kernkörperchen. Unter dem Begriff der Anisozytose bzw. Anisokaryose versteht man die Vielgestaltigkeit des Zytoplasmaleibes bzw. des Zellkerns. Mit dem Begriff der Anisonukleolose wird eine variable Größe der Kernkörperchen beschrieben. Karyomegalie bezeichnet das Vorkommen von Riesenkernen in Tumorzellen. Das Auftreten sehr groß erscheinender Tumorzellen wird mit dem Begriff Megalozytose beschrieben. Zur Einschätzung des Wachstumsverhaltens von Tumorzellen wird die Häufigkeit von Mitosefiguren (meist angegeben pro Gesichtsfeld bei 400-facher Vergrößerung, engl. high power field = hpf; z. B. 6 Mitosen/hpf) und gegebenenfalls das Vorliegen von abnormalen Zellteilungsfiguren angegeben. Eine hohe Mitoserate kann sowohl auf ein schnelles Wachstum als auch auf Bösartigkeit hinweisen, aber beide Parameter müssen nicht unbedingt miteinander korreliert sein, denn auch gutartige Tumoren können ein relativ hohes Proliferationsverhalten zeigen, beispielsweise das kanine kutane Histiozytom. Das Ausmaß der morphologischen Ähnlichkeit mit der Ursprungszelle (z. B. Fibrozyt bei Fibromen und Fibrosarkomen) gibt dabei wichtige Hinweise auf den Differenzierungsgrad des Tumors (homoiotypisch/heterotypisch) und letztendlich auch auf seine Dignität. So werden bei Mastzelltumoren abhängig von der Differenzierung der Tumorzellen drei Grade unterschieden, die für die Beurteilung der Dignität des Tumors herangezogen werden. Grad-I-Mastozytome besitzen gut differenzierte neoplastische Mastzellen, die den normalen Gewebemastzellen stark ähneln, während die Tumorzellen eines Grad-III-Mastozytoms weit entdifferenziert und kaum noch als Mastzellen anzusprechen sind. 4.7.2 Ausbildung einer extrazellulären Matrix Verschiedene Tumorzelltypen können eine extrazelluläre Matrix synthetisieren, die es erleichtert, die zelluläre Herkunft sowie die Differenzierungsrichtung und den -grad der Tumorzellen zu beurteilen. So können Fibrome und Fibrosarkome Kollagenfasern ausbilden, während in Osteosarkomen Osteoid nachgewiesen wird. 4.7.3 Verhalten von Tumorzellen im Gewebeverband Sowohl für die Identifikation des Ursprungs von Tumorzellen als auch für die Beurteilung ihrer Dignität (gutartig versus bösartig) ist die Beschreibung des Verhaltens der Tumorzellen im Gewebeverband von Bedeutung. So bilden Tumorzellen, die von einem Drüsengewebe abstammen (z. B. Adenome oder Adenokarzinome der Milchdrüsen oder der Talgdrüsen), häufig gewebetypische Zellverbände aus (Drüsenazini oder -alveolen, Tubuli, Ausführungsgänge etc.), die sie beispielsweise von mesenchymalen Tumoren unterscheidbar machen. Man spricht in diesem Fall von mehr oder weniger deutlich ausgeprägtem, organoidem Wachstum. Weichgewebetumoren wie Fibrome, Fibrosarkome oder Tumoren der glatten Muskulatur zeigen dagegen häufig ein fischzugähnliches Muster größerer Zellverbände. Für die Beurteilung der Dignität ist ferner von Bedeutung, ob alle Tumorzellen in einem geschlossenen Verband vorliegen oder ob sich einzelne oder kleine Nester neoplastischer Zellen bereits aus dem Verband gelöst haben (lokal invasives Wachstum). Im Gewebeverband können besonders bei schnell wachsenden, bösartigen Tumoren auch zentrale 28 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 Histologische Beurteilung von Tumoren 4.7.4 Beurteilung des Tumorstromas Tumoren unterschiedlicher Histogenese induzieren ein bindegewebiges Stützgerüst (Stroma), das meist aus Fibroblasten/Fibrozyten einschließlich der von diesen gebildeten Kollagenfasern sowie Gefäßen und Gefäßsprossen (Angiogenese) besteht. Dieses Tumorstroma setzt sich aus nicht neoplastischen, reaktiven Zellen, die durch sezernierte Wachstumsfaktoren der Tumorzellen kontrolliert werden, zusammen. Bestimmte Tumoren weisen eine besonders starke Kollagenfasersynthese im Tumorstroma auf (z. B. Karzinome, die dann als skirrhös bezeichnet werden), die häufig mit Malignität vergesellschaftet ist. Der Grad der Angiogenese korreliert bei vielen Tumortypen mit der Wahrscheinlichkeit des Auftretens von Metastasen. Oftmals wird bei malignen Tumoren sowohl in der Peripherie als auch im Innern der Neoplasie eine Infiltration mit Entzündungszellen, vor allem Lymphozyten und Plasmazellen, beobachtet, die möglicherweise eine immunologische Reaktion gegenüber dem Tumor darstellt. 4.7.5 Ausbildung einer Kapsel und Kompression des Nachbargewebes An ihrer Außenseite bilden insbesondere gutartige Tumoren eine kollagenfaserhaltige Tumorkapsel aus, die zu einer klaren Trennung des Tumors von seiner Umgebung führt. Eine deutliche Tumorkapsel, die von den Tumorzellen nicht durchbrochen wird, ist meist ein Zeichen von Gutartigkeit. Allerdings ist nicht jeder benigne Tumor von einer Kapsel umgeben (z. B. kanines kutanes Histiozytom). Bösartige (invasive oder metastasierende) Tumoren dagegen bilden zumeist entweder keine Kapsel aus oder durchbrechen ihre Kapsel. Von einer echten Tumorkapsel zu unterscheiden ist eine Kompressionskapsel (Pseudokapsel), die durch eine Kompression des präexistenten, benachbarten Bindegewebes bei expansiv wachsenden Tumoren entsteht. Diese wird bei Tumoren unterschiedlicher Histogenese beobachtet, beispielsweise beim kaninen Hämangioperizytom oder dem Hypophysenadenom. Infolge des expansiven, verdrängenden Wachstums gutartiger Tumoren und der daraus resultierenden Kompression des Nachbargewebes kann es konsekutiv auch zu einer Atrophie und funktionellen Beeinträchtigung kommen. 4.7.6 Lokal invasives Wachstum, Folgen für das Nachbargewebe und Gefäßeinbrüche Der Nachweis von lokal invasivem Wachstum von Tumorzellen gilt häufig als eindeutiges Kriterium für Malignität. Dazu zählt die Vereinzelung von Tumorzellen oder kleiner Gruppen und deren Entfernung vom Primärverband (Nachweis im angrenzenden Gewebe), der Durchbruch durch eine Tumorkapsel sowie die Invasion in angrenzende Blut- oder Lymphgefäße. Maligne Neoplasien führen infolge ihres lokal invasiven Wachstums zu einer lokalen Gewebedestruktion, die mit einer Funktionsbeeinträchtigung einhergehen kann. Das lokal invasive Wachstum maligner Tumoren deutet auf eine erhöhte Wahrscheinlichkeit von Rezidiven und Metastasen hin. Der Nachweis von Tumorzellen in lokalen Blut- oder Lymphgefäßen ist stark korreliert mit einem erhöhten Metastasierungspotenzial, jedoch kein Beweis für metastasierendes Verhalten. 4.7.7 Identifikation von Metastasen Das Wachstum von Tumorzellen in einem Organ, in dem der Tumor nicht entstanden ist, gilt als Beweis für metastasierendes Verhalten mit entsprechend schlechter Prognose für den Patienten und besonderer Relevanz für die Therapie und Nachsorge. Der Untersuchung der regionären Lymphknoten auf das Vorliegen von Metastasen kommt dabei eine wichtige Bedeutung zu, insbesondere bei epithelialen Tumoren. 4.7.8 Vollständige Entnahme Die Frage, ob ein Tumor bei der chirurgischen Exzision vollständig entfernt wurde, ist häufig von großer praktischer Relevanz. Dazu wird bei der histologischen Untersuchung beurteilt, ob der Tumor allseits von nicht tumorösem Gewebe umgeben ist (vollständig entfernt) oder ob die Tumorzellen bis an den Rand des exzidierten Gewebes heranreichen (unvollständig entfernt). 29 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Gewebeuntergänge (Nekrosen) beobachtet werden, die bei der Beurteilung der Dignität und der Wachstumsgeschwindigkeit helfen können. 4 Tumoren Tab. 4.1 Histologische Kriterien zur Beurteilung von Tumoren Kriterium gutartige Tumoren bösartige Tumoren Differenzierungsgrad der Tumorzellen homoiotypisch (gut differenziert, hohe Ähnlichkeit zum Herkunftszelltyp) heterotypisch (schlecht differenziert, geringe Ähnlichkeit zum Herkunftszelltyp) Zell- und Kernpleomorphie (Vielgestaltigkeit) gering hoch Mitoserate gering hoch Ausbildung organoider Gewebeformationen häufig selten Synthese von extrazellulärer Matrix viel oder wenig meist wenig Infiltration mit Entzündungszellen selten häufig Vorliegen von Nekrosen selten häufig Ausbildung einer Kapsel häufig nein lokal invasives Wachstum nein ja Kompression des umliegenden Gewebes ja ja Einbruch in Gefäße nein ja Metastasierung nein ja 4.8 Prognose Die Prognose im Hinblick auf den weiteren Krankheitsverlauf berücksichtigt die Wahrscheinlichkeit der vollständigen Heilung sowie das Auftreten von Rezidiven und/oder Metastasen. Die Prognose richtet sich nach der Tumorklassifikation, d. h. nach der Festlegung des histologischen Tumortyps anhand lichtmikroskopischer Parameter (tumor grading) und nach klinisch feststehenden Parametern des Wachstumsverhaltens des Tumors (tumor staging). Bezüglich Letzterer sei auf das einschlägige Schrifttum der klinischen Veterinärmedizin und der allgemeinen Pathologie verwiesen. Bei histologisch als gutartig klassifizierten Tumoren ist die Prognose in der Regel günstig, da keine Metastasen und, bei vollständiger chirurgischer Exzision des Tumors, keine Rezidive zu erwarten sind. Des Weiteren können gutartige Tumoren auch primär multizentrisch auftreten, wie es oftmals bei kaninen Mammatumoren beobachtet wird. Bei bestimmten Neoplasien, beispielsweise dem kutanen Mastozytom vom Grad I, Papillom, equines Sarkoid oder dem gutartigen, kutanen Melanom des Pferdes, ist die Prognose relativ günstig, da diese Tumoren sich meist gutartig verhalten, jedoch in Einzelfällen Rezidive und/oder Metastasen vorkommen können. Bei bestimmten malignen Tumoren (komplexes Karzinom der Mamma, Adenokarzinom der Mamma), beim kutanen Mastozytom Grad II, bei Fibrosarkomen und Plattenepithelkarzinomen der Haut ist die Prognose vorsichtig zu stellen, da die Gefahr von Rezidiven und/oder Metastasen besteht. Bei allen malignen Tumoren, bei denen histologisch Einbrüche in Blut- und/oder Lymphgefäße nachgewiesen wurden, ist die Prognose ungüns- 30 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 4 Tumorarten tig, da Rezidive und/oder Metastasen in hohem Maße auftreten können. Dies gilt unter anderen für das anaplastische und das solide Mammakarzinom der Hündin, für das Adenokarzinom der Mamma der Katze, das Hämangiosarkom, das maligne Melanom der Mundhöhle und Zehe beim Hund, Plattenepithelkarzinome der Tonsillen und der Mundhöhle sowie für Osteo- und Chondrosarkome. peripheren Nervenscheiden eingesetzt. Maligne Lymphome können durch die Lymphozytenmarker CD3 und CD79a als T- bzw. B-Zell-Lymphome typisiert werden. Als ungünstig bis infaust ist die Prognose bei Tumoren zu stellen, bei denen bereits histologisch Tumormetastasen in regionären Lymphknoten nachgewiesen wurden. Die gleiche Prognose gilt auch bei Tumoren, die häufig systemisch auftreten, wie zum Beispiel maligne Lymphome. Spezies Immunhistologische Tumordiagnostik Bei einigen Tumoren ist es nicht immer möglich, eine histologische Diagnose allein nach morphologischen Gesichtspunkten zu stellen. Die Klärung der histogenetischen Herkunft von Tumorzellen bereitet häufig Schwierigkeiten bei undifferenzierten Blastomen bzw. bei deren Metastasen. Durch den gezielten Einsatz immunhistologischer Verfahren unter Verwendung von spezifischen Antikörpern gegen Zytoskelettkomponenten wie Intermediärfilamente (Zytokeratine, Vimentin, Desmin, Neurofilament, Gliafilament) und andere Marker ist es möglich, eine Phänotypisierung der Zellen durchzuführen. Dadurch wird eine histogenetische Identifizierung und Zuordnung der neoplastischen Zellen erleichtert. Zytokeratine sind in epithelialen und Vimentin in mesenchymalen Zellen enthalten. Myogene Zellen exprimieren das muskelspezifische Desmin. Neuronale Zellen enthalten Neurofilament und die Zellen der Neuroglia (Astrozyten) enthalten das saure Gliafaserprotein (GFAP = glial fibrillary acidic protein). In myoepithelialen Tumorzellen ist α-alpha-smooth muscle actin (α-alpha-SMA) nachweisbar. Außer durch Antikörper gegen Neurofilament können Neuronen auch über die Expression von neuronenspezifischer Enolase (NSE) dargestellt werden. Zur Identifizierung von Melanomzellen finden die Tumormarker Melan A und das S-100-Protein Verwendung. Das S-100-Protein wird auch zum Nachweis von Tumoren der Tumorarten 4.10.1 Fibrom S. 50 Hund, selten Katze, Pferd, Wiederkäuer, Schwein, Kaninchen Ätiologie unbekannt für die meisten Spezies; Shope’s Fibromvirus (Kaninchen) Pathologisch-anatomische Differenzialdiagnosen Fibromatose, Fibrosarkom, Myxom, benigner peripherer Nervenscheidentumor, Leiomyom, kollagener Nävus, Granulationsgewebe Tumorigenese und Dignität Die Ausgangszelle dieser Neoplasie ist der Fibroblast. Fibrome sind langsam wachsende, gutartige, mesenchymale Tumoren. Sie zeigen ein expansives, verdrängendes Wachstum mit Kompression des Nachbargewebes. In der Haut sind sie im Korium (Dermatofibrom) oder der Subkutis lokalisiert. Metastasen treten nicht auf und nach vollständiger chirurgischer Entfernung werden auch keine Rezidive beobachtet, sodass die Prognose als günstig einzustufen ist. Fibrome treten meist bei adulten Individuen in der Haut auf. Sie können jedoch prinzipiell auch an anderen Stellen des Körpers vorkommen. Als disponierte Hunderassen werden Rhodesian Ridgeback, Dobermann und Boxer genannt. Geschlechtsdispositionen für diesen Tumor sind nicht beschrieben. Bei der generalisierten, nodulären Dermatofibrose, die vor allem beim Deutschen Schäferhund beschrieben ist, tritt das Fibrom in Form multipler, intradermaler Knoten auf. Bei dieser Erkrankung finden sich zusätzlich bilateral Nierenkarzinome und bei Hündinnen auch uterine Leiomyome. Lokalisation meist in der Haut von Gliedmaßen und Kopf 31 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.9 4.10 Tumoren Krankheitsbild Klinisch zeigen betroffene Individuen eine indolente, meist solitäre, umschriebene, noduläre Umfangsvermehrung. Intradermale Fibrome sind über der Subkutis verschieblich, während bei subkutanen Fibromen die Haut über dem Tumorknoten bewegt werden kann. In vielen Fällen wölben sich die Neoplasien über das Niveau der Haut hervor. In Einzelfällen kann die Haut über dem Tumor auch ulzeriert sein. Fibrome sind nicht von einer Kapsel umgeben und zeigen eine derbe bis gummiartige Konsistenz. Makroskopisch stellt sich das Fibrom als runde oder ovale, umschriebene, knotige Umfangsvermehrung dar, die gegenüber dem gesunden Nachbargewebe klar begrenzt ist. Der Tumorknoten besitzt eine grauweiße Farbe und je nach Kollagenfasergehalt kann eine derbe, gummiartige oder weiche Konsistenz festgestellt werden. Im Anschnitt ist eine grauweiße, feinfaserige oder homogene Schnittfläche nachweisbar. Histologisch ist der Tumor durch eine expansive Proliferation von Fibroblasten und/oder Fibrozyten gekennzeichnet. Bildet die Neoplasie reichlich kollagene Fasern und ist sie relativ zellarm, bezeichnet man sie auch als Fibroma durum (Abb. 4.1 und Abb. 4.2). Bei hohem Zellgehalt und geringem Kollagenfaseranteil handelt es sich um ein Fibroma molle. Aber es können auch Übergangsformen auftreten. Ebenso sind unterschiedlich zell- und faserreiche Areale innerhalb eines Tumors möglich. Die Tumorzellen liegen in Bündeln und Strängen vor, die ineinander verwoben ein dreidimensionales Netzwerk bilden (Abb. 4.3). Gelegentlich werden auch wirbelförmige Anordnungen angetroffen. Die Tumorzellen besitzen eine monomorphe Gestalt. Sie weisen einen längsovalen bis spindelförmigen Zellleib und ein mäßig ausgebildetes, eosinophiles, homogenes Zytoplasma mit unscharfen Zellgrenzen auf. Der Kern zeigt ebenfalls eine rundovale bis längliche Form mit mäßigem Heterochromatingehalt. Mitosefiguren werden nur selten beobachtet. In Einzelfällen kann eine fokale Hyalinisierung der kollagenen Fasern auftreten. Das Tumorgewebe ist von einem nur spärlichen Gefäßgeflecht durchzogen (Abb. 4.4). Zur Darstellung der kollagenen Fasern können Spezialfärbungen, beispielsweise die Azan- oder Masson-Goldner-Färbung, verwendet werden. Immunhistologisch kann in den Tumorzellen die Expression des Intermediärfilaments Vimentin nachgewiesen werden. Das für glatte Muskelzellen des Leiomyoms spezifische Protein α-smooth-muscle-actin oder das S-100-Protein, das bei Nervenscheidentumoren exprimiert wird, lassen sich in Fibromen nicht feststellen. 4.10.2 Leiomyom Spezies Hund, Katze, Meerschweinchen, Kaninchen, andere Spezies selten S. 52 Ätiologie unbekannt, möglicherweise Hormoneinfluss Pathologisch-anatomische Differenzialdiagnosen Leiomyosarkom, Fibrom, Fibrosarkom, Nervenscheidentumoren, Sticker-Tumor Tumorigenese und Dignität Die Ausgangszelle dieses Tumors ist die glatte Muskelzelle. Leiomyome sind langsam wachsende, gutartige, mesenchymale Tumoren. Sie zeigen ein expansives, verdrängendes Wachstum mit Kompression des Nachbargewebes und sind nicht von einer bindegewebigen Kapsel begrenzt. Leiomyome treten besonders häufig in der Wand des Gastrointestinal- und Urogenitaltrakts auf. Sie können jedoch prinzipiell auch an anderen Stellen des Körpers, beispielsweise der Haut, dem Tracheobronchialbaum oder dem Gefäßsystem, vorkommen. Bei Tumoren des Gastrointestinaltrakts werden neben glatten Muskelzellen oftmals Zellen beobachtet, die Fibroblasten oder Zellen der Neuralleiste ähnlich sehen. Aufgrund dieser heterogenen Differenzierung bezeichnet man die nicht lymphatischen Tumoren des Gastrointestinaltrakts kollektiv auch als gastrointestinale, stromale Tumoren (GIST). Als Ausgangszelle wird die Cajal-Zelle angenommen, der eine Schrittmacherfunktion für die Motorik des Darmes zugeschrieben wird. In Leiomyomen können in unterschiedlichen Mengen auch Fibroblasten und kollagene Fasern vorkommen, sodass bei ausgeprägtem Gehalt von Bindegewebszellen auch von Fibroleiomyomen gesprochen wird. Nach vollständiger chirurgischer Entfernung werden keine Rezidive beobachtet, sodass die Prognose als günstig einzustufen ist. Leiomyome treten meist bei adulten Individuen auf. Für genitale Leiomyome besteht 32 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 4 Tumorarten Lokalisation vor allem Magen, Darm, Uterus, Vagina Krankheitsbild Klinisch zeigen betroffene Individuen eine indolente, meist solitäre, umschriebene, noduläre Umfangsvermehrung. Bei genitaler Lokalisation können Scheidenausfluss oder Dysurie beobachtet werden. genitalen Leiomyomen wird auch eine Proliferation von Bindegewebszellen beobachtet. Zur Darstellung der Muskelfasern können Spezialfärbungen, beispielsweise die Trichrom- oder die Azan-Färbung, verwendet werden. Immunhistologisch kann das für glatte Muskelzellen spezifische Protein α-smooth-muscle-actin nachgewiesen werden. Allerdings zeigen auch Myofibroblasten eine spezifische Markierung, sodass die Interpretation unter Berücksichtigung auch histologischer Befunde erfolgen muss. Bei gastrointestinalen stromalen Tumoren werden zusätzlich unter anderen auch S-100-Protein und neuronenspezifische Enolase nachgewiesen. 4.10.3 Fibrosarkom Spezies S. 54 Katze, Hund, andere Spezies selten Makroskopisch stellt sich das Leiomyom als runde oder ovale, umschriebene, knotige Umfangsvermehrung dar, die gegenüber dem gesunden Nachbargewebe klar begrenzt ist. Es ist in der Wand von Hohlorganen nicht verschieblich und kann sich polypenartig in das Lumen vorwölben. Der Tumorknoten besitzt eine grauweiße Farbe und eine derbe Konsistenz. Im Anschnitt ist eine grauweiße, feinfaserige oder homogene Schnittfläche nachweisbar. Histologisch zeigt sich am Beispiel eines uterinen Leiomyoms eine noduläre Umfangsvermehrung in der Wand der Gebärmutter (Abb. 4.5), die durch expansive Proliferation einer relativ monomorphen Population von glatten Muskelzellen gekennzeichnet ist. Die dicht gepackten Tumorzellen liegen in ineinander verwobenen Bündeln und Strängen. Aufgrund ihrer teils rechtwinkeligen Anordnung lässt sich auch ein Fischgrätenmuster der Muskelfaserbündel erkennen. Die Zellen besitzen einen längsovalen, zigarrenförmigen Kern mit grobscholligem Heterochromatingehalt. Das Zytoplasma ist eosinophil und die Zellen sind undeutlich begrenzt (Abb. 4.6 bis Abb. 4.8). Vergleichbar zu hypertrophen Muskelfasern kann auch eine feinblasige Vakuolisierung des Zytoplasmas vorkommen. Mitosefiguren werden nur selten beobachtet. Das Tumorgewebe ist meist von einem spärlichen fibrovaskulären Stroma durchzogen. Zur Abgrenzung von einem Leiomyosarkom können die Mitoserate und das lokale Invasionsverhalten herangezogen werden. Vor allem bei Ätiologie unbekannt bei den meisten Spezies; bei Katzen infolge einer Infektion mit dem felinen Sarkomvirus und in Assoziation mit bestimmten Impfungen Pathologisch-anatomische Differenzialdiagnosen Fibrom, Hämangioperizytom, malignes Melanom, Leiomyosarkom, malignes fibröses Histiozytom, Granulationsgewebe, chronische eitrige oder nekrotisierende Entzündung Tumorigenese und Dignität Die Ausgangszelle dieses mesenchymalen Tumors ist der Fibroblast. Fibrosarkome stellen maligne, oftmals sehr zellreiche Tumoren mit einem lokal invasiven Wachstum dar. Metastasen treten selten auf, aber Rezidive werden häufig beobachtet, sodass die Prognose als vorsichtig einzustufen ist. Das Fibrosarkom stellt den häufigsten Tumor adulter Katzen dar. Das Auftreten bei juvenilen und jungadulten Individuen bis zu einem Alter von 3 Jahren ist meist auf eine Infektion mit dem felinen Sarkomvirus, einer Mutante des felinen Leukämievirus, zurückzuführen. Des Weiteren ist bei Katzen ätiologisch eine Assoziation mit bestimmten Impfungen beschrieben. Pathogenetisch stellen Adjuvanzien in den Vakzinen wahrscheinlich einen Stimulus für die neoplastische Transformation dar. Bei Hunden ist die Ätiologie des Tumors nicht bekannt. Während bei Katzen eine Geschlechts- und Rassendisposition nicht besteht, 33 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. beim Boxer eine Rassendisposition. Genitale Leiomyome sind oft mit follikulären Ovarialzysten, östrogenproduzierenden Tumoren, endometrialer Hyperplasie und Mammatumoren vergesellschaftet. Eine Hypoglykämie wurde bei Hunden mit Tumoren der glatten Muskulatur des Gastrointestinaltrakts als paraneoplastisches Syndrom beschrieben. Tumoren zeigen Golden Retriever und Dobermann eine erhöhte Inzidenz für diese Neoplasie. Bei Katzen wird das Fibrosarkom oftmals in der Unterhaut von Nacken, Rücken, seitlicher Brust- und Bauchwand beobachtet, da in diesen Lokalisationen die Applikation von Vakzinen erfolgt. Lokalisation vor allem Haut und Unterhaut von Kopf, Rumpf und Gliedmaßen Krankheitsbild Klinisch zeigen betroffene Individuen eine rasch wachsende, meist solitäre, noduläre Umfangsvermehrung. Palpatorisch zeigt der Tumor eine inhomogene, derbknotige bis weiche Konsistenz. Gelegentlich treten Ulzerationen auf. Makroskopisch stellt sich das Fibrosarkom als runde oder ovale, umschriebene oder infiltrative, knotige bis flächige Umfangsvermehrung dar. Der Tumor besitzt eine grauweiße, glänzende Farbe und eine heterogene, weiche bis derbe Konsistenz. Im Anschnitt ist eine grauweiße, feinfaserige Schnittfläche nachweisbar, die vereinzelt auch Blutungsherde aufweisen kann. Vakzinationsassoziierte Fibrosarkome besitzen oftmals einen zentralen, zystischen Hohlraum mit wässrigem bis muzinösem Inhalt. Histologisch ist das gut differenzierte Fibrosarkom durch eine meist lokal infiltrativ, selten expansiv wachsende Umfangsvermehrung gekennzeichnet (Abb. 4.9), die aus einer relativ monomorphen Population von Fibroblasten besteht. Die dicht gepackten Tumorzellen liegen in miteinander verwobenen Bündeln und Strängen (Abb. 4.10). Aufgrund ihrer teils rechtwinkeligen Anordnung lässt sich auch ein Fischgrätenmuster der Zellbündel erkennen. Das Tumorgewebe zeigt meist eine geringe Vaskularisierung und es können Nekroseherde im Tumorgewebe auftreten (Abb. 4.11). Die Zellen besitzen einen ovalen bis spindelförmigen Kern mit kleinen Nukleoli und niedrigem Heterochromatingehalt. Das spärliche Zytoplasma ist eosinophil und die Zellen sind undeutlich begrenzt. Die Tumoren weisen einen variablen Gehalt an kollagenen und retikulären Fasern auf. Weniger gut differenzierte Fibrosarkome zeigen eine stärkere Anisokaryose, -zytose und -nukleolose. Polygonale oder bi- und multinukleäre Zellen können vorkommen. Die Zahl der Mitosen variiert stark (Abb. 4.12). Bei vakzinationsassoziierten Fibrosarkomen finden sich oftmals auch plumpe, ovoide Zellen sowie zahlreiche, mehrkernige Riesenzellen. Eine Abgrenzung zur postvakzinalen Entzündung kann im Einzelfall schwierig sein. Das Tumorgewebe ist meist von einem spärlichen, fibrovaskulären Stroma durchzogen. Vor allem bei vakzinationsassoziierten Fibrosarkomen werden in der Tumorperipherie nesterartig angeordnete, lympho- und histiozytäre Infiltrate beobachtet. Zur Darstellung der kollagenen Fasern können Spezialfärbungen, beispielsweise die Trichromoder die Azan-Färbung, verwendet werden. Immunhistologisch kann in den Tumorzellen das Intermediärfilament Vimentin nachgewiesen werden. 4.10.4 Osteosarkom Spezies Hund, Katze, andere Spezies sehr selten S. 56 Ätiologie unbekannt, in Einzelfällen im Zusammenhang mit chronischen, mechanischen Irritationen, intraund extraossären Fixateuren und Implantaten Pathologisch-anatomische Differenzialdiagnosen Chondrosarkom, Fibrosarkom, Synovialsarkom, granulomatöse Ostitis und Osteomyelitis, Frakturen mit Kallusbildung, hypertrophe Osteopathie Tumorigenese und Dignität Die Ausgangszelle dieses mesenchymalen Tumors ist eine pluripotente Mesenchymzelle, die Osteoid produziert. Osteosarkome stellen maligne, mesenchymale Tumoren mit einem raschen, lokal invasiven Wachstum dar. Sie besitzen je nach morphologischer Ausprägung eine außerordentliche Vielfalt, die durch eine unterschiedlich starke Destruktion präexistenten Knochens, eine end- und periostale, reaktive Knochenproliferation und eine Neubildung von Osteoid charakterisiert ist. So werden vorwiegend lytische, produktive und gemischte Osteosarkomvarianten unterschieden. Aufgrund des pluripotenten Potenzials der Ausgangszelle werden in unterschiedlichem Ausmaß auch Knorpel und kollagene Fasern nachgewiesen. Osteosarkome besitzen ein hohes Potenzial, Rezidive und Metastasen zu bilden, sodass die Prognose als vorsichtig bis ungünstig einzustufen ist. Fernmetastasen finden sich bevorzugt in der Lun- 34 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 ge. Das Osteosarkom stellt den häufigsten Knochentumor adulter Hunde und Katzen dar. Das Auftreten bei jungadulten Hunden wird vor allem bei großrahmigen Rassen beobachtet. Insbesondere sind Deutsche Doggen, Deutsche Schäferhunde, Rottweiler, Irische Setter, Dobermann, Berner Sennenhunde und Boxer betroffen. Bei Katzen tritt das Osteosarkom vor allem bei alten Tieren auf. Männliche Individuen sind häufiger betroffen. Lokalisation fokal im Skelettsystem; zentral im Knochen oder peripher (periostal) Krankheitsbild Klinisch zeigen betroffene Individuen je nach Lokalisation des Tumors unterschiedliche Symptome. Sind Extremitätenknochen betroffen, werden Lahmheiten beobachtet. Des Weiteren treten dolente, noduläre oder flächige Schwellungen auf. Im fortgeschrittenen Stadium entwickeln sich eine Muskelatrophie sowie eine Schwellung und Verfestigung des regionären Lymphknotens infolge einer Tumormetastasierung. Pathologische Frakturen können zu plötzlicher, hochgradiger Lahmheit führen. Osteosarkome des Gesichtsschädels, der Rippen oder der Wirbelsäule treten zunächst als knöcherne Umfangsvermehrungen in Erscheinung. Nasale Osteosarkome können mit eitrigem Ausfluss einhergehen. sich eine osteoblastenähnliche Tumorzellpopulation mit deutlicher Anisokaryose und -zytose. Diese ist durch eine rundovale bis polygonale Gestalt mit rundem, heterochromatinarmem Kern und mäßigem Zytoplasmagehalt gekennzeichnet. Sie synthetisiert Osteoid, das als homogene, eosinophile Substanz inselartig oder in schmalen Feldern abgelagert wird (Abb. 4.14). Die osteoblastenähnlichen Tumorzellen finden sich solitär oder kettenartig diesem Osteoid angelagert. Innerhalb des Osteoids finden sich in Lakunen osteozytenähnliche Tumorzellen, die durch einen runden oder rundovalen Kern und einen schmalen Zytoplasmasaum charakterisiert sind. Des Weiteren stellen sich die neoplastischen Osteoblasten auch mit einer fibroblastenähnlichen Gestalt dar. Zellen mit dieser Morphologie können in Strängen oder Bündeln angeordnet sein. Die Anzahl von mehrkernigen Riesenzellen, die Osteoklasten ähnlich sind, kann stark variieren. Mitosefiguren sind meist in großer Zahl zu beobachten. Innerhalb des Tumorgewebes können auch Nekrosen und Blutungen vorkommen (Abb. 4.15 und Abb. 4.16). 4.10.5 Mastozytom Synonyme S. 58 Mastzellentumor Spezies Hund, Katze, andere Spezies selten Makroskopisch zeichnen sich Osteosarkome durch eine Destruktion des präexistenten Knochens und eine Knochenneubildung durch das Tumorgewebe aus. Zudem finden sich end- und periostale, reaktive Proliferate von Knochengewebe. Der Tumor besteht aus einem invasiv wachsenden, nicht demarkierten, derben bis harten, grauweißen Gewebe. Gelegentlich sind Frakturen im Tumorbereich festzustellen. Histologisch findet man unterschiedliche Zellpopulationen, die zu folgender Subklassifikation geführt haben: schlecht differenziertes, osteoblastisches, chondroblastisches, fibroblastisches, teleangiektatisches Osteosarkom. Darüber hinaus gibt es noch den Riesenzelltyp. Beim osteoblastischen Osteosarkom lässt sich eine meist lokal invasive, seltener expansive, noduläre oder zirkuläre Auftreibung des Knochengewebes mit mehr oder weniger vollständiger Destruktion präexistenter Knochenstrukturen nachweisen (Abb. 4.13). Es findet Ätiologie unbekannt Pathologisch-anatomische Differenzialdiagnosen malignes Lymphom, kutanes Histiozytom, StickerTumor, Entzündung Tumorigenese und Dignität Die Ausgangszelle dieses mesenchymalen Tumors ist die Gewebsmastzelle. Es können solitäre oder primär multiple Tumorknoten auftreten. Des Weiteren gibt es eine generalisierte Form mit Infiltration von Leber, Milz und Lymphknoten, die als Mastzellenleukose bezeichnet wird. Die Ursache der Mastozytome bei Haustieren ist nicht geklärt. Aufgrund der mediatorhaltigen Sekretgranula finden sich regelmäßig variable Infiltrate von eosinophilen Granulozyten, die funktionelle Antagonisten der Mastzellgranula, beispielsweise Histaminasen, besitzen. Beim Hund wurde eine 35 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 Tumorarten Tumoren Korrelation zwischen der Tumordifferenzierung und dem biologischen Verhalten in einem Gradierungssystem abgebildet. Gut differenzierte Mastozytome (Grad I) zeichnen sich durch eine Infiltration von ausgereiften Tumorzellen in der Dermis aus. Mäßig differenzierte (Grad II) und schlecht differenzierte Mastozytome (Grad III) weisen eine zunehmende Zellpolymorphie, Anisokaryose, einen geringeren Granulagehalt, eine höhere Mitoserate sowie eine Infiltration der tieferen Dermis und Subkutis auf. Durch die Histaminausscheidung kommt es zu einer Hypersekretion von Salzsäure durch die Belegzellen des Magens, die zu Schleimhautulzerationen führen kann. Andere Mediatoren, beispielsweise Heparin, können zu Gerinnungsstörungen mit Blutungen oder zum Schock führen. Je schlechter die Differenzierung des Mastozytoms, desto höher ist das Risiko der Rezidivbildung und Metastasierung. Daher ist die Prognose von Mastozytomen des Hundes als vorsichtig anzusehen. Das Mastozytom tritt meist bei mittelalten Hunden und Katzen auf. Für Boxer, Dackel, Mopse, Boston-Terrier, Bullterrier, Weimaraner und Labrador und Golden Retriever sowie Siamkatzen besteht eine Rassendisposition. Lokalisation häufig solitär oder multipel in der Haut, insbesondere an Gliedmaßen, Rumpf und Kopf; selten in Darm, Leber, Lymphknoten und Milz Krankheitsbild Klinisch zeigt die Haut bei kutanen Mastozytomen ein Erythem, Alopezie und eine ödematisierte, flächige Schwellung. Bei größeren Tumoren treten häufig Ulzerationen auf. Abdominale Schmerzzustände in Folge der Ausbildung von Magenulzera mit Erbrechen und Inappetenz werden gelegentlich bei kutanen oder viszeralen Mastozytomen beobachtet. Makroskopisch stellen sich kutane Mastozytome als flache, erhabene, feste oder weiche Umfangsvermehrungen dar, die zum Nachbargewebe unscharf demarkiert sind. Auf der Schnittfläche ist eine gelbe oder graue Farbe erkennbar. Die Haut weist oft eine Ulzeration auf. Die Beschaffenheit der Mastzelltumoren kann durch die mediatorvermittelte Entzündung erheblich modifiziert werden. Histologisch zeigt sich bei kutanen Mastozytomen des Hundes eine nicht demarkierte, mehr oder weniger zellreiche Infiltration des Koriums mit Mastzellen. Oftmals ist eine Reihenbildung der Zellen zu erkennen (Abb. 4.17 und 4.18). Die Tumorzellen zeigen entsprechend ihrem Differenzierungsgrad eine unterschiedlich stark ausgeprägte Ausreifung und Homogenität. Gut differenzierte Mastozytome weisen einen runden bis polygonalen Zellleib mit zentralem oder geringfügig exzentrischem, rundem Kern auf. Im Zytoplasma sind zahlreiche basophile Granula nachweisbar (Abb. 4.19). Je schlechter die Mastzellen differenziert sind, desto stärker variiert die Zellund Kernmorphologie, desto geringer ist die Ausbildung von Sekretgranula und umso höher die Anzahl der Mitosen. Zur besseren Darstellung der Granula können histologische Spezialfärbungen, beispielsweise die Toluidinblau- oder Kresyl-EchtViolett-Färbung, angewendet werden. Infolge der Metachromasie der Granula erscheinen diese dann in einem violetten Farbton. Regelmäßig finden sich variable Infiltrationen von eosinophilen Granulozyten. Darüber hinaus werden Kollagenolysen, Ödeme, Nekrosen und sekundäre Entzündungen beobachtet (Abb. 4.20). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 Bei Katzen stellt sich das Mastozytom meist als gut demarkierte Infiltration ausgereifter Mastzellen dar, die keine Zellpleomorphie oder Mitosen aufweisen. Selten lassen sich eosinophile Granulozyten nachweisen, jedoch sind regelmäßig lymphozytäre Infiltrate vorhanden. Vor allem bei jungen Siamkatzen tritt eine histiozytäre Variante des Mastzelltumors auf, die durch große, runde bis polygonale Zellen gekennzeichnet ist und leicht mit einer granulomatösen Entzündung verwechselt werden kann. 4.10.6 Malignes Melanom der Mundhöhle Spezies S. 60 Hund, selten andere Spezies Ätiologie unbekannt Pathologisch-anatomische Differenzialdiagnosen Plattenepithelkarzinom, Fibrosarkom, odontogene Tumoren, Epulis, Stomatitis 36 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Tumorarten Das maligne Melanom ist beim Hund der häufigste bösartige Tumor der Mundhöhle. Die Ursache für maligne Melanome in der Mundhöhle ist nicht geklärt. Histogenetisch stammt die Neoplasie von den Melanozyten der Mukosa ab. Die Melanozyten können entweder junktionalen Ursprungs sein, also im Übergangsbereich vom Epithel zur Lamina propria mucosae lokalisiert sein, oder aus tieferen Anteilen der Mukosa stammen. Aufgrund histologischer Befunde werden ein epitheloider, spindelzelliger und gemischter Typ unterschieden. Des Weiteren kann der Pigmentgehalt stark variieren. Insbesondere in der Mundhöhle sind die malignen Melanome oftmals kaum pigmentiert (sog. „amelanotisches malignes Melanom“). Jedoch besitzen weder der Pigmentgehalt noch die Zellform eine Bedeutung für die prognostische Bewertung. Maligne Melanome zeichnen sich durch ein rasches, lokal invasives und destruierendes Wachstum aus. Sie weisen ein hohes Potenzial zur Rezidivbildung und Metastasierung vor allem in die regionären Lymphknoten und die Lunge auf, sodass die Prognose als ungünstig einzustufen ist. Das maligne Melanom in der Mundhöhle kommt meist bei adulten Hunden vor. Dackel, Cockerspaniel und Pudel besitzen eine Rassendisposition für diesen Tumor. Für männliche Hunde wurde nicht in allen Studien eine erhöhte Inzidenz nachgewiesen. Melanome in der Mundhöhle treten bei anderen Spezies selten auf. Lokalisation Mundhöhle, vor allem der Gaumen, die labiale und bukkale Mukosa sowie die Zunge, selten Tonsillen und Pharynx Krankheitsbild Klinisch zeigen betroffene Individuen einen auffälligen Foetor ex ore und Blutungen aus der Maulhöhle. Je nach Lokalisation des Tumors können auch Störungen der Nahrungsaufnahme und -zerkleinerung sowie die Protrusion einer fleischigen, unterschiedlich stark pigmentierten, oftmals ulzerierten Neubildung in der Mundhöhle beobachtet werden. Die regionären Lymphknoten können deutlich vergrößert und derb sein. Makroskopisch stellt sich der Tumor meist als eine solitäre, erhabene, graubraune bis schwarze Umfangsvermehrung dar, die infiltrativ in das be- nachbarte Gewebe wächst. Die Oberfläche kann auch von weißer oder rot gesprenkelter Mukosa bedeckt sein. Oftmals sind aber Ulzerationen nachweisbar. Die Konsistenz des Tumors ist fest oder durch Nekrose oder Entzündung weich. Die Schnittfläche besitzt eine homogen schwarze oder fleckige, braune bis grauweiße Farbe. Die regionären Lymphknoten weisen oftmals Metastasen in Form nodulärer, braunschwarz pigmentierter Herde auf. Histologisch ist eine in Nestern angeordntete, lokal invasiv wachsende Tumorzellpopulation in der oralen Mukosa nachweisbar (Abb. 4.21). Es findet sich eine zellreiche, teils lobulierte Proliferation von Melanozyten in den basalen Anteilen des Epithels oder der angrenzenden Mukosa. Eine ausgeprägte Anisokaryose und -zytose der Tumorzellen ist möglich. Die runden oder ovalen, zentral gelegenen Kerne zeigen meist ein prominentes Kernkörperchen. Im Zytoplasma kann der Pigmentgehalt stark variieren. In stark pigmenthaltigen Fällen können die zellulären Strukturen vollständig bedeckt sein, sodass erst nach dem Bleichen des Pigments die Zellmorphologie und die Anzahl der Mitosen beurteilt werden können. In wenig pigmentierten Melanomen sind nur sehr wenige Pigmentgranula in einzelnen Zellen nachweisbar. Die Zellen können eine epitheloide Gestalt mit rundem bis polygonalem Zellleib und deutlichen Zellgrenzen besitzen. Der spindelzellige Typ des malignen Melanoms zeichnet sich durch einen elongierten Zellleib und einen längsovalen Kern aus. Gemischte Melanome weisen beide Zelltypen auf. Selten werden auch klarzellige Varianten angetroffen. In malignen Melanomen werden meist zahlreiche, teils atypische Mitosen beobachtet. Des Weiteren sind in malignen Melanomen solitäre oder kleine Nester von Melanophagen nachweisbar, die Pigmentgranula der Tumorzellen phagozytiert haben (Abb. 4.22 bis Abb. 4.24). Das Stroma besteht aus einem spärlichen, fibrovaskulären Gewebe. Bei wenig pigmentierten malignen Melanomen kann mithilfe einer Silberfärbung nach Masson-Fontana eine schwarze Anfärbung von Pigmentgranula erfolgen. Immunhistologisch lassen sich neben dem Intermediärfilament Vimentin die Expression der Proteine Melan-A und S-100 in den Tumorzellen nachweisen. Am Gefrierschnitt kann enzymhistochemisch Dihydroxyphenylalanin-Oxidase in den Tumorzellen festgestellt werden. 37 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorigenese und Dignität 4 4 Hund, selten Katze ckel, Pudel, Spaniels und Terriern, auf. Rüden stellen weniger als 1% der Träger von Mammatumoren. Siamkatzen und Perserkatzen besitzen für Mammatumoren eine Rassendisposition. Ätiologie Lokalisation unbekannt, möglicherweise Hormoneinfluss fokal oder multifokal Pathologisch-anatomische Differenzialdiagnosen Krankheitsbild Mammatumoren anderer Histogenese und Dignität, Hyperplasie und Dysplasie der Mamma, Mastitis, Hauttumoren, Lipom, Fibrom Klinisch zeigen betroffene Tiere außer einer fokalen oder multifokalen, nodulären, indolenten Umfangsvermehrung im Mammadrüsengewebe keine weiteren Symptome. Häufiger sind die Tumoren in den beiden letzten Drüsenkomplexen lokalisiert. Der betroffene Milchdrüsenkomplex zeigt eine noduläre oder plaqueartige Umfangsvermehrung und in Einzelfällen können auch Ulzerationen nachweisbar sein. Bei zystischen Varianten können fluktuierende Kavernen palpierbar sein. 4.10.7 Einfaches Adenom der Mamma Spezies S. 62 Tumorigenese und Dignität Die benignen Neoplasien der Mamma werden beim Hund in epitheliale und mesenchymale Tumoren sowie Mischtumoren unterteilt. Die benignen epithelialen Tumoren können einfach oder komplex aufgebaut sein. Die einfachen Adenome sind durch gut differenzierte, alveoläre Epithelzellen mit tubuloalveolärer Wuchsform charakterisiert. Demgegenüber zeichnen sich die komplexen Adenome durch eine Proliferation von alveolären und myoepithelialen Zellen aus. Beide Tumortypen wachsen expansiv und zelluläre Atypien und Nekrosen fehlen. Das einfache Adenom der Mamma bei der Hündin zählt zu den relativ häufigen Tumoren des Milchdrüsengewebes. Einfache Adenome können solitär oder multipel in einem oder mehreren Mammarkomplexen gleichzeitig auftreten. Im Gegensatz zum Hund, bei dem der Anteil an gutartigen epithelialen Mammatumoren etwa 50 – 60 % beträgt, ist bei der Katze die Inzidenz gutartiger Mammatumoren mit 6 – 14 % relativ gering. Die Ursache kaniner Mammatumoren ist nicht eindeutig geklärt. Zahlreiche Faktoren haben auf die Tumorigenese einen Einfluss. Vor allem sind hormonelle Faktoren bedeutsam. Endogenes, aber auch exogenes Progesteron spielt wahrscheinlich die wichtigste Rolle. Eine Ovariektomie vor dem ersten Zyklus reduziert das Risiko einer Mammatumorentstehung beim Hund auf 0,5 % und nach dem ersten Zyklus auf 8 %. Bei der Katze vermindert eine frühe Kastration nicht in gleicher Weise wie beim Hund das Risiko der Mammatumorentstehung. Metastasen und Rezidive treten beim benignen, einfachen Adenom nicht auf, sodass die Prognose als uneingeschränkt günstig einzustufen ist. Allerdings können an anderen Stellen der Milchdrüse ähnliche oder andere Tumoren entstehen. Mammatumoren treten bevorzugt bei kleinen Rassen, beispielsweise Da- Makroskopisch ist der betroffene Mammarkomplex infolge einer oder mehrerer nodulärer Umfangsvermehrungen geschwollen. Das Tumorgewebe ist weich bis fest und auf der Schnittfläche homogen grauweiß. Bei Zystadenomen können unterschiedlich große Hohlräume mit klarer Flüssigkeit vorkommen. Histologisch zeichnet sich das einfache Adenom durch einen umschriebenen, nodulären oder multilobulierten Gewebeknoten mit expansivem Wachstum aus (Abb. 4.25). Das Tumorgewebe besteht aus einer Proliferation von monomorphen, iso- bis hochprismatischen, epithelialen Tumorzellen. Die Zellen bilden adenoide, tubuläre, papilläre oder solide Strukturen mit einem ein- bis zweireihigen Epithelbesatz (Abb. 4.26 und Abb. 4.27). Die Tumorzellen besitzen einen runden bis rundovalen, mäßig heterochromatinreichen Kern mit meist einem kleinen Nukleolus. Der schmale, eosinophile Zytoplasmasaum weist oftmals eine deutliche Zellbegrenzung auf (Abb. 4.28). Pro Gesichtsfeld ist bei hoher Vergrößerung weniger als eine Mitosefigur anzutreffen. Das Tumorgewebe ist meist von einem spärlichen, fibrovaskulären Stroma durchzogen. In Einzelfällen finden sich zystische Hohlräume mit isoprismatischer oder flacher Epithelauskleidung und Akkumulation von proteinreicher Flüssigkeit. Gelegentlich können im Stroma Makrophagen, Lymphozyten und Plasmazellen angetroffen werden. 38 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumoren Tumorarten S. 64 Einfaches Adenokarzinom der Mamma Spezies Hund, Katze Ätiologie unbekannt, möglicherweise Hormoneinfluss Pathologisch-anatomische Differenzialdiagnosen Mammatumoren anderer Histogenese und Dignität; Hyperplasie und Dysplasie der Mamma; Mastitis, Hauttumoren, Lipom, Fibrom, Fibrosarkom Tumorigenese und Dignität Die malignen Mammatumoren können epithelialer oder mesenchymaler Herkunft sein oder setzen sich aus Komponenten beider Keimblätter zusammen. Beim einfachen Adenokarzinom der Mamma handelt es sich um einen malignen epithelialen Tumor, der von den Epithelien ausgeht. Demgegenüber stellt das komplexe Adenokarzinom eine Proliferation epithelialer und myoepithelialer Zellen dar. Das biologische Verhalten dieses Tumors ist gegenüber dem einfachen Adenokarzinom als weniger maligne einzustufen. Weiterhin gibt es ein nicht infiltrativ wachsendes Karzinom (Carcinoma in situ), das zwar zytologische Merkmale eines malignen Tumors jedoch kein Invasionspotenzial besitzt. Als besondere Varianten werden das Spindelzellkarzinom, Plattenepithelkarzinom, das muzinöse Karzinom und das lipidreiche Karzinom unterschieden. Das einfache Adenokarzinom kann in unterschiedlichen, morphologischen Subtypen auftreten, die entsprechend ansteigender Malignität als tubulopapillärer, solider und anaplastischer Subtyp bezeichnet werden. Die einfachen Adenokarzinome wachsen lokal invasiv und ihre Rezidivrate ist entsprechend hoch. Eine lymphohämatogene Metastasierung dieser Tumoren ist häufig (Angiosis carcinomatosa), sodass die Prognose als vorsichtig bis ungünstig einzustufen ist. Meist lässt sich periund intratumorös eine lymphozytäre Infiltration nachweisen, die wahrscheinlich auf die Expression von bestimmten tumorspezifischen Antigenen zurückzuführen ist. Für das Vorkommen von einfachen Adenokarzinomen bei Hündinnen gelten die gleichen Alters- und Rassendispositionen wie für das einfache Adenom. Maligne Mammatumoren stellen beim Hund ca. 40 – 50 % und bei der Katze zwischen 86 – 94 % der tumorösen Neu- bildungen der Milchdrüse dar. Bei der Katze ist dabei das einfache Adenokarzinom der häufigste Tumor des Mammadrüsengewebes, der ein hohes Rezidiv- und Metastasierungspotenzial besitzt. Lokalisation fokal oder multifokal Krankheitsbild Klinisch zeigen betroffene Individuen eine meist unscharf demarkierte, noduläre Umfangsvermehrung eines oder mehrerer Mammarkomplexe. Der Tumor kann über der Unterhaut verschieblich sein und fokale Ulzerationen sind möglich. Bei ausgeprägten entzündlichen Veränderungen ist das Gewebe vermehrt warm und schmerzhaft. Im Falle einer Lymphangiosis carcinomatosa finden sich strangartige oder kleinknotige Verhärtungen der Haut. Makroskopisch ist das einfache Adenokarzinom durch eine unscharf demarkierte, lokal invasiv wachsende Umfangsvermehrung gekennzeichnet. Die Konsistenz ist weich bis hart. Infolge von Nekrosen kann es zu Einschmelzungen und Kavernenbildungen kommen. Die Schnittfläche ist grauweiß oder infolge von Einblutungen fleckig gerötet. Histologisch ist je nach Subtyp des einfachen Adenokarzinoms eine tubulopapilläre oder solide Proliferation einer mäßig pleomorphen, epithelialen Tumorzellpopulation zu finden. Der tubulopapilläre Subtyp kann entweder als tubuläre oder als papilläre Variante vorkommen. Erstere weist lokal invasiv wachsende, tubuläre Strukturen auf (Abb. 4.29 und Abb. 4.30), während Letztere durch größere, zystische Hohlräume mit papilliformen Projektionen von Tumorzellen charakterisiert ist. Die Zellen besitzen einen großen, heterochromatinarmen Kern mit meist einem oder mehreren Kernkörperchen. Das Zytoplasma ist spärlich ausgebildet und eosinophil (Abb. 4.31). Der solide Subtyp zeigt eine zellreiche Proliferation von pleomorphen Tumorzellen. Bei beiden Tumortypen sind mehr oder weniger zahlreiche Mitosefiguren zu erkennen. Der anaplastische Subtyp weist prominente Zellatypien mit Megalozytosen, Karyomegalien, bizarren Kernformen, bi- und multinukleären Zellen, Anisokaryose, Anisozytose und Anisonukleolose auf. Die Zahl der Mitosen ist meist noch höher als in den beiden anderen Subtypen. Bei allen drei Varianten können Nekrosen, 39 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.10.8 4 4 Tumoren 4.10.9 Benigner Mammamischtumor Spezies S. 66 Hund, extrem selten Katze Ätiologie unbekannt, möglicherweise Hormoneinfluss Pathologisch-anatomische Differenzialdiagnosen Mammatumoren anderer Histogenese und Dignität, Hyperplasie und Dysplasie der Mamma, Mastitis, Hauttumoren, Lipom, Fibrom Tumorigenese und Dignität Der benigne Mammamischtumor gehört zu den gutartigen Neoplasien der Mamma des Hundes und besteht aus epithelialen und mesenchymalen Zellen. Der benigne Mammamischtumor kann solitär oder multipel in einem oder mehreren Mammarkomplexen beim Hund auftreten. Häufiger sind die beiden kaudalen Komplexe einer Milchleiste betroffen. Die Mischtumoren enthalten variable Anteile von epithelialen und/oder myoepithelialen Zellen sowie mesenchymales Gewebe. Bei diesem handelt es sich um Binde-, Fett-, Knorpel- und/oder Knochengewebe. Benigne Mischtumoren zeigen ein langsames, expansives Wachstum. Die Rezidivneigung ist gering, sodass die Prognose als günstig anzusehen ist. Für das Vorkommen von Mammamischtumoren bei Hündinnen gelten die gleichen Alters- und Rassendispositionen wie für das einfache Adenom. Bei der Katze treten Mischtumoren extrem selten auf. Lokalisation fokal oder multifokal Krankheitsbild Klinisch zeigen betroffene Individuen entweder einen solitären oder multiple, gut demarkierte, indolente, noduläre Umfangsvermehrungen in einem oder mehreren Mammarkomplexen. In Einzelfällen können die Tumoren eine erhebliche Größe von bis zu 20 cm Durchmesser besitzen. Der Tumorknoten ist über der Unterhaut verschieblich. Palpatorisch zeichnet sich der Mammamischtumor durch eine feste bis knöcherne Beschaffenheit aus. Makroskopisch ist der betroffene Mammarkomplex durch den Tumorknoten vergrößert und kann eine über die Oberfläche erhabene Umfangsvermehrung aufweisen. Der Tumorknoten zeichnet sich durch eine feste bis knöcherne Konsistenz aus. Auf der Schnittfläche ist ein gut demarkierter, expansiv wachsender Tumorknoten mit grauweißen, knorpeligen oder nicht schneidbaren, knöchernen Gewebsanteilen in variabler Ausbildung erkennbar. Für die histotechnologische Aufarbeitung ist eine Entkalkung des Hartgewebes, beispielsweise in 5 %iger Salpetersäure, notwendig. Histologisch ist der Mammamischtumor in der Regel von einer bindegewebigen Kapsel umgeben. Im Tumorgewebe lassen sich in unterschiedlichem Ausmaß epitheliale und/oder myoepitheliale sowie mesenchymale Gewebeanteile nachweisen. Die regulär strukturierten Epithelien bilden adenoide, tubuläre, papilläre oder solide Proliferationen, die irregulär im Tumorgewebe verteilt sind. Des Weiteren können nesterartige Ansammlungen von spindel- oder sternförmigen, myoepithelialen Zellen vorkommen, die in eine faserarme, teilweise muzinöse, extrazelluläre Matrix eingebettet sind (Abb. 4.33 und 4.34). Die mesenchymale Tumorkomponente kann sich aus ausgereiften Adipozyten, in Strängen angeordneten Fibroblasten oder Knochen- und Knorpelgewebe zusammensetzen. Das Knorpelgewebe kann aus großkernigen Chondroblasten und einer schwach basophilen, chondroiden Matrix bestehen (Abb. 4.35 und 4.36). Oftmals ist ein kontinuierlicher Übergang zwischen Knorpelgewebe und Myoepithel zu beobachten. Gleichzeitig oder ausschließlich kann aber auch Knochengewebe vorkommen, das sich aus Spongiosabälkchen mit Osteozyten und peripherem Osteoblastenbesatz zusammensetzt. Vereinzelt werden mehrkernige Osteoklasten beobachtet. Zwischen den Spongiosabälkchen kann hämatopoietisch aktives Knochenmark nachweisbar sein. Das Tumorgewebe wird von einem fibrovaskulären Stroma unterschiedlicher Ausprägung durchzogen, in dem in Einzelfällen eine Infiltration mit Lymphozyten, Plasmazellen und Makrophagen auftritt. 40 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Blutungen, lymphozytär-plasmazelluläre Infiltrationen und Tumorzellemboli in Lymphgefäßen nachweisbar sein (Abb. 4.32). In Einzelfällen kann eine starke Begleitentzündung das Tumorgewebe stark infiltrieren und die Diagnose erschweren. Der Nachweis des Intermediärfilaments Zytokeratin kann in diesen Fällen zur Identifikation der Tumorzellen hilfreich sein. Tumorarten S. 68 Plattenepithelkarzinom der Haut Spezies Hunde, Katzen, Pferde, Rinder, selten kleine Wiederkäuer und Schwein Ätiologie unbekannt, aktinische Schädigung durch Sonnenlicht, mechanische Irritationen, chronische Entzündung Pathologisch-anatomische Differenzialdiagnosen Carcinoma in situ, Basalzelltumor, Basalzellkarzinom, Adenokarzinom, malignes Melanom, malignes Trichoepitheliom, chronische Entzündungen Tumorigenese und Dignität Das Plattenepithel ist das Ausgangsgewebe dieser Neoplasie. Plattenepithelkarzinome zeigen ein infiltratives, destruierendes Wachstum mit Invasion in das Nachbargewebe. Das Tumorstroma ist oftmals im Rahmen einer immunologischen Abwehrreaktion von Lymphozyten und Plasmazellen infiltriert. Das subunguale Plattenepithelkarzinom, das vom Plattenepithel des Krallenbettes ausgeht, ist als besondere Entität in der WHO-Klassifikation erfasst. Plattenepithelkarzinome treten meist bei adulten Individuen in der Haut oder den Schleimhäuten auf. Bei Hunden und Katzen tritt das Plattenepithelkarzinom vor allem in der Haut und in der Mundhöhle auf. Insbesondere weiße Katzen erkranken an einem Plattenepithelkarzinom an den Rändern der Ohrmuscheln. Bei Rindern und Pferden sind besonders die mukokutanen Übergänge betroffen. Am Auge wird bei Rindern auch vom cancer eye gesprochen. Als disponierte Hunderassen werden der Wolfsspitz, Schnauzer und Basset genannt. Bei Pferden tritt die Neoplasie besonders bei Belgiern, Clydesdale, Shire und Appaloosas auf. Rinder mit fehlender periokulärer Pigmentierung, beispielsweise Hereford oder Simmentaler, erkranken häufiger als andere Rinderrassen. Geschlechtsdispositionen für diesen Tumor sind nicht beschrieben. Das Plattenepithelkarzinom wächst in vielen Fällen langsam. Trotz des invasiven Wachstums werden nur selten Metastasen in regionären Lymphknoten festgestellt. Rezidive können jedoch auftreten. Die Prognose ist daher als vorsichtig zu bezeichnen. Lokalisation Haut von Kopf, Abdomen, Vorder- und Hintergliedmaßen, Krallenbett, Perineum, Ohrränder, Augenlider, Planum nasale (Katze); mukokutane Übergänge am Auge und an der Vulva (Rind, Pferd); Penis, Präputium (Hengst) Krankheitsbild Klinisch zeigen Tiere mit einem Plattenepithelkarzinom am Auge meist eine eitrige Konjunktivitis. Bei einem Tumorsitz in der Haut kann eine flache Ulzeration mit peripherer Verdickung und Induration der betroffen Lokalisation beobachtet werden. Gelegentlich kann eine zerklüftete, blumenkohlartig erhabene Umfangsvermehrung mit Blutungen auftreten. An der Zehe zeigt sich eine unscharf demarkierte, knotige Auftreibung, die meist ulzeriert ist und mit einem Verlust des Krallenhornes einhergeht. Die regionären Lymphknoten können klinisch unverändert sein oder eine Umfangsvermehrung aufweisen. Makroskopisch stellt sich das Plattenepithelkarzinom als derbe, meist endophytisch wachsende Umfangsvermehrung dar, die gegenüber dem gesunden Nachbargewebe undeutlich begrenzt ist. Ulzerierte Tumoren weisen eine graue, kraterartige Oberfläche mit Blutungen auf. Der Tumor besitzt eine derbe Konsistenz und eine grauweiße Schnittfläche. An der Zehe ist in unterschiedlichem Ausmaß eine Osteolyse der distalen Zehenknochen oder ein Verlust der Krallentüte zu beobachten. Lymphknotenveränderungen können in kleinen, grauweißen Herden bestehen. Histologisch ist der Tumor durch eine infiltrative Proliferation von Plattenepithelzellen gekennzeichnet (Abb. 4.37). Das Tumorgewebe steht in Kontinuität mit dem oberflächlichen Epithel und bildet Stränge, Bänder und Inseln. Diese zeigen bei differenzierten Neoplasien einen dem normalen Plattenepithel ähnlichen Aufbau. Peripher sind basaloide Zellen mit runden, heterochromatinarmen Kernen und einem prominenten, solitären Nukleolus zu beobachten (Abb. 4.38). Das Zytoplasma ist reichlich ausgebildet und schwach eosinophil. In zentralen Anteilen der Tumorzellinseln findet eine Plattenepithelzelldifferenzierung statt. Diese ist durch eine Vergrößerung der Zellen mit Ausbildung von reichlich eosinophilem Zytoplasma charakterisiert. Es können zudem Ein- 41 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.10.10 4 4 Tumoren 4.10.11 Equines Sarkoid Spezies S. 70 Pferd, Esel Ätiologie bovines Papillomavirus Typ 1 und 2 Pathologisch-anatomische Differenzialdiagnosen Fibrosarkom, Fibrom, (Fibro-)Papillom, Tumoren der Nervenscheiden, Dermatophytosen, Keloid, Habronematidose, Granulationsgewebe Tumorigenese und Dignität Das equine Sarkoid ist der häufigste Hauttumor des Pferdes. Die Ursache der Neoplasie besteht in einer nicht produktiven Infektion mit dem bovinen Papillomavirus Typ 1 und 2. Die Zielzellen der Viren sind dermale Fibroblasten. Die virale DNS wird episomal repliziert, aber es werden keine Viruspartikel synthetisiert. Die benachbarte Epidermis zeigt eine prominente, irreguläre epidermale Hyperplasie mit Hyperkeratose und ist oftmals ulzeriert. Anhand morphologischer Kriterien werden ein verruköser, ein fibroblastisch gestielter, ein sessiler und ein gemischter Typ des equinen Sarkoids unterschieden. Typische Lokalisationen dieses Hauttumors sind der Kopf, die Lippen, die Gliedmaßen und das ventrale Abdomen. Annähernd 40 % betroffener Pferde haben multiple Neoplasien. Das equine Sarkoid zeigt eine hohe Rezidivrate, Metastasen treten aber nicht auf. Der Tumor wird als semimaligne eingestuft und die Prognose ist daher als relativ günstig zu bewerten. Das equine Sarkoid kann bei Pferden jeden Alters auftreten, jedoch werden die meisten Fälle bei Tieren gesehen, die jünger als 4 Jahre sind. Es besteht keine Rassen- oder Geschlechtsdisposition. Lokalisation fokal oder multifokal in der Haut Krankheitsbild Klinisch zeigen betroffene Individuen solitäre oder multiple, erhabene, derbe Umfangsvermehrungen der Haut. Je nach Tumortyp können warzenartige Knoten mit zerklüfteter, ulzerierter Oberfläche, gestielte oder knotige, dermale Umfangsvermehrungen vorkommen, die meist über der Unterhaut verschieblich sind. Makroskopisch finden sich einzelne oder mehrere Neubildungen in der Haut. Sie können erhaben sein und eine zerklüftete Oberfläche mit zahlreichen schuppigen Auflagerungen haben. Es können auch gestielte Knoten oder flache, intradermal lokalisierte Neubildungen vorkommen. Die Konsistenz der Tumoren ist derb. Auf der Schnittfläche zeigen sie eine weiße Farbe mit feiner Fasertextur. Das equine Sarkoid kann entweder unscharf demarkiert in das Nachbargewebe übergehen oder als umschriebener Knoten in der Dermis lokalisiert sein. Oftmals zeigt die Haut im Bereich eines equinen Sarkoids eine ulzerative Entzündung. Histologisch findet sich eine nicht demarkierte, infiltrativ wachsende oder eine demarkierte, dermale, mäßig zellreiche Proliferation von Fibroblasten und eine irregulär proliferierte Epidermis (Abb. 4.41). Die Epidermis zeigt eine prominente, irreguläre, epidermale Hyperplasie mit Ausbildung von multiplen, auffälligen Reteleisten und Hyperkeratose. Darüber hinaus sind fokale Ulzerationen nachweisbar, die eine Infiltration von neutrophilen Granulozyten und Makrophagen aufweisen. In vielen Fällen reicht das Tumorgewebe bis unmittelbar an die Epidermis heran (Abb. 4.42). Die Neoplasie besteht aus flächenhaften oder in kleinen Bündeln angeordneten Zel- 42 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. zelzellverhornungen oder akkumulierte Keratinlamellen im Zentrum der Plattenepithelinseln auftreten. Letztere werden auch als Hornperlen bezeichnet. Die Zellen aller Schichten zeigen eine deutliche Anisozytose und -karyose. Die Zahl der Mitosen pro Gesichtsfeld bei hoher Vergrößerung liegt meist bei ein bis zwei. Das Stroma besteht aus einem mäßig vaskularisierten Bindegewebe, das oftmals eine lympho-histiozytäre plasmazelluläre Infiltration mit neutrophilen Granulozyten aufweist (Abb. 4.39 und Abb. 4.40). Wenig differenzierte Plattenepithelkarzinome zeigen ein meist solides Wachstum. Sie haben weitgehend die Fähigkeit der Zelldifferenzierung und Verhornung verloren. Es findet sich ein polymorphes Zellbild mit zahlreichen, auch untypischen Mitosen. Ulzerierte Tumoren weisen eine periläsionale Infiltration von neutrophilen Granulozyten und Makrophagen auf. Im regionären Lymphknoten können metastatische Tumorzellnester vorkommen. Immunhistologisch kann in den Tumorzellen das Intermediärfilament Zytokeratin nachgewiesen werden. Tumorarten 4.10.12 Hämangiosarkom Spezies S. 72 Hund, selten Katze, Wiederkäuer, Pferd, Schwein Ätiologie unbekannt, bei kutanen Hämangiosarkomen evtl. aktinische Schädigung durch Sonnenlicht Pathologisch-anatomische Differenzialdiagnosen Haemangioma cavernosum, Hämatom, noduläre Hyperplasie (Milz), Nebenmilz Tumorigenese und Dignität Das Hämangiosarkom, früher auch als malignes Hämangioendotheliom bezeichnet, stellt einen malignen mesenchymalen Tumor ausgehend vom Gefäßendothel dar. Da eine direkte Verbindung zum Gefäßsystem vorliegt, erfolgt meist eine rasche hämatogene Metastasierung. Nach Exzision ist die Rezidivrate hoch und Metastasen werden häufig beobachtet. Die Prognose ist daher als ungünstig einzustufen. Da bei Hunden meist die Milz und das rechte Herzohr gleichzeitig betroffen sind, wird angenommen, dass der Tumor primär multizentrisch auftritt. Metastasen werden vor allem in Lunge, Leber, Niere, großem Netz und Gehirn, aber auch an anderen Lokalisationen im Körper angetroffen. Als besondere Komplikation tritt bei Hämangiosarkomen eine Ruptur der Milz mit daraus resultierendem Hämaskos oder eine Ruptur des rechten Herzohres mit konsekutiver Herzbeuteltamponade auf. Beide Fälle führen meist rasch zum Tod. Hämangiosarkome treten bei adulten Hunden und Katzen auf. Für Deutsche Schäferhunde und Golden Retriever, kurzhaarige, hell- häutige Rassen, beispielsweise Greyhounds, Whippets, American Pitbull Terrier, besteht ein erhöhtes Tumorrisiko. In einigen Fällen wurde eine maligne Transformation von Hämangiomen beschrieben. Lokalisation Milz, rechtes Herzohr, Leber, Haut Krankheitsbild Klinisch zeigen Hunde mit einem Hämangiosarkom der Milz zunächst keine Symptome. Beim Auftreten von Rupturen mit intratumorösen oder abdominalen Blutungen werden Schwäche, Inappetenz und blasse Schleimhäute beobachtet. Hunde können auch plötzlich und unerwartet sterben. Dermale oder subkutane Hämangiosarkome stellen umschriebene, weiche Umfangsvermehrungen dar. Makroskopisch zeigt die Milz meist eine fokale, erhebliche Auftreibung von dunkelroter bis schwarzroter Farbe. Fokal kann eine Ruptur der Kapsel vorliegen, die von anhaftenden Blutkoagula bedeckt ist. Auch in der Bauchhöhle kann freies, partiell geronnenes Blut vorliegen. Die Konsistenz des Tumors ist weich. Die Schnittfläche zeigt sich oftmals homogen schwarzrot gefärbt und blutig. In der Milz können gleichzeitig auch mehrere Tumorknoten vorliegen. Erst durch Auflamellieren der gesamten Umfangsvermehrung können gelegentlich graurote, solidere Tumorareale gefunden werden. Im rechten Herzohr, in der Lunge, der Leber, der Niere, dem großem Netz und in anderen Organen können in der Größe variable, schwarzrote, noduläre Neubildungen nachgewiesen werden. Histologisch findet sich in der Milz eine nicht demarkierte, infiltrativ wachsende Umfangsvermehrung mit unterschiedlich großen, teils kapillären, teils kavernösen Hohlräumen. Mitunter sind auch solide Areale mit nur wenigen Gefäßspalten vorhanden. Die kapillären, teilweise kavernösen Hohlräume sind mit Erythrozyten gefüllt und von einem einschichten Endothel mit ausgeprägter Pleomorphie ausgekleidet (Abb. 4.45 und Abb. 4.46). Die endothelialen Tumorzellen besitzen große, rundovale, vesikuläre Kerne mit zum Teil deutlicher Anisokaryose. Das Zytoplasma ist mäßig ausgebildet, eosinophil und wölbt sich in den angrenzenden Hohlraum vor. Pro Gesichtsfeld sind bei hoher Vergrößerung meist zahlreiche Mi- 43 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. len, die in einer extrazellulären Matrix von variierendem Fasergehalt eingebettet sind (Abb. 4.43). Die neoplastischen Zellen zeigen eine deutliche Pleomorphie mit Anisozytose und Anisokaryose. Die Tumorzellen können spindelförmig oder polygonal sein. Es finden sich längsovale, rundovale und gekerbte, mäßig heterochromatinreiche Kerne unterschiedlicher Größe mit einem oder selten zwei Kernkörperchen. Das Zytoplasma ist mäßig eosinophil und die Zellgrenzen sind undeutlich (Abb. 4.44). Meist ist weniger als eine Mitosefigur pro Gesichtsfeld bei hoher Vergrößerung erkennbar. Eine ätiologische Diagnose kann durch den Nachweis von DNS boviner Papillomaviren mittels In-situ-Hybridisierung erfolgen. 4 4 Tumoren Lokalisation Haut, vor allem Kopf und Gliedmaßen Krankheitsbild Kanines kutanes Histiozytom Klinisch zeigen Hunde mit einem kutanen Histiozytom ein ungestörtes Allgemeinbefinden. Die betroffene Hautstelle stellt sich als eine umschriebene, intradermale, leicht gerötete und erhabene, knopfartige Verdickung dar. Die Haut weist meist eine Alopezie und in manchen Fällen auch eine kraterartige Ulzeration auf. Pathologisch-anatomische Differenzialdiagnosen Makroskopisch zeigt sich eine zirkumskripte, derbe Umfangsvermehrung der Haut, die ulzeriert sein kann. Auf der Schnittfläche findet sich ein unscharf demarkierter, grauweißer, nodulärer Herd, der intradermal liegt oder bis zum Unterhautfettgewebe reichen kann. 4.10.13 Spezies S. 74 die jünger als 4 Jahre alt sind, betroffen, aber es können auch ältere Individuen erkranken. Für Schottische Terrier, Bullterrier, Boxer, Englische Cockerspaniel, Flat coated Retriever, Dobermann, Pinscher, Bobtails und Shelties besteht eine Rassendisposition. Beide Geschlechter sind gleich häufig betroffen. Hund Ätiologie unbekannt kutane Histiozytose, histiozytäres Sarkom, systemische Histiozytose, maligne Histiozytose, extramedulläres Plasmozytom, kutanes Lymphosarkom, transmissibler venerischer Tumor (sog. Sticker-Sarkom), granulomatöse Dermatitis Tumorigenese und Dignität Das kanine kutane Histiozytom ist ein sehr häufiger, gutartiger, mesenchymaler Tumor, der oft eine spontane Regression aufweist. Die Ausgangszelle der Neoplasie ist die Langerhanszelle der Epidermis, die eine antigenpräsentierende Funktion besitzt. Das Auftreten von Rezidiven beim kaninen kutanen Histiozytom ist selten und es ist unklar, ob es sich dann nicht um De-novo-Tumoren handelt. Metastasen treten bei kutanen Histiozytomen nicht auf, es können allerdings gleichzeitig Tumoren an verschiedenen Körperstellen nachweisbar sein. Das multiple Auftreten von Histiozytomen wird als kutane Histiozytose bezeichnet. Die Prognose ist als uneingeschränkt günstig einzustufen. Ein Zusammenhang zwischen der spontanen Regression des Tumors und der lymphozytären Infiltration erscheint wahrscheinlich. Insbesondere spielen CD4-positive Lymphozyten bei der Induktion einer Immunantwort eine bedeutsame Rolle. Diese ist mit einem Anstieg der Expression von IL-2, IFN-γ und TNF-α korreliert. Der Tumor tritt insbesondere in der Haut des Kopfes, vor allem an den Ohrmuscheln, und an den Gliedmaßen auf. Typischerweise sind Hunde, Histologisch findet sich eine bis an die Epidermis heranreichende, flächige, zellreiche Proliferation mäßig pleomorpher Tumorzellen. Die Tumorzellen sind nicht von einer Kapsel demarkiert, zeigen allerdings eine deutliche Demarkierung vom Nachbargewebe (Abb. 4.49). Im oberflächlichen Korium ist häufig eine kettenartige Anordnung der Tumorzellen zu finden (Abb. 4.50). Gelegentlich lassen sich auch intraepidermale Tumorzellakkumulationen beobachten. Die Tumorzellen weisen eine mäßige Anisokaryose und Anisozytose auf. Sie zeigen eine runde bis polygonale Gestalt mit einem runden, rundovalen oder bohnenförmig gekerbten, vesikulären Kern. Sie besitzen ein mäßig ausgebildetes, schwach eosinophiles Zytoplasma. Vereinzelt können bi- oder multinukleäre Zellen auftreten. Pro Gesichtsfeld sind bei hoher Vergrößerung zahlreiche Mitosefiguren zu beobachten (Abb. 4.51). Zell- und Kernatypien fehlen jedoch. An der Basis des Tumors sind nesterartige, lymphozytäre Infiltrate zu finden, bei denen es sich vorwiegend um CD3- und CD4-positive Lymphozyten handelt (Abb. 4.52). Die Haut weist meist eine epidermale Hyperplasie oder eine Ulzeration mit peripherer Infiltration von 44 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. tosefiguren zu erkennen (Abb. 4.47 und Abb. 4.48). Die Endothelzellen sitzen auf einem faserreichen, teils azellulären hyalinen Stroma. Multifokal können Abscheidungsthromben auftreten. Des Weiteren werden häufig hämosiderinbeladene Makrophagen beobachtet. In anderen Organen mit einem Hämangiosarkom findet sich prinzipiell ein ähnlicher Tumoraufbau. Immunhistologisch kann in den Tumorzellen die Expression von Faktor-VIII-related-Antigen (Von-Willebrand-Faktor) nachgewiesen werden. Tumorarten 4.10.14 Lungenadenomatose Spezies S. 76 Schaf Ätiologie Jaagsiekte Retrovirus (JSRV) Pathologisch-anatomische Differenzialdiagnosen Maedi, Lungenwurmbefall Tumorigenese und Dignität Die Lungenadenomatose stellt morphologisch ein gut differenziertes, bronchiolo-alveoläres Adenokarzinom dar, das meist primär multizentrisch auftritt. Es handelt sich um einen durch das Jaagsiekte Retrovirus hervorgerufenen, übertragbaren Tumor adulter Schafe. Mit Ausnahme von Australien und Neuseeland ist die Erkrankung nahezu weltweit verbreitet. Die Infektion erfolgt aerogen durch Tröpfcheninfektion und nach einer Inkubationszeit von durchschnittlich 5 bis 8 Monaten, in Einzelfällen von bis zu 3 Jahren (slow virus infection), tritt die Tumorerkrankung klinisch in Erscheinung. Die Pathogenese der neoplastischen Transformation ist bislang noch nicht eindeutig geklärt. Es liegen Hinweise vor, dass über die Bindung eines Hüllproteins an den Rezeptor Hyaluronidase-2 die Onkogenese vermittelt wird. Die Lungenadenomatose wird bei adulten Tieren meist zwischen dem 2. und 4. Lebensjahr angetroffen. Durch bakterielle Infektionen der erkrankten Lunge wird der Verlauf der Erkrankung wesentlich beschleunigt. Zwischen verschiedenen Rassen bestehen unterschiedliche Empfänglichkeiten für die Ausbildung der Erkrankung. So treten beispielsweise bei bestimmten Fettschwanzschafen in bis 30 – 50 % der Fälle extrathorakale Metastasen auf, während andere Rassen nur in 5 % Metastasen in den regionären Lymphknoten aufweisen. Eine Geschlechtsdisposition existiert nicht. Eine Koinfektion mit dem Maedi/Visna-Virus wird häufig beobachtet. Lokalisation multifokal in beiden Lungenhälften Krankheitsbild Klinisch zeigen betroffene Schafe je nach Ausprägung des Krankheitsbildes einen schlechten Ernährungszustand, Augenausfluss, Tachypnoe und Dyspnoe, Letztere insbesondere nach körperlicher Belastung. Bei Tieren ohne Sekundärinfektionen werden weder Fieber noch Inappetenz nachgewiesen. Typischerweise zeigen erkrankte Schafe eine exzessive Produktion von Alveolarflüssigkeit, die als wässriges Sekret, vor allem nach dem Anheben der Hinterhand, aus der Nase austritt. Makroskopisch weist die schlecht retrahierte Lunge multifokal, vor allem in den kranioventralen Anteilen, aber auch in anderen Regionen, konfluierende, graue Herdveränderungen auf, die eine Größe von einem Millimeter bis zu mehreren Zentimetern haben können. Die Pleura pulmonalis ist unverändert. Die Knoten zeigen eine solide, feste Beschaffenheit und sind oftmals von emphysematösem Lungengewebe umgeben. Bakterielle Sekundärinfektionen oder Nekrosen können vorkommen. In ausgeprägten Fällen kann das Gesamtgewicht der Lunge bis zu 300 % (bis zu 2 kg; Normalwert: 0,3 bis 0,8 kg) ansteigen. Auf der Schnittfläche kann in den tieferen Atemwegen reichlich schaumige Flüssigkeit nachgewiesen werden. Die regionären Lymphknoten sind vergrößert, ödematisiert und können auf der Schnittfläche kleinknotige, graue Metastasen zeigen. Histologisch finden sich multiple, unterschiedlich große, teils miteinander konfluierende, invasiv wachsende Tumorareale (Abb. 4.53 und 4.54). Die Neoplasie besteht aus papillären oder alveolären Strukturen (Abb. 4.55). Die Epithelzellen besitzen eine kubische oder hochprismatische Gestalt, die den Typ-II-Pneumozyten oder Clarazellen ähnlich ist. Das meist einschichtige Epithel sitzt auf einem dünnen, fibrovaskulären Stroma. Multifokal können auch fibrotische Areale vorkommen. Des Weiteren ist oftmals eine prominente Alveolarhistiozytose nachweisbar (Abb. 4.56). Mitosefiguren sind nur selten zu beobachten. Sowohl im Tumorstroma als auch im benachbarten Lungeninterstitium können Infiltrationen mit Lymphozyten und Plasmazellen auftreten. Beim Nachweis von zahlreichen, peribronchiolär lokalisierten, hyper- 45 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Makrophagen und neutrophilen Granulozyten auf. In älteren Tumoren können auch Nekrosefelder vorkommen. Immunhistologisch kann die Expression von CD1, CD11 und dem Haupthistokompatibilitätsantigen (MHC) Klasse II in den Tumorzellen nachgewiesen werden. 4 4 Tumoren 4.10.15 Seminom Spezies S. 78 Hund, selten Pferd, Schaf, Rind, Katze Ätiologie unbekannt Pathologisch-anatomische Differenzialdiagnosen Leydig-Zell-Tumor, Sertoli-Zell-Tumor, Teratom, embryonales Karzinom, Dottersackkarzinom Tumorigenese und Dignität Das Seminom ist der häufigste Hodentumor des Hundes. Seminome sind zellreiche, epitheliale Keimzelltumoren, die von den germinativen Zellen der Hoden abstammen und das Gegenstück zu den ovariellen Dysgerminomen darstellen. Die Tumorzellen ähneln Spermatogonien. Seminome können solitär oder multipel und uni- oder bilateral vorkommen. Bei einem Individuum können auch Hodentumoren unterschiedlicher Histogenese, v. a. Leydig- und Sertoli-Zell-Tumoren, gleichzeitig auftreten. Der Tumor wächst zunächst fokal oder multifokal intrakanalikulär in den Tubuli seminiferi. Im fortgeschrittenen Stadium ist nach der Zerstörung der Basalmembran ein diffuses Tumorwachstum mit Destruktion der organspezifischen Hodenarchitektur nachweisbar. Seminome können in bis zu 10 % der Fälle ein malignes biologisches Verhalten mit Metastasen in den regionären Lymphknoten und auch Fernmetastasen aufweisen. Die Prognose ist daher als relativ günstig bis vorsichtig zu stellen. In Einzelfällen zeigen Rüden mit Seminomen einen erhöhten Östradiolspiegel, aber eine Feminisierung ist meist nicht zu beobachten. Kryptorchide Hoden sind für die Entwicklung von Seminomen und Sertoli-Zell-Tumoren disponiert. Bei Boxern und Jack-Russel-Terriern, die eine hereditäre bzw. familiäre Neigung zum Kryptorchismus haben, wird ein vermehrtes Auftreten von Hodentumoren beschrieben. Das Durchschnittsalter liegt für alle Hodentumoren bei 9 – 11 Jahren, während sie bei kryptorchiden Rüden in jüngeren Jahren (< 5 Jahre) zu finden sind. Lokalisation fokal oder multifokal, uni- oder bilateral im Hoden Krankheitsbild Klinisch zeigen Rüden mit Seminomen eine skrotale oder inguinale Umfangsvermehrung. Eine Feminisierung mit Gynäkomastie, vergrößerten Zitzen, Attraktivität für andere Rüden, verminderter Libido, atrophischer Dermatose, Prostatahyperplasie, Atrophie des kontralateralen Hodens und aplastischer Anämie wird nur in Einzelfällen beobachtet. Makroskopisch findet sich ein bis zu faustgroßer, umschriebener Knoten im Hodengewebe. Das Tumorgewebe besitzt eine grauweiße, glänzende Schnittfläche und eine weiche bis feste Konsistenz. Durch Blutungen und Nekrosen können dunkelrote Areale oder gelbliche Erweichungsherde auftreten. In Fällen maligner Seminome finden sich Tumorknoten in den regionären Lymphknoten und inneren Organen. Histologisch zeigen Seminome ein zellreiches, intratubuläres oder diffuses Wachstum. Bei der intratubulären Form finden sich tumorös entartete germinative Zellen nur in den Tubuli seminiferi. Das normale Keimdrüsenepithel und die SertoliZellen sind nicht mehr nachweisbar. Die diffuse Form geht mit einem Verlust der normalen Architektur des Hodengewebes einher (Abb. 4.57 und 4.58). Disseminiert lassen sich Einzelzellnekrosen oder kleinere Nekrosefelder beobachten. Die Kerntrümmer werden von Makrophagen phagozytiert und verleihen dem Tumor ein „sternhimmelartiges“ Aussehen. Darüber hinaus finden sich multifokal nesterartige Infiltrate von Lymphozyten (Abb. 4.59). Die relativ großen, pleomorphen Tumorzellen besitzen eine runde bis polygonale Gestalt mit scharfen Zellgrenzen. Die großen, runden, heterochromatinarmen Kerne enthalten einen oder zwei, meist prominente, solitäre Nukleoli. Das schmale bis mäßig ausgebildete Zytoplasma färbt sich basophil bis amphophil. Es werden zahlreiche, teils bizarre Mitosefiguren angetroffen (Abb. 4.60). Eine Infiltration der Tumorzellen in die Blut- und Lymphgefäße oder angrenzendes Gewebe, beispielsweise die Tunica albuginea, sind als Malignitätskriterien anzusehen. 46 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. plastischen Lymphfollikeln und einer interstitiellen Pneumonie muss eine Koinfektion mit dem Maedi/Visna-Virus in Betracht gezogen werden. In Fällen mit einer sekundären bakteriellen Infektion der Lunge lässt sich zusätzlich eine katarrhalischeitrige oder fibrinöse Pneumonie nachweisen. Tumorarten Oligodendrogliom Spezies S. 80 Hund, selten Katze, Rind und Pferd Ätiologie unbekannt Pathologisch-anatomische Differenzialdiagnosen Hirntumoren anderer Histogenese, sekundäre Hirntumoren Tumorigenese und Dignität Das Oligodendrogliom gehört zu den neuroektodermalen Tumoren des zentralen Nervensystems. Die Ausgangszelle der Neoplasie ist der Oligodendrozyt. Anhand histologischer Kriterien werden die oligodendroglialen Tumoren in das Oligodendrogliom, das anaplastische Oligodendrogliom, das gemischte Gliom (Oligoastrozytom), das Gliosarkom, die Gliomatosis cerebri und das Spongioblastom eingeteilt. Oligodendrogliome kommen als umschriebene Umfangsvermehrungen in der weißen und grauen Substanz des Gehirns, vor allem des Großhirns, seltener des Rückenmarks vor. Die Frequenz betroffener Lokalisationen nimmt in den Großhirnhemisphären von rostral nach kaudal ab. Beim Hund brechen die Neoplasien oft in die Lateralventrikel ein und bei der Katze infiltrieren sie eher die Meningen. Aufgrund des lokal destruierenden Wachstums und der Rezidivgefahr ist die Prognose in den meisten Fällen ungünstig. Brachyzephale Rassen wie Boxer, Boston-Terrier und Bulldoggen scheinen für Oligodendrogliome disponiert zu sein. Meist sind Hunde, die älter als 5 Jahre sind, von dem Tumor betroffen. Eine Geschlechtsdisposition existiert nicht. Lokalisation fokal im Neuroparenchym, vor allem im Großhirn Krankheitsbild Klinisch zeigen betroffene Individuen je nach Lokalisation des Tumors unterschiedliche Symptome. Ist der Tumor im Großhirn lokalisiert, werden oftmals Verhaltensänderungen oder Anfallsgeschehen beobachtet. Es können auch Veränderungen im Bewegungsablauf, Bewusstseinsänderungen, Störungen der Balance, Kreisbewegungen, Veränderungen der Sehfähigkeit, Kopfnervenausfälle oder propriozeptive Defizite auftreten. Makroskopisch zeichnet sich das Oligodendrogliom durch eine meist relativ große, gut demarkierte, weiche Umfangsvermehrung aus. Die Schnittfläche besitzt eine graublaue bis rosafarbene, oftmals gelatinöse oder mukoide Beschaffenheit. Das Tumorgewebe kann bis in die Leptomeninx oder die Ventrikelräume infiltrieren. Des Weiteren können multifokal rötliche Blutungsherde, gelbliche Nekrosefelder oder gelatinöse Zysten auftreten. Histologisch stellt sich das Oligodendrogliom als eine zellreiche, oftmals solide Proliferation von monomorphen Tumorzellen dar, die meist unscharf vom Nachbargewebe demarkiert ist und infiltrativ in das Neuroparenchym wächst (Abb. 4.61). In der Tumorperipherie können arkaden- oder girlandenartige, sog. glomeruloide Proliferationen von Kapillaren in bandartiger Anordnung nachweisbar sein (Abb. 4.62). Die Zellen sind teilweise in Ketten oder Strängen angeordnet. Gegenüber dem Nachbargewebe kann eine deutliche Abgrenzung bestehen. Die Zellen besitzen einen runden, heterochromatinarmen, zentral gelegenen, kleinen Kern und ein schwach eosinophiles Zytoplasma und deutliche Zellgrenzen. Wird das Tumorgewebe erst mit zeitlicher Verzögerung nach dem Tod fixiert, entstehen perinukleäre, ungefärbte Höfe, die aufgrund der deutlich gefärbten Zellmembran den Zellen ein typisches „Honigwabenmuster“ verleihen (Abb. 4.63). Mitosefiguren sind selten zu finden. Weitere histologische Befunde bestehen in dystrophischen Verkalkungsherden, Nekrosen, muzinreicher Degeneration mit interzellulärer Akkumulation von blassem, graublauem Material und Zystenbildung. Für formalinfixierte und in Paraffin eingebettete Oligodendrogliome gibt es bei Hund und Katze keine spezifischen Marker. Eine Expression des sauren Gliafaserproteins (GFAP) in Oligodendrogliomen kann sowohl in intratumorösen, reaktiven Astrozyten als auch in Minigemistozyten beobachtet werden. Das von humanen Oligodendrogliomen exprimierte myelinbasische Protein und das myelinassoziierte Glykoprotein sind in kaninen und felinen Oligodendrogliomen immunhistologisch nicht nachweisbar. 47 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.10.16 4 4 Tumoren S. 82 Malignes Lymphom in der Leber Synonyme Lymphosarkom Spezies Fleischfresser, Wiederkäuer, Pferd, Schwein, Kaninchen und Labornager Ätiologie unbekannt, Retroviren bei einzelnen Tierarten (Rind, Schaf, Katze) Pathologisch-anatomische Differenzialdiagnosen Leukosen anderer Histogenese, beispielsweise Erythroleukämie, Megakaryozyten-Leukose, Mastzellen-Leukose, myeloische Leukose; hepatozelluläres Karzinom, cholangiogenes Karzinom; histiozytäre Tumoren oder rundzellige Neoplasien anderer Histogenese; multifokale, chronische, granulomatöse Hepatitis, Gallengangskokzidiose (Kaninchen) Tumorigenese und Dignität Das maligne Lymphom kann als reifzelliges oder unreifzelliges T- oder B-Zell-Lymphom auftreten. Es werden akute und chronische Verlaufsformen unterschieden. Leukämisch verlaufende maligne Lymphome gehen mit einem Nachweis von Tumorzellen im Blut einher, während bei der aleukämischen Form keine neoplastischen Zellen hämatogen zirkulieren. Tiere mit einem malignen Lymphom zeigen eine tumorös veränderte Milz, Lymphknoten und meist auch Tumorzellinfiltrate im Knochenmark. Die Tumorzellen besiedeln auf hämatogenem Wege die Leber und sind sowohl im Portalfeld als auch innerhalb der Läppchen zu finden. Die Leber kann diffus infiltriert oder multifokal von nodulären Tumorzellproliferationen durchsetzt sein. In den meisten Fällen sind beim malignen Lymphom des Hundes zusätzlich auch die Milz, die Lymphknoten und das Knochenmark sowie verschiedene Organe, beispielsweise Niere oder Lunge, von der Tumorzellinfiltration betroffen. In Einzelfällen wird auch ein paraneoplastisches Syndrom oftmals in Form einer Hyperkalzämie beobachtet. Das maligne Lymphom kann bei Tieren unterschiedlichen Alters auftreten. Bei Hunden sind meist adulte Individuen betroffen. Die Prognose dieser meist systemisch auftretenden malignen Lymphome ist infaust. Lokalisation disseminiert knotig oder diffus infiltrierend in der Leber Krankheitsbild Klinisch zeigen betroffene Individuen je nach Ausprägung des Krankheitsbildes ein variables Erscheinungsbild. Dies kann mit struppigem Haarkleid, Abmagerung, Kachexie, Apathie, Anämie infolge Knochenmarksschädigung, vergrößerten lymphatischen Geweben, sekundären bakteriellen Infektionen und paraneoplastischen Syndromen einhergehen. Steht die Leberbeteiligung im Vordergrund dominieren Funktionsstörungen des Organs das klinische Bild. Dabei können Ikterus und sogar ein hepatisches Koma beobachtet werden. Makroskopisch ist die Leber mäßig vergrößert, hellbraun bis graurot, von weicher, brüchiger Konsistenz. Die Läppchenzeichnung kann einerseits infolge einer interstitiellen Tumorzellinfiltration deutlich hervortreten. Andererseits kann das Organ auch von unterschiedlich großen, grauweißen, weichen, speckigen Knoten durchsetzt sein, die im Zentrum einen nekrotischen Zerfall und/oder Blutungen aufweisen können. Die regionären Lymphknoten zeigen meist eine erhebliche Vergrößerung und besitzen eine weiche Konsistenz und eine homogene, speckige Schnittfläche. Histologisch kann durch die Tumorzellinfiltration die Läppchenarchitektur verwischt oder in stark infiltrierten Bereichen sogar verloren gegangen sein (Abb. 4.64). Vor allem in den Portalfeldern, den Sinusoiden peripherer Läppchenbereiche und den Zentralvenen findet sich eine relativ monomorphe Zellpopulation, die je nach Differenzierungsgrad der Zellen ein eher lymphozytoides oder lymphoblastoides Aussehen haben kann. Die Tumorzellen liegen solitär, in Nestern oder als größere, solide Areale vor (Abb. 4.65). Sie besitzen zentral liegende, runde, hyperchromatische Kerne und gelegentlich ist ein schmaler, eosinophiler Zytoplasmasaum sichtbar. In einzelnen Tumorzellen kann ein solitärer Nukleolus erkennbar sein. Durch die Zellinfiltrate können herdförmig Druckatrophien von Leberzellbalken auftreten. Pro Gesichtsfeld bei hoher Vergrößerung sind meist zahlreiche, auch atypische Mitosefiguren erkennbar (Abb. 4.66). Durch Rückstau von Blut können die Lichtungen der Sinusoide erweitert sein. Bei vie- 48 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.10.17 Tumorarten sierung der Tumorzellen durchführen, die eine genauere Einteilung in maligne B- oder T-Zell-Lymphome erlaubt (Abb. 4.67). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. len Tierarten lässt sich mithilfe von spezifischen Antikörpern gegen Oberflächenantigene (z. B. CD3 und CD79a) eine immunhistologische Phänotypi- 4 49 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Tumoren Abb. 4.1 In der Subkutis ist ein Segment eines Fibroms (F) zu erkennen, das durch ein homogen eosinophiles, kollagenfaserreiches Bindegewebe gekennzeichnet ist. Das Tumorgewebe wächst expansiv. Die Haut mit Epidermis (Pfeil), Korium (K) und Haarfollikeln (H) ist unverändert. HE, 2,5x. Balkenlänge ≈ 620 μm. Zusammenfassung der wichtigsten Befunde Haut und Unterhaut (Epidermis, Korium mit Haarfollikeln, Fettgewebe) fokal noduläre, expansiv wachsende Umfangsvermehrung aus spindelförmigen Zellen mit hochgradigem Kollagenfasergehalt geringe Vaskularisierung Ÿ Ÿ Pathohistologische Diagnose Fibroma durum in der Unterhaut Ÿ 50 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Fibrom in der Haut eines Hundes Abb. 4.2 Das Fibrom (F) weist ein expansives, verdrängendes Wachstum auf. Eine Kapsel ist nicht nachweisbar. Das Tumorgewebe besteht aus kollagenfaserreichem, gefäßarmem Bindegewebe. Das benachbarte subkutane Fettgewebe (S) wirkt komprimiert. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.3 Das Fibrom besteht aus unterschiedlich breiten Bündeln von eosinophil gefärbten Kollagenfasern, die ineinander verwoben sind. Es sind längs- (1) und quer geschnittene (2) Faserverläufe zu erkennen. Vereinzelt sind Gefäße (G) nachweisbar. HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.4 Die Tumorzellen besitzen ein monomorphes, spindelförmiges Aussehen mit einem rundovalen bis länglichen Kern (1). Das eosinophile Zytoplasma der Tumorzellen geht kontinuierlich in die kollagenfaserreiche, extrazelluläre Matrix über. Mitosen sind nicht erkennbar. Das Tumorgewebe ist von einzelnen, kapillären Gefäßen (2) durchzogen. HE, 40x. Balkenlänge ≈ 40 μm. 51 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.5 Fokal ist regulär strukturiertes Uterusgewebe mit einem einreihigen Epithelbesatz des Endometriums (1), den Uterindrüsen (2), dem Myometrium (3) und der Serosa (4) erkennbar. Das Uteruslumen (L) ist eingeengt. Weiterhin ist ein Leiomyom (T) als eine noduläre Umfangsvermehrung mit unscharf begrenzten Randbereichen zu erkennen (Pfeilspitzen). Das angrenzende Endometrium zeigt eine ausgeprägte Druckatrophie mit weitgehendem Verlust der Uterindrüsen und einzelnen, hochgradig dilatierten Drüsenlumina (5). HE, 2,5x. Balkenlänge ≈ 620 μm. Zusammenfassung der wichtigsten Befunde Uterus (Endometrium, Uterindrüsen, Myometrium, Serosa) umschriebene, noduläre Proliferation monomorpher, glatter Muskelzellen längliche, zigarrenförmige Kerne teils eosinophiles, teils nahezu ungefärbtes Zytoplasma Ÿ Ÿ Ÿ Ÿ Pathohistologische Diagnose Leiomyom im Uterus 52 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Leiomyom im Uterus bei einem Hund Abb. 4.6 Das Leiomyom setzt sich aus Bündeln und Strängen monomorpher, glatter Muskelzellen zusammen. Partiell besitzen die Tumorzellen ein eosinophiles (1), partiell ein nahezu ungefärbtes Zytoplasma (2). HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.7 Die Tumorzellen sind in kurzen Strängen angeordnet, die ineinander verwoben sind. Je nach Anschnittsebene zeigen die Kerne eine runde (1) oder längliche Gestalt (2). Teilweise besitzen die Tumorzellen ein nahezu ungefärbtes Zytoplasma (Sterne). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.8 Die Morphologie der Tumorzellen ist durch einen länglichen, zigarrenförmigen Kern mit abgerundeten Kernpolen gekennzeichnet (1). Je nach Anschnittsebene können die Kerne auch rund oder rundoval erscheinen (2). Das Zytoplasma ist eosinophil und weist keine erkennbare Zellmembran auf. HE, 40x. Balkenlänge ≈ 40 μm. 53 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.9 In der Subkutis (S) ist ein zellreiches, eosinophiles, mäßig kollagenfaserreiches Segment eines Fibrosarkoms (F) zu erkennen. Das Tumorgewebe wächst expansiv und zeigt keine bindegewebige Demarkation. Peritumorös sind einzelne hochgradig hyperämische Gefäße (G) erkennbar. Die Haut mit Epidermis (1), Korium (K) und Haarfollikeln (2) ist unverändert. HE, 2,5x. Balkenlänge ≈ 620 μm. Zusammenfassung der wichtigsten Befunde Haut und Unterhaut (Epidermis, Korium mit Haarfollikeln, Fettgewebe) noduläre, überwiegend expansive, nicht demarkierte, zellreiche Umfangsvermehrung, bestehend aus spindelförmigen, mäßig pleomorphen Zellen mit mäßigem Kollagenfasergehalt und zahlreichen Mitosen und Apoptosen geringe Vaskularisierung fokale Nekrose Ÿ Ÿ Pathohistologische Diagnose dermales Fibrosarkom Ÿ Ÿ 54 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Fibrosarkom bei einer Katze Abb. 4.10 Das zellreiche Tumorgewebe besteht aus ineinander verwobenen Zellsträngen, die teils längs (1), teils quer (2) angeschnitten sind. Peritumorös lassen sich zahlreiche hyperämische Gefäße (G) sowie eine hochgradige Infiltration mit überwiegend lymphozytären Zellen (3) nachweisen. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.11 Das Fibrosarkom setzt sich aus ineinander verwobenen, zellreichen Gewebesträngen zusammen, die teils längs (1), teils quer (2) angeschnitten sind. Das Tumorgewebe ist gefäßarm und fokal ist ein Nekrosefeld (N) zu erkennen. HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.12 Die Tumorzellen zeigen einen rund- bis längsovalen, heterochromatinarmen Kern mit meist einem Nukleolus (1). Es besteht eine mäßige Anisokaryose. Das Zytoplasma ist eosinophil und die Zellen sind undeutlich begrenzt. Multifokal sind Mitosefiguren zu beobachten (2). Darüber hinaus lassen sich zahlreiche apoptotische Zellen erkennen (3). Die Zellen sind in eine fibrilläre, extrazelluläre Matrix eingebettet (4). HE, 40x. Balkenlänge ≈ 40 μm. 55 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.13 Fokal ist ein Segment eines überwiegend expansiv wachsenden Osteosarkoms (T) nachweisbar. Das peritumoröse Bindegewebe der Subkutis (S) ist stark kom- Zusammenfassung der wichtigsten Befunde Haut und Unterhaut (dilatierte Schweißdrüsen, Bindegewebe) noduläre, expansiv wachsende Umfangsvermehrung mit Osteoid und osteozyten-, osteoblasten- und fibroblastenähnlichen Tumorzellen sowie Osteoklasten zahlreiche Mitosen fokale Nekrose mit Einblutung Ÿ Ÿ primiert. Des Weiteren lassen sich zahlreiche, hochgradig dilatierte Schweißdrüsen (D) des Koriums erkennen. HE, 2,5x. Balkenlänge ≈ 620 μm. Pathohistologische Diagnose Osteosarkom Ÿ Ÿ 56 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Osteosarkom bei einem Hund Abb. 4.14 Das Tumorgewebe besteht aus irregulär angeordnetem Hart- und Weichgewebe. Das Hartgewebe besteht aus Osteoid (O), das sich in Form eosinophiler Felder, in denen einzelne Tumorzellen eingeschlossen sind, darstellt. Zwischen diesen ist ungeordnetes, teils in kurzen Strängen verlaufendes Tumorgewebe (1) nachweisbar. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.15 Im Osteosarkom finden sich in den Feldern aus osteoidem Material (O) eingeschlossene Tumorzellen, die den Osteozyten (1) ähnlich sind. Im Randbereich des Osteoids lassen sich großkernige Zellen finden (2), die morphologisch den Osteoblasten entsprechen. Des Weiteren finden sich mehrkernige Zellen (3), die als Osteoklasten anzusprechen sind. Zwischen den Osteoidinseln finden sich weiterhin fibroblastenähnliche Tumorzellen (4). Fokal ist ein Nekrosefeld (N) mit Einblutung zu beobachten. HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.16 Fokal ist eine homogen eosinophil erscheinende Insel aus Osteoid (O) mit einzelnen eingeschlossenen osteozytenähnlichen Tumorzellen (1) zu erkennen. Saumartig finden sich entlang des Osteoids großkernige Zellen mit der Morphologie von Osteoblasten (2). Des Weiteren lassen sich strangartig angeordnete, fibroblastenähnliche Tumorzellen (3) beobachten. Multifokal finden sich Mitosefiguren (4). HE, 40x. Balkenlänge ≈ 40 μm. 57 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.17 Im Korium (K) der Haut findet sich eine irreguläre, nicht demarkierte Infiltration stark basophiler Tumorzellen (T), bei denen es sich um Mastzellen handelt. Die Zellen liegen in teils miteinander kommunizierenden Nestern Zusammenfassung der wichtigsten Befunde Haut (Korium mit Kollagenfaserbündeln und Gefäßen) hochgradige Infiltration des Koriums mit ausgereiften Mastzellen mittelgradige Infiltration mit eosinophilen Granulozyten fokale Degeneration von kollagenen Fasern („Kollagenolyse“) Ÿ Ÿ Ÿ Ÿ oder Strängen. Vereinzelt sind kettenartig angeordnete Tumorzellen nachweisbar (1). Des Weiteren sind Gefäße (G) und kollagene Faserbündel (2) des Koriums zu erkennen. HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose Mastozytom Grad I 58 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Mastozytom bei einem Hund Abb. 4.18 Die in Nestern oder Ketten angeordneten, großen, basophilen Tumorzellen (1) liegen zwischen den Kollagenfaserbündeln des Koriums (3). Multifokal sind auch mittelgradig kleinere Zellen nachweisbar (2), die disseminiert zwischen den Tumorzellen eingestreut sind. Bei diesen Infiltraten handelt es sich um eosinophile Granulozyten. Multifokal sind dilatierte Gefäße (G) zu erkennen. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.19 Die Morphologie der Tumorzellen ist durch einen meist runden bis rundovalen, zentral oder leicht exzentrisch gelegenen, heterochromatinreichen Kern gekennzeichnet (1). Das Zytoplasma ist reichlich ausgebildet, enthält eine feine basophile Granulierung und die Zellgrenzen sind deutlich. Disseminiert sind eosinophile Granulozyten mit einem hypersegmentierten Kern und zytoplasmatischen, rötlichen Granula erkennbar (2). Des Weiteren sind Kollagenfaserbündel (3) und ein Gefäß (G) zu beobachten. HE, 40x. Balkenlänge ≈ 40 μm. Abb. 4.20 Hier findet sich fokal ein stark eosinophiler Bereich (1), bei dem es sich um eine Degeneration der kollagenen Fasern („Kollagenolyse“) handelt. Das betroffene Areal ist von zahlreichen Granulozyten umgeben (2). Weiter peripher lassen sich einige Mastzellen (3) und zahlreiche eosinophile Granulozyten (4) beobachten. HE, 40x. Balkenlänge ≈ 40 μm. 59 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.21 Die orale Mukosa ist an einem Plattenepithel (1), der Lamina propria (2) und der Submukosa erkennbar. In der Lamina propria ist eine solide, aus unterschiedlich großen Nestern zusammengesetzte, zellreiche Infiltration nachweisbar, bei der es sich um ein malignes Melanom handelt (Sterne). Disseminiert sind stark pigmenthaltige Zellen erkennbar (3), die Melanophagen darstellen. HE, 5x. Balkenlänge ≈ 310 μm. Zusammenfassung der wichtigsten Befunde Mundhöhle (kutane Schleimhaut mit Plattenepithel und Lamina propria) hochgradige Infiltration der Lamina propria mit monomorphen, teils pigmenthaltigen Tumorzellen mit Mitosefiguren Nachweis zahlreicher Melanophagen Ÿ Ÿ Pathohistologische Diagnose malignes Melanom der Mundhöhle Ÿ 60 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Malignes Melanom in der Mundhöhle bei einem Hund Abb. 4.22 Das Plattenepithel weist eine fokale Hyperplasie (1) auf. In der Lamina propria (2) finden sich infiltrativ wachsende Nester von monomorphen, pigmentarmen Zellen eines malignen Melanoms (Sterne). Die meisten der stark pigmentierten Zellen stellen Melanophagen dar (3), die Pigmentgranula phagozytiert haben, die aus Tumorzellen freigesetzt wurden. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.23 Die Morphologie der Tumorzellen (1) ist durch einen meist rundovalen Kern mit grobgranulärem Heterochromatin und einem solitären Nukleolus gekennzeichnet. Das Zytoplasma einzelner Tumorzellen enthält feingranuläres, braunes Melaninpigment (2). Mehrere Mitosefiguren (3) sind zu erkennen. Des Weiteren finden sich zahlreiche, große, stark pigmenthaltige Zellen, bei denen es sich um Melanophagen (4) handelt. HE, 40x. Balkenlänge ≈ 40 μm. Die Tumorzellen Abb. 4.24 weisen meist rundovale Kerne mit einem solitären Nukleolus auf (1). Darüber hinaus sind auch Tumorzellkerne mit mehreren, oftmals kleinen Kernkörperchen zu erkennen (2). Im unscharf begrenzten Zytoplasma ist ein geringer Gehalt an feingranulärem, braunem Pigment nachweisbar (3). Des Weiteren sind einzelne Mitosefiguren (4) zu beobachten. Die hochgradig mit Pigment beladenen Zellen stellen Melanophagen (5) dar. HE, 63x. Balkenlänge ≈ 25 μm. 61 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.25 In der Subkutis (S) ist fokal eine expansiv wachsende, tumoröse Umfangsvermehrung (T) nachweisbar, in deren Nachbarschaft einzelne, regulär strukturierte Milchdrüsenläppchen (1) zu erkennen sind. Die angrenzende Haut mit Epidermis (2), Korium (K) und Haarfollikeln (3) erscheint fokal etwas komprimiert (Pfeilspitzen). HE, 2,5x. Balkenlänge ≈ 620 μm. Zusammenfassung der wichtigsten Befunde Haut, Subkutis und Mamma (Epidermis, Korium, Haarfollikel, Drüsenläppchen) expansiv wachsende, bindegewebig demarkierte, tubuläre Proliferation von alveolären Epithelzellen spärliches, fibrovaskuläres Stroma geringgradige Kompression des angrenzenden Unterhautgewebes Ÿ Ÿ Pathohistologische Diagnose einfaches Adenom der Mamma Ÿ Ÿ 62 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Einfaches Adenom der Mamma bei einem Hund Abb. 4.26 Das expansiv wachsende Tumorgewebe besteht aus epithelialen Zellen, die ein tubuläres Wachstum (1) zeigen. Die Neoplasie ist von einer bindegewebigen Kapsel umgeben (2). Fokal sind ein Gefäß (G) und ein regulär strukturiertes Milchdrüsenläppchen zu beobachten (3). HE, 5x. Balkenlänge ≈ 310 μm. Abb. 4.27 Das Tumorgewebe wird durch eine kollagenfaserreiche Bindegewebskapsel demarkiert (1). Die Tumorzellen weisen ein- oder mehrreihige, adenoide bis tubuläre Wachstumsformen auf (2), die von einem schmalen, fibrovaskulären Stroma (3) begleitet werden. HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.28 Die Tumorzellen zeichnen sich durch einen längsovalen Kern und ein mäßig ausgebildetes, eosinophiles Zytoplasma aus (1). Die Zellgrenzen zwischen den Tumorzellen sind undeutlich. Sie sitzen einer Basalmembran auf (2), die eine Grenze zum Tumorstroma bildet. Fokal sind kleine Blutgefäße zu erkennen (3). Im Randbereich befindet sich die bindegewebige Tumorkapsel (4). HE, 40x. Balkenlänge ≈ 40 μm. 63 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.29 Die Haut mit Epidermis (1) weist im tieferen Korium (K) eine nicht demarkierte, infiltrativ wachsende, epitheliale Tumorzellpopulation auf (2). Die Tumorzellen bilden tubuläre Strukturen, die durch kollagenfaserreiches Zusammenfassung der wichtigsten Befunde Haut (Epidermis, Korium) hochgradige Infiltration solider oder tubulär proliferierender, pleomorpher, epithelialer Tumorzellen mit Mitosen Nachweis von Tumorzellemboli in Lymphgefäßen (Lymphangiosis carcinomatosa) flächenhafte Nekrose kollagenfaserreiches Stroma mit lymphozytärer Infiltration Ÿ Ÿ Bindegewebe (3) voneinander getrennt sind. Herdförmig ist im Tumorgewebe eine umschrieben Nekrose (N) nachweisbar. HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose einfaches Adenokarzinom der Mamma mit Lymphangiosis carcinomatosa Ÿ Ÿ Ÿ 64 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Einfaches Adenokarzinom der Mamma bei einem Hund Abb. 4.30 Die Invasionsfront des einfachen Adenokarzinoms ist durch schmale Stränge epithelialer Tumorzellen gekennzeichnet, die teilweise noch kein zentrales Lumen aufweisen (1). Herdförmig sind auch kleine, solide Tumorzellnester zu beobachten (2). Weiter zentral im Tumor ist ein Nekrosefeld (N) zu erkennen. HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.31 Die Tumorzellen bilden Stränge (1) oder tubuläre Strukturen (2). Es besteht eine deutliche Zell- und Kernpleomorphie. Die meisten Kerne sind heterochromatinarm, rundoval und besitzen einen solitären Nukleolus (3). Multifokal sind Mitosefiguren (4) und Einzelzellnekrosen (5) zu erkennen. Zwischen den Tumorzellen findet sich ein kollagenfaserreiches Bindegewebsstroma (6). Im Randbereich ist ein Nekrosefeld (N) vorhanden. HE, 40x. Balkenlänge ≈ 40 μm. Abb. 4.32 In einer Lymphkapillare (L) ist ein Tumorzellembolus nachweisbar (Lymphangiosis carcinomatosa; 1). Fokal sind einzelne solide (2) und tubulär (3) proliferierende Tumorzellen zu erkennen. Des Weiteren ist ein kollagenfaserreiches Bindegewebsstroma (4) mit kleineren Blutgefäßen (G) und einer fokal mittelgradigen Infiltration von Lymphozyten (5) zu beobachten. HE, 40x. Balkenlänge ≈ 40 μm. 65 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.33 Der benigne Mammamischtumor setzt sich aus epithelialen, myoepithelialen und mesenchymalen Anteilen zusammen. Die epithelialen Tumorzellen bilden tubuloalveoläre Strukturen (1). Das proliferierte Myoepithel stellt sich als nesterartige Ansammlung spindeliger bis sternförmiger Zusammenfassung der wichtigsten Befunde Mamma (tumorös veränderte alveoläre und myoepitheliale Milchdrüsenanteile) tubuloalveoläre Proliferation von Epithelzellen Proliferation sternförmiger Myoepithelzellen fokal Proliferation von Knorpelgewebe fokal geringgradige, überwiegend lymphozytäre Infiltration Ÿ Ÿ Ÿ Ÿ Ÿ Zellen dar (2), die in einer faserarmen, extrazellulären Matrix eingebettet sind. Der mesenchymale Tumoranteil besteht aus Knorpelgewebe (3). Das Tumorgewebe ist von einem kollagenfaserreichen Bindegewebsstroma durchzogen (4). HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose benigner Mammamischtumor 66 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Benigner Mammamischtumor bei einem Hund Abb. 4.34 Die epithelialen Anteile des benignen Mammamischtumors bilden tubuloalveoläre Strukturen (1). Angrenzend lassen sich flächenhafte Proliferationen von Myoepithelien nachweisen, die teils ein nodulär expansives (2), teils ein ungeordnetes Wachstum (3) zeigen. Herdförmig ist im Stroma eine geringgradige Infiltration mit Lymphozyten und einzelnen Makrophagen (4) zu erkennen. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.35 Die tubuloalveolär proliferierenden, epithelialen Zellen (1) des benignen Mammamischtumors zeigen eine monomorphe Gestalt. Sie sind von zahlreichen, über ZytoplasmaAusläufer miteinander in Kontakt stehenden Myoepithelien (2) umgeben. Fokal ist Knorpelgewebe mit einzelnen Chondrozyten (3) als mesenchymaler Tumoranteil erkennbar. Im Stroma sind einzelne, überwiegend lymphozytäre Infiltrate zu beobachten (4). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.36 Die tubuloalveolär angeordneten, epithelialen Zellen des benignen Mammamischtumors besitzen rundovale, monomorphe Kerne, in denen meist ein oder zwei kleine Nukleoli vorhanden sind (1). Benachbart finden sich myoepitheliale Zellen (2), die einen rundovalen, heterochromatinarmen Kern und ein sternförmiges, eosinophiles Zytoplasma besitzen. Die Zellen stehen über ihre Zytoplasma-Ausläufer miteinander in Kontakt. Darüber hinaus ist Knorpelgewebe mit Chondrozyten (3), die in einer chondroiden Matrix eingebettet sind, erkennbar. HE, 40x. Balkenlänge ≈ 40 μm. 67 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.37 Die Ohrmuschel zeigt auf der einen Seite des Ohrknorpels (K) regulär strukturierte Haut mit Epidermis (1) und Adnexe (2). Auf der anderen Seite des Ohrknorpels besteht ein invasiv wachsendes Plattenepithelkarzinom mit zahlreichen Epithelzellsträngen (3) und Ulzeration (4). HE, 2,5x. Balkenlänge ≈ 620 μm. Zusammenfassung der wichtigsten Befunde Haut (Epidermis, Korium Adnexe) strang- oder nesterartige Proliferation epithelialer Tumorzellen mit squamöser Differenzierung vereinzelt Mitosefiguren Ödematisierung und geringgradige Infiltration mit neutrophilen Granulozyten, Lymphozyten und Makrophagen im angrenzenden Bindegewebe fokale Ulzeration Ÿ Ÿ Pathohistologische Diagnose Plattenepithelkarzinom der Haut Ÿ Ÿ Ÿ 68 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Plattenepithelkarzinom der Haut bei einer Katze Tumorarten 4 Abb. 4.39 Die invasiv wachsenden Tumorzellinseln zeigen eine irreguläre Gestalt. Die peripher lokalisierten, geringgradig pleomorphen, basaloiden Zellen besitzen einen großen Kern mit einem prominenten Nukleolus (1). Zentral weisen die Zellen eine plattenepithelzellähnliche Differenzierung auf, die vor allem durch ein prominentes, eosinophiles Zytoplasma (2) gekennzeichnet ist. Vereinzelt ist eine zentrale Degeneration der Zellen mit Kavernenbildung nachweisbar (3). Multifokal sind Mitosefiguren zu erkennen (4). Das gefäßreiche Korium (K) ist geringgradig mit neutrophilen Granulozyten, Lymphozyten und Makrophagen infiltriert (5). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.40 Die nesterartig angeordneten, epithelialen Tumorzellen besitzen sowohl peripher als auch zentral große Kerne mit einem prominenten Nukleolus (1). Die zentralen, squamös differenzierten Zellen weisen darüber hinaus ein prominentes, eosinophiles Zytoplasma auf. Vereinzelt sind Mitosefiguren vorhanden (2). Zwischen den Tumorzellverbänden ist ein ödematisiertes Bindegewebe (3) mit geringgradiger Infiltration von neutrophilen Granulozyten (4) und hyperämischen Gefäßen (G) nachweisbar. HE, 40x. Balkenlänge ≈ 40 μm. 69 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 4.38 Das Plattenepithelkarzinom ist durch invasiv wachsende Epithelzapfen oder -inseln (1), die in einem mäßig ödematisierten Korium (K) lokalisiert sind, gekennzeichnet. Die Tumorareale zeigen eine squamöse Differenzierung mit peripher lokalisierten, basophilen, basaloiden Zellen (2) und zentral gelegenen, zytoplasmareichen, eosinophilen Zellen (3). Das Korium weist eine geringgradige Infiltration mit Entzündungszellen auf (4). HE, 10x. Balkenlänge ≈ 155 μm. 4 Tumoren Abb. 4.41 Die Haut weist im Korium eine diffuse, mäßig zellreiche Infiltration mit mesenchymalen Tumorzellen (T) auf, die bis an die Epidermis heranreicht. Die Epidermis zeigt eine irreguläre, epidermale Hyperplasie mit Ausbildung unterschiedlich langer, teils anastomosierender Zusammenfassung der wichtigsten Befunde Haut (Epidermis, Korium) diffuse Infiltration des Koriums mit bis an die Epidermis heranreichenden Tumorzellen deutliche Pleomorphie der Tumorzellen einzelne Mitosefiguren irreguläre, epidermale Hyperplasie mit Ausbildung von Reteleisten Ÿ Ÿ Ÿ Ÿ Ÿ Reteleisten (1). Herdförmig ist eine mittelgradige Hyperkeratose sichtbar (2). Adnexale Strukturen sind durch das Tumorwachstum vollständig verschwunden. HE, 2,5x. Balkenlänge ≈ 620 μm. Pathohistologische Diagnose spindelzelliges Sarkom (Equines Sarkoid) 70 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Equines Sarkoid bei einem Pferd Abb. 4.42 Das Tumorgewebe ist mäßig zellreich und besitzt vor allem in tieferen Anteilen des Koriums einen hohen Gehalt an faserreicher, extrazellulärer Matrix (1). Die Tumorzellen reichen bis an die Epidermis heran. Lange, miteinander anastomosierende Reteleisten ziehen bis tief in das Korium (2). Fokal besteht eine mittelgradige Hyperkeratose der Epidermis (3). HE, 5x. Balkenlänge ≈ 310 μm. Abb. 4.43 Das mäßig zellreiche Tumorgewebe weist im oberen Teil des Koriums einen geringen (1), im tieferen einen hohen Gehalt an faserreicher, extrazellulärer Matrix auf (2). Die Epidermis ist hyperplastisch und hat lange Reteleisten ausgebildet (3). Darüber hinaus ist eine mittelgradige Hyperkeratose erkennbar (4). HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.44 Die Tumorzellen weisen eine deutliche Pleomorphie mit Anisozytose, Anisokaryose und Anisonukleolose auf. Meist besitzen sie einen runden bis längsovalen, mäßig heterochromatinreichen Kern mit einem meist kleinen Nukleolus (1). Fokal ist eine Karyomegalie mit einem prominenten Nukleolus nachweisbar (2). Das unterschiedlich stark ausgebildete Zytoplasma ist eosinophil und die Zellgrenzen sind undeutlich. Extrazellulär ist ein geringer bis mäßiger Kollagenfasergehalt erkennbar (3). Fokal ist eine Mitosefigur zu erkennen (4). HE, 40x. Balkenlänge ≈ 40 μm. 71 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.45 In mehreren Lokalisationen findet sich Tumorgewebe (T) eines Hämangiosarkoms und Anteile von unverändertem Milzgewebe mit einem Follikel (F). Die Abgrenzung zum Milzgewebe ist unscharf. Der Tumor zeigt Zusammenfassung der wichtigsten Befunde Milz (Trabekel, Follikel) hochgradige Infiltration von Zellen mit endothelzellähnlicher Morphologie Ausbildung von kavernösen und kapillären, mit Erythrozyten gefüllten Hohlräumen zahlreiche Mitosefiguren Ÿ Ÿ Ÿ Ÿ einerseits kavernöse Hohlräume (K), andererseits ein feinmaschiges Netzwerk aus kapillären Spalträumen (1). HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose Hämangiosarkom der Milz 72 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Hämangiosarkom in der Milz bei einem Hund Abb. 4.46 Das Hämangiosarkom zeichnet sich durch zahlreiche, unterschiedlich große, kapilläre Spalträume aus (1), in denen sich vorwiegend Erythrozyten befinden. Fokal ist auch ein mehr solide wirkender Bereich vorhanden (2). HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.47 Die Morphologie der Tumorzellen ist durch einen meist rundovalen Kern gekennzeichnet (1). Die Tumorzellen kleiden zahlreiche, spaltartige Hohlräume aus (2). Ein kollagenes Stroma ist nur spärlich ausgebildet (3). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.48 Die Tumorzellen weisen eine deutliche Pleomorphie mit Anisozytose und Anisonukleose auf. Die Tumorzellen zeigen eine endothelzellähnliche Morphologie. Die Kerne zeichnen sich durch eine rundovale bis längliche Gestalt mit grobscholliger Heterochromatinstruktur aus (1). Gelegentlich sind ein bis zwei Kernkörperchen zu erkennen (2). Das eosinophile Zytoplasma ist spärlich ausgebildet und die Zellgrenzen sind unscharf. Multifokal sind Mitosefiguren zu beobachten (3). HE, 40x. Balkenlänge ≈ 40 μm. 73 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.49 Die Haut mit Epidermis (1), Haarfollikeln (2) und einigen Schweißdrüsen (3) weist fokal eine flächenhafte, zellreiche Infiltration mit Tumorzellen (T) eines kutanen Histiozytoms auf. Die Tumorzellen sind gegenüber Zusammenfassung der wichtigsten Befunde Haut (Epidermis, Korium, Adnexe) diffuse Infiltration des Koriums mit histiozytären Tumorzellen, die bis an die Epidermis heranreichen keine Demarkation zum Nachbargewebe multifokale lymphozytäre Infiltration Ÿ Ÿ dem Nachbargewebe deutlich demarkiert. In basalen Anteilen des Tumors sind nesterartig (follikulär) stark basophile, lymphozytäre Zellinfiltrate (L) nachweisbar. HE, 1,25x. Balkenlänge ≈ 1240 μm. Pathohistologische Diagnose kanines, kutanes Histiozytom Ÿ Ÿ 74 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Kutanes Histiozytom bei einem Hund Abb. 4.50 Die Epidermis (E) der Haut zeigt eine deutliche, irreguläre Hyperplasie mit Ausbildung von Reteleisten (1). Die Tumorzellen (T) des kutanen Histiozytoms haben das Korium flächenhaft infiltriert und reichen bis an die Epidermis heran. Vor allem in den oberflächlichen Tumoranteilen ist vereinzelt eine kettenartige Anordnung der Tumorzellen zu finden (2). HE, 5x. Balkenlänge ≈ 310 μm. Abb. 4.51 Die Morphologie der Tumorzellen ist weitgehend monomorph. Sie besitzen eine histiozytäre Gestalt mit einem exzentrisch gelegenen, bohnenförmig gekerbten Kern und ein mäßig ausgebildetes, eosinophiles Zytoplasma (1). Des Weiteren finden sich auch in unterschiedlicher Anzahl rundkernige Tumorzellen (2). Multifokal sind Mitosefiguren unterschiedlicher Stadien zu beobachten (3). HE, 40x. Balkenlänge ≈ 40 μm. Abb. 4.52 In den basalen Anteilen des Tumorgewebes (T) zeigen die Tumorzellen überwiegend einen runden bis rundovalen Kern (1). Des Weiteren sind follikuläre Infiltrationen von Lymphozyten (L) zu erkennen, die durch einen kleinen, basophilen, heterochromatinreichen Kern und einen schmalen Zytoplasmasaum gekennzeichnet sind. Fokal ist ein Gefäßanschnitt zu beobachten (2). HE, 20x. Balkenlänge ≈ 80 μm. 75 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.53 Unverändertes Lungengewebe ist an einigen regulär strukturierten Alveolen (A) zu erkennen. Multifokal sind nesterartige, alveoläre, epitheliale Zellproliferationen vorhanden (1), die ineinander konfluieren. Fokal ist ein Bronchiolus mit papilliformer Zellproliferation nachweisbar Zusammenfassung der wichtigsten Befunde Lunge (Bronchiolus, Alveolen, Interstitium) multifokal adenoide Proliferation iso- bis hochprismatischer Zellen mit papilliformen Projektionen gering- bis mittelgradige Infiltration im Interstitium mit Makrophagen und neutrophilen Granulozyten Ÿ Ÿ (2). Peribronchiolär besteht eine mittelgradige Infiltration mit Entzündungszellen, bei denen es sich überwiegend um Lymphozyten (L) handelt. Des Weiteren sind in zahlreichen Alveolen histiozytäre Zellinfiltrate zu beobachten (3). HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose bronchiolo-alveoläres Karzinom mit Infiltration von Makrophagen und neutrophilen Granulozyten Ÿ 76 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Lungenadenomatose bei einem Schaf Abb. 4.54 Die nesterartig angeordneten Tumorzellen zeigen alveoläre Wachstumsformen. Multifokal sind auch papilliforme (1) Proliferationen erkennbar. Die Tumorzellen sitzen auf einem fibrovaskulären Stroma (2). Die benachbarten Alveolen sind überwiegend von Makrophagen (Alveolarhistiozytose) infiltriert (3). HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.55 Die alveolären Strukturen werden von einem ein- bis mehrreihigen Besatz aus epithelialen Tumorzellen ausgekleidet (1). Multifokal sind papilliforme (2) Proliferationen erkennbar. Die Tumorzellen sitzen auf einem fibrovaskulären Stroma (3). In angrenzenden Alveolen sind zahlreiche Makrophagen (Alveolarhistiozytose) erkennbar (4). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.56 Die Tumorzellen besitzen eine weitgehend monomorphe Gestalt. Es handelt sich um iso- bis hochprismatische Zellen (1), die ein- oder mehrreihig auf einem fibrovaskulären Stroma (2) sitzen. In der Nachbarschaft sind geringgradig Makrophagen (3) und neutrophile Granulozyten (4) zu erkennen. HE, 40x. Balkenlänge ≈ 40 μm. 77 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.57 Fokal ist im Hodengewebe, das an einigen Hodenkanälchen (1) mit umgebendem Interstitium (2) zu erkennen ist, eine diffuse, flächenhafte, zellreiche Proliferation germinativer Zellen (T) zu beobachten, die zu einer Kompression des Nachbargewebes geführt hat. Zusammenfassung der wichtigsten Befunde Hoden (Hodenkanälchen, Interstitium) hochgradige, diffuse Infiltration von monomorphen, großkernigen Zellen mit zahlreichen Mitosefiguren weitgehender Verlust organspezifischen Gewebes geringgradige Infiltration von Lymphozyten und Makrophagen Ÿ Ÿ Der Tumor hat das Hodengewebe weitgehend zerstört. Vereinzelt sind aber noch Kanälchenstrukturen vorhanden, in denen sich auch Tumorzellen befinden (3). HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose diffus wachsendes Seminom Ÿ Ÿ 78 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Seminom bei einem Hund Abb. 4.58 Das Tumorgewebe (T) zeichnet sich durch eine diffuse, flächenhafte und sehr zellreiche Proliferation von großkernigen, germinativen Zellen aus. Das Hodengewebe ist weitgehend zerstört. Fokal sind einzelne Tubulusstrukturen mit Tumorzellen zu erkennen (1). Des Weiteren lassen sich lymphozytäre Infiltrate (2) nachweisen. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.59 Das zellreiche Tumorgewebe setzt sich aus mäßig pleomorphen Tumorzellen (T) zusammen. Überwiegend besteht ein diffuses Tumorwachstum. Zwischen den Tumorzellen lassen sich disseminiert lymphozytäre Zellen (1) und einige Makrophagen mit wenig gefärbtem vakuolären Zytoplasma (Sternhimmelzellen; 2) erkennen. In zwei Lokalisationen sind Anschnitte von erhaltenen Samenkanälchen vorhanden, in denen nur wenige Tumorzellen lokalisiert sind (3). HE, 20x. Balkenlänge ≈ 80 μm. Abb. 4.60 Die Tumorzellen zeigen eine mäßige Anisozytose, Anisokaryose und Anisonukleolose. Sie besitzen einen meist runden, zentral lokalisierten, großen Kern mit geringem Heterochromatingehalt (1). Meist ist ein großer Nukleolus mit geringer Variation der Größe vorhanden, selten finden sich auch zwei oder drei kleinere Kernkörperchen (2). Das Zytoplasma ist schwach basophil bis amphophil und die Zellgrenzen sind undeutlich. Multifokal sind Mitosefiguren in unterschiedlichen Stadien vorhanden (3). Des Weiteren lassen sich disseminiert Lymphozyten (4) beobachten. HE, 40x. Balkenlänge ≈ 40 μm. 79 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.61 In der weißen Substanz des Hirngewebes (H) ist eine unscharf demarkierte, lokal invasiv wachsende Infiltration einer zellreichen, monomorphen Tumorzellpopulation (T) zu beobachten. Fokal ist eine bandartige Prolifera- Zusammenfassung der wichtigsten Befunde Gehirn (weiße Substanz) fokal hochgradige Infiltration mit einer monomorphen Tumorzellpopulation rundkernige Tumorzellen mit honigwabenartiger Textur, schwach eosinophilem Zytoplasma und deutlichen Zellgrenzen multiple Einzelzellnekrosen fokal bandartige Proliferation von kapillaren Gefäßen Ÿ Ÿ Ÿ tion von kapillären Gefäßen erkennbar (G), die in das Tumorgewebe hineinreicht. Das peritumoröse Neuroparenchym weist einzelne Vakuolen auf (1). HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose Oligodendrogliom Ÿ Ÿ 80 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Oligodendrogliom bei einem Hund Abb. 4.62 Das zellreiche Tumorgewebe (T) besteht aus monomorphen, kleinkernigen Zellen, die eine flächenhafte, solide Proliferation aufweisen. Das Tumorgewebe ist im Randbereich nicht demarkiert, und es besteht eine Infiltration in das benachbarte Hirngewebe (H; 1). Fokal ist eine bandartige Proliferation von kapillären Gefäßen erkennbar (G). Innerhalb des Tumors finden sich vereinzelt kapilläre Gefäße (2). HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.63 Die Tumorzellen besitzen eine monomorphe Gestalt, die Oligodendrozyten ähnlich ist. Der Zellverband zeigt eine honigwabenähnliche Morphologie. Die Zellen besitzen einen kleinen, runden bis rundovalen, zentral lokalisierten Kern mit einem geringen Heterochromatingehalt (1). Gelegentlich sind einzelne Kernkörperchen nachweisbar. Das Zytoplasma ist schwach eosinophil und perinukleär findet sich ein ungefärbter Hof. Die Zellgrenzen sind deutlich sichtbar. Vereinzelt sind kapilläre Gefäße zu erkennen (2). Darüber hinaus finden sich zahlreiche Einzelzellnekrosen mit einem pyknotischen Kern (3). HE, 20x. Balkenlänge ≈ 80 μm. 81 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten 4 Tumoren Abb. 4.64 Die Läppchenarchitektur der Leber (L) ist durch die Tumorzellinfiltrate teilweise überdeckt. Es sind unterschiedlich große, nesterartige, durch die Kerndichte basophile Tumorzellfelder (1) nachweisbar. Sie liegen in den Portalfeldern (P) und in der angrenzenden Läppchenperipherie, Zusammenfassung der wichtigsten Befunde Leber (Portalfeld, Hepatozyten) hochgradige Infiltration der Portalfelder und der Läppchenperipherie mit monomorphen, lymphoblastoiden Zellen mit zahlreichen Mitosefiguren Verlust peripherer Hepatozyten immunhistologischer Nachweis des CD3-Moleküls Ÿ Ÿ in der die Hepatozyten verschwunden sind. Die angrenzenden Hepatozyten zeichnen sich durch ein kaum gefärbtes Zytoplasma und prominente Zellmembranen aus. HE, 5x. Balkenlänge ≈ 310 μm. Pathohistologische Diagnose malignes T-Zell-Lymphom in der Leber (nach immunhistologischer Phänotypisierung) Ÿ Ÿ 82 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel: Malignes Lymphom in der Leber bei einem Hund Abb. 4.65 Die Portalfelder (P) sind von einer relativ monomorphen Zellpopulation infiltriert. Die Trias von Arterie, Vene und Gallengang ist infolge der Tumorzellinfiltration kaum zu identifizieren. Die ursprünglich peripher liegenden Hepatozyten der betroffenen Läppchen sind verschwunden. Die angrenzenden Hepatozyten mit zentral gelegenem Kern zeigen ein kaum gefärbtes Zytoplasma und deutliche Zellgrenzen (1), durch die sie eine wabenartige Struktur mit einem milchglasähnlichen Aussehen erhalten. HE, 10x. Balkenlänge ≈ 155 μm. Abb. 4.66 Die Morphologie der Tumorzellen ist durch einen meist runden Kern mit scholligem Heterochromatin und vereinzelt durch einen solitären Nukleolus gekennzeichnet (1). Ein schmaler Zytoplasmasaum ist nur bei einzelnen Zellen erkennbar. Multifokal sind Mitosefiguren unterschiedlicher Stadien zu beobachten (2). HE, 63x. Balkenlänge ≈ 25 μm. Abb. 4.67 Der immunhistologische Nachweis von CD3, einem Komplex von Proteinen des T-ZellRezeptors, der auf allen T-Lymphozyten nachweisbar ist, zeichnet diesen Tumor als malignes T-ZellLymphom aus. Das braune Reaktionsprodukt der immunhistologischen Markierung findet sich insbesondere entlang der Zellmembran nahezu aller Tumorzellen (1). Im Zentrum des Bildes liegt die Arterie eines Portalfeldes (2). Avidin-Biotin-Peroxidase-Komplex-Immunhistologie, NomarskiDifferenzial-InterferenzkontrastFilter, Hämatoxylin-Gegenfärbung, 40x. Balkenlänge ≈ 40 μm. 83 Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tumorarten Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Aus Baumgärtner, W.: Pathohistologie für die Tiermedizin (ISBN 978-3-8304-1054-6) © Enke Verlag 2007 Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden!