4.2 Virale Genomtypen und Virusgruppen
Werbung

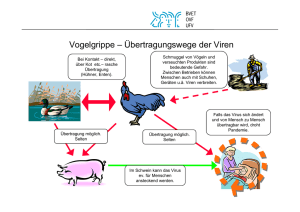
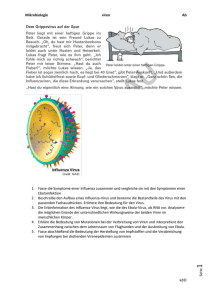
4 Viren 4.2 Virale Genomtypen und Virusgruppen Das virale Genom besteht entweder aus RNA oder DNA. Aufgrund ihres Genoms werden vier Virusgruppen unterschieden: Einzelsträngige DNAViren, doppelsträngige DNA-Viren, einzelsträngige RNA-Viren und doppelsträngige RNA-Viren. Viren mit einzelsträngiger RNA können in Plusstrangund Minusstrang-Viren unterteilt werden. Das Genom einiger RNA-Viren ist segmentiert. Die einzelnen Virustypen besitzen unterschiedliche Mechanismen zur Replikation der viralen Nucleinsäuren in den Wirtszellen. Bei den Retroviren verläuft die Replikation über eine DNA-Zwischenstufe. Dazu benötigt das Virus die Reverse Transkriptase. Zu den virusähnlichen infektiösen Agentien gehören Viroide, Satellitenviren, und Defective-Interfering-Particles. Prionen sind infektiöse Proteine, bei denen keine Nucleinsäure nachgewiesen werden konnte. Die Größe viraler Genome variiert zwischen 3,5 und 250 Kilobasen. E. coli infizierende RNA-Phagen (MS2, Qß) gehören zu den Viren mit dem kleinsten kompletten Genom, dessen Gene für nur vier Virus-spezifische Proteine codieren. Im Gegensatz dazu besitzen Viren mit großem Genom, z. B. das Pockenvirus, genetische Informationen für 200–300 Proteine. Viren enthalten jeweils nur eine Kopie des viralen Genoms, sie sind haploid. Eine Ausnahme bildet eine Gruppe der Retroviren, sie sind mit zwei fast identischen Kopien diploid. Viren haben eine Reihe unterschiedlicher Strategien entwickelt, um den Informationsgehalt der wenigen vorhandenen Nucleinsäure zu erhöhen: Transkription beider Stränge eines doppelsträngigen Genoms, Verwendung mehrerer Initiations-, Start- und Stoppcodons pro Leserahmen, ribosomale Frameshift, überlappende Leseraster, Splicing von mRNA, Transaktivierung von Genen der Wirtszelle und deren Nutzung für die virale Replikation. Auf der anderen Seite der Größenskala ist das Mimivirus mit 400 nm das größte bisher entdeckte Virus. Es vermehrt sich in der Amöbe Acanthamoeba polyphaga und wurde zuerst irrtümlich aufgrund seiner Größe und seines Aussehen als kleines kokkenförmiges Bakterium angesehen – aus dem täuschenden (mimicking) Virus wurde dann kurz Mimivirus. 2004 wurde die Struktur seines Erbguts veröffentlicht: Die Mimivirus-DNA ist über 1,2 Millionen Basenpaare groß und enthält 1260 Gene, darunter solche, die bisher nur von zellulären Organismen bekannt waren. Das genomische Material liegt bei Viren in Form von DNA oder RNA vor. Entsprechend lassen sich zwei Gruppen unterscheiden: DNA-Viren und RNA-Viren. Das virale Genom liegt entweder als einzelsträngiges oder als doppelsträngiges Molekül vor. So lassen sich die beiden Gruppen anhand der Genomstruktur weiter differenzieren in Einzelstrang (ss, single stranded)- oder Doppelstrang (ds, double stranded)-DNA-Viren, bzw. Einzelstrang (ss)- oder Doppelstrang (ds)-RNA-Viren. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 112 4.2 Virale Genomtypen und Virusgruppen 113 Einzelsträngige DNA- oder RNA-Moleküle bestehen aus einem Polynucleotidstrang. Treten komplementäre Sequenzfolgen auf, so kommt es in diesen Bereichen zu Basenpaarungen. Ein solches Genom wird trotz doppelsträngiger Bereiche als einzelsträngig bezeichnet. Die sekundäre Struktur des Polynucleotidstranges besitzt häufig eine funktionelle Bedeutung und kann in die Regulation der Expression viraler Gene involviert sein. 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Die Polarität der mRNA eines Organismus ist mit plus festgelegt. Somit ist in einer Doppelstrang-DNA sowohl ein Strang mit Pluspolarität als auch einer Abb. 4.6 Virale Genomstrukturen. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 4 Viren mit Minuspolarität vorhanden, während in einer Einzelstrang-DNA oder -RNA nur jeweils eine Form vorhanden ist. Picornaviren besitzen beispielsweise eine Plusstrang-ssRNA, während die Paramyxoviren eine Minusstrang-ssRNA als Genom aufweisen. Einen weiteren Nucleinsäuretyp findet man bei den Arenaviren: ambisenseRNA. Die einzelsträngige RNA besitzt gemischte Polarität: in einigen Abschnitten Pluspolarität in anderen Minuspolarität. Bei diesen Viren findet bereits auf der Ebene der Transkription eine Kontrolle über die Proteinexpression statt. Die Nucleinsäure der meisten DNA-Viren ist an sich infektiös, d. h. die Transfektion nackter Virus-DNA führt zur Virusvermehrung, da die virale DNA von der wirtseigenen zellulären DNA-abhängigen Polymerase abgelesen wird. Auch die RNA von Plusstrang-RNA-Viren ist infektiös, da sie in der Zelle als mRNA fungiert. Am 5l Ende der RNA finden sich Strukturen, die Bindung zu Ribosomen eingehen und das 3l-Ende besitzt oft eine Poly-A-Sequenz. Die RNA der Retroviren bildet hier eine Ausnahme. Sie ist zwar plussträngig, doch für die Replikation benötigt sie die Reverse Transkriptase. Bei den Minusstrang-Viren kann die RNA allein jedoch nicht zur Virusvermehrung führen, da die Zelle keine RNA-abhängige RNA-Polymerase besitzt. Daher bringen diese Viren ihre eigene Polymerase als Bestandteil des Nucleocapsids mit in die Zelle. 4.2.1 DNA-Viren Forschungen über die Evolution und den Ursprung von Viren machen deutlich, dass es bei DNA-Viren zu einem häufigen Genaustausch zwischen dem viralen Genom und dem der Wirtszellen gekommen ist. DNA-Viren nehmen einerseits über Rekombination zelluläre Gene in ihr Genom auf und geben sie auf diese Weise auch an andere Genome weiter, ein Beispiel sind die Thymidinkinasegene bei Herpesviren. Andererseits werden virale Gene in das Genom der Zelle integriert. Vermutlich sind kleinere DNA-Viren durch Kombination zellulärer Gene mit genetischen Elementen wie Plasmiden oder Transposons entstanden. Zur Gruppe der ssDNA-Viren (ssDNA) gehört die Familie der Parvoviridae. Die Einzelstrang-DNA dieser Viren ist linear und kann sowohl Pluspolarität als auch Minuspolarität besitzen (Abb. 4.7). Ebenfalls ssDNA findet man bei den Circoviren. Diese ssDNA liegt jedoch in zirkulärer Form vor mit kovalent verbundenen Enden. Vermehrungszyklus von ssDNA-Viren am Beispiel der Parvoviren: Parvoviren binden an Rezeptoren in der Zellmembran und gelangen über Endosomen ins Cytoplasma. In den Endosomen wird das Capsid abgebaut. Die Virus-DNA wird allmählich freigesetzt und gelangt zum Kern. Nach Adsorption an die Kernmembran wird die Virus-DNA in den Kern transportiert. Die DNA-Replikation findet im Kern durch einen modifizierten rollenden Haarnadelmechanismus (Rolling Hairpin Mechanism) statt (Abb. 4.7). Die Zellen müssen sich dazu in der S-Phase befinden. Zunächst wird die ssDNA zu einem Doppelstrang konvertiert. Die entstandene monomere doppelsträngige DNA dient als Matrize für die virale mRNA-Synthese. So können die frühen viralen Genprodukte NS1 Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 114 4.2 Virale Genomtypen und Virusgruppen 115 Abb. 4.7 Replikation von Parvoviren nach dem rollenden Haarnadelmechanismus (Rolling Hairpin Mechanism). Die Initiation der Replikation beginnt mit der Synthese zum Doppelstrang (Gap-fill-Synthese). Dabei dienen die invertierten terminalen Repeats (ITR) am 3l-Ende als Primer. Das 5l-Ende wird durch weitergehende Synthese aufgerollt (Displacement-Synthese). Die DNA wird bis zum 5l-Ende synthetisiert. Es findet ein Rearrangement statt, indem die ITR wieder ihre Haarnadelstruktur ausbilden. Es kommt nun wieder zur Displacement- und Gap-fill-Synthese, bis ein erster kompletter SyntheseRundgang beendet ist. Endonucleasen schneiden die DNA-Einheiten aus. Es lagern sich Strukturproteine an und die Displacement-Synthese läuft weiter. Das Genom liegt in verpackter Form vor. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 116 4 Viren 4 Zu den Viren mit Doppelstrang-DNA gehören die Pocken-, Herpes- und Adenoviren. Das Genom besteht aus einer linearen dsDNA. Eine zirkuläre dsDNA liegt bei den Papovaviren (Polyoma- und Papillomavirus) vor. Die Replikation läuft hier über einen Rolling-Circle-Mechanismus ab. Bei den Hepadnaviren, zu denen das Hepatitis-B-Virus gehört, ist die zirkuläre dsDNA nur partiell doppelsträngig und nicht kovalent geschlossen. Vermehrungszyklus von dsDNA-Viren am Beispiel von SV40: Das Polyomavirus gelangt über Endocytose in die Zelle. Nach dem Transport zur Kernmembran und nachfolgendem Uncoating, kommt es zur Transkription der frühen mRNAs. Die translatierten T-Antigene sind zuständig für die weitere Regulation der Replikation. Die Replikation der DNA selbst beginnt am „Origin of Replication“ (ori) und erfolgt durch zelluläre DNA-Polymerasen zur Produktion großer viraler Genommengen in einem „Rolling Circle“, wobei ein Strang kontinuierlich, der andere diskontinuierlich synthetisiert wird. Eine bidirektionale Replikation findet statt, wenn geringere Virusmengen gebildet werden sollen. Als replikative Abb. 4.8 Rolling-Circle-Replikation der Polyomaviren. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. und NS2 synthetisiert werden, die für weitere Replikationsschritte benötigt werden. Die DNA-Replikation und die Transkription der späten Proteingene werden initiiert. Dies sind vor allem Strukturproteine, die wieder zum Kern wandern, wo das Virusassembly stattfindet. Die Viren werden über Zelllyse freigesetzt. 117 Intermediate entstehen ineinander hängende DNA-Ringe, die durch weiteres Processing getrennt werden. Nach Beendigung der DNA-Replikation werden die späten Proteine exprimiert. Dies sind vor allem Strukturproteine, die wieder zum Kern wandern. Dort findet die Verpackung der viralen DNA zusammen mit zellulären Histonen statt. Nach erfolgtem Assembly werden die Viren über Zelllyse freigesetzt. Vermehrungszyklus von partiell dsDNA-Viren am Beispiel des Hepatitis-B-Virus: Das virale Genom des Hepatits-B-Virus (HBV) gelangt über Kernporen in den Zellkern. Dort wird zunächst die zirkuläre, partiell doppelsträngige DNA komplettiert und zur zirkulären DNA geschlossen. Anschließend erfolgt die Plusstrang-RNA-Synthese durch die zelluläre RNA-Polymerase. Die entstandene mRNA dient zunächst der Synthese der viralen Proteine und der Reversen Transkriptase. Gleichzeitig ist sie Template für die Herstellung einer Doppelstrang-DNA. Die eigentliche reverse Transkription findet im Cytoplasma in Präcapsiden statt. Diese enthalten sowohl mRNA als Template als auch die Reverse Transkriptase. Nach erfolgter reverser Transkription und Reifung der Capside durchläuft das Virus Kernhülle, ER und Golgi-Apparat, wobei es seine Hülle erhält. Die Freisetzung erfolgt über Exocytose. Eine lineare dsDNA findet sich bei dem Phagen l. Der Doppelstrang besitzt an den 5l-Enden kurze Überhänge mit umgekehrt komplementären Basensequenzen. Unter entsprechenden Umständen kann die DNA eine zirkuläre Form einnehmen, indem die komplementären Basen miteinander Basenpaarungen bilden. Die Fähigkeit zur Ausbildung einer zirkulären DNA ist eine wichtige Voraussetzung für die Integration in das Genom der Wirtszelle, wie es bei lysogenen Infektionen (s. u.) der Fall ist. Der Bakteriophage T4 gehört mit seinem komplexen Aufbau (Abb. 4.10) ebenfalls zu den dsDNA-Viren. Die Rezeptoren von T4 sind Lipoproteine der äußeren Schicht der bakteriellen Zellwand. Vermehrungszyklus eines dsDNA-Phagen am Beispiel T4: Der Phage nimmt mit den Enden der Schwanzfäden den ersten Kontakt mit dem bakteriellen Zellwandrezeptor auf (Adsorption, Abb. 4.10). Die Gelenke der Schwanzfäden knicken ein, sodass die Abb. 4.9 Diagramm der dsDNA des Phagen l. Das lineare Molekül besitzt an seinen 5l-Enden kurze Überhänge. Die DNA kann zirkularisieren und die komplementären Sequenzen bilden Basenpaarungen. Nach der Infektion wird der Doppelstrang durch eine Ligase kovalent geschlossen. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 118 4 Viren Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 Abb. 4.10 Die Vermehrung des Phagen T4 wird in verschiedene Phasen unterteilt: Adsorption, Penetration, Synthese viraler Nucleinsäuren und Proteine, Assembly und Freisetzung. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 119 Basalplatte in engen Kontakt mit der Oberfläche der Zellwand kommt. Durch Kontrahieren der Schwanzscheide durchstößt das innere Schwanzrohr die Zellwand (Penetration). Die dafür benötigte Energie liefert das in der Schwanzscheide enthaltene ATP. Die DNA wird in das Cytoplasma der Wirtszelle injiziert, die Proteinhülle verbleibt außerhalb. Kurz nach Eintritt der Phagen-DNA kommt es zu einer vollständigen Umstellung im Stoffwechsel der Wirtszelle. Zunächst wird die frühe mRNA des Phagen mit Hilfe bakterieller RNA-Polymerase gebildet. Durch Translation der frühen mRNA entstehen Enzyme und Faktoren, die eine weitere Synthese bakterieller DNA verhindern, deren Abbau vorantreiben und die Transkription der Phagengene beschleunigen. Die Phagen-DNA ist vor Selbstzerstörung geschützt, da sie 5-Hydroxymethylcytosin (HMC) an Stelle des gewöhnlichen Cytosins enthält. In der zweiten Hälfte der Synthesephase werden die „späten“ Proteine gebildet. Dazu gehören die Strukturproteine des Phagen, Proteine, die beim Zusammenbau des Phagen beteiligt sind und die Phagen-Lysozyme. Beim Assembly wird zunächst die Basalplatte gebildet. Das innere Schwanzrohr wird aufgesetzt und von der Schwanzscheide umhüllt. Parallel dazu findet der Zusammenbau des Phagenkopfes statt. Nachdem die DNA im Kopf verpackt ist, heftet sich der fertige Kopf spontan an den Schwanz an. Erst danach werden die Schwanzfäden mit der Basalplatte verknüpft. Das Lysozym des Phagen führt zur Auflockerung der Zellwand und bereitet die nun folgende Lyse der Zelle vor. n Baculoviren sind Insektenviren mit doppelsträngiger DNA, sie befallen vor allem Schmetterlinge und Motten. Bei den Baculoviren sind ein oder auch mehrere Nucleocapside von einer Proteinhülle, einem Polyeder aus dem Protein Polyhedrin umgeben. Zur Bildung des Polyeders sind große Mengen Polyhedrin erforderlich, entsprechend besitzt das Polyhedringen einen außerordentlich starken Promotor. In gentechnologischen Verfahren lässt sich dieser Promotor dazu verwenden, nahezu jedes Eiweißmolekül in großen Mengen in Zellkultur herzustellen. Beispiele für Proteine, die mit Hilfe des Baculovirus-Systems hergestellt werden, sind Interferon-alpha, Interleukin 2, monoklonale Antikörper und Herpes- sowie Poliovirus-Proteine. Baculoviren werden auch in der Landwirtschaft zur Kontrolle von Schadinsekten eingesetzt, da sie über sehr unspezifische Rezeptoren zahlreiche unterschiedliche Wirtszellen infizieren können, aber dort keine viruseigenen Gene exprimieren und somit die Infektion keine negativen Auswirkungen auf Pflanzen, Tiere, Vögel, Fische oder andere Insekten hat. m 4.2.2 RNA-Viren RNA-Viren stellen die größte Virusgruppe dar. RNA bildet komplexere Raumstrukturen aus als DNA und kann eigene enzymatische Funktionen entwickeln. Da RNA-Polymerasen keine Fehlerkorrekturfunktion haben, tritt eine hohe Mutationsrate bei RNA-Viren auf. Die Viren erhalten somit den Vorteil, sich an veränderte Wirtszellverhältnisse anzupassen. Durch die hohe Mutationsrate entsteht eine Vielzahl von Quasispezies desselben Virus mit teilweise neuen Eigenschaften. Durch eine hohe Mutationsfrequenz kann es aber auch zur Anhäufung nicht infektiöser Viren kommen. Bei DNA-Viren ist die Mutationsrate deutlich geringer als bei den RNA-Viren, trotzdem können auch DNA-Viren Resistenzen ausbilden (z. B. Acyclovir-Resistenz bei Herpes-simplex-Viren). Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 120 4 Viren 4 Bei einigen RNA-Viren besteht das Genom nicht aus einem durchgehenden Polynucleotidstrang sondern aus mehreren RNA-Segmenten. Bei diesen Viren kann es zum Reassortment der Segmente kommen, wodurch neue Virusvarianten entstehen (s. u. Influenzavirus). Zu den Viren mit linearer Doppelstrang-RNA gehören die Enteritis verursachenden Rotaviren (Familie der Reoviridae). Das virale Genom besteht aus 10–12 Segmenten. Vermehrungszyklus von dsRNA-Viren am Beispiel der Rotaviren: Nach Infektion der Wirtszelle läuft bei den Rotaviren die gesamte Virusreplikation im Cytoplasma ab, in partiell desintegrierten Capsidpartikeln. Die virale Plusstrang-RNA dient dabei nicht als mRNA. Vom Minusstrang wird mit Hilfe der viralen RNA-Polymerase die mRNA gebildet. Nach der Translation von regulatorischen Proteinen und Strukturproteinen wird die mRNA in ein Präcapsid verpackt. Dort dient sie als Template für die Synthese des zweiten Stranges. Die Präcapside mit den doppelsträngigen Genomsegmenten werden komplettiert, durch das ER geschleust, erhalten ein zweites Capsid und verlassen die Zelle über Lyse. Zur Gruppe der Viren mit Einzelstrang-RNA von negativer Polarität gehören die Paramyxoviren (Mumps- und Masernvirus), die Rhabdoviren (Rhabiesvirus) und die Orthomyxoviren (Influenzaviren). Weitere Gemeinsamkeiten zwischen der Familie der Orthomyxoviridae und der Familie der Paramyxoviridae sind ein helikales Nucleocapsid und eine Virushülle. Dennoch sind diese Familien sehr verschieden. Das Genom der Orthomyxoviridae ist segmentiert und die RNASynthese dieser Viren findet im Nucleus statt. Im Gegensatz zu den Paramyxoviren benötigen die Orthomyxoviren einen Primer für die mRNA-Synthese. Gemeinsam ist ihnen jedoch, dass sie eine eigene RNA-abhängige RNA-Polymerase besitzen, die im Virus verpackt in die Zelle gelangt. Vermehrungszyklus von ssRNA-Viren am Beispiel von Paramyxoviren: Nach Adsorption des Virus an den Zellrezeptor kommt es zur Fusion zwischen Virushülle und Zellmembran. Das Nucleocapsid wird in das Cytoplasma freigesetzt. Die virale RNA-Polymerase synthetisiert einen Plusstrang, der als Matrize für weitere Negativstränge dient. Während der Transkription bleiben die RNA-Stränge von Nucleocapsidproteinen umhüllt. Die viralen mRNAs besitzen CAP-Struktur, eine Poly-A-Sequenz und sind methyliert. Die Glykoproteine H und F werden über ER und Golgi-Apparat prozessiert und modifiziert. Das Matrixprotein ermöglicht eine Interaktion zwischen dem Nucleocapsid und der Region in der Plasmamembran, in der die Glykoproteine inseriert sind. Es kommt an dieser Stelle zum Budding des Virus. Vermehrungszyklus von ssRNAViren am Beispiel der Influenzaviren: Die umhüllten Viren heften sich über Rezeptoren an die Zellmembran und gelangen über Endocytose in die Wirtszelle (Abb. 4.11). Nach Fusion der Virushülle mit der Endosomenmembran werden die freigesetzten Nucleocapside zum Kern transportiert. Die virale RNA-abhängige RNA-Polymerase beginnt umgehend mit der Transkription der viralen RNA (vRNA) in Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Die Bildung von Quasispezies mit neuen biologischen Eigenschaften konnte bei HIV gezeigt werden. HIV-infizierte Patienten besaßen bereits vor der Therapie mit AZT Mutanten mit Resistenz gegenüber diesem Reverse-Transkriptase-Hemmer. Bei einer solchen Therapie wird eine bereits vorhandene resistente Quasispezies selektioniert. 121 mRNA. Als Primer der mRNA-Synthese dient eine CAP-RNA-Struktur, die von zellulärer RNA durch ein virales Protein abgespalten und übertragen wird („cap snatching“). Von der vRNA werden zunächst Kopien (cRNA) hergestellt, die zur Replikation weiterer vRNA benötigt werden. Die Translation findet im Cytoplasma statt. Proteine mit Kernlokalisationssignal wandern wieder zum Nucleus, während ein Teil der viralen Proteine zur Cytoplasmamembran transportiert wird. Nach der Bildung des Nucleocapsids findet das Budding der Viren an der Zellmembran statt, wodurch die Viren ihre Hülle mit den darin inserierten viralen Glykoproteinen erhalten. Influenzaviren werden aufgrund ihrer typspezifischen Nucleoprotein- und Membranprotein-Antigene in drei Gruppen eingeteilt: A, B, und C. Influenza C spielt fast keine Rolle bei Erkrankungen des Menschen. Influenza B kommt vor allem bei Kindern und Jugendlichen vor, der Erkrankungsverlauf ist milder als bei der Influenza A. Influenza-A-Viren sind beim Menschen, Säugetieren (Schweine, Pferde) und in großer Vielfalt bei Vögeln, vor allem Wasservögeln, die häufigste Ursache von Epidemien und Pandemien. Abb. 4.11 ssRNA-Viren. a Masernvirus. (EM-Aufnahme, Vergr. 150 000fach: A. Maisner, Marburg) b InfluenzavirusReplikationszyklus. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 4 4 Viren In der Virushülle sind die beiden integralen Glykoproteine von großer Bedeutung. Das größere der beiden ist das Hämagglutinin (HA), das die Viren zum Anheften an die Wirtszellen brauchen, die Neuraminidase (NA) sorgt für die Freisetzung der Viren aus infizierten Zellen. Die aus der Hülle herausragenden Spikes enthalten die Oberflächenantigene des Virus, gegen die sich die Immunabwehr der Wirtszellen richtet. Inzwischen gibt es 15 nachgewiesene Subtypen des Hämagglutinins und neun Subtypen der Neuraminidase, die auch zur Benennung herangezogen werden. Bekanntheit erlangte der aviäre, hoch pathogene Influenzastamm vom Typ H5N1, der 1997 unter Geflügelbeständen in Hongkong auftrat. Die Behörden führten eine Massentötung durch, womit die Seuche vorübergehend zum Stillstand kam. 2003 tauchte sie in Gebieten von China, 2004 in Südkorea, Thailand, Japan und Indonesien wieder auf. 2005 wurden in Russland und Kasachstan auch Infektionen bei Wildvögeln festgestellt. Über die Vogelflugrouten breiteten sich die Viren weiter aus, im Februar 2006 wurden die ersten Erreger in Europa nachgewiesen. Bis dahin waren 170 Menschen an Vogelgrippe erkrankt und 90 von ihnen daran verstorben, die engen Kontakt zu infiziertem Geflügel hatten. Die Übertragung der Erreger infizierter Menschen auf andere Menschen konnte nur in einzelnen Fällen eindeutig bestätigt werden. Der hochpathogene Stamm H5N1 hat bislang keine Pandemie hervorrufen können. Die antigene Variabilität der Influenzaviren ist die Hauptursache für das alljährliche Auftreten von neuen Influenzaerkrankungen. Sie lässt es bislang unmöglich erscheinen, Influenza durch Impfung vollständig unter Kontrolle zu bekommen. Antikörper gegen das HA-Protein können eine Influenzainfektion neutralisieren. Doch Variationen im globulären Teil des HA-Proteins durch einzelne Punktmutationen helfen den Viren, der Immunantwort zu entkommen. Eine solche Antigenveränderung wird als Antigendrift bezeichnet. Ein wesentlich stärkerer Antigenwandel, der bei Influenza-A-Viren zum Auftreten neuer Subtypen und somit zu neuen Pandemien führt, wird als Antigenshift bezeichnet. Bei einer gleichzeitigen Infektion einer Zielzelle mit zwei verschiedenen Subtypen kann es beim Verpacken der viralen RNA zum Austausch von funktionell homologen RNA-Segmenten kommen, so dass neue Virustypen mit veränderten Segmentkombinationen (Reassortment) entstehen. Wenn der neue Virusstamm besonders virulent ist, kann er eine weltweite Pandemie auslösen und zum Tod von Millionen Menschen führen, wie es bei der „Spanischen Grippe“ 1918 der Fall war. n Mutationen im HA sind für die unterschiedliche Pathogenität der Virusstämme verantwortlich. Das Hämagglutinin ist verantwortlich für die Anheftung des Virus an Rezeptoren der Wirtszelle. Im Anschluss an die Adsorption wird das Virus in zelluläre Endosomen internalisiert. HA-Proteine bestehen aus zwei Polypeptiden, HA1 und HA2, die über Cysteinbrücken miteinander verbunden sind. Die Ansäuerung der Endosomen verursacht eine Konformationsänderung, wodurch hydrophobe Bereiche des HA2-Proteins freigelegt werden und es zu einer Interaktion bzw. Fusion der Virushülle mit der Membran der Endosomen und damit Freisetzung der viralen Nucleocapside in das Cytoplasma der Wirtszelle kommt. Die Fusionsaktivität des Hämagglutinins ist abhängig vom gespaltenen Zustand des Proteins in die beiden Polypeptide. Das HA-Glykoprotein wird während des Transportes zur Cytoplasmamembran durch eine zelluläre Protease gespalten. Bei den hoch pathogenen aviären Stämmen sind Protease-Schnittstellen im HA vorhanden, die von ubiquitären Proteasen erkannt werden, während humanpathogene Influenzaviren durch Trypsin-ähnliche Proteasen aktiviert werden müssen. m Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 122 123 Zu den Viren mit Einzelstrang-RNA von positiver Polarität gehören die Picornaviren, Flaviviren, Togaviren, Coronaviren, die Mehrzahl der Pflanzenviren und die einfachen E. coli infizierenden RNA-Phagen (MS2, Qb). Nach erfolgter rezeptorvermittelter Endocytose und Freisetzung der vRNA in die Zelle findet die weitere Replikation dieser Viren im Cytoplasma statt. Zunächst werden virale Proteine und virale RNA synthetisiert. Dabei kann die virale RNA direkt als mRNA eine Proteinsynthese starten und benötigt weder die Transkription noch zelluläre Enzyme. Die Translation der RNA führt zu einem großen Polyprotein, das durch virale Proteasen in Capsidproteine und funktionelle Proteine gespalten wird. Die virale RNA-Polymerase synthetisiert über Minusstrangkopien neue vRNA mit Pluspolarität. Die Plusstrang-RNA wird anschließend in das Präcapsid verpackt und nach erfolgter Reifung findet die Freisetzung der Viren statt. 2002 trat in China erstmals das Akute Atemwegssyndrom (severe acute respiratory syndrome, SARS) auf mit sehr plötzlich auftretendem hohen Fieber, Muskelschmerzen, Husten und Atemnot, häufig Lungenentzündungen oder Lungenversagen. SARS entwickelte sich zu einer Epidemie, bei der in über 30 Ländern 8000 Menschen erkrankten, 774 verstarben. Erst 2003 konnte dank weltweiter Infektionskontrolle die Epidemie eingedämmt werden. Als Erreger wurde ein bis dahin unbekanntes Coronavirus entdeckt. Das SARS-assoziierte Coronavirus (SARS-CoV) ist neu in der menschlichen Population und unterscheidet sich in seiner Genomsequenz wesentlich von den bisher bekannten Coronaviren. Deshalb ist nicht davon auszugehen, dass SARS durch Mutationen bzw. Rekombination aus schon bekannten humanen Coronaviren entstanden ist, die banale Infekte der oberen Atemwege verursachen. Es scheint eher so, dass ein Coronavirus mit anderer Wirtsspezifität die Fähigkeit erlangt hat, auf Menschen übertragbar zu sein. Inzwischen gilt es als sehr wahrscheinlich, dass die Fledermaus der natürliche Wirt dieses Virus ist. Spezielle Therapien gibt es bislang nicht. Ansätze bieten die Entwicklung von Proteaseinhibitoren, die die Entstehung der RNA-Polymerase hemmen oder die Spaltung des S-Proteins unterbinden sollen, bzw. die Entwicklung von Inhibitoren der Coronavirus Acetylesterase, durch die die Virusreplikation beeinträchtigt werden soll. Es wird außerdem versucht, einen Impfstoff herzustellen, der auf isoliertem S-Protein basiert. 4.2.3 Retroviren Die einzelsträngige RNA der Retroviren besitzt positive Polarität. Im Gegensatz zu den Plusstrang-Viren ist die RNA jedoch nicht infektiös, denn die Replikation der Retroviren verläuft über eine DNA-Zwischenstufe, für die eine RNA-abhängige DNA-Polymerase notwendig ist. Diese Reverse Transkriptase wird im Nucleocapsid des Retrovirus mitgeführt. Im Capsid sind außerdem mindestens zwei Kopien der genomischen RNA enthalten. n Die Synthese von DNA an einem RNA-Template erfordert als Enzym eine RNAabhängige DNA-Polymerase, die auch als Reverse Transkriptase bezeichnet wird. Die Entdeckung dieses Enzyms durch die Forscher Howard Temin und David Baltimore war ein Meilenstein in der Forschung, da bis dahin der Grundsatz galt, dass der Informationsfluss immer von DNA über RNA zum Protein läuft. Doch bei Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 124 den deshalb auch so bezeichneten Retroviren verläuft mit der Übersetzung der vorhandenen viralen RNA in DNA durch die Reverse Transkriptase der Informationsfluss in umgekehrter Richtung. Mit Hilfe dieses Enzyms ist es möglich, jede RNA in die komplementäre DNA (cDNA) zu überschreiben. Das Enzym findet daher heute vielseitige Anwendung in der Gentechnik, z. B. bei der Herstellung von DNAChips zur Untersuchung des Transkriptoms einer Zelle oder zur Erzeugung eines intronfreien Inserts, wenn ein eukaryotisches Protein durch ein bakterielles Expressionssystem hergestellt werden soll. Durch die Reverse Transkriptase in DNA umgeschriebene RNA kann auch über Polymerasekettenreaktion, PCR, amplifiziert werden. m Retroviren sind umhüllte Viren mit charakteristischen Oberflächenspikes (Abb. 4.3). Nach Anheftung des Virus an die Rezeptoren der Wirtszelle, kommt es zur Verschmelzung der Hülle mit der Zellmembran. Das Nucleocapsid wird freigesetzt und das virale Genom gelangt in das Cytoplasma (Abb. 4.12). Von einem der beiden RNA-Genome wird mit Hilfe der Reversen Transkriptase eine einzelsträngige DNA-Kopie hergestellt. Die Reverse Transkriptase ist ebenso zuständig für den anschließenden Abbau der viralen RNA (RNAse-H-Aktivität) und die Synthese des komplementären DNA-Stranges. Die doppelsträngige DNA wird in den Nucleus transportiert und dort in die Wirts-DNA integriert, und zwar durch Abb. 4.12 Replikationszyklus von Retroviren am Beispiel von HIV. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 4 Viren 125 einen Mechanismus, der analog zur Integration von Transposons verläuft. Hierbei ist das viruseigene Enzym Integrase beteiligt. Einmal integriert, verhält sich die virale DNA, die jetzt als Provirus bezeichnet wird, als stabiles genetisches Element und kann dort latent verbleiben. Wenn es zur Aktivierung und Virusproduktion kommt, beginnt die Transkription durch zelluläre RNA-Polymerasen. Es werden Transkripte in voller Länge und auch kürzere gespleißte Transkripte gebildet. An den Polyribosomen entsteht durch Translation ein Polyprotein, das im weiteren Prozess durch eine viruseigene Protease in die einzelnen funktionellen Proteine geschnitten wird. Die viralen Hüllproteine lagern sich in der Zellmembran ein und markieren somit die Bereiche an denen später das Budding der Viren stattfindet. Das Humane-Immundefizienz-Virus (HIV) gehört zur Gruppe der Retroviren und ist der Erreger des erworbenen Immundefektsyndroms (AIDS). Die bevorzugten Zielzellen dieses Virus sind aktivierte CD4+-T-Lymphocyten, doch das Virus infiziert auch andere Zelltypen einschließlich Makrophagen. Man unterscheidet zwei HIV-Typen: HIV-1 und HIV-2. Obwohl es bei einer HIV-2-Infektion wesentlich später zum Ausbruch der Krankheit kommt, zeigen die beiden Virustypen ansonsten ein einheitliches Krankheitsbild. HIV-2-Infektionen sind vornehmlich in West-Afrika zu finden, während Infektionen mit HIV-1 weltweit auftreten. Die Viruspartikel besitzen ein Nucleocapsid, das mindestens zwei Kopien der plusRNA, die Reverse Transkriptase und die Integrase enthält. In die Virushülle sind Spikes inseriert. Sie bestehen aus dem Transmembranprotein gp41 das durch nicht kovalente Interaktionen mit dem stark glykosylierten gp120 verbunden ist. Das Matrixprotein p17 kleidet die Virushülle von innen aus. Das Virusprotein p24 ist ein Hauptbestandteil des Capsids. Untersuchungen zeigen, dass CD4+-Rezeptoren zwar notwendig sind für die Infektion, aber nicht ausreichend für das Eindringen in die Wirtszelle. Als Korezeptoren für HIV wurden Rezeptoren für Chemokine entdeckt. CCR5-Rezeptoren sind in der frühen Phase der HIV-Infektion beteiligt. Sie ermöglichen die Infektion von Makrophagen. Weitere Korezeptoren sind CXCR4, auch bekannt als Fusinrezeptor und CCR2. Sobald gp120 an CD4+ bindet, findet eine Konformationsänderung statt, die zur erhöhten Affinität für den Chemokin-Rezeptor führt. Die Bindung an den Chemokin-Rezeptor verursacht eine Konformationsänderung im gp41-Fusionsprotein von HIV, wodurch die Fusion von Virusmembran und Zellmembran eingeleitet wird. Nach Fusion der Virushülle mit der Wirtszellmembran und dem Uncoating wird von einem der beiden RNA-Genome mit Hilfe der Reversen Transkriptase eine einzelsträngige DNA-Kopie hergestellt (Reverse Transkription). Der Einzelstrang wird zur Doppelstrang-DNA komplettiert und in das Genom der Wirtszelle integriert (Integration). Das Provirus kann lange Zeit latent bleiben, ehe es aktiviert wird und die Virusbildung beginnt. Von der integrierten Virus-DNA wird durch Transkription mRNA synthetisiert, die im Cytoplasma translatiert wird und zur Produktion von Virusproteinen führt. Vom Provirus wird auch neue Virus-RNA gebildet, die später in die Viruspartikel eingebaut wird. Nachdem Zusammensetzung und Budding an der Cytoplasmamembran stattgefunden haben, findet eine weitere Capsidreifung außerhalb der Zelle statt. Bei diesem Reifungsvorgang wird zum einen das Vorläuferprotein „Gag“ bestehend aus Matrixprotein (p17), Capsidprotein (p24) und Nucleoprotein (p7) sowie das Vorläuferprotein „Gag-Pol“ durch die HIV-Protease gespalten. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 126 4 Viren Abb. 4.13 Der Verlauf einer HIV-Infektion wird in 4 Phasen unterteilt. Der Krankheitsverlauf kann in vier Phasen unterteilt werden (Abb. 4.13). Akute Phase: 2–6 Wochen nach der Infektion können grippeähnliche Symptome wie Fieber, Nachtschweiß, geschwollene Lymphknoten, Übelkeit usw. auftreten. Wird das Virus über Sexualkontakt aufgenommen, so binden dendritische Zellen die mit HIV beladenen Makrophagen und transportieren sie zu den Lymphknoten. Dort werden zunächst CD4+-T-Lymphocyten infiziert, später werden andere Zelltypen befallen. Der Virustiter im Blut ist sehr hoch. Die Anzahl der CD4+-Zellen nimmt kurzfristig ab, erreicht aber bald einen normalen Titer. Die akute Phase dauert 4–6 Wochen. Latenzphase: Cytotoxische B- und T-Lymphocyten zeigen eine starke Abwehrreaktion und können das Virus fast vollständig aus der „Zirkulation“ entfernen. Zwar wird in den infizierten Zellen viel Virus gebildet, doch das Immunsystem kann die Viren schnell neutralisieren. Es stellt sich ein Gleichgewicht ein zwischen zerstörten und neu gebildeten T4-Lymphocyten. Ein kleiner Anteil der infizierten T-Lymphocyten bleibt jedoch als „Gedächtniszellen“ erhalten und trägt das HIV als Provirus im Genom. Im Blut der Patienten ist kaum Virus nachweisbar, doch die Virusproduktion findet weiter statt in Lymphknoten, dendritischen Zellen und Makrophagen. Körperliche Symptome treten keine auf. Aids related complex (ARC): Die Zahl der CD4+-Zellen nimmt rasch ab. In dieser Phase gibt es nur eine geringe spezifische Immunabwehr gegen HIV, da die spezifischen CD4+-Zellen selbst infiziert werden und eine Apoptose von CD4+- und CD8+-Zellen eingeleitet wird. Es kommt zu Erkrankungen, die auf eine Schwächung des Immunsystems hinweisen. Charakteristisch für dieses Stadium sind chronischer Durchfall, Pilzbefall von Mund und Rachen, NervenFunktionstörungen, Lymphknotenschwellung und stetiger Gewichtsverlust. AIDS ist das Endstadium der HIV-Infektion. Die Zahl der CD4+-Lymphocyten sinkt und der Virustiter steigt schnell an. Es kommt zum Auftreten von lebensbedrohlichen opportunistischen Infektionen: Lungenentzündung mit schwer behandelbaren Keimen (Pneumocystis), Infektionen des Nervensystem bis hin zur Hirnhautentzündung, typische Tumoren (Kaposi-Sarkom, Lymphome), ausgedehnter Pilzbefall in Luft- und Speiseröhre bzw. Lungen, Herpesinfektionen, Tuberkulose. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 127 Die Wahrscheinlichkeit der Übertragung durch Bluttransfusionen oder Blutkomponenten konnte durch Spenderselektion und durch Anwendung des Anti-HIV-Tests in jeder Einzelspende sowie durch permanente Elimination aller infizierten Spender in Deutschland auf ein Restrisiko von 1:1 Mio. gesenkt werden. Die sexuelle Übertragung, heterosexuell und homosexuell, ist mittlerweile die häufigste Art der Verbreitung. Die vertikale Infektion von der HIV-infizierten Mutter auf das Neugeborene kann bei der Geburt über Blut geschehen. Die Übertragung über Stillen ist ebenfalls möglich. Eine HIV-Übertragung findet nicht über Insekten und andere Arthropoden statt. HIV wird nicht über Tröpfcheninfektion, durch Hautkontakt oder normales familiäres Zusammenleben übertragen. Dem jährlichen UN-Aidsbericht (2005) zufolge starben bisher 25 Millionen Menschen an der Immunschwäche. Derzeit leben weltweit fast 40 Millionen Menschen mit dem Aids-Virus, davon rund 660 000 Kinder. Es gab 4,1 Millionen Neuinfektionen in 2005. Obwohl bisher kein Mittel zur Heilung gefunden werden konnte, ist es möglich geworden, die tödliche Erkrankung in eine Behandelbare zu wandeln. Erstes Ziel dabei ist es, die Vermehrung der Viren im Körper zu hemmen und so die Schwächung des Immunsystems aufzuhalten. Zur Zeit werden drei Wirkstoffklassen angewandt: Reverse-Transkriptase-Inhibitoren, Protease-Inhibitoren und Fusionsinhibitoren. Da das Virus schnell Resistenzen gegenüber einzelnen Medikamente entwickelt, setzt man zur Bekämpfung von HIV eine dreifach Kombinationstherapie ein, die „hochaktive antiretrovirale Therapie“ (HAART). Diese besteht aus Inhibitoren der Reversen Transkriptase und Proteaseinhibitoren. Retroviren können Gene besitzen, die nach Integration in die chromosomale DNA, Tumoren induzierende Wirkung zeigen, sogenannte onc-Gene oder Onkogene. Klassisches Beispiel eines transformierenden Virus ist das Rous-Sarkom-Virus (Abb. 4.3), das beim Huhn Sarkome erzeugt. Für die Tumorentstehung wird das src-Gen verantwortlich gemacht. Das Genprodukt ist eine Tyrosin-Kinase, die zelluläre Proteine phosphoryliert und dadurch das Zellwachstum beeinflusst. Man konnte nachweisen, dass virale onc-Gene zellulären Ursprungs sind. Onc-Gene kommen in den Genomen aller höheren Tierarten vor. Die Funktion ihrer Genprodukte in der Zelle ist vielfältig und häufig mit der Regulation des Zellwachstums verbunden. Die zellulären onc-Gene sind an sich nicht onkogen, weil ihre Expression aufgrund ihres krebserzeugenden Potentials normalerweise streng reguliert wird. Im Laufe der Evolution müssen die zellulären onc-Gene in das Genom der Retroviren gelangt sein. Man nimmt an, dass Retroviren in unmittelbarer Nähe zum zellulären onc-Gen integriert worden sind. Bei der Replikation ist dann das virale Genom mitsamt dem zellulären onc-Gen transkribiert und in das Virus verpackt worden. Die onc-Gene der Viren haben sich unabhängig von den zellulären Genen weiterentwickelt, so dass die viralen onc-Gene (oncv) und die zellulären onc-Gene (oncc) nicht mehr identisch sind, im oben genannten Beispiel unterscheidet sich das virale src-Genprodukt in einer einzigen Aminosäure von der zellulären Tyrosin-Kinase. Gelangt ein solches verändertes onc-Gen zusammen mit dem restlichen retroviralen Genom in das Wirtsgenom, entfaltet es unter dem Einfluss der viralen Steuerelemente seine onkogene Wirkung. Aber auch Retroviren, deren Genome keine Onkogene enthalten, können tumorinduzierend wirken, wenn z. B. das virale Genom in direkter Nachbarschaft eines zellulären onc-Gens integriert und das zelluläre onc-Gen unter dem Einfluss starker viraler Promotoren dauerhaft verstärkt exprimiert wird ( Genetik) oder im Verlauf der Virusreplikation gebildete virale Proteine direkt die Transkription bestimmter zellulärer Gene aktivieren. Auf diesem Mechanis- Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2 Virale Genomtypen und Virusgruppen 128 mus beruht die Entstehung bestimmter Leukämien durch das Humane T-Zell-LeukämieVirus. Retroviren scheinen aber ansonsten für die Tumorentstehung beim Menschen nur eine untergeordnete Rolle zu spielen. Auch DNA-Viren werden in kausalen Zusammenhang mit bestimmten menschlichen Tumoren gebracht, z. B. das Humane Papillomaviren mit Zervixkarzinom, EBV (EpsteinBarr-Virus), mit Burkitt-Lymphom oder HBV mit Leberzellkarzinom. Die onkogene Wirkung der DNA-Viren beruht auf der direkten Inaktivierung bestimmter zellulärer Proteine, sogenannter Tumorsuppressorproteine, durch virale Regulatorproteine, deren physiologische Funktion darin besteht, unkontrolliertes Zellwachstum zu verhindern. 4.2.4 Viroide und defekte Viren Viroide wurden zuerst bei Untersuchungen der Spindelknollenkrankheit an Kartoffeln beobachtet. Das infektiöse Agens verhielt sich ähnlich wie ein Virus, konnte aber nicht durch Ultrazentrifugation pelletiert werden. Weitere Untersuchungen zeigten, dass es sich um nackte RNA ohne weitere Hüllproteine handelt. Die infektiöse RNA der Viroide ist ein ringförmig geschlossener Einzelstrang und besteht aus 250–400 Nucleotiden. Komplementäre Sequenzen ermöglichen Basenpaarungen innerhalb kurzer Bereiche, an die sich unpaare Regionen anschließen. Die Enden werden von kleinen unpaaren Loops gebildet. Die RNA codiert nicht für Proteine und wird nicht von einem Capsid umschlossen. Während der Infektion wird das RNA-Molekül repliziert und interferiert mit dem Nucleinsäurestoffwechsels des Wirtes. Es kommt zur Verfärbung der Blätter und Früchte sowie verlangsamtem Wachstum und Fehlbildung der Pflanze. Defekte Viren sind nicht im Besitz der gesamten Gene, die für einen kompletten Infektionszyklus notwendig sind. Viele der defekten Viren weisen Deletionen auf. Diese entstehen oft im Verlauf der Replikation aus Wildtypviren, wenn es z. B. zum Übergreifen der Nucleinsäurepolymerase auf ein anderes Template kommt. Aufgrund der Deletionen benötigen defekte Viren ein weiteres Virus, das sogenannte Helfervirus, das die fehlenden Funktionen bereitstellt. Trotz des Helfervirus muss ein defektes Virus, wenn es vermehrt werden soll, mindestens noch folgende Funktionen besitzen: Signale für die Polymerase, zur Replikation des Genoms und Verpackungssignale am Genom. Defekte Viren konkurrieren mit dem Helfervirus bei der Vermehrung um Replikationsapparat, Hüllproteine und Capsidproteine. Daher fällt die Replikation der Helferviren meistens weniger effektiv aus als ohne Anwesenheit eines defekten Virus (Partikel). Man bezeichnet dieses Phänomen als Beeinträchtigung (interference) und diese defekten Partikel als Defective Interfering Particles (DI particles). In vitro können defekte Viren zur Etablierung persistenter Infektionen, zur Beeinträchtigung des Virustiters und zur Eliminierung replizierender Viren führen. Defekte Viren, die nicht durch spontane Mutationen auftreten, sondern prinzipiell einen defekten Zustand besitzen, werden als Satellitenviren bezeichnet. Hierzu gehört das Hepatitis-D-Virus, das nur zusammen mit dem Hepatits-BVirus als Helfervirus repliziert. Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4 4 Viren 4.2 Virale Genomtypen und Virusgruppen Prionen Prionen sind infektiöse Proteine (protein infectious agent, PrP). Früher wurden Erkrankungen wie Scrapie bei Schafen, Gehirnerkrankungen von Nerzen und Rinderwahn (BSE) den langsam verlaufenden Viruserkrankungen zugeordnet. Mittlerweile hat sich herausgestellt, dass diese neue Art der Infektion durch falsch gefaltete Proteine, Prionen, hervorgerufen wird. Bei Menschen sind es die Kuru-Krankheit und die Creutzfeld-Jakob-Krankheit (CJD), die durch Prionen verursacht werden. Bei der Creutzfeld-Jakob-Krankheit kann die falsche Proteinfaltung auch genetisch bedingt sein. All diesen Krankheiten ist gemeinsam, dass eine lange Inkubationszeit vorausgeht, es zur Degeneration des Gehirns kommt, eine spongiforme Encephalopathie auftritt mit Vakuolenbildung und Ablagerungen von fibrillären Aggregaten, die PrPsc enthalten. Die Erkrankung verläuft in allen Fällen tödlich. Das erste Prion wurde im Zusammenhang mit Scrapie bei Schafen charakterisiert (PrPsc). Das physiologische Protein (PrPc) wird von einem zellulären Gen codiert, es ist an der Zellmembran über einen Glykosylphosphatidylinositol(GPI)-Anker gebunden. Die höchste Expressionsrate findet man in Neuronen. PrPc ist bei den meisten der bislang untersuchten Tierspezies zu finden. Doch Versuche mit Knockout-Mäusen haben gezeigt, dass es nicht essentiell ist. Man vermutet, dass das Protein bei der synaptischen Funktion, aber auch bei der Schlafregulation und der Regulation des Immunsystems eine Rolle spielt. Das Protein kommt vor allem auf der Zelloberfläche vor und schützt die Zelle vor freien Radikalen. Neueste Forschungsergebnisse diskutieren auch eine Bedeutung der Prionen bei der Neurogenese. PrPc und das pathologische Protein (PrPsc) haben die gleiche Aminosäuresequenz und die gleichen post-translationalen Modifikationen. Sie besitzen jedoch eine unterschiedliche Konformation. Die normale Form enthält einen großen Anteil an a-Helices während dieser bei PrPsc in der b-Faltblattstruktur vorliegt ( Biochemie, Zellbiologie). Das so veränderte Protein polymerisiert und kann in der Zelle nicht mehr abgebaut werden. PrPsc wirkt als Matrize und drängt dem physiologischen Protein seine b-Faltblattstruktur auf. Unklar ist dabei, ob Chaperone ( Genetik) an der Umwandlung beteiligt sind. So kommt es zu einer Art Kettenreaktion, bei der große Mengen falsch gefalteter Proteine entstehen. PrPsc verursacht weder die Bildung einer zellulären noch die Bildung einer humoralen Antwort. Der Grund hierfür ist bislang unbekannt. Prionen sind gegenüber äußeren Einflüssen sehr stabil. Sie sind unempfindlich gegenüber UVund Gammastrahlen sowie Hitze und herkömmlichen Desinfektionsmitteln. Feuchte Hitze wird noch immer als die effektivste Methode zur Inaktivierung betrachtet (S. 281). Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! 4 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 4.2.5 129 4 4 Viren DNA-Viren: Geringe Mutationsrate, Fehlerkorrekturfunktion, Rekombination möglich, zirkulärer oder linearer DNA-Strang. Polarität: Die Polarität von Einzelstrang-Viren kann plus oder minus sein. Ausnahme ist die ambisenseRNA mit Plus- und Minuspolarität. RNA-Viren: RNA bildet komplexe Raumstruktur, Enzymfunktion möglich, hohe Mutationsrate, keine Fehlerkorrekturfunktion, bei segmentiertem Genom ist Reassortment möglich. Retroviren: Einzelsträngige RNA-Viren mit positiver Polarität, Replikation läuft über DNA-Zwischenstufe ab, Integration in das Wirtsgenom. Provirus: Virale DNA wird mit Hilfe der Integrase in das Wirtsgenom integriert und verbleibt dort als latent bis zur Aktivierung. Reverse Transkriptase: Enzym, das von einer RNA eine einzelsträngige DNAKopie herstellt, der RNA-Strang wird dabei abgebaut (RNAseH-Aktivität) und der komplementäre DNA-Strang synthetisiert. onc-Gene (Onkogene): Retrovirale Gene, die nach Integration in die chromosomale DNA Tumoren induzieren können. Viroide: Infektiöses Agens bei Pflanzen, ringförmig geschlossene EinzelstrangRNA, keine Hüllproteine. Defekte Viren: Besitzen kein komplettes Genom, sind bei der Vermehrung auf Helferviren angewiesen. Satellitenviren: Defekte Viren, die nicht spontan sondern prinzipiell in einem defekten Zustand auftreten. Sie benötigen zur Vermehrung ein Helfervirus. DI particles (defective-interfering-particles): Defekte Viren, die das Wachstum des Helfervirus auf verschiedenen Art beeinträchtigen. Prionen (protein infectious agent): Infektiöse Proteine (PrPsc) verursachen spongiforme Encephalopathien, indem sie den intakten zellulären Proteine (PrPc) die eigene falsche Faltung aufdrängen. PrPsc wirken dabei wie eine Matrize. 4.3 Strategien der Virusinfektion Sowohl bei Menschen und Tieren als auch bei Pflanzen gibt es Beispiele für generalisierte Infektionen, die sich im ganzen Organismus ausbreiten und Beispiele für lokalisierte Infektionen. Bei der Vermehrung von Phagen werden zwei Arten der Infektionen unterschieden: lytische und lysogene Infektionen. Dauerhafte Infektionen können unbemerkt bleiben (latent) oder aber persistent und produktiv sein. Es gibt verschiedene Übertragungswege für eine Virusinfektion: Neben dem direkten oder indirekten Kontakt können auch Vektoren als Überträger in Betracht kommen. Der Begriff der Virusinfektion bezeichnet das Eindringen eines Virus in eine Zelle. Nach dem Eindringen kann die Interaktion von Virus und Zelle im tierischen Organismus zu ganz unterschiedlichen Ergebnissen führen: Das Virus vermehrt sich rasch und effizient in der Wirtszelle. Es kommt zur Produktion großer Virus- Aus Munk, Katharina: Taschenlehrbuch Biologie - Mikrobiologie (ISBN 978-313-144861-3) © 2008 Georg Thieme Verlag KG, Stuttgart Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 130