Institut für Molekulare Immunologie
Werbung

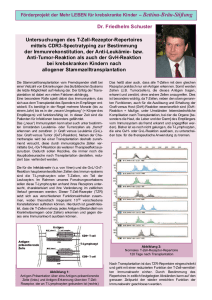
Institute of Molecular Immunology München Munich (Direktorin: Prof. Dr. Dolores J. Schendel) ie Forschungsaktivitäten des Instituts bewegen sich im Grenzgebiet zwischen Hämatologie, Immunologie, Onkologie und Transplantationsbiologie. Hier werden Konzepte zur Modulation des Immunsystems mittels zell- und molekularbiologischer Methoden entwickelt. Untersucht werden neue Strategien der Immuntherapie und Gentherapie bei Krebs sowie bei der Behandlung von Autoimmunerkrankungen und Transplantat-Abstoßungsreaktionen. Dabei kommen Tiermodelle und In-vitro-Studien mit isolierten Zellen des menschlichen Immunsystems zum Einsatz. Auf der Grundlage dieser Strategien werden in enger Kooperation mit medizinischen Fakultäten sowohl innerhalb als auch außerhalb München klinische Studien entworfen und umgesetzt. Am Institut für Molekulare Immunologie arbeiten zum Jahresende 8 Wissenschaftler, 6 Nachwuchswissenschaftler (davon 2 sonderfinanziert) und 8 technische Assistenten (1 sonderfinanziert), an immunologischen Projekten der Grundlagenforschung bzw. der anwendungsorientierten Forschung. Im Jahr 2002 promovierten zwei Doktoranden in der Biologie (Dr. rer. nat.), eine Doktorandin absolvierte ihre tiermedizinische Promotion (Dr. med. vet.). Als Beispiel unserer Forschungsaktivitäten im Jahr 2002 stellen wir ein Projekt aus der Arbeitsgruppe Tumorimmunologie vor, D DIE INSTITUTE Institut für Molekulare Immunologie (Director: Prof. Dr. Dolores J. Schendel) esearch in the institute is focused on the intersecting field between haematology, immunology, oncology, and transplantation biology. Concepts are developed for modulating the immune system by means of cellular and molecular methods. New strategies are investigated for the immunotherapy and gene therapy of cancer, and the treatment of autoimmune diseases and transplant rejection reactions. The research uses both animal models and in vitro studies with isolated cells from the human immune system. Clinical studies based on these strategies are designed and carried out in close cooperation with medical faculties both in Munich and elsewhere. As an example of our activities in 2002, we present a project from the research group in Tumour Immunology that was performed in collaboration with the DKFZ (Experimental and Molecular Pathology, Prof. Gröne) and the Institute of Pathology at the GSF (Prof. Hutzler). At the end of 2002, there were 8 scientists, 6 junior scientists (2 supported by grant funds), and 8 technicians (1 supported by grant funds) involved in basic and applied immunological research at the Institute. In 2002, three students were awarded doctorates, two in biology and one in veterinary medicine. R 221 GSF das in Zusammenarbeit mit dem DKFZ (Experimentelle und Molekulare Pathologie, Prof. Gröne) und dem Institut für Pathologie der GSF (Prof. Hutzler) bearbeitet wird. Charakterisierung des lymphozytären Infiltrats im Nierenzellkarzinom Tumorparenchym Bindegewebs-Kapsel M. Rosmanit, E. Nößner Das Nierenzellkarzinom wird, wie das Melanom, zu den immunogenen Tumoren gezählt, weil in seltenen Fällen spontane Remissionen auftreten und weil die systemische Applikation von Zytokinen bei einigen Patienten zur Tumorregression führt. Auch gelang es uns und anderen Arbeitsgruppen, T-Lymphozyten aus Tumoren zu isolieren, die in vitro zytotoxische Aktivität gegen Tumorzellen zeigten. Über die letzten Jahre hinweg waren die aus Tumoren von Patienten isolierten Lymphozyten (tumorinfiltrierende Lymphozyten, TIL) der Fokus unserer Forschungsaktivitäten, und die gewonnenen Kenntnisse wurden in ein allogenes Tumorzell-Vakzine-Konzept umgesetzt, das demnächst an der Urologischen Klinik und Poliklinik Großhadern (Prof. Hofstetter) und der Robert-Rößle-Klinik Berlin (Prof. Pezzutto) an Patienten mit metastasiertem Nierenzellkarzinom evaluiert wird (siehe auch Jahresbericht 1998 und 2001). Die Beobachtung, dass T-Zellen mit zytotoxischer Aktivität gegen autologe Tumorzellen relativ oft und auch bei Patienten mit fortgeschrittener Tumorerkrankung isoliert werden können, lässt uns mit der Frage zurück, warum das Tumorwachstum in den meisten Fällen dennoch nicht verhindert wird. Die Diskrepanz zwischen dem positiven Nachweis zytotoxischer Lymphozyten und dem Versagen der Lymphozyten bei der Kontrolle des Tumorwachstums veranlasste uns dazu, das lymphozytäre Infiltrat am Ort des Tumors (in situ) zu untersuchen, um Hinweise zu erhalten, warum die T-Zellen in situ nicht aktiv sind. Wir führten immunhistologische Färbungen an 16 klarzelligen Nierenzellkarzinomen 222 GSF peritumorale Lymphfollikel Normales Nierengewebe Abb.1: Histologische Übersicht des Nierenzellkarzinoms von Patient 26. Rot gefärbt (APAAP-Methode) sind CD8-positive Zellen. Deutlich sind die peritumoralen follikelartigen Lymphozyten-Ansammlungen zu sehen. durch und konzentrierten uns dabei auf die Tumor-charakteristische Morphologie, die Verteilung des lymphozytären Infiltrats innerhalb der histologisch unterschiedlichen Bereiche des Tumors und die Zusammensetzung des lymphozytären Infiltrats. Zur Quantifizierung der Lymphozyten-Subpopulationen isolierten wir TIL aus frischem Tumorgewebe und charakterisierten diese mittels Dreifarben-Immunfluoreszenz (FACS-Analyse). Weiterhin untersuchten wir die Expression funktionsrelevanter Proteine, wie der T-Zell-Rezeptor-assoziierten (TCR)-zeta-Kette und des zytotoxischen Effektormoleküls Perforin. Die TCR-zetaKette ist für die Weiterleitung des über den TCR empfangenen antigenspezifischen Signals verantwortlich. Eine verminderte oder fehlende Expression der TCR-zetaKette wurde bei verschiedenen malignen Erkrankungen, hauptsächlich Leukämien, aber auch einigen soliden Tumoren beobachtet und wird als ein zentraler Immunevasionsmechanismus diskutiert. Perforin ist das zentrale Effektormolekül zytotoxischer MHC-Klasse I-restringierter T-Lymphozyten und natürlicher Killer (NK)-Zellen. Die Immunhistologie zeigte, dass das Nierenzellkarzinom von einer ausgeprägten fibrinösen „Pseudo-Kapsel“ vom Normalgewebe separiert ist (Abb. 1). Auch das Tumorparenchym ist regelmäßig von Bindegewebssepten durchzogen, die oftmals einen direkten Kontakt der infiltrierenden Lymphozyten mit den Tumorzellen verhindern. Das lymphozytäre Infiltrat konzentrierte sich in der Kapsel und den Septen, während das Tumorparenchym spärlich infiltriert war. Die bevorzugte Konzentrierung des Infiltrats in der Kapsel und den Septen könnte bedeuten, dass hier spezifische Rekrutierungsmechanismen zum Tragen kommen. Die Einwanderung der Lymphozyten ins Tumorparenchym könnte dadurch beeinträchtigt sein. Besonders ausgeprägt waren peritumoral (im Bereich des Normalnierengewebes) an die Bindegewebskapsel angelagerte Lymphozyten-Ansammlungen, die morphologisch eine den Keimzentren ähnliche Organisation (Follikel) zeigten (Abb. 1). Ob diese „Follikel“ eine spezielle Bedeutung haben, etwa als Initiationszentren einer antitumoralen Immunantwort, ist derzeit unklar. Phänotypische Charakterisierung des lymphozytären Infiltrats DIE INSTITUTE Charakteristische Morphologie des Nierenzellkarzinoms und Verteilung des lymphozytären Infiltrats Die CD3-positiven T-Lymphozyten exprimierten nahezu ausschließlich den -TZell-Rezeptor (TCR). TCR- positive TLymphozyten wurden extrem selten gefunden. Innerhalb des T-Zell-Infiltrats dominierten die CD8-positiven T-Zellen über die CD4-positiven T-Zellen. Die Unterrepräsentation von CD4-T-Zellen könnte ein Grund sein, warum sich eine CD8-T-Zell-vermittelte Immunreaktion gegen Tumorantigene nicht optimal entwickelt. Neben den T-Lymphozyten wurden in allen Proben auch CD3+/Perforin + (T-Zelle) CD3+/Perforin + (NK-Zelle) Abb. 2: Immunhistologische Fluoreszenzdoppelfärbung mit Antikörpern gegen CD3 (grün) und Perforin (rot). Im Großbild dargestellt sind CD3-positive T-Lymphozyten (grün), die überwiegend Perforin-negativ sind. Zwei T-Lymphozyten (Pfeile) zeigten schwache Färbung für Perforin (in der Überlagerung gelb gefärbt). Die diffuse Verteilung der Perforin-haltigen Granula bei T-Lymphozyten (Vergrößerung, oben) läßt vermuten, dass kein Antigen-spezifischer Kontakt mit Tumorzellen besteht. Unten dargestellt ist eine Perforin-positive, CD3-negative Zelle (NK-Zelle) mit polarer Anordnung der Perforin-Granula (rot). Zellkerne sind blau dargestellt. 223 GSF NK-Zellen in variabler Menge von 5% bis 40% (Mittelwert bei 18%) gefunden. Untersuchungen zum Effektorstatus des lymphozytären Infiltrats Um Aufschluss über den Effektorzustand der tumorinfiltrierenden Lymphozyten zu erhalten, wurden Färbungen mit Antikörpern gegen Perforin und der TCR-assoziierten Zeta-Kette durchgeführt. Bei allen untersuchten Proben war die TCR-zetaKette sowohl histologisch als auch mittels FACS-Analyse nachweisbar. Nur in Einzelfällen zeigte ein geringer Prozentsatz der T-Zellen einen Verlust der TCR-zeta-Kette. Auffällig dagegen war die geringe Zahl an Perforin-positiven Zellen. Bei den wenigen Perforin-positiven T-Lymphozyten ließ die diffuse Verteilung der Perforin-haltigen Granula vermuten, dass diese T-Lymphozyten nicht in zytotoxischem Kontakt mit Tumorzellen stehen (Abb. 2). NK-Zellen waren in der Mehrzahl positiv für Perforin, und die polare Ausrichtung der PerforinGranula könnte auf zytotoxischen Kontakt mit Zielzellen hindeuten. Da aber die benachbarten Tumorzellen keine Anzeichen von Apoptose zeigten, ist anzunehmen, dass auch die Effektorfunktion der NK-Zellen inhibiert ist. Bedeutung der Befunde für die Immuntherapie des Nierenzellkarzinoms i) Die Untersuchungen zeigten, dass das Nierenzellkarzinom von potenziell zytotoxischen Lymphozyten (T-Zellen und NK-Zellen) infiltriert ist. Das Fehlen von Perforin bei den T-Lymphozyten könnte auf eine Dysfunktion in situ hinweisen, die durch eine aktive Suppression oder alternativ durch Erschöpfung der T-Zellen nach permanentem Kontakt mit Tumorzellen entsteht. Inwieweit auch eine unzureichende Hilfe z. B. durch zu wenige oder unzureichend aktivierte CD4-positive T-Zellen die Dysfunktion der CD8-T-Zellen in situ erklären könnte, muss noch geklärt werden. 224 GSF ii) Im Gegensatz zu den T-Lymphozyten exprimierten tumorinfiltrierende NKZellen Perforin. Dennoch zeigten sie direkt nach Isolierung aus Tumorgewebe keine oder nur schwache zytotoxische Aktivität. Aus unseren In-vitro-Untersuchungen wissen wir, dass CD8-T-Zellen und NK-Zellen ex vivo durch Kultivierung in IL-2-haltigem Medium zytotoxische Aktivität gewinnen können. In der klinischen Situation könnte die Applikation von IL-2 für die Wiederbelebung der funktionellen Kapazität der CD8+ CTL relevant sein. iii) T-Lymphozyten, die den -TCR exprimierten, wurden nur sehr selten gefunden. Da -T-Zellen möglicherweise eine sehr wichtige T-Zell-Populationen für die antitumorale Immunabwehr sind, könnte eine Rekrutierung von T-Zellen im Rahmen von Impfstrategien Bedeutung haben. Suizid-Gentherapie beim Hund als Modell für adoptive Immuntherapie beim Menschen M. Weber, H. Adler, W. Günther, H.-J. Kolb Die allogene Stammzelltransplantation ist heute in der Behandlung von zahlreichen hämatologischen Erkrankungen, z.B. von akuten und chronischen Leukämien, Lymphomen sowie Myelomen, etabliert. Der Erfolg der allogenen im Vergleich zur autologen Transplantation ist in erster Linie auf den durch die Spender-Lymphozyten vermittelten sog. „Graft-versus-Leukemia“ – Effekt (GvL) zurückzuführen. Die SpenderLymphozyten verursachen jedoch auch eine Reihe von Komplikationen, die den therapeutischen Nutzen teilweise stark beeinträchtigen. Dazu gehören lebensbedrohliche Infektionen und „Graft versus Host Disease“ (GvHD). GvHD kann durch die Depletion von T-Zellen aus dem Transplantat weitgehend verhindert werden. Nachteile der T-ZellDepletion sind ein höheres Abstoßungs- A DIE INSTITUTE nicht-toxischen Substanz, da nur sie zur Umwandlung in die toxische Form in der Lage sind. Alle anderen Zellen werden von der Substanz nicht beeinträchtigt. Das gegenwärtig am besten charakterisierte Suizid-Gen ist das Herpes-simplexVirus-Thymidin-Kinase-Gen (HSV-TK), welches bereits in ersten klinischen Studien eingesetzt wurde. HSV-TK kann die Substanz Ganciclovir in eine nicht-toxische Zwischensubstanz, ein Monophosphat, umwandeln. Dazu sind zelleigene Kinasen nicht in der Lage. Die zelleigenen Kinasen wandeln anschließend das Ganciclovirmonophosphat in die Triphosphat-Form um. Das Ganciclovirtriphosphat wird bei der zellulären DNA-Synthese anstelle des normalerweise verwendeten Thymidintri- und Infektionsrisiko sowie eine höhere Rate des Wiederauftretens der Grunderkrankung. Das Rezidiv kann durch erneute Infusion von Spenderlymphozyten (Donor Lymphocyte Infusion [DLI]) behandelt werden, womit das Risiko schwerer GvHD verbunden sein kann. Deshalb wäre eine Möglichkeit, durch gezielte Ausschaltung der Spender-Lymphozyten die GvHD zu behandeln, von großem Vorteil. Das kann durch das Einbringen eines Suizid-Gens in die Spender-Lymphozyten erreicht werden. Ein Suizid-Gen kodiert für ein Protein, welches in der Lage ist (in den modifizierten Zellen) eine nicht-toxische Substanz in eine toxische Form umzuwandeln. Demzufolge werden Zellen, die das Suizid-Gen exprimieren, empfindlich gegenüber der B 64 KnochenmarkTransplantation Events M1 Spender Empfänger Blut HSV-Tk Selektion 0 100 425 TK 425 Ko 70000 60000 50000 cpm 102 103 104 D 80000 40000 30000 20000 10000 0 GCV (µg/ml) 0 0,01 0,1 1 10 100 % transduzierte Zellen im Blut C 101 4 3,5 transduzierte Zellen 3 2,5 2 1,5 1 0,5 0 1 2 3 4 5 6 7 14 21 28 35 56 115 227 Abb. 3: Nachweis der Persistenz der Gen-modifizierten Zellen: Nach einer allogenen Knochenmarktransplantation wurden dem Spender T-Lymphozyten entnommen und mit dem Suizidgen transduziert (A). Die Gen-modifizierten Zellen wurden auf über 95% Reinheit angereichert (B) und auf ihre Empfindlichkeit gegenüber Ganciclovir getestet (C). 80 Tage nach der Transplantation wurden die T-Zellen dem Knochenmarkempfänger transfundiert. Die Persistenz der Zellen im peripheren Blut wurde mittels FACS-Analyse nachgewiesen (D). 225 GSF phosphats in die DNA eingebaut. Dies führt in Folge zu einem Abbruch der DNA-Synthese und letztendlich zum Zelltod. Obwohl die HSV-TK bereits bei einigen Patienten klinisch angewandt wurde, sind viele Fragen noch offen. Da durch die Beantwortung dieser Fragen Gefährdungen des Patienten ausgeschlossen werden können, sollen sie im Versuch an einem Tier modellartig beantwortet werden. Zur Entwicklung der Stammzell-Transplantation haben sich Versuche beim Hund bestens bewährt; Methoden der Organ-, Knochenmark- und Stammzell-Transplantation wurden bis zur klinischen Reife gebracht. Für die Untersuchungen zum Einsatz der HSV-TK als Suizidgen werden zwei Gruppen von Spender-Empfänger-Kombinationen ausgewählt: In der ersten Gruppe DLA-haploidentischer Empfänger mit DLAhomozygoten Spendern soll geprüft werden, ob die Transfusion der Gen-modifizierten Zellen zum Auftreten einer ähnlich schweren GvHD wie die unmodifizierter Zellen führen kann. Danach soll untersucht werden, ob und bis zu welchem Zeitpunkt die GvHD durch die Gabe von Ganciclovir erfolgreich therapiert werden kann. In der zweiten Gruppe bei DLA-identischen Spen- der-Empfänger-Kombinationen tritt keine GvHD auf, wenn die Lymphozyten-Infusion erst 60 Tage nach der T-Zell-depletierten Transplantation erfolgt. Dieser Ansatz ermöglicht die Untersuchung der Verteilung, der Funktion und der Überlebensrate der transfundierten Zellen sowie die Untersuchung einer potenziell auftretenden Immunreaktion seitens des Empfängers gegen die Gen-modifizierten Spender-Zellen. In unseren Untersuchungen haben wir HSV-TK-modifizierte T-Zellen beim Hund eingesetzt (Abb. 3). Das Ziel unserer Arbeiten ist es, den Einsatz der HSV-TK beim Hunde soweit zu entwickeln, dass die gegenwärtig noch bestehenden Probleme gelöst werden können und eine breite klinische Anwendung möglich wird. Wir konnten zeigen, dass die Funktion von mit HSV-TK modifizierten T-Zellen in vitro erhalten bleibt und dass diese Zellen Ganciclovir-sensitiv sind. Es gelang ebenfalls, aus den modifizierten T-Zellen zytotoxische Zellen zu generieren, ohne dass diese ihre Spezifität und Funktion verloren. In ersten In-vivoExperimenten konnten wir zeigen, dass die Gen-modifizierten Zellen im lebenden Organismus überleben und über einen längeren Zeitraum im Blut nachzuweisen sind. Zusammenarbeit Ausgewählte Veröffentlichungen Sechs Mitarbeiter des Instituts sind am Lehrbetrieb der Ludwig-Maximilians-Universität beteiligt. Die Institutsleiterin ist Koordinatorin des HGF-Programms „Infektion und Immunität“ für die GSF und stellvertretende Sprecherin eines DFG-Sonderforschungsbereichs (SFB 455). Noessner, E.*, Gastpar, R.*, Milani, V.*, Brandl, A., Hutzler, P.J.S., Kuppner, M.C., Roos, M., Kremmer, E., Asea, A., Calderwood, S.K. and Issels, R.D.: Tumorderived heat shock protein 70-peptide complexes are cross-presented by human dendritic cells. J. Immunol. 169: 5424–5432 (2002). (* shared first authorship). Es bestehen direkte Kooperationen mit verschiedenen HGF-Zentren (DKFZ und MDC). Darüber hinaus bestehen Kooperationen mit der Urologischen Klinik und Poliklinik der Ludwig-Maximilians-Universität München, dem Institut für Experimentelle Onkologie und Therapieforschung der Technischen Universität München, sowie der Universität Tübingen, Institut für Zellbiologie, Abt. Immunologie (Dr. S. Stevanovic, Prof. Rammensee). Die Arbeiten des Instituts werden mit Drittmitteln der DFG, der Wilhelm-Sander-Stiftung, des BMBF und der HGF gefördert. Beisel, C., Imhof, A., Greene, J., Kremmer, E., Sauer, F.: Histone methylation by the Drosophila epigenetic transcriptional regulator Ash1. Nature, 419: 857–862 (2002). Kronenberger, K., Dieckmann, A., Selmayr, M., Strehl, J., Wahl, U., Lindhofer, H., Kraal, G. und Mocikat, R.: Impact of the lymphoma idiotype on in vivo tumor protection in a vaccination model based on targeting antigens to antigen-presenting cells. Blood 99: 1327–1331 (2002). Falk, C.S., Noessner, E., Weiss, E.H. and Schendel, D.J.: Retaliation against tumor cells showing aberrant HLA expression using lymphokine activated killer (LAK)derived T cells. Cancer Res. 62(2): 480–487 (2002). Schleuning, M., Stoetzer, O., Waterhouse, C., Schlemmer, M., Ledderose, G., Kolb, H.J.: Hematopoietic stem cell transplantation after reduced-intensity conditioning as treatment of sickle cell disease. Exp Hematol: 30(1): 7–10 (2002). 226 GSF