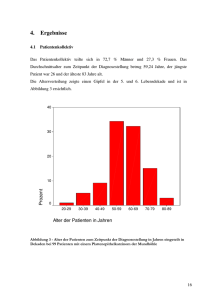
Die MHC-Klasse-I-Allelfrequenz bei Patienten mit einem
Werbung

Aus der Medizinischen Klinik 5 für Hämatologie und Internistische Onkologie der Friedrich-Alexander Universität Erlangen-Nürnberg Direktor: Prof. Dr. med. Andreas Mackensen Die MHC-Klasse-I-Allelfrequenz bei Patienten mit einem Plattenepithelkarzinom der Mundhöhle Inaugural-Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Katrin Kunkel aus Aschaffenburg Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. med. J. Schüttler Referent: Priv.-Doz. Dr. med. B. Spriewald Korreferent: Priv.-Doz. Dr. med. Dr. med. dent. E. Nkenke Tag der mündlichen Prüfung: 29.06.2011 Inhaltsverzeichnis 1. Zusammenfassung Seite 1 1.1 Deutsche Zusammenfassung Seite 1 1.2 English Summary Seite 2 Hintergrund und Ziele Seite 4 2.1 Das Plattenepithelkarzinom der Mundhöhle Seite 4 2.2 Das HLA-System Seite 12 2.3 HLA und Krebs Seite 15 2.4 Ziele der Arbeit Seite 18 Material und Methoden Seite 19 2. 3. 3.1 Patienten und Kontrollkollektiv Seite 19 3.2 DNA-Isolierung Seite 19 3.3 Gelelektrophorese Seite 20 3.4 HLA-Klasse-I-Genotypisierung Seite 21 3.4.1 Das Prinzip Seite 21 3.4.2 Geräte und Material Seite 21 3.4.3 Testdurchführung Seite 22 3.4.4 Bedienung des LabScan 100 Flow-Analyzers Seite 23 3.4.5 Probenauswertung am Computer Seite 24 3.5 Statistik 4. Ergebnisse und Beobachtungen 4.1 Patientencharakteristika Seite 25 Seite 26 Seite 26 4.1.1 Alters- und Geschlechtsverteilung der Patienten Seite 26 4.1.2 Alters- und Geschlechtsverteilung der Kontrollen Seite 28 4.1.3 Tumorart und Tumorstadium bei Erstdiagnose Seite 30 4.1.4 Lokalisation des Tumors Seite 31 4.2 Die HLA-Klasse-I-Genotypisierung Seite 32 4.2.1 Die HLA-A-Genotypisierung Seite 32 4.2.2 Die HLA-B-Genotypisierung Seite 34 5. Diskussion Seite 37 6. Literaturverzeichnis Seite 42 7. Abkürzungen Seite 48 8. Danksagung Seite 50 9. Lebenslauf Seite 51 1 1. Zusammenfassung 1.1 Deutsche Zusammenfassung Hintergrund und Ziele: Das Plattenepithelkarzinom gehört mit seinen Hauptrisikofaktoren Alkohol und Nikotin zu den am häufigsten vorkommenden Tumoren der Mundhöhle. Da dieser Tumor lange symptomlos bleibt, wird er meist erst spät entdeckt und hat somit eine relativ schlechte Prognose. Aus diesem Grund ist es von Bedeutung, die bisherigen Therapiemöglichkeiten durch zellvermittelte immuntherapeutische Konzepte zu ergänzen und somit hoffentlich die Prognose der Patienten zu verbessern. Ein besonderes Augenmerk liegt dabei auf der Entwicklung von Impfstoffen mit tumorspezifischen Antigenen. Da die Tumorvakzine im Kontext von einzelnen HLA-Antigenen präsentiert wird, ist die Kenntnis der HLA-Antigenfrequenzen für die Entwicklung einer solchen Vakzine von großer Bedeutung. In der vorliegenden Arbeit wurde daher die Allelelfrequenz der HLA-Klasse-I-Gene HLA-A und -B in einem Kollektiv von Patienten mit einem oralen Plattenepithelkarzinom untersucht und mit gesunden Kontrollen verglichen. Insbesondere sollte festgestellt werden, ob Unterschiede bezüglich der Häufigkeit für das Antigen HLA-A*02 bestehen, da im weiterem Verlauf eine Impfung mit HLA-A*02 restringiertem Tumorantigen vorgesehen ist. Darüber hinaus wollten wir untersuchen, ob es Hinweise für eine Assoziation zwischen bestimmten HLA-Allelen und einem Plattenepithelkarzinom der Mundhöhle gibt. Methoden: Zunächst wurden 114 Patienten mit einem Mundhöhlenkarzinom bezüglich ihres Alters, Geschlechts, der Tumorart, dem Tumorstadium sowie der Lokalisation des Tumors charakterisiert. Für die 114 Patienten und 200 gesunden Kontrollen wurde eine Genotypisierung für die HLA-Klasse-I Loci HLA-A und HLA-B durchgeführt und die Allelfrequenzen beider Gruppen miteinander verglichen. Ergebnisse und Beobachtungen: Mit Hinblick auf Alter, Geschlecht, Tumorart und Lokalisation des Tumors stimmten die Charakteristika unseres Patientenkollektivs mit den in der Literatur Beschriebenen überein. HLA-A*02 zeigte sich in der Patientengruppe im Gegensatz zur Kontrollgruppe leicht unterrepräsentiert, mit einer Odds Ratio (OR) von 0,65 (0,41-1,04; CI 95%). HLAA*23 mit OR=3,8 (1,39-10,43; CI 95%), HLA-A*24 mit OR=1,53 (0,85-2,75; CI 2 95%) und deren serologische Hauptgruppe HLA-A9 mit OR=1,87 (1,09-3,2; CI 95%) traten dagegen in der Patientengruppe vermehrt auf. Als Nebenbefund zeigte sich, dass HLA-B*07 mit OR=0,61 (0,36-1,04, CI 95%) in der Patientengruppe etwas seltener vertreten war als bei den Kontrollen. Praktische Schlussfolgerung: Die Ergebnisse unserer Studie zeigen, dass HLAA*02 und -B*07 bei Patienten mit einem Plattenepithelkarzinom der Mundhöhle im Gegensatz zur gesunden Bevölkerung unterrepräsentiert zu sein scheinen. Somit könnte den beiden HLA-Molekülen die Bedeutung eines protektiven Allels zukommen. Weiterhin deuten unsere Ergebnisse eine Assoziation des HLA-A*23, -A*24 und -A9 mit der Erkrankung eines Plattenepithelkarzinoms der Mundhöhle an. Die Absicherung unserer Befunde im Hinblick auf statistische Signifikanz, sowie deren Bedeutung für die Entwicklung weiterer Immuntherapien, soll Gegenstand weiterer Untersuchungen sein. 1.2 English Summary Background and objectives: The squamous cell carcinoma with its main risk factors alcohol and nicotine belongs to the most common tumours in the oral cavity. Due to the fact that the tumour does not show any symptoms for a long time, the diagnosis is usually made late and therefore it has a relatively poor prognosis. For this reason it seems important to enhance the existing therapeutic concepts. One possibility would be to use cell-mediated immunotherapy in order to increase the outcome for these patients. An important strategy is to develop vaccines with tumour specific antigens. The tumour vaccine will be presented in the context of specific HLA antigens. For this reason the knowledge of the respective HLA allele frequency is important for the development of tumour vaccines. In the present study we therefore investigated the allele frequency for the MHC class I genes HLA-A and -B in a cohort of patients suffering from a squamous cell carcinoma of the oral cavity. The data were compared to a cohort of healthy controls. We were interested whether differences in the frequency of HLAA*02 could be observed, since a vaccination trial using an HLA-A*02 restricted vaccine is planned. In addition we analysed whether indications for an association between certain HLA antigens and the occurrence of a squamous cell carcinoma of the oral cavity could be observed. 3 Methods: 114 patients with an oral squamous cell carcinoma have been characterised according to age, gender, and the type, stage and localisation of the tumour. Genotyping for the HLA class-I loci HLA-A and HLA-B was carried out for the 114 patients and 200 healthy controls and the allele frequencies in both groups were compared. Results and observations: With regard to age, gender, type and localisation of the tumour the characteristics of our patients matched those described in the literature. HLA-A*02 was underrepresented within our patients group compared to the control group, with an Odds Ratio (OR) of 0,65 (0,41-1,04; CI 95%). The incidence of HLA-A*23 with OR=3,8 (1,39-10,43; CI 95%), HLA-A*24 with OR=1,53 (0,85-2,75; CI 95%) and their serological broad antigen HLA-A9 with OR=1,87 (1,09-3,2; CI 95%) was higher within the patient group. An additional finding showed that the frequency of HLA-B*07 with OR=0,61 (0,36-1,04, CI 95%) was lower within the patient group compared to healthy controls. Conclusion: The results of our study indicate that HLA-A*02 and -B*07 seem to be underrepresented among patients with a squamous cell carcinoma of the oral cavity compared to healthy controls. Therefore these antigens might represent protective alleles. Moreover, our results suggest an association between the HLAA*23, -A*24, their serological broad antigen HLA-A9 and the occurrence of a squamous cell carcinoma of the oral cavity. To assure our theses in terms of statistical significance as well as its importance for the development of further immune therapies, our assumptions should be used for more intensive researches. 4 2. Hintergrund und Ziele 2.1 Das Plattenepithelkarzinom der Mundhöhle Das Plattenepithelkarzinom stellt mit einer Inzidenz von etwa 80% den am häufigsten vorkommenden malignen Tumor der Mundhöhle dar. An allen Tumorerkrankungen haben die Karzinome der Mundhöhle einen Anteil von 2 bis 4 %. [12, 16] Morphologisch äußert sich das Plattenepithelkarzinom der Mundhöhle zumeist durch ein Ulkus, das durch eine durch den Tumor hervorgerufene Zerstörung des Oberflächenepithels entsteht und als das typische und führende Leitsymptom dieses malignen Tumors gilt. Das Ulkus zeichnet sich oberflächlich durch eine höckerige Struktur und weißliche Fibrinbeläge aus, bei deren Abtragung es zu Blutungen aus dem Tumor kommen kann. Abbildung 1: Plattenepithelkarzinom des Mundbodens [3] Weiterhin kennzeichnet diese Tumorart ein aufgeworfener Randwall, der häufig entzündet und geschwollen erscheint. Bei fortgeschrittenem Tumorstadium finden sich oft Infiltrationen des benachbarten Gewebes sowie Nekrosen. Die 5 Infiltrationen können dabei auch den umliegenden Knochen betreffen und zur Osteolyse führen. [12, 14, 16] Im Hinblick auf das Tumorwachstum lässt sich beim Plattenepithelkarzinom der Mundhöhle das exophytische vom endophytischen Wachstum unterscheiden. Bei ersterem wächst der Tumor eher über das Niveau der Schleimhaut hinaus. Das endophytische Wachstum zeichnet sich dagegen durch eine kraterförmig in die Tiefe gerichtete Tumormasse aus. [14, 16] Abbildung 2: exophytisches Wachstum [14] Abbildung 3: endophytisches Wachstum [14] 6 Das Plattenepithelkarzinom kann in nahezu allen Bereichen der Mundhöhle auftreten. Zu seinen Hauptlokalisationen zählen das hintere Drittel der Zunge sowie der laterale Zungenrand, der Alveolarfortsatz, der Mundboden, die Unterlippe, die Wange und der Gaumen. [12] Zu den bedeutendsten Risikofaktoren für die Entstehung eines Plattenepithelkarzinoms der Mundhöhle zählen der erhöhte Alkohol- und Nikotinkonsum, wobei meist der Konsum beider Noxen für die Tumorpatienten typisch ist. Außerdem wird in einigen Studien beschrieben, dass eine Infektion mit dem humanen Papillomavirus das Risiko, an einem Plattenepithelkarzinom zu erkranken, erhöhen kann. [25, 45] Daneben können auch eine schlechte Mundhygiene sowie chronische Reizungen, die zum Beispiel durch überstehende Kronen- oder Füllungsränder hervorgerufen werden, für die Tumorentstehung mit verantwortlich sein. Bei einem Zusammenwirken mehrerer der genannten Faktoren kann das Risiko für die Entstehung eines Plattenepithelkarzinoms um ein Vielfaches erhöht werden. [16, 43, 6, 23, 36, 34] Aufgrund ihres eher langsamen Wachstums bleiben Mundhöhlenkarzinome meist lange symptomlos und werden erst bei auftretenden Tumorbeschwerden von den Patienten wahrgenommen. Nur in sehr seltenen Fällen werden im Rahmen einer allgemeinen Untersuchung Tumoranzeichen vom Arzt entdeckt und näher untersucht. Hierbei sollte auch der oralen Leukoplakie, die als Vorstufe eines malignen Tumors der Mundhöhle gelten kann, besondere Beachtung geschenkt werden. Unter einer Leukoplakie versteht man weißliche, nicht abwischbare Veränderungen der Mundschleimhaut, die bei längerem Bestehen durch eine Biopsie genauer untersucht werden sollten, um eine maligne Entartung ausschließen zu können. [16, 27, 46, 4] 7 Abbildung 4: homogene Leukoplakie [12] Zu der speziellen Symptomatik der Mundhöhlenkarzinome zählen Einschränkungen der Mundöffnung oder Zungenbeweglichkeit sowie Ulzerationen und Nekrosen, die mit Blutungen oder Entzündungszeichen einhergehen können. Des Weiteren kann es zu Zahnlockerungen aufgrund einer Osteolyse oder zu Zahnverschiebungen und Änderung des Prothesensitzes kommen, welche durch Knochenauftreibungen verursacht werden können. Auch Weichteilschwellungen, Schluckstörungen oder erschwertes Sprechen und Atmen zählen zu den speziellen Tumorsymptomen. [16, 14] Die Metastasierung der Mundhöhlenkarzinome erfolgt meist lymphogen und betrifft in der Regel die drainierenden Halslymphknoten, wobei sowohl ipsilaterale als auch kontralaterale Metastasen beobachtet werden. Sind bereits Metastasen vorhanden, erscheinen die betroffenen Lymphknoten geschwollen und können getastet werden. Bei der Entstehung von Fernmetastasen können sich je nach deren Lokalisation spezielle klinische Folgen zeigen. [16, 14] Besteht der Verdacht auf ein Plattenepithelkarzinom der Mundhöhle, sollte nach einer Basisdiagnostik, welche eine ausführliche Anamnese und klinische Untersuchung beinhaltet, unterstützt durch entsprechende bildgebende Verfahren, zur Diagnosesicherung eine Biopsie durchgeführt werden. Ein länger als drei Wochen bestehendes Ulkus sowie eine nicht abheilende Extraktionswunde gelten hierbei als besonders tumorverdächtig und bedürfen einer definitiven Abklärung. 8 Wird die Verdachtsdiagnose bestätigt, erfolgt anschließend das Staging des Plattenepithelkarzinoms der Mundhöhle, um den Tumor in Bezug auf seine Ausdehnung und dem Vorhandensein von Lymphknoten- bzw. Fernmetastasen zu beschreiben. Diese Klassifizierung der Union Contre le Cancer (UICC) ist als TNM-System bekannt und umfasst folgende Kriterien: T Lokale Tumorausdehnung Tis Carcinoma in situ T0 Kein Primärtumor vorhanden T1 Tumorgröße bis maximal 2 cm T2 Tumorgröße zwischen 2,1 und 4 cm T3 Tumorgröße größer als 4 cm T4 Tumor infiltriert unabhängig von seiner Größe Nachbarstrukturen Tx Primärtumor nicht bestimmbar N Regionale Metastasierung in Lymphknoten N0 Keine regionalen Lymphknotenmetastasen nachweisbar N1 Ein solitärer, ipsilateraler Lymphknoten kleiner als 3 cm N2 Drei Subtypen: N2a Lymphknotenmanifestation ipsilateral solitär zwischen 3 und 6 cm N2b Lymphknotenmanifestation ipsilateral multipel, keine Lymphknoten größer als 6 cm N2c Bilaterale oder kontralaterale Lymphknotenmanifestation, kein Lymphknoten größer als 6 cm N3 Lymphknotenmetastase größer als 6 cm unabhängig von der Seitenlokalisation Nx Regionale Lymphknoten nicht beurteilbar M Vorliegen von Fernmetastasen M0 Keine Fernmetastase M1 Fernmetastase vorhanden Mx Vorhandensein bzw. Fehlen von Fernmetastasen kann nicht beurteilt werden 9 C Diagnostischer Sicherheitsfaktor C1 Diagnostisches Standardverfahren (einschließlich konventioneller Röntgenaufnahmen) C2 Spezielle diagnostische Maßnahmen (CT, MRT, Biopsie) C3 Chirurgische Exploration C4 Untersuchungsbefund beim definitiven Eingriff (einschließlich kompletter Aufarbeitung des Resektionspräparates) C5 Autopsie Tabelle 1: TNM-Klassifikation beim Plattenepithelkarzinom [12, 39] Das Staging ist ausschlaggebend für Therapie und Prognose. Der Certainty-Index (diagnostischer Sicherheitsfaktor) wurde zur Angabe der Genauigkeit der Diagnostik eingeführt. [16, 39] Die TNM-Klassifikation kann durch pathologische Befunde ergänzt werden. Diese Klassifikation mit der Tumorformel pTNM stützt sich auf die Beurteilung der Tumorausdehnung und dem Vorhandensein von Lymphknoten- und Fernmetastasen nach histopathologischer Aufarbeitung und erhöht somit die Sicherheit der Diagnose. [16] Nach den Vorgaben der UICC lassen sich nach der TNM-Klassifikation die Karzinome der Lippen und der Mundhöhle außerdem in fünf verschiedene Stadien einteilen: Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium II T2 N0 M0 Stadium III T1, T2 N1 M0 T3 N0, N1 M0 T1, T2, T3 N2 M0 T4a N0, N1, N2 M0 Stadium IVA 10 Stadium IVB Stadium IVC jedes T N3 M0 T4b Jedes N M0 jedes T jedes N M1 Tabelle 2: UICC-Klassifikation [49] Um die Klassifikation eines Plattenepithelkarzinoms zu vervollständigen, bedarf es vor der Therapie auch einer histopathologischen Differenzierung des Tumors, dem so genannten Grading. Dieses wird mit dem G-System beschrieben, welches sich wie folgt darstellt: G1 Gut differenzierter Tumor G2 Mäßig differenzierter Tumor G3 Schlecht differenzierter Tumor G4 Undifferenzierter / entdifferenzierter / anaplastischer Tumor Tabelle 3: Grading beim Plattenepithelkarzinom [13] Bei der Therapie der Mundhöhlenkarzinome kann man zunächst zwischen einem kurativen und einem palliativen Therapieansatz unterscheiden. Das Ziel der kurativen Therapie ist die Heilung der Tumorkrankheit und somit die Genesung des Patienten. Hierzu muss der Tumor durch Ausräumung und Zerstörung aller Tumorzellen vollständig entfernt werden. Gleichzeitig sollte durch Wiederherstellung von Form und Funktion anatomischer Strukturen die Lebensqualität des Patienten bewahrt werden. [14] Ist die Tumorheilung durch Entfernung aller Tumorzellen von Anfang an nicht mehr möglich, sollte die Schmerzlinderung, die körperliche Kräftigung sowie die psychologische Betreuung des Patienten im Zentrum der Behandlung stehen. Man spricht in diesem Fall von einer palliativen Therapie. [14] Grundsätzlich ist die kurative Therapie der Wahl bei einem Plattenepithelkarzinom der Mundhöhle eine radikale Operation mit anschließender Rekonstruktion. Kurativ operabel sind in der Regel die Stadien I-III (T1-T3). Der Tumor wird hierbei zumeist zusammen mit den angrenzenden Lymphknoten entfernt. Die 11 Entfernung der Lymphknoten bezeichnet man als neck dissection. Bei der neck dissection unterscheidet man zwischen einer radikalen und einer konservativen Form. Während bei der radikalen Lymphknotenentfernung der musculus sternocleidomastoideus, die vena jugularis und der nervus accessorius mit entfernt werden, versucht man diese anatomischen Strukturen bei der konservativen Form primär zu erhalten. Bei inoperablen fortgeschrittenen Tumoren erfolgt zur Verbesserung der Prognose eine Bestrahlung des Tumorgebietes eventuell in weiterer Kombination mit einer Chemotherapie. Beides kann sowohl prä- als auch postoperativ erfolgen und mindert zusätzlich die Wahrscheinlichkeit des Auftretens von Lokalrezidiven. [12] Die Prognose von Plattenepithelkarzinomen ist zum einen abhängig von tumorassoziierten Faktoren, zu denen die Größe des Tumors, die Infiltrationstiefe und der Lymphknotenstatus Überlebenswahrscheinlichkeit gehören. des Patienten Zum aber anderen auch wird durch die nicht tumorassoziierte Faktoren wie Mangelernährung oder zusätzliche Erkrankungen bestimmt, die den Allgemeinzustand des Patienten negativ beeinflussen können. Abgesehen von diesen prognostisch relevanten Faktoren bestimmt vor allem die Operabilität des Tumors das Patientenschicksal. So zeigt sich bei operablen Tumoren eine 5-Jahres-Überlebenswahrscheinlichkeit von 40 bis 60 % während sie bei nicht operablen nur 10 bis 15 % beträgt. [12, 33] Zusammenfassend lässt sich sagen, dass die Prognose bei einem Plattenepithelkarzinom der Mundhöhle im Wesentlichen von der Größe abhängt, die der Tumor bei der Primärdiagnose aufweist. Aus diesem Grund kommt der Früherkennung eine sehr große Bedeutung zu. Je früher das Karzinom erkannt wird, desto besser ist die Lebenserwartung für den Patienten. Nicht abheilende Ulzerationen oder Extraktionswunden, unbegründete Zahnlockerungen, sowie Schleimhautveränderungen sind daher besonders zu beachten und histologisch abzuklären. [1, 40, 12] Trotz verfeinerter Therapiekonzepte hat das Plattenepithelkarzinom weiterhin eine schlechte Prognose. Die geringe Überlebensrate resultiert aus häufig auftretenden lokoregionalen Rezidiven oder daraus resultierenden Fernmetastasen, für deren Erkennen sensitive und spezifische Marker fehlen. Das Auftreten von Rezidiven erklärt sich aus dem Zurückbleiben von versteckten residualen malignen Zellen in Randbereichen des Tumors. Das Entstehen von Fernmetastasen dagegen kommt 12 dadurch zustande, dass sich Zellen aus dem Tumorverband lösen und sich anschließend über das Blut und die Lymphe verteilen. Man spricht hierbei von der minimalen Resterkrankung (MRD = minimal residual disease). Meistens befinden sich die Tumorzellen hierbei in der Ruhephase des Zellzyklus (G0-Phase), was die eingeschränkte Wirkung systemischer Chemotherapien gegen diese Zellen erklärt. [18, 31, 32, 47, 11] Aus diesem Grund ist es notwendig, eine Ergänzung bisher bekannter Therapiekonzepte des Plattenepithelkarzioms der Mundhöhle durch Antikörperund Immuntherapien anzustreben. Deswegen wurde an der Zahn-, Mund- und Kieferklinik der Universität Erlangen die spontane T-Zell-Reaktivität gegen Cancer/Testis-Antigene (CTA) beim Platteneptithelkarziom der Mundhöhle in einer ebenso benannten Studie untersucht. Ziel der Studie war es, eine spontane antigenspezifische CD8+-T-Zell-Antwort gegen CTA, die vom Plattenepithelkarziom exprimiert werden können, nachzuweisen. Die Antigene werden hierbei von HLA-Klasse-I-Molekülen den T-Zellen präsentiert. 2.2 Das HLA-System Der Haupthistokompatibilitätskomplex (engl.: major histocompatibility complex, MHC) wurde erstmals in Transplantationsexperimente den wusste 50er man, Jahren dass entdeckt. Durch frühere Gewebetransplantate vom empfangenden Organismus als immunologisch fremd erkannt und zerstört werden können. Die Ursache hierfür ist eine immunologische Reaktion gegen die unterschiedlichen Transplantationsantigene, in denen sich Spender und Empfänger unterscheiden. Diese Antigene bezeichnet man als Haupthistokompatibilitätsantigene. Sie sind innerhalb des MHC kodiert und spielen eine wichtige Rolle bei der immunologischen Unterscheidung von Selbst und Nicht-Selbst für den Organismus. [48] Die Antigene des menschlichen MHC werden als HLA (Humanes LeukozytenAntigen) bezeichnet, da diese Antigene erstmals auf den weißen Blutkörperchen verschiedener Individuen entdeckt wurden. Die physiologische Rolle der HLA ist ihre Funktion als antigenpräsentierende Moleküle, ohne die eine spezifische Immunantwort gegen Infektionserreger nicht möglich wäre. Darüber hinaus können sie bei der Zell-, Gewebs- oder Organtransplantation zwischen nicht-HLA- 13 identischen Individuen eine Abstoßungsreaktion hervorrufen. Dies erklärt die klinische Relevanz des HLA-Systems, da das Transplantatüberleben davon abhängt, wie gut Spender und Empfänger in Bezug auf ihre HLA-Moleküle zusammenpassen. Des Weiteren gibt es mehrere Krankheiten, die eine Assoziation mit bestimmten HLA-Molekülen aufzeigen, wodurch Rückschlüsse auf das Krankheitsrisiko gezogen werden können. [48, 19] Die Gene des HLA-Komplexes sind auf dem kurzen Arm des menschlichen Chromosoms 6 lokalisiert. Dieser Genabschnitt weist einen außerordentlichen Polymorphismus auf. Alle Gene des menschlichen MHC-Komplexes werden gleichberechtigt vom väterlichen oder mütterlichen Chromosom, also kodominant, exprimiert. Die allelische Variabilität ist so groß, dass die Wahrscheinlichkeit, dass zwei nicht verwandte Individuen einen identischen Satz von MHC-Produkten aufweisen, sehr gering ist. [38, 24, 41, 48] Aufgrund von Struktur- und Funktionsunterschieden lassen sich die auf dem MHC kodierten HLA-Antigene in zwei Klassen einteilen: HLA-Klasse-I und HLAKlasse-II. Bei den HLA-Klasse-I-Molekülen kann man drei verschiedene Typen unterscheiden: HLA-A, -B und -C. Sie bestehen aus einer schweren polymorphen α-Kette und einer nicht-polymorphen leichten Kette, dem β2-Mikroglobulin. Die α-Kette, die im Gegensatz zur β-Untereinheit in der Zellmembran verankert ist, besteht aus drei extrazellulären Domänen (α1, α2, α3). Die α1- und α2-Domäne bilden die Peptidbindungsfurche, die an den Enden geschlossen ist. So können im Komplex mit HLA-I Peptide mit einer Länge von 8-10 Aminosäuren präsentiert werden. Die Domäne α3 ist eine Immunglobulindomäne und besitzt eine Bindungsstelle für CD8. [38, 48, 19] Die HLA-Klasse-II-Moleküle hingegen heißen HLA-DR, HLA-DP und HLA-DQ. Sie bestehen aus einer membranverankerten α- und β-Kette, die miteinander assoziiert sind. Beide Ketten besitzen zwei extrazelluläre Domänen (α1, α2 und β1, β2). Die α1- und β1-Domäne bilden zusammen die Peptidbindungsfurche, die an den Enden offen ist. Dies gewährleistet, dass längere Peptide von 12–25 Aminosäuren gebunden werden können. Auf der β2-Domäne findet sich die Bindungsstelle für CD4. [38, 48] 14 Abbildung 5: Aufbau der HLA-Klasse-I- und -II-Komplexe [48] HLA-Klasse-I- und -II-Moleküle besitzen zum einen eine ausgeprägte Homologie ihrer DNA- und Proteinsequenzen, zum anderen findet sich eine allelische Variabilität innerhalb der hypervariablen Regionen, welche die Proteinbindungsfurche oder die Bindungsstelle für den T-Zell-Rezeptor bilden. So wird gewährleistet, dass sämtliche zu präsentierende Proteinfragmente trotz struktureller Unterschiede effektiv an die Antigenbindungsstelle der HLAMoleküle binden können und damit sichergestellt, dass die HLA-Moleküle in ihrer Funktion der antigenabhängigen T-Lymphozytenaktivierung wirksam sein können. [48] Die Funktion der HLA-Moleküle besteht in der Präsentation von Proteinfragmenten verschiedener Antigene, welche die Reifung und Funktion der T-Lymphozyten steuert. Die T-Lymphozyten erkennen die Antigene mittels des TZell-Rezeptors nur dann, wenn diese als Proteinfragmente an HLA-Moleküle gebunden sind. Diese Erkennung der Antigene wird durch den ternären Komplex vermittelt, der aus HLA-Molekül, prozessiertem und an das eigene (Selbst-) HLAMolekül gebundenem Antigen und T-Zell-Rezeptor besteht. Somit können die TLymphozyten nicht nur das Antigen erkennen, sondern auch zwischen Selbst- und Nicht-Selbst-HLA-Molekülen differenzieren. Die von HLA-Klasse-II präsentierten Antigene werden von CD4+-T-Helferzellen erkannt, während CD8+- 15 zytotoxische T-Lymphozyten Antigene nur erkennen, wenn diese von HLAKlasse-I-Molekülen präsentiert werden. Die meisten von HLA-I-Molekülen präsentierten Peptide kommen aus der Prozessierung von Proteinen, die sich intrazellulär meistens im Zytoplasma, aber auch im Zellkern befinden. Klasse-IIMoleküle exponieren dagegen durch Degradation im Phagolysosom entstandene Peptide. [48] Die unterschiedliche Funktion der HLA-Klassen kommt auch durch eine ebenso differenzierte Genexpression zum Ausdruck. HLA-Klasse-I-Moleküle sind auf nahezu allen kernhaltigen Zellen exprimiert, mit Ausnahme von neuronalen Zellen im Gehirn, Trophoblastenzellen der Plazenta und den Spermien. Die Expression von HLA-Klasse-II-Molekülen ist meist auf Zelltypen beschränkt, die als antigenpräsentierende Zellen an der spezifischen Immunantwort beteiligt sind. Hierzu gehören zum einen B-Lymphozyten und aktivierte T-Lymphozyten, zum anderen Zellen des mononukleären phagozytischen Systems, dendritische Zellen, Langerhanszellen der Haut, Mikroglia u.a. . [48] 2.3 HLA und Krebs Wie auch in unserer Studie, stellt man sich in Wissenschaft und Forschung immer wieder die Frage, ob es einen Zusammenhang zwischen bestimmten HLAMolekülen und Krebserkrankungen gibt. Hierzu vergleicht man an Krebs erkrankte Patienten mit gesunden Kontrollen im Hinblick auf das Auftreten von HLA-Spezifitäten. Ist im Vergleich der beiden Gruppen das Auftreten eines bestimmten HLA-Moleküls erhöht bzw. erniedrigt, liegt eine positive bzw. negative Assoziation vor. Dieser Vergleich erlaubt dann eine Risikoeinschätzung. Aufgrund der zentralen Bedeutung der HLA-Antigene für die spezifische Immunantwort haben mehrere Studien untersucht, ob eine Assoziation von HLAAntigenen mit malignen Erkrankungen besteht. Insbesondere für Malignome, bei deren Entstehung eine infektiöse Genese gezeigt oder vermutet wurde, konnte gezeigt werden, dass bestimmte HLA-Antigene mit der Erkrankung assoziiert sind. Wu et al. untersuchten, ob bestimmte HLA-Klasse-II-Antigene mit einem erhöhten oder erniedrigten Risiko für die Entstehung von Gebärmutterhalskrebs durch eine Infektion mit dem humanen Papillomavirus (HPV) in Verbindung gebracht 16 werden können. Um dies zu prüfen, wurde bei 133 Frauen mit Gebärmutterhalskrebs sowie bei einer Kontrollgruppe von 98 Gesunden eine HLA-Typisierung durchgeführt. Die Ergebnisse zeigten, dass die Frequenz für HLA-DPB1*1301 bei den Patientinnen mit Gebärmutterhalskrebs deutlich höher war als in der Kontrollgruppe, wodurch dieses Allel mit einem erhöhten Risiko für die Entstehung dieser Art von Krebs bei chinesischen Frauen in Verbindung gebracht werden kann. Die Haplotypen HLA-DPB1*150101-DQB1*0602 und DRB1*070101-DQB1*0201 dagegen kamen bei der Kontrollgruppe häufiger vor und sprechen somit für ein verringertes Risiko. Es konnte durch diese Studie gezeigt werden, dass bestimmte HLA-Klasse-II-Allele und Haplotypen die Immunantwort auf bestimmte HPV-kodierte Epitope und somit das Risiko von Gebärmutterhalskrebs bei chinesischen Frauen beeinflussen können. [50] Eine bakterielle Infektion mit Helicobacter pylori ist eine der häufigsten bekannten Infektionen, die in Zusammenhang mit einem erhöhten Risiko für die Entstehung von Magenkrebs stehen. Ob ebenfalls ein Zusammenhang mit dem Polymorphismus der HLA-Antigene besteht wurde in einer Studie in Linqu County in China untersucht. Hierzu wurden 52 Patienten mit Magenkrebs und eine Kontrollgruppe mit 139 gesunden Personen bezüglich ihrer HLA-Klasse-I- und II-Antigene typisiert. Es zeigte sich vor allem bei den HLA-Allelen CW*03 und DRB1*01 eine sehr unterschiedliche Verteilung zwischen den Magenkrebspatienten und der Kontrollgruppe. Beide Allele waren ausschließlich bei den Patienten mit Magenkrebs vorhanden, wobei die Manifestation hier bei den Krebspatienten mit Helicobacter pylori stärker war als bei jenen ohne. Zusammenfassend zeigte die Studie, dass das Tragen der beiden HLA-Allele CW*03 und DRB1*01 mit einem erhöhten Magenkrebsrisiko einhergeht und dies vor allem bei Patienten, bei denen Helicobacter pylori nachgewiesen werden konnte. [22] El-Chennawi et al. beschäftigten sich mit der Assoziation zwischen den HLAKlasse-II-Antigenen DRB1 und DQB1 und der Entstehung von Leberzellkarzinomen (HCC) bei Ägyptern. Neben Umwelt-, Ernährungs- und Lifestyle-Einflüssen, gehören vor allem HBV- und HCV-Infektionen, Leberzirrhose, das männliche Geschlecht sowie hohes Alter zu den wichtigsten Risikofaktoren bei der Entstehung von Leberzellkarzinomen. Ob die HLA- KlasseII-Antigene DRB1 und DQB1 ebenfalls als Risikofaktoren bei der HCC- 17 Entwicklung anzusehen sind, untersuchte man wie folgt: Bei 50 Patienten mit HCC zwischen 40 und 64 Jahren und 50 gesunden Kontrollpersonen wurde eine HLA-Klasse-II-Typisierung durchgeführt. Die Ergebnisse zeigten ein erhöhtes Auftreten von DRB1*04 und DQB1*02 bei Patienten mit einem Leberzellkarzinom sowie ein erhöhtes Auftreten von DQB1*06 bei der Kontrollgruppe. Somit ergibt sich, dass die Allele DRB1*04 und DQB1*02 Risikofaktoren für die Entstehung von Leberzellkarzinomen darstellen, während DQB1*06 zu den schützenden Allelen gehört. [8] Aber auch für Malignome, die nicht im Verdacht stehen einen infektiösen Auslöser zu haben, sind solche Assoziationen gezeigt worden. In einer Studie zur genetischen Prädisposition von Brustkrebs am General Hospital von Massachusetts gingen Subhra et al. davon aus, dass das Immunsystem eine schützende Rolle bei der Tumorentstehung spielen könnte und untersuchten, ob es einen Zusammenhang zwischen dem Vorhandensein bestimmter schützender Allele der HLA-Klasse-II-Gene und der Entstehung von Brustkrebs gibt. Hierzu wurden 176 Frauen unter 40 Jahren, die sich in einem frühen Stadium von Brustkrebs befanden, im Hinblick auf die HLA-Klasse-II-Antigene DPB1, DQB1, DRB1 und DRB3 typisiert. Die Kontrollgruppe umfasste 215 gesunde Kaukasier. Das Ergebnis ergab, dass sowohl HLA-DQB 03032 als auch HLA-DRB1*11 wesentlich häufiger bei der Kontrollgruppe gefunden wurde als bei den Brustkrebspatienten. Diese deutliche Überrepräsentation konnte zeigen, dass diesen beiden Allelen wohl eine protektive Rolle bei der Entstehung von Brustkrebs zugesprochen werden kann. [44] Eine mögliche Erklärung für diese Assoziationen könnte die unterschiedliche Effektivität der jeweiligen HLA-Antigene sein, das entsprechende Tumorantigen zu präsentieren und so eine Immunantwort gegen den Tumor zu induzieren. Weiterhin ist die Kenntnis der MHC-Genfrequenzen für geplante Immuntherapien gegen Krebs von Bedeutung (Vakzine). In der bereits erwähnten Studie der Zahn-, Mund- und Kieferklinik (ZMK) der Universität Erlangen hat man zur Steigerung der Überlebensrate beim Plattenepithelkarzinom der Mundhöhle zellvermittelte Immuntherapien erforscht. Hierbei wurde untersucht, ob Cancer/Testis-Antigene (CTA), die vom Plattenepithelkarzinom exprimiert werden, CD8+-T-Zellreaktionen auslösen können. 18 Ausgangspunkt hierbei waren bereits vorhandene Studien der dermatologischen Klinik in Bezug auf das maligne Melanom. Hier ist es bereits gelungen eine Tumorvakzination, das heißt eine Induktion und Vermehrung tumorspezifischer TZellen, durchzuführen. Durch Zellexperimente hat man herausgefunden, dass dendritische Zellen, in die ein bestimmtes tumorassoziiertes Antigen eingebracht wurde, als möglicher Impfstoff gegen den Tumor eingesetzt werden können. [37] Als Grundstein zukünftiger Vakzinationstherapien beim Plattenepithelkarzinom der Mundhöhle untersuchte man in der ZMK Erlangen nun spontane zellulärzytotoxische Immunantworten speziell gegen CTA, sowie deren Expressionshäufigkeit in Primärtumoren bei Patienten mit unterschiedlichem HLA-Hintergrund. Hierbei wurden zunächst nur HLA-A*02 positive Patienten untersucht, da dieses Allel in der kaukasischen Bevölkerung Europas mit ca. 50% am häufigsten vorkommt und bereits zahlreiche HLA-A*02 restringierte Epitope in der Literatur beschrieben sind. Bei der HLA-Typisierung zeigte sich nun, dass bei den Patienten mit einem Plattenepithelkarzinom der Mundhöhle das HLA-A*02-Molekül im Gegensatz zur Bevölkerung ohne Plattenepithelkarzinom deutlich unterrepräsentiert war, was uns zu unserer Studie veranlasste. 2.4 Ziele der Arbeit Wir untersuchten in der vorliegenden Arbeit ein Kollektiv von 114 Patienten mit einem Plattenepithelkarzinom der Mundhöhle hinsichtlich der Genfrequenzen der HLA-Klasse-I-Gene HLA-A und -B. Die Allelfrequenzen der Patienten verglichen wir mit einem Kontrollkollektiv von 200 gesunden Thrombozytenspendern. Zum einen wollten wir herausfinden, ob Unterschiede bezüglich der Häufigkeit des Antigens HLA-A*02 bestehen, da eine Impfung mit Tumorantigenen bei HLA-A*02 positiven Patienten in weiterem Verlauf vorgesehen ist. Zum anderen wollten wir untersuchen, ob es möglicherweise eine Assoziation zwischen den HLA-Allelen und einem Plattenepithelkarzinom der Mundhöhle gibt und den Allelen somit die Rolle eines protektiven oder eines SuszeptibilitätsFaktors zugesprochen werden kann. 19 3. Material und Methoden 3.1 Patienten und Kontrollkollektiv In unserer Studie wurde bei 114 Patienten mit einem Plattenepithelkarzinom der Mundhöhle eine HLA-Typisierung in Bezug auf die HLA-Klasse-I-Gene HLA-A und HLA-B durchgeführt. Die Lokalisation der Plattenepithelkarzinome variierte typischerweise zwischen Zunge, Mundboden, Alveolarkamm, Wange, Gaumen und Speicheldrüsen, war aber ausschließlich auf die Mundhöhle beschränkt. Die Informationen zum Alter der Patienten, der Tumorart, dem Tumorstadium bei Erstdiagnose und der Lokalisation des Tumors wurden aus den Patientenakten im Archiv der Zahn-, Mund- und Kieferklinik der Universität Erlangen entnommen. Die Blutentnahme für die Typisierung erfolgte im Rahmen der von der Ethikkommission genehmigten Studie der ZMK Erlangen nach Aufklärung und schriftlichem Einverständnis. Die Kontrollgruppe bestand aus 200 gesunden kaukasischen Thrombozytenspendern, bei denen ebenfalls eine HLA-Typisierung durchgeführt wurde. Anschließend wurden die Ergebnisse mit denen der Patientengruppe verglichen. 3.2 DNA- Isolierung Aus dem peripheren Blut der Patienten- und Kontrollgruppe wurde die DNA mittels affinitätschromatographischer Isolierung mit dem Extraktionskit der Firma Quiagen extrahiert. Hierbei wurden 20 µl Quiagen-Protease mit 200 µl Blutprobe und 200 µl Puffer AL in ein 1,5 ml Eppendorfröhrchen pipettiert, 15 sek vermischt und dann für zehn Minuten bei 56° C inkubiert. Nach kurzem Abzentrifugieren wurden anschließend 200 µl 96%-Ethanol hinzugegeben, 15 sek vermischt und abzentrifugiert. Die Lösung wurde nun in ein 2 ml Säulchen mit Sammelröhrchen (spin column) pipettiert und bei 8000 U/min eine Minute lang zentrifugiert. Hierbei wurde die DNA an die Säulchenmembran gebunden. Das Säulchen wurde im Folgenden in ein neues 2 ml Sammelröhrchen umgesetzt, 500 µl Puffer AW 1 zugegeben und bei 8000 U/min für eine Minute zentrifugiert. Dieser Vorgang 20 wurde im Anschluss allerdings unter Zugabe von 500 µl Puffer AW 2 und bei 15000 U/min für drei Minuten wiederholt. Die Säulchen wurden nun in ein 1,5 ml Eppendorfröhrchen umgesetzt, 200 µl Puffer AE hinzupipettiert und bei Raumtemperatur eine Minute lang inkubiert. Nach nochmaligem Zentrifugieren bei 8000 U/min für eine Minute war der Vorgang abgeschlossen. Das gewonnene Lysat war die DNA. Die Ausbeute bei dieser DNA-Extraktionsmethode ist sehr variabel, wodurch man keine pauschalen Angaben über die gewonnene DNA-Menge treffen kann. Aus diesem Grund wurden die Reinheit und Konzentration der DNA-Proben im Weiteren spektralphotometrisch überprüft. Hierfür wurde angenommen, dass eine optische Dichte (OD) von 1 bei einer Wellenlänge von 258 nm einer DNAKonzentration von 50µg DNA/ml entspricht. Wird die gewünschte Reinheit und Konzentration der DNA, die für die Analyse erforderlich ist, nicht erreicht, ist eine erneute Isolation aus der Rückstellprobe oder die Anforderung von neuem Material erforderlich. 3.3 Gelelektrophorese Die Agarosegelelektrophorese ist ein klassischer Weg zur Trennung von DNAFragmenten nach deren Größe. Die jeweiligen Genabschnitte der zu typisierenden MHC und Zytokinen wurden zunächst mittels Polymerasekettenreaktion (PCR) amplifiziert. Um diese beurteilen zu können, wurden sie auf ein horizontales 2 % Agarose Gel aufgetragen und elektrophoretisch (230 mV; 130 mA) für 40 Minuten aufgetrennt. Anschließend wurde das Gel mit Ethidium-Bromid gefärbt und unter UV-Licht visuell ausgewertet. Die Auswertung erfolgte hierbei durch Beurteilung der Anwesenheit der Kontrollbanden bzw. der spezifischen Banden. Um ein PCRProdukt als spezifisch zu werten, muss es im Vergleich zu dem mitgeführten Längenstandard auf der zu erwartenden Höhe laufen. Die positiven Banden wurden in die Interpretationstabelle unter Berücksichtigung der Übereinstimmung des angegebenen Molekulargewichtes übertragen, wodurch die einzelnen Allele abgelesen und somit nachgewiesen werden konnten. 21 3.4 HLA-Klasse-I-Genotypisierung Die Typisierung der HLA-Klasse-I-Antigene wurde auf „Low-resolutionAuflösung“ mit Hilfe von Durchfluss-zytometrischer Technik durchgeführt (LABType, Luminex). 3.4.1 Das Prinzip LABType verwendet die Luminex-Technologie für die reverse SSO DNATypisierungsmethode. Zunächst erfolgt die Amplifizierung der Ziel-DNA unter Verwendung eines gruppenspezifischen Primers. Das biotinylierte PCR-Produkt kann mit R-Phycoerithrin-konjugiertem (PE) Streptavidin (SAPE) nachgewiesen werden. Es folgt die Denaturierung des PCR-Produktes, welches anschließend an komplementären, sequenzspezifischen Oligonukleotid-Sonden, die mit floureszenzkodierten Mikrosphären (Beads) konjugiert sind, rehybridisiert werden kann. Der LabScan 100 Flow-Analyser identifiziert die Fluroeszenzintensität von PE auf jedem einzelnen Bead. Die HLA-Typisierung erfolgt durch den Vergleich von Reaktionsmustern mit Mustern, die mit veröffentlichten HLA-Gensequenzen assoziiert werden. Wie viele Beads verwendet werden ist abhängig von dem untersuchenden Genort und dessen polymorpher Struktur. Um Hintergrundsignale auszuschließen und mögliche Abweichungen bei der Probenmenge und Reaktionseffizienz zu berücksichtigen, umfasst jede Bead-Mischung eine Negativund eine Positivkontrollsonde. Die Auswertung ist computerunterstützt und HLAAllel- und Lot-spezifisch. 3.4.2 Geräte und Material Folgende Geräte und Materialien wurden verwendet: • LABType SSO DNA Typisierungssystem für HLA-Klasse-I-Allele (A, B, Cw) der Firma BMT • LabScan 100 Flow-Analyzer • SAPE Stammlösung • Taq-Polymerase • PCR Maschine und Reaktionsröhrchen 22 • Gelelektrophorese und Geldokumentationssystem • Whirlmixer • Platten-Zentrifuge • Uniplatte, 96 Well, 250 µl Mikroplatte • Tray-Versiegelung • Eppendorfreaktionsröhrchen 1,5 ml • Eppendorf Multipipette und Pipetten verschiedener Volumina 3.4.3 Testdurchführung Der Test wurde nach chargenspezifischer Arbeitsanleitung durchgeführt. PCR Als Ausgangsmaterial dienten 20 ng/µl DNA (Ratio: 1,65–1,8). Für eine DNAProbe wurden 4 µl Primer, 13,8 µl D-Mix und 0,2 µl Taq-Polymerase vermischt und als Mastermix vorgelegt. 18 µl des Mastermixes wurden mit 2 µl DNA in PCR-Tubes pipettiert und folgendermaßen amplifiziert: 96° C 3 Minuten 5 Zyklen: [96° C - 20 sek/ 60° C - 20 sek/ 72° C - 20 sek] 30 Zyklen: [96° C - 10 sek/ 60° C - 15 sek/ 72° C - 20 sek] 72° C-10 min 4° C unendlich Im Anschluss wurde das Vorhandensein des PCR-Produktes mit Hilfe einer Gelelektrophorese bestätigt. Denaturierung/ Neutralisation Zur Denaturierung wurden 5 µl der amplifizierten DNA auf eine 96-well-Platte übertragen. Nach der Zugabe von 2,5 µl Denaturierungspuffer pro well wurde die Platte versiegelt, gevortext und für zehn Minuten bei Raumtemperatur inkubiert. Anschließend wurden 5 µl Neutralisationspuffer pro well hinzugegeben, versiegelt, gevortext und die Platte im Anschluss auf Eis gestellt. 23 Hybridisierung Die benötigte Beadmischung wurde als Mastermix pro Genort vorpipettiert. Pro vorbehandeltem PCR-Produkt sind 34 µl Hybridisierungspuffer und 4 µl BeadMischung erforderlich. Nach der Zugabe der Beadmischung wurde das PCR Rack mit einem Deckel oder einer Folie verschlossen, auf dem Vortexer gut vermischt und anschließend für 15 Minuten bei 60° C in der PCR Maschine hybridisiert. Nach der Hybridisierung wurden pro well 100 µl Waschpuffer zugegeben, mit Folie abgedeckt, gevortext und 5 Minuten bei 900-1000 g zentrifugiert. Dieser Waschvorgang wurde anschließend noch zweimal wiederholt. Färbung Pro DNA-Ansatz wurden 50 µl einer 1x SAPE-Lösung (0,5 µl SAPE plus 49,5 µl SAPE-Puffer) hinzugegeben, verschlossen, gevortext und für weitere 5 Minuten bei 60° C in der PCR-Maschine inkubiert. Anschließend wurden pro well 100 µl Waschpuffer zugegeben, das Ganze wiederum verschlossen, gevortext und 5 Minuten bei 900-1000g zentrifugiert. Für die Messung wurden nun 70 µl Waschpuffer eingefüllt, vorsichtig gemischt und das Reaktionsvolumen in eine spezielle Messplatte (ELISA-Spitzboden) überführt. Bis zur Messung wurde die Platte im Kühlschrank bei 4° C aufbewahrt. Vor der endgültigen Messung wurde die Platte nochmals vorsichtig gemischt. 3.4.4 Bedienung des LabScan 100 Flow-Analyzers Nach dem Anschalten der Puffer-Reservoir-Pumpe, des LabScan 100 und des Lasers wurde das Programm Luminex 100 IS geöffnet. Nach einem 30 minütigen Warm- up begann man mit „Prime“, wenn das Gerät auf Stand-by stand. Es folgte dreimal der „Alkohol-Flush“. Die Luftblasen wurden aus dem System entfernt. Anschließend wurde durch „Wash“ und „Eject“ das Ethanol im Reservoir des Plattentisches gegen Sheath-Fluid ausgetauscht und weitere drei Waschvorgänge durchgeführt. Das Gerät war nun bereit für die Testung. 24 Nach der Eingabe der Proben und der vollständigen Auftragsverteilung in der Multibatch Maske konnten die Messungen beginnen. Für die ersten Schritte wurde „Single-step“ angewählt, um das optimale Arbeiten des Gerätes zu garantieren und den Auftrag gegebenenfalls sofort stoppen zu können. Mit „Resume“ wurde der Messvorgang jeweils fortgesetzt. Folgten die Messungen ohne Probleme konnte der „Single-step“ herausgenommen werden. Am Ende der Messung wurde das gesamte System über „Wash“ zweimal mit Sheath-Fluid gespült. Im Anschluss wurde über „Santizise“ und „Eject“ das Reservoir geleert und mit 3 % Hypochlorid befüllt. Anschließend wurde das Gerät mittels der Programme „Soak“ und „Wash“ gereinigt. 3.4.5 Probenauswertung am Computer Nach dem Aufrufen des Programms „HLA-Tools“ mussten die Roh-Daten zum Analysieren aus dem Flow-Analyzer über „Tools-Explorer“ in das Auswertungsprogramm geladen und mit dem entsprechenden „Template“ und der zugehörigen Lot-Nummer und der aktuellsten Revision des Tests überarbeitet werden. Zur Auswertung wurden zunächst das kitinterne Negativkontroll-Bead (Bead Nr.35) und gegebenenfalls Positivkontroll-Beads (Klasse-I-Bead 13 und 32, Klasse-II-Bead 34) auf ihre Richtigkeit überprüft. Die Reaktionsstärke der Positivkontrolle sollte hierbei über 1000 FI (= Fluoreszens Intesity) liegen. Das Negativkontroll-Bead musste unter dem definierten Cutoff liegen. Hatten die Kontrollen nicht korrekt reagiert, durfte keine Auswertung stattfinden. Der Test musste in diesem Fall wiederholt werden. Wenn die Kontrollen im Referenzbereich lagen, wurden die einzelnen Patienten analysiert. Mit der Funktion „Matched“ konnte man nachvollziehen, welches Bead für welches vorgeschlagene Allel reagiert hatte. Die Reaktionsstärke jedes einzelnen Beads konnte über die Funktion „BeadAnalysis“ abgefragt werden. Über die Funktion „Type/Subtype“ wurde das endgültige Typisierungsergebnis angezeigt. 25 3.5 Statistik In unserer Arbeit wurden die statistischen Berechnungen mit der Software SPSS Version 11,0 (SPSS Inc., Chicago, IL, USA) durchgeführt. Der Vergleich der Genfrequenzen zwischen der Patientengruppe und dem Kontrollkollektiv erfolgte mit einem nach Yates korrigierten Chi-Quadrat Test. Ein nicht korrigierter p-Wert von pu< 0,05 wurde als signifikant gewertet. Die p-Werte wurden anschließend mit der Bonferroni Methode durch Multiplikation dieser mit der Anzahl der beobachteten Allele korrigiert (pk). Die Berechnung der Odds Ratio (OR) erfolgte mit einem Konfidenzintervall (CI) von 95%. 26 4. Ergebnisse und Beobachtungen 4.1 Patientencharakteristika 4.1.1 Alters- und Geschlechtsverteilung der Patienten Für unsere Studie wurden 114 Patienten mit einem Karzinom der Mundhöhle untersucht. 90 Anzahl der Patienten 80 70 60 50 82 40 30 20 32 10 0 Frauen Männer Abbildung 6: Geschlechtsverteilung der Tumorpatienten mit N = 114 Unter den Tumorpatienten befanden sich 32 Frauen (28,1 %) und 82 Männer (71,9 %). Dies entspricht einem Verhältnis männlich zu weiblich von 2,6:1. 27 45 Anzahl der Patienten 40 39 35 36 30 25 20 19 15 13 10 5 0 4 3 30-39 40-49 50-59 60-69 70-79 80-89 Alter der Patienten Abbildung 7: Altersverteilung der Patienten mit N = 114 Der Median des Alters der Patienten lag bei 58 Jahren, wobei der jüngste Patient bei Erstdiagnose 33 und der Älteste 89 Jahre alt war. In der Altersgruppe zwischen 30 und 39 Jahren gab es drei Patienten (2,6 %), in der Gruppe zwischen 40 und 49 Jahren 19 Patienten (16,7 %), in der Gruppe zwischen 50 und 59 Jahren 39 Patienten (34,2 %), in der Gruppe zwischen 60 und 69 Jahren 36 Patienten (31,6 %), in der Gruppe zwischen 70 und 79 Jahren 13 Patienten (11,4 %) und in der Gruppe zwischen 80 und 89 Jahren 4 Patienten (3,5 %) Somit fiel bei knapp zwei Dritteln (65,8 %) der Patienten die Erstdiagnose in die 5. und 6. Lebensdekade. 28 4.1.2 Alters- und Geschlechtsverteilung der Kontrollen Die Kontrollgruppe unserer Studie umfasste 200 Thrombozytenspender. 140 Anzahl der Kontrollen 120 100 80 117 60 83 40 20 0 Frauen Männer Abbildung 8: Geschlechtsverteilung der Kontrollgruppe mit N = 200 Unter den 200 Kontrollen waren 83 Frauen (41,5 %) und 117 Männer (58,5 %) Dies entspricht einem Verhältnis männlich zu weiblich von 1,4:1. 29 A nzahl der K ontrollen 140 126 120 100 80 60 49 40 22 20 2 1 50-59 60-69 0 20-29 30-39 40-49 Alter der Kontrollen Abbildung 9: Altersverteilung der Kontrollgruppe mit N = 200 Der Median des Alters der Kontrollgruppe lag bei 29 Jahren, wobei der Jüngste 20 und der Älteste 62 Jahre alt war. In der Altersgruppe zwischen 20 und 29 Jahren gab es 49 Personen (24,5 %), in der Gruppe zwischen 30 und 39 Jahren 126 Personen (63 %), in der Gruppe zwischen 40 und 49 Jahren 22 Personen (11 %), in der Gruppe zwischen 50 und 59 Jahren 2 Personen (1 %) und in der Gruppe zwischen 60 und 69 Jahren 1 Person (0,5 %). Somit war der Großteil der Personen der Kontrollgruppe (63 %) zwischen 30 und 39 Jahre alt. 30 4.1.3 Tumorart und Tumorstadium bei Erstdiagnose Bei 111 der Tumorpatienten (ca. 97,3 %) war ein Plattenepithelkarzinom diagnostiziert worden. Jeweils ein Patient litt unter einem adenoidzystischen Karzinom (ca. 0,9 %), einem Ackermann-Tumor (ca. 0,9 %) und einem mikrozystischen Adnex-Karzinom (ca. 0,9 %). 45 39 Anzahl der Patienten 40 33 35 30 22 25 20 12 15 10 5 4 1 2 1 UICC IVB UICC IVC nicht bekannt 0 UICC 0 UICC I UICC II UICC III UICC IVA UICC- Stadium Abbildung 10: Einteilung der Patienten anhand der UICC-Stadien Anhand der vorliegenden TNM-Klassifikation bei Erstdiagnose ließen sich 4 Patienten dem UICC-Stadium 0 (ca. 3,5 %) zuordnen, 33 dem Stadium I (ca. 28,9 %), 22 dem Stadium II (ca. 19,3 %), 12 dem Stadium III (ca. 10,5 %), 39 dem Stadium IV A (ca. 34,2 %), ein Patient dem Stadium IV B (ca. 0,9 %) und zwei dem Stadium IV C (ca. 1,8 %). Bei einem Patienten konnte zu dem UICCStadium keine Angaben gemacht werden (ca. 0,9 %). Bei der Einteilung nach dem Differenzierungsgrad des Tumors (Grading) konnten 19 Patienten dem Grad G1 (ca. 16,7 %), 50 Patienten dem Grad G2 (ca. 43,9 %) und 16 Patienten dem Grad G3 (ca. 14 %) zugeteilt werden. Bei 25 der Tumorpatienten wurde zu dem Differenzierungsgrad keine Angabe gemacht (ca. 31 21,9 %). Bei weiteren vier Patienten zeigte der Tumor bei Erstdiagnose ein nicht invasives Wachstum (ca. 3,5 %). 4.1.4 Lokalisation des Tumors andere 9 2 Oberlippe 2 Anzahl der Patienten submandibulärer Bereich Unterlippe 3 Wange 3 Alveolarkamm 13 Mundboden + Zunge 10 Zungengrund 8 Zungenrand 21 Mundboden 43 0 10 20 30 40 50 Lokalisation Abbildung 11: Lokalisation des Tumors der Patienten Bei 43 der untersuchten Patienten (ca. 37,7 %) und somit am häufigsten war das Plattenepithelkarzinom am Mundboden lokalisiert. Bei 29 Patienten befand sich der Tumor im Bereich der Zunge, wobei man zwischen Zungenrand (21 Patienten: ca. 18,4 %) und Zungengrund bzw. -körper (8 Patienten: ca. 7 %) unterscheiden konnte. Sowohl der Mundboden als auch die Zunge waren bei 10 Patienten infiltriert (ca. 8,8 %). Des Weiteren fand sich das Karzinom bei 13 Patienten am 32 Alveolarkamm des Ober- bzw. Unterkiefers (ca. 11,4 %). Weitere Lokalisationen waren bei jeweils 3 Patienten (ca. 2,6 %) die Wange und die Unterlippe, bei jeweils 2 Patienten (ca. 1,75 %) die Oberlippe und der submandibuläre Bereich und bei jeweils einem Patienten (ca. 0,9 %) der harte Gaumen, die Tonsillenloge, der Oropharynx, das Vestibulum, der Unterkieferast, der Gaumenbogen, der sulcus glossoalveolaris, der Nasopharynx und der arcus palatoglossus und velum palatinum. 4.2 Die HLA-Klasse-I-Genotypisierung 4.2.1 Die HLA-A-Genotypisierung In der folgenden Tabelle sind die Genfrequenzen für die HLA-A-Gene der Patienten- und Kontrollgruppe gegenübergestellt. Für HLA-A*02 zeigte sich mit einer Odds Ratio (OR) von 0,65 (0,41–1,04; CI 95 %) ein vermindertes Auftreten bei den Patienten im Vergleich zur Kontrollgruppe. Für HLA-A*23 mit einer Odds Ratio von 3,8 (1,39–10,43; CI 95 %), HLA-A*24 mit einer Odds Ratio von 1,53 (0,85–2,75; CI 95 %) und deren serologischer Hauptgruppe HLA-A9 mit einer Odds Ratio von 1,87 (1,09–3,2; CI 95 %) zeigte sich dagegen ein vermehrter Nachweis der Allele bei der Patientengruppe. Patienten Kontrollen OR (95 % CI) N = 114 N = 200 n (%) n (%) A*01 34 (30) 46 (23) A*02 α 45 (40) 100 (50) A*03 31 (27) 59 (30) A*11 7 (6,1) 21 (11) A*23 β 12 (11) 6 (3) 3,8 (1,39–10,43) A*24 γ 25 (22) 31 (16) 1,53 (0,85–2,75) A9 δ 34 (30) 37 (19) 1,87 (1,09–3,2) HLA-A 0,65 (0,41–1,04) 33 Serologische Hauptgruppe von A*23 und A*24 A*25 10 (8,8) 10 (5) A*26 9 (7,9) 15 (7,5) A*34 0 (0) 0 (0) A*66 1 (0,9) 1 (0,5) A10 19 (17) 26 (13) A*29 7 (6,1) 7 (3,5) A*30 7 (6,1) 8 (4) A*31 9 (7,9) 11 (5,5) A*32 10 (8,8) 13 (6,5) A*33 0 (0) 2 (1) A*74 0 (0) 0 (0) A19 33 (29) 40 (20) A*36 0 (0) 0 (0) A*43 0 (0) 0 (0) A*68 7 (6,1) 2 (1) A*69 0 (0) 1 (0,5) A28 7 (6,1) 14 (7) A*80 0 (0) 0 (0) α: pu = 0,093; pk = n.s.; OR 0,65; 95 % CI 0,41–1,04 β: pu = 0,012; pk = n.s.; OR 3,8; 95 % CI 1,39–10,43 γ: pu = 0,201; pk = n.s.; OR 1,53; 95 % CI 0,85–2,75 δ: pu = 0,03; pk = n.s.; OR 1,87; 95 % CI 1,09–3,2 Tabelle 4: Allelfrequenzen von HLA-A der Patienten mit einem Karzinom der Mundhöhle und der gesunden Kontrollgruppe 34 4.2.2 Die HLA-B-Genotypisierung Die Genfrequenzen der HLA-B-Gene wurden ebenfalls zwischen der Patientengruppe und dem Kontrollkollektiv verglichen und sind in folgender Tabelle beschrieben. Lediglich bei dem Allel HLA-B*07 mit einer Odds Ratio von 0,61 (0,36–1,04, CI 95 %) zeigte sich ein vermindertes Auftreten des Allels bei der Patientengruppe im Vergleich zu den Kontrollen. Patienten Kontrollen N = 114 N = 200 n (%) n (%) B*07 ε 26 (23) 65 (33) B*08 20 (18) 32 (16) B*13 14 (12) 18 (9) B*18 11 (9,6) 19 (9,5) B*27 11 (9,6) 14 (7) B*35 19 (17) 30 (15) B*37 4 (3,5) 4 (2) B*38 5 (4,4) 11 (5,5) B*39 6 (5,3) 7 (3,5) B16 10 (8,8) 18 (9) B*40 12 (10,5) 29 (15) B*41 5 (4,4) 2 (1) B*42 / / B*44 31 (27) 44 (22) B*45 3 (2,6) 1 (0,5) B12 34 (30) 45 (23) B*46 / / OR (95 % CI) HLA-B 0,61(0,36–1,04) 35 B*47 1 (0,9) 2 (1) B*48 / / B*49 5 (4,4) 8 (4,0) B*50 2 (1,8) 3 (1,5) B21 6 (5,3) 11 (5,5) B5 10 (8,8) 23 (11,5) B*53 / 2 (1) B*54 / / B*55 3 (2,6) 5 (2,5) B*56 1 (0,9) 2 (1) B22 3 (2,6) 8 (4) B*57 8 (7) 12 (6) B*58 / 2 (1) B17 8 (7) 14 (7) B*59 / / B*60 / 24 (12) B*61 / 5 (2,5) B15 18 (16) 38 (19) B*64 / 1 (0,5) B*65 / / B14 8 (7) 7 (3,5) B*67 / / B*71 / / B*72 / / B70 / / B*73 / / B*78 / / B*81 / / 36 B*82 / / ε: pu = 0,091; pk = n.s.; OR 0,61; 95 % CI 0,36–1,04 Tabelle 5: Allelfrequenzen von HLA-B der Patienten mit einem Karzinom der Mundhöhle und der gesunden Kontrollgruppe 37 5. Diskussion In unserer Studie wurde bei 114 Patienten mit einem Plattenepithelkarzinom der Mundhöhle eine HLA-Klasse-I-Typisierung durchgeführt. Die Ergebnisse wurden mit den Genfrequenzen einer Kontrollgruppe verglichen, die 200 gesunde Thrombozytenspender umfasste. Der Anteil der Männer zeigte sich mit 71,9 % in der Gruppe der Patienten im Vergleich zu 58,9 % der Kontrollgruppe deutlich erhöht. Der hohe Männeranteil ist charakteristisch für das Plattenepithelkarzinom der Mundhöhle, welches bei Männern bis zu dreimal häufiger auftritt als beim weiblichen Geschlecht. [12, 2, 35] Ein Grund hierfür kann mit den Hauptrisikofaktoren Alkohol und Nikotin in Verbindung gebracht werden. So wurde in einer Studie über die Unterschiede zwischen männlichen und weiblichen Patienten mit einem Plattenepithelkarzinom der Mundhöhle ermittelt, dass die Rate der Patienten ohne Risikofaktoren bei den Frauen deutlich höher ausfiel. Bei den Männern waren es nur wenige, die weder Alkohol noch Nikotin konsumierten. [21] Die Erstdiagnose fiel bei über zwei Dritteln unserer Patienten in die 5. oder 6. Lebensdekade. Das mediane Erkrankungsalter lag bei 58 Jahren, was den Werten aus der Literatur entspricht. [12] Das mediane Alter der Kontrollgruppe, die sich überwiegend aus Blutspendern zusammensetzte, lag erwartungsgemäß niedriger. Der Median betrug hier 29 Jahre. In der Literatur wird das Plattenepithelkarzinom als der am häufigsten vorkommende Tumor der Mundhöhle beschrieben. Auch in unserer Studie wurde bei 97,3 % der Patienten der Mundhöhlentumor als Plattenepithelkarzinom diagnostiziert. Das Stadium des Tumors bei Erstdiagnose wurde in unserer Studie anhand der UICC-Kriterien eingeteilt. Hierbei zeigte sich der größte Gipfel im UICC-Stadium IVA mit 34,2 % der Patienten. Das ist am ehesten darauf zurückzuführen, dass die Früherkennung des Mundhöhlenkarzinoms weiterhin ein Problem darstellt. Gerade in den Anfangsstadien zeigt das Plattenepithelkarzinom der Mundhöhle häufig keine malignitätsverdächtigen Symptome, weshalb es meist erst spät entdeckt wird. [26] Somit sollte im Hinblick auf diese Problematik der speziellen Schulung von Medizin- und Zahnmedizinstudenten sowie der Sensibilisierung bereits approbierter Ärzte und Zahnärzte besondere Bedeutung beigemessen werden. [5] 38 Die Hauptlokalisation des Tumors unserer Patienten war mit 37,7 % der Mundboden. Auch die restlichen Lokalisationen wie Zunge, Alveolarkamm, Wange, Ober- und Unterlippe sowie der submandibuläre Bereich sind typisch für diese Tumorart. [12, 16] Da insbesondere bei fortgeschrittenen Tumorstadien die Prognose noch unbefriedigend ist, erforscht man derzeit in zahlreichen Ansätzen die Nutzung des Immunsystems zur Krebstherapie. Hierbei versucht man eine Bekämpfung bösartiger Tumorzellen durch die Immunzellen im Körper zu induzieren. Ein viel versprechender Ansatz für die Immuntherapie, der auch an der Zahn-, Mund- und Kieferklinik Erlangen untersucht wird, ist die Verwendung von Antigenen als Impfstoff, die möglichst nur vom Tumor, nicht aber von den übrigen Körperzellen gebildet werden. Hierbei werden die Tumorantigene in isolierte unreife dendritische Zellen des Patienten injiziert. Nach der Impfung des Patienten mit den beladenen Zellen, präsentieren diese das Tumorantigen über den MHC-Komplex an ihrer Oberfläche, wodurch eine zytotoxische T-Zell-Reaktion ausgelöst werden soll. [37] Neben dem malignen Melanom wurden bereits für das Pankreas- sowie das Prostatakarzinom Tumorantigene identifiziert, die von HLA-A*02 präsentiert werden und eine zytotoxische T-Zell-Antwort auslösen können. [20, 17] Erstmals beim malignen Melanom wurden Tumorantigene isoliert, die als MAGEAntigene beschrieben sind. Sie gehören zur Gruppe der Cancer/Testis-Antigene und werden mit Ausnahme der männlichen Keimdrüsen ausschließlich von malignen Zellen gebildet. Sie sind somit für Immuntherapien bestens geeignet und können sowohl von HLA-Klasse-I als auch von HLA-Klasse-II-Molekülen präsentiert werden. Eine Schädigung der Gonaden bei der Bekämpfung des Tumors ist nicht anzunehmen, da HLA-Moleküle in den männlichen Keimdrüsen nicht gebildet werden. Diese Antigene werden ebenfalls vom Plattenepithelkarzinom der Mundhöhle exprimiert. [29, 30,10] Somit hat man, wie bereits beschrieben, in Anlehnung an bereits vorliegende Forschungsergebnisse, in einer Studie der Zahn-, Mund- und Kieferklinik der Universität Erlangen zur Steigerung der Überlebensrate beim Plattenepithelkarzinom der Mundhöhle Grundlagen für eine Vakzinationstherapie erarbeitet. Bei diesen ersten Untersuchungen schien sich eine Unterrepräsentation des HLA-A*02-Antigens bei den Patienten mit einem Plattenepithelkarzinom der 39 Mundhöhle im Vergleich zur bekannten Genfrequenz in der gesunden Bevölkerung abzuzeichnen. Diese Annahme wurde in unserer Studie bestätigt, bei der das Auftreten von HLA-A*02 in der Patientengruppe mit 39,5 % im Gegensatz zur Kontrollgruppe mit 50 % vermindert auftrat, auch wenn der Befund aufgrund der Gruppengröße keine statistische Signifikanz erreichte. Das Ergebnis kann darauf hinweisen, dass Personen, die HLA-A*02 positiv sind, ein geringeres Risiko haben, an einem Mundhöhlenkarzinom zu erkranken. Das HLA-A*02 könnte folglich als protektives Allel im Hinblick auf diese Art von Krebs angesehen werden. Die Assoziation zwischen HLA-A*02 und malignen Erkrankungen war bereits Gegenstand zahlreicher Studien. So zeigten beispielsweise Niens et al. in ihrer Studie von 2007, dass HLA-A*02-positive Personen ein statistisch signifikant geringeres Risiko für die Erkrankung an einem EBV assoziierten Hodgkin- Lymphom haben. Noch näher an unserem Studiengegenstand forschten Hosono et al.. Diese zeigten 2010 einen inversen Zusammenhang zwischen HLA-A*02 und der Entstehung eines zervikalen Plattenepithelkarzinoms bei japanischen Frauen. Beide obige Studien stützen somit die These, dass HLA-A*02 als protektives Allel angesehen werden kann, möglicherweise durch die günstigere Präsentation potentieller Tumorantigene und eine somit bessere immunologischen Kontrolle. [15, 28] Ein gänzlich anderes Bild zeigte sich bei dem Allel HLA-A9 in Bezug auf die Protektivität. Mit 29,8 % in der Patientengruppe im Vergleich zu 18,5 % im Kontrollkollektiv trat dieses Allel bei den Patienten häufiger auf und kann als Suszeptibilitätsfaktor angesehen werden. Hiernach haben HLA-A9-positive Individuen eine höhere Mundhöhlenkarzinoms. Empfindlichkeit Auch in für anderen die Studien Entstehung wurde bereits eines ein Zusammenhang von HLA-A9 und bestimmten Krankheiten beschrieben. So zeigten Stein et al. in ihrer Studie eine positive Assoziation von HLA-A9 und der aggressiven Form der Parodontitis und somit dessen Rolle als Suszeptibilitätsfaktor. Dardari et al. ermittelten dagegen in ihrer Studie über den Zusammenhang zwischen HLA und Nasopharyngealkarzinomen bei marokkanischen Patienten ein gegenteiliges Ergebnis. Hier war HLA-A9 mit einem verminderten Risiko für die Entstehung eines Nasopharyngealkarzinoms assoziiert. Somit zeigt sich ein uneinheitliches Bild von HLA-A9 in Bezug auf dessen Protektivität bzw. Suszeptibilität bei verschiedenen Krankheiten. In diesem 40 Zusammenhang stellt sich nun die Frage, inwieweit HLA-A9 krankheitsspezifisch entweder als protektiver Faktor oder als Suszeptibilitätsfaktor angesehen werden kann. Neben ethnischen Besonderheiten spielen auch kulturelle Faktoren wie die Exposition gegenüber Risikofaktoren wie Nikotin und Alkohol eine Rolle. Um diese Frage abschließend klären zu können, bedarf es weiterer Untersuchungen. [7, 42] Ebenso wie die serologische Hauptgruppe HLA-A9 zeigten sich in unserer Studie die beiden hierzu gehörenden Allele HLA-A*23 und –A*24 im Patientenkollektiv überrepräsentiert. HLA-A*23 trat in der Gruppe der Patienten mit einem Plattenepithelkarzinom deutlich häufiger auf als in der Kontrollgruppe, wodurch ein Zusammenhang dieses Allels mit einem höheren Erkrankungsrisiko beschrieben werden kann. Auch in einer Studie von Yilmaz et al. wurde HLAA*23 bereits als Suszeptibilitätsfaktor charakterisiert und mit einem erhöhten Risiko für die Entstehung eines Nierenzellkarzinoms assoziiert. Des Weiteren hatte auch HLA-A*24 in unserem Patientenkollektiv einen höheren Anteil als bei den Kontrollen. Eine signifikant höhere Frequenz von HLA-A*24 bei japanischen Frauen mit einem oralen Karzinom beschrieben bereits Eura et al. in ihrer Studie von 1999 und somit dessen Einfluss auf die Entwicklung dieser Krebsart. Zusammenfassend lässt sich feststellen, dass beide Allele mit einem erhöhten Risiko für die Entwicklung eines Plattenepithelkarzinoms der Mundhöhle assoziiert zu sein scheinen. [9, 51] Als Nebenbefund zeigte sich in unserer Studie für HLA-B*07 ein leicht vermindertes Auftreten in der Gruppe der Patienten im Vergleich zu den gesunden Kontrollen. Ob dem Allel allerdings eine protektive Rolle zugesprochen werden kann, ist aus unseren Ergebnissen nicht ersichtlich und könnte ebenfalls Gegenstand weiterer Untersuchungen sein. Zusammenfassend deuten die Daten unserer Studie darauf hin, dass eine Assoziation zwischen bestimmten HLA-Antigenen und der Entstehung eines Plattenepithelkarzinoms der Mundhöhle besteht. Hierbei scheint es, dass die jeweiligen Antigene entweder protektive Funktionen für HLA-A*02 oder suszeptibilitätsfördernde Funktionen für HLA-A*23 besitzen. Auch wenn unsere Ergebnisse nicht das Signifikanzniveau erreicht haben, deuten sie zusammen mit bereits publizierten Daten einen Zusammenhang zwischen bestimmten HLAAntigenen und dem Risiko für Krebsentstehung an. Neben der Bedeutung der 41 HLA-Antigene als zentrale Immunregulationsmoleküle stärken die Ergebnisse im Hinblick auf HLA-A*02 die weitere Entwicklung spezifischer Immuntherapien. 42 6. Literaturverzeichnis 1. Baykul T, Yilmaz HH, Aydin U, Aydin MA, Aksoy M, Yildirim D. Early diagnosis of oral cancer. J Int Med Res. 2010. 38(3):737-49. 2. Bertz J, Giersiepen K, Haberland J, Hentschel S, Kaatsch P, Katalinic A, Stabenow R, Stegmaier C, Ziegler H. Krebs in Deutschland-Häufigkeiten und Trends. 5.Auflage. Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V.. Saarbrücken. 2006. S 22-24. 3. Boenninghaus HG, Lenarz Th. Hals- Nasen- Ohren- Heilkunde. 12. Auflage. Springer Verlag. Heidelberg. 2007. S.227. 4. Böker W, Denk H, Heitz PhU, Moch H. Pathologie. 4. Auflage. Urban & Fischer Verlag. München. 2008. S. 679-684. 5. Bornstein M, Lys O, Altermatt HJ, Stauffer E, Buser D. Primärdiagnose beim Plattenepithelkarzinom der Mundhöhle. Schweiz Monatsschr Zahnmed. 2005. 115: 542–548. 6. Cruz IBF, Snjiders PJF, Steenbergen R, Meijer JLM, Snow GB, Walboomers JMM, van der Wal I. Age-dependence of human papillomavirus DNA presence in oral squamous cell carcinomas. Eur J Cancer B Oral Oncol. 1996. 32B (1):55-62. 7. Dardari R, Khyatti M, Jouhadi H, Benider A, Ettayebi H, Kahlain A, Mansouri A, El Gueddari B, Benslimane A. Study of human leukocyte antigen class I phenotypes in Moroccan patients with nasopharyngeal carcinoma. Int J Cancer. 2001. 92(2):294-7. 8. El-Chennawi FA, AF, Metwally SS, Mosaad YM, El-Wahab MA, Tawhid ZE. HLA-class II alleles in Egyptian patients with hepatocellular carcinoma. Clinical Immunology Unit. 2008. 37(7): 661-74. 43 9. Eura M, Katsura F, Oiso M, Obata A, Nakano K, Masuyama K, Ishikawa T. Frequency of HLA-A alleles in Japanese patients with head and neck cancer. Jpn J Clin Oncol. 1999. 29(11):535-40. 10. Eura M, Ogi K, Chikamatsu K, Lee KD, Nakano K, Masuyama K, Itoh K, Ishikawa T. Expression of the MAGE gene family in human head-and-neck squamous-cell carcinomas. Int J Cancer. 1995. 64(5):304-8. 11. Gath HJ, Brakenhoff R. Minimal residual disease in head and neck cancer. Cancer Metastasis Rev. 1999. 18:109-126. 12. Gutwald R, Gellrich NC, Schmelzeisen R. Einführung in die zahnärztliche Chirurgie. Urban&Fischer Verlag. München/ Jena. 2003. Kap 10, S. 250-262. 13. Hansis M. Basiswissen Chirurgie. Springer Verlag. Berlin/ Heidelberg/ New York. 2000. S.19-21. 14. Horch HH. Mund-Kiefer-Gesichtschirurgie. 4. Auflage. Urban&Fischer Verlag. München [ u.a.]. 2007. Kap.18, S.670-742. 15. Hosono S, Kawase T, Matsuo K, Watanabe M, Kajiyama H, Hirose K, Suzuki T, Kidokoro K, Ito H, Nakanishi T, Yatabe Y, Hamajima N, Kikkawa F, Tajima K, Tanaka H. HLA-A alleles and the risk of cervical squamous cell carcinoma in Japanese women. J Epidemiol. 2010. 20(4):295-301. 16. Howaldt HP, Schmelzeisen R. Einführung in die Mund-, Kiefer-, Gesichtschirurgie. Urban & Fischer Verlag. München/ Jena. 2002. S.97-112. 17. Imai K, Hirata S, Irie A, Senju S, Ikuta Y, Yokomine K, Harao M, Inoue M, Tomita Y, Tsunoda T, Nakagawa H, Nakamura Y, Baba H, Nishimura Y. Identification of HLA-A2-restricted CTL epitopes of a novel tumour-associated antigen, KIF20A, overexpressed in pancreatic cancer. Br J Cancer. 2011. 104(2):300-7. 44 18. Izbicki JR, Hosch SB. The significance of immunohistochemically detectable tumor cells in lymph nodes. Zentralbl Chir. 2000. 125(10):796-8. 19. Janeway AC, Travers P, Walport M, Shlomchik MJ. Immuno Biology. 5. Auflage. Garland Publishing; Taylor & Francis Group. New York. 2001. S.167-182. 20. Kiessling A, Stevanovic S, Füssel S, Weigle B, Rieger MA, Temme A, Rieber EP, Schmitz M. Identification of an HLA-A*0201-restricted T-cell epitope derived from the prostate cancer-associated protein prostein. Br J Cancer. 2004. 90(5):1034-40. 21. Kruse AL, Bredell M., Grätz KW. Oral cancer in men and women: are there differences. Oral Maxillofac Surg. 2011. 15:51-55. 22. Li Z, Chen D, Zhang C, Li Y, Cao B, Ning T, Zhao Y, You W, Ke Y. HLA polymorphisms are associated with Helicobacter pylori infected gastric cancer in a high risk population, China. Immunogenetics. 2005. 56(11):781-7. 23. Lissowska J, Pilarska A., Pilarski P, Samolczyk-Wanyura D, Piekarczyk J, Bardin-Mikolłajczak A, Zatonski W, Herrero R, Munoz N, Franceschi S. Smoking, alcohol, diet, dentition and sexual practices in the epidemiology of oral cancer in Poland. Eur J Cancer Prev. 2003. 12(1):25-33. 24. Löffler G. Basiswissen Biochemie. 6. Auflage. Springer Verlag. Heidelberg. 2004. S. 565-568, S. 446. 25. Marur S, D´Souza G, Westra WH, Forastiere AA. HPV-associated head and neck cancer: a virus-related cancer epidemic. Lancet Oncol. 2010. 11(8):7819. 26. Mashberg A, Samit A. Early diagnosis of asymptomatic oral and oropharyngeal squamous cancers. CA Cancer J Clin. 1995. 45(6):328-51. 45 27. Nagel P. Hals-Nasen-Ohren-Heilkunde Basics. Urban&Fischer Verlag. München/ Jena. 2005. S.78-79. 28. Niens M, Jarrett RF, Hepkema B, Nolte IM, Diepstra A, Platteel M, Kouprie N, Delury CP, Gallagher A, Visser L, Poppema S, te Meerman GJ, van den Berg A. HLA-A*02 is associated with a reduced risk and HLA-A*01 with an increased risk of developing EBV+ Hodgkin lymphoma. Blood. 2007. 110(9):3310-5. 29. Ohman Forslund K, Nordqvist K. The melanoma antigen genes--any clues to their functions in normal tissues? Exp Cell Res. 2001. 265(2):185-94. 30. Ottaviani S, Zhang Y, Boon T, van der Bruggen P. A MAGE-1 antigenic peptide recognized by human cytolytic T lymphocytes on HLA-A2 tumor cells. Cancer Immunol Immunother. 2005. 54(12):1214-20. 31. Pantel K, Cote R, Fodstad O. Detection and Clinical Importance of Micrometastatic Disease. J Natl Cancer Inst. 1999. 91(13):1113-24. 32. Pantel K, von Knebel Doeberitz M. Detection and clinical relevance of micrometastatic cancer cells. Curr Opin Oncol. 2000. 12(1):95-101. 33. Parkin DM, Pisani P, Ferlay J. Global cancer statistics. CA Cancer J.Clin. 1999. 49:33-64. 34. Reichart PA. Tabak und Mundgesundheit. Dtsch Zahnärztl Z. 2010. 55: 223– 229 (2000b). 35. Rojas-Alcayaga G, Brignardello R, Espinoza I, Franco ME, Lobos N, OrtegaPinto AV. Oral malignant tumours: a report on 728 cases in Chile. Acta Odontol Latinoam. 2010. 23(2):136-42. 46 36. Rosenquist K. Risk factors in oral and oropharyngeal squamous cell carcinoma: a population-based case-control study in southern Sweden. Swed Dent J Suppl. 2005. (179):1-66. 37. Schneider AG. Impfen gegen Krebs. Apotheken Umschau. 2011. S.54-59. 38. Schütt C, Bröker B. Grundwissen Immunologie. 2. Auflage. Spektrum Akademischer Verlag. Heidelberg. 2009. S.24-26. 39. Schwenzer N, Ehrenfeld M. Mund-Kiefer-Gesichtschirurgie. 4. Auflage. Thieme Verlag. München/ Tübingen. 2010. S.69-70. 40. Sciubba J. Oral cancer. The importance of early diagnosis and treatment. Am J Clin Dermatol. 2001. 2(4):239-51. 41. Staines N, Brostoff J, James K. Immunologisches Grundwissen. 3. Auflage. Spektrum Akademischer Verlag. Stuttgart/ Jena. 1997. S.34-35. 42. Stein JM, Machulla HK, Smeets R, Lampert F, Reichert S. Human leukocyte antigen polymorphism in chronic and aggressive periodontitis among Caucasians: a meta-analysis. J Clin Periodontol. 2008. 35(3):183-92. 43. Strutz J, Mann W. Praxis der HNO-Heilkunde, Kopf- und Halschirurgie. 2. Auflage. Thieme Verlag. Stuttgart [u.a.]. 2010. S.453-454. 44. Subhra Chaudhuri, Cariappa A, Tang M, Bell D, Haber D, Isselbacher KJ, Finkelstein D, Forcione D, Shiv Pillai†. Genetic susceptibility to breast cancer: HLA DQB*03032 and HLA DRB1*11 may represent protective alleles. Proc Natl Acad Sci. 2000. 97(21): 11451–11454. 45. Tachezy R, Klozar J, Saláková M, Smith E, Turek L, Betka J, Kodet R, Hamsíková E. HPV and other risk factors of oral cavity/oropharyngeal cancer in the Czech Republic. Oral Dis. 2005. 11(3):181-5. 47 46. Terhorst D. Dermatologie Basics. Urban&Fischer Verlag. München. 2005. S. 96-97. 47. Oijen van MG, Leppers Vd Straat FG, Tilanus MG, Slootweg PJ. The origins of multiple squamous cell carcinomas in the aerodigestive tract. Cancer. 2000. 15; 88(4):884-93. 48. Waßmuth R. Einführung in das HLA-System. 2. Auflage. Ecomed Medizin Verlagsgruppe Hüthig Jehle Rehm GmbH. Landsberg/ Lech. 2005. S.9-98. 49. Wittekind C, Bootz F. TNM-Klassifikation maligner Tumore. 6. Auflage. Springer Verlag. Berlin [u.a.]. 2002. S. 223 f. 50. Wu Y, Liu B, Lin W, Xu Y, Li L, Zhang Y, Chen S, Lin Z, Xu A. Human leukocyte antigen class II alleles and risk of cervical cancer in China. Hum Immunol. 2007. 68(3):192-200. 51. Yilmaz E, Çekmen A, Akkuş E, Önal B, Özalp AU, Solok V, Erdoğan E, Eren B. The relationship between human leukocyte antigens (HLA) and renal cell carcinoma. Bosn J Basic Med Sci. 2010. 10(4):282-6. 48 7. Abkürzungen HLA Humanes Leukozyten Antigen MHC Major Histocompatibility Complex OR Odds Ratio CI Konfidenzintervall UICC Union Contre le Cancer TNM T (Tumor) N (Nodes) M (Metastasen) MRD Minimal Residual Disease CTA Cancer/Testis Antigene HPV Humanes Papilloma Virus HCC Hepato-Cellular Carcinoma HBV Hepatitis-B Virus HCV Hepatitis-C Virus ZMK Zahn-, Mund- und Kieferklinik DNA Desoxiribo-Nucleid-Acid OD Optische Dichte PCR Polymerase Chain Reaction EBV Epstein-Barr-Virus CD4 Cluster of Differentiation 4 CD8 Cluster of Differentiation 8 % Prozent ml Milliliter µl Mikroliter sek Sekunde U/min Umdrehungen pro Minute 49 ºC Grad Celcius nm Nanometer µg Mikrogramm mV Millivolt mA Milliampere UV Ultraviolett PE Phycoerithrin g Gramm FI Fluoreszens Itensity Pu unkorrigierter p-Wert Pk korrigierter p-Wert Nr Nummer 50 8. Danksagung Mein besonderer Dank gilt meinem Doktorvater PD Dr. med. Bernd Spriewald und Herrn Professor Dr. med. Andreas Mackensen, Leiter der Medizinischen Klinik 5 für Hämatologie und Internistische Onkologie, für die freundliche Überlassung des Themas, die fachliche Unterstützung und die Betreuung der Dissertation. Ich danke Herrn Prof. Dr. med. Dr. med. dent. Emeka Nkenke für die freundliche Übernahme des Korreferats und Frau Dr. rer. nat. Jutta Ries für ihre Unterstützung bei der Probenakquirierung. Des Weiteren danke ich den Mitarbeiterinnen und Mitarbeitern des HLA-Labors Erlangen, ganz besonders Frau Birgit Lauer, für die technische Unterstützung und die Hilfestellungen bei den Laborarbeiten. Meinem besten Freund Andreas Bleistein danke ich für seine Hilfe beim statistischen Teil der Dissertation. Zum Schluss möchte ich noch meinem Freund Steffen Adis, meiner Freundin Sina Brand und meiner Familie für deren Hilfe und moralische Unterstützung danken.