ENZYMATIK 1. Vorversuch Beobachtung: Es hat keine Reaktion
Werbung

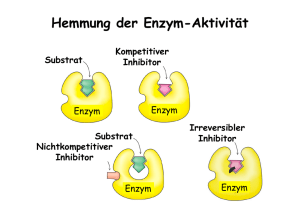
ENZYMATIK 1. Vorversuch Versuch „Spaltung von Wasserstoffperoxid (H2O2) Material: Bäckerhefe, Braunstein (MnO2), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid werden in einen Rundkolben gebracht und ein glühender Glimmspan über die Lösung gehalten. Beobachtung: Es hat keine Reaktion stattgefunden. Durchführung 2: 5ml Wasserstoffperoxid werden im Rundkolben erhitzt. Anschließend wird die Glimmspanprobe durchgeführt. Beobachtung: Es ist eine Gasentwicklung zu beobachten. Der Glimmspan entflammt. Erklärung: Wasserstoffperoxid wird durch Erhitzen in Wasser und Sauerstoff gespalten. Der Sauerstoff entflammt den Glimmspan. 2H2O2 Æ 2H2O + O2 Durchführung 3: 5ml Wasserstoffperoxid werden im Rundkolben mit einer Spatelspitze Braunstein versetzt. Anschließend wird die Glimmspanprobe durchgeführt. Beobachtung: Es ist eine Gasentwicklung zu beobachten. Der Glimmspan entflammt. Erklärung: Wasserstoffperoxid wird durch die (katalytische) Wirkung des Braunsteins in Wasser und Sauerstoff gespalten. Der Sauerstoff entflammt den Glimmspan. Durchführung 4: 5ml Wasserstoffperoxid werden im Rundkolben mit einigen Tropfen einer Hefesuspension versetzt. Anschließend wird die Glimmspanprobe durchgeführt. Beobachtung: Es ist eine Gasentwicklung zu beobachten. Der Glimmspan entflammt. Erklärung: Hefe enthält eine katalytische Substanz, die Wasserstoffperoxid in Wasser und Sauerstoff spaltet. Der Sauerstoff entflammt den Glimmspan. Bei der katalytischen Substanz handelt es sich um das Enzym Katalase. 2 H2O2 Æ 2 H2O + O2 2. Bau und Wirkungsweise von Enzymen Aktivierungsenergie: Energiebetrag, der aufgebracht werden muss, damit eine chemische Reaktion in Gang kommt. Die unkatalysierte Reaktion Die durch Enzyme katalysierte Reaktion Bei nicht katalysierter und bei der katalysierten Reaktion wird gleich viel Energie gewonnen. Der zu investierende Betrag der Aktivierungsenergie ist bei der katalysierten Reaktion deutlich geringer! Merke: Definition Enzyme: Enzyme sind Biokatalysatoren, die chemische Reaktionen in Lebewesen beschleunigen, ohne selbst dabei verbraucht zu werden. Sie senken den Betrag der Aktivierungsenergie und ermöglichen den Reaktionsverlauf bei Körpertemperatur. Aufbau eines Enzyms Protein mit aktivem Zentrum, einer „Tasche“, in der das Substrat umgesetzt wird. Ablauf einer enzymatischen Reaktion Substrat (S) bindet an Enzym (E), es entsteht der Enzym‐Substrat‐Komplex (ESK). Substrat und Enzym binden sich durch „Schlüssel‐Schloss‐Prinzip“. Produkte (P) werden gebildet. Enzym‐Substrat‐ Komplex zerfällt. Enzym geht unverändert aus der Reaktion hervor. Eine einfache unkatalysierte Reaktion verläuft nach dem Schema: S Æ P Eine katalysierte Reaktion verläuft nach dem Schema E + S Æ ESK Æ P + E 3. Spezifitäten enzymatischer Reaktionen Substratspezifität: Enzyme können, durch die spezielle Struktur ihres aktiven Zentrums, nur ganz bestimmte Substrate binden. Diese passen nach dem Schlüssel‐Schloss‐Prinzip zu einem Enzym. Schlüssel‐Schloss‐Prinzip Gruppenspezifität Ähneln sich bestimmte Substrate stark weil sie eine chemische Gruppe bilden, können unter Umständen mehrere Moleküle an ein und dasselbe Enzym binden. Man spricht von Gruppenspezifität. Wirkungsspezifität Ein Substrat kann häufig in mehreren Reaktionen reagieren. Ein Enzym katalysiert aber immer nur eine ganz bestimmte Reaktion eines Substrats. 4. Nomenklatur Alle Enzymnamen enden immer auf „‐ase“. Doch auch aus dem vorderen Teil des Namens lassen sich Informationen ableiten: ‐ ‐ Substratname Name der Reaktion Beispiel: DNA –Ligase Substratname Name der Reaktion Endung für „Enzym“ (ligieren = verbinden; Verbinden von DNA‐Strängen) 5. Einflüsse auf die Enzymkatalyse 5.1. Die Temperatur Die Temperaturabhängigkeit der Enzymwirkung Grundlagen: Sie arbeiten mit Trockenhefe. Diese enthält Katalase. Katalasen sind Enzyme, die das bei der Zellatmung anfallende Zellgift Wasserstoffperoxid in Wasser und Sauerstoff spalten und damit eliminieren.[1] Das Enzym kommt in allen pflanzlichen und tierischen Organen vor, besonders in der Leber und in den Erythrozyten. Aufgaben: 1. 2. 3. Führen Sie den Versuch durch. Vorsicht: Wasserstoffperoxid ist ätzend! Bei Hautkontakt sofort mit Wasser spülen. Protokollieren Sie die Beobachtungen. Was schließen Sie aus den Versuchsergebnissen? Stellen Sie Ihre Ergebnisse und Erkenntnisse dem Plenum vor. Materialien: 4 Reagenzgläser (RG), RG‐Ständer, Spatel, Schutzbrille, 3 x 400‐mL‐Bechergläser (für Wasserbäder 0° C, 20 °C, 37 °C, Trockenhefe, Wasserstoffperoxid‐Lösung (w = 10 %), Eis. Bereiten Sie 4 RG vor: RG 1: + Spatelspitze Trockenhefe + ca. 1 mL (halbe Daumenbreite) kochendes Wasser. Lassen Sie es danach abkühlen. RG 2: + ca. 1 mL Leitungswasser + ca. 2 mL Wasserstoffperoxid‐Lösung, 5 min lang in Eiswasser stellen. RG 3: + ca. 1 mL Leitungswasser + ca. 2 mL Wasserstoffperoxid‐Lösung, 5 min lang in Wasserbad mit der Temperatur des Leitungswassers stellen. RG 4: + ca. 1 mL Leitungswasser + ca. 2 mL Wasserstoffperoxid‐Lösung, 5 min lang in Wasserbad mit 37 °C stellen (Herstellen aus 1 Teil Wasser mit 100°C und 3 Teilen Wasser mit 20°C). Fügen Sie zu RG 1 ca. 2 mL Wasserstoffperoxid‐Lösung und zu den RG 2‐4 je 1 Spatelspitze Trockenhefe hinzu und vergleichen Sie nach kurzem Schütteln die Intensität der Gasentwicklung. - Zusatzaufgabe: Bei welcher Temperatur „arbeiten“ die Enzyme unseres Körpers wohl am besten? Die Reaktionsgeschwindigkeit chemischer Reaktionen nimmt mit steigender Temperatur entsprechend der RGT‐Regel zu. Wie lautet diese Regel? Bei biochemischen Reaktionen (Enzymreaktionen) verhält sich die Reaktionsgeschwindigkeit ab einer bestimmten Temperatur anders. Dies geht aus der folgenden Grafik hervor. Begründen Sie den Sachverhalt! Zeichnen Sie den Verlauf der Reaktionsgeschwindigkeit nach der RGT‐Regel in die Abbildung ein. RGT‐Regel Æ zunehmende Reaktionsgeschwindigkeit Denaturierung Æ zunehmende Inaktivierung Temperaturoptimum RGT‐Regel (Reaktionsgeschwindigkeits‐Temperaturregel) Eine Temperaturerhöhung um 10°C führt zu einer zwei‐ bis viermal so hohen Reaktionsgeschwindigkeit. Temperaturoptimum Temperaturbereich, in der das Enzym am effektivsten arbeitet 5.2. Der pH‐Wert Der pH‐Wert hat ebenfalls Einfluss auf die Enzymaktivität. Der pH‐Bereich vollständiger Enzymaktivität (pH‐Optimum) ist umgeben von Bereichen einer reversiblen Inaktivierung. Das heißt, in diesen Bereichen kann das Enzym zwar nicht mehr arbeiten, erlangt aber diese Fähigkeit wieder, sobald der pH‐Wert sich wieder richtig Optimum bewegt. Anders verhält es sich, wenn der pH‐Wert zu sauer bzw. zu basisch wird. In diesem Fall tritt eine irreversible (nicht rückgängig zu machende) Schädigung des Enzyms ein (Denaturierung). Selbst bei einer Veränderung des pH‐Wertes richtig Optimum kann sich das Enzym nicht wieder regenerieren. Es ist zerstört und muss neu gebildet werden. 6. Aktivierung und Hemmung enzymatischer Reaktionen