Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor
Werbung
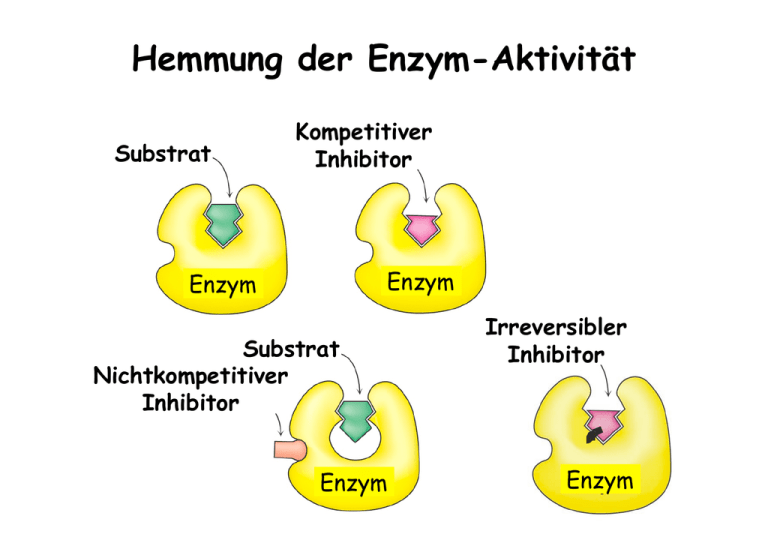
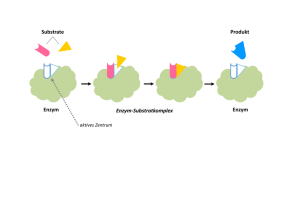
Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Enzym Irreversibler Inhibitor Enzym Enzym - Kinetik Michaelis – Menten Gleichung V0 = Vmax [ S ] [ S ] + KM KM 1 1 1 . + = V0 Vmax Vmax [ S ] Lineweaver - Burk Diagramm 1/v0 Kompetitive Enzym-Inhibitoren Kompetitive Inhibitoren Dihydrofolat Reduktase und Chemotherapie - blockiert ThyminBiosynthese - Bindet 1000x fester an die Dihydrofolat Red. Nichtkompetitive Enzym-Inhibitoren Irreversible Inhibitoren • Gruppen-spezifische Reagenzien • Substrat-Analoga • Suizid-Inhibitoren (Mechanismus-basierte Inhibitoren) Gruppen-spezifische Reagenzien: z.B. Diisopropylfluorphosphofat (DIFP) z.B.: SerinProtease Inaktiviertes Enzym Gruppen-spezifische Reagenzien: z.B. Iodacetamid Enzym Iodacteamid Inaktiviertes Enzym Substrat-analoge Inhibitoren Substrat für Chymotrypsin Spezifitäts-Gruppe Reaktive Gruppe Tosyl-L-phenylalanin-chlormethylketon (TPCK) Substrat-analoge Inhibitoren Triosephosphat Isomerase (TIM) Bromacetolphosphat ähnelt dem Substrat Dihydroxyacteonphosphat Inaktives Enzym Suizid Inhibitoren: Monoamin Oxidase Flavin (prosthetische Gruppe) Alkylierung Modifiziertes Flavin → inaktives Enzym Penicillin Reaktive PeptidBindung im β-Lactamring Wirkung von Penicillin Peptidoglykan: Gelb = Zucker Rot = Tetrapeptide Blau = Pentaglycin-Brücke Bildung der Querverbindungen im Peptidoglykan Mechanismus der GlykopeptidTranspeptidase Ähnlichkeit zwischen Penicillin und dem Substrat Bildung des Pencilloyl-Enzym Komplexes Regulation von Enzymaktivität • Allosterische Kontrolle (Kooperativität, Rückkopplungshemmung) • Isoenzyme • Kovalente Modifikation • Aktivierung durch proteolytische Spaltung Aspartat Transcarbamoylase (ATCase) (erster Schritt der Pyrimidin-Biosynthese) Carbamoylphosphat Aspartat N-Carbamoylaspartat Cytidintriphosphat (CTP) Feedback- (Rückkopplungs-) Hemmung CTP hemmt die ATCase = Endprodukt-Hemmung Physiologisch sinnvoll: es wird nur soviel CTP synthetisiert, wie in der Zelle benötigt CTP bindet nicht im aktiven Zentrum, sondern an einer anderen (allos) Stelle (= allosterische oder regulatorische Zentren) CTP = allosterischer Inhibitor ATCase Quartärstruktur: 2 katalyt.Trimere (6 c-Ketten) 3 regulat. Dimere (6 r-Ketten) (c6r6) Bisubstratanalogon PALA (= starker kompetitiver Inhibitor) Substrat ReaktionsIntermediat N-(Phosphonacetyl)-L-aspartat (PALA) Aminosäuren von benachbarten Untereinheiten bilden gemeinsam die katalytischn Zentren der ATCase Änderung der Quartärstruktur T Zustand (Tense state) R Zustand (Relaxed state) Endprodukt CTP bindet an die regulatorischen Untereinheiten im T – Zustand und stabilisiert den T - Zustand Kontrolle der ATCase Aktivität (konzertierter Mechanismus) Allosterisch regulierte Enzyme weichen von der MichaelisMenten Kinetik ab Sigmoide Kurve ATCase Aktivität in Anwesenheit allosterischer Effektoren Allosterische Effekte mit sequentiellen Mechanismus Homo-tetrameres Protein Untereinheit im T-Zustand Untereinheit im R-Zustand Regulation durch variable Isoenzym-Komplexe Beispiel: Lactat Dehydrogenase LDH Isoenzym Zusammensetzung in verschiedenen Geweben (M=Skelettmuskulatur, H=Herzmuskulatur) H4 H 3M H 2 M2 HM3 M4 H4 M4 Änderung der LDH Zusammensetzung im Herz während der Entwicklung Regulation der Proteinaktivität durch kovalente Modifiaktion Regulation von Enzymaktivität durch Phosphorylierung Proteinkinase OH-Gruppe eines Serin-, Threonin- oder Tyrosinrest Phosphoryliertes Protein Glycogen - Phosphorylase Aktivierung durch proteolytische Spaltung eines Proenzyms (Zymogen) Nach der Spaltung durch Trypsin kommt es zu einer Konformationsänderung, die zur vollständigen Ausbildung des aktiven Zentrums führt Blutgerinnungs-Kaskade (intravaskuläres System) (extravaskuläres System) Struktur des Fibrinogen Bildung eines Fibrin - Netzwerks Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen • Cofaktor wird für die Proteinfunktion benötigt wird, z.B. Metallion oder ein niedermolekulares Molekül • Im Fall von Enzymen werden Cofaktoren auch Coenzyme genannt (z.B. Vitamine) • Ist der Cofaktor permanent an das Protein gebunden (z.B. kovalent), wird dieser auch Prosthetische Gruppe genannt Hämgruppe (Protoporphyrin IX = substituierter Tetrapyrrolrinring) 2+ Strukturänderung durch O2-Bindung O2-Bindung durch Myoglobin und Hämoglobin Kooperativität ermöglicht die Übertragung von 1,7-mal mehr O2 als bei unabhängigen Bindestellen Allosterische Effekte mit sequentiellen Mechanismus Homo-tetrameres Protein Untereinheit im T-Zustand Untereinheit im R-Zustand (Desoxy-Form) (Oxy-Form) Hämoglobin pH-Abhängigkeit CO2 Transport Funktion von Proteinen: Immunsystem Antikörper (Immunglobuline) Struktur der Antikörper Quartärstruktur: L2H2 Funktionelle Domänen der Antikörper: Fab: Antigen-bindendes Fragment Fc: Kristallisierbares Fragment Erkennung eines Antigen Sequenz-Diversität von Immunglobulinen Variable und konstante Domänen Sequenzvariabilitaet der H Kette von humanen IgG Hypervariable Loops in den variablen Domänen Antikörper-Antigen Komplex: Bindung eines kleinen Antigens Strukturen von 3 unterschiedlichen Antikörpern gegen Lysozym Lysozym Vergleich der 3 Lysozym Antikörper: Optimale Komplementarität hohe Spezifität Antikörper in der Bioanalytik • • • • Polyklonale / Monoklonale Antikörper Herstellung von Antikörpern ELISA Western Blot Western Blot (Immunblot) ELISA: enzyme-linked immunosorbent assay Lokalisation eines DNAbindenden Proteins in einem Drosophila Embryo: Verwendung eines Antikörpers, an den ein Fluoreszenz-Farbstoff gebunden ist