PowerPoint-Datei - Online Media Server
Werbung
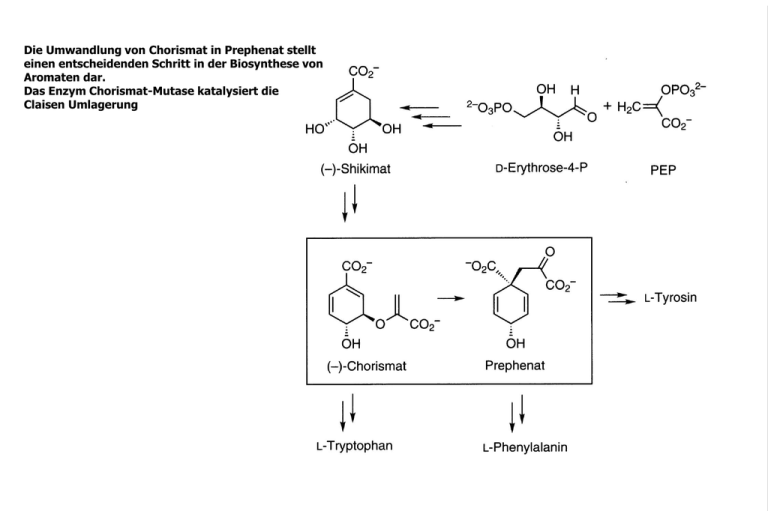
Die Umwandlung von Chorismat in Prephenat stellt einen entscheidenden Schritt in der Biosynthese von Aromaten dar. Das Enzym Chorismat-Mutase katalysiert die Claisen Umlagerung Bis heute wurden die Strukturen von drei Chorismat-Mutasen aus B. subtilis, (A), E. coli (B) und Hefe (C) aufgeklärt. Die Enzyme haben sehr unterschiedliche Strukturen was zeigt, dass die Natur das Problem der Claisen-Umlagerung unabhängig mehrfach gelöst hat. Divergente Evolution Fig. D zeigt einen katalytisch aktiven Antikörper Chorismat-Mutase katalysiert eine exergonische Reaktion. Das Chorismat muss von der in Lösung bevorzugten Konformation mit pseudoequatorialer Anordnung der Reste in eine Konformation umklappen, in der die Reste pseudoaxial stehen. Hierbei treten ungünstige 1,3 diaxiale Wechselwirkungen auf. Der ÜZ ist sesselförmig. Die Reaktion verläuft, Rechnungen zufolge, Konzertiert, aber nicht synchron. Der CO-Bindungsbruch ist schneller als die Bildung der C-C Bindung. Der Umklappprozess ist geschwindigkeitsbestimmend. Wie das Enzym hier eingreift ist unklar. Chorismat Prephenat Der Oxabicyclus ist ein gutes Modell für den ÜZ. Werden Mäuse mit diesem Molekül immunisiert bilden sie einen Antikörper, der auch katalytisch aktiv ist. Allerdings ist die katalytische Potenz 10010‘000 mal schlechter das Enzym. Die Kristallstruktur eines Komplexes aus dem B. subtilis Enzym und dem Inhibitor (ÜZ Analog) zeigt, wie das Enzym die Energie des ÜZ absenkt. Zentral ist die Ausbildung von nichtkovalenten Wechselwirkungen. So stabilisiert der positiv geladene Rest Arg90 die im ÜZ auftretenden negative Partialladung am „O“. Ersetzt man das Arg durch irgendeine andere Aminosäure (auch Lys), so erhält man nahezu nicht-aktive Enzyme. Die Stabilisierung der negativen Partialladung im ÜZ, als Mittel zur Absenkung der ÜZ Energie ist hochkonserviert. Positiv geladene Reste werden in allen anderen Enzymtaschen auch gefunden. Hier das E. coli Enzym mit Lys39 Ganz analog im Enzym aus der Hefe. Die Funktion von Arg90 übernimmt hier Lys168 Die aktive Tasche des Antikörpers ist Hingegen deutlich anders. Arg95 ist Zuweit entfernt um stabiliserend zu Wirken. Die ÜZ-Stabiliserung bleibt aus. Der Antikörper ist viel weniger aktiv











