63 4.7.5 Beeinflussung der Enzymaktivität - Medi
Werbung

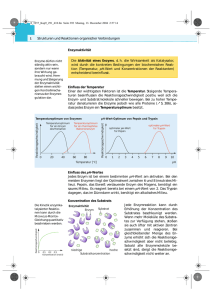
4.7.5 liche chemische Struktur aufweisen (sie sind isosterisch). Jedoch wird der Inhibitor bei Bindung im aktiven Zentrum vom Enzym nicht umgesetzt, sondern blockiert dieses nur (s. Abb. 76, S. 63). Bei gleicher Menge von Substrat und Inhibitor entscheidet die Affinität des Enzyms zu den beiden Substanzen, welches bevorzugt gebunden wird. – Ist die Affinität des Enzyms zum Inhibitor kleiner (der KM-Wert höher) als die Affinität zum Substrat, bilden sich überwiegend Enzym-Substrat-Komplexe (ES) und die Geschwindigkeit ist im Vergleich zur ungehemmten Reaktion (s. Abb. 77 a, S. 64, Kurve A) bei gleicher Substratkonzentration nur wenig verlangsamt (s. Abb. 77 a, S. 64, Kurve B). – Ist die Affinität des Enzyms zum Inhibitor dagegen größer (der KM-Wert niedriger) als die Beeinflussung der Enzymaktivität Affinität zum eigentlichen Substrat, bilden sich überwiegend Enzym-Inhibitor-Komplexe (EI) und die Reaktion verläuft im Vergleich zur ungehemmten Reaktion deutlich langsamer (s. Abb. 77 a, S. 64, Kurve C). Bei der kompetitiven Hemmung kann durch Erhöhung der Substratkonzentration der Einfluss eines Inhibitors auf die Reaktionsgeschwindigkeit weitgehend aufgehoben und so Vmax dennoch erreicht werden. Der KM-Wert eines Enzyms verschiebt sich in Gegenwart eines kompetitiven Inhibitors zu höheren Werten (die Affinität des Enzyms zum Substrat sinkt). 4 Merke! Die kompetitive Hemmung ist immer reversibel. Kompetitive Hemmung = KM steigt Enzym + Substrat Enzym-SubstratKomplex Enzym + Produkt Enzym + Inhibitor Enzym-InhibitorKomplex Enzym + Inhibitor Abb. 76: Wirkungsweise kompetitiver Inhibitoren www.medi-learn.de medi-learn.de/7-bc2-76 63