Chemie 2 LB Kapitel 9
Werbung
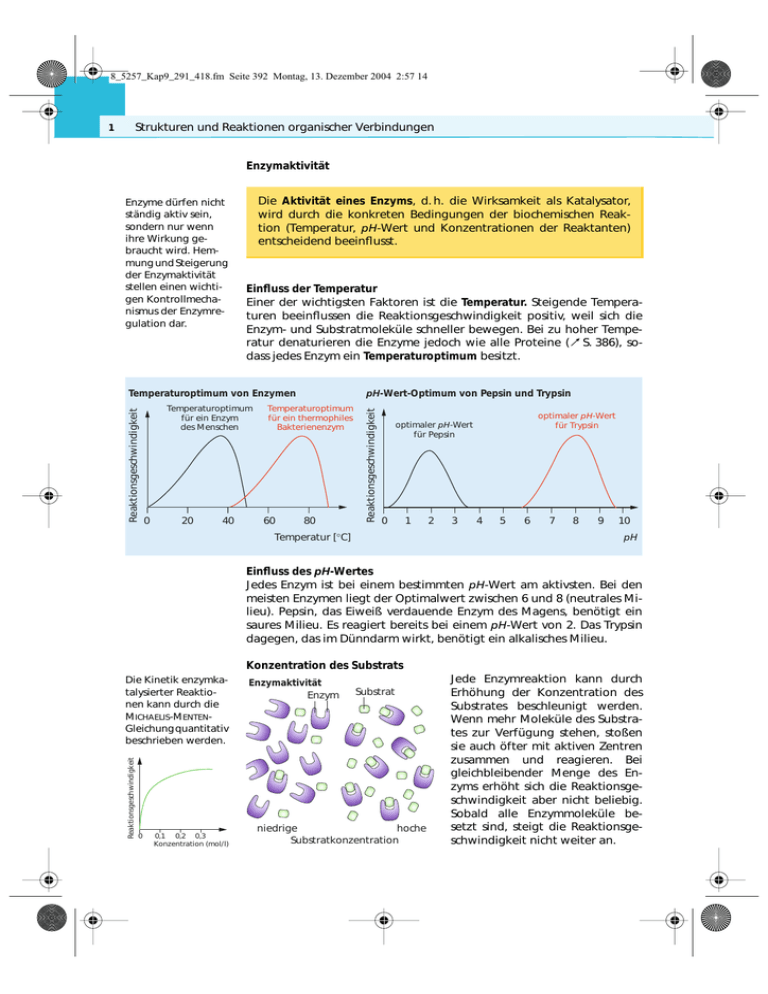
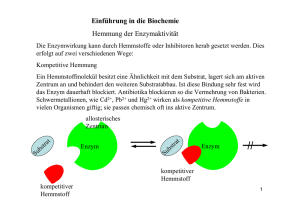
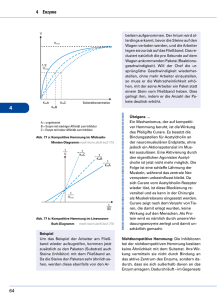
8_5257_Kap9_291_418.fm Seite 392 Montag, 13. Dezember 2004 2:57 14 Strukturen und Reaktionen organischer Verbindungen 1 Enzymaktivität Die Aktivität eines Enzyms, d. h. die Wirksamkeit als Katalysator, wird durch die konkreten Bedingungen der biochemischen Reaktion (Temperatur, pH-Wert und Konzentrationen der Reaktanten) entscheidend beeinflusst. Einfluss der Temperatur Einer der wichtigsten Faktoren ist die Temperatur. Steigende Temperaturen beeinflussen die Reaktionsgeschwindigkeit positiv, weil sich die Enzym- und Substratmoleküle schneller bewegen. Bei zu hoher Temperatur denaturieren die Enzyme jedoch wie alle Proteine (zS. 386), sodass jedes Enzym ein Temperaturoptimum besitzt. Reaktionsgeschwindigkeit Temperaturoptimum von Enzymen Temperaturoptimum für ein Enzym des Menschen 0 20 40 pH-Wert-Optimum von Pepsin und Trypsin Temperaturoptimum für ein thermophiles Bakterienenzym 60 80 Reaktionsgeschwindigkeit Enzyme dürfen nicht ständig aktiv sein, sondern nur wenn ihre Wirkung gebraucht wird. Hemmung und Steigerung der Enzymaktivität stellen einen wichtigen Kontrollmechanismus der Enzymregulation dar. optimaler pH-Wert für Trypsin optimaler pH-Wert für Pepsin 0 1 Temperatur [°C] 2 3 4 5 6 7 8 9 10 pH Einfluss des pH-Wertes Jedes Enzym ist bei einem bestimmten pH-Wert am aktivsten. Bei den meisten Enzymen liegt der Optimalwert zwischen 6 und 8 (neutrales Milieu). Pepsin, das Eiweiß verdauende Enzym des Magens, benötigt ein saures Milieu. Es reagiert bereits bei einem pH-Wert von 2. Das Trypsin dagegen, das im Dünndarm wirkt, benötigt ein alkalisches Milieu. Konzentration des Substrats Reaktionsgeschwindigkeit Die Kinetik enzymkatalysierter Reaktionen kann durch die MICHAELIS-MENTENGleichung quantitativ beschrieben werden. 0 0,1 0,2 0,3 Konzentration (mol/ l) Enzymaktivität Enzym Substrat niedrige hoche Substratkonzentration Jede Enzymreaktion kann durch Erhöhung der Konzentration des Substrates beschleunigt werden. Wenn mehr Moleküle des Substrates zur Verfügung stehen, stoßen sie auch öfter mit aktiven Zentren zusammen und reagieren. Bei gleichbleibender Menge des Enzyms erhöht sich die Reaktionsgeschwindigkeit aber nicht beliebig. Sobald alle Enzymmoleküle besetzt sind, steigt die Reaktionsgeschwindigkeit nicht weiter an. 8_5257_Kap9_291_418.fm Seite 393 Freitag, 14. Januar 2005 4:32 16 Chemie in Biosystemen 2 Enzymregulation Die Regulation der Lebensprozesse im Organismus erfolgt in vielen Fällen durch die Aktivierung bzw. Hemmung der katalytischen Wirkung von Enzymen. Existiert beispielweise in der Zelle ein ATP-Überschuss, wird die Funktion des Glucose abbauenden Enzyms Phosphofructokinase gehemmt, indem ATP und Enzym eine Bindung eingehen. Tritt ATP-Mangel auf, wird die Bindung zwischen ATP und Enzym gelöst und der Biokatalysator für den Glucoseabbau kann wieder voll wirksam werden. In diesem Fall ist die Hemmung des Enzyms reversibel und reguliert die ATP-Konzentration. Man unterscheidet kompetitive, nicht kompetitive und allosterische Hemmungen von Enzymfunktionen. Bei der kompetitiven Hemmung konkurriert ein Molekül oder Ion (Inhibitor) mit dem Substrat um die Bindungsstelle im Enzymmolekül. Das kann zur Einschränkung der Enzymaktivität führen. Die kompetitive Hemmung ist reversibel und abhängig von den Konzentrationsverhältnissen der Stoffe in den Zellen. Nicht kompetitive Hemmung liegt vor, wenn der Inhibitor nicht mit dem Substrat um eine Bindung am aktiven Zentrum des Enzyms konkurriert. Der Inhibitor dockt an einer anderen Stelle des Enzyms an und verursacht dabei eine Veränderung des aktiven Zentrums im Enzymmolekül, sodass die Enzymaktivität vermindert oder gar verloren geht. Die ursprünglich vom Enzym katalysierten Stoffumwandlungen sind nicht mehr möglich. Nicht kompetitive Hemmung ist meist irreversibel. Kompetitive und nichtkompetitive Enzymhemmung a) b) c) Substrat kompetitiver Hemmer (Inhibitor) Enzym aktives Zentrum nichtkompetitiver Hemmer (Inhibitor) Einige Enzyme besitzen neben dem aktiven noch ein so genanntes allosterisches Zentrum. Während das Substrat immer an das aktive Zentrum bindet, besetzen andere Moleküle das allosterische Zentrum und bewirken eine Änderung der Quartärstruktur des Enzymproteins. Das kann für die Enzymaktivität positive und negative Auswirkungen haben. Inhibitoren verändern das Enzymmolekül so, dass das Substrat nicht mehr gebunden wird. Aktivatoren beeinflussen die Enzymstruktur dagegen so, dass das Substrat besser gebunden werden kann. Inhibitoren sind Stoffe, die die Enzymaktivität hemmen. So inhibiert z. B. DDT (zS. 337) ein wichtiges Enzym im Nervensystem. Viele Medikamente wie Aspirin® sind Inhibitoren für lebenswichtige Enzyme in Bakterien. Eine nicht kompetitive Hemmung kann beispielsweise durch Schwermetall-Ionen wie Pb2+ und Hg+ verursacht werden. Diese Hemmung ist irreversibel und führt letztlich zur Denaturierung von Eiweißen (zS. 337).