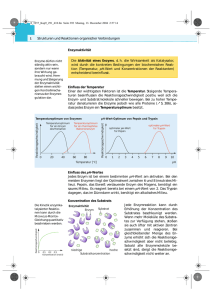
allosterischer Hemmstoff
Werbung
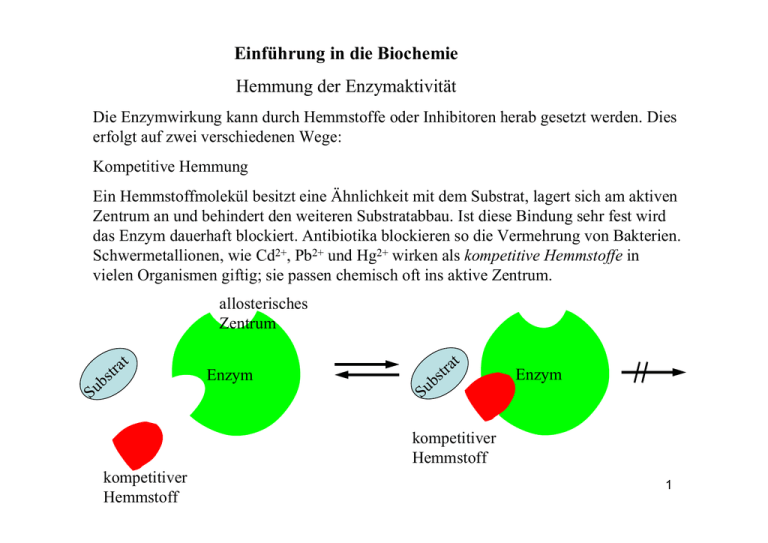
Einführung in die Biochemie Hemmung der Enzymaktivität Die Enzymwirkung kann durch Hemmstoffe oder Inhibitoren herab gesetzt werden. Dies erfolgt auf zwei verschiedenen Wege: Kompetitive Hemmung Ein Hemmstoffmolekül besitzt eine Ähnlichkeit mit dem Substrat, lagert sich am aktiven Zentrum an und behindert den weiteren Substratabbau. Ist diese Bindung sehr fest wird das Enzym dauerhaft blockiert. Antibiotika blockieren so die Vermehrung von Bakterien. Schwermetallionen, wie Cd2+, Pb2+ und Hg2+ wirken als kompetitive Hemmstoffe in vielen Organismen giftig; sie passen chemisch oft ins aktive Zentrum. allosterisches Zentrum b Su a str t Enzym b u S a str t Enzym kompetitiver Hemmstoff kompetitiver Hemmstoff 1 Einführung in die Biochemie Hemmung der Enzymaktivität Allosterische Hemmung Enzyme haben nur ein aktives Zentrum. Aufgrund ihrer hochkomplexen Struktur können andere Moleküle als das Substrat Andockstationen finden. Diese allosterischen Zentren sind für das Substrat nicht geeignet. Dockt aber ein anderes Molekül dort an, kann die Raumstruktur des Enzyms so verändert werden, dass sich am aktiven Zentrum kein Enzym-Substrat mehr bilden kann. Allosterische Hemmstoffe können nur von außen, nicht durch das Substrat, beeinflusst werden. Sie sind aber nicht immer eine Bedrohung für die Zelle, sondern können auch zur Steuerung biochemischer Prozesse beitragen. allosterischer Hemmstoff allosterisches Zentrum enzymatische b Su str at Enzym Katalyse Enzym b Su ts ra t b Su a str t Enzym 2