Enzymatische Versuche mit Urease
Werbung

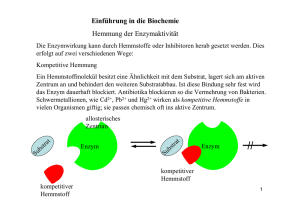
Enzymatische Versuche mit Urease Einleitend wird die Reaktionsgeschwindigkeit eines Enzyms in Abhängigkeit von der Substratkonzentration ermittelt: Laut der „RGT-Regel“ läuft die Reaktion exponentiell schneller ab, je mehr Substrat vorhanden ist. Bei sehr hohen Substratkonzentrationen beginnt die Reaktionsgeschwindigkeit jedoch, von anderen Faktoren abzuhängen. Bei dem so genannten km-Wert handelt es sich um die Substrat-Affinität: Sie gibt an wie gut das Enzym ein Substrat bindet. Dieser wird erreicht bei der halben Maximalgeschwindigkeit. Wir haben bei den Versuchen drei Möglichkeiten kennen gelernt, die Reaktionsgeschwindigkeit (messbar am km-Wert) zu beeinflussen: Über die Temperatur, über eine Zerstörung der Enzyme und über eine Hemmung der Enzyme. Hier eine grob schematische Darstellung: Ein Enzym erkennt ein Substrat und stürzt sich drauf. Substrat Enzym Betrachten wir zunächst die unbeeinflusste Reaktion: Es bildet sich ein Gleichgewicht aus Enzym E, Substrat S und Produkt P (sowie den Verbindungen zwischen Substrat und Enzym ES resp. Enzym und Produkt EP): ES ES EP EP Es kann jedoch auch einen kompetitiven Inhibitor I geben, welcher Enzyme blockiert (hemmt), indem er die Andockstellen des Substrates einnimmt: ES ES EP EP EI In diesem Fall läuft die gesamte Reaktion langsamer ab, d.h. eine höhere Substratkonzentration ist nötig, um eine gleiche Reaktionsgeschwindigkeit zu erreichen. Weiterhin gibt es noch unkompetitiven Inhibitoren, welche zwar nicht die Andockstelle des Substrats blockieren, aber dennoch das Enzym von der Arbeit abhalten: ES ES EP EP EI EIS Diese unkompetitive Hemmung verringert die Reaktionsgeschwindigkeit noch stärker als die kompetitive Hemmung: Bei der kompetetiven Hemmung wird bei hoher Substratkonzentration die gleiche Geschwindigkeit erreicht, wie ohne Hemmung. Bei unkompetiver Hemmung wird nicht die gleiche Geschwindigkeit erreicht bei einer ungehemmten Reaktion, unabhängig von der Konzentration. Die Temperatur wirkt sich gleich in doppelter Hinsicht auf die Enzyme aus: Einerseits läuft die Reaktion bei höherer Temperatur schneller ab (Mitte), andererseits werden ab einer bestimmten Temperatur die Enzyme denaturiert, also zerstört (links). Das Resultat ist eine Geschwindigkeitskurve, die bis zu einem Maximalwert bei knapp 40° ansteigt und danach rapide abfällt. Das Resultat sieht dann so aus: Enzymbestand Einzelreaktionsgeschwindigkeit Reaktionsgeschwindigkeit Z.B. Schwermetalle (Versuch 3) können das Enzym denaturieren, oder H2O2 (Versuch 4). Azeton denaturiert das Enzym nicht, lediglich das Lösungsmittel wird umgewurschtelt (Versuch 4). Versuch Nr. 6 Bei Harnstoff trat keine Veränderung auf, bei Thioharnstoff nur eine leichte: S O NH2 H2N H2N urea NH2 thiourea Dieses unterschiedliche Verhalten erklärt sich durch die unterschiedlichen Elektronegativitäten von Sauerstoff und Schwefel; der Sauerstoff zieht die Elektronen, die es mit dem Kohlenstoff teilt dichter zu sich hin als Schwefel es tut. Wie sich das allerdings auf die Enzyme auswirkt kann ich nicht erklären. Ich brauche Hilfe!