Merksätze
Werbung

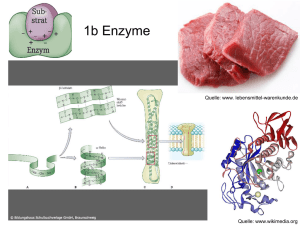
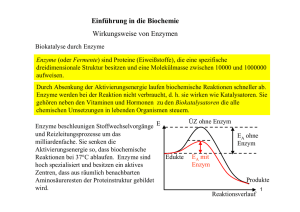
Katalysatoren sind Stoffe, die eine chemische Reaktion beschleunigen, am Ende der Reaktion aber wieder im ursprünglichen Zustand vorliegen Die Aktivierungsenergie ist jene Energie, die aufgewendet werden muss, um eine chemische Reaktion zu starten. Katalysatoren in Lebewesen werden als Biokatalysatoren oder Enzyme bezeichnet. Enzyme setzen die Aktivierungsenergie so weit herab, dass Stoffumwandlungen unter Körperbedingungen rasch ablaufen können. Enzyme gehen unverändert aus der Reaktion hervor und sind daher nur in äußerst geringen Konzentrationen erforderlich. Substrate sind Stoffe, die von Enzymen umgesetzt werden. Produkte sind jene Stoffe, die aus einer Reaktion hervorgehen. Substrat + Enzym [ES]-Komplex Produkte + Enzym Durch die Wechselzahl wird die Geschwindigkeit angegeben, mit der Enzyme ihr Substrat umsetzen. Sie gibt die Anzahl der Substratmoleküle, die in einer Sekunde umgesetzt werden und liegt i.A. zw. 103 und 106. Damit Enzyme ihre Substratmoleküle finden, haben sie eine charakteristische Oberfläche. Diese ist zerklüftet und besteht aus Hohlräumen und Spalten. Eine solche Spalte bildet das aktive Zentrum. Um 1890 verglich Emil Fischer das Substrat mit einem Schlüssel und das Enzym mit einem Schloss. Passen Schlüssel und Schloss zusammen, kommt es zu Wechselwirkungen zwischen Enzym und Substrat. Ein Enzym-Substrat-Komplex bildet sich vorübergehend, durch die Einlagerung des Substrates in das aktive Zentrum. Enzyme werden durch die Endung -ase gekennzeichnet. Enzyme sind hochmolekulare Proteine. Manche enthalten zudem einen Nicht-Proteinanteil, den man Coenzym oder auch Cofaktor nennt. Der Proteinanteil heißt dann Apoenzym, das gesamte Enzym Holoenzym. Substratspezifität: Aufgrund des Schlüssel-Schloss-Prinzips ist ein Enzym spezifisch für ein bestimmtes Substrat. Wirkungsspezifität: Ein Enzym katalysiert nur eine bestimmte Reaktion. Bei der kompetitiven Hemmung konkurriert ein Stoff, dessen Struktur dem Enzymsubstrat ähnlich ist, mit dem Substrat und blockiert das aktive Zentrum. Bei der nicht kompetitiven Hemmung bindet sich ein Inhibitor, z.B. ein Schwermetallion, an die Enzymproteine und inaktiviert sie irreversibel. Bei der allosterischen Hemmung lagert sich ein Hemmstoff nicht am aktiven Zentrum, sondern an einer anderen Stelle des Enzyms an und verändert die Struktur des gesamten Enzyms. Enzymaktivität Abhängigkeit von der Temperatur: Das Optimum der Enzymaktivität liegt i.d.R. im Bereich der Körpertemperatur. (Vgl. aber z.B. Bakterien in heißen Quellen!) Abhängigkeit vom pH-Wert: Je nach Wirkort haben die Enzyme oft ihr Wirkungsoptimum in einem bestimmten pH-Bereich. (Vgl. z.B. Verdauungsenzyme des Magens) Enzym-Hauptklassen 1) Oxidoreduktasen katalysieren Redoxreaktionen 2) Transferasen übertragen funktionelle Gruppen von einem Substrat auf ein anderes 3) Hydrolasen spalten Bindungen unter Einsatz von Wasser 4) Lyase katalysieren die Spaltung oder Synthese komplexerer Produkte aus einfachen Substraten, allerdings ohne Verbrauch von ATP. 5) Isomerase beschleunigen die Umwandlung von chemischen Isomeren 6) Ligase oder Synthethasen katalysieren Additionsreaktionen mithilfe von ATP.