Enzyme. sind Proteinmoleküle, die als . Biokatalysatoren
Werbung

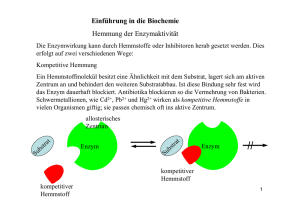
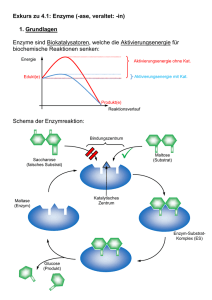
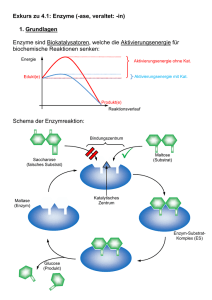
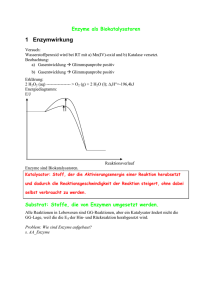
Biologie-Skript 11/12, Herr Blaurock 1. Cytologie – Zellkunde 1.1 Zellaufbau und Zellorganellen Alle uns bekannten Lebewesen sind aus Zellen aufgebaut. Daher ist die Untersuchung dieser Bausteine für die Biologie von großer Bedeutung. Anhand von grundlegenden Unterschieden in ihrem Aufbau werden zwei Typen von Zellen unterschieden, anhand derer auch alle Lebewesen in zwei sogenannte „Domänen“ unterteilt werden können: Die Prokaryoten und die Eukaryoten. Arbeitsblätter: Struktur eukaryotischer Zellen; Zellorganellen: Steckbriefe 1.2 Die Zellmembran Jede Zelle und die meisten Zellorganellen sind von Biomembranen umschlossen. Diese Membranen erfüllen mehrere Funktionen: - Zusammenhalten des Zellinhalts Auswahl von Molekülen, die in die Zelle eintreten/die Zelle verlassen können (selektive Permeabilität) Schnittstelle für Signalmoleküle Flexible Formgebung der Zelle Alle Biomembranen bestehen aus einer Phospholipid-Doppelschicht, die sich mithilfe zwischenmolekularer Kräfte von selbst ausrichtet. Phosphatkopf (wasseranziehend -> hydrophil) Fettsäureschwanz (wasserabweisend -> hydrophob bzw. fettanziehend -> lipophil) Da die Moleküle der Biomembran nicht miteinander verbunden sind, können sie sich innerhalb der Membran bewegen und besitzen keinen festen Platz. Die Funktionen der Biomembran werden von Proteinen übernommen, die in die Membran eingelassen sind. Sie werden als Membranproteine bezeichnet und können sich ebenfalls innerhalb der Membran frei bewegen. Man spricht daher bei Biomembranen von einem Flüssig-MosaikModell. Arbeitsblätter: Transportmethoden durch die Zellmembran; Zuordnungs-AB; Übungsaufgaben und Übersicht zum Membrantransport Membranproteine können nach ihrer Lage in der Membran in zwei Kategorien eingeteilt werden. - Proteine die auf einer Seite der Membran angelagert sind werden als periphere Proteine bezeichnet. Beispiel: Proteine in Signalketten Proteine die die Membran komplett oder teilweise durchdringen werden als integrale Proteine bezeichnet. Beispiel: Transportproteine Biologie-Skript 11/12, Herr Blaurock Ein letzter wichtiger Baustein im Membranaufbau sind Kohlenhydratketten. Diese befinden sich stets auf der Außenseite einer Zellmembran und dienen beispielsweise der Zellerkennung durch das Immunsystem. Die Kohlenhydratketten sind stets an einen Membranbaustein gebunden und werden hierdurch kategorisiert. - Kohlenhydratketten, die an ein Phospholipid gebunden sind werden als Glykolipide bezeichnet. Kohlenhydratketten, die an ein Membranprotein gebunden sind werden als Glykoproteine bezeichnet. Präsentation zum Thema Osmose 1.3 ATP- Die universale Energiewährung der Zelle Arbeitsblatt: ATP – Die universale Energiewährung der Zelle 1.4 a) b) c) d) e) f) 1.5 Proteinaufbau (Aufgabe aus Coverstunde) Aminosäure Peptidbindung Primärstruktur Sekundärstruktur Tertiärstruktur Quartärstruktur Buch S. 22/23 Enzyme Arbeitsblatt: Enzyme Definition (vom AB) Enzyme sind Proteinmoleküle, die als Biokatalysatoren fast alle Stoffwechselreaktionen in Organismen beschleunigen. Enzyme senken die Aktivierungsenergie einer ganz bestimmten Reaktion, gehen aus dieser jedoch unverändert hervor. Ausgangsstoffe einer enzymatischen Reaktion werden als Substrate bezeichnet. Substratspezifität (Schlüssel-Schloss-Prinzip) Das sogenannte aktive Zentrum eines Enzyms ist aufgrund seiner Raumstruktur ("das Schloss": Tertiär/Quartärstruktur des Proteins) nur für bestimmte Moleküle ("die Schlüssel": das Substrat) zugänglich. Beispiel: Chymotrypsin Biologie-Skript 11/12, Herr Blaurock Wechselzahl Sagt aus, wie viele Substratmoleküle in einer bestimmten Zeiteinheit durch das Enzym umgesetzt werden können. hohe Wechselzahl: schnell arbeitendes Enzym niedrige Wechselzahl: langsam arbeitendes Enzym Benennung Enzyme werden meist nach ihrem Substrat benannt: Amylase - katalysiert Stärkeabbau (Amylose) Lipase - katalysiert Fettabbau (Lipide) Protease - katalysiert Eiweißabbau (Proteine) Arbeitsblatt: Abhängigkeit der Enzymaktivität Abhängigkeiten der Enzymaktivität (vom AB) Substratkonzentration Die Umsatzgeschwindigkeit eines Enzyms hängt von der Substratkonzentration ab. Bei steigender Substratkonzentration wächst die Umsatzgeschwindigkeit, da die Wahrscheinlichkeit eines Zusammenstoßes von Enzym- und Substratmolekül höher wird. Bei sehr hohen Konzentrationen erreicht die Umsatzgeschwindigkeit asymptotisch die Maximalgeschwindigkeit vmax. Die Substratkonzentration bei halber Maximalgeschwindigkeit wird Michaelis-Menten-Konstante (KM) genannt. Einfluss des Bindungspartners auf die Enzymaktivität Kompetitive Hemmung Bei der kompetitiven Hemmung treten das Substrat und der Hemmstoff, der das aktive Zentrum des Enzyms für eine kurze Zeit besetzen kann, dabei aber nicht gespalten wird, in „Wettbewerb“. Entscheidend ist dabei, wie hoch die Wahrscheinlichkeit ist, dass ein unbesetztes Enzymmolekül auf ein Substratmolekül bzw. ein Hemmstoffmolekül trifft. Bei einer niedrigen Konzentration des Substrats ist die Wahrscheinlichkeit, dass ein Enzymmolekül auf ein Substratmolekül trifft niedriger als die Wahrscheinlichkeit auf ein Hemmstoffmolekül zu treffen. Die meisten Enzyme werden mit dem Hemmstoff besetzt, die Reaktionsgeschwindigkeit ist daher niedriger als bei der ungehemmten Reaktion. Bei sehr hohen Substratkonzentrationen ist die Wahrscheinlichkeit, dass das Enzymmolekül auf ein Substratmolekül trifft, sehr hoch. Daher ist der Effekt des Hemmstoffes hier kaum noch zu spüren. Die Maximalgeschwindigkeit der Reaktion vmax ist daher unverändert gegenüber der ungehemmten Reaktion. Allerdings wird vmax erst später erreicht, KM ist also größer. Schaubild und Grafik dazu siehe Buch S. 28 Biologie-Skript 11/12, Herr Blaurock Allosterische Hemmung Bei der allosterischen Hemmung treten Enzym und Hemmstoff nicht wie bei der kompetitiven Hemmung in Konkurrenz um das aktive Zentrum. In diesem Fall besitzt das Enzym zwei getrennte Bindungsstellen, eine für das Substrat und eine für den Hemmstoff. Die räumlich Struktur, und damit auch die Passform für das Substratmolekül, ändern sich in Abhängigkeit davon, ob ein Hemmstoffmolekül an der zweiten Bindungsstelle anliegt oder nicht. Mit gebundenem Hemmstoffmolekül passt das Substrat nicht in die ursprüngliche Bindungsstelle und kann daher das aktive Zentrum nicht erreichen. Ist kein Hemmstoff gebunden kann die Substratreaktion normal durch das Enzym katalysiert werden. Es gibt übrigens auch den umgekehrten Fall, also Enzyme deren aktives Zentrum erst durch die allosterische Veränderung für das Substrat zugänglich wird. Da die Bindung des Hemmstoffs an seiner eigenen Bindungsstelle von der Substratkonzentration unabhängig ist. ist ein gewisser Prozentsatz aller Enzymmoleküle bei der allosterischen Hemmung dauerhaft inaktiv. Insgesamt entspricht das Schaubild der Reaktionsrate daher einer Reaktion, der eine geringere Substratmenge hinzugefügt wurde: Vmax ist im Vergleich zur ungehemmten Reaktion kleiner, ½ vmax wird aber bei der gleichen Substratkonzentration erreicht, KM ist also gleich. Schaubild und Grafik dazu siehe Buch S. 29 Irreversible Hemmung Im Vergleich zu der reversiblen Hemmung, bei der die Hemmstoffe eine Bindungsstelle nach kurzer Zeit wieder verlassen, bleibt der Hemmstoff bei der irreversiblen Hemmung entweder permanent an der Bindungsstelle haften oder aber er verändert die Raumstruktur des Enzyms permanent, wodurch die ursprüngliche Enzymfunktion nicht wiederhergestellt werden kann. Ein Beispiel für letzteres sind Schwermetallionen, die Disulfidbrücken in Proteinen zerstören können und damit die Tertiärstruktur des Moleküls verändern.