3.1 Grundlagen der Enzymkinetik
Werbung

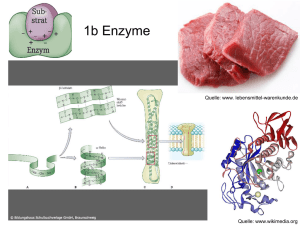
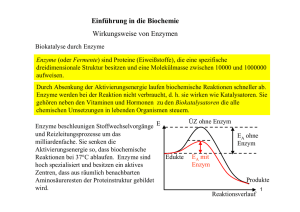
Gliederung Grundlagen der Enzymkinetik Referat von Anna Blume Definition: Enzyme • Enzyme sind Proteine, die als biologische Katalysatoren die ablaufenden Reaktionen in Organismen beschleunigen , ohne dabei das Gleichgewicht der Reaktion zu beeinflussen. • Sie besitzen spezifische Bindungsstellen, die nicht nur die selektive Anlagerung von Substraten ermöglichen ( Aktives Zentrum, Schlüssel- Schloss-Prinzip), sondern auch zur Regulation der katalytisierten Reaktionen dienen (Allostrisches Zentrum). • Enzyme besitzen Temperatur- und pH- Optimum in denen sie funktionieren, die optimalen Arbeitsbereiche sind enzymspezifisch. • Definition Enzyme • Aktivierungsenergie und Aktives Zentrum • Steady-State Theorie und Michaelis-Menten -Konstante • Michaelis-Menten Kinetik • Inhibition Warum kommt es zu einer Senkung der Aktivierungsenergie? Das Aktive Zentrum: 1.Fixiert Substrat und bringt es in richtige Orientierung 2.Enthält Coenzyme 3. Reaktive Gruppen, wie Protonendonatoren bringen Substrat in reaktionsfähigen Zustand. 4.Ausschluss von Wasser verstärkt die Stabilität ionischer Bindungen 1 Abhängigkeit der Reaktionsgeschwindigkeit eines Enzyms von der Substratkonzentration: • • Steady-State-Theorie: Es herrscht ein Fließgleichgewicht zwischen den Geschwindigkeiten, mit denen der Enzym-Substrat-Komplex in das Enzym und das Produkt (k2) bzw. das Enzym und das Substrat (k-1) zefällt, und mit der er gebildet wird (k1). Der k-2 Wert ist am Anfang der Reaktion zu gering, und deshalb zu vernachlässigen. • Bildungsgeschwindigkeit von [ES]=k1[E][S] • Zerfallsgeschwindigkeit von [ES]=(k-1 + k2)[ES] • Die MichaelisMenten-Konstante Km = Voraussetzungen für eine MichaelisMenten-Kinetik: 1. Die enzymkatalytische Reaktion hängt nur von der Konzentration eines Reaktionspartners ab, da von einer festen, gegebenen Enzymmenge ausgegangen wird. 2. v ist linear, wenn [S] klein und P noch nicht gebildet ist. (Rkt. 1. Ordnung) 3. Bei einer Substratsättigung erreicht v ein Maximum (Rkt. 0. Ordnung). Alle Enzyme sind belegt. 4. Der geschwindigkeitsbestimmende Schritt ist der Zerfall von Enzym-Substrat-Komplex zum Enzym und Produkt (k2), wobei ja k-2 in der Anfangsphase vernachlässigt wird. [ E ][S ] k 2 + k −1 = [ ES ] k1 Der Km –Wert wird in mol/l angegeben und ist ein Maß für die Affinität zwischen Enzym und Substrat. Ist Km klein, hat das Enzym eine große Affinität, ist Km klein hat das Enzym eine geringe Affinität. Km ist also enzymspezifisch Michaelis-Menten-Kinetik • • 1 v=k2 x [ES] weil k2 geschwindigkeitsbestimmender Schritt und v proportional zu [ES] 2 v max= k2 x[E total]= k2 x ([E]+ [ES]) Weil Maximalgeschwindigkeit erreicht wird, wenn alle Enzyme belegt sind. Dividiert man ½ erhält man: v/ vmax = [ES]/ [E]+ [ES] Wenn [S]=KM wird v =v max/2, d.h. KM ist die Substratkonzentration, bei der die Reaktionsgeschwindigkeit halbmaximal ist. Michaelis-Menten-Gleichung: v = v max ⋅ [ S ] K m + [S ] • Die Gleichung entsteht durch das Zusammenfügen der Gleichungen: v [ E ][S ] k 2 + k −1 [ ES ] = & Km = = v max v Zu: v max Nach Umformung: [ E ] + [ ES ] = v= [ ES ] k1 [ E ][ S ] [ E ] + [ E ][ S ] K m ⋅ Km v max ⋅ [ S ] K m + [S ] 2 Doppelt reziproke Schreibweise nach Lineweaver und Burk: Gleichung nach dem Schema. y= ax + b a=Steigung der Geraden b= Schnittpunkt mit der y-Achse Die Michaelis-Menten-Kurve nähert sich v max nur asymptotisch, hier ist der Kehrwert von v max der Schnittpunkt der y-Achse. K 1 1 1 = + m ⋅ v vmax vmax [ S ] Beispiel der Michaelis-MentenKinetik • Ein Beispiel wie sich unterschiedliche Km Werte in biologischen Systemen auswirken können: • Viele Asiaten vertragen keinen Alkohol. Dieser Effekt wird durch Acetaldehyd hervorgerufen, der durch AD gebildet wird. • EtOH + NAD+ Acetaldehyd + NADH • Acetaldehyd wird durch eine weitere DH zu Acetat abgebaut. Hiervon hat der Mensch 2 Isoenzyme: Mitochondriale DH mit niedrigem Km und cytosolische DH mit hohem Km.Bei alkoholempfindlichen Menschen ist die mitochondriale DH mutiert und daher inaktiv • Acetaldehyd wird aufgrund des hohen cytosolischen Km nur sehr schlecht abgebaut und daher ins Blut abgegeben. Dies führt zu den uns allen bekannten Effekten. Die Hemmung von Enzymen durch spezifische Moleküle • • Die Aktivität vieler Enzyme kann durch Bindung von Inhibitoren beeinflusst werden. Man unterscheidet folgende Inhibitoren: Irreversible Inhibitoren: Diese Inhibitoren binden sehr fest (häufig kovalent) an das Enzym und unterdrücken damit die Enzymaktivität (Bsp. Penicillin, Aspirin) Reversible Inhibitoren: Diese Inhibitoren binden reversibel an das Enzym und können die Aktiviät über drei Möglichkeiten beeinflussen: Kompetitive Hemmung Nicht- Kompetitive Hemmung Unkompetitive Hemmung 3 Literaturverzeichnis • Löffler und Petrides: Biochemie und Pathobiochemie (5. Auflage) • Horn: Biochemie des Menschen (2. Auflage) • Biochemie Praktikum Enzyme S 2005/06 • www.biozentrum.uniwuerzburg.de/biochemie/vorlesung • http://www.natur.sbg.ac.at/arnulf/biochem/pdf/bsp 1%20v1.pdf 4