Document
Werbung

Enzymkinetik
•
•
•
•
•
Aufbau und Einteilung von Enzymen
Kinetik enzymkatalysierter Reaktionen
Michaelis-Menten-Gleichung
Lineweaver-Burk-Auftragung
Hemmung enzymkatalysierter Reaktionen
ö !"#$
%&'()*+,-)&
ö
Was sind Enzyme?
ü
ü
!"#
$%
&
'() $*
&
+#
•
Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen
(=Synthasen), Isomerasen, Ligasen (=Synthetasen)
ö
Aufbau der Enzyme
ä(#
-#
.#
$/0&
-1#2
-#
!ä
ö
Aufbau der Enzyme
%
!*#
$"3&
4#
bestehen aus einem:
• Proteinanteil, dem Apoenzym und einem
• Kofaktor, einem niedermolekularen Molekül (kein
Protein)
• Organische Moleküle als Kofaktoren werden Koenzyme
genannt, sind sie kovalent an das Apoenzym gebunden,
nennt man sie prosthetische Gruppe
ö
Koenzyme:
(
$(&
•
Wird als Energiequelle für die enzymatische Reaktion
genutzt
'
•
Wird als Elektronenakzeptor (NAD+) oder als
Elektronendonator (NADH + H+) genutzt
"ö-!
-
ö
Wie wirken Enzyme?
"
(!
ü
ß
„!28 9))*1
#
) ä
ö
Das aktive Zentrum des Enzyms:
"
:
!')ß)(
*ä#
;ß <9ü
äö)!
=
• Wasserstoffbrücken, elektrostatische Wechselwirkungen,
hydrophobe Effekte
ö
Beispiel einer enzymkatalysierten Reaktion:
(!(
>#
'
3434.4?'(
4
34)3.)4?'(4?
'./&&& #
$#
'&&&'$###(
ö
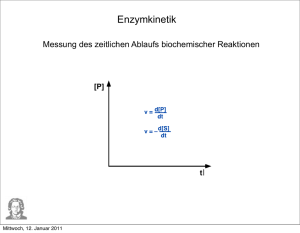
Enzymkinetik
ä
% #
• Maß für die Änderung der Substratkonzentration mit
der Zeit
•
= Stoffmenge an Substrat, die in einem bestimmten
Volumen pro Zeiteinheit umgesetzt wird [mol / L.s]
•
Abh. von: Temp., Salzkonz., pH-Wert, [E], [S], [P],
Inhibitoren, Aktivatoren
ö
Reaktionsgeschw. <> Enzymaktivität
!ä#
•
Unit (U) oder Katal (kat)
•
1U: diejenige Menge an Enzym, die 1 µmol Substrat
pro Minute umsetzt
(es gibt aber auch andere Definitionen)
•
1 kat: 1 mol/s
ö
Enzymkinetik
E+S
k1
k-1
ES
k2
P+E
/
/
/:) *1
/
/@
ö
Enzyme sind Katalysatoren
Energie
EA
-*
$&
S
P
Reaktionsablauf
AB ) AB ö
Überlegungen zur Enzymkinetik
E+S
k1
k-1
ES
k2
P+E
* zu Beginn liegt [S] meist im Überschuß vor
*
„Enzymsättigung“ [ES] = [E]
*
Fließgleichgewicht „steady state“
* v wird unabhängig von [S] (v = vmax,
Reaktion 0. Ordnung)
ö
[S]
Steady state
[P]
$!/!&
[E]
[E]
[ES]
t
ö
Michaelis-Menten-Gleichung
k1
E+S
k-1
k2
ES
P+E
Voraussetzungen:
1.) k-2 << als k2
(experimentelle Irreversibilität -> K-2= 0)
2.)
k2 << k1, k-1
d.h. Zerfall des ES Komplexes
in E und P ist geschwindigkeitsbestimmend
ö
Reaktionsgeschwindigkeit einer Enzymreaktion:
vmax * [S]
v=
KM + [S]
ö
Michaelis-Menten Kurve:
ü
•
ä
2
ü
• • !""ä
#$%&
$&
ö
Zusammenhang der Reaktionsgeschwindigkeit mit
[S] und vmax:
C
* /A
=ü!
• vmax 1 = 0,1; vmax 2 = 0,2
• ' #ö
ö
• !
• ) #$%&
ä
• *
+
$
#$%&
,
--
#$%&
.
ö
KM: gibt an, wie schnell bei steigender [S] die
Maximalgeschwindigkeit erreicht wird
C
!/A
=ü*
• KM 1 = 1; KM 2 = 10
•ö
•
!ü#
$%!!ä'#(
•)*#*$'$
'+('+,
$#*$'$
'+ä
•#*$'$
-.*$/
ö
Michaelis-Menten-Kurve:
'#
*!!! * (#>
--)*!
(#
• Lineweaver-Burk-Auftragung
ö
Lineweaver-Burk Auswertung
--)@#
=
+
/D1?
ö
Lineweaver-Burk-Auswertung:
A
*
A
max
/*0
&ö " 1
*&&
&
A
EF
A
*
ö
Änderungen der Enzymaktivität:
(!ä!
"
!
#
Aktivatoren: fördern die durch das Enzym katalysierte
Reaktion
• Inhibitoren: hemmen die durch das Enzym katalysierte
Reaktion
#
• das katalytische Zentrum des Enzyms binden
• oder an eine andere Stelle des Enzyms
•
ö
Einteilung der Enzymhemmung:
2&&
$*0
&- 2&&0
!
/4! $*0
/4566!
546&%4/4!
&&
54%
7
&&
#$%&
4 $
! %48! &&
7%4% 9 4
2&&
'
3
&
&
#$%&
ä
3
2&&
7$
-$
!:
7% „9<
&&:
$*
7 &&
'4!4=--
'
3
"
#$%&:
$
ö
ö
Reversible Hemmung: kompetitive Inhibitoren
0)#*
88
(///$6$
///6$
76$ öß
•#öß 2
•%'
•)3#!
45#*(2
ö
Reversible Hemmung: Nicht-kompetitive
Inhibitoren
6$*9#
6$'+,*'#
$,'#5$#*5#
(///6$
///$6$
•#öß 2
•)3#!
76$ *
%'5#*–(2
•4öß(2
ö







![E + S [ES] E + P Enzyme](http://s1.studylibde.com/store/data/011452180_1-cbdca6d5ea6d6e898aef4e3165d8acb4-300x300.png)


