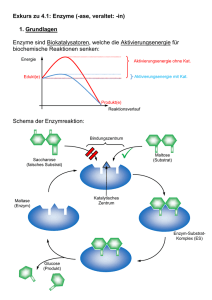
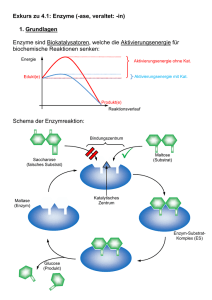
09-Enzymkinetik_WS20..
Werbung
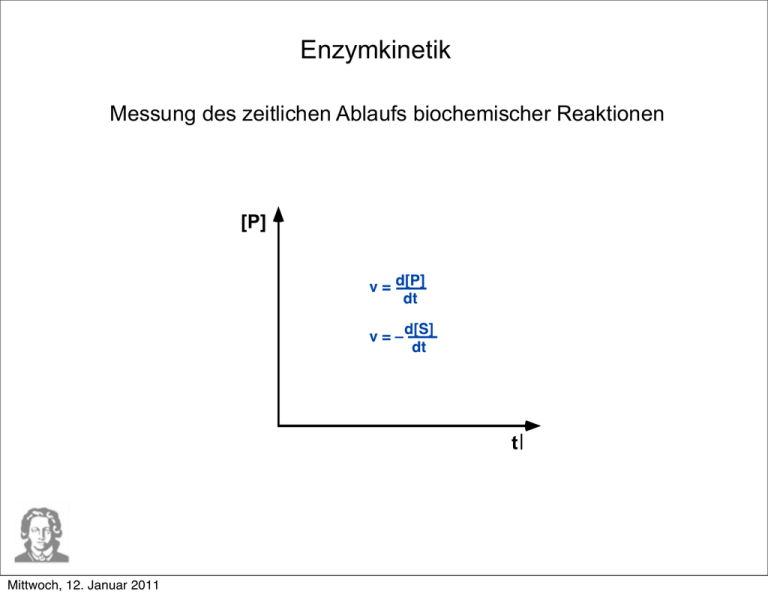
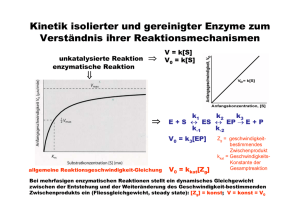
Enzymkinetik Messung des zeitlichen Ablaufs biochemischer Reaktionen [P] t Mittwoch, 12. Januar 2011 Enzymkinetik Messung des zeitlichen Ablaufs biochemischer Reaktionen [P] d[P] v= dt t Mittwoch, 12. Januar 2011 Enzymkinetik Michaelis-Menten-Auftragung E+S Mittwoch, 12. Januar 2011 [ES] E+P Enzymkinetik Michaelis-Menten-Auftragung E+S Mittwoch, 12. Januar 2011 [ES] E+P Enzymkinetik Michaelis-Menten-Auftragung Mittwoch, 12. Januar 2011 Enzymkinetik Michaelis-Menten-Auftragung Mittwoch, 12. Januar 2011 Enzymkinetik Michaelis-Menten-Auftragung Mittwoch, 12. Januar 2011 v= vmax [S] KM + [S] 0,5vmax = vmax [S] KM + [S] 0,5vmax (KM + [S]) = vmax [S] 0,5vmax KM + 0,5vmax [S] = vmax [S] 0,5vmax KM = vmax [S] - 0,5vmax [S] 0,5vmax KM = 0,5vmax [S] KM = [S] Mittwoch, 12. Januar 2011 Enzymkinetik Michaelis-Menten-Auftragung Mittwoch, 12. Januar 2011 Enzymkinetik Michaelis-Menten-Konstante KM • experimentell bestimmbar als diejenige Substratkonzentration [S], bei der die Reaktionsgeschwindigkeit halbmaximal ist • charakteristische Größe eines Enzym/Substrat-Paares • unabhängig von [E] und [S] in der Reaktion • hat die Einheit mol/l (M) • je höher die Bindungsaffinität des Enzyms zum Substrat ist, desto kleiner ist die KM ! 10-9 M Mittwoch, 12. Januar 2011 10-6 M Um 90% Maximalgeschwindigkeit einer enzymatischen Reaktion zu erreichen, muß die Substratkonzentration betragen: A. B. C. D. E. gleich KM 5 KM 4,5 KM 9 KM 90 KM A B C D E Mittwoch, 12. Januar 2011 X v= vmax [S] KM + [S] 0,9vmax = vmax [S] KM + [S] 0,9vmax (KM + [S]) = vmax [S] 0,9vmax KM + 0,9vmax [S] = vmax [S] 0,9vmax KM = vmax [S] – 0,9vmax [S] 0,9vmax KM = [S] 0,9vmax 0,1vmax KM = 0,1vmax [S] 9 KM = [S] Mittwoch, 12. Januar 2011 v Vmax 90% Vmax 80% Vmax 1 2 3 4 5 6 7 8 9 10 11 1213 KM Mittwoch, 12. Januar 2011 [S] Examensfrage ! Was ist ein KM-Wert? A. B. C. D. Eine nummerische Konstante für die Umrechnung von Grad Celsius in Kelvin. Eine charakteristische Kenngröße für die Affinität eines Enzyms zu einem Substrat. Die Michaelis-Menten-Konstante.. Die Substratkonzentration, bei der vmax am größten ist. A B C B, C B, D Mittwoch, 12. Januar 2011 X Enzyme Enzyme arbeiten bei einem Temperaturoptimum Aber!!! Enzymatische Reaktionen werden bei 25°C gemessen Mittwoch, 12. Januar 2011 Enzyme Enzyme arbeiten bei einem pH-Optimum Enzymatische Reaktionen werden am pH-Optimum gemessen Mittwoch, 12. Januar 2011 Isoenzyme • • • • • katalysieren dieselbe Reaktion unterscheiden sich durch Aminosäuresequenzen können verschiedene Affinitäten (KM) zum Substrat haben können innerhalb derselben Zelle auftreten Isoenzym-Muster können sich im Laufe der Entwicklung einer Zelle verändern Mittwoch, 12. Januar 2011 Hemmung einer enzymatischen Reaktion Mittwoch, 12. Januar 2011 Enzymhemmung Kompetitive Hemmung Nichtkompetitive Hemmung Allosterische Enzymregulation Mittwoch, 12. Januar 2011 Kompetitive Hemmung eines Enzyms Michaelis-Menten-Auftragung Lineweaver-Burk-Auftragung scheinbare Änderung der KM gleiche vmax Mittwoch, 12. Januar 2011 Nichtkompetitive Hemmung eines Enzyms Michaelis-Menten-Auftragung Lineweaver-Burk-Auftragung gleiche KM geringere vmax Mittwoch, 12. Januar 2011 Produkthemmung E1 S Mittwoch, 12. Januar 2011 E2 P1 E3 P2 E4 P3 P4 Allosterische Enzymregulation Sequenzmodell E Mittwoch, 12. Januar 2011 S ES E P

![E + S [ES] E + P Enzyme](http://s1.studylibde.com/store/data/011452180_1-cbdca6d5ea6d6e898aef4e3165d8acb4-300x300.png)