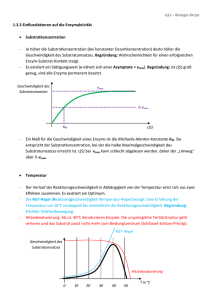
Versuch K 3 1 Enzymkinetik
Werbung

ENZYMKINETIK
K3-1
Versuch K 3
1 Enzymkinetik
1.1 Theoretische Grundlagen:
Enzyme gehören zur Klasse der Proteine (Eiweißstoffe). Die Monomereinheiten, aus denen
sie aufgebaut sind, sind Aminosäuren. Enzyme sind die Katalysatoren lebenswichtiger
Prozesse in der Zelle. Ihre zentrale Bedeutung lässt sich in dem Satz - Ohne Enzyme kein
Leben- zusammenfassen. Je nach dem Typus der biochemischen Reaktion, die katalysiert
wird, lassen sich die Enzyme unterteilen in:
¾ Oxidoreduktasen: Redoxprozesse (z.B.: NAD+/NADH+H+)
¾ Transferasen: Gruppenübertragungsreaktionen (z.B.: Methylgruppen)
¾ Hydrolasen: Hydrolysen (z.B: Esterverseifung, Peptidspaltung)
¾ Lyasen: nicht hydrolytische Bindungsspaltung(z.B.: C-C, =C=O)
¾ Ligasen: Kopplung zweier Substrate (z.B.: Eiweißsynthese)
¾ Isomerasen: Isomerisierungsreaktionen (z.B.: Keto-Enol-Umwandlung)
Enzymreaktionen folgen den Gesetzen der Reaktionskinetik, wenn man das Enzym als
stöchiometrische Größe mit in den Reaktionsablauf einbezieht. Um der Katalysatorfunktion
gerecht zu werden, muss man einen Kreisprozess formulieren:
E
+
S
ES
EP
E
+
P
Das Enzym (E) bildet mit dem Substrat (S) einen kurzlebigen Enzym-Substrat Komplex (ES),
der zu einem Enzymproduktkomplex (EP) umgesetzt wird. Diese bildet nach seinem Zerfall
das Produkt (P) und regeneriert dabei das Enzym. Michaelis und Menten formulierten 1913
einen Mechanismus, mit dem sich die Kinetik enzymatisch katalysierter Reaktionen einfacher
beschreiben lässt (Vernachlässigung der Bildung des Enzym-Produkt-Komplexes:
K3-2
ENZYMKINETIK
E
+
S
k2
k1
ES
k -1
E
+
P
k -2
Dies ist ein Beispiel einer Folgereaktion. Unter der Voraussetzung, dass k2 << k1 ist, gilt die
Bodensteinsche Näherung für die Quasistationarität:
d [ES] / dt = k1 [E][S] - k-1[ES] - k2[ES] + k-2[E][P] = 0
Hier stellt [E] die Konzentration an freiem Enzym dar .
Durch die Annahme, dass zu Anfang [P]= 0 und weitere Umformungen, folgt schließlich die
Michaelis-Menten-Gleichung:
v = - d[S] / dt = k2[ES] = k2[Eo] [S] / {KM + [S]}
(I)
wobei [Eo ] = [E] + [ES] die gesamte Enzymkonzentration (Summe aus freiem und vom
Substrat gebundenem Enzym) darstellt.
KM ist die Michaelis-Menten-Konstante:
KM = {([Eo] - [ES]) [S] } / [ES]
Für [S] >> KM (Substratüberschuss) läuft die Reaktion mit maximaler Geschwindigkeit ab.
Die Michaelis-Menten-Gleichung wird zu:
vmax = k2 [E0]
Setzt man dies in Gleichung I ein so ergibt dies.
v = - d[S] / dt = d[P] / dt = vmax [S] / {KM + [S]}
(II)
Eine wichtige Beziehung erhält man für den Fall, dass v = vmax / 2 :
KM = [S]
(Welche Einheit hat also die Michaelis-Menten-Konstante?)
Hieraus ergibt sich praktisch die Möglichkeit zur Bestimmung von KM . In der Praxis geht
man allerdings so vor, dass man Gleichung II entweder in die Lineweaver-Burk- oder die
Eadie-Hofstee-Beziehung verwandelt und KM dann graphisch ermittelt. (siehe Lehrbuch !!!,
z.B. Moore-Hummel, Physikalische Chemie)
ENZYMKINETIK
K3-3
Zur Untersuchung enzymkatalysierter Methoden kommen je nach Reaktionstyp verschiedene
Methoden (pH-Wert, Leitfähigkeitsmessung, Sauerstoffbestimmung, Photometrie) zur
Anwendung. In diesem Versuch soll die Änderung der Extinktion (Absorption) des
enzymkatalysierten Alkoholabbaus mittels der Photometrie untersucht werden. Ein
Absorptions photometer ist prinzipiell folgendermaßen aufgebaut:
Lichtquelle
Messküvette
Blende
Monochromator
(Gitter oder Prisma)
Photomultiplier
Verstärker und
Anzeige
Das Lambert-Beersche-Gesetz, in seiner für die Photometrie relevanten Form, sagt aus, dass
die Extinktion (dekadischer Logarithmus des Intensitätsverhältnis von eintretendem zu
austretendem Licht: I0/I ) vom molaren Extinktionskoeffizienten ε, der Dicke der Küvette d
(beide konstant und per Eichmessung bestimmbar) und der Konzentration c (z. B. Produkt das
gebildet wird und Licht einer bestimmten Wellenlänge absorbiert) abhängig ist.
E = log I0/I = ε c d
(III)
Bei konstanter Wellenlänge (ε = konst) und definierter Küvettenlänge d ist damit die
Extinktion proportional zur Konzentration des absorbierenden Stoffes. Dies ist das
Messprinzip der Photometrie, mit der Konzentrationen gemessen werden können. Gleichung
II lässt sich umformen in:
v = d[P] / dt = dc / dt = vmax [S] / (KM + [S])}
Gleichung III nach c aufgelöst und in IV eingesetzt ergibt (ε d = konstant):
(IV)
K3-4
ENZYMKINETIK
dE / dt = ε d {vmax⋅[S] / (KM + [S])} = konst⋅v
(mit konst= ε·⋅d)
1.2 Experimenteller Teil:
1.2.1
a)
Einfluss der Substratkonzentration auf die Enzymkinetik
Prinzip:
Die Peroxidase (POD) katalysiert unter Verbrauch von Wasserstoffperoxid die Oxidation von
2,2´´-Azino-di[3-ethylbenzthiazolinsulfonate (6)] (ABTS) zu einem grünen Farbstoff
ABTS
+
H2O 2
PO D
grüner Farbstoff
+
H2O
Die Reaktion lässt sich aufgrund des charakteristischen Absorptionsmaximums des Farbstoffes bei 405 nm photometrisch verfolgen. Bei überschüssiger Enzym (POD) soll der Einfluss der Substratkonzentration (ABTS) auf die Reaktionsgeschwindigkeit untersucht werden.
b)
Material:
¾ 2,2´´-Azino-di[3-ethylbenzthiazolinsulfonate (6)] (ABTS)
¾ Peroxidase-Lösung (0.2 mg Enzym . ml-1)
¾ Wasserstoffperoxid -Lösung, 30%ig
¾ Pufferlösung, pH 4.4-4.5 (0.8359 g Citronensäuremonohydrat, 1.068 Dinatriumhydrogenphosphat, 100 ml destilliertes Wasser)
c)
Versuchsausführung:
Vor Beginn des Versuchs soll das Spektrometer eingeschalten und auf 405 nm eingestellt
werden. Nach einer Viertelstunde hat der Temperaturausgleich stattgefunden. Nun soll durch
Drücken der Taste Mode auf Absorption gestellt werden. Eine Küvette, die mit Pufferlösung
(2 ml) gefüllt ist, wird in das Spektrometer gestellt und ein Nullabgleich - bei geschlossenem
Spektrometer - durchgeführt (Drücken der correction-Taste).
Bei jeder nun folgenden
Messung muss der Deckel ebenfalls geschlossen sein. In einer Versuchsreihe soll eine
ENZYMKINETIK
K3-5
Abhängigkeit der Reaktionsgeschwindigkeit für verschiedene Substratkonzentrationen
ermittelt werden.
Zu beachten:
Den Deckel des Spektrometers bitte immer vorsichtig schließen nie fallen lassen!
Zur Ausführung des Versuchs wird zunächst eine Lösung von 10 mg ABTS in 1 ml
Pufferlösung hergestellt. Diese Lösung wird auch noch für den zweiten Versuchsteil benötigt.
Es werden fünf Ansätze mit je 2.0 ml Pufferlösung, 5 µl Peroxidaselösung und 5 µl
Wasserstoffperoxid in 5 Küvetten gegeben . Nun wird die erste Küvette in das Spektrometer
gestellt und der Rührmotor eingeschaltet (Rührfisch in Küvette geben - dreht er sich?). Nach
Zugabe von 2 µl der ABTS-Lösung wird sofort die Stoppuhr gestartet, der Deckel vorsichtig
geschlossen und sofort alle 10 Sekunden die Extinktion 2 Minuten lang notiert. Die gleiche
Prozedur wiederholt man mit 4 µl, 6 µl, 10 µl, 25 µl ABTS.
Zu beachten ist:
Für Peroxidase, ABTS und Wasserstoffperoxid bitte separate Mikroliterspritzen nehmen
(entsprechend der Beschriftung)!!!
d)
Auswertung:
Die Extinktionswerte sind für jede Substratkonzentration (Mw(ABTS) = 548.7) in einem
Diagramm gegen die Zeit [s] aufzutragen (Michaelis-Menten-Graphik). Die Steigungen
(Änderung der Extinktion mit der Zeit) entsprechen den Reaktionsgeschwindigkeiten
(Gleichung III), die man in einem anderen Diagramm in Abhängigkeit von der
Substratkonzentration [mol/l] aufträgt. Mit Hilfe dieses Diagramms ermittelt man vmax /2 und
die Michaelis-Menten-Konstante. Außerdem erstelle man das Lineweaver-Burk-Diagramm,
um die gleichen Werte zu ermitteln. Hierfür wird die Michaelis-Menten-Gleichung
umgeformt in:
1/v = {KM / vmax [S]} + 1 / vmax
Nun trage man 1/v gegen 1 / [S] auf und ermittle vmax aus dem Ordinatenabschnitt und KM aus
dem Abszissenabschnitt.
K3-6
ENZYMKINETIK
Zu beachten:
Die Ergebnisse sind nicht mit Literaturwerten vergleichbar, da es sich bei der eingesetzten
Peroxidase um ein Antikörperkonjugat handelt, so dass die Aktivität des Enzyms verändert ist.
1.2.2
a)
Einfluss der Enzymkonzentration auf die Reaktionsgeschwindigkeit
Prinzip: (gleiche Reaktionsgleichung wie bei Versuch 1)
Die Reaktionsgeschwindigkeit derselben Reaktion wie oben soll - jetzt bei Substratüberschuss - in Abhängigkeit von der Enzymkonzentration (POD) untersucht werden.
b)
Material:
wie bei Versuch 1
c)
Ausführung:
Zunächst entnimmt man mit der entsprechenden Mikroliterspritze 10 µl aus der PeroxidaseLösung und mischt mit 1 ml PBS-Pufferlösung (pH 4.4) in einem Reagenzglas. Man erhält
also eine Verdünnung von 1:100. In 5 Küvetten lege man jeweils 2.0 ml Pufferlösung, 5 µl
Wasserstoffperoxid und verschiedene Volumina der Peroxidase-Verdünnung (0, 10, 20, 30,
40 und 100 µl) vor. Nun wird der Rührmotor gestartet und nach der Zugabe von 25 µl der
ABTS-Lösung (aus Versuch 1) die Extinktion 2 Minuten lang alle 10 s aufgenommen.
Zu beachten:
Nach Beendigung der Versuche bitte alle verwendeten Glasgeräte und Mikroliterspritzen mit
destilliertem Wasser spülen (Küvetten zuerst mit Küvettenspüli und anschließend
destilliertem Wasser) und zum Trocknen in die entspreechenden Vorrichtungen stellen
(Küvettenständer, Pipettengestell).
ENZYMKINETIK
d)
K3-7
Auswertung:
In einem Diagramm sind für jede Enzymkonzentration (Mw(POD) = 40.000) die gemessenen
Extinktionswerte gegen die Zeit aufzutragen. Die Steigungen (dE/dt) sind aus dem Diagramm
abzulesen. Die entsprechenden Enzymkonzentrationen sind in einem zweiten Diagramm
gegen die ermittelten Steigungen aufzutragen. Man erhält eine Eichkurve, die eine
Voraussage der zu erwartenden Extinktionsänderung bei einer bestimmten vorgelegten
Enzymkonzentration ermöglicht.
Die Steigung dieser Eichgerade ist graphisch zu ermitteln. Warum ergibt sich laut Theorie ein
linearer Verlauf der Eichkurve (s. Theorieteil!!) ? Welche Fehlerquellen gibt es für einen
nicht linearen Verlauf der Eichkurve (Stichwort: Gültigkeitsbereich des Lambert-Beerschen
Gesetz) ?
e)
Stichworte:
Grundlagen der Biochemie:
Enzyme,
Aminosäuren,
Proteine,
(Primär-,
Sekundär-,
Tertiärstruktur,
Funktion),
Transskription, Translation
Grundlagen der Kinetik:
s. a. Grundlagen Versuch K1 und K2: (Definition der Reaktionsgeschwindigkeit, Reaktionsordnung, Halbwertszeit, Arrheniusgleichung, …), für diesen Versuch: Folgereaktionen,
Fließgleichgewicht, Quasistationarität, Beispiele enzymatischer Reaktionen, MichaelisMenten-Kinetik, graphische Darstellung und Herleitung der Michaelis-Menten-Gleichung,
Lineweaver-Burk, Eadie-Hofstee, Beeinflussung der Geschwindigkeit enzymatischer
Reaktionen (Substratkonzentration, Enzymkonzentration, Hemmung: irrreversibel, reversibel:
kompetitiv, nichtkompetitiv, antikompetitiv)
Spektroskopische Grundlagen:
Aufbau und Prinzip eines Absorptionsspektrometers, Photometrie, Lambert-Beersches
Gesetz, wie kommt Absorption zustande?
K3-8
f)
ENZYMKINETIK
Empfohlene Literatur :
Theoretische Grundlagen
Michaelis-Menten (Kinetik); Physikalische Chemie, Moore-Hummel, 4. Auflage,
Biochemische Grundlagen: Kurzes Lehrbuch der Biochemie, Karlson, 14. Auflage;
Organische Chemie, Beyer-Walter
Atkins: Kinetik allgemein, Spektroskopie: Physikalische Chemie
L. Stryer: Biochemie
Ausführung und Auswertung
Hassinger-Wiebusch: Experimentelle Enzymologie
Moore-Hummel: Physikalische Chemie, 4. Auflage




![E + S [ES] E + P Enzyme](http://s1.studylibde.com/store/data/011452180_1-cbdca6d5ea6d6e898aef4e3165d8acb4-300x300.png)