Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer
Werbung

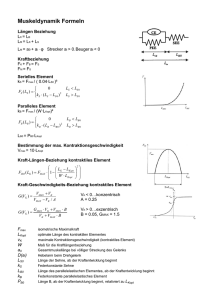
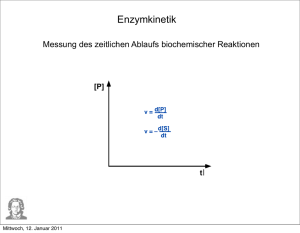
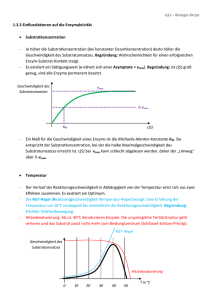
Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer Reaktionsmechanismen unkatalysierte Reaktion enzymatische Reaktion ⇒ V = k[S] V0 = k[S] ⇓ ⇒ k1 k2 k3 E + S ↔ ES ↔ EP → E + P k-2 k-1 V0 = k3[EP] allgemeine Reaktionsgeschwindigkeit-Gleichung V0 = kkat[Zg] Zg = geschwindigkeitbestimmendes Zwischenprodukt kkat = GeschwindigkeitsKonstante der Gesamptreaktion Bei mehrfasigen enzymatischen Reaktionen stellt ein dynamisches Gleichgewicht zwischen der Entstehung und der Weiteränderung des Geschwindigkeit-bestimmenden Zwischenprodukts ein (Fliessgleichgewicht, steady state): [Zg] = konst; V = konst = V0 Die Michaelis-Menten-Kinetik Vmax[S] V0 = -------------Km + [S] Michaelis-Menten-Gleichung k1 k2 E + S ↔ ES → E + P, k-1 wenn k-1 + k2 Km = -----------k1 ist V0 = Wmax/2 ⇒ Km = [SVmax/2] Km >> [S] ⇒ Vmax V0 = ------- [S] Km Km << [S] ⇒ V0 = Vmax Mit Ausnahme regulatorischer Enzyme gehorchen Enzyme der Michaelis-Menten-Kinetik Die doppelt-reziproke Transformation der Michaelismenten-Gleichung (Lineweaver-Burk-Diagramm) Michaelis⇐ MentenGleichung inverse Form der Michaelis⇐ MentenGleichung ⇑ Lineweaver-Burk-Gleichung Das Lineweaver-Burk Diagramm kann bei Analyse enzymkinetischer Probleme, z.B. bei Unterscheidung der drei Arten von Enzym-Hemmung, verwerdet werden Die wichtigsten kinetischen Parameter V0 = kkat[Zg] ⇐ allgemeine Reaktionsgeschwindigkeit-Gleichung V0 = Vmax Bei grossem ⇐ Substratsüberschuss [Zg] = [Et] Vmax = kkat[Et] V0 Vmax[S] = -------------Km + [S] kkat[Et][S] V0 = ---------------Km + [S] V0(Km + [S]) kkat = -----------------[Et][S] wenn [S] << Km Km + [S] = Km kkat V0 ------ = ---------Km [Et ][S] Michaelis⇐ MentenGleichung Vergleichs-Parameter ⇑ ⇓ Wechselzahlen (turnover numbers) Untersciedliche Wege der bimolekularen enzymatischen Reaktionen Hexokinase ATP + D-Glucose → → ADP + D-Glucose-6-phosphat E’ ~ persistent verändertes Enzym Die doppeltreziproke Darstellung (Lineweaver-Burk-Diagram) von Ergebnissen kinetischer Untersuchungen hilft bei Ermittlung unterschiedlicher Aspekten des Mechanismus enzymatischer Reaktionen. Reversible, kompetitve Enzym-Inhibition (-Hemmunng) Vmax[S] V0 = --------------αKm + [S] wenn αKm << [S], ist V0 = Vmax ⇐ umgestaltete Michaelis-Menten-Gleichung umgestaltete Lineweaver-Burk-Gleichung ⇒ Einige Medikamente sind Inhibitoren αKm Km α = ------- : ----Vmax Vmax Reversible, unkompetitive Enzym-Inhibition (-Hemmung) Vmax[S] V0 = ----------------Km + α’[S] wenn Km << α’[S], ist V0 = Vmax/ α’ ⇐ umgestaltete Michaelis-Menten-Gleichung umgestaltete Lineweaver-Burk-Gleichung ⇒ α’ 1 α’ = ------- : -----Vmax Vmax Reversible, gemischte Enzym-Inhibition (-Hemmung) Vmax[S] V0 = ------------------αKm + α’[S] wenn αKm << α’[S], ist V0 = Vmax/ α’ ⇐ umgestaltete Michaelis-Menten-Gleichung umgestaltete Lineweaver-Burk-Gleichung ⇒ Irreversible Enzym-Inhibition Chymotrypsin + Diisopropylfluorophosphat Ein Selbstmord-Inhibitor ist ein modifiziertes Substrat, das zuerst reversibel und kompetitiv in dem aktiven Zentrum des Enzyms gebunden wird. Der entstehende Enzym-InhibitorKomplex kann danach durch den normalen enzymatischen Mechanismus in das normale Produkt und eine sehr reaktionsfähige Verbindung überführt werden, die sich kovalent und irreversibel an eine essenzielle funktionelle Gruppe des aktiven Zentrums bindet oder sie zerstört. Die Wirkungsweise einiger neuen Arzneimittel berucht sich an Selbstmord Inhibition. Abhängigkeit der Enzymaktivität vom pH-Wert (pH-Optimum) Der Grund für die pH-Abhängigkeit der Enzyme ist, dass Seitenketten einiger Aminosäureresten in ihren aktiven Zentren schwache Säuren oder Basen von unterschiedlichem pH-Optimum sind. Diese Seitenketten dissoziieren bei unterschiedlichen pH-Werten in unterschiedlichem Mass. Dies beeinflusst die räumliche Anordnung der funktionellen Gruppen in dem aktiven Zentrum des Enzyms, und dadurch seine katalytische Aktivität.






![E + S [ES] E + P Enzyme](http://s1.studylibde.com/store/data/011452180_1-cbdca6d5ea6d6e898aef4e3165d8acb4-300x300.png)

