Lösungsblatt 11
Werbung

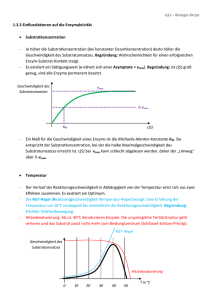
Physikalische Chemie II (für Biol./Pharm. Wiss.) FS 2010 Lösungsblatt 11 Musterlösungen zum Übungsblatt 11 vom 1 25.5.2010 Michaelis-Menten Enzym Kinetik Das Michaelis-Gesetz lautet: vP = k2 cS cE (0) cS + KM Wenn die Substratkonzentration viel grösser ist als die Michaelis Konstante ( cS ! Km ) kann letztere vernachlässigt werden. Daraus lässt sich eine Maximalgeschwindigkeit der Reaktion herleiten: vP 1 ⇒ vP = k2 cE (0) = vmax 1 Km 1 = + vmax vmax cS Trägt man die inverse Geschwindigkeit v1P (die gleich der inversen Um−1 satzrate R1P ist) als Funktion der inversen Konzentration [CO2 ] auf ergibt die linefit Methode der kleinsten Quadrate einen y-Achsenabschnitt von 4000 M−1 s. Dies entspricht einer Geschwindigkeit von vmax = 2.5 × 10−4 M s−1 . Verwendet man diesen Wert und die anfängliche Enzymkonzentration cE (0) = 2.3nM berechnet sich k2 zu k2 = vmax cE (0) = 2.5 × 10−4 M s−1 = 1.1 × 105 s−1 2.3 × 10−9 M Für die Steigung erhält man einen Wert von 40, so dass Km 2 = slope × vmax = (40 s)(2.5 × 10−4 M s−1 ) = 10 mM Temperaturabhängigkeit von Geschwindigkeitskonstanten Wir fertigen einen sog. “Arrhenius-Plot” an. Dabei trägt man ln(k1 /[k1 ]) gegen T −1 (wobei [T ]=K) auf. Man erhält eine lineare Kurve. Das Fitten einer Geradengleichung y = mx + t liefert den prä-exponentiellen Faktor A der Arrheniusgleichung (über den y-Achsenabschnitt t) und die Aktivierungsenergie Ea (über die Steigung m), denn die Arrheniusgleichung lautet 1 Physikalische Chemie II (für Biol./Pharm. Wiss.) k1 Ea = Ae− RT FS 2010 , also Ea . RT Wir sehen, dass in dem oben erwähnten Plot die Steigung m dem Quotienten − ERa und der y-Achsenabschnitt t ln A entspricht. Unter Verwendung der gegebenen Daten erhält man m ≈ −3508 K und t = 8.9623. Damit ist Ea = −mR = 29.2 kJ·mol−1 und A = [k1 ] · et = 7803 min. ln(k1 /[k1 ]) = ln(A/[k1 ]) − 3 Enzymkinetik und Umsatzraten (alte Klausur) 1. (a) Die Masse der Acetylcholinesterase beträgt m = 2.3 · 102 kDa = 2.3 · 105 · 1.66 · 10−27 kg = 2.3 · 105 · 1.66 · 10−27 · 106 mg = 3.82 · 10−16 mg . Ein mg Enzym enthält also 2.62 · 1015 Moleküle die 104 Einheiten entsprechen. Damit entspricht 1 Einheit 2.62·1011 Molekülen Enzym. Ein Einheit setzt 1.0 µmol Substrat pro Minute um. Somit setzten 2.62 · 1011 Moleküle Enzym 1.0 µmol Substrat pro Minute um. Dies −6 23 1 )/60 s· = 1016 1/s. Also entspricht einer Rate von (10 mol·6.02214·10 mol 11 16 setzen 2.62 · 10 Moleküle Enzym 10 Substarte pro Sekunde um. Insgesamt ergibt sich also eine Umsatzrate von 1016 1/s 1 = 38308 2.62 · 1011 s Somit werden also pro Enzym Acetylcholinesterase 38’308 Moleküle Substrat umgesetzt. Diese Rate ist natürlich unabhängig von der Konzentration. kkat = Anmerkung : Je nach Rechengenauigkeit bzw. gerundeten Stellen bei den Zwichenergebnissen kann Ihr Ergebnis von dieser Lösung abweichen. Rechnet man genau mit allen angegebenen Kommastellen kommt man beispielsweise auf kkat = 38320 1s oder mit den Zahlen des Bruches in der letzten Zeile auf kkat = 38168 1s . In der Klausur würde jedes dieser Ergebnisse volle Punktzahl erreichen sofern ersichtlich ist, wie Sie darauf gekommen sind. (b) Mit der Michaelis-Menten Gleichung erhält man v = = k2 cS cE (0) KM + cS 38308 1s · 4.35 · 10−11 mol −3 mol l · 10 l 10−3 mol l 9 · 10−5 mol l + M µM = 1.53 · 10−6 = 91.73 s min 2 Physikalische Chemie II (für Biol./Pharm. Wiss.) FS 2010 2. In der Vorlesung wurde gezeigt, in welcher Grössenordnung das Verhältnis zwischen katalytischer Reaktionskonstante und Michaeli-Menten Reaktionskonstante liegen muss, damit eine Reaktion diffusionskontrolliert ist. Für die hier berechneten Werte findet man kcat/KM = 38308 9· 1 s 10−5 mol l = 4.26 · 108 Damit ist die Reaktion fast diffusionskontrolliert ... 1 M·s 3. Da laut Aufgabenstellung das Medikament nur an das Acetylchlolin bindet (und nicht an den ACE-AC-Komplex) handelt es sich um einen kompetitiven Inhibitor. 4. Man kann mit der Form der Lineweaver-Burg Kurve argumentieren (nur in der Vorlesung). Dann kommt es auf die Schnittpunkte der Geraden mit cI = 0 und cI > 0 an. Man kann aber auch mit der Grafik auf Seite 91 argumentieren. Dann kann man die Geschwindigkeit bei verschiedenen Substratkonzentrationen messen. Tut man dies auch ohne Hemmung, dann kann man schon mal kompetativ von den anderen unterscheiden (dann ist vmax gleich der ungehemmten Reaktion). Wenn dies nicht zutrifft, kann man KM aus dem Geschwindigekitsgesetz unter Kenntnis der Anfangs-Enzymkonzentration bestimmen. Damit wird zwischen unkometitiver und nicht-kompetitiver Hemmung unterschieden. v k2cE(0) = kcatcE(0)=vmax vmax v=kcat/Km cE(0)cS=vmax/Km cS [S] 0 Figure 1: Michaelis-Menten-Kurve 3