K - Unibas Chemie
Werbung

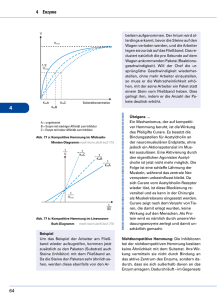
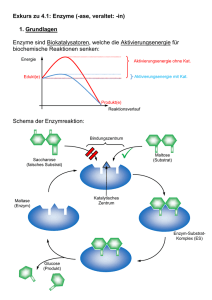
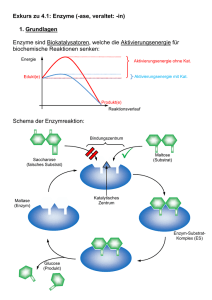
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion vermieden wird. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben Hin- und Rückreaktion werden um den gleichen Faktor beschleunigt! Hin Homogener Katalysator Heterogener Katalysator befindet sich in der gleichen Phase befindet sich in einer anderen Phase wie die Reaktionsmischung wie die Reaktionsmischung (z B : fester Katalysator in Gasphasenreaktion) (z.B.: Spezialfall: Enzyme Enzyme = biochemische Katalysatoren • mit it hoher h h katalytischer k t l ti h Aktivität Akti ität z.B.: Rohrzucker-Hydrolyse Ea = 107 kJ/mol in Gegenwart g von Saccharase Ea = 36 kJ/mol d.h. Reaktionsbeschleunigung um einen Faktor 1012 bei Körpertemperatur • mit hoher Spezifität Enzyme katalysieren nur eine einzige oder eine Serie eng verknüpfter Reaktionen kaum Nebenprodukte! • mit regulierbarer Aktivität Stichworte: - Feedback-Hemmung - Regulatorproteine - kovalente Modifikation - proteolytische Aktivierung Spezialfall: Enzyme Katalytische Aktivität Bildung von Enzym-Substrat (ES) -Komplexen p Substrat wird hochselektiv an das aktive Zentrum des Enzyms gebunden! - nicht-kovalente Wechselwirkungen - Schlüssel-Schloss-Prinzip Schlüssel Schloss Prinzip (E.Fischer, (E Fischer 1890) Adsorption des Substrates charakteristische Kinetik ((Reaktion mit vorgelagertem g g Gleichgewicht) g ) v Vmax [S] Michaelis-Menten-Modell Hypothese: Enzym E und Substrat S stehen mit Enzym-Substrat(ES) Komplex K l im i Gleichgewicht Gl i h i h k1 E + S k2 ES E + P k-1 Annahme: Produkt P wird nicht in ursprüngliches Substrat zurückverwandelt Gesucht: Ausdruck der Katalysegeschwindigkeit mit Enzym- und Substratkonzentration, sowie den Geschwindigkeiten der Einzelschritte verknüpft v = k2[ES] [ES]?? Bildungg des ES-Komplexes: p vf = k1[E][S] Zerfall des ES-Komplexes: vd = k-1[ES] + k2[ES] Stationärer Zustand (Fliessgleichgewicht, ´steady state´) Bildungs und Zerfallsgeschwindigkeit des ES-Komplexes BildungsES Komplexes sind gleich vf = vd d.h. k1[E][S] = (k-1 + k2)[ES] [ ES] = [ E ][ S ] ( k−11 + k2 ) /k1 k −1 + k 2 KM = k1 Def.: Michaelis-Menten-Konstante KM: [ ES ] = [ E ][ ][ S ] KM Konzentration an freiem Enzym: [E] = [E]0 - [ES] Konzentration an freiem Substrat: [S] ≈ [S]0 (Annahme: [E]0<<[S]0 !) [E] ( [ ES ] = oder: 0 ) − [ ES ] [ S ] KM [ E ] 0 [ S] [ ES ] = [ S] + K M Reaktionsgeschwindigkeit: Für [E] << [S]: [S] v = k2 [ ES ] = k 2 [ E ] 0 [S] + K M - gesamtes Enzym im ES ES-Komplex Komplex gebunden - alle Bindungsstellen mit Substrat gesättigt maximale Reaktionsgeschwindigkeit : Vmax = k2[E]0 (d h (d.h. Michaelis-Menten-Gleichung: [S] v = Vmax [S] + K M (bei [S] = KM v = Vmax/2!) ) Bestimmung von Vmax und KM: Linearisierung! v = Vmax v − KM [ S] 1 1 KM 1 = + v Vmax Vmax [ S] Bsp: (Eadie Hofstee) (Eadie-Hofstee) (Lineweaver-Burk) Lineweaver-Burk Diagramm 1 v 1 Vmax − 1 KM KM Vmax 1 [S] Bedeutung von KM und Vmax: • KM = [S] • k2 << k-11: Substratkonzentration, S b k i bei b i der d die di Hälfte Hälf der d aktiven ki Zentren besetzt ist KM = Gleichgewichtskonstante g der Dissoziation des ES-Komplex typische Werte für KM: 10-1 - 10-7 M • Vmax = k2 [E]0 kcat Wechselzahl (turnover number) typische Werte für kcat: 1 - 105 s-1 (Zahl der Katalysevorgänge pro sec) Beispiel: Carboanhydrase CO2 + H2O HCO3- + H+ KM = 8 mM kcat = 6*105 s-1 Hemmung von Enzymen - Kontrollmechanismus in biologischen Systemen - Wirkung von Medikamenten und Toxinen irreversible Hemmung reversible Hemmung Inhibtor ist sehr fest an Enzym gebunden schnelle Dissoziation des Enzym-Inhibitor z.B. B Wirkung Wi k von Nervengasen N auff AChE K Komplexes l a. kompetitive Hemmung: Substrat und Inhibitor werden vom aktiven Zentrum des Enzyms gebunden Enzym kann Substrat oder Inhibitor binden, aber nicht beide [ES] verringert! Kompetitive Hemmung Substrat kompetitiver Inhibitor Enzym Enzym Kinetik: 1 v 1 Vmax mit Inhibitor ohne Inhibitor 1 1 K M ⎛ [I] ⎞ 1 = + ⎜1+ ⎟ v Vmax Vmax ⎝ K i ⎠ [ S ] Ki = 1 [S] [ E ][ I ] [ EI ] b. nicht-kompetitive Hemmung: Inhibitor und Substrat können gleichzeitig vom selben Enzymmolekül gebunden werden verschiedene Bindungsstellen Substrat Enzym nicht-kompetitiver Inhibitor Nicht-kompetitive Hemmung Kinetik: 1 v mit Inhibitor ohne Inhibitor − 1 KM 1 [S] I Vmax = Vmax [I] 1+ Ki