Versuch: Enzyme (LDH)
Werbung

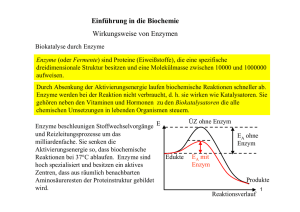
Tierphysiologie (Stoffwechselteil) 3. Semester 25.11.02 Versuch: Enzyme (LDH) Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105- 113 Zusammenfassung Eckert S. 77 – 89 Zusammenfassung Penzlin S. 50 – ff. Allgemein: Temperatur und Reaktionsgeschwindigkeit hängen eng zusammen. Für eine chemische Reaktion sind aber neben der Temperatur auch noch andere Faktoren, wie Druck, ph-Wert und Konzentration der Edukte und Produkte ausschlaggebend. Eine Reaktion läuft nur freiwillig ab, wenn ∆G negativ ist. Außerdem hat jede Reaktion eine Aktivierungsenergie. Da solche Reaktionen auch im Körper ablaufen müssen, man dort aber nicht einfach den Druck oder die Temperatur ändern kann, um die Reaktion freiwillig ablaufen zu lassen, muss sich der Körper mit der Verwendung von Enzymen weiterhelfen. Diese können viel gezielter eingesetzt werden, als eine Temperaturerhöhung, die einer anderen Reaktion oder der Struktur von Proteinen schaden würde. Somit laufen sämtliche Reaktionen im Körper über Enzyme ab, die um 37°C ihr Optimum aufweisen. Die Enzyme ändern jedoch nichts am Gleichgewicht einer Reaktion und können auch nur Reaktionen katalysieren, die auch von alleine ablaufen würden. Zusätzlich ändern Enzyme auch nichts an dem Wert von ∆G. Aktivierungsenergie: Ist die Energie, die benötigt wird, um bei einem Zusammenstoß zweier Teilchen eine Reaktion hervorzubringen. Enzyme: Enzyme sind Proteine mit katalytischen Eigenschaften. Sie bewirken eine Erniedrigung der Aktivierungsenergie, durch die Bildung eines EnzymSubstrat-Komplexes und erhöhen somit die Geschwindigkeit einer Reaktion. Enzyme gehen aus einer Reaktion immer unverändert hervor, ändern nichts am Reaktionsgleichgewicht und auch nicht an der freien Energie. Die Geschwindigkeit von Reaktionen erhöht sich um das 108 bis 1020 –fache. Somit kann die Geschwindigkeit von Reaktionen von Enzymen geregelt werden. Substratspezifisch: Enzyme können immer nur ein Substrat umsetzen. Dieses Substrat passt in das aktive Zentrum (das reaktive Zentrum von Enzymen) wie der Schlüssel in ein Schloß. Das Schlüssel-Schloß-Prinzip ist Tierphysiologie (Stoffwechselteil) 3. Semester ein sehr steifes Gedankenmodell. Heute spricht man eher von dem induced–fitModell. Es besagt, dass das sich nähernde Substrat die Struktur des aktiven Zentrums soweit ändert, dass es noch besser und effektiver gebunden werden kann. Reaktionsspezifisch: ein Enzym katalysiert nur eine Reaktion, auch dann, wenn das Substrat in mehrere verschiedene Produkte reagieren könnte. Stereospezifisch: ein Enzym kann nur eine Isomerieform eines Produkts herstellen. Dies liegt an der Form der Aminosäuren, die auch L- bzw. D sind!?! (Erklärung nicht sicher, nachlesen!) Temperatur: Steigt die Temperatur, so nimmt die Teilchengeschwindigkeit zu. Somit steigt auch die Wahrscheinlichkeit, dass ein Substratmolekül vom aktiven Zentrum gebunden wird (höhere Wechselzahl). Ist die Temperatur dagegen zu hoch, denaturisiert das Enzym (Protein). Dabei werden die schwachen Wechselwirkungen der Quartär-, Tertiär- und Sekundärstruktur aufgebrochen und es kommt zum Verlust der speziellen Struktur (siehe auch „aktive Zentrum“). So kann man nun feststellen, dass ein Enzym ein Temperaturoptimum aufweist. pH-Wert: Ein Enzym besitzt auch einen optimalen pH-Wert, bei dem es die beste Umsatzrate aufweist. Ist der pH-Wert zu basisch oder zu sauer so werden dadurch wieder die dreidimensionalen Strukturen zerstört. Jedoch können Enzyme den fallenden pH-Wert so nutzen, dass sie Protonen anlagern und die Aminosäurenketten in positiver Form vorliegen. Dies erleichtert die Bindung von Substraten die negative Gruppen besitzen. Das Aktive Zentrum: Ein Enzym besteht, wie oben schon erwähnt, aus Peptidketten. Das aktive Zentrum wird nur von Seitenketten einiger Aminosäuren gebildet. In dieser Kluft (Tasche) werden die Substratmoleküle durch verschiedene Wechselwirkungen (elektrische Bindungen, van-der-Waals-Kräfte, Wasserstoffbrückenbindungen) gebunden. Mechanismen v. Enzymen: a) b) c) d) Cofaktoren: die Substrate werden im aktiven Zentrum so gelegt, dass sie perfekt miteinander reagieren können. die Seitenketten des aktiven Zentrums dienen als Protonenakzeptoren und –rezeptoren. Enzym-Substrat-Komplex bildet zusammen eine instabilere und reaktivere Verbindung. Erhöhung der inneren Ladung Æ Erhöhung der Lsg. ?!? Cofaktoren können anorganische Ionen sein oder auch kleine organische Moleküle. Ein Enzym ist mit dem Cofaktor eine Einheit, da es ohne ihn keine Reaktionen katalysieren könnte. Das Proteinanteil eines solchen Enzyms bezeichnet man als Apoenzym, den nicht proteinhaltigen Teil als Prosthetische Gruppe (Cofaktor). Das Gesamtenzym wird Holoenzym genannt. Beispiele: NAD+ , Metallionen (Komplexbildung), Vitamine, Calciumionen. Tierphysiologie (Stoffwechselteil) Kinetik: 3. Semester Näheres in den Büchern!!! Auch hier gibt es Reaktionen 1., 2. und 0. Ordnung, wobei 1 Substrat, 2 Substrate oder kein Substrat der limitierende Faktor der Reaktion ist und in nicht optimaler Konzentration vorliegt. Dabei geht man davon aus, das die anderen Faktoren alle im Optimum liegen. Michaelis-Menten-Diagramm: Die Maximalgeschwindigkeit des Enzyms ist dann erreicht, wenn alle Enzyme als Enzym-Substrat-Komplex vorliegen. Die Halbmaximale Geschwindigkeit ist der Zustand, bei dem die Hälfte der Enzyme mit einem Substrat besetzt ist. Diese Halbmaximale Geschwindigkeit wird auch als Vergleichsvariable gewählt da vmax nicht genau zu bestimmen ist, da sich die Kurve asymptotisch nähert. Zusätzlich sinkt die Kurve bei fastmaximaler Geschwindigkeit wieder ab (siehe Substrathemmung). KM ist die Michaelis-Menten-Konstante, die eine Aussage über die Affinität zwischen Enzym und Substrat macht und angibt, wie hoch die Konzentration des Substrats sein muss, um die halbmaximale Geschwindigkeit eines Enzyms zu erreichen. Je größer KM ist, desto niedriger die Affinität! Die Funktion für die Kurve lautet: Lineweaver-Burk-Diagramm: hier sind die Daten nur mathematisch verändert worden (rezibroke Werte). Tierphysiologie (Stoffwechselteil) 3. Semester Die Steigung der Geraden zeigt v an. Wechselzahl: Mol Substrat / Mol Protein * sec = 1/sec Spezifische Aktivität: Mol/ g*sec 1 kat = 1 Mol / sec v-Berechnung: siehe Skript Näheres siehe Skript! Enzymhemmung + -aktivierung: Kompititive Hemmung: bei dieser Hemmung wird das aktive Zentrum von einem substratähnlichen Molekül besetzt und somit gehemmt. Das Substrat konkurriert mit dem Hemmstoff um die Anlagerung. Wenn man nun die Substratkonzentration erhöht, kann man die Hemmwirkung ausschalten, da die Wahrscheinlichkeit, dass ein Hemmstoff sich anlagert schwindend gering wird. vmax ändert sich nicht, dafür aber KM, da eine höhere Konzentration des Substrats benötigt wird, um vmax/2 zu erreichen. Nichtkompititive Hemmung: hier setzt sich der Hemmstoff in eins von dem aktive Zentrum weit entfernten Zentrum an, das sog. Allosterische Zentrum. Eine Substraterhöhung hat somit keinen Einfluß auf die Hemmung, da es nicht mit dem Hemmstoff konkurriert. KM bleibt gleich, vmax/2 wird kleiner, da in einer bestimmten Zeit weniger Substrat umgesetzt wird. Unkompititive Hemmung: Mischung aus den beiden oben genannten Hemmungen. „Vergiftete Hemmung“: Anlagerung von Teilchen, die das Enzym zerstören. So z.B., Schwermetalle und Cyanide. Feedback Hemmung: Auch Endprodukthemmung genannt. Das Endprodukt einer Stoffwechselkette setzt sich als Hemmstoff (Inhibitor) in das allosterische Zentrum des Enzyms, das den ersten Stoff umwandelt. Somit regelt es selber seine Produktion. Substrathemmung: Wenn ein Überschuß Substrat vorhanden ist, dann behindern sich die Substratmoleküle gegenseitig beim Anlagern an das aktive Zentrum. (deswegen macht die Kurve beim M_M_Diagramm hinten einen Bogen nach unten) Enzymaktivierung: Cofaktoren, wie z.B. werden Enzyme Muskelkontraktion die durch Anlagern von Calciumionen, aktiviert (z.B.: ATPase). aus Campbell: Enzymhemmung Tierphysiologie (Stoffwechselteil) 3. Semester