Cholesterin - MedUni Wien
Werbung
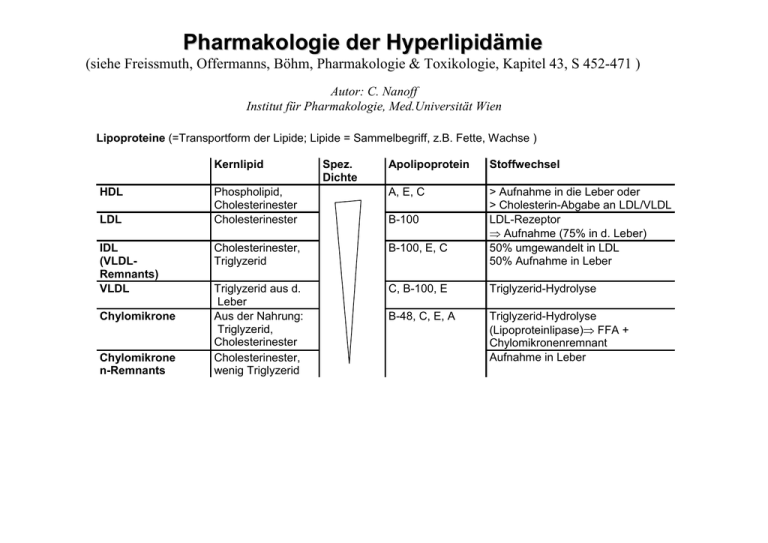
Pharmakologie der Hyperlipidämie (siehe Freissmuth, Offermanns, Böhm, Pharmakologie & Toxikologie, Kapitel 43, S 452-471 ) Autor: C. Nanoff Institut für Pharmakologie, Med.Universität Wien Lipoproteine (=Transportform der Lipide; Lipide = Sammelbegriff, z.B. Fette, Wachse ) Kernlipid HDL LDL IDL (VLDLRemnants) VLDL Chylomikrone Chylomikrone n-Remnants Spez. Dichte Apolipoprotein Stoffwechsel Phospholipid, Cholesterinester Cholesterinester A, E, C Cholesterinester, Triglyzerid B-100, E, C > Aufnahme in die Leber oder > Cholesterin-Abgabe an LDL/VLDL LDL-Rezeptor Aufnahme (75% in d. Leber) 50% umgewandelt in LDL 50% Aufnahme in Leber Triglyzerid aus d. Leber Aus der Nahrung: Triglyzerid, Cholesterinester Cholesterinester, wenig Triglyzerid C, B-100, E Triglyzerid-Hydrolyse B-48, C, E, A Triglyzerid-Hydrolyse (Lipoproteinlipase) FFA + Chylomikronenremnant Aufnahme in Leber B-100 Lipidtransport LPL...Lipoproteinlipase, HL...hepatische Lipase, FFA...freie Fettsäuren Lipoproteine - Abbildungslegende Fett in der Nahrung besteht zum Großteil aus Triglyzeriden und Cholesterinestern. Mit Hilfe der Gallensäuren wird das Fett in die Darmepithelzelle aufgenommen, von wo der Weitertransport in Form von Chylomikronen erfolgt. Für die Aufnahme von Cholesterin und pflanzlichen Sterinen wird NPC1L1 (Niemann-Pick C1-like protein) benötigt. Phytosterine kommen nicht in Chylomikrone sondern werden aktiv ins Darmlumen zurückgepumpt. Chylomikrone sind Lipoproteine, bestehen daher aus einem Proteinanteil (Apolipoproteinen=„apo“) und Lipiden (Triglyzeride, Cholesterinester, Phospholipide); die Apolipoproteine bestimmen das Schicksal jedes Lipoproteinpartikels. Chylomikrone werden im Darmepithel gebildet, enthalten zunächst nur Apo-B48 und nehmen erst im Blutstrom funktionell bedeutsame Apolipoproteine auf: (i) ApoC-II aktiviert die Lipoproteinlipase (LPL) in der Endstrombahn verschiedener Gewebe (Muskulatur, Fettgewebe), Triglyzerid wird hydrolysiert und die gewonnenen Fettsäuren an die Zellen geliefert. Dadurch entstehen die „Chylomikronen-Remnants“, die sich von der Kapillarwand ablösen und sehr rasch von den Leberzellen aufgenommen werden. Für die Aufnahme wird der Remnant-Rezeptor benötigt (auch LRP = LDL-Rezeptor related protein), der (ii) apoE als Liganden erkennt. Lipoproteine - Abbildungslegende, Fortsetzung VLDL wird in der Leber produziert und zwar, wenn der Leber ausreichende Mengen an Triglyzerid zur Verfügung stehen. Das Apolipoprotein ist B-100. Komplett wird VLDL aber erst nach Aufnahme der Apoproteine, apoC und apoE, im Blut. Wie die Chylomikrone wird VLDL durch apoC-II-aktivierte LPL verstoffwechselt. Die entstehenden VLDL-Remnants (=IDL) werden durch LDL-Rezeptoren (Ligand = apoB-100) oder LRP (Ligand = apoE) in die Leber gebracht. Etwa die Hälfte des IDL erfährt jedoch ein anderes Schicksal. Dieses wird weiter durch LPL und HL (= hepatische Lipase) abgebaut, wobei auch apoC und apoE entfernt werden. So entsteht LDL, das aus apoB-100 und Cholesterinestern aufgebaut ist. Wegen seiner geringen Clearance ist der LDL-Spiegel höher als der von VLDL/IDL. 75% des LDL geht in die Leber, der Rest in periphere Zellen, die mit LDL-Rezeptoren ausgestattet sind. Eine Zunahme der LDL-Rezeptoren wird durch Cholesterinmangel in der Leber induziert, dies führt verlässlich zur Abnahme der LDL-Spiegel. der Effekt wird durch SREBP2, einen cholesterinempfindlichen Transkriptionsfaktor vermittelt. Ebenfalls steigernd wirken Schilddrüsenhormon und Östrogen. LDL ist ein für die Atherosklerose wichtiges Lipidpartikel; nach Oxidation („ranzig Werden“) wird es von subendothelialen Makrophagen durch „Scavenger-Rezeptoren“ wie SR-B1 endozytiert ( Entstehung von Schaumzellen atherosklerotischer Plaque). Hohe LDL-Werte sind ein Risikofaktor für Atherosklerose und Herzinfarkt. Lipoproteine - Abbildungslegende, Fortsetzung HDL entsteht aus Apolipoprotein A-I und Phospholipid in Leber/Darm, kann sich aber auch spontan in der Blutbahn formieren. Diese Vorstufe (= Prä-1HDL) nimmt unverestertes Cholesterin aus Gefäßwänden auf (dank Bindung von apoA-I an einen spezifischen Transporter=ABCA1). Das Prä-1HDL Partikel wächst durch Aufnahme von mehr Cholesterin. Große HDL Partikel vom Typ HDL2 enthalten hauptsächlich Apo A-I und schützen vor Atherosklerose. Durch Andocken an einen Rezeptor (SR-B1) übernimmt die Leberzelle Cholesterin aus dem Partikel; über den gleichen Rezeptor kann Cholesterin aber auch ins Partikel nachfließen. Cholesterin wird durch Lecithin-Cholesterin-Acyltransferase (LCAT) verestert; in dieser Form wird es vermittels CETP auch auf LDL-Partikel übertragen (CETP = Cholesterinester-Transferprotein). HDL sind für den „reversen Cholesterintransport“ in die Leber mitverantwortlich: nur Leberzellen können Cholesterin abbauen, aber alle Körperzellen können im Prinzip Cholesterin synthetisieren. Cholesterin Cholesterin ER Insig-1 SCAP Insig-1 Insig-1 retiniert SCAP im endoplasmatischen Reticulum (ER) SCAP SREBP2 SREBP2 GolgiApparat nSREBP2 SREBP2 SCAP…SREBP cleavage activating protein SREBP…Sterol regulatory element binding protein SRE Zellkern LDL-Rezeptor HMG-CoA-Reduktase Cholesterin regelt die zelluläre Aufnahme von LDL und die Cholesterin- (= seine eigene) Neusynthese. Die Cholesterinkonzentration in der Membran des endoplasmatischen Reticulums (ER) bestimmt den Weitertransport von SCAP-SREBP2 zum Golgi-Apparat; Cholesterin stabilisiert die Bindung zwischen Insig-1 und SCAP und verhindert dadurch den Einbau von SCAP-SREBP2 in Vesikel, die sich vom ER abspalten und mit dem Golgi-Apparat fusionieren. An der Golgi-Membran werden Proteasen aktiv, die den Transkriptionsfaktor nSREBP2 freisetzen. Nach seiner Translokation in den Kern, steigert er die Expression von LDL-Rezeptoren und HMG-CoA-Reduktase. Leberzelle Insulinresistenz: Einfluss der Hyperinsulinämie auf Blutlipide AMPK Übermäßige Aktivierung des Insulinrezeptors in der Leber führt zu typischen Veränderungen des Lipidprofils. Zunehmende Insulinspiegel fördern die Bildung des Transkriptionsfaktors SREBP1-c (verwandt mit SREBP2, das den Cholesterinhaushalt reguliert aber nicht durch Insulin induziert wird). SREBP1-c hält die Kontrolle über den Insulin-abhängigen Fett- und Kohlenhydratstoffwechsel in der Leber. SREBP1-c steigert durch Induktion die Fettsäure- und Triglyzeridsynthese, fördert damit die Bildung und Freisetzung von VLDL und kann darüber hinaus zur Entstehung von Fettleber bei Typ II Diabetes führen. Aus einer intronischen Sequenz des SREBP1-c Gens entsteht ferner eine mikroRNA die - selbst komplementär zu einem Abschnitt der ABCA1-Sequenz - zum Abbau der ABCA1 –Transporter kodierenden mRNA führt (für diese Prozesse steht jeder Zelle ein Enzymapparat – RISC Komplex - zur Verfügung). Zu wenig ABCA1 reduziert die HDL-Spiegel. Hohes VLDL und niedriges HDL bei Patienten mit Insulinresistenz. Physiologisch fördert Insulin hingegen durch einen permissiven Effekt auf die Lipoproteinlipase (LPL) den Abbau von Triglyzerid in der Blutbahn. AMPK Aktivität vermindert SREBP1c und senkt VLDL. Störungen im Lipoproteinstoffwechsel = Dyslipidämie Primäre Dyslipidämie: polygenetische Ätiologie (monogenetische Defekte selten) Sekundäre Dyslipidämie - Beispiele Hypothyreose ( LDL) Diabetes mellitus, Nierenerkrankungen (Hypertriglyzeridämie, HDL, LDL oder ) Medikamente – z.B.: -Blocker, Thiazid-Diuretika (Triglyzeride) Risikofaktoren für die Atherosklerose Messwert Apo B/ Apo A-I Verhältnis LDL-gebundenes Cholesterin Apo A-I HDL-gebundenes Cholesterin LDL : HDL Verhältnis Lipoprotein(a) Hypertriglyzeridämie Ungünstig Sollwerte Gesamtcholesterin < 190 mg/dl >240 mg/dl HDL-C(holesterin) < 40 mg/dl > 60 mg/dl LDL-C < 100 mg/dl >160 mg/dl Triglyzeride < 150 mg/dl > 200 mg/dl Wünschenswert Hoch Niedrig Hoch Wünschenswert Hoch Normal Hoch Indikation für Behandlung mit Lipidsenker abhängig von Atheroskleroserisiko und LDL-Cholesterin Ohne Risikofaktor + LDL-C 160-190mg/dl Bei 2 Risikofaktoren + LDL-C > 160 mg/dl Bei koronarer Herzkrankheit + LDL-C >130 mg/dl Bei KHK + Diabetes mellitus + LDL-C > 100 mg/dl Lipidsenker Angriffspunkte und Wirksamkeit Angriffspunkt Stoffgruppe HMG-CoA-Reduktase () Statine Enterohepatischer Kreislauf der Gallensäuren () PPAR Leberstoffwechsel Unklar Cholesterintransport () am Darmepithel (NPC1L1) Anionenaustauscherharze Fibrate Nikotinsäure Ezetimibe Abfall des LDL-C 20-55% Zunahme von HDL-C 10% 20% 4% ? 25% 20% 5-15% 15 – 30% unbekannt Kombinationstherapie LDL-C Abfall um mehr als 50% Partner: Statin + Anionenaustauscherharz Simvastatin + Ezetimibe Statin + Fenofibrat Statin + Nikotinsäure Statine = kompetitive Hemmung der HMG-CoA-Reduktase, einem Schlüsselenzym der Cholesterinbiosynthese [HMG-CoA = Hydroxy-Methyl-Glutarsäure-Koenzym A] Vertreter (gereiht nach Affinität für HMG-CoA-Reduktase) Fluva- < Prava -, Lovas- < Simva- < Atorva- < Rosuva- < Pitava Effekt 1. Reduzierte Cholesterinsynthese in der Leber ... LDL-Rezeptoren LDL-Aufnahme Abfall des Plasma LDL titrierbar 2. VLDL-Synthese Triglyzeride Metabolismus der Statine First-pass effect: Aufnahme in Leberzelle durch OATP, Abbau durch CYPs und Glucuronyltransferase 5-20% der Dosis erreicht die systemische Zirkulation (Gefahr von tödlichen Zwischenfällen durch Bioverfügbarkeit = Interaktionen! z.B. Lipobay=Cerivastatin) Kein Einfluss auf NNR- und Keimdrüsenfunktion Halbwertszeit < 12 hr Orale Gabe, einmal täglich (am besten abends) Verträglichkeit = gut. Nebenwirkungen 1. Muskelbeschwerden 2. Statin-Myopathie Risiko der Rhabdomyolyse (Inzidenz gering <0.1%, Lebensgefahr) Symptome wie beim grippalen Infekt Zunehmende Schmerzen, Abgeschlagenheit Serum-Creatinkinase, Myoglobinurie Akutes Nierenversagen 3. KI = Schwangerschaft. 4. Hepatotoxizität = sehr selten Pharmakokinetische Eigenschaften und Wechselwirkungen von Statinen Effekte auf AUC Simva Lova Atorva Prava Rosuva Fluva Pitava CYP3A4 Inhibitor x 10 <x2 CYP2C9 Inhibitor <x2 <x2 Ciclosporin x 10 x5 gering höher 75% 50% Bioverfügbarkeit Induktion CYP2C9-Inhibitoren: Nife-, Nicardipin Diclofenac Omeprazol Azol-Antimykotika (Fluconazol, Voriconazol) Risikozunahme durch Wechselwirkung Gemfibrozil CYP3A4-Inhibitoren Azol-Antimykotika Makrolid-Antibiotika HIV-Protease-Inhibitoren Ciclosporin Wenn Kombination mit einem dieser Mittel notwendig: Statin-Dosis niedrig halten = ein Viertel der maximal empfohlenen Dosis PPAR – nukleäre Rezeptoren Angriffspunkte für stoffwechselaktive Pharmaka PPARSubtyp Rezeptorligand Gewebe Zielgene Ungesättigte Fettsäuren (Arachidonsäure metabolite) Leber Enzyme der Fettsäureoxidation Fibrate 1, 2 Pharmakol. Agonist 2 in Fettzellen Adiponectin und Vorstufen Thiazolidindione Placenta Foetus Skeletmuskel Herzmuskel keine Lactatdehydrogenase Fibrate, Liganden des PPAR (Peroxisomen-Proliferator-Aktivator-Rezeptor ) Vertreter: Fenofibrat, Bezafibrat, Gemfibrozil Aktivierung von PPAR in Leberzellen Fettsäureoxidation apoC VLDL LPL Fenofibrat apoA HDL Abnahme der „small dense“ LDL-Partikel AG = MCI Prävention, wenn HDL-Cholesterin niedrig (und Triglyzeridspiegel hoch) Indikationen Dyslipidämie wie bei Typ II Diabetes (HDL, Triglyzeride), aber: FenofibratKombi mit Statin bringt keinen Nutzen im Vergleich zu Statin allein Typ IIb Hyperlipidämie (LDL-C, Triglyceride) Hypertriglyzeridämie Verträglichkeit = gut Gastrointestinale Störungen (schwach leberschädlich) Relative Kontraindikation= Nieren-, Leberinsuffizienz Risiko für Entstehung von Gallensteinen KI = Schwangerschaft und Kindesalter Nikotinsäure (Präparate: Nikotinsäure in Retardgalenik; Acipimox) aktiviert in supraphysiologischen Dosen (1-2 g/Tag) einen G-Protein-gekoppelten Rezeptor …im Fettgewebe Hemmung der Lipolyse (vorübergehend) …in Hautzellen Prostaglandinfreisetzung Flush (vorübergehend) Lipidsenkung: Triglyzeride, LDL-Cholesterin, HDL Mechanismus verzögert (HDL), indirekt und im Detail unbekannt Pharmakokinetik: Hohe Clearance (15 ml/min/kg) • Rasche Verstoffwechslung zu Nikotinamid, NAD; Konjugation mit Glycin Nikotinursäure • Aus Nierentubuluszellen wird Nikotinsäure über den URAT1-Transporter in den Harn sezerniert - als „Gegenanion“ treibt Nikotinsäure die Rückresorption der Harnsäure AG = Kombi mit Statin (in submaximaler Dosis) Nebenwirkungen • Bei Therapiebeginn Flushsymptomatik mit Juckreiz, Parästhesien und Kopfschmerz – Dosis langsam steigern („einschleichen“), zur Prävention auch Gabe von COX-Hemmern oder Laropiprant (Prostaglandin D2-Rezeptorantagonist) • Insulinresistenz • Magenschmerzen (präventiv Antazida) • Leberschäden • Sehstörung infolge Retinaödems (reversibel) KI Diabetes Ulcus(anamnese) Hyperurikämie Nikotinsäureeffekte durch den HCA2Rezeptor Fettzelle Langerhanszelle Hemmung der Lipolyse Freisetzung von Prostaglandin(D) Abnahme der Freien Fettsäuren Flushing Keratinozyt Flushing Fettresorptionshemmung Ezetimibe hemmt intestinalen Cholesterintransport Anwendung allein: Cholesterinsynthese Anwendung in Kombination mit Statinen : LDL Pharmakokinetik: Sehr lipophil hepatische Glucuronidierung aktiver Metabolit Enterohepatischer Kreislauf Halbwertszeit ~ 20h Verträglichkeit: gut, wenig Erfahrung AG = ? (verhindert nicht Atherosklerose) Anionen-Austauscherharze Kolloidale nicht resorbierbare Kunsstoffpolymere (hygroskopisch)- Cholestyramin, Colesevelam hemmen Gallensäure- und Cholesterin-Resorption LDL-Rezeptor-Induktion und vermehrte Cholesterinsynthese. 1. LDL um 20% 2. VLDL-Spiegel anfänglich 3. HDL Nebenwirkungen Verdauungsstörungen (Obstipation, Völlegefühl, Fettstühle), Präparate schmecken schlecht Einnahmehinweise 2*tägl. vor dem Frühstück und Abendessen Mittel im Kühlschrank mit Wasser quellen lassen! Können Resorption von Pharmaka reduzieren– Einnahmezeitpunkte versetzen!


