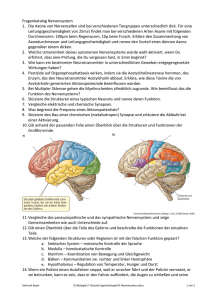
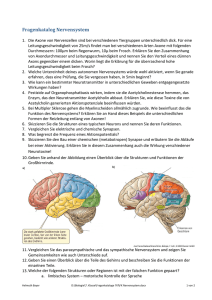
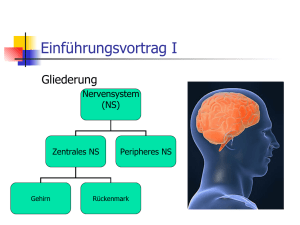
Das vegetative Nervensystem und seine therapeutischen Ansätze
Werbung

Diplomarbeit Das vegetative Nervensystem und seine therapeutischen Ansätze im klinischen Alltag eingereicht von Elena Maria Neururer zur Erlangung des akademischen Grades Doktor der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut für Experimentelle und Klinische Pharmakologie unter der Anleitung von Univ.-Prof.i.R. Mag.pharm. Dr. Eckhard Beubler Univ.-Prof. Dr.med.univ. Donnerer Josef Graz, August 2016 Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, 31.08.2016 .……………………………………………… Elena Maria Neururer eh Seite | 2 Danksagungen Da ich nun am Ende meiner Ausbildung stehe, möchte ich mich an dieser Stelle bei einigen Personen bedanken, die mich auf diesem langen Weg begleitet und unterstützt haben. Für ihre unendliche Liebe, Fürsorge, Motivation und Unterstützung, möchte ich mich bei meinen lieben Eltern, Wolfgang und Maria Neururer, bedanken. Ohne euch, wäre ich heute nicht da, wo ich bin. Ein besonderer Dank gilt meinem Bruder, Raphael - du hast mich nicht nur inspiriert, Medizin zu studieren, sondern warst in den letzten 6 Jahren auch meine allergrößte Stütze. Durch deine liebevolle, motivierende und bekräftigende Art hast du es stets geschafft, mir selbst in schwierigen Situationen ein Lachen ins Gesicht zu zaubern und neue Kraft zu geben. Dafür, großer Bruder und für deine uneingeschränkte Unterstützung und Hilfe in den vergangenen Jahren, danke ich dir von Herzen. Ein weiteres großes Dankeschön gilt meinem kleinen Bruder Clemens – obwohl du viele hunderte Kilometer entfernt warst, hattest du stets ein offenes Ohr für mich. Besonders in schwierigen Momenten hat mich deine unglaublich lustige und optimistische Art immer wieder aufs Neue inspiriert und motiviert. Meine Schwester Mirjam darf an dieser Stelle nicht unerwähnt bleiben, da sie stets an mich geglaubt und mich in meinem Tun bestärkt hat. Weiters möchte ich mich herzlich bei Evelyn Zöhrer bedanken - du hast es stets geschafft, mich mit lieben Worten oder kleinen Zettelchen aufs Neue zu motivieren und warst bei der Fertigstellung meiner Diplomarbeit eine große Hilfe. Ein ganz besonderer Dank gebührt meinem Diplomarbeitsbetreuer, Herrn Univ.-Prof.i.R. Mag.pharm. Dr. Eckard Beubler, für die Unterstützung, die Betreuung, die Begutachtung und vor allem die Vermittlung zu diesem sehr interessanten Thema. Des Weiteren möchte ich mich bei meinem Zweitbetreuer, Herrn Univ.-Prof. Dr.med.univ. Josef Donnerer für die organisatorische Hilfe bedanken. Abschließend bedanke ich mich bei all meinen Freunden und Studienkollegen, für die tolle Studienzeit, die wir gemeinsam miteinander verbringen durften. Seite | 3 Zusammenfassung In vielerlei Hinsicht ist das Nervensystem (lateinisch „Systema nervosum“) das komplizierteste, aber auch das faszinierendste funktionelle System des menschlichen Körpers: Es umfasst die Gesamtheit aller Nervenzellen (Neurone) und Gliazellen im Körper. Zu seinen wichtigsten Aufgaben zählen die Wahrnehmung von Reizen, deren Verarbeitung sowie das Auslösen angemessener Reaktionen. Das Nervensystem kann in ein zentrales Nervensystem (ZNS) und ein peripheres Nervensystem (PNS) gegliedert werden. Das Zentralnervensystem (ZNS) besteht aus dem Gehirn und dem Rückenmark. Die funktionelle Grundeinheit des Gehirns ist das Neuron, dessen Aufgabe es ist, Informationen zu einem anderen Neuron, einer Muskelzelle oder Drüsenzelle weiterzuleiten. Ein Neuron besteht aus einem Zellkörper (Perikaryon), einem oder mehreren Dendriten und aus einem Neurit (Axon). Das PNS setzt sich aus Hirn-und Spinalnerven, mit den dazugehörigen Ganglien, zusammen. Funktionell betrachtet wird das PNS weiters in ein vegetatives (auch autonomes oder viszerales) Nervensystem und ein somatisches Nervensystem unterteilt. Während das somatische (auch animalische) Nervensystem die willkürlichen und reflektorischen Körperaktionen steuert, arbeitet das vegetative Nervensystem ohne bewusste Steuerung (autonom). Es steuert alle vegetativen Parameter, wie z.B Kreislauf, Atmung, Körpertemperatur, Wasserhaushalt, Verdauung, Stoffwechsel, Fortpflanzung und innerviert motorisch vornehmlich die glatte Muskulatur der inneren Organe und Gefäße, sowie exokrine und endokrine Drüsen. Hinsichtlich funktioneller und struktureller Aspekte wird das vegetative Nervensystem in drei Teile gegliedert: Sympathikus, Parasympathikus und enterisches Nervensystem. In Zeiten von Stress und körperlicher Erregung stellt der Sympathikus Energie und Ressourcen bereit und hat somit eine aktivitätssteigernde Wirkung auf den Körper. Im Gegensatz dazu stellt der Parasympathikus seinen Dienst ganz in die Erholung des Körpers, indem er Leistungsreserven aufbaut und Energie speichert. Obwohl die Wirkungsweise von Sympathikus und Parasympathikus größtenteils gegensätzlich (antagonistisch) ist, arbeiten beide Systeme eng miteinander zusammen, um die Stabilität des inneren Körpermilieus (Homöostase) aufrecht zu erhalten. Für die Informationsübertragung im vegetativen Nervensystem werden Botenstoffe (Transmitter) benötigt. Wird durch ein ankommendes Aktionspotential die Nervenendigung depolarisiert, verschmelzen die mit Transmittern gefüllten Vesikel mit der präsynaptischen Membran. Die in den synaptischen Spalt ausgeschütteten Transmitter binden an der postsynaptischen Membran an spezielle Membranproteine, sogenannte Rezeptoren. Man unterscheidet exzitatorische (erregende) und inhibitorische (hemmende) Rezeptoren. Die häufigsten Transmitter die von Neuronen im vegetativen Nervensystem freigesetzt werden, sind Acetylcholin (AcH), Noradrenalin und Adrenalin. Nervenfasern, die Acetylcholin freisetzen, werden als cholinerge Fasern bezeichnet. Dazu zählen alle präganglionäre Fasern des vegetativen Nervensystems, sowohl sympathische als auch parasympathische, sowie alle postganglionäre Fasern des parasympathischen Systems und einige sympathische postganglionäre Fasern. Acetylcholin bindet an zwei Arten von Rezeptoren: zum einen an den nikotinischen und zum anderen an den muskarinischen Rezeptor. Nervenfasern, die Noradrenalin freisetzen, werden als adrenerge Fasern bezeichnet. Noradrenalin wird von den meisten sympathischen postganglionären Fasern freigesetzt und bindet an adrenerge Rezeptoren (alpha1, alpha2, beta1 und beta2). Daher bieten Synthese, Speicherung und Freisetzung des Neurotransmitters, sowie die Beendigung der Neurotransmitteraktivität und Rezeptoreffekte potentielle Angriffspunkte in der pharmakologischen Therapie. Parasympathomimetika sind Substanzen, die einen muskarinischen Rezeptor erregen; Substanzen, die ihn blockieren, werden als Parasympatholytika bezeichnet. Gleichermaßen werden Substanzen, die einen adrenergen Rezeptor stimulieren als Sympathomimetika und solche, die ihn blockieren, als Sympatholytika bezeichnet. Schlüsselworte: Vegetatives Nervensystem, Botenstoffe (Transmitter), adrenerge Rezeptoren, muskarinische Rezeptoren, pharmakologische Therapie Seite | 4 Abstract In many ways the nervous system (in Latin “Systema nervousum”) is the most complex, but also fascinating functional system of the human body. It encompasses all nerve cells (neuron) and glia cells in the human body. It’s most important tasks include the perception of stimuli, their processing as well as triggering the appropriate responses. The nervous system can be divided into a central nervous system (CNS) and a peripheral nervous system (PNS). The central nervous system is composed of the brain and the spinal cord; the basic working unit of the brain is the nerve cell, whose function is to transmit information to another nerve cell, muscle cell or gland cell. The intake and transmission of this nerve impulses takes place in form of an action potential. A nerve cell consists of a cell body, one or more dendrites and one neurite (axon). The peripheral nervous system consists of the brain- and spinal nerves, as well as the associated ganglia. Functionally, the peripheral nervous system is divided into an autonomic nervous system (ANS) and a somatic nervous system. While the somatic nervous system controls voluntary and reflex body actions, the autonomic nervous system operates mostly independently, autonomously. It controls all autonomic parameters such as e.g. circulation, respiration, body temperature, digestion, metabolism, reproduction and innervates mainly the smooth muscles of the internal organs and blood vessels, as well as the exocrine and endocrine glands. In terms of functional and structural aspects, the autonomic nervous system is divided into three parts: the sympathetic nervous system, the parasympathetic nervous system and the enteric nervous system. In times of stress and physical arousal the sympathetic nervous system provides energy and resources and has an overall activityincreasing effect on the human body. The parasympathetic nervous system however is active at rest and restores energy when needed. Although the mode of action is largely contrary (antagonistic); the two systems are working closely together, to maintain the stability of the inner body environment (homeostasis). To transmit information from cell to cell, the autonomic nervous system requires substances, called transmitters. If the nerve ending is depolarized by an incoming action potential, vesicles filled with transmitters merge within the presynaptic membrane. The transmitters are distributed into the synaptic cleft and bind onto specific membrane proteins, called receptors in the postsynaptic membrane. A distinction is made between excitatory and inhibitory receptors. The most common transmitters released by neurons in the autonomic nervous system are acetylcholine, norepinephrine and epinephrine. Nerve fibers, which release acetylcholine are called cholinergic fibers. These include all preganglionic fibers of the autonomic nervous system, both sympathetic, parasympathetic, postganglionic fibers of the parasympathetic nervous system and a few postganglionic fibers of the sympathetic nervous system. Acetylcholine binds onto two types of receptors: the nicotinic and muscarinic receptor. Nerve fibers, which release norepinephrine are called adrenergic fibers. Norepinephrine is released by most postganglionic sympathetic fibers and binds to adrenergic receptors (alpha1, alpha2, beta1 and beta2). Synthesis, storage, release of neurotransmitters, the termination of neurotransmitter activity and receptor effects offer potential targets in pharmacological therapy. Parasympathomimetics are substances that stimulate a muscarinic receptor; substances that block those types of receptors are referred to as parasympatholytics. Similarly, substances that stimulate the adrenergic receptor are called sympathomimetics; their counterparts are called sympatholytics. Keywords: Autonomic nervous system, transmitters, adrenergic receptors, muscarinic receptors, pharmacological therapy Seite | 5 Inhaltsverzeichnis Danksagungen .................................................................................................................................. 3 Zusammenfassung ............................................................................................................................ 4 Abstract ............................................................................................................................................ 5 Inhaltsverzeichnis ............................................................................................................................. 6 Glossar und Abkürzungen ................................................................................................................ 8 Abbildungsverzeichnis ...................................................................................................................... 9 Tabellenverzeichnis ........................................................................................................................ 10 1. EINLEITUNG ............................................................................................................................ 10 1.1 1.1.1 Aufbau und Anatomie ............................................................................................ 10 1.1.2 Zentrales Nervensystem (ZNS) ............................................................................... 11 1.1.3 Peripheres Nervensystem (PNS) ............................................................................. 12 1.2 3. Entwicklungsgeschichte des Nervensystems ..................................................... 12 1.2.1 Embryogenese/Embryonalentwicklung ................................................................. 12 1.2.2 Histogenese des Nervensystems ............................................................................ 14 1.3 2. Das Nervensystem .............................................................................................. 10 Zellen des Nervengewebes und deren Funktion ................................................ 16 1.3.1 Neuron .................................................................................................................... 16 1.3.2 Neuroglia ................................................................................................................ 20 1.3.3 Markscheide, Myelin ............................................................................................... 24 1.3.4 Synapse ................................................................................................................... 26 GRUNDLAGEN DER NEUROPHYSIOLOGIE ............................................................................ 29 2.1 Ionenkanäle ......................................................................................................... 29 2.2 Ruhepotential ..................................................................................................... 10 2.3 Aktionspotential .................................................................................................. 31 2.4 Erregungsleitung ................................................................................................. 32 DAS VEGETATIVE NERVENSYSTEM ....................................................................................... 33 3.1 Funktionelle Grundlagen .................................................................................... 33 3.1.1 3.2 Nervenfortsätze ....................................................................................................... 35 Anatomische Grundlagen, übergeordnete vegetative Steuerzentren ............... 35 3.2.1 Hypothalamus ......................................................................................................... 35 Seite | 6 3.2.2 Limbisches System ................................................................................................... 36 3.2.3 Formatio reticularis ................................................................................................. 36 3.3 3.3.1 Sympathikus ............................................................................................................ 38 3.3.2 Parasympathikus ..................................................................................................... 38 3.4 4. Organisation des vegetativen Nervensystems ................................................... 37 Neurotransmission .............................................................................................. 40 3.4.1 Grundlagen der Neurotransmission ........................................................................ 40 3.4.2 Neurotransmitter .................................................................................................... 40 ARZNEIMITTEL MIT WIRKUNGEN AUF DAS VEGETATIVE NERVENSYSTEM ........................ 45 4.1 Parasympathomimetika ...................................................................................... 45 4.1.1 Acetylcholin (ACh) ................................................................................................... 45 4.1.2 Synthetische Cholinester: Carbachol, Betanechol, Methacholin ............................ 46 4.1.3 Alkaloide .................................................................................................................. 48 4.1.4 Indirekte Sympathomimetika (AChE-Hemmstoffe) ................................................. 49 4.2 Parasympatholytika ............................................................................................ 51 4.2.1 4.3 Atropin, Scopolamin, Ipratropium, Tiotropium ....................................................... 52 Sympathomimetika ............................................................................................. 54 4.3.1 Adrenalin ................................................................................................................. 54 4.3.2 α- und β1-Rezeptor-stimulierende Sympathomimetika ......................................... 55 4.3.3 β-Rezeptor-stimulierende Sympathomimetika ....................................................... 56 4.3.4 β2-selektive Sympathomimetika ............................................................................. 57 4.4 Sympatholytika ................................................................................................... 60 4.5 Sympatholytika - α-Rezeptor-blockierende Substanzen (α-Blocker) ................. 61 4.5.1 α1-Rezeptor Antagonisten ...................................................................................... 61 4.5.2 α2-Rezeptor Antagonisten ...................................................................................... 64 4.5.3 Nicht-selektive α-Rezeptor Antagonisten ............................................................... 65 4.5.4 Weitere α-Rezeptor Antagonisten .......................................................................... 65 4.6 Sympatholytika - β-Rezeptor-blockierende Substanzen (β-Blocker) .................. 66 4.6.1 Nicht-selektive β-Blocker ........................................................................................ 70 4.6.2 β1-selektive-Rezeptor Antagonisten ....................................................................... 72 4.6.3 β-Rezeptor Antagonisten der 3. Generation ........................................................... 73 5. CONCLUSIO ............................................................................................................................ 75 6. LITERATURVERZEICHNIS ....................................................................................................... 76 Seite | 7 Glossar und Abkürzungen Abb. Abbildung ZNS Zentrales Nervensystem PNS Peripheres Nervensystem ER Endoplasmatisches Retikulum ATP Adenosintriphosphat GFAP Glia Fibrillary Acidic Protein mV Millivolt Acetyl-CoA Acetyl-Coenzym A L-Dopa L-Dihydroxyphenylalanin ms Millisekunden α Alpha β Beta ACh Acetylcholin COPD Chronisch obstruktive Lungenerkrankung, chronic obstructive pulmonary disease GI-Trakt Gastrointestinaltrakt MAO Monoaminoxidase AV-Block Atrioventrikulärer Block COMT Catechol-O-Methyltransferase BPH Benigne Prostatahyperplasie AV-Knoten Atrioventrikularknoten KHK Koronare Herzkrankheit, coronary heart disease NYHA New York Heart Association ACE Angiotensin-konvertierendes Enzym, angiotensin converting enzyme Seite | 8 Abbildungsverzeichnis Abb. 1: Struktur des Nervensystems - Seite 11 Abb. 2: Bläschenformation: Differenzierung der Primär- zu den Sekundärbläschen - Seite 14 Abb. 3: Neurulation & Histogenese: Entwicklung des embryonalen Nervensystems - Seite 15 Abb. 4: Aufbau/Struktur eines Neurons - Seite 17 Abb. 5: Axonaler Transport - graphische Übersicht - Seite 20 Abb. 6: Neuroglia im ZNS - Übersicht - Seite 23 Abb. 7: Neuroglia im PNS - Übersicht - Seite 24 Abb. 8: Markscheidenbildung im PNS - Seite 25 Abb. 9: Die Myelinscheide im ZNS - Seite 26 Abb. 10: Struktur - chemische Synapse - Seite 27 Abb. 11: Struktur - elektrische Synapse - Seite 28 Abb. 12: Ionenkanäle - Übersicht - Seite 30 Abb. 13: „Sympathikus vs. Parasympathikus“ - Seite 34 Abb. 14: Strukturformel: Acetylcholin - Seite 41 Abb. 15: Strukturformel: R-Adrenalin - Seite 42 Abb. 16: Strukturformel: Noradrenalin - Seite 44 Abb. 17: Pathologie des Asthma bronchiale - Seite 59 Abb. 18: Typische (weiße) Finger bei Raynaud-Syndrom - Seite 62 Abb. 19: Strukturformel: Propranolol, 3D-Darstellung der Strukturformel - Seite 70 Seite | 9 1. EINLEITUNG 1.1 Das Nervensystem 1.1.1 Aufbau und Anatomie „Was ist der Körper, wenn das Haupt ihm fehlt?“ [1] Das Nervensystem (lat. Systema nervosum) ist sicherlich in vieler Hinsicht das komplizierteste funktionelle System des Körpers. Es ermöglicht allen Menschen die Kommunikation mit ihrer Umwelt, durch Milliarden feinst abgestimmter elektrischer Impulse, die fortlaufend durch dieses faszinierende Netzwerk jagen, welches den Körper durchzieht und somit seine Teile wie ein sehr komplexes Telefonnetz verbindet. Die wohl wichtigsten Funktionen des Nervensystems sind die Wahrnehmung, die Integration des Wahrgenommenen, das Denken und Fühlen, sowie die Auslösung angemessener Verhaltensweisen. [2] Das Nervensystem wird unterteilt in: [3] - zentrales Nervensystem (Zentralnervensystem, ZNS) und - peripheres Nervensystem (PNS). Anatomisch betrachtet umfasst das zentrale Nervensystem das Gehirn und Rückenmark, wohingegen sich das periphere Nervensystem aus Hirn- und Spinalnerven, mit den dazugehörigen Ganglien, zusammensetzt. [4] Seite | 10 Abb. 1: Struktur des Nervensystems. (Modifiziert nach Amerman 2015[3]) 1.1.2 Zentrales Nervensystem (ZNS) Im ZNS bilden Gehirn und Rückenmark die Hauptzentren, die sowohl funktionell als auch strukturell untrennbar miteinander verbunden sind. Sowohl das Gehirn, als auch das Rückenmark werden durch die Knochen des Schädels und die Wirbelsäule geschützt. Hirnund Rückenmarkshäute (Meningen) umhüllen das ZNS, welches in ein Flüssigkeitskissen gebettet ist, das als Hirn- oder Nervenwasser (Liquor cerebrospinalis) bezeichnet wird. Diese klare, farblose Flüssigkeit fungiert unter anderem als Stoßdämpfer bei schnellen Bewegungen des Kopfes und übt somit eine Schutzfunktion aus. Auch in den sogenannten Hirnventrikeln, einem speziellen Hohlraumsystem innerhalb des ZNS, ist diese Flüssigkeit anzutreffen. [2,4] Seite | 11 1.1.3 Peripheres Nervensystem (PNS) Das PNS kann als Rezeptor- und Effektororgan des Zentralnervensystems angesehen werden. Es spiegelt sich in den zahlreichen Nerven wieder, die durch den gesamten Körper ziehen. Über sensible oder motorische Leitungsbahnen leitet es entweder Impulse von der Peripherie zum ZNS (sensibel) oder vom ZNS in die Peripherie (motorisch). Weiters wird das zentrale, als auch das periphere Nervensystem - funktionell betrachtet - in ein somatisches Nervensystem bzw. vegetatives Nervensystem unterteilt. [2] Somatisches Nervensystem Das somatische (auch animalische) Nervensystem besteht aus den neuronalen Strukturen des zentralen und peripheren Nervensystems und ist verantwortlich für (1) die Vermittlung und Verarbeitung von bewussten und unbewussten sensorischen (afferenten) Informationen in der Peripherie, wie Schmerz und Berührung und (2) dient es (motorisch) der willkürlichen Ansteuerung der Skelettmuskulatur. [5] Vegetatives Nervensystem Das vegetative (auch autonome oder viszerale) Nervensystem ist jener Teil des peripheren Nervensystems, das für die Aufrechterhaltung des inneren Gleichgewichts im Körper (Homöostase) verantwortlich ist. Weiters steuert es vegetative Parameter, wie Herzschlag, Atmung, Verdauung, Fortpflanzung und Stoffwechsel. [2] 1.2 Entwicklungsgeschichte des Nervensystems 1.2.1 Embryogenese/Embryonalentwicklung Die Genese des Nervensystems während der Embryonalzeit umfasst folgende drei Schlüsselschritte: - (Neural)-Induktion - Neurulation - Bläschenformation Seite | 12 (Neural)-Induktion In den frühen Stadien der Embryogenese entwickeln sich drei übereinanderliegende Schichten, die Keimblätter: Endoderm, Mesoderm und Ektoderm. Aus diesen drei Schichten gehen, unter starken Wechselwirkungen, Organ-, Knochen-, Muskel-, Haut- oder Nervengewebe hervor. Etwa am 17. Embryonaltag entwickelt sich aus dem Ektoderm, durch Ansporn (Induktion, auch Neuralinduktion) des Mesoderms und der Chorda dorsalis (= mesodermales, inneres Achsenskelett), das Neuroektoderm, aus dem schlussendlich die Neuralplatte hervorgeht. [2,6] Neurulation Am 18. Embryonaltag entwickelt sich das Neuralrohr (Neurulation im engeren Sinne). Dies geschieht, indem sich die Neuralplatte zur Mittellinie hin vertieft und sich die Neuralrinne ausbildet. Die Kanten der Neuralrinne wölben sich zu Wülsten und formen sich in weitere Folge zu den Neuralfalten. Diese bewegen sich aufeinander zu, verschmelzen miteinander und bilden einen langen Hohlzylinder, das Neuralrohr (Abb. 3). Aus diesem entstehen später Gehirn und Rückenmark; aus dem Hohlraum des Rohres entwickelt sich das Ventrikelsystem. Bis zum 25. Embryonaltag schließt sich das Neuralrohr, dessen vorderes (Kopf-)Ende als Neuroporus rostalis und hinteres Ende als Neuroporus caudalis bezeichnet wird. [2,4,7] Bläschenformation Die Proliferation der Zellen im vorderen, größeren Abschnitt des Neuralrohrs führt zur Dilatation dieses Bereiches und zur Bildung der drei sogenannten Primärbläschen: ein vorderes Prosencephalon-(Vorderhirn-)bläschen, ein mittleres Mesencephalon- (Mittelhirn-)bläschen und ein hinteres Rhombencephalon-(Rautenhirn-)bläschen. [2] Seite | 13 Abb. 2: Bläschenformation: Differenzierung der Primär- zu den Sekundärbläschen. [8] Am 32. Embryonaltag teilen sich Prosencephalon und Rhombencephlon in jeweils zwei weitere Bläschen auf: Das Prosencephalonbläschen teilt sich in ein hinteres Diencephalon(Zwischenhirn-)bläschen, aus dem auf beiden Seiten ein Augenbläschen wächst (= spätere Anlage des Nervus opticus und der Netzhaut) und ein davor liegendes Telencephalon(Endhirn-)bläschen. Das Rhombencephalon teilt sich weiter in ein Myel-encephalon(zukünftige Medulla oblungata) und ein Metencephalonbläschen, aus dem sich später das Cerebellum (Kleinhirn) und der Pons entwickeln. Telencephalon, Diencephalon, Mesencephalon, Metencephalon und Myelencephalon werden als Sekundärbläschen bezeichnet. [2] 1.2.2 Histogenese des Nervensystems Das Neuroepithel kleidet sowohl das Neuralrohr, als auch die Neuralleiste aus. Aus ihm entstehen später die Nerven- und Gliazellen. Mit Ausnahme der weichen Hirnhäute entwickeln sich alle bindegewebigen Anteile, die an das Nervensystem geknüpft sind, wie z.B. harte Hirnhaut, Blutgefäße und Mikrogliazellen, aus dem Mesenchym. Die Zellen des ZNS (zentrale Nervenzellen und zentrale Gliazellen) entwickeln sich aus dem Neuralrohr. Die Neuralleiste enthält das Zellmaterial der sensiblen und vegetativen Nerven bzw. Ganglien, sowie der peripheren Gliazellen (Schwann- und Satellitenzellen). Weiters enthält die Neuralleiste die Anlagen für die Zellen des Nebennierenmarks, der Melanozyten und die Zellen der weichen Hirnhäute. [2] Seite | 14 Abb. 3: Neurulation & Histogenese: Entwicklung des embryonalen Nervensystems. [9] Seite | 15 1.3 Zellen des Nervengewebes und deren Funktion Das Zentralnervensystem besteht aus Nervengewebe, welches sich aus Nervenzellen (Neuronen) und speziellen Bindegewebszellen/Stützzellen (Gliazellen) zusammensetzt und organisiert als graue und weiße Substanz vorliegt, welche sich wiederum in Rinde, Mark und Kerne gliedert. [2,4] 1.3.1 Neuron Nervenzellen (Neurone) sind spezialisierte Zellen, die mit- und untereinander auf einzigartige Weise kommunizieren. Als strukturelle und funktionelle Grundeinheit ist eine Nervenzelle dazu bestimmt, Informationen zu einer anderen Nervenzelle, Muskelzelle oder Drüsenzelle weiterzuleiten. Die Aufnahme und Weiterleitung dieser (Nerven-) Impulse erfolgt in Form eines Aktionspotentiales. Abhängig von der Spezies, enthält das Gehirn zwischen 1-100 Milliarden Nervenzellen. Sie unterscheiden sich erheblich in Größe und Form. Während einige Nervenzellen im ZNS nur 1mm lang sind, können periphere Nervenzellen bis zu 1 Meter Länge erreichen. [3,6] Ein Neuron setzt sich aus drei Teilen zusammen: dem Zellkörper (Soma oder Perikaryon), der den Zellkern und das Zytoplasma enthält und in dem die Mehrheit der biosynthetischen Prozesse der Zelle ablaufen; aus einem oder mehreren Dendriten, die elektrische Signale zum Zellkörper leiten und aus einem Neuriten (Axon), dem „langen Arm“ der Nervenzelle, der elektrische Signale vom Zellkörper weg-/weiterleitet. [3] Seite | 16 Abb. 4: Aufbau/Struktur eines Neurons. (Modifiziert nach Amerman 2015[3]) Zellkörper (Perikaryon) Der Zellkörper ist der metabolisch aktivste Teil eines Neurons, da er sowohl für die Aufrechterhaltung des zytoplasmatischen Volumens der Nervenzelle, als auch für die Produktion aller Proteine, die von der Nervenzelle benötigt werden, verantwortlich ist. Diese hohe biosynthetische Aktivität spiegelt sich in der Zusammensetzung der Organellen innerhalb des Zytoplasmas wider: [3,10] - Freie Ribosomen und endoplasmatisches Retikulum liegen im Überfluss vor. Sie spiegeln das Engagement des Zellkörpers zur Proteinsynthese wider. Das mit reichlich Ribosomen besetzte endoplasmatische Retikulum (raues oder granuläres ER) organisiert sich in zahlreiche, konzentrische Stapel (Nissl-Schollen). - Weiters sind der Golgi-Apparat und ein, oder mehrere Nucleoli an der Proteinsynthese beteiligt. - Eine große Anzahl an Mitochondrien stellt den (hohen) Energiebedarf der Nervenzelle sicher. - Darüber hinaus enthält der Zellkörper, der von einer doppelschichtigen Membran umgeben wird, Lysosomen und glattes endoplasmatische Retikulum. Seite | 17 Die charakteristische Form des Perikaryons wird allerdings durch andere Komponenten des Zytoplasmas aufrechterhalten - das neuronale Zytoskelett. Dieses besteht aus Intermediärfilamenten. Diese Filamente schließen sich zu Bündeln zusammen, um größere Struktur zu bilden, sogenannte Neurofibrillen, welche den gesamten Zellkörper und Fortsätze durchziehen. Das Zytoskelett enthält weiters Mikrotubuli, die zum einen für die mechanische Stabilisierung und zum anderen für den Transport von Proteinen zwischen dem Zellkörper und dem Axon zuständig sind. [3] Fortsätze: Dendriten und Axon Jene Verlängerungen, die sich aus den Zellkörpern aller Neuronen erstrecken und häufig an die „langen Arme“ der zugehörigen Nervenzelle reichen, sind zytoplasmatische Erweiterungen und werden Fortsätze genannt. Diese Fortsätze erlauben der Nervenzelle, mit anderen Zellen zu kommunizieren. Die meisten Neurone besitzen zwei Arten von Fortsätzen; ein oder mehrere Dendriten und ein Axon. [3] Dendriten sind in der Regel sehr kurze, stark verästelte Fortsätze, die die Erregung von anderen Nervenzellen aufnehmen und diese in Form von elektrischen Impulsen an den Zellkörper weiterleiten. Durch diese Verästelung wird deren Oberfläche stark vergrößert und dadurch auch der Raum, der den Zellen zur intrazellulären Kontaktaufnahme zur Verfügung steht. [3,11] Das Zytoplasma der Dendriten ähnelt dem der Zellkörper und enthält Nissl-Schollen, Mitochondrien, Mikrotubuli, Mikrofilamente, Ribosomen und agranuläres ER. [4] Obwohl ein Neuron mehrere Dendrite aufweisen kann, besitzt es in der Regel nur ein einziges Axon (Neurit). Das Axon wird als langer, neuronaler Fortsatz beschrieben, der die Leitung von Informationen aus dem Zellkörper in die Nervenendigungen gewährleistet. Ein Axon ist rohrförmig aufgebaut, variiert aber in der Länge, je nach Lokalisation des Neurons im Körper. So kann ein Axon sehr kurz sein (1 mm, z.B. Neurone des ZNS) oder extrem lang (bis zu 3 Meter), wenn sie sich von einem peripheren Rezeptor der Haut zum Rückenmark und von dort bis ins Gehirn erstrecken. Ein weiterer wesentlicher Aspekt ist der Durchmesser eines Axons; dieser variiert beträchtlich. Axone mit größerem Durchmesser leiten Impulse wesentlich schneller, als jene mit geringerem Durchmesser. Die Zellmembran die das Axon umgibt, wird als Axolemma (Axolemm) bezeichnet. Das Zytoplasma des Axons wird Axoplasma genannt. Das Axoplasma enthält Mitochondrien, Seite | 18 Lysosomen, sowie viele Neurofilamente und Neurotubuli, unterscheidet sich jedoch vom Zytoplasma des Zellkörpers durch Fehlen von Nissl-Granula und des Golgi-Apparates. Ebenfalls fehlen RNA und Ribosomen im Axoplasma. [4] Als Ursprungsort des Axons gilt eine kleine konische Erhebung auf dem Zellkörper, die frei von Nissl-Granula ist und Axonhügel oder Ursprungskegel genannt wird. Das darauf anschließende kurze Segment des Fortsatzes wird Initialsegment genannt. Es ist stets ohne Hülle und gilt als erregbarster Teil des Axons. Es ist jener Ort, an dem leicht ein Aktionspotential initiiert werden kann, aufgrund der auffallend niedrigen Erregungsschwelle des Axolemms. Die anschließende Hauptverlaufsstrecke des Axons kann in ihrer Länge variieren und Abzweigungen aufweisen. Diese meist im rechten Winkel abgehenden Äste, werden als Kollateralen bezeichnet. Sowohl das Axon, seine Kollateralen und die Dendriten spalten sich in der Nähe ihres Endes in sehr feine, multiple Zweige auf, die Telodendrien. Die Telodendrien enden in den Endknöpfchen (Axonterminal) und bilden so den präsynaptischen Teil der Synapse. [3,4] Ein Axon leitet immer Impulse vom Zellkörper weg. Eine Ausnahme stellen die Axone der sensorischen Hinterwurzelganglienzellen dar; hier leitet ein langer Neurit den Impuls zum Zellkörper hin. [4] Der axonale Transport Der axonale Transport ist ein wichtiges Mittel zur Organell- und Molekülbeförderung entlang der Nervenfaser, sowohl vom, als auch zum Zellkörper hin. Er ist für die neuronale Funktion und Lebensfähigkeit instrumental. Viele neurodegenerative Erkrankungen werden mit Fehlern bzw. Störungen im axonalen Transport in Zusammenhang gebracht; wie z.B. die Alzheimer-Krankheit, Parkinson, Chorea Huntington, diabetische Neuropathie uvm. Klassisch betrachtet können axonale Transport(prozesse) in zwei Richtungen ablaufen. Der anterograde (zentrifugale) Transport verläuft vom Zellkörper (Perikaryon) in Richtung der terminalen Aufzweigungen (Telodendron), der retrograde (zentripetale) Transport erfolgt vom Axonterminal in Richtung Zellkörper. [12] Seite | 19 Abb. 5: Axonaler Transport - graphische Übersicht. (Modifiziert nach Juranek 2013[12]) Mit Hilfe des axonalen Transportes werden z.B. Membranproteine, Neurotransmitter, Mitochondrien und glattes endoplasmatisches Retikulum transportiert. Abhängig von der Geschwindigkeit, unterscheidet man einen schnellen (bis zu 400mm/Tag) und einen langsamen (0,1 bis 3mm/Tag) axonalen Transport (Abb. 5). Der schnelle axonale Transport (100-400mm/Tag) dient vor allem den in Vesikeln verpackten Neuro-transmittern. Diese Art von Transport beruht auf Motorproteinen im Axoplasma, die ATP verbrauchen um die Substanzen entlang der Mikrotubuli zu transportieren. Diese Motorproteine sind Kinesien für den anterograden (weg vom Zellkörper) Transport und Dynein für den retrograden (zum Zellkörper hin) Transport. Langsamer axonaler Transport (0,1-3mm/Tag): Hier werden vor allem im Zellkörper synthetisierte Proteine, darunter die Strukturproteine des Zytoskeletts, transportiert. Der langsame axonale Transport findet nur in anterograde Richtung statt. [3,4] 1.3.2 Neuroglia Neuroglia (Gliazellen) sind Stützzellen, die sowohl Nervenzellen im zentralen, als auch im peripheren Nervensystem umgeben. Im Gegensatz zu den meisten Neuronen, behalten Gliazellen ihre Fähigkeit zur Teilung ein Leben lang und füllen die Lücke auf, wenn Neuronen zugrunde gehen. Im gesamten Nervensystem können 6 verschiedene Arten an Neuroglia unterschieden werden; 4 davon finden sich im ZNS und 2 im PNS wieder. [3,5] Seite | 20 Neuroglia im ZNS Die Anzahl an Neurogliazellen übertrifft die der Neuronen im ZNS um das 10-fache. Daher machen sie auch etwa die Hälfte der Gehirnmasse aus. [3] Innerhalb des ZNS kommen vier verschiedene Arten von Neurogliazellen vor: Astrozyten, Oligodendrozyten, Mikroglia und Ependymzellen. Astrozyten Astrozyten besitzen kleine Zellkörper mit vielen verzweigten Fortsätzen, die sich in alle Richtungen erstrecken. Es werden zwei Arten von Astrozyten unterschieden: [4] - Faserglia (Astrocytus fibrosus) werden vor allem in der weißen Substanz des ZNS gefunden; jeder ihrer Fortsätze ist lang, schlank und nicht stark verzweigt. - Protoplasmatische Glia (Astrocytus protoplasmaticus) kommen vor allem in der grauen Substanz des ZNS vor. Ihre Fortsätze sind kürzer, dicker und stärker verzweigt, als jene der Faserglia. Weitere Astrozyten sind die Bergmanzellen im Kleinhirn, die Müllerzellen in der Netzhaut, die Pinealozyten in der Zirbeldrüse und die Pituizyten im Hinterlappen der Hypophyse. [5] Astrozyten (wörtlich „sternförmige Zellen“) sind die am zahlreichsten und vielfältigsten Gliazellen im ZNS. Sie besitzen in der Tat ein sternförmiges Aussehen, mit mehreren aus dem Soma entspringenden Hauptfortsätzen. Das archetypische morphologische Merkmal der Astrozyten ist allerdings die Expression von Intermediärfilamenten, die das Zytoskelett bilden. Die zwei Hauptvertreter astroglialer Intermediärfilamente sind GFAP (Glia Fibrillary Acidic Protein) und Vimentin; die Expression von GFAP wird allgemein als spezifischer Marker zur Identifizierung von Astrozyten verwendet. [13] Oligodendrozyten Oligodendrozyten sind Gliazellen, die nur wenige Fortsätze besitzen, wie der Name bereits andeutet („oligo“ griechisch = wenig, „dendron“ griechisch = Baum). Die Haupt-funktion der Oligodendrozyten ist die Produktion von Myelin. [13] Seite | 21 Mikroglia Mikrogliazellen sind die immunkompetenten Zellen des ZNS. Im Wesentlichen bilden sie das Immunsystem des Gehirns aus, welches nach Verletzungen oder Infektionen aktiviert wird. Sie repräsentieren etwa 10 Prozent aller Gliazellen im Gehirn. Mikrogliazellen präsentieren sich im ZNS in drei unterschiedlichen Zustandsformen, nämlich als (1) „ruhende“ Mikrogliazellen (im gesunden Gehirn), (2) als aktivierte bzw. reaktivierte Mikrogliazellen (die in der Lage sind, Zytokine zu produzieren und bei Schädigungen des ZNS mit Hypertrophie und vermehrtem Zellwachstum zu reagieren) und (3) als phagozytische Zellen (Makrophagen). [5] Ependyma Ependymzellen sind einfache kubische (Glia-)Zellen. Sie kleiden die mit Flüssigkeit gefüllten Hohlräume im Gehirn und Rückenmark aus und tragen an ihrer Oberfläche ein Flimmerepithel. [3] Ependymzellen können in drei Gruppen unterteilt werden: [4] - Ependymozyten - kleiden die Ventrikel des Gehirns und den Zentralkanal des Rückenmarks aus und helfen durch Bewegung der Zilien bei der Zirkulation der zerebrospinalen Flüssigkeit. Die zahlreichen Mikrovilli an der Oberfläche der Ependymozyten lassen auch auf ein starkes Sekretions- und Resorptionsvermögen schließen. - Tanyzyten - säumen den Boden des dritten Ventrikels aus und sind an der Ausbildung der Blut-Hirn-Schranke mitbeteiligt. - Choroide Epithelzellen - bedecken die Oberfläche des Plexus choroideus und sind somit an der Produktion und Sekretion der zerebrospinalen Flüssigkeit mitbeteiligt. Seite | 22 Abb. 6: Neuroglia im ZNS - Übersicht. (Modifiziert nach Amerman 2015[3]) Gliazellen im PNS Im PNS existieren zwei Arten an Gliazellen: Schwann-Zellen und Satellitenzellen. Die Schwann-Zellen der peripheren Nerven und die perineuronalen Satellitenzellen der sensorischen und vegetativen Ganglien sind das Äquivalent zu den drei Arten an Gliazellen (Astroglia, Oligodendroglia, Mikroglia) im ZNS. Außer ihrer unterschiedlichen Lage, sind Schwann-Zellen und Satellitenzellen nicht voneinander zu unterscheiden. Wie Astroglia (Astrozyten), umschließen und separieren die Gliazellen des PNS unmyelinisierte Nervenfasern und (2) befinden sich im interneuronalen Raum zwischen den Neuronen. Wie Oligodendrozyten produzieren sie Myelin. Wie Mikroglia können Schwann-Zellen, als Antwort auf Verletzungen und Entzündungen der Nerven zu Phagozyten werden. Anders als Gliazellen, sezerniern Schwannzellen jedoch Kollagen, Laminin und Fibronektin (extrazelluläre adhäsive Proteine). Diese Proteine sind die wichtigsten Bestandteile der Basalmembran und extraneuronalen Matrix, sowie der Basallamina, die die Zellmembran von Axonen umgibt. [3,5] Seite | 23 Abb. 7: Neuroglia im PNS - Übersicht. (Modifiziert nach Amerman 2015[3]) 1.3.3 Markscheide, Myelin Die Markscheide (Myelinscheide) wird von den eben genannten Oligodendrozyten (ZNS) und Schwann-Zellen (PNS) gebildet. Sie ist eine fetthaltige/lipidreiche Isolierschicht, die die Axone spiralförmig umwickelt und somit die Erregungsleitung/-ausbreitung von Aktionspotentialen erleichtert. [13] Myelin-Struktur Myelin besteht aus sich wiederholenden Schichten von Plasmamembranen der neuroglialen Zellen; somit enthält es dieselben Bestandteile wie die Plasmamembran: Phospholipide, Lipide und Proteine. Die Hauptkomponenten (70-80%) von Myelin stellen verschiedene Lipide dar, einschließlich Cholesterin und weitere Phospholipide, wie Phosphatidylethanolamin und Lecithin. Bezogen auf den menschlichen Körper, bedeutet „elektrischer Strom“, Bewegung von Ionen. Ionen können jedoch nicht so leicht durch die Phospholipid-Doppelschicht der Plasmamembran passieren, weshalb der hohe Lipidgehalt von Myelin einen ausgezeichneten Isolator darstellt. Der Gesamteffekt dieser Isolierung ist, die Leitungsgeschwindigkeit von Aktionspotentialen zu erhöhen: Myelinisierte Axone leiten Aktionspotentiale etwa 15-150 Mal schneller, als unmyelinisierte Axone. [3] Seite | 24 Myelinisierung (Markscheidenbildung) Die Myelinisierung im PNS findet wie folgt statt: Eine Schwann-Zelle umwickelt den peripheren Nervenfortsatz und wächst mehrmals exzentrisch-kreisförmig um ihn herum. Die daraus im Querschnitt resultierende lamellenartige Struktur (Markscheide) wird bei lichtmikroskopischer Betrachtung sichtbar (Abb. 8). Dabei umwickeln mehrere SchwannZellen eine periphere Nervenfaser. [2] Abb. 8: Markscheidenbildung im PNS. SEM = scanning electron microscope (Modifiziert nach Amerman 2015[3]) Die Myelinscheide ist eine segmentierte, diskontinuierliche Schicht, die in regelmäßigen Abständen durch Ranvier-Schnürringe unterbrochen wird. Myelinscheide misst circa 0,5 bis 1mm an Länge. Schnürringen wird als Internodium bezeichnet; [4] [13] Jedes Segment der Der Abstand zwischen zwei hier findet keine Erregung (Aktionspotential) der Zellmembran statt. Internodium und Schnürringe bilden dabei eine funktionelle Einheit. Eine Erregung (Aktionspotential) der Plasmamembran ist alleinig an den Schnürringen möglich. Hier versammeln sich auch fast alle Natriumkanäle der Axonmembran, die als physiologische Grundlage der Aktionspotentiale gelten. Das daraus resultierende „Springen“ des Aktionspotentials von einem Schnürring zum nächsten, wird als saltatorische Erregungsleitung bezeichnet, wodurch bei der Erregungsleitung viel Zeit Seite | 25 eingespart wird. Dieses Prinzip ist umso effektiver, je dicker die Markscheidenumhüllung und je größer der Abstand zwischen zwei Ranvier-Schnürringen ist. [2] Als zentralnervöse Äquivalente der Schwann-Zellen, umwickeln die Oligodendrozyten die neuronalen Fortsätze nicht mit ihrem Zellleib, sondern einzig und allein mit ihren Fortsätzen. Da ein Oligodendrozyt mehrere Fortsätze besitzt, ist es ihm möglich, gleichzeitig mehrere Axone oder Dendrite zu umhüllen. [2] Abb. 9: Die Myelinscheide im ZNS. (Modifiziert nach Amerman 2015[3]) 1.3.4 Synapse Die Verbindung zwischen zwei Neuronen oder einem Neuron und einer Effektorzelle (Effektororgan) wird als Synapse bezeichnet. Als motorische Endplatte bezeichnet man die Synapse zwischen einem Motoneuron und einer Muskelzelle. Ein Impuls wandert am Axon entlang, bis es dessen Ende, auch Axonterminal genannt, erreicht. Die meisten Nervenzellen sind nicht direkt miteinander verbunden, sondern haben eine kleine Lücke zwischen sich. Diese Lücke wird auch synaptischer Spalt genannt. Diese Neuronen liegen jedoch nicht nahe genug beisammen, dass ein Impuls von einem Neuron auf das andere springen kann. Deshalb übertragen chemische Botenstoffe, sogenannte Neurotransmitter das neuronale Signal von einem Neuron auf das nächste Neuron bzw. auf eine Effektorzelle (z.B. Drüse, Muskelfaser). Unter physiologischen Bedingungen erfolgt die Kommunikation an der Synapse nur in eine Richtung. [14] Seite | 26 Es gibt zwei Arten von Synapsen: chemische und elektrische Synapsen. Die chemische Synapse Erreicht ein Aktionspotential den präsynaptischen Teil der Synapse, verursacht dieser ankommende Impuls einen Einstrom von Kalzium-Ionen an der präsynaptischen Zellmembran. Dadurch verschmelzen die mit Transmitter gefüllten Vesikel mit der Membran und geben ihren Inhalt durch Exozytose in den synaptischen Spalt ab. Die Transmitter diffundieren über die Synapse und erreichen die postsynaptische Membranen der nachfolgenden Nerven-, Muskel- oder Drüsenzellen in 0,5 bis 1 ms. Nach Erreichen der postsynaptischen Membran binden die Transmitter an spezifische Proteine in der Membran (Rezeptoren). Dadurch wird die postsynaptische Membran elektrisch erregt und das Signal von Zelle zu Zelle weitergeleitet. [2] Abb. 10: Struktur - chemische Synapse. (Modifiziert nach Amerman 2015[3]) Seite | 27 Nachdem ein Botenstoff seine Wirkung vollbracht hat, wird er von speziellen Enzymen aufgebrochen, inaktiviert und zumeist von der präsynaptischen Membran wiederaufgenommen und in Vesikel verpackt (Reuptake des Transmitters). [14] Die elektrische Synapse Die elektrischen Synapsen stellen im Nervensystem eher eine Ausnahme dar. Sie kommen vor allem im Herz- und glatten Muskelgewebe vor und beruhen auf dem Prinzip von interzellulären Ionenkanälen (Gap Junctions, Nexus). [2] Abb. 11: Struktur - elektrische Synapse. (Modifiziert nach Amerman 2015[3]) Seite | 28 2. GRUNDLAGEN DER NEUROPHYSIOLOGIE 2.1 Ionenkanäle Eine zweischichtige Zellmembran, deren innere Schicht aus Phospholipiden und äußere Schicht sich aus Glykoproteinen besteht, umgibt die Neuronen. Innerhalb der Zellmembran befinden sich spezialisierte Proteinmoleküle, die Kanäle ausbilden. Diese sind selektiv durchlässig für Natrium-, Kalium-, Chlorid- oder Kalzium-Ionen. Diese Ionenkanäle setzten sich aus Transmembranproteinen zusammen und bilden einen wassergefüllten Diffusionsweg durch die doppelschichtige Zellmembran aus. [11] Es gibt zwei Hauptklassen von Kanälen: [3,11,15,16,17] - Leak channels (Leckkanäle) sind immer offen und erlauben so den Ionen sich entlang ihres Konzentrationsgradienten, entweder in die Zelle oder aus der Zelle hinaus, zu bewegen. Der wohl wichtigste Vertreter dieser Klasse ist der K⁺-leak channel (oder K⁺-resting channel). - Gated channels (gesteuerte Kanäle) sind geschlossen und öffnen sich nur auf bestimmte Reize hin. So öffnen sich (A) Liganden-gesteuerte Kanäle lediglich, wenn der für sie spezifische Ligand an eine äußere Rezeptorstelle des Kanalproteins bindet. Dies bewirkt eine Konformationsänderung des Rezeptors, wodurch sich der Kanal öffnet und die Ionen einströmen können. Solche Kanäle kommen typischerweise an den Synapsen vor. Die Öffnungswahrscheinlichkeit bei (B) spannungsabhängigen Kanälen hängt maßgebend vom Membranpotential ab. Besonders wichtige Vertreter dieses Kanal-Typs sind die entlang von Nerven- und Muskelfasern vorkommenden Na⁺-Kanäle und die in den Endigungen der Nervenzellaxone vorkommenden Ca²⁺-Kanäle. Die dritte Art gesteuerter Kanäle sind die (C) mechanisch gesteuerten Kanäle, die durch mechanische Reize, wie Druck und Vibration aktiviert werden. Seite | 29 Abb. 12: Ionenkanäle - Übersicht. (Modifiziert nach Amerman 2015[3]) 2.2 Ruhepotential Die unregelmäßige Verteilung von Ionen im Intra (IZ)- und Extrazellulärraum (EZ) einer Nervenfaser und die unterschiedliche Ionenleitfähigkeit der Zellmembran führt dazu, dass sich innerhalb einer Nervenzellen ein elektrisches Potential aufbaut. Ausschlagegebend für das Ruhepotential einer Zelle ist das Verhältnis der Kalium-Ionen-Konzentration: Im nicht erregten Zustand (der Zellmembran) diffundieren fortlaufend Kalium-Ionen in den Seite | 30 Extrazellulärraum. Da die ruhende Membran für K⁺-Ionen gut permeabel ist und die Konzentration von K⁺-Ionen im intrazellulären Raum ungefähr 35-mal höher ist als im extrazellulären Raum, diffundieren K⁺-Ionen laufend nach extrazellulär. Aus diesem Grund lädt sich die Membran langsam negativ auf. Diese negative Aufladung der Zellmembran kommt zum Erliegen, wenn sie der Diffusionsdruck des Konzentrations-gradienten für K⁺ aufhebt und pendelt sich bei einem Wert (= Höhe des Ruhepotentials) von -60 bis -90 mV ein. Für Natriumionen ist die ruhende Membran überwiegend impermeabel. [11,17] 2.3 Aktionspotential Ein Aktionspotential ist per definitionem eine gleichförmige, schnelle Depolarisation und anschließende Repolarisation (des Membranpotentials) einer Zelle. Bezogen auf das Nervensystem, wird ein Aktionspotential an einem bestimmten Bereich des Axons, der sogenannten Triggerzone erzeugt; diese umfasst den Axonhügel und das Initialsegment eines Axons. D.h. dass ein Aktionspotential nur in (an) einem Axon generiert werden kann; an den Dendriten und Zellkörpern der Nervenzellen können nur lokale Potentiale erzeugt werden. Wenn eine Nervenzelle durch elektrische, chemische oder mechanische Stimuli erregt wird, werden an der Zellmembran Natriumkanäle geöffnet. Die Folge ist ein rascher Natriumeinstrom, der durch die ungleiche Verteilung von Natrium-Ionen im Intrazellulärraum (IZ) und Extrazellulärraum (EZ) zu erklären ist. Der rasche Einstrom von Natrium-Ionen führt dazu, dass sich die Membraninnenseite positiv auflädt. Unabhängig von Art und Stärke des depolarisierenden Reizes wird ein Aktionspotential ausgelöst => „Alles-odernichts-Gesetz“. Das Aktionspotential ist jedoch nur von geringer Dauer, etwa 5 ms. Mit einer leichten Verzögerung steigt nun auch die Membranpermeabilität der Kalium-Ionen erneut stark an, was dazu führt, dass Kalium-Ionen aus der Zelle (nach extrazellulär) diffundieren. Dadurch wird der vorrangegangene rasche Natriumeinstrom kompensiert. Weiters bewirkt der Kaliumausstrom eine Repolarisation der Membran, wobei hierbei auch eine aktive Natriumpumpe mitbeteiligt ist. Nachdem ein Aktionspotential erzeugt wurde, ist die Membran für kurze Zeit für neue Reize unerregbar; diese Zeitspanne wird als Refraktärzeit bezeichnet. Unterschieden wird eine zunächst absolute Refraktärzeit und eine (darauf folgende) relative Refraktärzeit. [3,4,11] Seite | 31 2.4 Erregungsleitung Beginnend am Axonhügel, bewegt sich das Aktionspotential, über eine schrittweise (sukzessive) Eröffnung von spannungsabhängigen Natriumkanälen entlang der Zellmembran des Axons fort. Mit welcher Geschwindigkeit sich dieser „Erregungsberg“, der als lokale Depolarisation verläuft, ausbreitet, ist stark abhängig vom Umfang des Axons und der Dicke seiner Markscheide. Einen besonderen Stellenwert nehmen hierbei die RanvierKnoten/Schnürringe ein: Wie schon unter Kapitel 1.3.3 beschrieben, umhüllt die Markscheide das Axon und wirkt dabei wie ein elektrischer Isolator, der die Kapazität der Axonmembran herabsetzt und ihren Widerstand verstärkt. Deshalb wird auch nur in diesem Bereich der nodalen Axonabschnitte ein Aktionspotential initiiert und die internodalen, bemarkten Teilbereiche in gewisser Weise „übersprungen“. Diese Art der Erregungsleitung wird als saltatorische Erregungsleitung bezeichnet und gewährleistet eine wesentlich raschere Fortleitung der Nervenzellimpulse. [11] Seite | 32 3. DAS VEGETATIVE NERVENSYSTEM 3.1 Funktionelle Grundlagen Das vegetative (auch autonome oder viszerale) Nervensystem innerviert motorisch vornehmlich die glatte Muskulatur der inneren Organe und Gefäße, sowie exokrine und endokrine Drüsen. Alle vegetativen Parameter, wie z.B Kreislauf, Atmung, Körpertemperatur, Wasserhaushalt, Verdauung, Stoffwechsel und Fortpflanzung werden durch das vegetative Nervensystem gesteuert. Gemeinsam mit dem endokrinen System, ist das vegetative Nervensystem für die „Aufrechterhaltung des inneren Milieus“ (Homöostase) verantwortlich. Des Weiteren passt es die einzelnen Organfunktionen an die aktuellen Bedürfnisse im Körper und die alternierenden Umwelterfordernisse an. Die Steuerung des vegetativen Nervensystems findet zum größten Teil auf der unbewussten Ebene statt. [2,4] Das vegetative Nervensystem wird anhand funktioneller und struktureller Gesichtspunkte in drei Teile gegliedert: [18] - Sympathikus - Parasympathikus - Enterisches Nervensystem. Die Wirkungsweise von Sympathikus und Parasympathikus auf die verschiedensten Strukturen im vegetativen Nervensystem ist größtenteils gegensätzlich (antagonistisch). Allerdings arbeiten die sympathischen und parasympathischen Komponenten des vegetativen Nervensystems eng miteinander zusammen, um die Stabilität des inneren Körpermilieus aufrecht zu erhalten. Während der Sympathikus in Zeiten von Stress und körperlicher Erregung, Energie und Ressourcen bereitstellt und somit eine aktivitätssteigernde Wirkung auf den Körper hat, stellt der Parasympathikus seinen Dienst ganz in die Erholung des Körpers. Er stellt sicher, dass die Leistungsreserven des Körpers wieder aufgebaut werden und Energie gespeichert wird. Unter dem Einfluss des Parasympathikus wird Glykogen in die Muskulatur und Leber eingelagert, die DrüsenSeite | 33 aktivität wird gesteigert und die Verdauung aktiviert. Auch werden Blutdruck und Herzfrequenz gesenkt. Diese Reaktionslage des Organismus nennt man auch „trophotrop“. [4,19] Der Parasympathikus entspringt aus dem Hirnstamm und dem Sakralmark, weshalb er auch als kraniosakrales System bezeichnet wird. [17] Im Gegensatz dazu, wird unter dem Einfluss des Sympathikus, Blutdruck, Herzfrequenz und Energieumsatz gesteigert, um den Organismus schnell an die wechselnde Belastung anzupassen. Des Weiteren wird die Verdauung gehemmt. Somit arbeitet der Sympathikus „ergotrop“. In Stress- und Fluchtreaktionen kommt es zu einer blitzschnellen, maximalen Aktivierung des Sympathikus. („fight or flight“). [19] Der Sympathikus wird auch thorakolumbales System genannt, da er dem Brustmark und den oberen 2-3 Segmenten des Lumbalmarks entstammt. [17] Abb. 13: „Sympathikus (grün) vs. Parasympathikus (blau)“.[20] Seite | 34 3.1.1 Nervenfortsätze Das vegetative Nervensystem besitzt einen afferenten (sensiblen) und einen efferente (motorischen) Schenkel. Efferenter Schenkel Die sympathischen und parasympathischen Endneurone (postganglionäre Neurone) liegen außerhalb des ZNS, wobei die sympathischen Endneurone im Grenzstrang zu finden sind und die parasympathischen Endneurone in der Nähe des innervierten Organs liegen. Die vorgeschalteten Neurone, auch präganglionäre Neurone genannt, haben ihren Ursprung im ZNS; ihre Zellkörper liegen entweder im Seitenhorn der grauen Substanz des Rückenmarks oder im Hirnstamm. Die Axone dieser Neurone ziehen zu den vegetativen Ganglien, die außerhalb des ZNS lokalisiert sind und enden synaptisch auf den Zellkörpern der postganglionären Neurone, welche die Effektororgane des vegetativen Nerven-systems innervieren. [21] Afferenter Schenkel Das bisher Geschriebene trifft jedoch nicht auf den afferenten (sensiblen) Teil des vegetativen Nervensystems zu. Dieser wird, im Gegensatz zum efferenten Teil nicht in einen sympathischen und parasympathischen Anteil unterteilt, da es keine Zweigliederung gibt, weder funktionell noch strukturell betrachtet. Analog zu den somatosensiblen Afferenzen, liegt der Zellkörper des 1. Neurons, bezogen auf die vegetativen Afferenzen, in einem Spinalganglion bzw. einem Hirnnervenganglion. [2] 3.2 Anatomische Grundlagen, übergeordnete vegetative Steuerzentren 3.2.1 Hypothalamus Der Hypothalamus ist jener Teil des Zwischenhirns, der sich von der Lamina terminalis und dem Chiasma opticum bis zum kaudalen Rand des Corpus mamillare erstreckt. Er liegt ventral des Sulcus hypothalamicus, an der Seitenwand des 3. Ventrikels. Somit ist Seite | 35 ersichtlich, dass der Hypothalamus anatomisch gesehen nur einen relativ kleinen Bereich des Gehirns ausmacht, jedoch strategisch sehr gut platziert ist, in unmittelbare Nähe zum limbischen System, Thalamus, zu den auf- und absteigenden Tracti, sowie zur Hypophyse. Mikroskopisch betrachtet, setzt sich der Hypothalamus aus kleinen Nervenzellen zusammen, die in Gruppen oder Kernen angeordnet sind. Physiologisch gesehen, findet im Körper kaum eine Tätigkeit statt, die nicht durch den Hypothalamus beeinflusst wird. Er steuert und integriert die Funktionen des vegetativen Nervensystems und endokrinen Systems. Somit spielt er eine wichtige Rolle in der Aufrechterhaltung des Körpermilieus (Homöostase). Des Weiteren ist er sehr eng mit dem limbischen System verknüpft. [4,5] 3.2.2 Limbisches System Das limbische System ist unter anderem beteiligt an der Verwertung von Emotionen, der Entstehung des Triebverhaltens und spielt eine bedeutende Rolle bei der Speicherung von Gedächtnisinhalten. [22] Anatomisch betrachtet, umfasst das limbische System folgende Strukturen: Gyrus cinguli, Gyrus parahippocampalis, Hippocampus, Corpus amygdaloideum (Mandelkern), Corpus mamillare, Fornix, Nuclei anterioventrales des Thalamus, Septum pellucidum. [4] 3.2.3 Formatio reticularis Die Formatio reticularis, bezeichnet ein diffuses Netzwerk an Nervenzellen und Nervenfasern, die sich vom Hirnstamm aus, über die Medulla oblongata, bis hin zum Thalamus erstrecken. Mikroskopisch betrachtet ist die Formatio reticularis ein Komplex (aus) grauer Substanz, vermischt mit Faszikeln der auf- und absteigenden Axone und dendritischen Dornen, die ihr das Aussehen eines „gewebten Netzes“ verleihen. Mit Ausnahme der Regionen, die den Hirnnervenkernen, dem Nucleus ruber und der Substantia nigra zugeschrieben werden, nimmt die Formatio reticularis die gesamte graue Substanz des Hirnstammtegmentums ein und zieht sich bis ins Rückenmark hinab. [2,4,5] Seite | 36 Gutabgrenzbare Kernregionen der Formatio reticularis sind die Raphekerne und der Locus caeruleus. Die Kerngruppen der Formatio reticularis lassen sich aufgrund zytoarchitektonischer und funktioneller Gründe in drei longitudinale Zonen (im Hirnstamm) einteilen: mediane Zone, mediale Zone und laterale Zone. Die mediane Zone besteht aus den oben genannten Raphekernen. Die mediale Zone („ableitende“ Zone) ist durch die Anwesenheit von vielen großen Neuronen, deren Axone sich in lange auf- und absteigende Äste (auf)gabeln, gekennzeichnet. Die laterale Zone („sensorische“ Zone“) besteht aus kleinen Zellen, mit relativ kurzen auf- und absteigenden Axonen, die in erster Linie in der medialen retikulären Zone enden. Diese laterale Zone erhält zahlreiche sensorische Informationen aus dem Rückenmark, den Hirnnerven und dem Cerebellum (Kleinhirn). [2,5] Die Funktionen der Formatio reticularis sind vielfältig: Einer ihrer wichtigsten Aufgaben ist die Verschaltung der einzelnen Hirnstammkerne. Das Atem- und Kreislaufzentrum, sowie das Brechzentrum in der Medulla oblongata und das im Mesencephalon gelegene Weckzentrum, das auch als aufsteigendes retikuläres aktivierendes System (ARAS) bezeichnet wird, sind Zentren, die in der Formatio reticularis lokalisiert sind. Der motorische Teil der Formatio reticularis beeinflusst über Projektionen ins Rückenmark (Fibrae bzw. Tractus reticulospinales) den Tonus von Rumpf- und Extremitätenmuskulatur und gehört somit zum extrapyramidalen System. [2,4] 3.3 Organisation des vegetativen Nervensystems Da die Wirkung von Sympathikus und Parasympathikus auf die verschiedensten Organe meist gegensätzlich ist, kann man sie funktionell als Antagonisten bezeichnen. Allerdings arbeiten beide Systeme eng miteinander zusammen, um das Gleichgewicht des Körpermilieus aufrechtzuerhalten. Seite | 37 3.3.1 Sympathikus Das sympathische Nervensystem innerviert das Herz, die Lunge, die Muskulatur der Blutgefäße, die Haarfollikel, die Schweißdrüsen, sowie den Großteil der abdomino-pelvinen Eingeweide. Die Hauptaufgabe des Sympathikus liegt darin, den Körper auf einen möglichen Notfall vorzubereiten. Sollte dieser (oder eine andere Stresssituation) eintreten, erhöht er die Herzfrequenz, verengt die Arteriolen der Haut und des Darms, erweitert die Arteriolen in der Skelettmuskulatur und führt zum Anstieg des Blutdruckes. Darüber hinaus erweitert der Sympathikus die Pupillen und hemmt (inhibiert) die glatte Muskulatur der Bronchien, des Darms und der Blasenwand. Weiters aktiviert der Sympathikus die Schweißdrüsen. [4] Sympathische Efferenzen Die präganglionären Neurone des sympathischen Nervensystems entspringen aus den thorakalen und lumbalen Regionen des Rückenmarks (Segmente von Th1-L2). Die meisten dieser präganglionären Neurone sind kurz. Sie bilden Synapsen mit den postganglionären Neuronen innerhalb der Ganglien aus, welche wiederum im Grenzstrang (Truncus sympathicus) zu finden sind. Der Grenzstrang verläuft parallel auf beiden Seiten des Rückenmarks und besteht aus 22 Ganglien. Ein einzelnes präganglionäres Neuron, kann mit mehreren postganglionären Neuronen in verschiedenen Ganglien Synapsen ausbilden, weshalb das Verhältnis von präganglionären Fasern zu postganglionären Fasern im sympathischen Nervensystem bei 1:20 liegt. Diese Divergenz der präganglionären Neurone führt zu einer koordinierten sympathischen Stimulation im gesamten Körper. Die meist sehr langen postganglionären Neurone entstammen dem Grenzstrang und ziehen von dort zu ihren Erfolgsorganen. [2,4] Seite | 38 3.3.2 Parasympathikus Die Aktivitäten des parasympathischen Nervensystems zielen darauf ab, Energie zu erhalten bzw. zu erneuern: Die Herzfrequenz wird verlangsamt, die Pupillen verengen sich, die Peristaltik und die Drüsentätigkeit wird erhöht, die Sphinkter öffnen sich und die Blasenwand wird kontrahiert. [4] Parasympathische Efferenzen Die präganglionären Neurone des Parasympathikus entspringen aus mehreren Kernen des Hirnstamms und aus den Rückenmarkssegmenten S2-S4. Die Axone der präganglionären Neurone sind recht lang, im Vergleich zu denen des sympathischen Systems. Sie bilden Synapsen mit den postganglionären Neuronen innerhalb der terminalen Ganglien, die auf oder in der Wand des Erfolgsorgans liegen. Die Axone der postganglionären Neurone hingegen sind sehr kurz. Da sich die terminalen Ganglien meist im innervierten Gewebe befinden, ist die Signaldivergenz sehr gering, im Vergleich zum sympathischen Nervensystem. In den meisten Organen gibt es ein 1:1 Verhältnis von präganglionären zu postganglionären Fasern. Die präganglionären Neuronen, die aus dem Hirnstamm entspringen, verlassen das ZNS über die Hirnnerven. Der Nervus oculomotorius innerviert die Augen; der Nervus facialis innerviert die Tränendrüsen, die Speicheldrüse und die Schleimhaut der Nasenhöhle; der Nervus glossopharyngeus innerviert die Parotis (Speicheldrüse); der Nervus vagus innerviert die Eingeweide des Thorax und des Abdomens (Herz, Lunge, Magen, Pankreas, Dünndarm, obere Hälfte des Dickdarms und Leber). Die physiologische Bedeutung dieser Nerven, in Bezug auf den Einfluss des Parasympathikus, wird durch ihre weite Verbreitung deutlich gemacht und der Tatsache, dass 75% aller parasympathischen Fasern im Vagusnerv lokalisiert sind. Die präganglionären Neurone, die aus dem Sakralbereich des Rückenmarks entspringen, verlassen das ZNS und schließen sich zusammen, um die Beckennerven zu bilden, die die Eingeweide der Beckenhöhle (untere Hälfte des Dickdarms, Rektum, ableitende Harnwege, innere und äußere Genitale) innervieren. [2,4] Seite | 39 3.4 Neurotransmission 3.4.1 Grundlagen der Neurotransmission Durch ein ankommendes Aktionspotential wird die Nervenendigung depolarisiert, was einen Calciumeinstrom in das Axoplasma des Nerventerminals zur Folge hat. Die mit Neurotransmitter gefüllten Vesikel sind durch Synapsin (= ein Protein) an das Zytoskelett geheftet. Durch den Calciumeinstrom wird das Synapsin phosphoryliert, wodurch sich die mit Neurotransmitter gefüllten Vesikeln vom Zytoskelett lösen und mit der präsynaptischen Membran verschmelzen. An der postsynaptischen Membran binden die ausgeschütteten Transmitter an spezielle Membranproteine, sogenannte Rezeptoren. Man unterscheidet: (1) Exzitatorische Rezeptoren - bindet ein Transmitter, steigt die Leitfähigkeit für Kationen (Na⁺/K⁺), was zu einer lokale Depolarisation führt. (2) Inhibitorische Rezeptoren - bindet ein Transmitter, kommt es aufgrund einer erhöhten Leitfähigkeit für K⁺ und Cl- zu einer Hyperpolarisation. Zur Beendigung der Wirkung wird der Transmitter entweder enzymatisch abgebaut oder er wird über einen speziellen Na+-abhängigen Amintransport wieder in die präsynaptische Nervenzelle aufgenommen. Synthese, Speicherung und Freisetzung des Neurotransmitters, die Beendigung der Neurotransmitteraktivität und Rezeptoreffekte, bieten potentielle Angriffspunkte in der pharmakologischen Therapie. [23] 3.4.2 Neurotransmitter Die häufigsten Neurotransmitter, die von Neuronen im vegetativen Nervensystem freigesetzt werden, sind Acetylcholin, Adrenalin und Noradrenalin. Nervenfasern, die Acetylcholin freisetzen, werden als cholinerge Fasern bezeichnet. Dazu gehören alle präganglionären Fasern des vegetativen Nervensystems, sowohl sympathische als auch parasympathische; alle postganglionären Fasern des parasympathischen Systems und einige sympathische postganglionäre Fasern. Nervenfasern, die Noradrenalin freisetzen, werden als adrenerge Fasern bezeichnet. Die meisten sympathischen postganglionären Fasern setzen Noradrenalin frei. [24] Seite | 40 Acetylcholin Abb. 14: Strukturformel: Acetylcholin. [25] Alle präganglionären Neurone des Sympathikus und Parasympathikus setzen Acetylcholin frei. Im parasympathischen System fungiert Acetylcholin als Botschafter des postganglionären Neurons und als Mediator an der motorischen Endplatte. Acetylcholin wird aus Cholin und Acetyl-CoA, welches in den Mitochondrien im Axonende synthetisiert wird, gebildet. Die vielfältigen Wirkungen von Acetylcholin werden von unterschiedlichen Rezeptor-Subtypen vermittelt. [24] Acetylcholin-Rezeptoren und Signaltransduktion Acetylcholin bindet an zwei Arten von Rezeptoren: an den nikotinischen und muskarinischen Rezeptor. Nikotinrezeptoren werden vor allem durch den Agonisten Nikotin erregt und sind ligandengesteuerte Ionenkanäle. Man findet sie auf den Zellkörpern aller postganglionären Neuronen, in den Ganglien des vegetativen Nervensystems, sowohl den sympathischen, als auch den parasympathischen post-ganglionären Neuronen. Acetylcholin wird von präganglionären Neuronen freigesetzt und bindet an einen Nikotinrezeptor. Dadurch öffnen sich Kanalporen und Na+ und Ca2+-Ionen diffundieren über die Zellmembran in die Zelle. Der Einstrom dieser zwei Kationen führt zu einer Depolarisation und in weiterer Folge zur Erregung in den postganglionären Neuronen. Muskarinrezeptoren werden durch den Agonisten Muskarin erregt und befinden sich auf der Zellmembran des Effektorgewebes. Sie sind an G-Proteine und Second MessengerSysteme gebunden. Die Stimulation dieser Rezeptoren führt zu einer Aktivierung der GProteine und zur Bildung von intrazellulären chemischen Molekülen, sogenannte Second Messenger. Deren Funktion besteht darin, gewebespezifische biochemische Effekte in der Zelle hervorzurufen. Dadurch ändert sich die Aktivität der Zelle. Abhängig vom Gewebe, auf dem sie lokalisiert sind, haben Muskarinrezeptoren entweder eine hemmende oder erregende Wirkung. [24] Seite | 41 Wirkung und Inaktivierung des Acetylcholins Acetylcholin bewirkt über die Bindung an den nikotinischen Rezeptor entweder eine Erregung der nachfolgenden postganglionären Neuronen (in den Ganglien) oder eine Kontraktion der quergestreiften Muskulatur. Muskarinische Rezeptoren haben ein vielfältiges Wirkungsspektrum. Acetylcholin bewirkt über die Bindung an muskarinische Rezeptoren eine Steigerung der Magensaftsekretion (M1-Wirkung), eine Abnahme der Herzfrequenz (M2-Wirkung), eine Kontraktion der glatten Muskulatur von Darm, Bronchien und verschiedenen Drüsen (M3-Wirkung) und eine Dilatation der Blutgefäße über indirekte NO-Freisetzung aus den Endothelzellen. [24] Das Enzym Acetylcholinesterase hydrolisiert Acetylcholin in Acetat und Cholin. Cholin wird von den präsynaptischen Neuronen wieder aufgenommen, um bei der Synthese von neuen Acetylcholin-Molekülen wiederverwendet zu werden. [3,24] Adrenalin Abb. 15: Strukturformel: R-Adrenalin. [26] Da die Wirkung von Adrenalin systemisch ist, wird es auch als Hormon bezeichnet. Es wird während akuter Stresssituationen aus den Zellen des Nebennierenmarks freigesetzt. Dies geschieht durch nervale Impulse des Sympathikus. [23,27] Biosynthese des Adrenalins Adrenalin wird zum größten Teil in den chromaffinen Zellen des Nebennierenmarks und zu einem geringen Teil im Gehirn synthetisiert. Adrenalin wird aus der Aminosäure Tyrosin synthetisiert. Durch das Enzym Tyrosin-Hydrolase wird Tyrosin - im ersten Schritt der Adrenalinsynthese - zu L-Dihydroxyphenylalanin (L-Dopa) umgewandelt. Durch das im Zytosol liegende Enzym L-Aminosäure-Decarboxylase wird L-Dopa zu Dopamin decarboxyliert. Dopamin wird nun weiter durch das Enzym beta-Hydroxylase, das in Seite | 42 bestimmten Nervenendigungen und in den Zellen des Nebennierenmarks vorkommt, zu Noradrenalin umgewandelt. Durch Koppelung einer Methyl-Gruppe an Noradrenalin entsteht schlussendlich Adrenalin. Dieser Vorgang wird durch das Enzym N-Methyltransferase, welches vor allem im Nebennierenmark, aber auch im Gehirn zu finden ist, katalysiert. [23] Adrenerge Rezeptoren und Signaltransduktion Es gibt zwei verschiedene Typen von adrenergen Rezeptoren: α(alpha)- und β(beta)Rezeptoren. Beide Rezeptorarten weisen weitere Subtypen auf: α1-, α2-, β1-, β2- und β3Rezeptoren. All diese Rezeptoren sind des Weiteren an G-Proteine und Second MessengerSysteme gekoppelt. [24] Stoffwechselwirkungen Die Effekte des Adrenalins auf den Stoffwechsel werden vor allem durch die Stimulation der β2-Rezeptoren vermittelt und sind sehr vielfältig. Alle Effekte dienen jedoch ein und demselben Ziel, nämlich der Bereitstellung von Energiestoffen - in erster Linie Glukose. Deshalb führt der Glykogenabbau in Leber und Muskulatur und die zusätzlich stattfindende Glukoneogenese in der Leber zu einer erhöhten Konzentration von Glukose im Blut. Die Effekte des Adrenalins im Fettgewebe werden durch β3-Rezeptoren vermittelt und führen dazu, dass Fettsäuren freigesetzt werden. Des Weiteren führt die Aktivierung von α2Rezeptoren auf den B-Zellen des Pankreas zu einer Hemmung der Insulinfreisetzung. Wirkungen auf das Herz Die Effekte von Adrenalin auf das Herz werden über β1-Rezeptoren vermittelt und sind positiv chronotrop (frequenzsteigernd), bathmotrop (erregungssteigernd), dromotrop („die Erregungsleitung des Herzens beeinflussend“) und inotrop („die Kontraktionskraft des Herzens beeinflussend“). Wirkungen auf die Bronchialmuskulatur In den Bronchien bewirkt Adrenalin über die Aktivierung der β2-Rezeptoren eine Weitstellung der Bronchien. Adrenalin hat also eine stark bronchodilatatorische Wirkung. Seite | 43 Wirkungen auf die Blutgefäße Über eine Aktivierung von α1-Rezeptoren führt Adrenalin zu einer Vasokonstriktion, vor allem in der Haut und dem Splanchnikusgebiet (Darm). Über eine Aktivierung von β2Rezeptoren bewirkt Adrenalin in den Blutgefäßen eine Vasodilatation. Dadurch werden die betroffenen Organe, z.B. die Skelettmuskulatur, besser durchblutet und mit mehr Sauerstoff versorgt. Abbau des Adrenalins Mithilfe dreier Enzyme, der Catechol-O-Methyl-Transferase (COMT), der Monoaminoxidase (MAO) und der Aldehyd-Dehydrogenase wird Adrenalin metabolisch in inaktive Abbauprodukte umgewandelt. Das Endprodukt ist die 3-Methoxy-4-Hydroxy-Mandelsäure, auch Vanilinmandelsäure genannt, die mit dem Harn ausgeschieden wird. [23] Noradrenalin Abb. 16: Strukturformel: Noradrenalin. [29] Der primäre Mediator der sympathischen postganglionären Neurone ist Noradrenalin. Noradrenalin (NA) wird, wie Adrenalin und Dopamin, aus der Aminosäure Tyrosin synthetisiert. Die vielfältigen Wirkungen des Noradrenalins spiegeln sich in deren verschiedenen Rezeptoren wieder (α1-, α2- und β1-Rezeptoren). Noradrenalin führt über die Aktivierung von α2-Rezeptoren zu einer Hemmung der Insulinausschüttung. Des Weiteren bewirkt Noradrenalin an der glatten Muskulatur eine Vasokonstriktion. Auf die Bronchial-muskulatur hat Noradrenalin so gut wie keinen Einfluss. Noradrenalin kann von einem präsynaptischen Neuron aus dem synaptischen Spalt wieder aufgenommen und in Vesikeln gespeichert werden. Durch die mitochondriale Monoaminooxidase wird das wiederaufgenommene Noradrenalin abgebaut. Auch kann Noradrenalin von der Effektorzelle aufgenommen und durch die Enzyme Catechol-OMethyltransferase (COMT) und Monoaminooxidase (MAO) abgebaut werden. [23,27] Seite | 44 4. ARZNEIMITTEL MIT WIRKUNGEN AUF DAS VEGETATIVE NERVENSYSTEM 4.1 Parasympathomimetika Parasympathomimetika ahmen die Wirkung des Parasympathikus nach; als Botenstoff agiert dabei Acetylcholin. Parasympathomimetika können in zwei Gruppen eingeteilt werden: 1.) direkt wirkende Parasympathomimetika erregen Muskarin- oder Nikotinrezeptoren direkt und beinhalten folgende Untergruppen: a) Cholinester: Acetylcholin, Methacholin, Carbachol und Betanechol. b) natürlich vorkommenden Alkaloide: Pilocarpin, Muscarin, Arecolin und Nikotin. 2.) indirekt wirkende Parasympathomimetika inhibieren die Wirkung des Enzyms Acetylcholinesterase (AChE). Hier unterscheidet man: a) reversible PSM, wie: Neostigmin, Physostigmin und Edrophonium. b) irreversible PSM, wie: Echotiophat. 4.1.1 Acetylcholin (ACh) Da Acetylcholin nur sehr schlecht über die Magenschleimhaut resorbiert wird, ist es oral verabreicht, unwirksam. Die empfohlene Verabreichungsform ist parenteral/intravenös. Allerdings wird Acetylcholin im Blut sehr schnell durch das Enzym Acetylcholinesterase hydrolysiert und in seine Bestandteile - Essigsäure (bzw. Acetat) und Cholin - gespalten. Aufgrund dessen kommt ACh im klinischen Alltag kaum zu Anwendung. Es besitzt die Fähigkeit, sowohl die Nikotinrezeptoren auf allen autonomen Ganglien und den neuromuskulären Synapsen, als auch die Muskarinrezeptoren, die vor allem in den postganglionären, cholinergen Nervenendigungen sitzen, zu erregen. Seite | 45 Im nachfolgenden wird die Wirkung von Acetylcholin an den verschiedenen Organen genauer, an den dort vorhandenen Muskarinrezeptoren - erörtert. [30] Acetylcholin besitzt vier wesentliche Wirkungen auf das (1) Herz-Kreislauf-System; es führt zu: - einer Vasodilatation (der Gefäße), - einer Senkung der Herzfrequenz (negativ chronotrop), - einer Senkung der Leitungsgeschwindigkeit im AV-Knoten (negativ dromotrop), - einer Verringerung der Kontraktionskraft des Herzens (negativ inotrop). Im (2) Gastrointestinaltrakt bewirkt Acetylcholin eine Steigerung der Motiliät, sowie eine Entspannung der Schließmuskeln (Sphinkter). Im (3) Harntrakt stimuliert ACh den Musculus detrusor vesicae (Detrusormuskel) und entspannt den inneren Harnröhren-schließmuskel (Musculus urethralis), was zur Entleerung der Blase führt. Die Wirkungen von ACh auf den (4) Respirationstrakt beinhalten nicht nur eine Bronchokonstriktion, sondern auch eine Steigerung der tracheobronchialen Sekretion und Stimulation der Chemorezeptoren im Glomus caroticum und Glomus aorticum; beides parasympathische Paraganglien. Diese Effekte werden hauptsächlich über M3-Muskarinrezeptoren vermittelt. Am (5) Auge bewirkt Acetylcholin eine Verengung der Pupillen (Miosis, durch Kontraktion des Musculus sphincter pupillae) und verstärkt die Akkommodation (durch Kontraktion des Musculus ciliaris). Auf die (6) exokrinen Drüsen (Speichel-, Magen-, Bronchial-, Tränen- und Schweißdrüsen) wirkt ACh stimulierend. [30,31] 4.1.2 Synthetische Cholinester: Carbachol, Betanechol, Methacholin Als synthetische Derivate (von Cholin) haben diese Substanzen einige Vorteile, gegenüber dem Acetylcholin: Sie besitzen eine (a) längere Wirkungsdauer, sind sowohl (b) oral, als auch parenteral verabreicht, wirksam und (c) sind in ihrer Wirkung selektiver. [30] Seite | 46 Carbachol (Isopto-Carbachol®, Miostat®) Carbachol besitzt anstelle der Acetylgruppe (im ACh) eine Carbamoylgruppe, die es vor der Hydrolyse „schützt“. Dies ist auch der Grund, warum die Halbwertszeit von Carbachol wesentlich länger ist, als die von ACh (4-24 Stunden, je nach Verabreichungsform). Carbachol stimuliert auch nikotinische Acetylcholinrezeptoren, allerdings steht die muskarinerge Wirkung im Vordergrund. Anwendung findet Carbachol vor allem im Bereich der Ophthalmologie, zur Senkung des Augeninnendrucks beim Glaukom (topische, lokale Anwendung) und bei Augen-operationen, wo eine Verengung der Pupillen (Miosis) induziert ist. Dabei wird Carbachol als 0,01-3%ige Lösung ins Auge geträufelt. Bethanechol (Myocholine-Glenwood®) Bethanechol ist wie Carbachol ein quartäres Amin. Pharmakokinetik, Pharmakodynamik und klinische Indikationen sind dem Carbachol sehr ähnlich; jedoch stimuliert Bethanechol keine Nikotinrezeptoren und weißt daher weniger Nebenwirkungen als Carbachol auf. Bethanechol wirkt in erster Linie auf den Harn- und Verdauungstrakt. Es ist das Mittel der Wahl, zur der Behandlung des akuten postpartalen und postoperativen nicht obstruktiven Harnverhalts. Es bewirkt, über die Stimulation der Muskarin-rezeptoren, eine Kontraktion der Harnblase, sowie eine Entspannung des äußeren Schließmuskels (external sphincter muscle of urethra). Weiters regt es die Peristaltik der Harnröhre an. Auch im Gastrointestinaltrakt bewirkt Bethanechol eine Steigerung der Motiliät und Peristaltik des Darmes. Methacholin (Provokit®) Methacholin ist das β-Methyl-Analogon von Acetylcholin. Es ist als Pulver verfügbar und wird mit 0,9% Natriumchlorid verdünnt über einen Vernebler verabreicht. Genau wie Carbachol und Bethanechol ist Methacholin resistent gegenüber dem Enzym Acetylcholinesterase. Aufgrund dessen reichen schon sehr niedrige Dosen (intravenös verabreicht) aus, um ähnliche Effekte wie ACh zu erzielen. Methacholin wird inhalativ verabreicht, um bei PatientInnen, mit Verdacht auf ein Asthma bronchiale, die Diagnose einer bronchialen Hyperreaktivität festzustellen. Methacholintest/-prüfung: Methacholin bewirkt als direktes Parasympathomimetikum in der Lunge eine dosisabhängige Bronchokonstriktion. Diese Reaktion ist bei PatientInnen Seite | 47 mit Asthma bronchiale erheblich stärker ausgeprägt als beim lungengesunden PatientInnen. [31] 4.1.3 Alkaloide In der Gruppe der cholinergen Alkaloide unterscheidet man (1) jene Substanzen, die ihre Wirkung am Nikotinrezeptor entfalten (z.B. Nikotin und Lobelin) und (2) jene Substanzen, die ihre Wirkung am Muskarinrezeptor entfalten; dazu zählen Muscarin, Pilocarpin uvm. Die Wirkung der (direkt wirksamen) Alkaloide sollte am Beispiel von Pilocarpin veranschaulicht werden. [30] Pilocarpin (Normastigmin®, Betacarpin®, Fotil®) Pilocarpin ist ein tertiäres Amin und kann aufgrund dessen sehr leicht aus dem Magendarmtrakt resorbiert werden. Als tertiäres Amin überwindet Pilocarpin auch die Blut-Hirn-Schranke. Wie alle natürlichen Alkaloide, wird Pilocarpin unverändert über die Nieren ausgeschieden. [30,31] Klinische Anwendungen: Pilocarpin wird vor allem zur der Behandlung der Mundtrockenheit (Xerostomie) eingesetzt, die nach einer Bestrahlung im Kopf-Hals-Bereich und bei PatientInnen mit Sjögren-Syndrom vorkommen kann; dies führt zu einer Steigerung der Speichelsekretion. Wie Carbachol, kommt Pilocarpin in der Ophthalmologie zur Behandlung des Glaukoms und als miotisches Mittel zur Anwendung. Kontraindikationen und Nebenwirkungen: sind Folge der Erregung am Muskarinrezeptor Schwitzen, Durchfall, Bauchkrämpfe, Übelkeit, Erbrechen, Hypotonie, sowie Akkommodationsstörungen. Die wichtigsten Kontraindikationen für die Verwendung der Muskarinagonisten sind Asthma bronchiale, COPD, Obstruktionen im Harn- und Gastrointestinaltrakt, Bradykardie, Hypotonie und Hyperthyreose (Muskarin-Agonisten können bei PatientInnen mit Hyperthyreose ein Vorhofflimmern auslösen). Alle Nebenwirkungen, als auch gewünschten Wirkungen, lassen sich durch die intravenöse Gabe von Atropin (= Parasympatholytikum) aufheben. [31] Seite | 48 4.1.4 Indirekte Parasympathomimetika (AChE-Hemmstoffe) Indirekte Parasympathomimetika hemmen das Cholinesterase-Molekül. Durch den dadurch fehlenden Abbau von Acetylcholin im synaptischen Spalt, steigt dessen Konzentration am Rezeptor und der Einfluss des Parasympathikus nimmt zu/steigt. Man unterscheidet (a) reversible Hemmstoffe und (b) irreversible Hemmstoffe. Die wichtigsten Vertreter der reversiblen Hemmstoffe sind Physostigmin, Neostigmin und Pyridostigmin. [31] Physostigmin (Anticholium®) Physostigmin ist ein natürlich vorkommendes Alkaloid, aus den getrockneten, reifen Samen des Schlingenstrauchs (Physostigma venenosum). Die Früchte des Strauches wurden einst von Einheimischen in Westafrika dazu verwendet, die Schuld bzw. Unschuld eines Angeklagten zu beweisen; deshalb werden sie auch heute noch als Gottesurteilbohnen bezeichnet. Physostigmin wird aus dem Gastrointestinaltrakt, über die Haut und die Schleimhäute resorbiert. Parenteral verabreicht, wird Physostigmin innerhalb von 2-3 Stunden weitgehend durch das Enzym Plasmaesterase hydrolytisch aufgespalten; die renale Ausscheidung spielt lediglich eine untergeordnete Rolle. Klinische Anwendungen: Physostigmin kann zur Behandlung der Myasthenia gravis, dem Glaukom und bei Störungen der Magenmotilität eingesetzt werden. Aufgrund einer starken Hemmung der Herzfrequenz und der ausgeprägten Wirkung im Darmtrakt, ist die systemische Anwendung von Physostigmin als Parasympathomimetikum limitiert. Zumal es heutzutage wesentlich besser verträgliche Substanzen, wie zum Beispiel Neostigmin und Pyridostigmin gibt. Im klinischen Alltag von größter Relevanz ist der Einsatz von Physostigmin, zur der Behandlung zentraler Vergiftungen durch Cholinolytika (Atropin, Hyoscyamin, Scopolamin, Strychnin), Antidepressiva, Amphetamine und Benzodiazepinen. [31,32] Seite | 49 Neostigmin (Normastigmin®) Neostigmin ist ein quartäres Amin und deshalb nicht in der Lage, die Blut-Hirn Schranke zu überwinden - es existiert bei physiologischem pH-Wert als Kation. Wie Physostigmin und Pyridostigmin wird auch Neostigmin vom Enzym Acetylcholinesterase hydrolysiert. Neostigmin wird nur sehr schlecht aus dem Gastrointestinaltrakt resorbiert und daher ausschließlich parenteral verabreicht. Klinische Anwendungen: Neostigmin kommt zur Behandlung der Myasthenia gravis (um der Muskelschwäche entgegen zu wirken), dem isolierten paralytischen Ileus, bei postoperativem Harnverhalt und als Antidot von nicht-depolarisierenden Muskelrelaxantien zur Anwendung. Ebenso bei Vergiftungen mit kompetitiven ACh-RezeptorAntagonisten wie Curare. Pyridostigmin (Mestinon®) Pyridostigmin ist dem Neostigmin in Wirkungen, klinischen Indikationen und möglichen Nebenwirkungen sehr ähnlich. Allerdings ist Pyridostigmin, in Kombination mit Distigmin, das Mittel der Wahl zur Erhaltungstherapie/Dauertherapie bei PatientInnen mit Myasthenia gravis, da die Wirkung des Pyridostigmin langsamer eintritt, aber länger anhält, als die von Neostigmin. Edrophonium (Tensilon®, Enlon®) Edrophonium ist ein kurzwirksamer Cholinesterasehemmer, der sich ideal zur Diagnosestellung neuromuskulärer Erkrankungen, wie die Myasthenia gravis, eignet - der sogenannte Tensilon-Test. Dabei werden 2mg Edrophoniumchlorid schnell intravenös injiziert. Bleibt die erste Dosis ohne Wirkung, werden 45 Sekunden später zusätzliche 8mg verabreicht. Leidet der/die PatientIn an einer Myasthenia gravis, kommt es zu einer ca. fünf Minuten andauernden (Ver)besserung der Muskelschwäche; was besonders an den Augenlidern beobachtet werden kann. [31,32] Seite | 50 Irreversible Hemmstoffe (Phosphorsäureester) Die Phosphorsäureester vom Typ der Organophosphate, wie z.B. Echothiophat und Isoflurophat, binden an das aktive Zentrum der Cholinesterase und hemmen somit langandauernd bzw. irreversibel dessen Enzymwirkung. Allerdings besitzen diese Verbindungen keinen therapeutischen Nutzen. Weitere Organophosphate sind Parathion und Malathion, die aufgrund ihrer geringen Flüchtigkeit und Stabilität in wässrigen Lösungen als Insektizide eingesetzt werden. [31] 4.2 Parasympatholytika Als Parasympatholytika werden Substanzen bezeichnet, die an einen muskarinen Rezeptor binden, und diesen dadurch blockieren. Die periphere cholinerge Übertragung lässt sich zum einen durch Ganglienblocker in den Ganglien, durch nikotinische AcetylcholinRezeptor-Antagonisten (Muskelrelaxantien) an der motorischen Endplatte und durch Parasympatholytika (an den parasympathischen Nervenendigungen) hemmen/blockieren. Parasympatholytika lassen sich einteilen in (1) die natürlich vorkommenden Alkaloide Atropin und Scopolamin, (2) die halbsynthetischen Derivate dieser Alkaloide, welche sich von Atropin und Scopolamin in erster Linie durch ihre Disposition im Körper und ihre Wirkungsdauer unterscheiden und (3) die synthetischen Derivate der Alkaloide, deren Vertreter eine ausgeprägte Selektivität für bestimmte Muskarinrezeptor-Subtypen zeigen. Nennenswerte Vertreter der letztgenannten Gruppen sind Homatropin und Tropicamid, die beide eine kürzere Wirkdauer als Atropin aufweisen, sowie die quartären Amine, Methylscopolamin, Ipratropium und Tiotropium, welche die Blut-Hirn-Schranke nicht überwinden können. [31] Seite | 51 4.2.1 Atropin, Scopolamin, Ipratropium, Tiotropium Atropin Das natürlich vorkommende Alkaloid Atropin ist in zahlreichen Nachtschattengewächsen (Solanaceae), vor allem aber in der Tollkirsche (Atropa belladonna), dem Bilsenkraut (Hyoscyamus niger) und dem Stechapfel (Datura stramonium) enthalten. Während der Zeit des römischen Reiches und im Mittelalter wurde die Tollkirsche dazu verwendet, unliebsame Gegner mit dem giftigen Pflanzensaft zu töten. Namensgebung: Atropos, einer der drei Schicksalsgöttinnen in der griechischen Mythologie, hatte als Aufgabe, am Ende der Lebenszeit, den Lebensfaden zu durchtrennen. „Belladonna“ deshalb, da angeblich italienische Frauen die Tollkirsche dazu benutzen, ihre Pupillen zu erweitern, um dadurch attraktiver zu erscheinen. Atropin wird bei (meist versehentlicher oraler Aufnahme) vollständig aus dem Magendarmtrakt resorbiert und gleichmäßig im Körper verteilt. Als tertiäres Amin ist es Atropin möglich, die Blut-Hirn-Schranke zu überwinden. Atropin hat eine Halbwertszeit von ca. vier Stunden und wird über den Leberstoffwechsel eliminiert (ca. 50%); der Rest wird unverändert über die Nieren ausgeschieden. [31] Wirkung von Atropin auf die Organsysteme: Im (1) ZNS wirken niedrige Dosen von Atropin sedierend; hohe Dosen haben eher die gegenteilige Wirkung; sie führen zu starker Erregung, Agitiertheit und Halluzinationen. Am (2) Auge bewirkt Atropin eine Mydriasis (Weitstellung der Pupillen, durch Relaxation des Musculus sphincter pupillae), sowie durch Relaxation bzw. Schwächung/Lockerung des Musculus ciliaris eine Zyklopegie (Verlust der Fähigkeit zur Akkommodation). (3) Herz-Kreislauf-System: Atropin hemmt/blockiert die vagale parasympathische Stimulation, was zu einer Tachykardie und Vasokonstriktion führt. Im (4) Respirationstrakt bewirkt Atropin eine Bronchokonstriktion und führt zu einer Reduktion des Bronchialsekretes. Senkt im (5) GI-Trakt die Magenmotilität und Sekretion, relaxiert im (6) Urogenitaltrakt die glatte Muskulatur der Harnröhre (Urethra) und der Blasenwand (die Miktion wird dadurch verlangsamt) und unterdrückt an den (7) exokrinen Drüsen (speziell den Schweißdrüsen) deren Sekretion und Produktion. [30] Seite | 52 Klinische Anwendungen: Gemäß der „Advanced cardiac life support Guidelines (ALSGuidelines)“ ist Atropin das Mittel der Wahl zur Behandlung der symptomatischen Bradykardie. Bei pulsloser elektrischer Aktivität (PEA) und Asystolie, wird eine AtropinGabe nicht mehr empfohlen. [28] Bei der endotrachealen Intubation kann es durch Stimulation des Vagus zur Bradykardie und Hypotonie kommen; wird Atropin präoperativ verabreicht, verhindert dies eine Vagusstimulation. Ein weiteres Einsatzgebiet von Atropin ist bei Kopf-Hals-Operationen, wo eine verminderte/herabgesetzte Speichel-sekretion gewünscht wird. Atropin wird weiters als Gegengift (Antidot) bei Vergiftungen mit bestimmten Insektiziden und Nervenkampfstoffen (z.B. Sarin) eingesetzt. Scopolamin Scopolamin (auch Hyoscin) wird hauptsächlich aus dem Bilsenkraut (Hyoscyamus niger) gewonnen und unterscheidet sich von Atropin vor allem durch (a) eine kürzere Wirkdauer und (b) eine ausgeprägtere Dämpfung des ZNS. Aufgrund dieser Eigenschaften eignet sich Scopolamin sehr gut als Prämedikation vor Operationen und als Reisemedikament, das es eine starke antisekretorische und antiemetische Wirkung besitzt. Scopolamin beeinflusst nach Aufnahme im Körper Herzfrequenz und Blutdruck kaum, indiziert aber eine starke zentrale Wirkung, was eine tiefe Mydriasis zur Folge hat. In hohen Dosen (verabreicht), wirkt es zentral toxisch. Dieser Zustand ist lebensgefährlich und äußert sich vor allem durch Mundtrockenheit, Rubor (Hyperämie), Zyklopegie und Delir; Mittel der Wahl (als Antidot) ist eine umgehende Gabe von Physostigmin. Ipratropium (Atrovent®) Ipratropium wird zur Inhalationstherapie zur der Behandlung der COPD eingesetzt, da es eine Bronchodilatation hervorruft. Als Nasenspray verabreicht, bewirkt Ipratropium eine Linderung der Rhinorrhoe. Tiotropium (Spiriva®) Tiotropium(bromid) ist ein langwirkendes antimuskarines, anticholinerges Mittel zur Behandlung von Erkrankungen der Atemwege, wie z.B. der COPD oder des Asthma bronchiale und bewirkt eine Bronchodilatation (Bronchospasmolytikum). [31,32,33] Seite | 53 4.3 Sympathomimetika Sympathomimetika wirken stimulierend auf den Sympathikus; dazu zählen alle Substanzen, die α1-, α2-, β1-, β2- oder β3-Rezeptoren (Adrenorezeptoren, adrenerge Rezeptoren = GProtein-gekoppelte Rezeptoren) stimulieren/aktivieren. [27] Sympathomimetika können zum einen nach ihrem (1) molekularen Wirkmechanismus und (2) nach dem Spektrum von Rezeptoren, an denen sie angreifen, klassifiziert werden. Einige dieser Substanzen sind direkte Agonisten - Noradrenalin und Adrenalin - d.h. sie aktivieren einen Adrenorezeptor direkt. Substanzen, die die Konzentration der physiologischen Transmitter am synaptischen Spalt erhöhen, sind indirekte Agonisten. Ausschlaggebend für den klinischen Effekt aller Sympathomimetika, ist die Selektivität der jeweiligen (verabreichten) Substanz, für die Vielzahl an Rezeptorsubtypen. Nichtselektive adrenerge Agonisten wirken an den speziellen Adrenorezeptoren global im gesamten Körper und produzieren dadurch eine Vielzahl an systemischen Effekten (inklusive etwaiger Nebenwirkungen). [31] 4.3.1 Adrenalin Adrenalin (Suprarenin®) Adrenalin (Epinephrin) ist DER Prototyp aller adrenergen Substanzen und wird wie in Kapitel 3.4.2 beschrieben, in den chromaffinen Zellen des Nebennierenmarks (NNM) synthetisiert. Adrenalin wird im Gastrointestinaltrakt sehr schnell zerstört, konjugiert und in der Leber oxidiert. Daher sollte es nicht oral, sondern intramuskulär oder subkutan verabreicht werden. Eine intravenöse Injektion von Adrenalin ist nur unter bestimmten Indikationen und entsprechendem Monitoring zu empfehlen, da die Auswirkungen auf das HerzKreislauf-System durch das Wirkspektrum eklatant ausfallen können (z.B. Auslösen eines Vorhofflimmerns). Der Abbau erfolgt in der Leber; nur geringe Mengen an Adrenalin werden unverändert über den Urin ausgeschieden. [30,31] Seite | 54 Pharmakodynamik: Adrenalin ist ein direkt wirkender, adrenerger Agonist, der an allen αund β-Rezeptoren (α1, α2, β1 und β2) angreift. Klinische Anwendungen: Adrenalin ist ein hochpotentes (Herz)-Stimulans, das die Schlagkraft des Herzens und die Herzfrequenz über Erregung der β1-Rezeptoren erhöht und in charakteristischer Weise zu einer dosisabhängigen Erhöhung des systolischen Blutdrucks führt. Über die Aktivierung der α1- Rezeptoren, bewirkt Adrenalin ein Zusammenziehen der glatten Gefäßmuskulatur (=> Vasokonstriktion). [33] 4.3.2 α- und β1-Rezeptor-stimulierende Sympathomimetika Die wichtigsten Vertreter dieser Gruppe sind Phenylephrin, Etilefrin und Ephedrin, die therapeutisch vor allem wegen ihrer systemischen oder lokalen vasokonstriktorischen Wirkung eingesetzt werden. Dabei ist von geringerer Bedeutung, ob sie direkt oder indirekt wirken; jedoch sollte stets daran gedacht werden, dass bei der Verabreichung dieser Substanzen, neben der gewünschten Vasokonstriktion, vermittelt über α-Rezeptoren, es auch zu unerwünschten Wirkungen am Herzen, wie Tachykardie und Extrasystolie kommen kann (vermittelt über β1-Rezeptoren am Herzen). Phenylephrin (Neosynephrin®, Vibrocil®) Phenylephrin unterscheidet sich von Adrenalin - chemisch betrachtet - zum einen durch das Fehlen der 4-OH Gruppe und zum anderen durch seine längere Wirkdauer. Es bewirkt überwiegend eine lokale Vasokonstriktion, weshalb es therapeutisch zur Abschwellung der Schleimhäute bei Rhinitis oder Konjunktivitis eingesetzt werden kann. Im Bereich der Notfallmedizin, Anästhesie und Geburtshilfe kommt Phenylephrin auch als Vasopressor zum Einsatz. [31,32] Etilefrin (Effortil®) Etilefrin ist das N-Ethyl-Analogon des Phenylephrins. Es vermittelt seine Wirkung nicht nur über die Stimulation der α-, sondern auch über die der β-Rezeptoren. Wegen seiner systemisch vasokonstriktorischen Wirkung wird Etilefrin bei Hypotonie, orthostatischer Dysregulation und posturaler Hypotension eingesetzt. Über die Stimulation der β1Seite | 55 Rezeptoren am Herzen bewirkt Etilefrin eine Steigerung des Herzzeitvolumens und eine Blutdrucksteigerung. Es wird oral verabreicht fast vollständig resorbiert, besitzt eine relativ hohe Bioverfügbarkeit und ist gegenüber dem Abbau durch die hepatischen MAO relativ stabil. Aufgrund seiner phenolischen Hydroxylgruppe ist es Etilefrin nicht möglich, die BlutHirn-Schranke zu überwinden. Ephedrin Ephedrin ist ein Alkaloid vom Phenylethylamin-Typ und kommt in der Natur in Pflanzen der Gattung Ephedra vor. Ephedrin stimuliert α- und β-Rezeptoren (direkte Wirkung); darüber hinaus steigert es die Freisetzung von Noradrenalin aus den sympathischen Neuronen (indirekte Wirkung), weshalb es zu den gemischt wirkenden Sympathomimetika zählt. Klinische Anwendungen: Ephedrin stimuliert/erregt die Herzfrequenz, die Herzleistung und erhöht den peripheren Widerstand; infolgedessen kommt es zu einer Blutdruckerhöhung. Über die Erregung von β-Rezeptoren in der Lunge wird eine Bronchodilatation vermittelt. Ephedrin wirkt nicht nur peripher, sondern auch zentral, mit einer Halbwertszeit von 3-6 Stunden und wird weitgehend unverändert über den Urin ausgeschieden. Heutzutage wird Ephedrin meist nur noch in Mischpräparaten, wie in Broncholytika, Antitussiva, Grippemitteln und Venentherapeutika, verwendet. [31,33] 4.3.3 β-Rezeptor-stimulierende Sympathomimetika Isoprenalin (Isuprel®) Isoprenalin ist ein potenter, nicht-selektiver β-Rezeptor Agonist, mit nur einer sehr geringen Affinität für den α-Rezeptor. Intravenös verabreicht senkt Isoprenalin den peripheren Gefäßwiderstand, vor allem in der Skelettmuskulatur, aber auch in den Nierenund Mesenterialgefäßen. Es kommt zu einer Steigerung der Herzleistung (positiv inotrop und chronotrop); die Gabe von Isoprenalin kann aber auch kardiale Effekte wie Palpitationen, Sinustachykardie und Arrhythmien auslösen. Isoprenalin bewirkt eine Relaxation der glatten Muskulatur; dieser Effekt ist besonders in der glatten Muskulatur der Bronchien und des GI-Traktes sehr ausgeprägt. Um eine Broncho-konstriktion und die antigen-induzierte Freisetzung von Histamin und anderen Entzündungsmediatoren zu Seite | 56 verhindern bzw. zu lindern, wurde Isoprenalin früher häufig zur Behandlung des Asthma bronchiale eingesetzt; heutzutage existieren andere β2-Sympathomimetika, die ein besseres Wirkprofil bei geringeren Nebenwirkungen aufweisen. Parenteral oder als Aerosol verabreicht, wird Isoprenalin sehr schnell resorbiert und in der Leber verstoffwechselt. Klinische Anwendungen und Nebenwirkungen: Isoprenalin (i.v. verabreicht) kommt bei bradykarden Herzrhythmusstörungen (z.B. dem AV-Block), Asystolie und bei PatientInnen mit ventrikulärer Arrhythmie (Torsade-de-Pointes) zum Einsatz. Wie schon im Absatz zuvor beschrieben, kommen in der Behandlung des Asthma bronchiale mittlerweile andere β2Sympathomimetika zum Einsatz. Häufige Nebenwirkungen von Isoprenalin können sein: Palpitationen, Tachykardie, Kopfschmerzen, Flush. Insbesondere bei PatientInnen mit bekannter KHK, kann es zu vermehrtem Auftreten von Herzrhythmusstörungen und Herzischämien kommen. 4.3.4 β2-selektive Sympathomimetika Da (nichtselektive) β-Rezeptor-Agonisten, in der Behandlung des Asthma bronchiale oder der COPD eingesetzt, ebenso die β1-Rezeptoren am Herzen stimulieren (Nebenwirkungen!) und dadurch ein eher ungünstiges Wirkungsprofil aufweisen, wurden Substanzen entwickelt, die bevorzugt eine Affinität für β2-Rezeptoren aufweisen. Allerdings ist diese Selektivität nur relativ, nicht absolut, und bei hoher Konzentration der Substanz/des Medikaments geht sie vollständig verloren. Eine weitere Strategie, die die Nützlichkeit einiger β2-selektiven Agonisten in der Behandlung des Asthma bronchiale und der COPD erhöht hat, war die strukturelle Modifizierung dieser Substanzen, wodurch sich ihre Stoffwechselraten verringerten und ihre orale Bioverfügbarkeit, im Vergleich zu den Katecholaminen, stark verbesserte. Die Verabreichung von β2-Rezeptor Agonisten als Aerosol, führt in der Regel, meist innerhalb von wenigen Minuten, zum gewollten Therapieansprechen; allerdings gibt es einige Agonisten, wie z.B. Salmeterol, die einen verzögerten Wirkungseintritt haben. [31,32] Während eine subkutane Verabreichung auch prompt eine Bronchodilatation bewirkt, Seite | 57 kann das Maximum der Wirkintensität von oral verabreichten Substanzen dennoch mehrere Stunden verzögert sein. Wie schon mehrfach erwähnt, werden β2-Rezeptor Agonisten zur Behandlung des Asthma bronchiale und der COPD eingesetzt; es kommt zu einer Aktivierung der pulmonalen β2Rezeptoren, worauf sich die glatte Muskulatur in den Bronchien entspannt und der Atemwegswiderstand dadurch gesenkt wird. Obwohl diese Effekte, bei PatientInnen mit Asthma bronchiale, die Hauptwirkung dieser Medikamente zu sein scheint, deutet jedoch einiges darauf hin, dass β2-Rezeptor Agonisten auch die Freisetzung von Leukotrienen und Histamin aus den Mastzellen im Lungengewebe unterdrücken, die mukociliare Funktion erhöhen, die mikrovaskuläre Permeabilität verringern und möglicherweise auch das Enzym Phospholipase A2 hemmen. Diese zusätzlichen Wirkungen sind für den Krankheitsverlauf bzw. Therapieerfolg als durchaus positiv zu betrachten. [31,33] Orciprenalin (Alupent®) Orciprenalin, das chemische Isomer von Isoprenalin, besitzt genau wie Terbutalin und Fenoterol (die in den folgenden Absätzen noch genauer abgehandelt werden) an der dritten und fünften Position des Phenylrings eine Hydroxylgruppe. Folglich ist Orciprenalin resistent gegen die Methylierung durch das Enzym COMT und ein wesentlicher Anteil (40%) wird in aktiver Form (nach oraler Verabreichung) absorbiert. Die Ausscheidung erfolgt in erster Linie als Glucuronsäure-Konjugat. Nach inhalativer Verabreichung tritt die Wirkung innerhalb weniger Minuten ein. Orciprenalin wirkt stark broncholytisch und ist mittlerweile nur noch zur Behandlung des akuten Asthmaanfalls zugelassen (wobei hierfür ebenso effektivere Medikamente am Markt zu finden sind). Einige Einsatzgebiete können als OffLabel-Use genannt werden, wie bradykarde Herzrhythmusstörungen (zur Überbrückung einer endgültigen Schrittmacher-Therapie) oder als Antidot bei relativer oder absoluter Überdosierung mit Betablockern. [31] Seite | 58 Salbutamol (Sultanol®) Salbutamol ist ein (kurzwirksamer, „SABA“ = short-acting β2-agonist) selektiver β2Rezeptor Agonist, mit pharmakologischen Eigenschaften und therapeutischen Indikationen ähnlich dem Terbutalin. Im Regelfall wird Salbutamol inhalativ verabreicht und es kommt zu einem Wirkungseintritt innerhalb weniger Sekunden, mit einem Wirkungsmaximum nach ca. 15 Minuten und einer Wirkdauer von ca. drei bis vier Stunden. Salbutamol kann auch oral (Retardtabletten oder als Lösung) verabreicht werden, wenn ein verzögerter Wirkungseintritt gewollt ist. Salbutamol wird als Bronchospasmolytikum in der Therapie des Asthma bronchiale (Abb. 17), chronischer Bronchitis und der COPD eingesetzt. Oral verabreicht besitzt Salbutamol das Potential, frühzeitig auftretende Wehen zu hemmen. Die Nebenwirkungen und Kontraindikationen sind ähnlich denen aller β2-Rezeptor Agonisten (Schwitzen, Tremor, Palpitationen, Tachykardie, Kopfschmerzen, Schwindel); die kardiovaskulären Wirkungen sind jedoch deutlich schwächer ausgeprägt, als jene von z.B. Isoprenalin. Oral verabreicht besitzt Salbutamol das Potential, frühzeitig auftretende Wehen zu hemmen. [31,32] Abb. 17: Pathologie des Asthma bronchiale. [35] Seite | 59 Levosalbutamol Levosalbutamol ist das R-Enantiomer des Salbutamol und besitzt dasselbe/dieselbe(n) Behandlungsspektrum, Pharmakokinetik und pharmakodynamischen Eigenschaften. Salmeterol (Serevent®) und Formoterol (Foradil®, Oxis®) zählen zu den langwirksamen β2selektiven Sympathomimetika („LABA“ = long-acting β2-agonist). Aufgrund des langsamen Wirkeintritts sind sie nicht zur Akutbehandlung von Atemwegserkrankungen mit bronchialer Beteiligung geeignet. Terbutalin (Bricanyl®) Terbutalin ist ein schnell wirksames β2-selektives Sympathomimetikum („RABA“ = rapid acting β2-agonist). Es wird vor allem bei reversiblen Verengungen der Atemwege, wie dem Asthma bronchiale und der COPD eingesetzt. Die Verabreichung erfolgt im Regelfall per inhalationem, kann jedoch auch parenteral, als Notfallsmedikament, beim Status asthmaticus eingesetzt werden. Aufgrund seiner Wirkung auf die glatte Muskulatur des Uterus, kommt Terbutalin auch als Tokolytikum (Hemmung der Wehentätigkeit) in der Geburtshilfe zur Anwendung. Weitere schnell wirksame β2-seletive Sympathomimetika sind Fenoterol (Berotec®) und Reproterol (Bronchospasmin®).[31,32,33] 4.4 Sympatholytika Sympatholytika, oder auch Adrenolytika genannt, sind Substanzen, die die sympathischen/adrenergen Rezeptoren blockieren und so die Erregungsübertragung an den sympathischen Nervenenden auf die (sympathischen) Effektorzellen verhindern. Unterschieden werden α-Sympatholytika (α-Blocker), welche den α-Rezeptor blockieren und β-Sympatholytika (β-Blocker), welche den β-Rezeptor hemmen. Alle Wirkstoffe/ Substanzen haben einen sehr hohen Stellenwerte im klinischen Alltag und werden vor allem zur Behandlung von Herz-Kreislauf-Erkrankungen eingesetzt. [31] Seite | 60 Nahezu alle Substanzen dieser zugehörigen Gruppe sind kompetitive Antagonisten, d.h. sie binden an dieselbe Zielstruktur wie der entsprechende Agonist und verhindern dadurch dessen Bindung. Eine wichtige Ausnahme ist Phenoxybenzamin (Dibenzyran®), ein irreversibler Antagonist am α1- und α2-Rezeptor. 4.5 Sympatholytika - α-Rezeptor-blockierende Substanzen (α-Blocker) α-adrenerge Rezeptoren vermitteln viele wichtige Funktionen der endogenen Katecholamine, wie z.B. die über α1-Rezeptor-vermittelte Kontraktion der arteriellen, venösen und viszeralen glatten Muskulatur. α2-Rezeptoren unterdrücken die sympathische Leistung/den sympathischen Tonus (Adrenalin), erhöhen den Vagotonus, erleichtern die Blutplättchenaggregation, hemmen die Freisetzung von Noradrenalin und Acetylcholin (aus den Nervenendigungen) und regulieren metabolische Effekte. Zu diesen Effekten zählen unter anderem die Unterdrückung der Insulinsekretion und die Hemmung der Lipolyse. Auch α2-Rezeptoren vermitteln die Kontraktion einiger Arterien und Venen. α-Rezeptor Antagonisten bieten ein breites Spektrum an pharmakologischen Besonderheiten und sind chemisch betrachtet äußerst heterogen. Ihre Affinität(en) für α1und α2-Rezeptoren unterscheiden sich je Wirkstoff/Substanz deutlich. [31,32] 4.5.1 α1-Rezeptor Antagonisten Durch Blockade der α1-Rezeptoren, wird die von den endogenen Katecholaminen induzierte Vasokonstriktion gehemmt; dadurch sinkt der periphere Widerstand, was einen Blutdruckabfall zur Folge hat. Wie ausgeprägt dieser Effekt ist, hängt von der Aktivität des sympathischen Nervensystems ab, bezogen auf jenen Zeitpunkt, an dem der entsprechende Antagonist verabreicht wurde. Weiters können durch Blockade der α1Rezeptoren einige Symptome der gutartigen benignen Prostatahyperplasie (BPH) gelindert werden, wie z.B. dem Harnverhalt. Da die Prostata und die Gewebe des unteren Harntraktes einen hohen Anteil an α1-Rezeptoren aufweisen, kommt es bei einer Blockade zu einer α-Rezeptor-vermittelten Entspannung der glatten Muskulatur (in/um die Prostata und im Blasenhals); somit wird das Ausströmen des Urins wesentlich erleichtert. Das Seite | 61 Haupteinsatzgebiet im klinischen Alltag der α1-Rezeptor Antagonisten ist jedoch das HerzKreislauf-System. Prazosin (Minipress®) Prazosin ist der Prototyp aller α1-selektiven Antagonisten. Die Affinität zum α1-Rezeptor ist um das ca. 1000-fache gegenüber dem α2-adrenergen Rezeptor erhöht und besitzt ähnliche Potenzen zu den α1A-, α1B- und α1D-Subtypen. Prazosin und seine pharmakologischen Verwandten, Doxazosin (Supressin®) und Terazosin, werden vor allem zur Behandlung der arteriellen Hypertonie eingesetzt. Terazosin ebenso bei der BPH. Die Hauptwirkung von Prazosin resultiert aus einer Blockade der α1-Rezeptoren in den Arteriolen und Venen. Dies führt zur Verringerung des peripheren Widerstands und des venösen Rückstrom zum Herzen. Es verringert die kardiale Vorlast und bewirkt keine Erhöhung der Herzfrequenz. Prazosin wird nach oraler Verabreichung gut resorbiert, bei einer Bioverfügbarkeit von 50-70%. Die Plasmahalbwertszeit beträgt ca. 2-4 Stunden. Es ist fest an Plasmaproteine gebunden (nur ca. 5% zirkulieren frei im Blutkreislauf); Erkrankungen, bei denen es zu einer Veränderung der Plasmaproteine kommt (z.B. entzündliche Prozesse), können somit die freie Fraktion des Wirkstoffes verändern. Prazosin wird weitgehend in der Leber metabolisiert und nur geringe, unveränderte Mengen der Substanz werden über die Nieren ausgeschieden. Weiters wird Prazosin bei PatientInnen mit Raynaud-Syndrom (Abb. 18, Durchblutungsstörungen der Finger, durch auftretende Vasospasmen) und der BPH eingesetzt. [31,32,33] Abb. 18: Typische (weiße) Finger bei Raynaud-Syndrom. [36] Seite | 62 Terazosin (Uroflo®, Vicard®) Terazosin ist ein strukturelles Analogon zu Prazosin, besitzt jedoch eine höhere Spezifität für den α1-Rezeptor, auch wenn es weniger potent als Prazosin ist. Terazosin unterscheidet nicht zwischen den α1-Subtypen. Der wesentliche Unterscheid, zwischen Terazosin und Prazosin, besteht in ihren pharmakologischen Eigenschaften: Terazosin besitzt eine höhere Wasserlöslichkeit als Prazosin, was die Bioverfügbarkeit heraufsetzt (>90%). Die Wirkdauer beträgt in der Regel bis zu 18 Stunden. Folglich reicht es, wenn die Substanz von PatientInnen mit arterieller Hypertonie oder BPH einmal am Tag eingenommen wird. Ein interessanter Aspekt der Wirkung von Terazosin und Doxazosin in der Behandlung von Störungen der unteren Harnwege, bei Männern mit benigner Prostatahyperplasie, ist die Induktion zur Apoptose von glatten Muskelzellen der Prostata. Diese induzierte Apoptose kann die Symptome (durch Begrenzung der Zellproliferation) der chronischen BPH verringern. Nur ca. 10 % des Terazosins wird unverändert über den Urin ausgeschieden. Als Initialdosis wird 1mg empfohlen. Die Dosen werden langsam nach oben, in Abhängigkeit von der therapeutischen Reaktion, titriert. Alfuzosin (Uroxatral®) Alfuzosin ist ein Chinazolin-basierter α1-Rezeptor Antagonist und wird häufig bei der Behandlung der BPH eingesetzt; zur Behandlung der art. Hypertonie ist es nicht zugelassen. Alfuzosin besitzt eine Bioverfügbarkeit von ca. 60% und eine Halbwertszeit von 3-5 Stunden. Alfuzosin ist ein Substrat von CYP3A4, weshalb die gleichzeitige Einnahme von CPY3A4-Inhibitoren (wie z.B. Ketoconazol, Clarithromycin, Itraconazol, Ritonavir) kontraindiziert ist. Alfuzosin sollte bei PatientInnen mit einem Risiko für ein verlängertes QT-Syndrom (Long-QT-Syndrom) vermieden werden. Die empfohlene Dosis beträgt 10mg in Form einer Retardtablette. [31,32] Tamsulosin (Aglandin®, Alna®) Tamsulosin ist ein Benzolsulfonamid und ein α1-Rezeptor Antagonist mit einer gewissen Selektivität für α1A- und α1D-Rezeptoren. Diese Selektivität kann die Blockade von α1ARezeptoren in der Prostata begünstigen. Tamsulosin ist sehr wirksam in der Behandlung der BPH, mit nur geringen Auswirkungen auf den Blutdruck. Die Halbwertszeit beträgt ca. Seite | 63 5-10 Stunden und wird weitgehend durch CYP metabolisiert. In einer Übersichtsarbeit aus dem Jahr 2005, traten bei ca. 20% aller PatientInnen, denen eine höhere Dosis Tamsulosin verabreicht wurde, ungewollte Ejakulationen als Nebenwirkung auf. [34] Silodosin (Urorec®) Silodosin ist ein α1-Rezeptor Antagonist mit einer Selektivität für α1A-Rezeptoren. Es ist zur Behandlung der BPH zugelassen und hat nur geringe Auswirkungen auf den Blutdruck. Dennoch können Schwindel und orthostatische Hypotonie auftreten. Die häufigste Nebenwirkung von Silodosin ist allerdings eine retrograde Ejakulation (bei 28% aller Behandelten). Silodosin wird als Kapsel verabreicht, in Dosierungen von 4mg oder 8mg. 4.5.2 α2-Rezeptor Antagonisten α2-Rezeptoren spielen eine wichtige Rolle in der Regulation der Aktivität des sympathischen Nervensystems, sowohl peripher als auch zentral. Wie bereits erwähnt, hemmt die Aktivierung präsynaptischer α2-Rezeptoren die Freisetzung von Noradrenalin und anderen Co-Transmittern aus den peripheren Nervenenden. Eine Aktivierung der α2Rezeptoren im pontomedullären Bereich des ZNS hemmt die Sympathikusaktivität und führt zu einem Abfall des Blutdrucks; an diesen Rezeptoren greifen Substanzen wie z.B. Clonidin (Catapresan®) an. Yohimbin (Yocon-Glenwood®) Yohimbin ist ein sehr potenter α2-Rezeptor Antagonist. Es ist ein natürliches Indol-alkaloid, das in der Rinde des Yohimbe-Baumes und den Rauwolfiawurzeln vorkommt. Yohimbin überwindet rasch die Blut-Hirn-Schranke und bewirkt über zentrale Mechanismen eine Erhöhung des Blutdrucks und der Herzfrequenz; es verstärkt auch die motorische Aktivität und kann somit einen Tremor hervorrufen. Diese Wirkungen sind denen von Clonidin, einem α2-Agonisten, entgegengesetzt. Yohimbin antagonisiert auch die Wirkungen von Histamin (5-HT). Yohimbin wurde vor allem zur Behandlung der erektilen Dysfunktion eingesetzt; jedoch mittlerweile von Mitteln mit einem besseren Wirkungsprofil vom Markt verdrängt. [31,32] Seite | 64 4.5.3 Nicht-selektive α-Rezeptor Antagonisten Phenoxybenzamin (Dibenzyran®) und Phentolamin Phenoxybenzamin und Phentolamin zählen zu den nicht-selektiven α-Rezeptor Antagonisten. Phenoxybenzamin, eine Halogenalkanamin-Verbindung, ist ein irreversibler Antagonist; während Phentolamin, ein Imidazolin, ein kompetitiver Antagonist ist. Therapeutische Anwendungen: Phenoxybenzamin wird zur Behandlung des Phäochromozytoms eingesetzt. Phäochromozytome sind Tumore des Nebennierenmarks (oder der sympathischen Paraganglien), die hormonell sehr aktiv sind und große Mengen an Katecholaminen produzieren. Dies führt bei betroffenen PatientInnen meist zu einer schweren Hypertonie, die auch nur episodisch auftreten kann. In der Regel werden Phäochromozytome chirurgisch saniert; dabei bedarf es einer guten präoperativen Vorbereitung, unter anderem der Gabe von Phenoxybenzamin. Dadurch können die Episoden einer schweren Hypertonie und dabei miteinhergehenden Schädigungen (der Katecholamine, an den Endorganen) minimiert werden. Ein konservativer Ansatz ist, die Behandlung mit Phenoxybenzamin ca. 1-3 Wochen vor der Operation zu initiieren. Die Dosis wird jeden zweiten Tag erhöht, bis die gewünschte Wirkung auf den Blutdruck erreicht wird (unter Berücksichtigung der Nebenwirkungen/unerwünschten Wirkungen). Phenoxybenzamin kann auch bei PatientInnen mit einem inoperablen Phäochromozytom zur Langzeittherapie eingesetzt werden. [31,32] 4.5.4 Weitere α-Rezeptor Antagonisten Indoramin (Wydora®) Indoramin ist ein selektiver, kompetitiver α1-Rezeptor Antagonist. Es wird zur Behandlung des arteriellen Hypertonus, der BPH und bei Migräne eingesetzt. Als selektiver α1-Rezeptor Antagonist senkt Indoramin den Blutdruck, bei nur gering ausgeprägter tachykarder Wirkung. Es verringert auch die Häufigkeit von Raynoud-Attacken. Die Bioverfügbarkeit liegt bei nur ca. 30 % (mit erheblicher Variabilität, ausgeprägter First-Pass-Metabolismus). Nebenwirkungen von Indoramin können sein: Sedierung, trockener Mund und Versagen Seite | 65 der Ejakulation. Obwohl Indoramin ein sehr wirksames antihypertensives Mittel ist, besitzt es eine komplexe Pharmakokinetik, weshalb es sehr selten zur Anwendung kommt. Urapidil (Ebrantil®) Urapidil ist ein selektiver α1-Rezeptor Antagonist. Über die Blockade peripherer α1Rezeptoren bewirkt Urapidil eine Senkung des Blutdrucks; allerdings besitzt es auch eine ZNS Wirkung. Einsatzgebiete sind vor allem die Notfallmedizin/Anästhesiologie, zur Behandlung von hypertensiven Schwankungen, z.B. intraoperativ. 4.6 Sympatholytika - β-Rezeptor-blockierende Substanzen (β-Blocker) Raymond Perry Ahlquist, ein US-amerikanischer Pharmakologe, stellte im Jahr 1948 eine Hypothese auf, dass die Effekte der Katecholamine über zwei verschiedene Rezeptoren, nämlich α- und β-Rezeptoren vermittelt werden. Damit legte er den Grundstein, für die Synthese und pharmakologische Evolution von β-Rezeptor Antagonisten; kompetitive Antagonisten an β-adrenergen Rezeptoren, auch Beta-Blocker genannt, erlangten dadurch eine enorme klinische Aufmerksamkeit, zur Behandlung des Bluthochdrucks, ischämischer Herzerkrankungen, kongestivem Herzversagen und Herzrhythmusstörungen. Die erste derartige (selektive) Substanz war Dichloroisoprenalin (DCI), ein partieller Agonist am β1und β2-Rezeptor. Auch wenn DCI nie von klinischer Bedeutung war, führte diese „Vorläufer-Substanz“ zur Entwicklung des ersten klinisch relevanten Beta-Blockers, Propranolol. Die bedeutendsten therapeutischen Wirkungen aller β-Rezeptor Antagonisten beziehen sich auf das kardiovaskuläre System. Da Katecholamine eine positiv chronotrope und inotrope Wirkung zeigen, stellen sich β-Rezeptor Antagonisten genau dem entgegen, und führen zu einer Senkung der Herzfrequenz und Verringerung der Kontraktilität des Herzens. Sie wirken somit antihypertensiv, antiischämisch und weisen antiarrhythmische Eigenschaften auf. [31,32,33] Beta-Blocker binden selektiv an β-Adrenorezeptoren und bewirken einen kompetitiven und reversiblen Antagonismus jener Wirkungen, die über β-adrenerge Reize auf verschiedene Organe hervorgerufen werden. Die pharmakologischen Wirkungen können aus der Seite | 66 Kenntnis heraus, in welchen Organen die entsprechenden Rezeptoren vorhanden sind und der Aktivität des sympathischen Tonus erklärt werden. So haben Beta-Blocker relativ wenig Einfluss auf die Herzfrequenz und Kontraktilität des Herzens, wenn sich der/die PatientIn im Ruhezustand befindet; wird das sympathische Nervensystem aktiviert, z.B. durch körperliche Aktivität oder anderer Stressoren, erzielen Beta-Blocker ihren Effekt, und verlangsamen, wie schon weiter oben beschrieben, die Herzfrequenz und verringern die Kontraktilität. Klassifizierung der Beta-Blocker Beta-Blocker können grob eingeteilt werden in: - (a) nicht-selektive Beta-Blocker, welche eine kompetitive Blockade sowohl der β1als auch der β2-Rezeptoren bewirken und - (b) jene, die eine viel höhere Affinität für β1- als für β2-Rezeptoren besitzen und daher auch als selektive β1-Rezeptor Antagonisten bezeichnet werden. Diese Selektivität ist dosisabhängig und sinkt oder verschwindet, sobald höhere Dosen verabreicht werden. Da Beta-Blocker eine große strukturelle Ähnlichkeit zu β-Sympathomimetika besitzen, erklärt sich deren teilweise paradoxe Wirkung. So können einige Beta-Blocker eine geringfügige erregende (agonistische) Wirkung auf β-Rezeptoren hervorrufen, eine sogenannte intrinsische sympathomimetische Aktivität (ISA), welche meist unerwünscht ist. Einige Beta-Blocker besitzen zusätzlich eine gefäß-erweiternde (vasodilatierende) Wirkung, z.B. Carvedilol und Labetalol, über die Blockade des α1-Adrenorezeptors, weisen einen β2-adrenergen Rezeptoragonismus auf (Celiprolol) oder wirken über unabhängige Mechanismen, ohne Adrenorezeptorblockade (Bucindolol, Nebivolol). Zusätzlich werden Beta-Blocker in lipophile und hydrophile Substanzen unterteilt. [31] Lipophile Substanzen wie Metoprolol, Propranolol und Timolol werden schnell und vollständig aus dem Gastrointestinaltrakt resorbiert, unterliegen aber einem hohen FirstPass-Effekt, was ihre orale Bioverfügbarkeit auf ca. 10-30% einschränkt. Bei PatientInnen mit eingeschränkter Leberdurchblutung (z.B. ältere Menschen, kongestiver Herzinsuffizienz, Leberzirrhose) können diese Substanzen sehr leicht akkumulieren. Alle lipophilen Beta-Blocker besitzen eine kurze Eliminationshalbwertszeit (1-5 Stunden) und Seite | 67 können leicht die Blut-Hirn-Schranke überwinden, weshalb es auch zu zentralen Nebenwirkungen kommen kann. Hydrophile Substanzen, wie Atenolol und Esmolol, werden unvollständig aus dem Magen-Darm-Trakt resorbiert und unverändert oder als aktive Metaboliten über die Niere(n) ausgeschieden. Sie besitzen eine längere Halbwertszeit (6-24 Stunden, verlängert bei PatientInnen mit eingeschränkter Nierenfunktion), besitzen kaum Wechselwirkungen mit anderen Substanzen, die ebenfalls in der Leber verstoffwechselt werden und überwinden kaum/nicht die Blut-Hirn-Schranke. Wirkmechanismus Die genauen Wirkmechanismen sind vielfältig und noch nicht vollständig verstanden; im Vordergrund steht jedoch die Prävention der kardiotoxischen Effekte aller Katecholamine. Die folgenden Mechanismen werden ebenfalls in Betracht gezogen: - (a) Die antihypertensive Wirkung, im Zusammenhang mit einer Abnahme der Herzleistung, einer Hemmung der Freisetzung von Renin und der Produktion von Angiotensin2, einer Blockade von präsynaptischen α-Adrenorezeptoren, die die Freisetzung von Noradrenalin aus den sympathischen Nervenendigungen steigern und der Abnahme der zentralen vasomotorischen Aktivität. - (b) Die antiischämische Wirkung der Beta-Blocker beruht auf einer Senkung des myokardialen Sauerstoffbedarfs, durch Verringerung der Herzfrequenz, der Herzkontraktionsfähigkeit und des systolischen Blutdrucks. Mit Verringerung der Herzfrequenz, kommt es zu einer Verlängerung der Diastole und somit zu einer gesteigerten myokardialen Perfusion. - (c) Reduktion der Freisetzung von Renin, Angiotensin2 und der Aldosteronproduktion, durch Blockade der β1-Adrenozeptoren, auf den juxtaglomerulären Zellen der Niere(n). - (d) Durch die Verbesserung der linksventrikulären Struktur und Funktion, sowie einer Abnahme der ventrikulären Größe und Erhöhung der Ejektionsfraktion (EF). - (e) Die antiarrhythmische Wirkung resultiert aus den direkten elektrophysiologischen Wirkungen am Herzen, wie: Senkung der Herzfrequenz, verlangsamte Leitung und erhöhte Refraktärzeit am AV-Knoten, Verringerung des sympathischen Antriebs, Steigerung des Baroreflexes und Verhinderung einer Katecholamininduzierten Hypokaliämie. [31,32] Seite | 68 Weitere (mögliche) Mechanismen: Hemmung der kardialen Apoptose, die über eine Aktivierung der β-adrenergen Bahnen vermittelt wird, Hemmung der Thrombozytenaggregation, Reduktion der mechanischen Belastung, die auf Plaques wirkt, Verhinderung der Plaqueruptur, Resensibilisierung des β-adrenergen Stoffwechsels und Veränderungen in der myokardialen Genexpression. Weiters besitzen einige Beta-Blocker antioxidative Eigenschaften und hemmen die Proliferation vaskulärer, glatter Muskelzellen. Nebenwirkungen Im Allgemeinen werden Beta-Blocker gut vertragen. Es können jedoch schwerwiegende Nebenwirkung auftreten, insbesondere, wenn hohe Dosen verabreicht werden. - Kardiovaskuläre Nebenwirkungen: Beta-Blocker senken die Herzfrequenz, verlangsamen die Leitung am AV-Knoten und erhöhen dessen Refraktärzeit, was eine (kardiovaskulär relevante) Bradykardie auslösen kann. Vor allem bei PatientInnen mit beeinträchtigter Sinusknotenfunktion und AV-Leitungsstörungen (z.B. AV-Block) werden diese Effekte häufig beobachtet. Durch Blockade der vaskulären β2-Rezeptoren und einer unopponierten Stimulation vaskulärer αRezeptoren, senken Beta-Blocker die Gewebedurchblutung. Als Ergebnis, können Beta-Blocker kalte Extremitäten und Raynaud-Phänomene hervorrufen und die Symptome, bei PatientInnen mit schweren peripheren Gefäßerkrankungen, verschlimmern. - Metabolische Nebenwirkungen: Bei PatientInnen mit insulinabhängigem Typ-1Diabetes, können nicht-selektive Beta-Blocker Warnsymptome (wie Tremor, Tachykardie) einer Hypoglykämie verschleiern; daher sollte bei diesen PatientInnen nur selektive Beta-Blocker verordnet werden. - Pulmonale Nebenwirkungen: Beta-Blocker können zu einem lebensbedrohlichen Anstieg des Atemwegwiderstands führen, weshalb sie bei PatientInnen mit Asthma bronchiale oder chronisch obstruktiver Lungenerkrankung (COPD) kontrainduziert sind. - Zentrale Nebenwirkungen: wie Müdigkeit, Kopfschmerzen, Schlafstörungen, Schlaflosigkeit, Alpträume und Depressionen. - Sexuelle Dysfunktion: Bei einigen PatientInnen bewirken Beta-Blocker einen Verlust der Libido und/oder können zu Impotenz führen. [31,33] Seite | 69 Ein abruptes Absetzen von Beta-Blockern, nach einer Langzeitbehandlung, kann zu Rebound-Symptomen (Hypertonie, Arrhythmien, Verschlechterung einer bestehenden Angina pectoris) führen. Dies steht im direkten Zusammenhang mit der Hochregulierung βadrenerger Rezeptoren bei chronischer Medikamenteneinnahme. Kontraindikationen Absolute Kontraindikationen, die gegen eine Therapie mit Beta-Blockern sprechen, sind das Asthma bronchiale, eine symptomatische Hypotonie oder Bradykardie, sowie eine dekompensierte Herzinsuffizienz. 4.6.1 Nicht-selektive β-Blocker Propranolol (Inderal®) Propranolol ist DER Prototyp aller Beta-Blocker und wirkt sowohl auf β1- als auch auf β2Rezeptoren mit gleicher Affinität; es ist somit ein kompetitiver, nicht-selektiver β-Rezeptor Antagonist und blockiert keine α-Rezeptoren. Propranolol ist stark lipophil und wird fast vollständig, nach oraler Verabreichung, aus dem Magentarmtrakt resorbiert. Aufgrund eines hohen First-Pass-Effektes, erreichen nur rund 25% der oral verabreichten Substanz den systemischen Kreislauf. Darüber hinaus existieren große individuelle Unterschiede in der präsystemischen Clearance von Propranolol durch die Leber, was zu einer enormen Variabilität der Plasmakonzentration führen kann; dies erklärt den breitgefächerten Dosierungsbereich, von Propranolol, der individuell auf jeden PatientInnen eingestellt werden muss. [31,32,33] Abb. 19: Strukturformel: Propranolol (links), 3D-Darstellung der Strukturformel (rechts). [37,38] Seite | 70 Propranolol besitzt ein großes Verteilungsvolumen (4L/kg) und überwindet die Blut-HirnSchranke. Ungefähr 90% des Wirkstoffs sind im Blutkreislauf an Plasmaproteine gebunden. Die meisten Metaboliten werden über den Urin ausgeschieden. Propranolol wird ebenso wie andere Beta-Blocker eingesetzt, zur Behandlung der arteriellen Hypertonie (durch Reduktion der Reninproduktion), der Herzinsuffizienz und KHK, bei thyroetoxischen Krisen und bestimmten Angstzuständen. Weiters reduziert es die Häufigkeit von MigräneKopfschmerzen und kommt als Mittel der ersten Wahl beim essentiellen Tremor zum Einsatz. Nadolol (Corgard®) Nadolol ist ein langwirkender β-Rezeptor Antagonist, mit gleicher Affinität für β1- und β2Rezeptoren. Ein charakteristisches Merkmal von Nadolol ist seine relativ lange Halbwertszeit, von ca. 20 Stunden. Es ist sehr gut in Wasser löslich und wird nur unvollständig aus dem Darm resorbiert; seine Bioverfügbarkeit beträgt ungefähr 35%. Es wird in der Behandlung der arteriellen Hypertonie, Angina pectoris und Migräne eingesetzt. Timolol (Betimol®) Timolol ist ein potenter, nicht-selektiver β-Rezeptor-Antagonist. Es besitzt keine intrinsische sympathomimetische und membranstabilisierende Aktivität. Timolol wird gut aus dem Gastrointestinaltrakt resorbiert und weitgehend durch CYP2D6 in der Leber metabolisiert. Seine Plasmahalbwertszeit beträgt ca. 4 Stunden. Timolol wird zur Behandlung der arteriellen Hypertonie, der Herzinsuffizienz, dem akutem Myokardinfarkt und zur Migräne-Prophylaxe eingesetzt. In der Ophthalmologie kommt Timolol zur Behandlung von Offenwinkelglaukomen und der intraokularen Hypertonie zum Einsatz. Der genaue Wirkmechanismus in der Behandlung von Offenwinkelglaukomen ist nicht gänzlich bekannt; allerdings scheint Timolol durch die Blockade von β-Rezeptoren auf dem Ciliarepithel die Kammerwasserproduktion zu reduzieren und führt somit indirekt zu einer Senkung des Augeninnendrucks. Seite | 71 Pindolol (Visken®) Pindolol ist ein nicht-selektiver β-Rezeptor-Antagonist, mit intrinsischer sympathomimetischer Aktivität. Es besitzt eine niedrige membranstabilisierende Aktivität und geringe Fettlöslichkeit. Nach oraler Verabreichung wird Pindolol fast vollständig resorbiert, besitzt eine mäßig hohe Bioverfügbarkeit von ca. 50 %, bei einer Plasmahalbwertszeit von ca. 4 Stunden. Die Einsatzgebiete von Pindolol beschränken sich auf die arterielle Hypertonie, sowie die Angina pectoris. 4.6.2 β1-selektive-Rezeptor Antagonisten Metoprolol (Beloc®, Seloken®) Metoprolol zählt zu den β1-selektiven-Rezeptor Antagonisten und weist keine intrinsische sympathomimetische und membranstabilisierende Aktivität auf. Nach oraler Verabreichung wird Metoprolol fast vollständig resorbiert. Es unterliegt allerdings einem ausgeprägten First-Pass-Effekt, weshalb seine Bioverfügbarkeit mit 40% relativ gering ist. Metoprolol wird weitgehend durch das Enzym CYP2D6 in der Leber verstoffwechselt; die Ausscheidung erfolgt über den Urin. Die Halbwertszeit beträgt in der Regel zwischen 2-8 Stunden. Metoprolol kann in der Therapie des Bluthochdrucks, der KHK, bei Angina pectoris, bei bestimmten Herzrhythmusstörungen, der Herzinsuffizienz, in der Therapie und Prävention des Herzinfarktes, bei vasovagalen Synkopen, als Ergänzung bei der Behandlung einer Hyperthyreose und zur Migräne-Prophylaxe eingesetzt werden. Metoprolol darf u.a. nicht bei höhergradem AV-Block (2. oder 3. Grades), Bradykardie, Hypotonie, dekompensierter Herzinsuffizienz (NYHA IV) und bronchialer Hyperreagibilität angewendet werden. [31,32,33] Atenolol (Atenolan®) Atenolol ist ein sehr hydrophiler β1-selektiver Antagonist, der keine intrinsische sympathomimetische und membranstabilisierende Aktivität aufweist. Atenolol wird nur unvollständig resorbiert (ca. 50%) und weitgehend unverändert über den Urin ausgeschieden. Die Eliminationshalbwertszeit beträgt in etwa 5-8 Stunden. Da die Substanz bei PatientInnen mit/im Nierenversagen akkumulieren kann, sollte die Dosierung der Kreatinin-Clearance angepasst werden. Atenolol wird in der Behandlung der arteriellen Seite | 72 Hypertonie, Arrhythmien, Angina pectoris, akuten Myokardinfarkt, supra-ventrikulärer Tachykardie, chronischem Herzversagen, Hyperthyreose, Long-QT-Syndrom und bei Migränekopfschmerzen eingesetzt. Die Initialdosis von Atenolol z.B. in der Behandlung der Hypertonie liegt bei 50mg/d, einmal täglich verabreicht. Atenolol verursacht weniger ZNSNebenwirkungen (Depressionen, Alpträume) und weniger bronchospastische Reaktionen als die meisten gängigen Beta-Blocker (aufgrund seiner pharmakologischen und pharmakokinetischen Eigenschaften). Esmolol (Brevibloc®) Esmolol ist ein kompetitiver, kardioselektiver β1-selektiver-Rezeptor Antagonist, der eine einzigartige Struktur (Esterverbindung) aufweist; der Abbau erfolgt nicht organgebunden, sondern über Esterasen-Hydrolasen in den Erythrozyten. Aufgrund dieser Eigenschaften kommt es bei Verabreichung zu einem raschen Wirkungseintritt, bei nur sehr kurzer Wirkdauer; die Halbwertszeit beträgt nur ca. 8 Minuten. Esmolol kommt häufig in der Notfallmedizin und während Operationen zum Einsatz, um Tachykardien zu verhindern bzw. zu demaskieren und supraventrikuläre Tachykardien zu therapieren. [31,32] 4.6.3 Β-Rezeptor Antagonisten der 3. Generation Neben den klassischen nicht-selektiven und selektiv adrenergen β1-Rezptor Antagonisten, gibt es auch eine Reihe von Substanzen, der (neuen) 3. Generation, die zusätzliche kardiovaskuläre (vor allem gefäßerweiternde) Eigenschaften aufweisen. Diese Effekte sind auf eine Reihe von Mechanismen zurückzuführen, einschließlich der Blockade von α1adrenergen Rezeptoren (Labetalol, Carvedilol, Bevantolol, Nipradilol), einer gesteigerten Produktion von Stickstoffmonoxid (Celiprolol, Nebivolol, Carteolol), über β2-agonistische Eigenschaften, über Blockade von Kalziumkanälen und durch Öffnen von Kaliumkanälen. Labetalol Labetalol wirkt als Antagonist sowohl am α-Adrenorezeptor, als auch an β1- und β2Adrenorezeptoren; nach oraler Gabe besitzt Labetalol ein 3:1 Verhältnis zum Beta-AlphaAntagonismus, zugunsten der Beta-Rezeptoren. Labetalol wird vor allem zur Behandlung der arteriellen Hypertonie (in Tablettenform) und als i.v.-Medikation in der Notfallmedizin Seite | 73 eingesetzt, zur Behandlung hypertensiver Krisen; dabei werden wiederholt intravenös Boli zwischen 20-80mg verabreicht, bis es zu einem adäquaten Therapieansprechen kommt. Carvedilol (Dilatrend®) Carvedilol, wie Labetalol, wird als racemisches Gemisch verabreicht. Es blockiert ähnlich wie Labetalol β1-, β2- und α1-Rezeptoren, besitzt aber zusätzlich noch antioxidative und entzündungshemmende Eigenschaften. Es weist eine membranstabilisierende Aktivität auf, jedoch fehlt eine intrinsische sympathomimetische Aktivität. Die Isomere werden stereo-selektiv in der Leber metabolisiert, was bedeutet, dass sich die Eliminationshalbwertszeiten unterscheiden; im Durchschnitt zwischen 7-10 Stunden. Carvedilol reduziert nachweislich die Mortalität bei PatientInnen mit (chronischer) Herzinsuffizienz, wird aber primär zur Behandlung der arteriellen Hypertonie eingesetzt. In der Behandlung der chronischen Herzinsuffizient kommt Carvedilol meist in Kombinationspräparaten mit Diuretika und ACE-Hemmern vor. Nebivolol (Nomexor®) Nebivolol ist ein β1-selektiver Antagonist, mit gefäßerweiternden Eigenschaften, die jedoch nicht über die Blockade α-adrenerger Rezeptoren vermittelt werden. D-Nebivolol weist eine hochselektive β1-blockierende Wirkung auf, während das L-Isomer eine Vasodilatation hervorruft; auch Nebivolol ist ein racemisches Gemisch. Der gefäßerweiternden Wirkung liegt eine Erhöhung der endothelialen Freisetzung von Stickstoffmonoxid (NO), durch Nebivolol induziert, zugrunde. Es weist keine intrinsische sympathomimetische und membranstabilisierende Aktivität auf, ist lipophil und hat keinen Einfluss auf den Glucose- und Lipidstoffwechsel. Seine Halbwertszeit beträgt im Durchschnitt 10-12 Stunden. Nebivolol wird vor allem zur Behandlung der arteriellen Hypertonie und als Ergänzung zu Standardtherapien der leichten- bis mittelschweren Herzinsuffizienz, eingesetzt. [31,32,33] Seite | 74 5. CONCLUSIO Das menschliche Nervensystem ist sicherlich das komplexeste System im menschlichen Körper. Das menschliche Gehirn alleine enthält über 100 Milliarden Nervenzellen und jede Nervenzelle weist bis zu 100.000 Verbindungen mit anderen Nervenzellen auf. Dies bedeutet, dass ein Nervenimpuls - ein elektrochemisches Signal - zu oder vom Gehirn weg bis zu 1015 Routen verlaufen kann. Über das sympathische, parasympathische und enterische Nervensystem kontrolliert das vegetative Nervensystem fast alle Organsysteme des Organismus. Aus diesem Grund wurden zahlreiche Wirkstoffe entwickelt, die über verschiedene Angriffspunkte im Bereich des vegetativen Nervensystems bei unterschiedlichen Erkrankungen eingesetzt werden. Diese sind vielfältig und in dieser Diplomarbeit habe ich versucht, auf die wichtigsten Präparate/-gruppen einzugehen. Aufgrund dieser Vielfältigkeit, haben und werden diese Medikamente auch zukünftig eine wichtige Rolle im klinischen Alltag spielen. Seite | 75 6. LITERATURVERZEICHNIS [1] Herausgegeben von Karl-Maria Guth. William Shakespeare: König Heinrich VI. Erster, zweiter und dritter Teil. Berlin: Hofenberg; 2015. p.297. [11] Mumenthaler M, Mattle H. Kurzlehrbuch Neurologie. 1st ed. Stuttgart: Georg Thieme Verlag; 2006. p.3. [2] Trepel M. Neuroanatomie Struktur und Funktion. 4th ed. München: Elsevier GmbH; 2008. p.2-26, 156, 167, 318-320. [12] Juranek JK. Axonal transport of cytoskeleton and cytoskeleton regulatory cargo proteins in neurodegenerative disorders. OA Anatomy 2013;1(3):22. [3] Amerman E. Human Anatomy & Physiology. 1st ed. San Francisco, CA: Pearson; 2015. p.382-407. [13] Verkhratsky A, Butt A. Glial Neurobiology. West Sussex: John Wiley & Sons Ltd.; 2007. p.24-27, 127-128. [4] Snell R. Clinical neuroanatomy. 7th ed. Philadelphia: Lippincott Williams & Wilkins; 2010. p.18-114, 135, 420, 509-513, 663-677, 840-841. [14] MHR. The Nervous and Endocrine Systems. (cited 2016 Jun 05]. Available from URL: http://highered.mheducation.com/sites/dl/fr ee/0070960526/323541/mhriib_ch11.pdf. [5] Noback C, Strominger N, Demarest R, Ruggiero D. The Human Nervous System: Structure and Function. 6th ed. Totowas, NJ: Humana Press Inc.; 2005. p.7-42, 381, 387388. [15] Müller W, Frings S. Tier- und Humanphysiologie. 4th ed. Heidelberg: Springer Medizin Verlag; 2009. p.345-347. [6] Society for Neuroscience. Brain Facts: A primer on the brain and nervous system. 2012 [cited 2016 May 03]. Available from URL: http://www.brainfacts.org/~/media/Brainfact s/Article%20Multimedia/About%20Neuroscie nce/Brain%20Facts%20book.ashx. [17] Schmidt R, Schaible H. Neuro- und Sinnesphysiologie. 5th ed. Heidelberg: Springer Medizin Verlag; 2006. p.16, 134. [18] Bommas-Ebert U, Teubner P, Voß R. Kurzlehrbuch Anatomie und Embryologie. 2nd ed. Stuttgart: Georg Thieme Verlag; 2006. p.416. [7] Raven P, Johnson G. Biology. 6th ed. Boston, MA: McGraw-Hill: 2002. p.1224. [8] Lecturio. Rhombencephalon - Anatomie und Funktion des Rautenhirns. 2016 [cited 2016 Jun 02]. Available from URL: https://www.lecturio.de/magazin/rhombence phalon/. [9] What-when-how. Development of the Nervous System. 1999 [cited 2016 Jun 02]. Available from URL: http://what-whenhow.com/neuroscience/development-of-thenervous-system-gross-anatomy-of-the-brainpart-1/. [10] Schneider F, Fink G. Funktionelle MRT in Psychiatrie und Neurologie. 2nd ed. Heidelberg: Springer Medizin Verlag; 2007. p.12. [16] Klinke R, Pape H, Silbernagl S. Physiologie. 5th ed. Stuttgart: Georg Thieme Verlag; 2005. p.23. [19] Appell H, Voss C. Funktionelle Anatomie: Grundlagen sportlicher Leistung und Bewegung. 4th ed. Heidelberg: Springer Medizin Verlag; 2008. p.164. [20] Fairman Studios. [cited 2016 Jun 08]. Available from URL: http://www.fairmanstudios.com/wpcontent/uploads/2011/12/07_AutonomicNS.j pg. [21] Delank H, Gehlen W. Neurologie. 11th ed. Stuttgart: Georg Thieme Verlag; 2006. p.57. [22] Lövblad K, Schaller K, Vargas M. The Fornix and Limbic System. Seminars in ULTRASOUND CT and MRI 2014;35:459-473. Seite | 76 [23] Horn F, Moc I, Schneider N, Grillhösl C, Berghold S, Lindenmeier G. Biochemie des Menschen: Das Lehrbuch für das Medizinstudium. 3th ed. Stuttgart: Georg Thieme Verlag; 2005. p.360-364, 424-429. [31] Brunton L L, Chabner B, Knollmann B. Goodman and Gilman's The Pharmacological Basis of Therapeutics. 12th ed. New York City: McGraw Hill, 2011; 227-257, 279-325.) [32] Katzung B, Masters S, Trevor A. Basic and Clinical Pharmacology. 12th ed. New-York City: McGraw-Hill Education; 2012. p.98-168. [24] McCorry L. Physiology of the Autonomic Nervous System. American Journal of Pharmaceutical Education 2007;71(4)Article78. [33] Smith M. Pharmacology for nurses. 1st ed. Burlington, Massachusetts: Jones & Bartlett Learning; 2014. p.136-151. [25] Wikipedia. Struktur von Acetylcholin. [cited 2016 Jun 12]. Available from URL: https://de.wikipedia.org/wiki/Acetylcholin#/ media/File:Acetylcholin2.svg. [26] Wikipedia. Strukturformel des R-Adrenalins. [cited 2016 Jun 12]. Available from URL: https://de.wikipedia.org/wiki/Adrenalin#/me dia/File:Adrenalin_-_Adrenaline.svg. [27] Beubler E. Kompendium der Pharmakologie: Gebräuchliche Arzneimittel in der Praxis. 2nd ed. Wien: Springer Verlag; 2007. p.33-35. [28] Jasmeet S, Jerry P Nolan et al. European Resuscitation Council Guidelines for Resuscitation 2015 Section 3. Adult advanced life support. Resuscitation 2015;95:100-147. [29] Wikipedia. Strukturformel von Noradrenalin. [cited 2016 Jun 12]. Available from URL: https://de.wikipedia.org/wiki/Noradrenalin#/ media/File:Noradrenalin__Noradrenaline.svg. [30] The Carter Center. Lecture Notes For Health Science Students Pharmacology. [cited 2016 Jul 14]. Available from URL: https://www.cartercenter.org/resources/pdfs /health/ephti/library/lecture_notes/health_s cience_students/pharmacology.pdf. [34] Franklin C Lowe. Summary of Clinical Experiences With Tamsulosin for the Treatment of Benign Prostatic Hyperplasia. Rev Urol. 2005;7(suppl 4):S13-S21. [35] meds4all. Ventolin. [cited 2016 Jul 18]. Available from URL: http://www.meds4all.com/de/asthma/ventol in/wirkung/. [36] MedMedia. Raynaudsyndrom - manchmal mehr als nur weiße Finger. [cited 2016 Jul 18]. Available from URL: http://www.medmedia.at/aerztekrone/raynaudsyndrom-manchmal-mehr-alsnur-weise-finger/. [37] Wikipedia. Propranolol. [cited 2016 Jul 21]. Available from URL: https://en.wikipedia.org/wiki/Propranolol#/ media/File:Propranolol.svg. [38] Wikipedia. Propranolol. [cited 2016 Jul 21]. Available from URL: https://en.wikipedia.org/wiki/Propranolol#/ media/File:Propranolol_ball-andstick_model.png. Seite | 77