256 Der Kleine Infektiologe Acinetobacter spp
Werbung

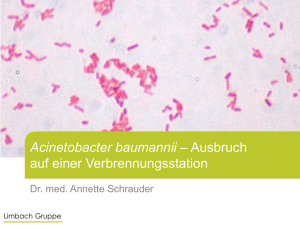
256 Acinetobacter spp. A c i n e t o ba c t e r I n f e k t i o n Abstract Zunehmend multiresistente Erreger opportunistischer Infektionen, mit typischem Auftreten als nosokomiale Erkrankung. BSL 2-3 Erreger. Fakten Erreger: Taxonomie: Reservoir: Übertragung: Inkubationszeit: Nachweis: Therapie: ICD-10: MeSH: Acinetobacter calcoaceticus-baumannii complex, primär A. baumannii (sp. 2; etwa 80-90%), selten A. genomic species 13TU, A. genomic species 3; sowie A. lwoffii (sp. 8/9), A. johnsonii (sp. 7), A. haemolyticus (sp.4), A. junii (sp. 5), A. radioresistens (sp.12), A. soli, A. bereziniae Abteilung Proteobacteria, Klasse Gammaproteobacteria, Ordnung Pseudomonadales, Familie Moraxellaceae, Genus Acinetobacter Ubiquitär (insb. in Erdboden, Wasser), kolonisierte / infizierte Personen; auch bei Insekten (Körperläusen) nachgewiesen Kontaktinfektion, Inokulation, aerogen, nosokomial, endogen; evtl. kontaminierte Nahrungsmittel unbekannt Kultur, PCR, Liquor-Diagnostik; Transformations-Assay, RNA Analyse Antibiose nach Sensibilitätstest B96.5 (Pseudomonas) D000150, D000151 Klinik Variable klinische Präsentation, vornehmlich als Infektion von Haut und Weichteilen (SSTI), Atemwegsinfektion (insb. HAP, VAP), sowie als ZNS-Infektion. Infektionen der Haut beginnen oft unspezifisch (z.B. mit „orangen-“ oder „sandpapier-“ artiger Darstellung), mit nachfolgender Entwicklung von Vesikeln, Bullae und Nekrose. Mögliche Komplikationen sind z.B. Pneumonie, HWI, Peritonitis, Cholangitis, Sepsis, ZNS-Infektionen (insb. als sekundäre Meningitis nach Schädel-Hirn-Trauma). Letalitätsrate bis zu 75% beschrieben (primär in Folge einer Grund- bzw. Vorerkrankung). Risikofaktoren: Immundefizienz, Unterbringung in Betreuungseinrichtungen, Hospitalisierung (insb. intensivmedizinische), Vorerkrankungen, invasive Prozeduren (z.B. Katheter, Nähte, Beatmung, Dialyse), vorherige Antibiose, Verlegung kolonisierter / infizierter Personen (innerhalb von Krankenhäusern, national, international), Trauma (u.a. Kriegsverletzungen, Brandwunden). Oft Auftreten als polymikrobielle Mischinfektion, z.B. mit Klebsiella, Candida, Enterococcus. Infektiosität: Überleben der Erreger in der Umwelt über etwa 21d (auch länger) beschrieben. Biofilmbildung auf Oberflächen wie Glas und Plastik möglich. Diagnostik Nachweis durch kulturelle Isolation, PCR, Liquor-Diagnostik. Speziesdifferenzierung z.B. durch DNA Transformationsassay, RNA Restriktionsanalyse (ARDRA), Amplified Fragment Length Polymoprphism (AFLP), DNA-DNA Hybridisierung, Ribotypisierung, MLST, PFGE, Massenspektrometire (TOF-MS) oder 16S rDNA Sequenzierung möglich. Gram-negative kokkoide Stäbchen (etwa 1.0-1.5x1.5-2.5µm), strikt aerob, non-motil, pleomorph, (fakultative) non-fermenter, Katalase-positiv, Oxidase-negativ. Cave: Nachweis von Kolonisierung statt Infektion (insb. bei Probennahme aus gewöhnlich nicht-sterilen Kompartimenten). Morphologische Verwechslung möglich (z.B. mit Haemophilus influenzae, Enterobacteriaceae), gram-positive Darstellung bei unvollständiger Entfärbung. Therapie Behandlung vorliegender Grunderkrankungen und strikte Einhaltung von Hygienemaßnahmen (insb. Hand-, Instrumenten- und Oberflächenhygiene). Kontaktisolation von infizierten und kolonisierten Personen. Antibiose nach Sensibilitätstest, auch in Kombination. Erfolgreiche Antibiose (Cave: Hochvariable Suszeptibilität) beschrieben, mit z.B. Carbapenemen (Imipenem, Meropenem), Ampicillin-Sulbactam (intrinsische Aktivität von Sulbactam auch ohne Der Kleine Infektiologe 257 Ampicillin), Cefepim, Amikacin, Tobramycin, Ceftazidim, Tigecyclin. Polymyxine (Colistin) sollten vornehmlich als Reservetherapie bei Multiesistenz eingesetzt werden. Der alleinige Nachweis einer Kolonisation ohne Krankheitssymptome ist keine Indikation zum Versuch einer Dekolonisation. Epidemiologie und spezifische Merkmale Viele Acinetobacter-Spezies sind als ubiquitäre Organismen mit weiter Verbreitung in der Umwelt beschrieben (z.B. Erdboden, Wasser; auf Obst und Gemüse) und können von trockenen und feuchten Oberflächen isoliert werden. Da sich die medizinische Literatur primär mit der Beschreibung im Rahmen von Ausbrüchen multiresistenter A. baumannii Stämme auf Intensivstationen beschäftigt, gibt es bisher keine verlässichen Daten zur tatsächlichen Verbreitung dieser Spezies in der Umwelt. Das Vorkommen vieler Acinetobacter Spezies als Umweltkeim sollte jedoch zur Aufmerksamkeit mahnen. Asymptomatische Kolonisation beschrieben von vornehmlich Haut (u.a. Axilla, Leiste, Zehen), Atemwegen, Schleimhäuten und Körperflüssigkeiten (z.B. Urogenitaltrakt, Liquor, Peritoneum), oft mit geringpathogenen Spezies wie A. lwoffii, A. johnsonii und / oder A. radioresistens. Bei nicht-hospitalisierten Personen wurde eine Kolonisationsrate von 43% beschrieben, bei hospitalisierten Patieten höher. In Westeuropa und den USA werden etwa 2-10% der nosokomialen Infektionen (insb. intensivmedizinisch) durch Acinetobacter verursacht. In Osteuropa, Südamerika, Afrika und Asien auch höher. Multi- und Panresistenz (MDR, XDR, PDR) beschrieben, z.B. gegen Cephalosporine, Penicilline, Carbapeneme, Chloramphenicol, TMP-SMX, Fluorchinolone, Aminoglykoside, Tigecyclin und Polymyxine. Ursache sind z.B. OXA (Oxacillinase like enzymes), AmpC (Class C Beta-Lactamases), MBL (Metallo Beta-Lactamases wie IMP, VIM, SIM), ADC (Acinetobacter-Derived Cephalosporinases) und Effluxpumpen (AdeABC). Acinetobacter gehört zur ESKAPE Gruppe resistenter Erreger und besitzt verschiedene Mechanismen Resistenzen aufzunehmen (z.B. als Transposons, Integrons, Insertionssequenzen). Im Genus Acinetobacter sind bisher mindestens 27 Spezies beschrieben. Historie Erste Isolation des Organismus durch den niederländischen Mikrobiologen Beijerinck im Jahr 1911 aus Erdboden und zunächst Bezeichnung als Micrococcus calcoaceticus. Nach Phänotypanalysen durch Baumann et al. im Jahr 1968, Klassifikation als Acinetobacter im Jahr 1971. Zuvor wurde der Acinetobacter-Komplex in mindestens 15 verschiedene Genera und Spezies eingeordnet. Der Name „Acinetobacter“ bezieht sich auf die non-Motilität der Organismen. Während A. baumannii bis Anfang der 1980er Jahre noch sensibel gegenüber gängigen Erstlinien-Antibiotika war, wurde nachfolgend ein zunehmendes Auftreten resistenter und multiresistenter Stämme beschrieben. Während des Irakkonfliktes 2003-2004 wurde A. baumannii als bedeutender Erreger von Haut- und Weichteilinfektionen bei US-Soldaten beschrieben. Der Kleine Infektiologe