aufbau und atome
Werbung

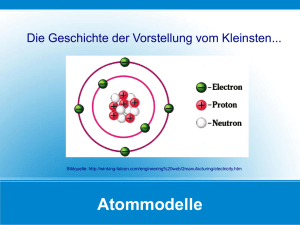
9 Aufbau und Atome AUFBAU UND ATOME In diesem Kapitel geht es um: ■ Elementarteilchen ■ die Masse von Atomen ■ die Elektronenhülle 123 9 9.1Elementarteilchen Sind Atome unteilbar? Atome sind keine starren Kugeln. Sie besitzen einen winzigen ■ Atomkern und eine ■ Atomhülle. Abb. 124.1 Ernest Rutherford Der Atomkern besteht aus Protonen und Neutronen, die Atomhülle aus Elektronen. Man nennt sie daher auch Elektronenhülle. In neutralen, d.h. nicht geladenen Atomen ist die Anzahl der Protonen und Elektronen gleich groß. Protonen, Neutronen und Elektronen nennt man auch Elementarteilchen. Atome bestehen aus Protonen, Neutronen und Elektronen. Abb. 124.2 Helium-Atom Die Masse der Elementarteilchen Die tatsächliche Masse der Elementarteilchen (ausgedrückt in Gramm) ist außerordentlich gering. Man verwendet daher eine eigene Einheit, die Atommasseneinheit u. Die Masse der Elementarteilchen wird dann relative Masse bezeichnet. Elementarteilchen Proton p+ Neutronn Elektrone Relative Masse Ladung 1u 1u 0,001 u +1 0 –1 Tab. 124.1 Protonen und Neutronen haben die relative Masse von etwa 1u. Elektronen haben praktisch keine Masse. Mit den folgenden Übungen zeigst du deine grundlegenden Kenntnisse über den Aufbau der Atome. Ü 9.1 Ergänze folgenden Text: Der Atomkern besteht aus ____________ und ____________. Er ist ____________ geladen. Die Atomhülle besteht aus ____________. Sie ist ____________ geladen. Ü 9.2 Was versteht man unter Elementarteilchen? Welche kennst du? Ü 9.3 Ein Atom des Elementes Gold besteht aus 79 Protonen, 118 Neutronen und 79 Elektronen. Berechne seine ungefähre relative Masse. Ü 9.4 Ein neutrales Natrium-Atom besitzt 11 Protonen. Wie groß ist die Anzahl der Elektronen? 1 R utherford, Ernest (1871-1937). Atomphysiker und Nobelpreisträger für Chemie entdeckte, dass ein Atom aus Atomkern und Elektronenhülle besteht. 124 Aufbau und Atome 9.2 Die Masse von Atomen Atome bestehen fast nur aus leerem Raum Wie wir heute wissen, ist der Durchmesser des Atomkerns ungefähr 1000bis 10 000-mal kleiner als das ganzen Atoms. Der Kern besteht aus Protonen und Neutronen. Elektronen besitzen praktisch keine Masse. Das heißt, dass die gesamte Masse eines Atoms im Kern konzentriert ist. Beinahe unglaublich ist, was daraus folgt: Ein Eisenwürfel von 10 m Kantenlänge hat eine Masse von etwa 8 000 t. Könnte man alle Atom-kerne der in diesem Block enthaltenen Eisenatome zusammenfassen, würden sie nur das Volumen eines Stecknadelkopfes besitzen, der allerdings fast die Gesamtmasse des Eisenblocks, also rund 8 000 t, hätte. Mit Ausnahme des Volumens eines Stecknadelkopfes besteht der Eisenblock somit nur aus leerem Raum! Ein Airbus A380 besitzt im Vergleich dazu beim Start (also einschließlich Treibstoff) eine Masse von rund 400 t. Ordnungszahl, Massenzahl Protonen sind positiv geladene Teilchen im Kern. Ihre Anzahl nennt man daher auch Kernladungszahl oder Ordnungszahl (OZ). Alle Atome eines Elementes haben dieselbe Protonenzahl und damit die-selbe Ordnungszahl. Protonen und Neutronen haben jeweils eine Masse von ungefähr 1 u, während Elektronen praktisch keine Masse haben (siehe Tabelle 118.1). Die Masse eines Atomkerns und damit des ganzen Atoms ist daher die Summe aus der Anzahl der Protonen und der Anzahl der Neutronen. Sie wird als Massenzahl (MZ) bezeichnet. Das Element Natrium enthält z.B. 11 Protonen und 12 Neutronen. Seine Massenzahl ist daher 11 + 12 = 23. Zur näheren Bezeichnung einzelner Atome wird die Massenzahl links oberhalb, die Ordnungszahl links unterhalb vor das betreffenden Elementsymbol geschrieben, z.B.: 1 235 1H 92U Da mit der Angabe des Elementsymbols auch die Protonenzahl gegeben ist, wird häufig nur die Massenzahl angeschrieben, z.B. U-235 bzw. U-238. Abb. 125.1 Alle Atomkerne von 20 Flugzeugen des Typs Airbus A380 hätten ungefähr ein Volumen von einem Stecknadelkopf und eine Masse von etwa 8 000 Abb. 125.2 Kern eines Natrium-Atoms mit 11 Protonen und 12 Neutronen Die Ordnungszahl ist die Anzahl der Protonen, die Massenzahl die Summe von Protonen und Neutronen. Schreibweise: MZ OZ Symbol Beispiel 9.1 Wie viele Protonen und Neutronen besitzt das Element F (F-19)? 19 9 Die Ordnungszahl ist 9. Das Element besitzt daher 9 Protonen. Die Massenzahl ist 19, daher sind im Kern 19 – 9 = 10 Neutronen vorhanden. Mit den folgenden Übungen kannst du grundlegende Begriffe des Atombaus wiedergeben. Ü 9.5 Was versteht man unter Ordnungszahl eines Atoms? Ü 9.6 Was versteht man unter Massenzahl eines Atoms? Ü 9.7Bestimme bei folgenden Atomen jeweils Ordnungszahl, Massenzahl, Anzahl der Protonen und Neutronen (verwende dazu auch das Periodensystem auf Seite xxx): 2 238 18 34 131 C-12 N-14 1H 92U 8O 16S 53I 125 9 Isotope sind Elemente mit derselben Protonenzahl und verschiedener Neutronenzahl. Sie besitzen daher auch eine unterschiedliche Masse. Isotope Viele Elemente besitzen verschiedene Arten von Atomen, die dieselbe Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen besitzen. Solche Atome eines Elementes nennt man Isotope. Vom Element Chlor kennt man z.B. die beiden Isotope: CI 3717CI 35 – 17 = 18 Neutronen 37 – 17 = 20 Neutronen Das in der Natur vorkommende Chlor setzt sich zu ungefähr 75 % aus Chlor-35 und zu 25 % aus Chlor-37 zusammen. Die durchschnittliche Masse eines Chlor-Atoms beträgt also 35,5 u. Diese durchschnittlichen Massen sind im Periodensystem bei den einzelnen Elementen angeführt. 35 17 35 · 75 + 37 · 25 = 35,5 100 Abb. 126.1 Henry Becquerel Abb. 126.2 Marie Curie Radioaktivität ist die Eigenschaft von Atomkernen, ohne äußere Einwirkung zu zerfallen. Sie geben dabei Energie in Form von Strah-lung ab (α-, β- und γ-Strahlung). Halbwertszeit ist die Zeit, in der die Hälfte der Atomkerne der An-fangsmenge zerfallen ist. Abb. 126.3 126 Die Isotope eines Elements besitzen gleiche chemische Eigenschaften. Sie können aber durchaus unterschiedliche physikalische Eigenschaften wie etwa verschieden lange Halbwertszeiten aufweisen. Radioaktivität Für jede Protonenzahl gibt es eine optimale Neutronenzahl, sodass ein stabiler Kern entsteht. Bei einem ungünstigen Verhältnis von Protonen und Neutronen wird der Kern instabil und zerfällt von selber, er ist radioaktiv. Die Radioaktivität wurde von Henri Becquerel1 im Jahr 1896 entdeckt: Während seiner Arbeit mit Uranverbindungen stellte er zufällig fest, dass diese unsichtbare Strahlen aussandten, die in der Lage waren, Papier zu durchdringen und Fotoplatten zu schwärzen. Aufbauend auf dieser Entdeckung gelang es Marie Curie2 und ihrem Mann Pierre Curie aus dem Mineral Pechblende zwei besonders stark strahlende Elemente zu isolieren. Zu Ehren von Marie Curies Heimatland Polen nannten sie das eine Element „Polonium“, das andere „Radium“ (das „Strahlende“), weil es mehr als hunderttausendfach stärker strahlte als das Uran. Blei mit der Ordnungszahl 82 ist das letzte Element mit stabilen Isoto-pen. Ab der Ordnungszahl 83 sind alle Elemente radioaktiv: die Anhäufung von positiven Ladungen macht den Kern instabil. Elemente mit einer Ordnungszahl unter 83 besitzen radioaktive Isotope („Radioisotope“). Bei den ausgesandten Strahlen unterscheidet man α-Strahlung, β-Strahlung und die γ-Strahlung3. Die γ-Strahlung ist ähnlich der Röntgenstrahlung, aber wesentlich energiereicher und daher gefährlicher. γ-Strahlung kann Materie durchdringen und in lebendem Gewebe großen Schaden anrichten. Unterschiedlich sind auch die Möglichkeiten zur Abschirmung der radioaktiven Strahlung. α-Teilchen werden bereits durch Papier, β-Teilchen durch Aluminiumblech abgehalten. Für die Abschirmung von γ-Strahlung ist eine mindestens 5 cm dicke Bleiplatte erforderlich. Ein Maß für die Abnahme der radioaktiven Strahlung ist die Halbwertszeit. Man versteht darunter jene Zeit, nach der nur mehr die Hälfte eines radioaktiven Stoffes vorhanden ist. Sie kann von Bruchteilen von Sekunden bis zu Milliarden von Jahren betragen. Durch die Reaktorkatastrophe in Fukushima im März 2011 ist u.a. das radioaktive Isotop Cs-137 in die Umwelt gelangt. Seine Halbwertszeit beträgt ungefähr 30 Jahre. Das heißt, im Jahr 2041 wird noch ca. die Hälfte, im Jahr 2071 ca. ¼ usw. des ausgetretenen Cäsiums in der Umwelt vorhanden sein. 1 Becquerel, Henri (1852–1908). Professor für Physik in Paris. 1903 Nobelpreis für Physik 2 Curie, Marie (1867–1934). Physikerin und Chemikerin. 1903 Nobelpreis für Physik, 1911 für Chemie 3 α (alpha), β (beta) und γ (gamma) sind die ersten drei Buchstaben des griechischen Alphabets Aufbau und Atome Mit den folgenden Übungen zeigst du deine grundlegenden Kenntnisse über Isotope. Ü 9.8 Was sind Isotope? Ü 9.9Es gibt drei verschiedene Silicium-Atome: 2814Si, 2914Si und 3014Si Wie viele Protonen und Neutronen besitzt jedes dieser Isotope? Ü 9.10Die wichtigsten Kupfer-Isotope sind Cu-63 und Cu-65. Ungefähr 70 % aller Kupfer-Atome sind Cu-63, 30 % Cu-65. Was ist die durchschnittliche Masse von Kupfer-Atomen? Ü 9.11In einem Labor hat man am heutigen Tag genau 80 mg vom Isotop Iod-131. Wann sind nur mehr 10 mg des Isotops vorhanden? (Die Halbwertszeit von Iod-131 beträgt 8 Tage.) 9.3Elektronenhülle Die negativen Ladungen der Elektronen in der Atomhülle gleichen die positiven Ladungen der Protonen im Kern aus. Bei ungeladenen (neutralen) Atomen ist die Anzahl von Protonen und Elektronen gleich groß. In einem Fluor-Atom sind z.B. 9 Protonen und 9 Elektronen, in einem Natrium-Atom 11 Protonen und 11 Elektronen enthalten. Fluor-Atom (9 p+/9 e–): F Abb. 127.1 Natrium-Atom (11 p+/11 e–): Na Neutrale Atome enthalten gleich viele Protonen und Elektronen. Kationen (positiv geladen) enthalten mehr Protonen als Elektronen. Anionen (negativ geladen) enthalten mehr Elektronen als Protonen. Abb. 127.2 In Ionen überwiegen entweder die Protonen oder die Elektronen. In Anionen (negativ geladen) sind mehr Elektronen als Protonen enthalten (z.B. Fluor-Anion F–). In Kationen (positiv geladen) sind mehr Protonen als Elektronen vorhanden (z.B. Natrium-Kation Na+). Fluorid-Anion (9 p+/10 e–): F– Natrium-Kation (11 p+/10 e–): Na+ Abb. 127.3 Abb. 127.4 Bohr’sches Atommodell (Schalenmodell) Die Atomhülle besteht aus Elektronen. Doch wie kann man sich die Verteilung der Elektronen in der Hülle vorstellen? Diese Frage beantwortet ein sehr einfaches Atommodell des dänischen Physikers Niels Bohr1. In diesem Bohr’schen Atommodell2 (Schalenmodell) besteht die Elektronenhülle aus sieben Schalen. Sie werden von innen nach außen mit den Buchstaben K bis Q bezeichnet. Die Elektronen bewegen sich auf diesen Schalen um den Atomkern, vergleichbar den Bewegungen der Planeten um die Sonne. Je weiter die Schale vom Kern entfernt ist, umso mehr Elektronen kann sie aufnehmen. Abb. 127.4 Niels Bohr 1 B ohr, Niels (1885–1962). Bohr war Schüler Rutherfords. Er erhielt 1922 den Nobelpreis für Physik für seine Verdienste um die Erforschung der Struktur der Atome und der von ihnen ausgehenden Strahlung 2 Dieses Modell erklärt einige Eigenschaften der Elemente sehr gut, manche Eigenschaften aber gar nicht. Andere – kompliziertere – Modelle können mehr erklären. 127 9 Schale K L M N Abb. 128.1 Elektronenanordnung von Natrium 2, 8, 1 Maximale Anzahl der Elektronen pro Schale 2 8 18 32 Tab. 128.1 Die einzelnen Schalen werden von innen nach außen mit Elektronen aufgefüllt. Das Element Fluor besitzt z.B. 9 Elektronen. Davon befinden sich 2 in der K-Schale und 7 in der L-Schale. Die Elektronenanordnung von Fluor ist daher 2, 7. Natrium besitzt 11 Elektronen. Von diesen sind 2 in der K-Schale, 8 in der LSchale und 1 in der M-Schale. Die Elektronenanordnung ist also 2, 8, 1. Mit den folgenden Übungen zeigst du deine grundlegenden Kenntnisse über Ionen und Atombau. Ü 9.12 Was sind „Ionen“? Welche Arten gibt es? Ü 9.13Gib von folgenden Atomen bzw. Ionen die Anzahl der Elektronen an (in der Klammer stehen die Ordnungszahlen): a) Si (14) b) Mg2+ (12) c) O2– (8) d) Li+ (3) e) Al (13) f) Sr (38) g) Sr2+ – + – – h) Hg (80) i) Cl (17) j) Al3 (13) k) Ag (47) l) Br (35) m) S2 (16) Ü 9.14 Was ist die Elektronenanordnung folgender Elemente (in der Klammer stehen die Ordnungszahlen)? a) Si (14) b) O (8) c) Al (13) d) Mg (12) e) S (16) f) He (2) g) H (1) Ü 9.15Es sind die Elektronenanordnungen einiger Elemente gegeben. Um welche Elemente handelt es sich (verwende dazu auch das Periodensystem): a) 2, 2 b) 2, 8, 5 c) 2, 8, 8 128 Periodensystem der Elemente PERIODENSYSTEM DER ELEMENTE In diesem Kapitel geht es um: ■ den Aufbau des Periodensystems ■ einige Elementfamilien ■ die Elektronenanordnung der Edelgase 10 129 10 10.1 Aufbau des Periodensystems Abb. 130.1 Bücher werden in einer Bibliothek nach Gruppen geordnet (z.B. Reisen, Abenteuer, Krimis, Sachbücher usw.) Alkalimetalle: Lithium (Li – OZ 3): Natrium (Na – OZ 11) Einteilung in Gruppen Die gesamte Materie ist nur aus etwa 100 verschiedenen Elementen aufgebaut. Um eine Übersicht über alle Elemente zu bekommen, ist es notwendig, sie zu ordnen. Man verwendet dazu ihre chemischen Eigenschaften. Elemente mit ähnlichen chemischen Eigenschaften werden wie Bücher in einer Bibliothek (Abb. 124.1) zu Gruppen („Elementfamilien“) zusammengefasst. So gibt es z.B. die Gruppen der Alkalimetalle, der Erdalkalimetalle, der Halogene, der Edelgase usw. Worauf beruht die Ähnlichkeit der Eigenschaften unter den Elementen einer Gruppe? Betrachten wir die Elektronenanordnung der Elemente Lithium und Natrium: es zeigt sich, dass beide Elemente jeweils ein Elektron in der äußersten Schale besitzen. Lithium hat ein Elektron in der L-Schale, Natrium ein Elektron in der M-Schale. 2, 1 2, 8, 1 Erdalkalimetalle Beryllium (Be – OZ 4) 2, 2 Magnesium (Mg – OZ 12)2, 8, 2 Halogene Fluor (F – OZ 9) Chlor (Cl – OZ 17) Abb. 130.2 2, 7 2, 8, 7 Elemente einer Gruppe besitzen dieselbe Anzahl von Elektronen in der äußersten Schale und haben daher ähnliche Eigenschaften. Abb. 130.3 Lithium und Natrium besitzen jeweils ein Elektron in der äußersten Schale Elemente der Gruppe der Erdalkalimetalle (z.B. Beryllium, Magnesium) besitzen zwei Elektronen in der äußersten Schale, Elemente der Gruppe der Halogene (z.B. Fluor, Chlor) sieben Elektronen in der äußersten Schale usw. Die Anzahl der Elektronen in der äußersten Schale ist also die Ursache für die ähnlichen Eigenschaften der Elemente einer Gruppe. Reihung der Elemente im Periodensystem Die bis heute beste Ordnung der Elemente ist das Periodensystem. Es stammt von den beiden Wissenschaftlern Lothar Meyer1 und Dimitrij Iwanowitsch Mendelejew2, die die Systematik der chemischen Elemente im Jahr 1869 völlig unabhängig voneinander erarbeitet haben. Die Elemente einer Gruppe werden untereinander und die einzelnen Gruppen nebeneinander geschrieben. Geht man von einem Element zum nächsten, steigt die Ordnungszahl an, es kommen jeweils ein Proton und damit ein Elektron dazu. Das Periodensystem besteht somit aus 7 waagrechten Zeilen (Perioden) und 18 senkrechten Spalten (Gruppen) – siehe Periodensystem auf Seite xxx. Lothar Meyer Abb. 130.4 Dimitrij Mendelejew 130 1 Meyer, Lothar Julius (1830–1895). Professor für Chemie und Physik in Eberswalde, 2 Mendelejew, Dimitrij Iwanowitsch (1834–1907). Dozent für Chemie in Petersburg Periodensystem der Elemente Abb. 131.2 Vereinfachter Aufbau des Periodensystems In Perioden stehen Elemente mit gleicher Anzahl von Schalen Betrachten wir die Elektronenanordnung der Elemente mit den Ordnungszahlen 1 bis 18 (siehe Tabelle125.1): Die erste (K-)Schale kann nur zwei Elektronen aufnehmen. Daher ist sie bereits beim Helium voll besetzt. In der ersten Periode stehen somit auch nur zwei Elemente, der Wasserstoff und das Helium. Beim Element Lithium mit der Ordnungszahl 3 wird das letzte hinzukommende Elektron in die L-Schale eingebaut. Beim Element Neon (Ordnungszahl 10) ist auch diese Schale voll besetzt, und das nächste Elektron kommt beim Element Natrium (Ordnungszahl 11) in die M-Schale, usw. Element Wasserstoff Helium Lithium Beryllium Bor Kohlenstoff Stickstoff Sauerstoff Fluor Neon Natrium Magnesium … Chlor Argon … OZ e– K L M 1 2 3 4 5 6 7 8 9 10 11 12 1 2 3 4 5 6 7 8 9 10 11 12 1 2 2 2 2 2 2 2 2 2 2 2 1 2 3 4 5 6 7 8 8 8 1 2 17 18 17 18 2 2 8 8 7 8 Mit jeder neuen Periode beginnt die Besetzung einer neuen Schale in der Elektronenhülle. Somit besitzen alle Elemente einer Periode dieselbe Anzahl von Schalen. Tab. 131.1 131 10 Das Periodensystem der Elemente beruht auf der Elektronenanordnung in den Atomen. Die 7 Perioden enthalten jeweils Elemente mit derselben Anzahl von Schalen. Die 18 Gruppen enthalten jeweils Elemente mit derselben Anzahl von Elektronen in der äußersten Schale. Abb. 132.1 Elemente einer Gruppen enthalten gleiche Anzahl von Außenelektronen Aus der Stellung eines Elementes im Periodensystem lässt sich dessen Elektronenanordnung ableiten: ■ Die Periodennummer gibt die Anzahl der Schalen an, ■ die Gruppennummer gibt die Anzahl der Außenelektronen an. Von ihr sind die Eigenschaften eines Elementes abhängig. Tabelle 125.2 gibt den Zusammenhang zwischen Gruppennummer und Anzahl der Elektronen in der äußersten Schale an. Ausnahmen ■ Helium besitzt nur zwei Außenelektronen, wird aber auf Grund seiner Eigenschaften zu den Edelgasen mit 8 Außenelektronen gezählt. ■ Wasserstoff besitzt wie die Alkalimetalle (Lithium, Natrium, Kalium usw.) nur ein Elektron in der äußersten Schale, hat aber völlig andere Eigenschaften. Wasserstoff wird daher separat angeschrieben und steht nicht in der 1. Gruppe. Metalle – Nichtmetalle Im Periodensystem stehen die Metalle auf der linken Seite, die Nichtmetalle auf der rechten Seite. Im Übergangsbereich befinden sich Elemente, die sowohl metallische als auch nichtmetallische Eigenschaften besitzen. Man nennt sie Halbmetalle. Gruppen Nr. Zahl der Außenelektronen 1 2 3 bis 12 13 bis 18 1 2 (meist) 2 3 bis 8 Tab. 132.1 Mit den folgenden Übungen zeigst du deine grundlegenden Kenntnisse über das Periodensystem In Abb. 125.2 sind die Buchstaben A bis H keine chemischen Symbole. Sie stehen für chemische Elemente und sie beziehen sich auf folgende Fragen: Ü 10.1 Welches dieser 8 Elemente hat die höchste Ordnungszahl? Ü 10.2 Bestimme die Elektronenanordnung des Elementes „D“. Ü 10.3 Welches dieser Elemente hat die größte Anzahl von Elektronen in der äußersten Schale? Ü 10.4 Welches dieser Elemente hat die größte Anzahl von Schalen? Ü 10.5 Welches dieser Elemente besitzt nur ein Elektron? Ü 10.6Suche im Periodensystem die chemischen Symbole der Elemente A bis H. Ü 10.7Gib von jedem Element die Anzahl seiner Schalen und die Elektro- Abb. 132.2 nen in der äußersten Schale an (verwende dazu die Tabelle 125.2). 132 Periodensystem der Elemente 10.2 Besondere Elementfamilien Gruppe 1 – Alkalimetalle Kleine Mengen von Lithium, Natrium und Kalium werden der Reihe nach in eine zu 2/3 mit Wasser gefüllte Glasschale gegeben. Die Alkalimetalle ragieren mit dem Wasser. Unter Bildung von Wasserstoff entstehen Laugen z.B.: Natrium + Wasser → Natronlauge und Wasserstoff. Die Reaktion wird von Lithium zu Kalium immer heftiger. Das Kalium schmilzt durch die Reaktionswärme und der gebildete Wasserstoff entzündet sich. Bringt man wässrige Lösungen von Verbindungen der Alkalimetalle (zB LiCl, NaCl, KCl) mit Hilfe eines Platindrahtes in die Flamme eines Bunsenbrenners, so zeigen sich charakteristische Flammenfärbungen: Lithium: rot, Natrium: intensiv gelb, Kalium: violett ■ Die Alkalimetalle bilden die 1. Gruppe im Periodensystem und besitzen 1 Elektron in der äußersten Schale. ■ Sie sind grau, weich und lassen sich mit dem Messer schneiden. An der Schnittfläche sind sie silberglänzend. ■ Alkalimetalle sind sehr reaktionsfähig. Bei der Reaktion mit Wasser entstehen eine Lauge und Wasserstoff (s. Experiment). Alkalimetalle dürfen daher nicht an der Luft gelagert werden. Sie werden in Petroleum aufbewahrt. ■ Verbindungen der Alkalimetalle können eine Flamme färben (s. Experiment). Abb. 133.2 Abb. 133.1 Alkalimetalle Natrium und Kalium (links: Natrium, rechts: Kalium) Flammenfärbung (Li-Na-K-Rb-Cs) Gruppe 2 – Erdalkalimetalle ■ Die Erdalkalimetalle bilden die 2. Gruppe im Periodensystem und besitzen 2 Außenelektronen. ■ Sie haben ähnliche Eigenschaften wie die Alkalimetalle, sind aber weniger reaktionsfähig. Sie können daher an der Luft gelagert werden. ■ Magnesium verbrennt mit einer grellen Flamme zu Magnesi-umoxid. ■ Verbindungen der Erdalkalimetalle können ebenfalls eine Flamme färben. Sie werden daher zur Herstellung von Feuerwerken verwendet. Abb. 133.3 Kein Feuerwerk ohne Alkali- und Erdalkalimetalle 133 10 Gruppen 3 bis 12 – Übergangselemente ■ Die Übergangselemente bilden die Gruppen 3 bis 12 im Periodensystem. Sie besitzen meist 2 Außenelektronen. ■ Alle Übergangselemente sind Metalle. Zu ihnen zählen z.B. die Elemente Eisen, Kupfer, Zink, Gold, Silber, Quecksilber (siehe Periodensystem auf Seite xxx) Abb. 134.1 Walt-Disney-Concert Hall in Los Angeles aus rostfreiem Stahl Abb. 134.2 Chlor wird zum Desinfizieren von Schwimmbädern verwendet. Abb. 134.3 Leuchtreklamen Abb. 134.4 134 Gruppe 17 – Halogene ■ Die Halogene bilden die 17. Gruppe im Periodensystem und besitzen 7 Außenelektronen. ■ Sie sind Nichtmetalle. ■ Sie sind sehr reaktionsfähig. Chlor reagiert z.B. mit Natrium zu Natriumchlorid (Kochsalz). ■ Chlor wird als Bleichmittel und Desinfektionsmittel (z.B. in Schwimmbädern) verwendet. ■ Verbindungen von Fluor sind in Zahnpasten enthalten um Karies vorzubeugen. ■ Chlor ist ein wichtiger Rohstoff. Es wird beispielsweise zur Herstellung von Salzsäure oder dem Kunststoff PVC benötigt. Gruppe 18 – Edelgase ■ Die Edelgase bilden die 18. Gruppe im Periodensystem. Sie besitzen mit Ausnahme von Helium 8 Elektronen in der äußersten Schale. ■ Sie sind farblose Gase, sind sehr reaktionsträge und nicht brennbar. ■ Sie kommen nur in geringer Menge in Form von Einzelatomen in der Luft vor. ■ Helium wird zum Füllen von Ballonen verwendet, weil es leichter als Luft und unbrennbar ist. ■ Edelgase werden für Leuchtreklamen, zum Füllen von Leuchtmitteln (z.B. Xenonlampen für Autoscheinwerfer) verwendet. Die Geschichte der Entdeckung der Edelgase 1785 hatte der englische Gelehrte Henry Cavendish gezeigt, dass Luft neben Stickstoff und Sauerstoff mindestens einen dritten Bestandteil enthalten müsse. Aber erst 1894, als schon die meisten natürlichen Elemente bekannt waren, gelang den beiden englischen Forschern Ramsay und Rayleigh die Isolierung des ersten Edelgases aus der Luft. 1892 war Lord Rayleigh aufgefallen, dass der aus Luft gewonnene Stickstoff eine größere Dichte besaß als der durch Zersetzung von Stickstoffverbindungen erzeugte. Ramsay zog daraus den richtigen Schluss, dass „Luftstickstoff“ noch ein anderes, unbekanntes Gas enthalten müsse. Er isolierte diese Substanz und nannte sie Argon (griech. „träge“). Die Suche nach weiteren Elementen mit ähnlichen Eigenschaften war schon bald erfolgreich. Ramsay wies nach, dass aus bestimmten Mineralien ein Gas entwich, das identisch war mit einer Substanz, die in der Sonne enthalten ist: Helium (griech. „Sonne“). Etwa zur selben Zeit wurde vom deutschen Ingenieur Carl von Linde ein Verfahren zur Verflüssigung von Luft entwickelt. Ramsay nützte dieses Verfahren, um Argon zu verflüssigen und fand bei dessen Trennung durch Destillation drei neue Edelgase, das Krypton (griech. „verborgen“), das Neon (griech. „neu“) und das Xenon (griech. „fremd“). Das radioaktive Radon konnte allerdings erst 1910 von Ramsay näher charakterisiert werden. Periodensystem der Elemente Mit den folgenden Übungen zeigst du deine grundlegenden Kenntnisse über das Periodensystem und einige besondere Elementfamilien. Ü 10.8 Warum besitzen Elementfamilien ähnliche Eigenschaften? Ü 10.9 Warum müssen die Alkalimetalle unter Petroleum aufbewahrt werden? Ü 10.10Welches Element ist reaktionsfähiger: Natrium oder Magnesium? Ü 10.11 Welche der folgenden Elemente sind Übergangselemente? Barium, Natrium, Eisen, Cobalt, Chlor, Mangan, Gold, Silber, Calcium, Kupfer, Aluminium, Zink, Wasserstoff, Krypton (verwende dazu das Periodensystem auf Seite xxx). Ü 10.12 Suche in deiner Umgebung nach Gegenständen, die aus Übergangselementen bestehen. Ü 10.13 Welcher Buchstabe A bis H steht in Abb. 127.3 für ein Alkalimetall, Erdalkalimetall, Übergangselement, Halogen bzw.Edelgas? Ü 10.14Verschiedenen Glühlampen enthalten Iod. Zu welcher Elementfa- Abb. 135.1 milie gehört das Element Iod und wie nennt man diese Art der Glühlampen? 10.3Elektronenanordnung der Edelgase Edelgaskonfiguration Edelgase besitzen ■ 8 Elektronen in der äußersten Schale (mit Ausnahme von Helium, das 2 besitzt) und sind daher ■ außerordentlich reaktionsträge. Diese besondere Anordnung von 8 Elektronen in der äußersten Schale nennt man auch Elektronenoktett oder Edelgaskonfiguration. Sie stellt eine ideale und besonders stabile Elektronenanordnung dar. Diese wird auch von allen anderen Elementen angestrebt. Atome können solche abgeschlossenen äußeren Schalen z.B. durch Aufnahme bzw. Abgabe von Elektronen erreichen. Jedes Element strebt nach einer Edelgaskonfiguration. Es erreicht diese durch Aufnahme oder Abgabe von Elektronen. Beispiel 10.1 Wie erreicht Mg (OZ = 12) ein stabiles Elektronenoktett? Mg hat 12 p+ und 12 e– (2, 8, 2). Durch Abgabe der beiden Elektronen in der M-Schale entsteht ein Elektronenoktett in der L-Schale. Jetzt besitzt Mg nur mehr 10 e–, und hat daher die Ladung 2+. 2+ Abgabe von 2e– MgMg 2, 8, 32, 8 135 10 Je näher ein Atom der Edelgaskonfiguration ist, umso leichter wird es Elektron(en) aufnehmen und Anionen bilden. Z.B.: Chlor steht in der 17. Gruppe und hat daher 7 Außenelektronen. Durch Aufnahme von einem Elektron erreicht es 8 Elektronen in der äußersten Schale. Dabei bildet sich ein Chlor-Anion (Cl–). Abb. 136.1 Ein Chlor-Atom nimmt ein Elektron auf und bildet ein Cl–-Ion. Je geringer die Anzahl der Außenelektronen ist, umso leichter wird das Atom Elektron(en) abgeben und Kationen bilden. Z.B.: Natrium steht in der 1. Gruppe und hat daher 1 Außenelektron. Durch Abgabe dieses Elektrons erreicht es 8 Elektronen in der äußersten Schale. Dabei bildet sich ein Natrium-Kation (Na+). Abb. 136.3 Bildung von Ionen Abb. 136.2 Ein Natrium-Atom gibt ein Elektron ab und bildet ein Na+-Ion. Mit den folgenden Übungen kannst du einen Zusammenhang herstellen zwischen dem Aufbau der Elektronenhülle und der Bildung von Ionen. Ü 10.15 Welche der folgenden Elemente geben Elektronen ab und bilden Kationen, welche nehmen Elektronen auf und bilden Anionen? Natrium, Fluor, Calcium, Chlor, Lithium, Brom, Magnesium Ü 10.16 Das Element Fluor besitzt die Ordnungszahl 9. a) Wie viele Protonen und Elektronen besitzt es? b) Wie sind die Elektronen auf die einzelnen Schalen verteilt? c) Wie kann ein Fluor-Atom ein Elektronenoktett erreichen? Wie ist es dann geladen? Ü 10.17 Das Element Kalium steht in der ersten Gruppe des Periodensystems. a) Wie viele Elektronen besitzt es in der äußersten Schale? b) Wie kann ein Kalium-Atom ein Elektronenoktett erreichen? Wie ist es dann geladen? Ü 10.18 Zeichne das Schalenmodell des Atoms Sauerstoff (OZ = 8). Wie erreicht es eine Edelgaskonfiguration? Ü 10.19 Welches Element der folgenden Paare wird leichter ein Elektron abgeben: Chlor oder Kalium; Aluminium oder Helium; Natrium oder Brom? Ü 10.20 Welches Element der folgenden Paare wird leichter ein Elektron aufnehmen: Iod oder Kalium; Sauerstoff oder Argon; Natrium oder Brom? 136 Periodensystem der Elemente Ü 10.21 Löse folgendes Kreuzworträtsel. (Alle Begriffe stammen aus den Kapiteln Atombau und Periodensystem.) WaagrechtSenkrecht 3. Übergangselement 1. positiv geladenes Ion 7. Wird zum Füllen von Ballons verwendet 2. Halogen 8. Befindet sich in der Atomhülle 3. Metall 10. Erstes Element der 13. Gruppe 4. Abkürzung für Periodensystem der Elemente 11. Element mit dem chem. Symbol Sn 5. chemisches Symbol für Aluminium 15. Atome mit der gleichen Ordnungszahl und verschiedener Massenzahl 6. Kernbaustein 9. Vorname von Meyer 18. Übergangselement 12. geladenes Teilchen 20. negativ geladenes Ion 13. Kernbaustein 23. Edelgas 14. chem. Symbol für Eisen 25. Halogen 16. Kunststoff, der aus Chlor hergestellt wird 27. kleinstes Teilchen eines Elements 17. Edelgas 28. senkrechte Spalte im Periodensystem 19. Alkalimetall 30. chem. Symbol für Argon 21. Vorname von Bohr 31. Nobelpreisträger für Physik 22. Abkürzung für Ordnungszahl 33. Halogen 24. Element mit dem chem. Zeichen Au 34. Abkürzung für Massenzahl 26. chem. Symbol von Quecksilber 36. Polnische Wissenschafterin 29. horizontale Zeile im Periodensystem 32. Entdecker des ersten Edelgases 35. chem. Symbol von Brom 137