Aufgabe 5
Werbung

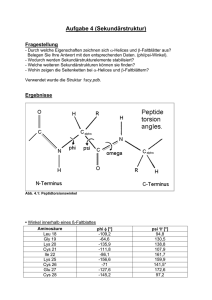
Aufgabe 5 (Supersekundärstruktur) Fragestellung Bei der Untereinheit des Arthropodenhämocyanins aus Limulus polyphemus werden folgende Fragestellungen untersucht: - Welche Supersekundärstrukturen gibt es in diesem Hämocyanin? - Was ist eine Domäne? Können Sie Domänen im Hämocyaninmolekül finden? - Wodurch wird die Tertiärstruktur stabilisiert? Weitere Fragen, die sich während der Bearbeitung ergaben: ÆWie sieht das aktive Zentrum aus? Wie werden die Kupferatome stabilisiert? ÆWelche Wechselwirkungen stabilisieren die Supersekundärstrukturen? Ergebnisse „Four α-Helix bundle“ (AS 1-180) Abb.5.1: „Four α-Helix bundle“ in Ribbon-Darstellung Hydrophobe AS in rot, polare in Blau. Die hydrophoben AS zeigen ins Innere. Abb.5.2: „Four α-Helix bundle“ in der Spacefill Darstellung Hydrophobe AS in rot, polare in blau. Auch hier erkennt man, dass die hydrophoben Bereiche im Innern liegen. Abb.5.3: „Four α-Helix bundle“ mit Spacefill-Darstellung im slab modus Hydrophobe AS in rot, polare in blau. Die hydrophoben AS füllen das Innere. Abb.5.4: Lokalisation des „Four α-Helix bundles“ „Four Helix bundle“ in blau, Rest der Untereinheit in rot, Cu-Atome in cyan. Das „Four Helix bundle“ liegt im äußeren Bereich der Hämocyanin-UE. Abb.5.5: „Four α-Helix bundle“ mit H-Brücken „Four α-Helix bundle“ in blau, H-Brücken in rot. es gibt nur H-Brücken zur Stabilisierung der einzelnen Helices, keine zusätzlichen H-Brücken zwischen den 4 Helices. „β-Barrel“ (AS 401-660) Abb.5.6: „β-Barrel“ mit Spacefill-Darstellung (links) und im Slab-Mode (rechts) Hydrophobe AS in grün, polare in orange, backbone in schwarz. Im Innern des β-Barrels sind vor allem hydrophobe AS. Abb.4.7: Lokalisation des „β-Barrels“ innerhalb der Hämocyanin-UE „β-Barrel“ in grün, Rest der Untereinheit in blau, Cu-Atome in rot. Das „β-Barrel“ befindet sich am Rand der Untereinheit. Abb.5.8: „β-Barrel“ in Ribbon-Darstellung mit H-Brücken Faltblätter in grün, H-Brücken in rot. Zwischen den Faltblättern gibt es sehr viele H-Brücken. aktives Zentrum (AS 181-400) Abb.5.9:Aktives Zentrum der Hämocyanin-UE α-Helices in blau, Histidin-Seitenketten in rot, Cu-Atome in grün. Das aktive Zentrum ist von mehren Helices umgeben. Abb.5.10: Aktives Zentrum in Detail Histidin-Reste in rot, Cu-Atome in grün. Jedes Kupfer-Atom wird von 3 Histidin-Resten stabilisiert. Abb.5.11: aktives Zentrum in Spacefill-Darstellung im Slab-Modus polare AS in blau, hydrophobe in rot, Cu-Atome in grün (links), rechts zusätzlich geladene AS in gelb. In unmittelbarer Nähe der Cu-Atome befinden sich vor allem polare AS, genauer: geladene AS. Auswertung / Diskussion In dieser Aufgabe sollte eine Hämocyanin-Untereinheit Supersekundärstrukturen bzw. Domänen untersucht werden. von Limulus auf Polypeptidketten, die aus mehr als 200 Resten bestehen falten sich gewöhnlich in 2 oder mehrere globuläre Einheiten, die man als Domänen bezeichnet. Die Domänen umfassen 100-200 Aminosäurereste und haben einen durchschnittlichen Durchmesser von ungefähr 2,5nm. Eine Domäne ist also eine strukturell unabhängige Einheit, welche Charakteristika kleiner globulärer Proteine aufweist. Die Domänenstruktur muss aber nicht offensichtlich sein, die Domänen können nämlich untereinander in so engem Kontakt stehen, dass das Protein als eine globuläre Einheit erscheint. Bei der Untersuchung der Hämocyanin-Untereinheit wurden 3 solcher Domänen entdeckt: ein „Four α-Helix bundle“, ein „β-Barrel“ und die Domäne um das aktiven Zentrums. „Four α-Helix bundle” (Domäne 1) Das „Four α-Helix bundle“ besteht, wie der Name schon vermuten lässt, aus vier Helices. Wie man in den Abb.5.1-5.3 deutlich sieht, ragen die hydrophoben Reste der vier Helices hauptsächlich zur Mitte des bundles während die polaren Aminosäurereste nach außen zeigen. Diese Struktur wird also durch hydrophobe WW sehr stark zusammengehalten und nicht – wie zunächst vermutet – durch HBrücken: Innerhalb des „Four α-Helix bundles“ treten nur die zur Stabilisierung der einzelnen Helices notwendigen H-Brücken auf. Zwischen den einzelnen Helices konnten keine zusätzlichen H-Brücken detektiert werden (vlg.Abb.5.5).Die Struktur des „Four α-Helix bundles“ kann als „Anker“ im Protein dienen an der weitere Strukturen befestigt sein können. Bei genauerer Betrachtung der Spacefill-Darstellung aus Abb.5.2+5.3 fällt auf, dass die hydrophoben Aminosäure nicht nur in der Mitte der Domäne sondern auch im äußeren Bereich zu finden sind. Dies liegt daran, dass das „Four α-Helix bundle“ kein separater Bereich ist, sondern mit dem restlichen Protein interagiert. Andere Regionen des äußeren Bereichs sind hingegen völlig polar. Hier liegt die Vermutung nahe, dass dieser Bereich die Außenseite der Proteinuntereinheit darstellt und an das wässrige Medium angrenzt, denn das Four Helix bundle liegt im äußeren Bereich der Hämocyanin-Untereinheit (vgl.Abb.5.4). Aktives Zentrum (Domäne 2) Das aktive Zentrum ist ebenfalls aus α-Helices aufgebaut. Die Helices umschließen die beiden Kupferatome, die durch je 3 Histidin-Seitenketten stabilisiert werden (Abb. 5.9 + 5.10). Die Aminosäuren in unmittelbarer Nachbarschaft zu den Kupferatomen sind polar bzw. geladen (vlg. Abb.5.11) Im äußeren Bereichs des aktiven Zentrums befinden sich jedoch vorwiegend hydrophobe AS (Abb. 5.11.). Die Helices stabilisieren sich also untereinander durch hydrophobe WW. Außerdem wirkt das Four Helix bundle, das an das aktive Zentrum angrenzt, zusätzlich stabilisierend. „β-Barrel“ (Domäne 3) Das „β-Barrel“ ist ebenfalls eine Domäne in diesem Protein da es -einzeln betrachtetannährend globuläre Struktur aufweist. Es ist nämlich nicht, wie der Name vermuten lässt hohl, sondern ausgefüllt (vgl. Abb. 5.6). Stabilisiert wird die Struktur hauptsächlich durch H-Brücken zwischen den β-strands, die fünf der sechs βstrands miteinander verbinden (Abb.5.8). Weiterhin spielen bei der Stabilisierung dieser Domäne auch die hydrophoben WW eine große Rolle: Wie in Abb. 5.6 zu sehen ist, befinden sich im Innern des β-Barrels vor allem hydrophobe Aminosäuren während man im äußeren Bereich polare Aminosäuren findet. Dies ist durchaus sinnvoll, da das β-Barrel im äußeren Bereich der Protein-Untereinheit lokalisiert ist und somit an das äußere wässrige Medium angrenzt. Allgemein lässt sich sagen, dass an der Ausbildung der Tertiärstruktur neben ionischen und hydrophoben WW auch Disulfidbrücken beteiligt sind. Solche Disulfidbrücken bilden sich zwischen den Seitenketten von Cysteinen aus. In dem hier untersuchten Protein findet man z.B. Disulfidbrücken zwischen dem Cys 536 und Cys 583 sowie zwischen Cys 534 und Cys 576. Diese Cysteine liegen alle innerhalb des β-Barrels.