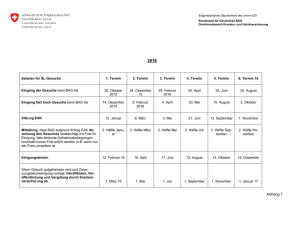
Aufnahme und Überprüfung von Medikamenten in der
Werbung

Aufnahme und Überprüfung von Medikamenten in der Spezialitätenliste Bericht der Geschäftsprüfungskommission des Ständerates vom 25. März 2014 2014-1537 7775 Das Wichtigste in Kürze Die schweizerische obligatorische Krankenpflegeversicherung vergütet nur Medikamente, die auf der sogenannten Spezialitätenliste aufgeführt sind. Die im Auftrag der beiden Geschäftsprüfungskommissionen der eidgenössischen Räte (GPK) erarbeitete Evaluation der parlamentarische Verwaltungskontrolle (PVK) befasst sich mit dem Verfahren zur Aufnahme und Überprüfung von Medikamenten in der Spezialitätenliste. Die GPK-S würdigt positiv, dass in den letzten Jahren verschiedene Massnahmen getroffen wurden oder sich zurzeit in Planung befinden, um das Verfahren zur Aufnahme und Überprüfung der Medikamente in der Spezialitätenliste zu verbessern, namentlich Preissenkungen im Rahmen der periodischen Überprüfungen, eine Aufstockung der Ressourcen der zuständigen Institutionen und die Beschleunigung des Aufnahmeverfahrens. Die Evaluation der PVK zeigt aber auch verschiedene Schwachstellen des Verfahrens und insbesondere des Systems der Preisfestsetzung auf. So macht die Evaluation deutlich, dass die Kriterien zur Aufnahme eines Medikaments in die Spezialitätenliste ungenügend und zu wenig präzis definiert sind. Namentlich erfolgt bei der Beurteilung keine ausreichende Kosten-Nutzen-Analyse der Medikamente. Die Mechanismen zur Preisfestsetzung der Medikamente – der therapeutische Quervergleich und der Auslandpreisvergleich – weisen ebenfalls systematische Schwächen auf. Nach Ansicht der GPK-S gewährleistet das aktuelle System nur ungenügend, dass mit einem höheren Medikamentenpreis auch ein entsprechend höherer Nutzen des Medikaments verbunden ist. Die Evaluation zeigt weiter, dass es in der Schweiz keine klare Trennung der einzelnen Verfahrensschritte in die international anerkannte Aufteilung «Medizinischtherapeutische Beurteilung» (Assessement), «Gesundheitspolitisch-gesellschaftliche Beurteilung» (Appraisal) und «Politische Entscheidung» (Decision) gibt und dass die Kompetenzen der beteiligten Institutionen – der Eidgenössischen Arzneimittelkommission (EAK) und dem Bundesamt für Gesundheit (BAG) zu wenig klar abgegrenzt sind. Zudem kann festgestellt werden, dass die Untersuchungsergebnisse nur unzureichend dokumentiert und kaum der Öffentlichkeit kommuniziert werden. Aus der Evaluation der PVK wird ebenfalls ersichtlich, dass die neu eingeführte periodische Überprüfung der Medikamente in der Spezialitätenliste aufgrund eingeschränkter Beurteilungskriterien und der knappen Ressourcenlage der zuständigen Sektion des BAG nicht geeignet ist, sicherzustellen, dass die Medikamente auch nach der Aufnahme in der Spezialitätenliste weiterhin die Aufnahmekriterien erfüllen. Vielmehr stellt die GPK-S fest, dass bestehende Medikamente trotz sinkendem Kosten-Nutzen-Verhältnis – etwa durch die Einführung wirksamerer Medikamente – nicht im Preis gesenkt oder von der Spezialitätenliste gestrichen werden. So erhalten die Arzneimittelhersteller mit der Aufnahme eines Medikaments faktisch eine unbefristete Garantie auf Abrechnung zulasten der obligatorischen Krankenpflegeversicherung. 7776 Auch bei den patentfreien Medikamenten zeigt die Evaluation deutlich, dass das aktuelle System nur unzureichend für kostengünstige Medikamente sorgt. Die GPK-S stellt fest, dass im Vergleich zum Ausland die schweizerische Preisfestsetzung von Generika zu höheren Preisen von Generika und Originalpräparaten führt und dadurch der Anteil der Generika am Gesamtumsatz des Medikamentenmarkts gering ausfällt. 7777 Bericht 1 Einleitung Damit ein Medikament von der obligatorischen Krankenpflegeversicherung (OKP) vergütet wird, muss es vom Schweizerischen Heilmittelinstitut Swissmedic zugelassen und vom Bundesamt für Gesundheit (BAG) in der Spezialitätenliste aufgenommen worden sein. Diese Liste zählt in einer abschliessenden Weise die Medikamente auf, welche durch die Krankenkassen übernommen werden müssen und nennt für jedes Medikament einen zu vergütenden Höchstbetrag. Das Verfahren zur Aufnahme und Überprüfung von Medikamenten in der Spezialitätenliste stand in den letzten Jahren oft in der Kritik. So wurde bemängelt, dass die der Entscheidung zugrunde liegenden Beurteilungskriterien unzureichend definiert und nur ungenügend geprüft werden oder dass die Medikamentenpreise in der Schweiz allgemein zu hoch seien.1 Die Kritik galt auch den im internationalen Vergleich hohen Generikapreisen in der Schweiz.2 Von Seiten der Arzneimittelhersteller kam verschiedentlich der Vorwurf, die Entscheide der Behörden seien nicht transparent und das Verfahren dauere zu lange. Die Kritik am Verfahren wiederspiegelt sich auch in den häufigen Anpassungen der gesetzlichen Bestimmungen auf Verordnungsebene, welche in den letzten Jahren im Medikamentenbereich vorgenommen wurden; etwa die Anpassung des Länderkorbs für den Auslandpreisvergleich oder die Einführung der periodischen Überprüfung der Medikamente in der Spezialitätenliste. Die Kritik und die vielen Massnahmen im Medikamentenbereich erklären sich auch durch die Bedeutung der Medikamentenausgaben in der Schweiz. Die Ausgaben für Medikamente stellen mit rund 20 % den drittgrössten Ausgabeposten der obligatorischen Krankenpflegeversicherung dar. Der reale Kostenanstieg betrug in den letzten zehn Jahren rund 14 %; das entspricht ungefähr dem Durchschnitt der allgemeinen Kostensteigerung im Gesundheitswesen.3 Vor diesem Hintergrund beschlossen die beiden Geschäftsprüfungskommissionen der eidgenössischen Räte (GPK) am 7. Januar 2012, die parlamentarische Verwaltungskontrolle (PVK) mit einer Evaluation der Aufnahme von Medikamenten in der Spezialitätenliste sowie deren Überprüfung auf der Liste zu beauftragen. Die zuständige Subkommission EDI/UVEK der Geschäftsprüfungskommission des Ständerates (GPK-S) entschied am 19. April 2012 auf der Grundlage der Vorschläge der PVK, dass sowohl herkömmliche wie auch komplementärmedizinische Medikamente und Generika untersucht werden und dass der Fokus auf das Verfahren der Preisfestsetzung gerichtet werden sollte. Die PVK hielt die Ergebnisse ihrer Untersuchung am 1 2 3 Vgl. etwa die parlamentarischen Vorstösse 08.3670 «Regelmässige Überprüfung der Arzneimittelpreise», 09.3088 «Medikamentenpreise. Massnahmen im Preisbildungsprozess», 09.3539 «Senkung der Medikamentenpreise», 12.3342 «Neufestsetzung der Medikamentenpreise», 12.3396 «Anpassung im Preisbildungssystem für Medikamente» und 12.3614 «Medikamentenpreise. Neue Methode für die Preisfestsetzung». Vgl. etwa Bericht des Preisüberwachers vom August 2013 «Schweizer Medikamentenmarkt im internationalen Vergleich – Handlungsbedarf im patentfreien Bereich»; Bericht von Obsan vom Oktober 2013 «Influence des génériques sur le marché des médicaments». Protokoll der Anhörung von Vertretern des BAG durch die GPK vom 4.11.2013. 7778 13. Juni 2013 im Bericht «Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung» (siehe Anhang) fest. Der vorliegende Bericht der GPK-S stützt sich auf die Evaluation der PVK und auf Anhörungen der Subkommission mit Vertretern des BAG und der Preisüberwachung.4 Die GPK-S versteht ihren Bericht als Ergänzung zum Bericht der PVK und beschränkt sich im Folgenden auf die Darstellung der wichtigsten Schlussfolgerungen und ihrer Empfehlungen. 2 Mängel im Aufnahmeverfahren und bei der Aufgabeteilung 2.1 Das Aufnahmeverfahren im Überblick Voraussetzung für die Aufnahme eines Medikaments in der Spezialitätenliste ist, dass es von Swissmedic für den schweizerischen Markt zugelassen worden ist.5 Sobald der Zulassungsentscheid von Swissmedic oder zumindest ein Vorbescheid vorliegt, kann der Arzneimittelhersteller oder Importeur eine Aufnahme eines Medikamentes in der Spezialitätenliste beantragen. Zusammenfassend kann festgehalten werden, dass das Bundesamt für Gesundheit (BAG) die Aufnahme von Medikamenten in der Spezialitätenliste nach Anhörung der Eidgenössischen Arzneimittelkommission (EAK) beschliesst.6 Im ordentlichen oder beschleunigten Verfahren leitet das BAG das Aufnahmegesuch an die EAK weiter, welche das Gesuch anhand der gesetzlich vorgesehenen Kriterien Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit (WZW-Kriterien) begutachtet und eine Empfehlung an das BAG abgibt. Im einfachen Verfahren, das namentlich bei der Aufnahme von Generika zur Anwendung gelangt, ist ein Beizug der EAK nicht vorgesehen. In Kenntnis der Empfehlung der EAK beurteilt das BAG danach seinerseits die Erfüllung der WZW-Kriterien, wobei es insbesondere die Wirtschaftlichkeit beurteilt und einen Höchstpreis festlegt. Gelangt das BAG zum Entscheid, dass die WZW-Kriterien erfüllt sind, erlässt es eine Verfügung zur Aufnahme des Medikaments. Wenn das BAG zum Schluss kommt, dass der Preis zu hoch angesetzt ist oder die weiteren WZW-Kriterien nicht erfüllt sind, weist es das Gesuch für eine Überarbeitung an den Gesuchsteller zurück.7 Das BAG kann die Aufnahme auch mit Auflagen verbinden oder zeitlich befristen. Im Falle einer Erweiterung der Indikation oder einer Änderung der Limitation eines Medikaments überprüft das BAG erneut, ob das Medikament die WZW-Kriterien erfüllt. 4 5 6 7 Siehe Beilage. Das Verfahren der Marktzulassung durch Swissmedic war nicht Gegenstand der Evaluation der PVK. Auch die Ausgestaltung der Vertriebsmargen von Medikamenten wurde in dieser Evaluation nicht berücksichtigt. Im Bericht der PVK wird der Prozessablauf der Aufnahme von Medikamenten überblicksmässig dargestellt. Vgl. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 2. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 5.3. 7779 2.2 Unklare Aufgabentrennung zwischen der EAK und dem BAG Aus der Evaluation der PVK wird deutlich, dass die Aufgabenbereiche der EAK und des BAG im Aufnahmeprozess nicht klar getrennt sind.8 Eindeutig festgelegt ist einzig, dass die EAK nur eine beratende Funktion hat und die Entscheidkompetenz über die Aufnahme der Medikamente in der Spezialitätenliste beim BAG liegt. Die Erfüllung der gesetzlich vorgeschriebenen WZW-Kriterien wird doppelt, das heisst sowohl von der EAK wie auch vom BAG, geprüft. Das Handbuch zur Spezialitätenliste hält einzig fest, dass das BAG insbesondere das Kriterium der Wirtschaftlichkeit beurteilt. Wie die Beurteilung aber genau zustande kommt, ist nicht transparent geregelt. Die PVK zeigt in ihrem internationalen Vergleich,9 dass im Ausland die Verfahrensschritte und die Aufgabengebiete der beteiligten Stellen strenger voneinander getrennt sind. International ist die Aufteilung in die Verfahrensschritte «Medizinischtherapeutische Beurteilung» (Assessement), «Gesundheitspolitisch-gesellschaftliche Beurteilung» (Appraisal) und «Politische Entscheidung» (Decision) üblich. Die damit verbundene institutionelle Trennung der medizinischen Beurteilung durch Fachleute und der Gewichtung dieser Ergebnisse aus gesellschaftspolitischer Sicht durch ein Gremium von Interessensvertretern soll eine fach- und stufengerechte Entscheidungsgrundlage gewährleisten, damit die staatliche Stelle über die Aufnahme eines Medikaments im Leistungskatalog der obligatorischen Krankenpflegeversicherung entscheiden kann. In der Schweiz ist nur der Verfahrensschritt der politischen Entscheidung (Decision) klar einer Institution, dem BAG, zugeteilt. Wie der Bericht der PVK aufzeigt, wird die medizinisch-therapeutische Beurteilung (Assessement) und die gesundheitspolitisch-gesellschaftliche Beurteilung (Appraisal) sowohl vom BAG wie auch von der EAK wahrgenommen. Nach Auffassung der GPK-S erweisen sich die fehlende institutionelle Trennung der Verfahrensschritte und die Mehrfachrolle, welche das BAG im Aufnahmeverfahren innehat, als problematisch. Sie ist der Meinung, dass eine verstärkte institutionelle Trennung der Verfahrensschritte zu besseren und gegen aussen transparenteren Entscheidungsgrundlagen für die Aufnahme eines Medikaments in der Spezialitätenliste führt. Im Weiteren ist die Kommission der Auffassung, dass die Frage der Zusammensetzung und des Auftrags der EAK überprüft werden müsste. 8 9 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 3. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 3.1. 7780 Empfehlung 1 Die GPK-S ersucht den Bundesrat, zu prüfen, ob die gegenwärtige Aufgabentrennung zwischen der EAK und dem BAG zweckmässig und prozessoptimiert ist sowie der Zusammensetzung dieser Stellen gerecht wird. Dabei soll der Bundesrat insbesondere die Einführung von klar getrennten Verantwortlichkeiten gemäss der international anerkannten Aufteilung der Verfahrensschritte (Assessement, Appraisal und Decision) prüfen. 2.3 Kategorisierung der Medikamente nicht umgesetzt Gemäss Artikel 31 Absatz 3 der Krankenpflege-Leistungsverordnung (KLV10) teilt die EAK jedes Arzneimittel in eine der folgenden Kategorien ein: (a) medizinischtherapeutischer Durchbruch; (b) therapeutischer Fortschritt; (c) Kosteneinsparung im Vergleich zu anderen Arzneimitteln; (d) kein therapeutischer Fortschritt und keine Kosteneinsparung; (e) unzweckmässig für die soziale Krankenversicherung. Das Handbuch zur Spezialitätenliste sieht zudem die Kategorie «dp» für Medikamente vor, die als zu teuer eingestuft werden und damit das Kriterium der Wirtschaftlichkeit nicht erfüllen. In ihrer Evaluation stellt die PVK fest, dass die EAK in der Praxis keine explizite Einteilung in die von der Verordnung vorgesehenen Kategorien vornimmt.11 Stattdessen entscheidet das BAG aufgrund der Beratung der EAK über die Einteilung eines Medikaments in eine der Kategorien. Das BAG begründet diese Praxis damit, dass die Kategorien nicht zweckmässig seien und die meisten Gesuche in die Kategorie «dp» fallen würden.12 Die GPK-S zeigt sich erstaunt über diese nicht rechtskonforme Umsetzung durch das BAG. Abgesehen vom Grundsatz der Gesetzmässigkeit, der zumindest eine Anpassung der vom EDI erlassenen Verordnung nahelegen würde, stellt sich nach Ansicht der GPK-S auch die Frage der institutionellen Unabhängigkeit der EAK, welche durch eine eigenständige Kategorisierung durch die EAK gestärkt würde. Empfehlung 2 Die GPK-S ersucht den Bundesrat, die Zweckmässigkeit und Praxistauglichkeit der Kategorisierung gemäss Artikel 31 Absatz 3 KLV zu prüfen und allenfalls Anpassungen vorzunehmen. 10 11 12 Verordnung des EDI vom 29. September 1995 über Leistungen in der obligatorischen Krankenpflegeversicherung, SR 832.112.31. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 3.2. Gemäss des Schreibens des BAG vom 19. Dezember 2013 an die GPK-S werden die Kategorien seit dem Jahr 2012 wieder mehrheitlich angewandt. 7781 2.4 Ungenügende Ressourcen der EAK und des BAG Neben der schwachen institutionellen Stellung der EAK zeigt die Evaluation der PVK auch einen Ressourcenmangel der EAK auf.13 Das Milizprinzip der ausserparlamentarischen Kommission stösst aufgrund der hohen Anzahl an Gesuchen und deren Komplexität an seine Grenzen. Zudem fehlt ein eigenes und unabhängiges Sekretariat der EAK; das Sekretariat wird durch das BAG geführt. Im internationalen Vergleich zeigt sich, dass die eigenständigen Evaluationsbehörden im Ausland mit mehr eigenen Ressourcen ausgestattet sind. Die Kommission begrüsst, dass auf Anfang 2014 eine Erhöhung der Anzahl Sitzungen der EAK von 4 auf 6 Sitzungen jährlich beschlossen wurde. Sie stellt ausserdem fest, dass die Mitglieder der EAK die Unterstützung durch das BAG als positiv beurteilen. Wie das BAG bekannt gab, will es ab 2014 die Beurteilung der EAK durch zusätzliche Vorarbeiten erleichtern, namentlich durch die Erstellung von Faktenblättern zuhanden der EAK sowie eine formelle und inhaltliche Vorprüfung der eingereichten Dossiers. Auch hier stellt sich der GPK-S aber vor dem Hintergrund der bereits bis anhin dominierenden Rolle des BAG im Aufnahmeverfahren die Frage, ob durch diese Massnahmen die Unabhängigkeit der EAK nicht weiter eingeschränkt wird. Die GPK-S begrüsst jedoch, dass die Sitzungen der EAK seit Januar 2012 nicht mehr vom BAG, sondern von einem verwaltungsunabhängigen Mitglied der EAK präsidiert werden. Die Analyse der PVK deutet auch auf einen Mangel an Ressourcen bei der zuständigen Sektion im BAG hin. Die PVK stellt fest, dass deren Ressourcenausstattung nicht ausreicht, um die Gesuche vertieft zu untersuchen.14 Nach Ansicht der GPK-S werden die Grenzen der personellen Ressourcen bei der zuständigen Sektion im BAG insbesondere bei der gesetzlich vorgeschriebenen periodischen Überprüfung der Medikamente in der Spezialitätenliste offensichtlich.15 Die GPK-S begrüsst deshalb, dass im Hinblick auf die zu erwartende Mehrbelastung der zuständigen Sektion des BAG mit der im Mai 2013 beschlossene Verkürzung des Aufnahmeverfahrens auf höchstens 60 Tage eine Aufstockung der personellen Ressourcen um drei zusätzliche Vollzeitstellen genehmigt wurde. Empfehlung 3 Die GPK-S ersucht den Bundesrat, in Abhängigkeit der zukünftigen Rollen der EAK und der zuständigen Sektion des BAG und unter Berücksichtigung der Resultate der laufenden Effizienzüberprüfung des BAG sicherzustellen, dass beide Institutionen mit den für die Erfüllung ihres Auftrags erforderlichen Ressourcen ausgestattet sind. Der Bundesrat trägt dabei insbesondere der Unabhängigkeit der EAK und einer angemessenen organisatorischen Trennung zum BAG Rechnung. 13 14 15 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 3.3. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 3.3. Vgl. unten Ziffer 5 7782 2.5 Keine Weitergabe von Berichten der Swissmedic an das BAG Das BAG und die EAK prüfen ein Gesuch aufgrund der Unterlagen, welche vom Gesuchsteller eingereicht werden. Das BAG kann das Gesuch mit weiteren sachdienlichen Unterlagen ergänzen, welche nicht vom Gesuchsteller eingereicht wurden. Die Berichte von Swissmedic, welche für die Überprüfung der Sicherheit von Medikamenten und damit für deren Marktzulassung erstellt werden, sind dem BAG jedoch aufgrund gesetzlicher Restriktionen nicht zugänglich.16 In den Berichten der Swissmedic werden die Ergebnisse der Begutachtung einer grösseren Anzahl von Studien festgehalten. Dem BAG und der EAK fehlen so wichtige Informationen, die von Swissmedic im Kontext der Marktzulassung bereits erarbeitet wurden.17 Die GPK-S stellt mit Befriedigung fest, dass in der aktuellen Revision des Heilmittelgesetzes vorgesehen ist, dem Bundesrat die Kompetenz zu geben, den weiteren Bundesbehörden des Gesundheitsbereichs die Daten von Swissmedic zur Verfügung zu stellen.18 Die GPK-S ist der Ansicht, dass mit der heutigen Rechtslage die Synergien zwischen dem BAG und Swissmedic nicht optimal genutzt werden können. 3 Ungenügende und unpräzise Beurteilungskriterien 3.1 Unzureichende Präzisierung der Kriterien der Wirksamkeit und der Zweckmässigkeit Die PVK stellt in ihrer Evaluation fest, dass die WZW-Kriterien in der Schweiz nur wenig für den Vollzug konkretisiert worden sind.19 Insbesondere die Kriterien der Wirksamkeit und der Zweckmässigkeit sind in der Schweiz viel allgemeiner formuliert als in den Vergleichsländern Deutschland und Österreich. So gibt es in der Schweiz namentlich für die Bewertung des Nutzens eines Medikaments keine spezifischen Vorgaben, welche eine einheitliche Anwendung gewährleisten würden.20 Die rechtlichen Grundlagen sehen für den Nachweis der Wirksamkeit, d.h. des individuellen Nutzens eines Medikaments für den Patienten, keine klaren Indikatoren (z.B. Operationalisierung der Lebensqualität) oder Vergleiche mit anderen Medikamenten oder auch mit nichtmedikamentösen Leistungen vor. Der zusätzliche Nutzen, der sich aus einem neuen Medikament für die Patientinnen und Patienten 16 17 18 19 20 Das BAG gilt nicht als eine Vollzugsbehörde des Heilmittelgesetzes und ist damit nach aktueller Rechtslage nicht berechtigt, die Daten von Swissmedic zu erhalten; vgl. Art. 63 des Bundesgesetzes vom 15. Dezember 2000 über Arzneimittel und Medizinprodukte (Heilmittelgesetz, HMG), SR 812.21. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.1. Vgl. Art. 63 E-HMG (Entwurf vom 7. Nov. 2012 zum Bundesgesetz über Arzneimittel und Medizinprodukte, BBl 2013 131). Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4. Im Bereich der komplementärmedizinischen Arzneimittel stellte die PVK fest, dass insbesondere keine Beurteilungskriterien für den Nachweis der Wirksamkeit festgelegt sind. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.5. 7783 ergibt, muss vom Gesuchsteller nicht nachgewiesen werden und wird folglich nur ungenügend berücksichtigt.21 Auch für den Nachweis der Zweckmässigkeit sind keine präzisen Kriterien festgehalten, um den Nutzen eines Medikaments und namentlich die soziale Nutzenperspektive (Notwendigkeit einer Leistungsübernahme durch die obligatorische Krankenpflegeversicherung) zu bestimmen und zu gewichten.22 Nach Ansicht der GPK-S stellt die fehlende Präzisierung der WZW-Kriterien eine unbefriedigende Situation dar. Sie ist der Meinung, dass eine detailliertere Ausgestaltung der Beurteilungskriterien die einheitliche Anwendung der Aufnahme von Medikamenten fördern und zudem die Entscheide der Vollzugsbehörden für die beteiligten Akteure nachvollziehbarer machen würde. Auch ist die GPK-S der Auffassung, dass die Nutzenanalyse eines Medikaments gegenwärtig nur unzureichend in die Beurteilung einfliesst. Wie die Evaluation der PVK aufzeigt, werden in den meisten Ländern der EU klare Anforderungen an den Nachweis des Nutzens von Medikamenten gestellt, wenn diese von der obligatorischen Krankenversicherung übernommen werden sollen. Auf internationaler Ebene besteht zudem der Trend zu vertieften Versorgungsstudien sowie umfassenden «Health Technology Assessments» (HTA), bei denen gesundheitsökonomische, rechtliche, ethische und soziale Aspekte anhand von Indikatoren systematisch einbezogen werden. Die GPK-S ist sich bewusst, dass solche umfassenden Prüfverfahren komplex und ressourcenintensiv sein können. Sie stellt aber fest, dass die gegenwärtige Ausgestaltung des Prüfverfahrens den therapeutischen Mehrwert eines neuen Medikaments für die individuelle und soziale Nutzenperspektive nur ungenügend berücksichtigt. Postulat 1 Die GPK-S fordert den Bundesrat auf, eine Präzisierung und Ergänzung der Kriterien zum Nachweis der Wirksamkeit und Zweckmässigkeit zu prüfen und darüber Bericht zu erstatten. Dabei sorgt er insbesondere für eine verbesserte Berücksichtigung des Medikamentennutzens. 3.2 Wirtschaftlichkeit: Mangelhafte Referenzwerte Ein Arzneimittel gilt als wirtschaftlich, wenn es die indizierte Heilwirkung mit möglichst geringem finanziellem Aufwand gewährleisten kann. Geprüft wird die Wirtschaftlichkeit durch den Vergleich mit anderen Arzneimitteln – dem therapeutischen Quervergleich (TQV) – und den Auslandpreisvergleich (APV). In ihrer Evaluation kommt die PVK jedoch zum Schluss, dass sich beide Instrumente nur beschränkt für die Beurteilung der Wirtschaftlichkeit eignen und in der Anwendung 21 22 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.1. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.2. 7784 auf gravierende Schwierigkeiten stossen. Zudem stellt sie fest, dass den gesetzlichen Bestimmungen keine Gewichtung der beiden Instrumente zu entnehmen ist.23 Für den therapeutischen Quervergleich mangelt es in der Schweiz an einer klaren Definition von Vergleichsgruppen. Anders als im Ausland ist es in der Schweiz daher oft nicht klar, mit welchen Arzneimitteln ein bestimmtes Medikament verglichen werden muss. Zudem fehlt es, wie oben bereits dargelegt, an einer aussagekräftigen Nutzenanalyse eines Medikaments. Wie die PVK aufzeigt, ist der Gesuchsteller in der Schweiz nicht verpflichtet, ökonomische Studien einzureichen, welche die Kosten eines Medikaments ins Verhältnis zu seinem Nutzen stellen und somit den Vergleich zu anderen Medikamenten erleichtern würde. Die PVK stellt fest, dass auch der Auslandpreisvergleich, welcher sich an den Listenpreisen von Medikamenten im Ausland orientiert, nur eine begrenzte Aussagekraft aufweist. Denn aufgrund von teilweise substantiellen Rabatten, welche die Arzneimittelhersteller im Ausland auf den Listenpreisen gewähren, oder aufgrund von Festbetragssystemen ist der effektiv von den Krankenversicherern vergütete Medikamentenpreis im Ausland oft wesentlich tiefer als der gelistete Preis. Diese Rabatte sind häufig nicht transparent ausgewiesen und damit schwierig zu eruieren. Doch auch die gesetzlich vorgeschriebenen und somit öffentlich bekannten Rabatte (wie in Deutschland) bleiben aktuell vom BAG unberücksichtigt. Auch im Zusammenhang mit der Gewährleistung von Innovationszuschlägen, welche die Kosten für Forschung und Entwicklung angemessen berücksichtigen sollen, stellt die PVK fest, dass die Anwendungsrichtlinien nur ungenügend präzisiert wurden.24 Postulat 2 Die GPK-S fordert den Bundesrat auf, eine Optimierung der Kriterien zur Bestimmung der Wirtschaftlichkeit zu prüfen und darüber Bericht zu erstatten. Im Bereich des therapeutischen Quervergleichs prüft er insbesondere die Festlegung von Vergleichsgruppen und eine Weiterentwicklung der Kosten-NutzenAnalyse. Im Zusammenhang mit dem Auslandpreisvergleich prüft er eine verbesserte Berücksichtigung der tatsächlich von den Krankenkassen im Ausland vergüteten Medikamentenpreise. Mit der Präzisierung der Bedingungen eines Innovationszuschlages sorgt er für eine einheitliche Zuschlagsgewährung. 23 24 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.3 und 5.2. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 5.2. 7785 3.3 Problematik der befristeten Aufnahme Wenn bei der Gesuchstellung um Aufnahme eines Medikaments in der Spezialitätenliste noch keine ausreichenden Wirksamkeitsbelege vorliegen, kann das BAG das Medikament befristet aufnehmen. Wie die PVK aufzeigt,25 liegt die Problematik der befristeten Aufnahme darin, dass nach Ablauf der Frist häufig weiterhin ein klarer Wirkungsnachweis fehlt, die befristet aufgenommenen Medikamente aber nur schwierig wieder von der Spezialitätenliste ausgeschlossen werden können, da die Patientinnen und Patienten bereits auf die Medikamente eingestellt sind und eine Absetzung problematisch für sie sein könnte. Die GPK hält fest, dass die befristete Aufnahme zwar eine begrüssenswerte Flexibilität für die Aufnahme von neuen und noch schwach belegten Medikamenten bietet, aber auch ein problematisches Präjudiz für die spätere unbefristete Aufnahme schaffen kann. Die GPK-S erachtet es als wichtig, die Praxis der befristeten Aufnahme transparent auszuweisen. Empfehlung 4 Die GPK-S empfiehlt dem Bundesrat, die befristete Aufnahme von Medikamenten in der Spezialitätenliste transparent auszuweisen und dafür zu sorgen, dass diejenigen Medikamente, welche die gesetzlichen WZW-Kriterien nicht erfüllen, nach erfolgter Evaluation konsequent von der Kassenpflicht ausgeschlossen werden. 3.4 Vereinzelte Festlegung von Rückvergütungen in der «Limitation» Gemäss den gesetzlichen Vorgaben wird im Feld «Limitation» der Spezialitätenliste die ordentliche Vergütungspflicht der OKP auf eine bestimmte Anwendung des Medikaments (insbesondere in Bezug auf die Menge oder die medizinischen Indikationen) eingeschränkt.26 Die PVK stellt jedoch in ihrer Evaluation einzelne Fälle fest, in welchen Medikamente mit relativ hohen Listenpreisen aufgenommen wurden, gleichzeitig aber in der Limitation eine Rückvergütung an die Krankenkassen vorgeschrieben wurde.27 Die PVK erklärt diese Fälle, in denen die Limitation nicht eine Anwendungsbeschränkung sondern einen Preisrabatt festlegt, damit, dass ein hoher Listenpreis in der Schweiz Einfluss auf die Preisfestsetzung im Ausland hat, da die Schweiz in vielen Referenzkörben von anderen Ländern aufgenommen ist. Die Arzneimittelhersteller sind folglich an einem möglichst hohen Listenpreis interessiert. Die GPK-S ist erstaunt ab dieser offensichtlich bestimmungsfremden Nutzung der Limitation in der Spezialitätenliste. Die Aufnahme eines Medikaments mit einer im Vorhinein festgelegten Rückvergütung an die Krankenversicherer wirft die Frage 25 26 27 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 5.2. Art. 73 der Verordnung vom 27. Juni 1995 über die Krankenversicherung (KVV), SR 832.102 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 5.3 7786 auf, ob ein Listenpreis – der nicht dem tatsächlich vergüteten Preis entspricht – das Kriterium der Wirtschaftlichkeit erfüllt. Das BAG nennt zwar in seinem Schreiben an die GPK-S verschiedene Gründe, weshalb in der Limitation mit einer Rückvergütung sichergestellt werden müsse, dass die Kosten des Medikaments ihrem therapeutischen Nutzen entsprechen.28 Die GPK-S sieht aber nicht ein, weshalb das Kriterium der Wirtschaftlichkeit nicht direkt bei der Festsetzung des Listenpreises der Medikamente berücksichtigt wurde. Zudem fragt sich die Kommission, ob der Mehraufwand für die Einforderung der Rückvergütung bei den Krankenversicherungen gerechtfertigt ist. Empfehlung 5 Die GPK-S ersucht den Bundesrat, die Praxis der Festsetzung von Rückvergütungen in der Limitation eines Medikaments zu überprüfen. 4 Mangelnde Transparenz des Aufnahmeverfahrens Die Evaluation der PVK zeigt auf, dass das Aufnahmeverfahren und die Entscheide des BAG wenig transparent sind.29 Einerseits lässt sich feststellen, dass die Ergebnisse der einzelnen Prüfschritte in der Schweiz kaum und nur oberflächlich dokumentiert werden. Dies im Gegensatz zu gewissen ausländischen Verfahren, insbesondere Deutschland, wo die Ergebnisse zu jedem einzelnen Verfahrensschritt im Internet publiziert werden. Vor dem Hintergrund der bereits festgestellten ungenügenden Trennung der Verfahrensschritte und Verantwortlichkeiten im schweizerischen Aufnahmeverfahren30 und der nicht explizit umgesetzten Kategorisierung der Medikamente durch die EAK31 ist die Dokumentation der einzelnen Verfahrensschritte nach Ansicht der GPK-S ungenügend. Neben der schwachen internen Berichterstattung ortet die PVK andererseits auch eine mangelhafte Transparenz gegenüber der Öffentlichkeit. Die Entscheidkommunikation begrenzt sich auf die Bekanntgabe des zugelassenen Medikaments, des Preises und einer allfälligen Limitation. Das BAG begründet die Zurückhaltung bei der Veröffentlichung von Unterlagen mit der Rücksichtnahme auf Geschäftsgeheimnisse. Wie die PVK aber aufzeigt, unterliegen nur wenige Unterlagen dem Geschäftsgeheimnis und namentlich die Berichte zum Assessement und zum Appraisal, d.h. zur medizinischen und gesellschaftspolitischen Beurteilung des Medikaments, könnten ohne Beeinträchtigung des Geschäftsgeheimnisses veröffentlicht werden. Die GPK-S ist überzeugt, dass eine grössere Transparenz des Aufnahmeverfahrens die Entscheide des BAG nachvollziehbarer machen und zudem den Leistungserbringern und den Patientinnen und Patienten wertvolle Informationen bieten würde. 28 29 30 31 Schreiben des BAG vom 19. Dezember 2013 an die GPK-S. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 5.4. Vgl. oben Ziffer 2.2. Vgl. oben Ziffer 2.3. 7787 Empfehlung 6 Die GPK-S empfiehlt dem Bundesrat, zu prüfen, wie die Verfahrensschritte und der Entscheid über die Aufnahme eines Medikaments in der Spezialitätenliste transparenter dokumentiert und der interessierten Öffentlichkeit kommuniziert werden können. Er berücksichtigt dabei sowohl das Interesse der Öffentlichkeit und der Leistungserbringer an der Bekanntgabe der Beurteilung des Medikamentennutzens als auch die Interessen der Arzneimittelhersteller auf Wahrung des Geschäftsgeheimnisses. Der Bundesrat stellt dabei sicher, dass Entscheide des BAG, welche von der Beurteilung der EAK abweichen, ausreichend begründet werden. 5 Defizite in der periodischen Überprüfung Mit Artikel 65d der Verordnung über die Krankenversicherung (KVV) führte der Bundesrat 2009 eine dreijährliche periodische Überprüfung der Medikamente in der Spezialitätenliste ein. Auf dieser Rechtsgrundlage überprüft das BAG jedes Jahr rund einen Drittel der kassenpflichtigen Medikamente. Falls das BAG dabei zum Schluss kommt, dass die Wirtschaftlichkeit nicht mehr erfüllt ist, verfügt es eine angemessene Preissenkung. Die ersten periodischen Überprüfungen fanden in den Jahren 2012 und 2013 statt. Von den je rund 800 geprüften Medikamenten wurde bei jeweils rund 500 Medikamenten eine Preissenkung verfügt. 5.1 Eingeschränkte Beurteilung bei der Überprüfung Gemäss den rechtlichen Bestimmungen müssen die Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit aller Leistungen der obligatorischen Krankenpflegeversicherung periodisch überprüft werden.32 Wie die PVK in ihrer Evaluation feststellt, beurteilt das BAG aber bei der periodischen Überprüfung nur das Kriterium der Wirtschaftlichkeit.33 Die Wirksamkeit und die Zweckmässigkeit werden nicht berücksichtigt, obwohl ihre Überprüfung auch gesetzlich vorgesehen wäre. Bei der Beurteilung der Wirtschaftlichkeit wendet das BAG zudem in der Regel nur den Auslandpreisvergleich an; ein therapeutischer Quervergleich wird nur durchgeführt, wenn das Medikament im Ausland nicht auf dem Markt ist (Art. 65d Abs. 1bis KVV). Wie die PVK aufzeigt, entsprach die Preissenkung von rund 20 % bei der ersten Überprüfung ungefähr der Anpassung des für Auslandpreisvergleiche geltenden Wechselkurses.34 32 33 34 Vgl. Art. 32 Abs. 2 des Bundesgesetzes vom 18. März 1994 über die Krankenversicherung (KVG), SR 832.10. Vor der Verordnungsänderung mit Art. 65d KVV fand die Überprüfung in längeren, unregelmässigen Abständen statt. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 6. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 6.2. 7788 Das BAG begründet die eingeschränkte Beurteilung bei der periodischen Überprüfung damit, dass sich der Nutzen eines Medikaments gegenüber anderen Medikamenten in der Regel nicht ändere. Zudem würden die verfügbaren Ressourcen im BAG nicht ausreichen um systematisch einen therapeutischen Quervergleich mit anderen Medikamenten durchzuführen. Schliesslich würde der therapeutische Quervergleich die Wahrscheinlichkeit erhöhen, dass die vom BAG verfügten Preissenkungen angefochten würden.35 Die PVK stellt fest, dass die periodische Überprüfung momentan nur zu gewährleisten vermag, dass die Preisdifferenz zum Ausland nicht zunimmt.36 Da bei Überprüfung einzig der Auslandpreisvergleich durchgeführt wird, bleiben nicht nur die Kriterien der Wirksamkeit und der Zweckmässigkeit unberücksichtigt, auch der therapeutische Mehrwert und damit auch das Kosten-Nutzen-Verhältnis gegenüber anderen Medikamenten fliessen nicht in die Beurteilung ein. So wie die periodische Überprüfung heute ausgestaltet ist, bewirkt sie nicht, dass die Preise von bestehenden Medikamenten im Falle von Innovationen im Medikamentenmarkt gesenkt werden. Die GPK-S stellt begrüssend fest, dass die seit 2012 durchgeführten periodischen Überprüfungen zu wesentlichen Preissenkungen im Medikamentenmarkt führten (die Überprüfung im Jahr 2012 führt voraussichtlich zu einer jährlichen Einsparung von rund 240 Millionen Franken und jene von 2013 zu einer zusätzlichen jährlichen Einsparung von mindestens 200 Millionen Franken). Angesichts der von der PVK dargelegten Situation kommt die GPK-S nicht darum herum, festzuhalten, dass die periodische Überprüfung im Medikamentenbereich nicht den Vorgaben von Artikel 32 Absatz 2 KVG entspricht, da sie die Kriterien der Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit nicht vollständig berücksichtigt. Die auf den Auslandpreisvergleich beschränkte dreijährliche Überprüfung der Medikamente in der Spezialitätenliste stellt nach Auffassung der Kommission eine ungenügende Massnahme dar, um das angemessene Kosten-Nutzen-Verhältnis der kassenpflichtigen Medikamente zu gewährleisten. Kommt hinzu, dass der Auslandpreisvergleich, wie bereits festgestellt,37 nur eine begrenze Aussagekraft aufweist. Für die GPK-S ist es interessant zu erfahren, dass andere Länder eine weitergehende Überprüfung der Kassenpflicht von Medikamenten kennen, und neben der reinen Preisbetrachtung auch den Nutzen im Sinne der Wirksamkeit und Zweckmässigkeit regelmässig überprüfen.38 Empfehlung 7 Die GPK-S fordert den Bundesrat auf, darzulegen, wie der Auftrag der periodischen Überprüfung gemäss Artikel 32 Absatz 2 KVG im Bereich der Medikamente künftig vollumfänglich umgesetzt werden kann. 35 36 37 38 Schreiben des BAG vom 19. Dezember 2013 an die GPK-S. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 6.3 und 8.3. Vgl. oben Ziffer 3.2. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 8.3. 7789 5.2 Keine Streichungen aufgrund negativer WZW-Beurteilungen Die PVK stellt weiter fest, dass in den letzten 10–15 Jahren keine Medikamente aufgrund von negativen Beurteilungen der WZW-Kriterien durch das BAG von der Spezialitätenliste gestrichen wurden.39 Das BAG entfernt ein Medikament einzig von der Spezialitätenliste, wenn Swissmedic dem Medikament die Marktzulassung entzieht oder wenn der Arzneimittelhersteller die Streichung beantragt. Das BAG begründet seine Zurückhaltung bei der Streichung von Medikamenten mit der Schwierigkeit des Nachweises, dass ein Medikament die WZW-Kriterien nicht mehr erfüllt. Da die Beweislast beim BAG liege und Streichungsverfahren aufwändig und langwierig verliefen, sei eine Streichung faktisch unmöglich. Postulat 3 Die GPK-S fordert den Bundesrat auf, in einem Bericht Massnahmen abzuklären, die es ermöglichen, in der Spezialitätenliste aufgenommene Medikamente, welche die WZW-Kriterien nicht mehr erfüllen, konsequent von der Spezialitätenliste zu streichen. 6 Generika: Fehlende Anreize zu Preissenkungen im patentfreien Medikamentenbereich Nach Ablauf des Patentschutzes von Originalpräparaten können diese durch günstigere Generika konkurriert werden. Als Generikum gilt ein Arzneimittel, das aufgrund identischer Wirkstoffe sowie seiner Darreichungsform und Dosierung austauschbar mit dem Originalpräparat ist. Bei der Aufnahme von Generika in der Spezialitätenliste prüft das BAG die Wirksamkeit nicht separat, da von derselben Wirksamkeit wie beim Originalpräparat ausgegangen wird. Die Zweckmässigkeit von Generika gilt als erfüllt, wenn sie in den gleichen Verabreichungsformen, Packungsgrössen und Dosisstärken wie das Originalpräparat für Erwachsene angeboten werden. Die Wirtschaftlichkeit beurteilt das BAG gemäss Artikel 65c KVV nach einem fixen Preisabstand zum Originalpräparat. Je nach Umsatzvolumen des Originalpräparats muss der Preis von Generika zwischen 10 und 60 % tiefer liegen als der Preis der Originalpräparate. Wie der Ländervergleich der PVK aufzeigt, stellt diese fixe Preisabstandregelung zwischen Generika und Originalpräparaten ein Sondermerkmal des schweizerischen Systems dar.40 In anderen Ländern wird der von den Krankenkassen vergütete Preis von Originalpräparaten mit der Einführung austauschbarer Generika oft gesenkt. In der Schweiz werden hingegen Medikamente trotz austauschbarer Wirkung zu unterschiedlichen Preisen von der obligatorischen Krankenpflegeversicherung vergütet. Zwar tragen die Patientinnen und Patienten seit der Einführung von Artikel 38a KLV beim Kauf von Originalpräparaten trotz Vorhandensein von Generika einen 39 40 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 6.3. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.4. 7790 höheren Selbstbehalt (20 statt 10 %). Dies führt teilweise dazu, dass die Preise von Originalpräparaten gesenkt werden, um dem höheren Selbstbehalt auszuweichen. Die PVK kommt aber in ihrer Evaluation zum Schluss, dass die Wirkung des differenzierten Selbstbehalts noch nicht eindeutig eruiert werden kann.41 In seinem Bericht über den Medikamentenmarkt im patentfreien Bereich geht der Preisüberwacher von einer zu schwachen Wirkung des erhöhten Selbstbehalts aus.42 Die PVK stellt trotz des differenzierten Selbstbehalts einen grundsätzlichen Widerspruch zur gesetzlichen Anforderung der Wirtschaftlichkeit fest, da die Krankenkassen nicht nur das kostengünstigste sondern auch das teurere Originalpräparat vergüten müssen.43 Angesichts der per Definition vorausgesetzten Austauschbarkeit von Generika und Originalpräparaten müsste die obligatorische Krankenpflegeversicherung gemäss dem Prinzip der Wirtschaftlichkeit ein Medikament nur bis zum Preis des günstigsten Generikums vergüten. Die GPK-S stellt fest, dass die schweizerische Preisregulierung von Generika im Vergleich zum Ausland zu grundsätzlich höheren Preisen von Generika und Originalpräparaten und zu einem geringen Anteil von Generika auf dem Medikamentenmarkt führen.44 Angesichts der Sonderstellung der schweizerischen Preisregelung von Generika fragt sich die GPK-S, ob andere Preisfestsetzungsmechanismen, beispielsweise ein Festbetragssystem (wie vom Preisüberwacher gefordert oder in einer anderen Form), besser geeignet wären, der gesetzlichen Anforderung der Wirtschaftlichkeit Rechnung zu tragen. Im sogenannten Festbetragssystem, das – wie der Preisüberwacher aufzeigt45 – bereits 22 europäische Länder in unterschiedlichen Varianten eingeführt haben, werden Medikamente mit gleichen Wirkstoffen nur zum Preis des kostengünstigsten Präparats von den Krankenkassen vergütet. Empfehlung 8 Die GPK-S fordert den Bundesrat auf, im Bereich der patentfreien Medikamente Massnahmen zu prüfen, die griffigere Anreize zur Preissenkung von Originalpräparaten und Generika sowie zur vermehrten Verschreibung von Generika schaffen. Dabei nimmt er insbesondere zur möglichen Einführung eines Festbetragssystems Stellung. 41 42 43 44 45 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.4. Bericht des Preisüberwachers vom August 2013 «Schweizer Medikamentenmarkt im internationalen Vergleich – Handlungsbedarf im patentfreien Bereich», Seite 5. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenversicherung, Bericht der PVK, Ziffer 4.4 Dieser Schluss ergibt sich auch aus dem Bericht des Preisüberwachers vom August 2013 «Schweizer Medikamentenmarkt im internationalen Vergleich – Handlungsbedarf im patentfreien Bereich» und dem Bericht von Obsan vom Oktober 2013 «Influence des génériques sur le marché des médicaments» Bericht des Preisüberwachers vom August 2013 «Schweizer Medikamentenmarkt im internationalen Vergleich – Handlungsbedarf im patentfreien Bereich», Seite 8 7791 7 Schlussfolgerungen Insgesamt zeigt die Evaluation nach Ansicht der GPK-S, dass die aktuelle Ausgestaltung des Verfahrens zur Aufnahme und Überprüfung der Medikamente in der Spezialitätenliste verschiedentliche Schwachstellen aufweist. Die Kommission ersucht daher den Bundesrat, bis spätestens am 31. August 2014 zu ihren Feststellungen und Empfehlungen sowie zur Evaluation der PVK Stellung zu nehmen, und dabei darzulegen, mit welchen Massnahmen und bis wann er die Empfehlungen der Kommission umzusetzen gedenkt. 25. März 2014 Im Namen der Geschäftsprüfungskommission des Ständerates Der Präsident: Hans Hess Die Sekretärin: Beatrice Meli Andres 7792 Beilage Liste der angehörten Personen Pascal Strupler Direktor BAG Sandra Schneider Leiterin Abteilung Leistungen, Direktionsbereich Krankenund Unfallversicherung, BAG Andrea Frey Leiterin Sektion Medikamente, Direktionsbereich Krankenund Unfallversicherung, BAG Stefan Meierhans Preisüberwacher Manuel Jung Leiter Fachbereich Gesundheit, Preisüberwachung 7793 7794 Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung Anhang Bericht der Parlamentarischen Verwaltungskontrolle zuhanden der Geschäftsprüfungskommission des Ständerates vom 13. Juni 2013 2014-1538 7795 Das Wichtigste in Kürze Die Medikamentenpreise sind im Kontext der steigenden Gesundheitskosten ein wiederkehrendes Thema. Die Geschäftsprüfungskommissionen der eidgenössischen Räte haben deshalb der Parlamentarischen Verwaltungskontrolle (PVK) den Auftrag erteilt, die Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung zu evaluieren. Die zuständige Subkommission EDI/UVEK der Geschäftsprüfungskommission des Ständerates hat am 19. April 2012 über die genaue Ausrichtung der Untersuchung entschieden. Ergebnisse im Überblick Insgesamt zeigt die Evaluation verschiedene rechtliche Defizite im Verfahren der Zulassung und Überprüfung sowie Schwierigkeiten beim Vollzug auf. Die Kriterien für die Beurteilung von Medikamenten sind zu wenig präzise, die Verfahrensstruktur und Kompetenzen sind unklar, die neu eingeführte Überprüfung von bereits zugelassenen Medikamenten ist zu wenig wirksam und die Preisregulierung bei Generika ist rechtlich widersprüchlich. Dass namentlich das Ziel einer wirtschaftlichen Medikamentenversorgung mit den gegenwärtigen Verfahren beschränkt erreicht wird, zeigt sich auch daran, dass sich die Zahl der kassenpflichtigen Arzneimittel in den vergangenen 15 Jahren verdoppelt hat und die Preise neuer Arzneimittel kontinuierlich gestiegen sind. Unpräzise Beurteilungskriterien und unsystematische Nutzenbewertung Von der Krankenversicherung werden nur Arzneimittel vergütet, die auf der so genannten Spezialitätenliste (SL) aufgeführt sind, die das Bundesamt für Gesundheit (BAG) verabschiedet. Damit Medikamente kassenpflichtig werden, müssen sie die drei Kriterien der Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit erfüllen. Die WZW-Kriterien werden vom BAG und von der Eidgenössischen Arzneimittelkommission (EAK) bei jedem Gesuch stets angewendet. Diese Kriterien wurden von den Behörden aber nur unzureichend präzisiert. Namentlich wird der Nutzen der Medikamente ungenügend und nicht nach einheitlichen Kriterien bewertet. Dies wirkt sich unter anderem auf die Preisfestsetzung aus. Die beiden Instrumente, die für die Preisbestimmung angewandt werden, weisen Defizite auf. So werden beim so genannten Auslandpreisvergleich Listenpreise aus sechs anderen Ländern herangezogen, die zum Teil deutlich über den tatsächlich bezahlten Preisen liegen. Dies führt in der Schweiz zu überhöhten Ansätzen. Das zweite Instrument, der Vergleich mit ähnlichen Arzneimitteln in der Schweiz, wäre für die Preisfestlegung grundsätzlich geeigneter. Dabei ist aber nicht klar definiert, welche Medikamente in den Vergleich einfliessen. Seine Ergebnisse sind umstritten. Die unklaren Beurteilungskriterien schwächen insgesamt die Stellung des BAG gegenüber den oftmals wissenschaftlich und juristisch besser ausgestatteten Arzneimittelherstellern. 7796 Unklare Verfahrensstruktur und Kompetenzen Das Verfahren der Zulassung von Medikamenten in der Schweiz ist nicht klar strukturiert, so ist keine Trennung zwischen medizinisch-therapeutischer und gesundheitspolitisch-gesellschaftlicher Beurteilung erkennbar. Sowohl das BAG wie auch die Eidgenössische Arzneimittelkommission (EAK) sind für die Beurteilung der Medikamente zuständig. Die Arbeitsteilung zwischen den beiden ist nicht geklärt. Zudem verfügen sowohl das BAG als auch die EAK für die Durchführung der Verfahren über wenige Ressourcen, wie namentlich ein Vergleich mit dem Ausland zeigt. Die Ergebnisse der einzelnen Verfahrensschritte werden weder gegenüber den Gesuchstellern noch gegenüber der Öffentlichkeit transparent gemacht. Eingeschränkte und wenig wirksame Überprüfung Die Kassenpflicht eines Medikaments wird neuerdings alle drei Jahre überprüft. Wie die erste Überprüfung im Jahr 2012 zeigt, wird dabei allerdings nur der Preis geprüft, indem ein Auslandspreisvergleich durchgeführt wird. Hingegen werden die Wirksamkeit und die Zweckmässigkeit nicht erneut beurteilt, obwohl allenfalls neue Erkenntnisse vorliegen würden. Angesichts der Ressourcenlage der zuständigen Sektion beim BAG ist eine fundiertere Überprüfung nicht realistisch. Vom Überprüfungsverfahren ist deshalb bestenfalls eine beschränkte Wirkung auf die Preise der Medikamente zu erwarten, während auch weniger geeignete Medikamente auf der SL verbleiben. Preisreglung bei Generika schafft Widerspruch zur Wirtschaftlichkeit Die obligatorische Krankenpflegeversicherung soll eine medizinisch hochstehende Versorgung zu möglichst günstigen Preisen gewährleisten. Dieses Ziel wird mit der gegenwärtigen Preisregelung bei Generika nicht erreicht. Während im Ausland der Preis eines Originalpräparats bei der Zulassung eines damit austauschbaren Generikums gesenkt wird, bleibt er in der Schweiz auch nach Patentablauf gleich. Der Preis des Generikums entspricht in der Schweiz dem Preis des Originals abzüglich eines fixen Prozentsatzes. Die Krankenversicherung bezahlt nicht nur das kostengünstigste, sondern auch das gleichwertige teurere Präparat, was im Widerspruch zum Ziel der Wirtschaftlichkeit steht. Zudem bleiben Generika auch nach dem prozentualen Abzug gegenüber dem Preis des Originalpräparates in der Schweiz markant teurer als im Ausland. Vorgehen der Evaluation Die Verfahren zur Zulassung und Überprüfung von Medikamenten in die obligatorische Krankenpflegeversicherung wurden aus drei unterschiedlichen Blickwinkeln untersucht: aus einer rechtlichen, einer vollzugsorientierten und einer international vergleichenden Perspektive. Zwei der drei Evaluationsteile, das Rechtsgutachten und der internationale Vergleich, wurden extern in Auftrag gegeben. Die PVK untersuchte den Vollzug anhand einzelner Medikamente und Gesprächen mit den zuständigen Behörden und weiteren beteiligten Akteuren. 7797 Inhaltsverzeichnis Das Wichtigste in Kürze 7796 1 Einleitung 1.1 Anlass der Evaluation 1.2 Vorgehen und Methodik 1.3 Aufbau des Berichts 7800 7800 7801 7802 2 Die Zulassung und Überprüfung von Medikamenten im Überblick 7802 3 Verfahrensstruktur, Kompetenzaufteilung und Ressourcen 3.1 Verfahren in internationaler Perspektive 3.2 Kompetenzaufteilung zwischen den Akteuren 3.3 Ressourcen 3.4 Verfahrensdauer 7805 7805 7806 7808 7809 4 Beurteilung anhand der WZW-Kriterien 4.1 Wirksamkeit 4.2 Zweckmässigkeit 4.3 Wirtschaftlichkeit 4.4 WZW-Kriterien bei Generika 4.5 WZW-Kriterien bei komplementärmedizinischen Arzneimitteln 7810 7810 7812 7813 7814 7815 5 Entscheid 5.1 Rechtliche Grundlagen 5.2 Entscheidpraxis 5.3 Folgen der Nichterfüllung der Bedingungen 5.4 Transparenz der Entscheide 7816 7816 7817 7819 7821 6 Verfahren der Überprüfung 6.1 Rechtliche Grundlagen 6.2 Erstmalige Überprüfung 2012 6.3 Zweckmässigkeit des Verfahrens 7822 7822 7822 7824 7 Auswirkungen auf die SL 7.1 Anzahl kassenpflichtiger Medikamente 7.2 Preisentwicklung 7825 7825 7826 8 Schlussfolgerungen 8.1 Unpräzise Beurteilungskriterien und unsystematische Nutzenbewertung 8.2 Unklare Verfahrensstruktur und Kompetenzen 8.3 Eingeschränkte und wenig wirksame Überprüfung 8.4 Preisreglung bei Generika schafft Widerspruch zur Wirtschaftlichkeit 7828 7798 7828 7829 7830 7831 Abkürzungsverzeichnis 7833 Literaturverzeichnis 7834 Zusammenhang Bericht und Materialien 7835 Verzeichnis der Interviewpartnerinnen und -partner 7837 Impressum 7838 7799 Bericht Der vorliegende Bericht enthält die wesentlichen Ergebnisse der Evaluation. Eine ausführliche Beschreibung der Analysen und Bewertungsgrundlagen findet sich in den Materialien1. 1 Einleitung 1.1 Anlass der Evaluation Die Krankenversicherung soll gewährleisten, dass die gesamte Bevölkerung angemessen mit Medikamenten versorgt wird.2 Von der Krankenversicherung werden grundsätzlich nur Arzneimittel vergütet, die auf der so genannten Spezialitätenliste (SL) aufgeführt sind. Das Bundesamt für Gesundheit (BAG) entscheidet nach den drei gesetzlich verankerten Kriterien Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit (abgekürzt WZW), ob ein Medikament in die SL aufgenommen wird. Zusätzlich legt das BAG den durch die Versicherung bezahlten Höchstpreis fest. Damit verfügt das BAG über ein wichtiges Instrument, um den Verkaufspreis kassenpflichtiger Medikamente und folglich die Kosten eines grossen Teils des Medikamentenmarktes zu beeinflussen. Verschiedentlich ist das Verfahren für die Zulassung kassenpflichtiger Medikamente kritisiert worden.3 Die Prüfung der WZW-Kriterien durch das BAG sei mangelhaft. Zudem prüfe die Eidgenössische Arzneimittelkommission (EAK), welche das BAG berät, den möglichen Mehrwert neuer Medikamente gegenüber den bereits kassenpflichtigen Arzneimitteln zu wenig.4 Weiter greife die im Jahr 2009 neu eingeführte Überprüfung der Arzneimittel auf der SL drei Jahre nach der Zulassung zu wenig tief. Ebenfalls wurde wiederholt die Frage gestellt, wie die Wirksamkeit von komplementärmedizinischen Arzneimitteln nachgewiesen wird. Schliesslich standen die Preise der im internationalen Vergleich teuren Generika wiederholt in der Kritik.5 Vor diesem Hintergrund haben die Geschäftsprüfungskommissionen der eidgenössischen Räte (GPK) die Parlamentarische Verwaltungskontrolle (PVK) am 27. Januar 2012 mit einer Evaluation beauftragt. Dabei steht folgende Frage im Zentrum: Wie sind die Verfahren der Zulassung und Überprüfung kassenpflichtiger Medikamente 1 2 3 4 5 Vgl. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung, Materialien zum Bericht der parlamentarischen Verwaltungskontrolle zuhanden der Geschäftsprüfungskommission des Ständerates vom 13. Juni 2013. Diese finden sich in der deutschen Originalsprache unter: www.parlament.ch > Organe und Mitglieder > Kommissionen > Parlamentarische Verwaltungskontrolle> Veröffentlichungen. Im Anhang des vorliegenden Berichts befindet sich eine Übersicht, auf welche Teile der Materialien sich die einzelnen Kapitel des vorliegenden Berichts stützen. In den Materialien werden Untersuchungsgegenstand, Analysemodell und Vorgehen der Evaluation, vor allem aber die Ergebnisse ausführlicher dargestellt. Art. 25 Abs. 1 Krankenversicherungsgesetz (KVG), SR 832.10. Unter «Zulassung» wird im vorliegenden Bericht die Zulassung zur Vergütung durch die Krankenversicherung – also die Aufnahme in die SL – verstanden. Dies darf nicht mit der Marktzulassung durch Swissmedic verwechselt werden (vgl. Kapitel 2). Vgl. etwa die Motion 07.3861 «Medikamente. Wirkung statt Scheininnovation». Vgl. etwa das Postulat 09.4078 «Für eine kostenbewusstere Medikamentenversorgung». 7800 zu beurteilen? Gemäss Entscheid der zuständigen Subkommission EDI/UVEK der GPK des Ständerates vom 19. April 2012 sollen sowohl herkömmliche als auch komplementärmedizinische Arzneimittel und Generika berücksichtigt werden und insbesondere die Verfahren der Preisfestsetzung untersucht werden. 1.2 Vorgehen und Methodik Um das Verfahren der Zulassung und Überprüfung kassenpflichtiger Medikamente zu beurteilen, wurden die Verfahren aus drei unterschiedlichen Blickwinkeln untersucht: aus einer rechtlichen, einer vollzugsorientierten und einer international vergleichenden Perspektive. Aus rechtlicher Sicht wird geprüft, ob die Normen in den Gesetzen, Verordnungen und Reglementen präzise sind, ob es Doppelspurigkeiten oder Widersprüche gibt und ob im Verfahren die Zuständigkeiten klar geregelt sind. Hierzu wurde ein Rechtsgutachten in Auftrag gegeben, das die geltende Rechtslage anhand der klassischen juristischen Erkenntnismittel (umfassende Analyse der Rechtsgrundlagen, der Materialien, der Praxis und der Literatur) analysiert und kritisch würdigt. Das Rechtsgutachten wurde von Prof. Dr. Thomas Gächter der Universität Zürich unter Mitarbeit von Frau Arlette Meienberger erstellt. Hinsichtlich des Vollzugs wird von der PVK bewertet, inwiefern die WZWKriterien aus Sicht der beteiligten Akteure konkretisiert und umgesetzt sind, wie die Verfahrensschritte ablaufen, wie die Gesuche um Zulassung konkret beurteilt werden und wie all diese Aspekte die SL beeinflussen. Dazu wurden einerseits im Rahmen von Fallstudien acht Zulassungsdossiers genau überprüft sowie weitere acht Fälle mit einem Fokus auf die Preisfindung analysiert. Andererseits führte die PVK Interviews mit beteiligten Akteuren durch. Aus international vergleichender Perspektive stellt sich die Frage, wie die Schweizer Verfahren der Zulassung und Überprüfung kassenpflichtiger Medikamente im Vergleich zu anderen westlichen Ländern zu beurteilen sind. Dazu wurden anhand von Literatur- und Dokumentenrecherchen verschiedene Aspekte des schweizerischen Systems (Organisation des Verfahrens, Kriterienkatalog, Instrumente, Preisfestsetzungsverfahren, Transparenz) mit Deutschland und Österreich verglichen, die beide ebenfalls über eine obligatorische Krankenpflegeversicherung verfügen. Der internationale Vergleich wurde von Prof. Dr. Tilman Slembeck der Universität St. Gallen unter Beizug von Länderexperten erarbeitet. Die Evaluation fokussiert auf die Zulassung und Überprüfung von schulmedizinischen6 Originalpräparaten. Daneben wurden aber auch komplementärmedizinische Arzneimittel und Generika betrachtet. Die Erkenntnisse lassen sich nicht auf alle weiteren Gesuchsarten (wie Co-Marketing-Arzneimitteln andere Packungsgrössen und Dosisstärken) übertragen, jedoch deckt diese Auswahl eine grosse Mehrheit der Zulassungen ab. 6 Im Gesetz werden konventionelle Arzneimittel, die auf naturwissenschaftlichen Erkenntnissen und Beweisen beruhen, auch als Allopathie bezeichnet. Dies bedeutet die Krankheitsbehandlung, bei der Mittel zur Bekämpfung der Krankheitsursache angewandt werden. Im vorliegenden Bericht wird die Bezeichnung Schulmedizin verwendet. 7801 Zur Sicherstellung der fachlichen Qualität der Evaluation hat Dr. Josef Hunkeler (ehemaliger Mitarbeiter des Preisüberwachers und dort Dossierzuständiger für Medikamente) die Arbeiten begleitet. 1.3 Aufbau des Berichts Das folgende zweite Kapitel erläutert die rechtlichen Vorgaben und stellt die Verfahren im Überblick dar. Anschliessend werden die Erkenntnisse der Evaluation in fünf Kapiteln zusammengefasst. Das dritte Kapitel stellt die Verfahrensstruktur und dabei die unklare Kompetenzaufteilung zwischen dem BAG und der EAK ins Zentrum. Ebenfalls wird die problematische Ressourcensituation thematisiert. Im vierten Kapitel werden die WZW-Kriterien bewertet. Dabei kommt in erster Linie die unpräzise Konkretisierung dieser Kriterien zum Vorschein. Im Rahmen des abschliessenden Entscheides durch das BAG – dargelegt im fünften Kapitel – werden die mangelnde Transparenz und die oft unklare Gewichtung der Instrumente ausgeführt. In Kapitel sechs wird das Verfahren der Überprüfung betrachtet. Dieses neu eingeführte Verfahren wird aufgrund seines engen Fokus auf den Auslandpreisvergleich als unzweckmässig beurteilt. Die Auswirkungen der diskutierten Aspekte auf die SL, die vom Umfang her jährlich wächst, werden im siebten Kapitel beleuchtet. Zum Schluss werden vier zentrale Folgerungen aus der Evaluation gezogen. 2 Die Zulassung und Überprüfung von Medikamenten im Überblick Die Arzneimittel, die von der obligatorischen Krankenpflegeversicherung vergütet werden, sind auf der Spezialitätenliste (SL) aufgeführt. Das BAG erstellt diese Liste gemäss Krankenversicherungsgesetz (KVG) nach Anhören der Eidgenössischen Arzneimittelkommission (EAK).7 Damit Leistungen von der Krankenversicherung vergütet werden, müssen sie sämtliche WZW-Kriterien erfüllen, d.h. wirksam, zweckmässig und wirtschaftlich sein (Art. 32 Abs. 1 KVG). Die SL enthält zusätzlich zu den Originalpräparaten auch Generika, also Arzneimittel mit dem gleichen Wirkstoff wie ein Originalpräparat, die mit diesem austauschbar sind und preisgünstiger angeboten werden. Da es sich bei der SL um eine sogenannte «Positivliste» handelt, sind die Versicherer verpflichtet, die aufgeführten Arzneimittel zu vergüten. Die Liste gibt dabei für jede Packung und Dosierung den Fabrikabgabepreis (FAP) und den Höchstpreis an, zu dem die Versicherung das Medikament vergüten muss (so genannter Publikumspreis, PP).8 Damit ein Arzneimittel in die SL aufgenommen wird, muss von Swissmedic zumindest der Vorbescheid vorliegen9 und der Arzneimittelhersteller muss ein entsprechendes Gesuch an das BAG stellen. Eine Pflicht zur Antragsstellung besteht jedoch 7 8 9 Die jeweils gültige Liste ist abrufbar unter www.sl.bag.admin.ch. Der FAP wird vom BAG festgelegt und widerspiegelt die Kosten für die Herstellung und den Vertrieb der Herstellungs- und der Vertriebsfirma bis zur Ausgabe ab Lager. Der PP besteht aus dem FAP und dem Vertriebsanteil, der insbesondere die mit dem Transport, der Lagerhaltung, der Abgabe und dem Inkasso verbundenen Betriebs- und Investitionskosten beinhaltet (Art. 67 KVV). Für die definitive Aufnahme in die SL muss aber die definitive Marktzulassung vorliegen. 7802 nicht.10 Die Marktzulassung hat nur einen indirekten Einfluss auf den Prozess der Zulassung und Überprüfung kassenpflichtiger Medikamente, der im Zentrum des Interesses dieser Evaluation steht. Die Aufnahme in die SL beruht auf einer vom BAG erlassenen Verfügung. Für Preisanpassungen, Änderungen im Bereich der Limitierung11, Indikation oder Menge muss das BAG ebenfalls eine Verfügung erlassen. Sämtliche Verfügungen können mit einer Beschwerde beim Bundesverwaltungsgericht angefochten werden. Abbildung 1 zeigt den groben Ablauf der Zulassung und der Überprüfung kassenpflichtiger Medikamente, wie er im Handbuch SL12 vorgegeben ist. Auf der linken Seite sind die am Prozess beteiligten Akteure aufgelistet. Abbildung 1 Prozessablauf der Zulassung und der Überprüfung kassenpflichtiger Medikamente Legende: Die Felder und Pfeile mit gestrichelter Umrandung stellen das vorgelagerte Verfahren der Marktzulassung dar. Abkürzungen: vgl. Abkürzungsverzeichnis. 10 11 12 Damit die gesundheitliche Versorgung auf jeden Fall gewährleistet ist, hat der Bundesrat nach Art. 70 KVV die Möglichkeit geschaffen, dass das BAG ein von Swissmedic zum Markt zugelassenes Arzneimittel, das für die medizinische Behandlung von grosser Bedeutung ist, auch ohne Antrag des Arzneimittelherstellers oder gegen dessen Antrag in die SL aufnehmen oder darin belassen kann. Die Limitation ist dazu da, um ein Arzneimittel resp. deren Vergütung auf eine gewisse Indikation oder Gruppe einzuschränken. Handbuch betreffend die Spezialitätenliste (SL), 1. September 2011, Stand am 1. März 2013 (Handbuch SL). 7803 Zum Verständnis der Abbildung sind folgende Punkte zu erwähnen: (1) Der Arzneimittelhersteller reicht beim BAG ein Gesuch für die Aufnahme in die SL ein. Dieses Gesuch enthält u. a. den Marktzulassungsentscheid oder den Vorbescheid von Swissmedic, die drei wichtigsten klinischen Studien und verschiedene Formulare zu den Merkmalen des Arzneimittels (je nach Arzneimittelkategorie gibt es leichte Abweichungen). (2) Im Rahmen von ordentlichen und beschleunigten Verfahren unterbreitet das BAG die Gesuchsunterlagen der EAK. Die EAK begutachtet das Gesuch nach den WZW-Kriterien und gibt eine Empfehlung zuhanden des BAG ab. (3) Bei einfachen Verfahren, wie sie z.B. bei Generika angewandt werden, wird die EAK nicht einbezogen. Die Wirksamkeit wird durch die Marktzulassung durch Swissmedic, bzw. durch die Kassenzulässigkeit des Originalpräparates, als gegeben betrachtet. (4) Das BAG entscheidet aufgrund der WZW-Kriterien und der Empfehlung der EAK, ob ein Arzneimittel in die SL aufgenommen wird,13 und legt einen Höchstpreis fest. Dazu dienen die beiden Instrumente des Auslandpreisvergleichs (APV) und des therapeutischen Quervergleichs (TQV). Das BAG kann die Aufnahme in die SL mit Auflagen verbinden oder zeitlich befristen. (5) Sind die Voraussetzungen nicht erfüllt, teilt das BAG der Gesuchstellerin unter Angabe der Gründe mit, dass das Gesuch ganz oder teilweise abgewiesen wird. Wurde der Preis zu hoch angesetzt, kann dieser vom Hersteller angepasst werden (in der Grafik als «C» bezeichnet). Die Gesuchstellerin kann dann ein Neuüberprüfungsgesuch einreichen, wenn mit zusätzlichen Studien oder Gutachten neue Evidenz vorliegt (in der Grafik als «A» bezeichnet). Darin muss sie begründen, weshalb sie mit dem Entscheid des BAG nicht einverstanden ist. In der Folge nimmt das BAG Stellung. Nachdem das BAG eine Verfügung versandt hat, kann der Arzneimittelhersteller innert 30 Tagen beim Bundesverwaltungsgericht rekurrieren. Wird keine Beschwerde erhoben, so ist – nach Ablauf dieser Rechtsmittelfrist – eine Verfügung in Rechtskraft erwachsen. Der Arzneimittelhersteller kann ein Wiedererwägungsgesuch (in der Grafik als «B» bezeichnet) einreichen. (6) Alle drei Jahre sowie nach Patentablauf oder nach einer Indikationserweiterung findet eine Überprüfung der Bedingungen für die Kassenpflicht durch das BAG statt. Folglich wird jährlich ca. ein Drittel der auf der SL aufgeführten Arzneimittel überprüft. Die Arzneimittelhersteller müssen dem BAG die nötigen Informationen zum Arzneimittel vorlegen. Im Rahmen der Überprüfung wird die EAK in der Regel nicht einbezogen.14 13 14 In der Regel erlässt das BAG innert 60 Tagen nach der Sitzung der EAK die entsprechende Verfügung (Handbuch SL A.4.2). Auf den 1. eines Monats setzt das BAG Änderungen der SL in Kraft (Handbuch SL A.8.1). Bei der Überprüfung nach einer Indikationserweiterung wird die EAK einbezogen. 7804 3 Verfahrensstruktur, Kompetenzaufteilung und Ressourcen In diesem Kapitel wird aufgezeigt, dass das Verfahren zur Zulassung von kassenpflichtigen Medikamenten in der Schweiz nicht nach den international üblichen Schritten abläuft. Dies zeigt sich einerseits darin, dass die Schritte nicht mit einem klaren Ergebnis abgeschlossen werden und andererseits in der unklaren Kompetenzaufteilung zwischen den beteiligten Akteuren. Die Akteure verfügen über sehr bescheidene Ressourcen, was sich einerseits auf die Qualität der Entscheide und andererseits auf die Verfahrensdauer auswirken dürfte. 3.1 Verfahren in internationaler Perspektive Die Verfahrensstruktur entspricht, wie in diesem Abschnitt dargelegt, nicht den internationalen Gepflogenheiten. In der internationalen Literatur werden Verfahren der Kassenzulassung von Medikamenten (englisch «reimbursement») in drei Schritte eingeteilt, für die verschiedene Akteure zuständig sind: 1. Medizinisch-therapeutische Beurteilung (Assessment): In diesem Prozessschritt werden die Wirksamkeit, der therapeutische Wert, der Patientennutzen sowie ein allfälliger Zusatznutzen eines Medikaments ermittelt. Zuständig hierfür sind Fachleute, in der Regel eine Expertengruppe. Ergebnis ist ein Bericht mit einer Empfehlung, ob das Medikament namentlich aufgrund seiner Wirksamkeit kassenpflichtig werden soll. Demgegenüber prüft Swissmedic im Rahmen der Marktzulassung einzig, ob bei einem Arzneimittel eine Wirksamkeit besteht und ob diese den möglichen Schaden übersteigt. 2. Gesundheitspolitisch-gesellschaftliche Beurteilung (Appraisal): Bei diesem Schritt werden die Ergebnisse des Assessments gewichtet, indem gesundheitspolitisch und gesellschaftlich relevante Aspekte, wie der Zugang zu Leistungen, die mögliche Stigmatisierung bestimmter Bevölkerungsgruppen, und die nachhaltige Finanzierbarkeit der Leistungen, berücksichtigt werden. Für diese Aufgabe ist ein Gremium von Interessenvertretern bzw. Anspruchsgruppen mit verschiedenen Perspektiven zuständig. Ergebnis ist ein weiterer Bericht mit Empfehlung zur Kassenpflicht und zum Preis. 3. Politische Entscheidung (Decision): Basierend auf den Berichten und Empfehlungen des Assessments und Appraisals wird die definitive Entscheidung gefällt, ob ein Arzneimittel von der Krankenversicherung bezahlt wird und zu welchem Preis. Die formelle Entscheidungskompetenz liegt bei einer staatlichen Stelle. Durch die verschiedenen Schritte und deren Zuweisung an unterschiedliche Akteure sollen fach- und stufengerechte Beurteilungen und Entscheidungen gewährleistet werden. Den drei Schritten vorgelagert ist die Marktzulassung, die im gesamten EU-Raum durch eine unabhängige Institution erfolgt, die neue Medikamente auf ihre Qualität und Sicherheit prüft, aber nicht die Frage der Bezahlung durch die Sozialversicherung klärt. 7805 In Deutschland ist die institutionelle Trennung der Schritte Assessment (Expertengruppe)15, Appraisal (Gremium von Interessenvertretern) und Decision (Staat) vollständig und in Österreich weitgehend umgesetzt. In der Schweiz hingegen wird zwar die Marktzulassung durch eine unabhängige Institution (Swissmedic) entschieden, doch fehlt im Verfahren der Kassenzulassung die Trennung der drei Schritte Assessment, Appraisal und Decision. Namentlich werden die beiden Beurteilungsschritte medizinisch-therapeutische Beurteilung (assessment) und die gesundheitspolitisch-gesellschaftliche Beurteilung (appraisal) im Verfahren überhaupt nicht unterschieden. Klar erkennbar ist lediglich der Verfahrensschritt des formellen Entscheids: Es ist das BAG als staatliche Stelle, das die Verfügung erlässt, ob ein Arzneimittel in die SL aufgenommen wird oder nicht (vgl. zu diesem Schritt Abschnitt 5). Das BAG ist allerdings zusammen mit der EAK auch für das Assessment und das Appraisal zuständig. Es fällt somit die Entscheidung zumindest teilweise aufgrund der eigenen Beurteilung, womit eine institutionelle Trennung der Verfahrensschritte fehlt. 3.2 Kompetenzaufteilung zwischen den Akteuren Nicht nur fehlt die klare Trennung der Verfahrensschritte, zusätzlich ist die Kompetenzaufteilung im Rahmen der Beurteilung zwischen BAG und EAK unklar. Das Hauptproblem besteht darin, dass die rechtlichen Grundlagen die Kompetenzen von BAG und EAK bei der Beurteilung der Gesuche nicht eindeutig festlegen, was im Vollzug zu Unklarheiten und Doppelspurigkeiten führt. Rechtliche Grundlagen Aus rechtlicher Sicht sind sowohl das BAG als auch die EAK für die Beurteilung der Gesuche nach den WZW-Kriterien (vgl. Kap. 4) zuständig. Die EAK hat dabei eine beratende Funktion, während das BAG die Entscheidkompetenz innehat (vgl. Kap. 5). Weder die Verordnungen noch das Handbuch SL regeln allerdings genau, wer bei der Beurteilung wofür verantwortlich ist. Das Handbuch SL legt lediglich fest, dass das BAG insbesondere die Wirtschaftlichkeit prüft. Das Rechtsgutachten leitet daraus ab, dass die Wirksamkeit und die Zweckmässigkeit primär von der EAK beurteilt werden muss und das BAG diesbezüglich der Einschätzung der EAK in der Regel folgen sollte. Laut den rechtlichen Grundlagen teilt die EAK jedes Arzneimittel nach der Beurteilung im Sinne einer Empfehlung an das BAG in eine der folgenden Kategorien ein (Art. 31 Abs. 2 KLV)16: (a) medizinisch-therapeutischer Durchbruch; (b) therapeutischer Fortschritt; (c) Kosteneinsparung im Vergleich zu anderen Arzneimitteln; (d) kein therapeutischer Fortschritt und keine Kosteneinsparung; (e) unzweckmässig für die soziale Krankenversicherung. Das Handbuch SL führt eine zusätzliche Kategorie ein: «dp: kein therapeutischer Fortschritt und keine Kosteneinsparung, Kostenfrage». Bei dieser Kategorie handelt es sich laut BAG um Medikamente mit einem 15 16 Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) ist ein fachlich unabhängiges, rechtsfähiges, wissenschaftliches Institut. Verordnung des EDI über Leistungen in der obligatorischen Krankenpflegeversicherung (Krankenpflege-Leistungsverordnung, KLV), SR 832.112.31, Verordnung über die Krankenversicherung (KVV), SR 832.102. 7806 neuen Wirkstoff, die jedoch keinen therapeutischen Zusatznutzen erkennen lassen, weshalb die Kassenzulassung eine reine Preisfrage ist, die das BAG aushandeln soll. Umsetzung der Kompetenzen In der Umsetzung sind die Aufgaben bei der Beurteilung jedoch nicht so aufgeteilt. Vielmehr prüft das BAG, nachdem es ein Gesuch erhält, ob alle erforderlichen Unterlagen entsprechend den Check-Listen vorhanden sind, bevor es das Dossier an die EAK weiterleitet. Das BAG wie auch die EAK prüfen danach die Dossiers inhaltlich. Die Mitglieder der EAK verstehen ihre Aufgabe unterschiedlich. Die einen sehen den Kern ihrer Aufgabe darin, die im Gesuch mitgelieferten Studien zur Wirksamkeit der Arzneimittel zu überprüfen und damit ein Assessment vorzunehmen. Andere dagegen vertreten die Meinung, die EAK sei eine Stakeholderkommission, in der es um ein breit abgestütztes Appraisal gehe. Für das BAG nimmt die EAK beide Funktionen wahr: sie soll einerseits fachliche Lücken füllen und andererseits die Gesuche hinsichtlich dem Mehrwert für das schweizerische Gesundheitswesen beurteilen. Auch die personelle Zusammensetzung der Kommission widerspiegelt die doppelte Funktion: Vertreten sind sowohl Experten wie auch Stakeholder, z.B. Vertreter der Arzneimittelhersteller oder der Krankenversicherer.17 In der Praxis finden in der EAK zwar Diskussionen zum medizinischen Nutzen und den dafür gerechtfertigten Kosten statt, jedoch teilt die Kommission die Gesuche nicht wie von der KLV gefordert explizit einer der Kategorien a–e zu. Einzelne Mitglieder der EAK geben an, von diesen Kategorien noch gar nie gehört zu haben. Die Zuteilung wird stattdessen durch das BAG selber aufgrund der Ergebnisse der Diskussionen, denen es beiwohnt, vorgenommen. Das BAG begründet dies damit, die Kategorien seien nicht zweckmässig; die meisten Gesuche würden allemal in die Zusatzkategorie «dp» fallen. Diese werden aber auch ohne Zusatznutzen nicht als Generikum, sondern als Originalpräparat behandelt, da sich das BAG bei der Differenzierung zwischen Original und Generikum auf die Einordnung der Arzneimittel von Swissmedic abstützt. Im Vergleich mit dem Ausland ist im schweizerischen System die Distanz zwischen den Instanzen, die für die Beurteilung zuständig sind – die beauftragte Sektion bzw. Abteilung des BAG sowie die EAK − und der Entscheidungsinstanz im BAG gering. Diese mangelnde Distanz kann dazu führen, dass die Gesuche nicht unabhängig beurteilt bzw. entschieden werden. Auf den 1. Januar 2012 ist die Unabhängigkeit der EAK gestärkt worden, indem ihr Präsident künftig nicht mehr durch das BAG gestellt wird. Dies wird von allen Seiten begrüsst. Dennoch nimmt das BAG im Verfahren gemäss den rechtlichen Grundlagen weiterhin mehrere Funktionen wahr. Beizug externer Experten Verschiedentlich werden nach einer ersten Behandlung eines Gesuchs durch die EAK externe Experten beigezogen. Dies geschieht ohne klare Systematik. Faktisch steht man zu diesem Zeitpunkt schon im Appraisal, Expertenwissen müsste jedoch in die medizinisch-therapeutische Beurteilung – also ins Assessment – einfliessen. Der Einbezug externer Experten geschieht nach Auffassung der PVK eher spät. Das 17 Zur personelle Zusammensetzung der EAK vgl. www.admin.ch/ch/d/cf/ko/index_311.html (Stand 20.1.2013) 7807 Gesuch mit dem zusätzlichen Gutachten muss dann in der EAK ein weiteres Mal traktandiert werden, was den Prozess in die Länge zieht. Indes erweist es sich für das BAG manchmal als schwierig, unabhängige Experten zu finden. Grund dafür ist einerseits die Kleinheit der Schweiz, die dazu führt, dass es nicht allzu viele Experten gibt, und andererseits die Tatsache, dass viele Forschende mit der Pharmaindustrie eng zusammenarbeiten und deshalb nur beschränkt unabhängig sind und sich häufig nicht exponieren wollen. Deshalb ist es laut BAG auch notwendig, Expertengutachten, die von den Arzneimittelherstellern mit ihren Gesuchen eingereicht werden, kritisch zu prüfen. 3.3 Ressourcen Die Ressourcenausstattung des BAG und der EAK reichen für eine fundierte Beurteilung der Gesuche nicht aus. Die zuständige Sektion beim BAG verfügt nicht über die zeitlichen Ressourcen, um die Gesuche vertieft beurteilen zu können.18 Beim Mitarbeiterbestand der Sektion Medikamente handelt es sich zum gegenwärtigen Zeitpunkt um 460 Stellenprozente bei den Apothekerinnen und Apotheker und um 240 Stellenprozente bei den Juristinnen und Juristen. Ausserdem wurde von verschiedener Seite bemängelt, dem BAG fehle vereinzelt spezialisiertes Wissen.19 Noch ausgeprägter ist der Mangel an Ressourcen für eine fundierte Beurteilung bei der EAK. Aufgrund der hohen Anzahl Gesuche und deren Komplexität gerät das System der ausserparlamentarischen Milizkommission an seine Grenzen. Ein Problem stellt der grosse Aufwand dar. Viele Mitglieder der EAK begutachten aufgrund der grossen Zahl an Gesuches nur einen Teil davon. Andere Mitglieder besprechen die Gesuche in Arbeitsgruppen mit weiteren Interessensvertretern, die nicht Mitglied der EAK sind, was aufgrund der Vertraulichkeit der Dossiers nicht erlaubt wäre. Im Gegensatz zu Swissmedic, die den Mitgliedern der Expertenkommission auch die Vorbereitungszeit pauschal vergütet, erhalten die Mitglieder der EAK hierfür keine Entschädigung. Ebenfalls fehlt der EAK ein eigenes und unabhängiges Sekretariat. Die Unterstützung durch das BAG wird von den EAK-Mitgliedern positiv beurteilt. Für die Behandlung der Gesuche sind vier Sitzungen pro Jahr vorgesehen.20 Hinzu kommt eine Sitzung für die Diskussion von Grundsatzfragen. Ein Sitzungstag wird mit 400 Franken vergütet. Für eine sorgfältige Beurteilung aller Gesuche wird die Sitzungszahl mehrheitlich als zu knapp erachtet. Eine höhere Sitzungskadenz würde zwar die Arbeitslast nicht verringern, jedoch die Vergütung etwas erhöhen und die Verfahren beschleunigen. Dass das Schweizer System mit bescheidenen Ressourcen ausgestattet ist, wird gerade im Vergleich zu Deutschland und Österreich deutlich, wo entsprechend der oben erwähnten organisatorischen Trennung verschiedene Evaluationseinrichtungen existieren, die jeweils mit massgeblichen eigenen Ressourcen ausgestattet sind. 18 19 20 Anpassungen der KVV per 1.6.2013 beinhalten eine Erhöhung der Gebühren (Art. 71). Dadurch sollen die personellen Ressourcen beim BAG schrittweise erhöht werden. Kritisiert wird namentlich, dass in der Sektion gegenwärtig keine Person über spezifisches Wissen im Bereich der Komplementärmedizin verfügt. Ab dem Jahr 2014 soll die Anzahl Sitzungen, an denen Gesuche behandelt werden, von vier auf sechs erhöht werden. 7808 3.4 Verfahrensdauer Die Verfahrensdauer, die speziell von den Arzneimittelherstellern kritisiert wird, dürfte international im Rahmen liegen. Mit einer klareren Strukturierung von Verfahrensschritten und Kompetenzen sowie mit mehr Ressourcen liessen sich die Verfahren nach Ansicht der PVK möglicherweise aber beschleunigen. Einschätzungen der Verfahrensdauer Verlässliche Daten zur Dauer der Zulassungsverfahren lassen sich weder für die Schweiz noch international finden. Für die Schweiz liegen zwei Auswertungen vor, die beide auf einem beschränkten Zeitraum beruhen: eine vom BAG und eine von Interpharma, einem Branchenverband von arzneimittelherstellenden Unternehmen. Die Dauer von der Einreichung eines Gesuchs beim BAG mit einer Voranzeige von Swissmedic bis zur Aufnahme in die SL liegt gemäss diesen Daten bei einem Median von 164 respektive 181 Tagen.21 Solche Verzögerungen lassen sich nicht ausschliesslich dem BAG zuschreiben. Verschiedentlich liegen Gesuche über Monate bei den Herstellern, da sie auf neue Studienergebnisse oder auf eine Zulassung in einem anderen Land warten. Von den Akteuren wird die Verfahrensdauer, wie die Vollzugsevaluation zeigt, unterschiedlich beurteilt. Die Arzneimittelhersteller bezeichnen die Bearbeitung der Gesuche häufig als zu langsam und moniert, dass das BAG oftmals kleinlich handle und teilweise weltfremde Preisvorstellungen habe, auf welche die Hersteller nicht eingehen könnten. Dies führe zu Verzögerungen. Das BAG sieht die Gründe für die Verzögerungen bei den überhöhten und unrealistischen Preisforderungen, die die Arzneimittelhersteller einreichen, sowie bei unvollständig eingereichten Gesuchen. Dass die Verfahren in der Schweiz langsam seien, lässt sich aufgrund des Vergleichs mit Deutschland, wo Verfahren in der Regel zwischen sechs und zwölf Monaten dauern, nicht erhärten.22 Für die Sparte der Generika ist die Bearbeitungsgeschwindigkeit laut Aussagen der Generikaindustrie kein Problem, da beim Kriterium des Preises kein Handlungsspielraum besteht (vgl. Abschnitt 4.4). Das BAG behandle Gesuche zunehmend schneller. Die Erkenntnisse aus Kapitel 3 geben verschiedene Hinweise darauf, welche Faktoren die Bearbeitungsgeschwindigkeit der Gesuche beeinflussen dürften. Im Zentrum steht auch hier, dass die Verfahrensschritte Assessment und Appraisal von mehreren Akteuren durchgeführt werden, nämlich durch das BAG wie auch die EAK und teilweise zusätzlich durch Expertinnen und Experten. Ist letzteres der Fall, muss das Dossier noch einmal in der EAK behandelt werden. Solche Schleifen und Mehr- 21 22 Die Differenz lässt sich mit den unterschiedlichen Erhebungszeiträumen erklären. In beiden Auswertungen wird ersichtlich, dass die Durchschnittswerte stark von einigen wenigen Gesuchen mit einer enorm langen Dauer nach oben gezogen werden. Die Werte der arithmetischen Mittel sind mit 185 resp. 258 Tagen klar höher als der jeweilige Median. Gemäss den mit Vorsicht zu geniessenden Daten von EFPIA ist die Zulassungsdauer in der Schweiz im internationalen Vergleich tendenziell eher kurz (European Federation of Pharmaceutical Industries and Associations 2010). 7809 fachbehandlungen führen zu Verzögerungen, zumal die EAK aktuell nur viermal jährlich tagt.23 4 Beurteilung anhand der WZW-Kriterien Die WZW-Kriterien sind für die Anwendung durch die EAK und das BAG nur unzureichend präzisiert. Zudem wird der Nutzen der Medikamente in der aktuellen Praxis nur beschränkt bewertet. Damit Leistungen von der Krankenversicherung vergütet werden, müssen sie sämtliche WZW-Kriterien erfüllen, d.h. wirksam, zweckmässig und wirtschaftlich sein (Art. 32 Abs. 1 KVG). Die Kriterien werden in der angegebenen Reihenfolge beurteilt. Ein Arzneimittel, das nicht wirksam ist, braucht in der Folge gar nicht erst auf seine Zweckmässigkeit und Wirtschaftlichkeit hin geprüft zu werden. Die Definition und Anwendung der einzelnen Kriterien wird zunächst allgemein für den Bereich der Schulmedizin beschrieben und bewertet, bevor gesondert auf die WZWBeurteilung von Generika und komplementärmedizinischen Arzneimitteln eingegangen wird. Insgesamt kann aus rechtlicher Sicht für den schulmedizinischen Bereich festgehalten werden, dass die Operationalisierung der WZW-Kriterien gesetzmässig und abgesehen von Ausnahmen widerspruchsfrei und stringent ist. Im Vergleich zu Deutschland und Österreich ist der Kriterienkatalog grundsätzlich ähnlich, jedoch sind die einzelnen Kriterien im Falle der Schweiz sehr allgemein gehalten und wenig präzisiert. Wie die Vollzugsevaluation aufzeigt, sind die Kriterien für die meisten am Prozess beteiligten Akteure sodann mehrheitlich nicht ausreichend konkretisiert. Namentlich führt die fehlende Präzisierung des Kriteriums der Wirksamkeit zu Schwierigkeiten bei der Beurteilung aller drei Kriterien, denn die Zweckmässigkeit und die Wirtschaftlichkeit bauen auf der Wirksamkeit auf. Bei komplementärmedizinischen Arzneimitteln ist ebenfalls die Anforderung an den Wirksamkeitsnachweis ungenügend klar, während die Kriterien der Zweckmässigkeit und der Wirtschaftlichkeit angemessen sind. Bei Generika erweist sich dagegen das Instrument zur Beurteilung der Wirtschaftlichkeit als problematisch. Die WZW-Kriterien werden vom BAG und von der EAK bei jedem Gesuch stets angewendet. Dazu tragen das Handbuch SL und die dazugehörigen Formulare bei, welche die Anforderungen an die Gesuchstellenden konkretisieren und eine effiziente Bearbeitung der Gesuche unterstützen.24 4.1 Wirksamkeit Auch wenn aus rechtlicher Sicht das Kriterium der Wirksamkeit – in anderen Worten der therapeutische Nutzen – klar definiert ist, zeigt sich in der Praxis eine mangelnde Operationalisierung um ein Gesuch fundiert zu beurteilen. 23 24 Das BAG verfügt nach der angepassten KLV vom 1.6.2013 (Art. 31 Bst. 5) die Aufnahme in die SL innert 60 Arbeitstagen, sofern die Gesuche vollständig und mit Voranzeige von Swissmedic eingereicht wurden. Von allen Akteuren werden die seit Januar 2012 eingesetzten Formulare sowie Konkretisierungen, die das BAG im Handbuch SL vorgenommen hat, positiv beurteilt. 7810 Artikel 65a KVV25 schreibt vor, dass die Wirksamkeit eines schulmedizinischen Arzneimittels anhand von klinisch kontrollierten Studien beurteilt werden muss. Artikel 32 KLV bestimmt ausserdem, dass sich das BAG bei seiner Beurteilung der Wirksamkeit auf die Unterlagen von Swissmedic stützt, wobei es von den Gesuchstellerinnen weitere Unterlagen verlangen kann. Diese rechtlichen Anforderungen an die Wirksamkeit werden durch das Rechtsgutachten als klar beurteilt, namentlich weil die Form der erforderlichen Studien definiert ist (klinisch kontrollierte Studien). Präzisierung der Kriterien Die beteiligten Akteure sehen dies hingegen mehrheitlich anders. Sie gehen davon aus, dass der Wirksamkeitsnachweis – basierend auf den Unterlagen von Swissmedic, nicht für eine Aufnahme in die SL genügt. Swissmedic verlangt in der Regel zwar ebenfalls klinisch kontrollierte Studien, welche jedoch die Wirksamkeit eines Medikaments gegenüber einem Placebo nachweisen. Der Nutzen eines Arzneimittels kann entweder mit klarer Definition von Kriterien (z.B. Operationalisierung der Lebensqualität) oder gegenüber einem anderen Arzneimittel beurteilt werden. Für Ersteres bestehen keine klar definierten Indikatoren. Eine systematische Bewertung im Vergleich zu bestehenden Arzneimitteln würde eine Klassifizierung von Wirkstoffgruppen und die Definition eines Referenzstandards (theoretisch beste und kosteneffektivste Therapie) erfordern. Mit diesem Standard müsste der Nutzen jedes neue Arzneimittel in der Gruppe verglichen werden. Dies wird beispielsweise in Deutschland so gemacht, indem auf den zusätzlichen Nutzen abgestellt wird, welcher sich für die Patientinnen und Patienten ergibt. In der Schweiz ist die relative Wirksamkeit in den rechtlichen Grundlagen hingegen nicht explizit vorgesehen. Ob und wie Studien zur relativen Wirksamkeit beurteilt werden sollen, bleibt demnach unklar. Mehrheitlich legen die Gesuchstellenden den Gesuchen nur Studien mit Vergleichen gegenüber einem Placebo bei. Die Berichte von Swissmedic, in welchen eine grössere Anzahl von Studien begutachtet wird, sind nach Artikel 63 HMG26 für das BAG nicht zugänglich. Die Daten liegen nur den Vollzugsbehörden des HMG offen, wozu das BAG nicht zählt.27 Dem BAG und der EAK fehlen damit wesentliche Informationen. Während Swissmedic die spezifischen Anforderungen an Studien zur Marktzulassung mit den Arzneimittelherstellern klärt, bevor diese ihr Gesuch einreichen, gibt es im Rahmen der Zulassung zur Kassenpflicht keine ähnliche Möglichkeit für das BAG. Das BAG versichert sich bei Gesuchen ohne Studien zur relativen Wirksamkeit fallweise über Partnerinstitutionen im Ausland, ob keine solchen existieren. Falls nicht, werden Vergleiche über mehrere Studien (indirekte Vergleiche) angestellt. Dies ist jedoch äusserst schwierig und führt oftmals zu ausgiebigen Diskussionen zwischen dem BAG, der EAK und – nach dem Entscheid – zwischen dem BAG und den Gesuchstellenden. Das Einfordern der Durchführung neuer Studien ist für das BAG aufgrund der langen Dauer solcher Untersuchungen schwierig. 25 26 27 Verordnung über die Krankenversicherung (KVV), SR 832.102. Bundesgesetz über Arzneimittel und Medizinprodukte (HMG), SR 812.21. Eine Ausweitung der Informationsrechte auf das BAG steht im Rahmen der aktuellen HMG-Revision zur Diskussion. 7811 Anforderung an die Wirksamkeit in Vergleichsländern International werden allgemein höhere Anforderungen gestellt, wenn das Arzneimittel durch die Krankenversicherung finanziert werden soll. So wird beispielsweise in Deutschland die Qualität der eingereichten Studien klassifiziert und die Stärke ihrer Aussagekraft bei der Bewertung der Wirksamkeit berücksichtigt. Ausserdem ist in den meisten Ländern der EU die relative Wirksamkeit respektive sogar der Zusatznutzen im Vergleich zu bestehenden Alternativen zu belegen. Bei den Alternativen kann es sich auch um nichtmedikamentöse Leistungen handeln. Ein neues Krebsmedikament wird dabei beispielsweise mit einer Operation verglichen. Ein solcher Vergleich kann bisher in der Schweiz aufgrund fehlender rechtlicher Normen im Rahmen der Aufnahme in die SL nicht gemacht werden. Schliesslich verlangen andere Länder den Nachweis des Patientennutzens, wofür über klinische Studien hinausgehende Versorgungsstudien notwendig wären. Die meisten Befragten würden eine ausführlichere Prüfung der Wirksamkeit als sinnvoll erachten.28 4.2 Zweckmässigkeit Die Prüfung der Zweckmässigkeit eines Arzneimittels gestaltet sich gegenüber der Wirksamkeitsprüfung einfacher. Die zu beurteilenden sozialen Präferenzen sind jedoch nicht konkretisiert und werden situativ bestimmt. Gemäss Artikel 33 Absatz 1 KLV wird die Zweckmässigkeit eines Arzneimittels in Bezug auf seine Wirkung und Zusammensetzung nach klinisch-pharmakologischen29 und galenischen30 Erwägungen, nach unerwünschten Wirkungen sowie nach der Gefahr missbräuchlicher Verwendung beurteilt. Entscheidend ist demnach der diagnostische oder therapeutische Nutzen, gemessen am angestrebten Heilerfolg der möglichst vollständigen Beseitigung der körperlichen oder psychischen Beeinträchtigung, unter Berücksichtigung der damit verbundenen Risiken sowie der Missbrauchsgefahr.31 Kurz: Die Zweckmässigkeit setzt zusätzlich zur Wirksamkeit voraus, dass der Nutzen eines Medikaments (z.B. erhöhte Lebensqualität, Verminderung der Schmerzen usw.) seinen Schaden (z.B. Übelkeit als Folge von Medikamenteneinnahme, andere Therapienebenwirkungen, Mortalität usw.) übersteigt. Das BAG stützt sich für die Beurteilung der Zweckmässigkeit wiederum auf die Unterlagen, die für die Marktzulassung durch Swissmedic massgebend waren. Es kann aber auch weitere Unterlagen verlangen (Art. 33 Abs. 2 KLV). Nach der Verwaltungspraxis erfolgt die Beurteilung der Zweckmässigkeit aufgrund des Verhältnisses von Erfolg und Misserfolg (Fehlschlägen) einer Anwendung sowie 28 29 30 31 Gewünscht werden so genannte gesundheitsökonomische «Health Technology Assessments» (HTA), die rechtliche, ethische und soziale Aspekte berücksichtigen und alle medizinischen Leistungen umfassen, wobei ein einheitliches Verständnis von HTA fehlt. Die Bezeichnung wird in den verschiedenen Ländern nicht deckungsgleich verwendet. Die Komplexität und der Ressourcenbedarf für HTA sind hoch. Die Klinische Pharmakologie beschäftigt sich mit allen Aspekten der Anwendung von Arzneimitteln im Menschen und schliesst die Lücke zwischen der GrundlagenPharmakologie und der medizinischen Praxis. Die Galenik ist die Lehre von der Herstellung von Arzneimitteln. Unter der galenischen Form wird die Darreichungsform (Tablette, Granulat, Tropfen etc.) verstanden. BGE 130 V 299 E. 6.1 S. 304; BGE 129 V 32 E. 4.1 S. 37 7812 der Häufigkeit von Komplikationen.32 Dabei werden wiederum primär die in ihrem Wirksamkeitsbegriff beschränkten klinischen Studien beigezogen. Nach allgemeiner Auffassung der beteiligten Akteure zählt zur Prüfung der Zweckmässigkeit aber auch die Frage, ob ein Arzneimittel für die obligatorische Krankenpflegeversicherung erforderlich ist, womit soziale Aspekte ins Blickfeld rücken (vgl. Appraisal). Angesichts des Fehlens entsprechender Richtlinien werden die sozialen Präferenzen situativ bestimmt. Für eine einheitliche Beurteilung der Erforderlichkeit wäre zudem genauer zu bestimmen, wo ein Arzneimittel eingesetzt werden soll. 4.3 Wirtschaftlichkeit Zur Beurteilung der Wirtschaftlichkeit stehen in der Schweiz zwei Instrumente zur Verfügung: der therapeutische Quervergleich (TQV) und der Auslandspreisvergleich (APV), der auf dem durchschnittlichen FAP von sechs Vergleichsländern liegt. Beide Instrumente sind für eine fundierte Beurteilung der Wirtschaftlichkeit nur eingeschränkt zweckmässig. Ein Arzneimittel gilt gemäss den rechtlichen Grundlagen als wirtschaftlich, wenn es die geplante Heilwirkung mit möglichst geringem finanziellem Aufwand gewährleistet (Art. 65b Abs. 1 KVV). Geprüft wird die Wirtschaftlichkeit einerseits durch den TQV, bei dem mehrere Arzneimittel, die zum gleichen Behandlungszweck in der Schweiz zur Verfügung stehen, miteinander verglichen werden (Art. 65b Abs. 2 KVV und Art. 34 Abs. 2 Bst. b und c KLV), und andererseits durch den APV, bei dem der Preis des fraglichen Präparats in ausgewählten Ländern verglichen wird (Art. 65b Abs. 2 KVV und Art. 34 Abs. 2 Bst. a KLV). Die Kriterien zur Beurteilung der Wirtschaftlichkeit sind sowohl gemäss Rechtsgutachten als auch nach Auffassung der beteiligten Akteure in den rechtlichen Grundlagen sowie speziell im Handbuch SL klar und ausführlich festgelegt. Jedoch wird die Wirtschaftlichkeit im Schweizer System sehr eng definiert. Im Gegensatz zum Ausland werden keine Studien verlangt, welche die Kosten eines Medikaments ins Verhältnis zu seinem Zusatznutzen stellen. Im Falle von Deutschland werden beispielsweise neue Arzneimittel, die keinen Zusatznutzen nachweisen, mit einem (relativ tiefen) Festbetrag der Vergleichsgruppe versehen.33 Nur wenn ein Zusatznutzen anhand wissenschaftlicher Studien belegt werden kann, finden Preisverhandlungen statt. In der Schweiz fliessen ökonomische Studien hingegen nur in die Bewertung ein, falls der Gesuchsteller diese von sich aus einreicht. In der Regel liegen lediglich Schätzungen bezüglich der zu Lasten der Grundversicherung entstehenden Gesamtkosten vor. Nur indirekt, über den Vergleich mit dem Preis anderer Arzneimittel mit demselben Behandlungszweck beim TQV, werden die Kosten mit dem medizinischen Nutzen in Beziehung gesetzt. Die beiden Instrumente TQV und APV, anhand welcher die Wirtschaftlichkeit bestimmt wird, stossen in der Anwendung auf Schwierigkeiten. Da beim Nachweis der Wirksamkeit keine Vergleichsstudien mit anderen Medikamenten oder der besten verfügbaren Behandlungsalternative verlangt werden, liegen auch häufig keine solchen vor, sondern es sind höchstens indirekte Vergleiche möglich. Deshalb ist der TQV in der Anwendung oftmals umstritten. 32 33 BGE 127 V 138 E. 5 S. 146 Für Ausführungen zum Festbetragsystem siehe Internationaler Vergleich. 7813 Der APV basiert seinerseits auf ausländischen Listenpreisen, die in einzelnen Ländern um einiges höher liegen als die tatsächlich vergüteten Kosten. Denn auf den im Ausland angegebenen FAP können einerseits substanzielle Rabatte gewährt werden oder andererseits kann der tatsächliche Preis tiefer liegen, da für ein Arzneimittel nur ein Festbetrag vergütet wird. Bei den genannten Rabatten handelt es sich in der Regel um nicht öffentlich bekannte, von den Arzneimittelherstellern einzelnen Krankenversicherern gewährte Rabatte. In Deutschland verlangt der Staat bei Arzneimitteln, die aufgrund eines Zusatznutzens nicht in eine Festbetragsgruppe fallen, gegenwärtig einen Zwangsrabatt von 16 % auf den Listenpreis, den die Arzneimittelhersteller zu gewähren haben. Teilweise werden jedoch höhere Rabatte ausgehandelt. So liegt beispielsweise der FAP von Zytiga (120er-Packung à 250 mg) in Deutschland bei 5450.21 Euro.34 Dieser Preis fliesst dann auch in den APV in der Schweiz mit ein. Der Rabatt in Deutschland wurde auf knapp 1150 Euro, also auf rund 21 % und somit über dem Zwangsrabatt von 16 % ausgehandelt. Wird in der Evaluation in Deutschland kein Zusatznutzen festgestellt, wird das Arzneimittel für den Festbetrag der Wirkstoffgruppe eingeteilt. Der FAP von Sortis (100er-Packung à 20 mg) liegt beispielsweise in Deutschland bei umgerechnet 144.25 Franken.35 Der Festbetrag für die Wirkstoffgruppe, zu der Sortis zählt, ist jedoch auf 18.50 Euro festgelegt. Die Kassen bezahlen in Deutschland für Sortis deshalb in Realität nur rund 15 % des angegebenen FAP, der in der Schweiz für den APV herangezogen wird. In der Schweiz wurde der FAP für Sortis auf 130.40 Franken festgelegt. Die ausländischen Preise, die beim APV verglichen werden, sind folglich wenig aussagekräftig. 4.4 WZW-Kriterien bei Generika Die Anwendung der WZW-Kriterien gestaltet sich bei Generika einfach. Jedoch steht der fixe Preisabstand eines Generikums zum Originalpräparat im Widerspruch mit den Prinzipien des KVG und stellt im Vergleich zum Ausland ein Sondermerkmal dar. Dank Patentschutz haben die Originalpräparate in den ersten Jahren nach der Markteinführung keine Konkurrenz durch Generika.36 Die danach eingeführten Generika sind per Definition mit dem Originalpräparat austauschbar, d.h. sie enthalten die identischen Wirkstoffe (oder Wirkstoffkombinationen) in gleicher Dosierung und Darreichungsform und entfalten die gleiche Wirkung. Der Wirksamkeitsnachweis gilt gemäss rechtlichen Grundlagen deshalb bei Generika von kassenpflichtigen Originalpräparaten mit der Marktzulassung durch Swissmedic als erbracht, da von derselben Wirksamkeit ausgegangen werden kann wie beim Originalpräparat, was mit einer Bioäquivalenzstudie belegt wird. Das BAG prüft die Wirksamkeit nicht mehr. Die Zweckmässigkeit von Generika ist dann erfüllt, wenn sie in den gleichen 34 35 36 Siehe www.arznei-telegramm.de/blitz-pdf/blitz-a-t _31.01.2013.pdf (Stand 15.4.2013). Werte für die Schweiz stammen aus der SL (Stand 01.03.2013) und für Deutschland aus der Festbetragsliste (Stand 15.2.2013). Die Dauer des Patents ist auf 20 Jahre begrenzt. Aufgrund der Anforderungen, die vor der Markteinführung eines neuen Medikaments erfüllt werden müssen, während das Patent bereits läuft, wirkt der effektive Patentschutz durchschnittlich 10 Jahre. 7814 Verabreichungsformen, allen Packungsgrössen und Dosisstärken des Originalpräparates für Erwachsene angeboten werden. Ein Generikum gilt gemäss Artikel 65c KVV als wirtschaftlich, wenn dessen FAP einen gewissen Prozentsatz (je nach Marktvolumen des Originals zwischen 10 und 60 %) tiefer liegt als derjenige des mit diesem Generikum austauschbaren Originalpräparates (sogenannter fixer Preisabstand). Die rechtlichen Vorgaben für die Beurteilung von Generika nach den WZWKriterien sind klar, doch sind die Vorgaben zur Sicherstellung der Wirtschaftlichkeit ungeeignet. Die Preisabstandregelung zwischen Originalpräparaten und Generika steht im Widerspruch zum Grundsatz des KVG, gemäss dem eine qualitativ hochstehende medizinische Versorgung zu möglichst günstigen Preisen gewährleistet werden soll. Wie auch das Bundesgericht festgehalten hat, ist bei vergleichbarem medizinischem Nutzen das kostengünstigste Präparat das wirtschaftliche.37 Da das Generikum per Definition mit dem Originalpräparat austauschbar ist, ist der vergleichbare medizinische Nutzen gegeben. Weshalb eine Preisdifferenz von bis zu 60 % vorgeschrieben sein soll, damit beide Arzneimittel gleich «wirtschaftlich» sind, ist nicht ersichtlich. Die Preisabstandregelung ist im Vergleich zum Ausland ein Sondermerkmal der Schweiz. In der Schweiz ist es dem Originalhersteller durch den Preisabstand nach KVV erlaubt, von den Kassen höhere Preise zu verlangen, als für die entsprechenden Generika gelten. In Österreich dagegen wird der Preis des Originalpräparates beim ersten und dritten Generikum gesenkt. Mit dem differenzierten Selbstbehalt nach Artikel 38a KLV, gemäss dem die Versicherten beim Kauf des Originalpräparats trotz vorhandenem Generikum 20 % statt nur 10 % der Kosten selber tragen müssen, wollen die Schweizer Behörden die Originalhersteller zwar ebenfalls Preissenkungen anregen, doch kann die Wirkung noch nicht eindeutig eruiert werden. Den grundsätzlichen Widerspruch zum gesetzlichen Ziel der Wirtschaftlichkeit wird dadurch nicht korrigiert. Würde der Preis von Generika in der Schweiz statt nach der Preisabstandregel aufgrund eines APV wie bei Originalpräparaten festgelegt, läge er tendenziell tiefer; die Preise von Generika in der Schweiz weisen durchschnittlich eine noch höhere Differenz zu den ausländischen Preisen auf als die Originalpräparate. 4.5 WZW-Kriterien bei komplementärmedizinischen Arzneimitteln Während die Kriterien der Zweckmässigkeit und der Wirtschaftlichkeit bei komplementärmedizinischen Arzneimitteln synonym zu den schulmedizinischen Arzneimitteln geprüft werden, sind die Anforderungen an die Wirksamkeit nicht ausreichend definiert. Im Gegensatz zu den schulmedizinischen Arzneimitteln, bei denen die Wirksamkeit gemäss Artikel 65a KVV mittels klinischer Studien nachgewiesen werden muss, hat es der Bundesrat in der KVV unterlassen, die Anforderungen an den Wirksamkeitsnachweis bei komplementärmedizinischen Arzneimitteln zu präzisieren. Die Beurteilung der Zweckmässigkeit bei einem Arzneimittel der Komplementärmedizin wird 37 BGE 130 V 532 E. 2.2 7815 im Handbuch SL dargelegt und ist für die am Prozess beteiligten Akteure klar definiert. Auch die Beurteilung der Wirtschaftlichkeit ist, wie bei der Schulmedizin, klar geregelt. Wie das Rechtsgutachten feststellt, sind die Kriterien widerspruchsfrei, aber im Falle der Wirksamkeit nicht spezifiziert. Hinzu kommt die Schwierigkeit, dass die SL eigentlich nur so genannte pharmazeutische Spezialitäten und konfektionierte Arzneimittel umfasst, komplementärmedizinische Arzneien, speziell im Bereich der Homoeopathica und Anthroposophica, oftmals jedoch nicht konfektioniert sind und vom Apotheker/von der Apothekerin gemischt werden müssen. Die Aufnahme von komplementärmedizinischen Arzneimitteln in die SL ist in der Schweiz vergleichsweise grosszügig geregelt. In Österreich ist die Aufnahme solcher Arzneimittel in den Erstattungskodex schwierig bis unmöglich, weil ein Nutzen oft schwer nachgewiesen werden kann. In Deutschland existiert ein Hinweis, dass bei «besonderen Therapierichtungen» der besonderen Wirkungsweise Rechnung zu tragen sei, wobei im Rahmen des internationalen Vergleichs nicht ermittelt werden konnte, wie dies in der Praxis umgesetzt wird. 5 Entscheid Dieses Kapitel rückt den Verfahrensschritt des Entscheids ins Zentrum, für den das BAG zuständig ist (siehe Punkt 4 in Abbildung 1). Das BAG erlässt eine Verfügung, die feststellt, ob und zu welchem Höchstpreis ein Medikament in die SL aufgenommen wird. Schwierigkeiten zeigen sich bei der Preisdurchsetzung, sobald der Auslandpreisvergleich (APV) sowie der Therapeutische Quervergleich (TQV) vorliegen. Das gesamte Verfahren muss insgesamt als intransparent bezeichnet werden. In der Folge werden die rechtlichen Entscheidgrundlagen dargelegt, bevor die Entscheidpraxis beschrieben wird. Ein Schwerpunkt liegt dabei auf der Festlegung der Preise. Anschliessend wird erläutert, was geschieht, wenn das BAG zum Entscheid kommt, dass die Bedingungen für eine Kassenzulassung nicht erfüllt sind. Zum Schluss wird die Transparenz der Entscheidungen bewertet. 5.1 Rechtliche Grundlagen Der Entscheid über die Kassenzulassung liegt beim BAG. Es entscheidet gemäss den rechtlichen Grundlagen nach Anhörung der EAK und unter Berücksichtigung der WZW-Kriterien über die auf der SL geführten Arzneimittel (Art. 52 Abs. 1 Bst. b KVG). Das BAG entscheidet selbständig. Die EAK ist nicht zum Eingreifen ermächtigt, und der Bundesrat respektive das Departement sind für das System zuständig, grundsätzlich jedoch nicht für die einzelnen Zulassungsentscheide. Vorgaben zur Preisfestlegung Wie in Abschnitt 4.3 erwähnt, ist die Beurteilung der Wirtschaftlichkeit, bei der es namentlich um den Preis eines Medikaments geht, der durch die Krankenversicherung vergütet wird, am stärksten umstritten. In der Folge werden die rechtlichen Vorgaben zur Preisbestimmung im Detail dargestellt. 7816 Weil geeignetere Nutzenbewertungen fehlen, wird die Wirtschaftlichkeit anhand der beiden Instrumente des TQV und des APV festgelegt. Dabei stellt sich die Frage, wie die Ergebnisse dieser beiden Vergleiche in den Preisentscheid einfliessen. Artikel 35 Absatz 1 KLV legt fest, dass der FAP eines Arzneimittels den durch den APV ermittelten durchschnittlichen FAP des gleichen Medikaments in der Regel nicht überschreiten darf. Gemäss dieser Bestimmung gilt der durch den APV berechnete Preis somit als Höchstpreis. Wie unter Punkt 4.3 erwähnt, handelt es sich bei den ausländischen Listenpreisen allerdings nicht in allen Fällen um tatsächlich bezahlte Preise. Der Stellenwert des TQV bei der Preisbestimmung ist dagegen nicht näher geregelt. Auch fehlen Vorgaben dazu, wie die Ergebnisse von TQV und APV gewichtet werden, wenn der TQV zu einem viel tieferen Preis führt. Bei Originalpräparaten, die von der EAK als «medizinisch-therapeutischer Durchbruch» oder als «therapeutischer Fortschritt» eingestuft werden (Art. 31 Abs. 2 Bst. a und b), sieht Artikel 65b Absatz 4 KVV einen Innovationszuschlag vor. Dieser Zuschlag, der für höchstens 15 Jahre gewährt wird, soll die Kosten für Forschung und Entwicklung abgelten (Art. 34 Abs. 2 Bst. d KLV). Der Innovationszuschlag beträgt, ausgehend vom Preis der durch den TQV ermittelt wurde, höchstens 20 % und darf den durch den APV ermittelten Durchschnittspreis nicht überschreiten (Handbuch SL C.2.2). Bei Generika gilt die Regel des fixen Preisabstands (vgl. hierzu Abschnitt 4.4). 5.2 Entscheidpraxis Als Entscheidungsgrundlage dient gemäss BAG neben der Empfehlung der EAK auch die eigene Evaluation des Gesuches und vereinzelt Expertengutachten. Wie sich in den Gesprächen mit den EAK-Mitgliedern und in den Dossiers der Vollzugsevaluation gezeigt hat, folgt das BAG in den allermeisten Fällen der Empfehlung der EAK. Selten weicht das BAG von der Empfehlung der EAK ab, und zwar laut Aussage des BAG vornehmlich dann, wenn Studien, die das Amt bei Partnerorganisationen angefordert hat, neue Evidenz liefern, die der EAK nicht bekannt war. Auch beim Preis folgt das BAG mehrheitlich den Empfehlungen der EAK. Abweichungen von deren Preisempfehlung kommen laut BAG dann vor, wenn die EAK ohne klare Argumente einen deutlich tieferen Preis festlegt als der Arzneimittelhersteller. Alleine wegen offenen Fragen zur Wirtschaftlichkeit geht kaum ein Gesuch zurück in die EAK. Bei der Preisfestsetzung agiert das BAG somit eigenständig. In der Folge wird die Praxis der Preisbestimmung bei Originalpräparaten näher beschrieben, indem zuerst auf den Stellenwert der beiden Vergleichsinstrumente APV und TQV eingegangen wird und anschliessend die gewährten Innovationszuschläge bewertet werden. Die Preise für Generika sind durch den fixen Preisabstand dagegen klar bestimmt, weshalb es beim Vollzug keinen Spielraum gibt. Gewichtung von APV und TQV Bezüglich der Bedeutung von APV und TQV bei der Preisfestlegung lässt sich feststellen, dass der APV vom BAG strikte als Maximalpreis angesehen und durchgesetzt wird. Die Ergebnisse der beiden Vergleiche werden allerdings nicht nach einem klaren Muster gewichtet. 7817 Liegen zu einem Medikament nur Daten zu einem der beiden Vergleiche vor, folgt die Preisfestsetzung – wie die Vollzugsevaluation zeigt – den Ergebnissen dieses Vergleichs. In seltenen Fällen wird auch ein tieferer Preis verfügt. Wird sowohl ein APV als auch ein TQV durchgeführt, ist der Konsumentenschutz der Auffassung, dass sich der Preis immer nach jenem Instrument (APV/TQV) richten sollte, das den tieferen Vergleichspreis aufweist. Einige Arzneimittelhersteller stehen dagegen für eine Gewichtung 50:50 ein. In der Praxis lässt sich keine klare Gewichtungsregel feststellen. Mehrheitlich wird jedoch der Preis auf der Höhe des tieferen Vergleichsinstruments angesetzt, wobei der APV nicht überschritten wird.38 Dies zeigt sich in den analysierten Dossiers wie auch in den Daten zu den Neuaufnahmegesuchen des 2. Semesters im Jahr 2012.39 Problematisch gestaltet sich die Preisfestsetzung vor allem in jenen Fällen, in denen die beiden Vergleiche sehr unterschiedliche Ergebnisse liefern. In diesen eher seltenen Fällen kann es zu einer Gewichtung von 50:50 (2 Fälle von 16) oder zu Gewichtungsmodellen mit unterschiedlichen Referenzen bei verschiedenen Dosisstärken kommen (1 Fall von 16). In zwei Fällen im 2. Semester 2012 wurden Preise verfügt, die tiefer als der APV wie auch tiefer als der TQV waren. Dies kann beispielsweise dann vorkommen, wenn der TQV mit einem Komparator angestellt wird, der einen höheren Nutzen aufweist. Mit der Festlegung des APV als Obergrenze verfügt das gegenwärtige System gegen oben somit über eine klare Begrenzung der Preise. Wie in Kapitel 4.3 bereits dargelegt, beruht der APV auf Listenpreisen, welche Schaufensterpreise darstellen, die zum Teil deutlich über den im Ausland tatsächlich bezahlten Preisen liegen. Der APV verfügt deshalb nur über eine begrenzte Aussagekraft. Das Fehlen einer klaren Gewichtungsregel wurde von einigen beteiligten Akteuren auch positiv bewertet, weil dies ermögliche, auf die Eigenheiten der einzelnen Gesuche Rücksicht zu nehmen. Andererseits erschwert es aber die Preisfestsetzung und führt zuweilen, wie im Abschnitt 3.4 dargelegt, zu langwierigen Verfahren und Rechtsungleichheiten. Innovationszuschlag Der Innovationszuschlag wird uneinheitlich und nicht in allen Fällen wie im Handbuch vorgesehen eingesetzt. Bei neuen Originalpräparaten wird in rund 4 bis10 % der Fälle ein Innovationszuschlag gewährt.40 Ob und wie ein solcher Zuschlag ausfallen soll, wird häufig kontrovers beurteilt, weil einerseits nicht klar definiert ist, was eine Innovation ist, und andererseits der zu erwartende Nutzen der Innovation gerade angesichts des Mangels an entsprechenden Vergleichsstudien (vgl. Abschnitt 4) offen bliebt. Eine einheitliche Anwendung ist deshalb schwierig. 38 39 40 Um in begründeten Ausnahmen die Medikamentenversorgung sicherzustellen, ist es laut dem BAG vorgekommen, dass der APV überschritten wurde. Ein Beispiel stellt die Tuberkulose dar, gegen die es keine zugelassenen Medikamente mehr gab, weil in der Schweiz über längere Zeit keine Krankheitsfälle auftraten. Aufgrund des APV hätte das Arzneimittel sehr günstig sein müssen. Keine Firma war interessiert, das Arzneimittel zu einem so tiefen Preis auf den Markt zu bringen. In 11 von 16 Fällen, siehe auch Tabelle 8 in der Vollzugsevaluation. Vgl. Ip Humbel 10.3944 und Rossini 12.3541 oder Vollzugsevaluation Kapitel 2.3.2.3. 7818 In einem der Dossiers betrug der Innovationszuschlag zudem 80 %.41 Zwar handelt es sich dabei sehr wahrscheinlich um einen Ausreisser, doch stellt er eine deutliche Missachtung des im Handbuch SL vorgegebenen Maximums von 20 % dar. Die Vorgaben aus dem Handbuch werden daher nicht immer eingehalten. Befristete Aufnahme Befristete Aufnahmen ermöglichen dem Hersteller bessere Daten zu erheben. Nach der erteilten Frist liegen oftmals aber noch keine weiteren Wirksamkeitsbelege vor. Bei neuen Arzneimitteln kann die Wirksamkeit oftmals erst schwach belegt werden. Die Arzneimittelhersteller haben daraufhin verschiedentlich so genannte befristete Aufnahmen in die SL als Massnahme ins Feld geführt. Eine befristete Aufnahme in die SL mit klaren Anforderungen würde gemäss den Arzneimittelherstellern erlauben, dass Patientinnen und Patienten bereits von der Innovation profitieren und die Hersteller in der erteilten Frist zum Beleg der Wirksamkeit weitere Daten erheben können. In seltenen Fällen wird dies gegenwärtig auch praktiziert. Die Problematik von befristeten Aufnahmen liegt aber darin, dass nach der erteilten Frist oftmals weiterhin klare Wirksamkeitsbelege fehlen, gleichzeitig jedoch einige Patientinnen und Patienten bereits auf das Medikament eingestellt sind und eine Absetzung für sie problematisch sein könnte. Eine nachträgliche Ablehnung des Medikaments ist deshalb kaum durchzusetzen. Zudem ist kritisch zu hinterfragen, ob die schnellere Einführung eines Medikaments, dessen Wirksamkeit bzw. Zusatznutzen noch nicht gut belegt ist, tatsächlich im Interesse des Patienten und der Patientin liegt. 5.3 Folgen der Nichterfüllung der Bedingungen Es ist üblich, dass das BAG bei erstmalig eingereichten Gesuchen entscheidet, dass ein Medikament die Bedingungen für die Aufnahme in die SL nicht erfüllt. Grund ist zumeist, dass der vom Arzneimittelhersteller verlangte Preis als zu hoch beurteilt wird. In der Regel folgen daraufhin mehrere Schlaufen, in welchen sich BAG und Hersteller zu einigen versuchen. Wenig formelle Abweisungen Gelangt das BAG zum Entscheid, dass ein Medikament sämtliche WZW-Kriterien erfüllt und zum Preis, den der Arzneimittelhersteller verlangt, vergütet werden kann, erlässt es eine Verfügung zur Aufnahme des Medikaments auf die SL. Erachtet das BAG die Kriterien dagegen nicht als erfüllt, lässt es dem Arzneimittelhersteller eine Mitteilung zukommen, in der es begründet, warum es beabsichtigt, das Gesuch ganz oder teilweise abzulehnen. Die Gesuchstellerin kann in der Folge ein Neuüberprüfungsgesuch einreichen. Das BAG erlässt somit nicht automatisch eine Abweisungsverfügung, sondern nur, falls der Hersteller eine solche wünscht (Handbuch SL A.4.2–4.3), namentlich weil er den Entscheid gerichtlich anfechten will. Pro Jahr gibt es nach Angaben des BAG höchstens eine Hand voll Abweisungsverfügungen, wobei das BAG weder die Anzahl der Abweisungsverfügungen noch der Mitteilungen systematisch erfasst. In aller Regel wird auf eine Abweisungsverfügung verzichtet und das Gesuch gilt als hängig. Der Hersteller hat jederzeit die 41 Der TQV lag sehr viel tiefer als der APV. Mit dem hohen Innovationszuschlag wurde ein etwa in der Mitte liegender Preis festgelegt. Der APV wurde somit nicht überschritten. 7819 Möglichkeit, ein Neuüberprüfungsgesuch beispielsweise mit neuen Argumenten, zusätzlichen Studien oder Gutachten einzureichen. Stellung des BAG bei Preisfestsetzung In der Praxis kommt es sehr oft vor, dass das BAG zunächst zur Einschätzung gelangt, dass die Bedingungen für eine Kassenzulassung nicht erfüllt sind, und zwar meistens, weil angesichts der Preisvorstellungen des Herstellers die Wirtschaftlichkeit als ungenügend erachtet wird. Die Analyse der Dossiers hat ergeben, dass die Arzneimittelhersteller in einer Mehrheit der erstmals eingereichten Gesuche Preise angeben, die klar über dem APV und dem TQV liegen. In selteneren Fällen wird auch die Zweckmässigkeit bemängelt, etwa weil die vorgesehene Packungsgrösse als zu gross erachtet wird. Kommt das BAG zum Schluss, dass der von der Gesuchstellerin beantragte Preis zu hoch ist, teilt es dies dem Hersteller mit und gibt gleichzeitig an, welcher Preis als angemessen erachtet wird. Stützt sich das BAG dabei auf den APV, kann von Seiten der Gesuchstellerin kaum daran gerüttelt werden. Die Hersteller kommen dem BAG in diesem Fall meistens entgegen. Stützt sich das BAG bei der Preisfestsetzung hingegen auf den TQV ab, reichen die Hersteller oftmals ein Neuüberprüfungsgesuch mit zusätzlichen Studien und Expertengutachten ein. In diesen Fällen ist es laut BAG schwierig, den Hersteller zu einem tieferen Preis zu bewegen. Nicht nur der TQV, sondern auch der Innovationszuschlag sorgt regelmässig für Diskussionen. Schlägt das BAG einen tieferen Preis vor, führen die Gesuchsteller oft ins Feld, dass dieser der Innovation und der dahinter stehenden Forschung nicht gerecht werde. Argumentiert wird also nicht mit dem Nutzen, sondern mit dem Aufwand. Liegen die Preisvorstellungen von BAG und Herstellern weit auseinander, werden oft mehrere Schlaufen von «Mitteilung des BAG – Neuüberprüfungsgesuch» durchlaufen, mit entsprechend vielen Schreiben, Argumentarien, Expertenberichten und zuweilen auch Treffen der beiden Akteure. Der Prozess kann sich dadurch extrem in die Länge ziehen. Beschwerden werden laut BAG schätzungsweise zwei bis drei Mal pro Jahr eingereicht (bei jährlich rund 580 neu aufgenommenen Packungen). Das gerichtliche Durchsetzen der Verfügungen ist für das BAG zwar extrem zeitaufwändig, jedoch hat das Bundesverwaltungsgericht von 2010 bis Anfang 2013 vier von fünf Beschwerden der Hersteller abgewiesen. Einer dieser Fälle wurde ans Bundesgericht weitergezogen, das die Beschwerde teilweise gutgeheissen hat. In seltenen Fällen endet die Preisfestsetzung mit einer fragwürdigen Einigung. Beispielsweise kam das BAG der Gesuchstellerin in einem Fall mit einem eher hohen Preis entgegen, schrieb aber gleichzeitig in der so genannten Limitation, in welcher Einschränkungen für den Einsatz des Medikaments angeordnet werden, einen Rabatt für die Kassen fest, der von der Pharmafirma gewährt werden muss.42 So erhielt der Hersteller einen hohen FAP, was den Preis bei der Zulassung in anderen Ländern erhöht,43 während die Krankenkassen lediglich den vom BAG ursprünglich angestrebten tieferen Preis vergüten müssen. 42 43 Siehe Vollzugsevaluation Kapitel 2.3.2.4 Die Schweiz ist im Referenzkorb von 20 Ländern direkt vertreten. In weiteren Ländern haben die Preise der Schweiz indirekten Einfluss auf deren Preisgefüge, da die 20 Länder mit der Schweiz in ihrem Referenzkorb selbst wiederum referenziert werden (Interpharma 2013). 7820 Die Sektion Medikamente im BAG handelt bei Preisfestsetzungen in der Regel selbständig, sichert sich bei heiklen Dossiers jedoch vorgängig beim Amtsleiter ab. Vereinzelt versuchen Hersteller, über den Departementsvorsteher oder den Amtsleiter den Entscheid zu beeinflussen. 5.4 Transparenz der Entscheide In der Schweiz sind die Kassenzulassungsentscheide namentlich im Vergleich zu Deutschland wenig transparent. Während einsichtig ist, dass aufgrund von Geschäftsgeheimnissen nicht alle Aspekte der Preisfestsetzung veröffentlicht werden können, gibt es kaum Gründe, weshalb die Berichte zum Assessment und Appraisal nach Abschluss des Verfahrens nicht öffentlich zugänglich gemacht werden. Beurteilung der Transparenz Hinsichtlich Transparenz nimmt Deutschland eine Vorbildrolle ein: Die Ergebnisse der einzelnen Verfahrensschritte (Assessment, Appraisal, Decision) werden jeweils nach Abschluss mit den wichtigsten Unterlagen im Internet publiziert. In der Schweiz werden die Ergebnisse der Beurteilung (Assessment und Appraisal) dagegen nur oberflächlich festgehalten. Die erste Prüfung durch das BAG wird nicht systematisch dokumentiert und weder der Öffentlichkeit noch der EAK zugänglich gemacht. Die Beratungen der EAK sind vertraulich und werden ebenfalls nicht ausführlich dokumentiert. Das BAG, aber auch die Arzneimittelhersteller begründen die Zurückhaltung bei der Veröffentlichung von Unterlagen mit Geschäftsgeheimnissen. Solche sind in den Dossiers aber nur wenige zu finden und betreffen namentlich Angaben zur Preisfestsetzung, beispielsweise Berechnungen zum erwarteten Absatz eines Arzneimittels und Studienergebnisse, die nicht publik sind. Auch in Deutschland unterliegen solche Informationen der Geheimhaltung. Abgesehen davon spricht hingegen nichts gegen eine Veröffentlichung der Berichte zum Assessment und zum Appraisal. Für die Ärzteschaft und letzten Endes für die Patientinnen und Patienten können diese Berichte wertvolle Informationen enthalten. Entscheidkommunikation Der Entscheid wird vom BAG nur sehr knapp kommuniziert, indem das zugelassene Medikament und sein Preis genannt werden. Die Grundlagen des Entscheids sind somit für Aussenstehende nicht nachvollziehbar. Laut Bundesgericht müsste das BAG aber Abweichungen von einer klaren Meinungsäusserung der EAK begründen.44 Dies wird jedoch nicht gemacht. Vertreter der Arzneimittelhersteller kritisieren zudem, aus den Mitteilungen des BAG gehe jeweils nicht klar hervor, warum ein Gesuch abgewiesen werde und welche Instanz (BAG/EAK) was wie beurteilt habe. Mittelungen werden deshalb manchmal als willkürlich bewertet. Zwar wünschen sich die Arzneimittelhersteller selber somit mehr Einblick in das Verfahren, jedoch nicht unbedingt mehr Transparenz gegenüber der Öffentlichkeit. 44 BGE 129 V 32 E. 3.2.2 7821 6 Verfahren der Überprüfung In diesem Kapitel wird das Verfahren der Überprüfung, bei dem künftig alle drei Jahre geprüft werden soll, ob ein Medikament die Kriterien der Kassenzulassung noch erfüllt, untersucht (siehe Punkt 6 in Abbildung 1). Aufgrund des nach unten angepassten Wechselkurses konnten die Preise um knapp 20 % gesenkt werden. Über die Korrektur von Wechselkurseffekten hinausgehende Preissenkungen sind über alles gesehen nicht erzielt worden. Nach einer kurzen Darstellung der rechtlichen Grundlagen wird das Verfahren ausgehend von den Erkenntnissen aus der ersten durchgeführten Überprüfung im Jahr 2012 beurteilt. 6.1 Rechtliche Grundlagen Laut Artikel 32 Absatz 2 KVG werden die Wirksamkeit, die Zweckmässigkeit und die Wirtschaftlichkeit aller Leistungen der obligatorischen Krankenpflegeversicherung periodisch überprüft. Für Medikamente wird gemäss Artikel 65d Absatz 1 KVV alle drei Jahre geprüft, ob sie die Bedingungen für die Aufnahme in die SL noch erfüllen. Die Arzneimittelhersteller sind dabei verpflichtet, dem BAG alle notwenigen Unterlagen zuzustellen (Art. 65d Abs. 3 KVV). Genauere rechtliche Vorgaben sind nur zur Art und Weise der Überprüfung der Wirtschaftlichkeit vorhanden (Art. 65d Abs. 1bis, 1ter und 2 sowie Art. 35b KLV), während Ausführungsbestimmungen zu den beiden übrigen Kriterien fehlen. Die Wirtschaftlichkeit wird bei Originalpräparaten ausschliesslich anhand eines Auslandpreisvergleichs (APV) überprüft; ein Therapeutischer Quervergleich (TQV) wird nur in jenen Fällen durchgeführt, in welchen das Medikament auf dem ausländischen Markt nicht verfügbar ist (Art. 65d Abs. 1bis KVV). Generika werden gleichzeitig mit dem entsprechenden Original überprüft. Dabei gilt eine Preisdifferenz von mindestens 20 % zum durchschnittlichen APV des Originalpräparats (Art. 35b Abs. 10 KLV). 6.2 Erstmalige Überprüfung 2012 Im Jahr 2012 hat das BAG die erste Überprüfung durchgeführt. Künftig wird jährlich rund ein Drittel der rund 2800 auf der SL aufgeführten Arzneimittel45 überprüft, so dass jedes Medikament alle drei Jahre hinsichtlich seiner Kassenzulassung neu beurteilt wird. Die erstmalige Überprüfung beschränkte sich auf das Kriterium der Wirtschaftlichkeit, während die Wirksamkeit und Zweckmässigkeit gänzlich ausser Acht gelassen wurden, obwohl ihre Überprüfung in den gesetzlichen Grundlagen eigentlich ebenfalls angelegt ist. Eine künftige Änderung dieser Praxis ist nicht geplant. Die aufgrund der Überprüfung der Wirtschaftlichkeit verordneten Preissenkungen betragen 20 %, was ungefähr der Senkung des Wechselkurses für den APV entspricht. 45 Da ein Arzneimittel meist verschiedene Packungsgrössen oder Darreichungsformen kennt, werden alle diese Formen überprüft. In der Folge wird von Packungen gesprochen. 7822 Angeordnete Preissenkungen Insgesamt wurden im Rahmen der Überprüfung 2012 die Preise von 1512 Packungen gesenkt, wobei häufig beim gleichen Arzneimittel die Preise für mehrere Packungsgrössen oder Verabreichungsformen angepasst wurden (siehe Tabelle 1). Der FAP sank durchschnittlich um 20.1 %. Das BAG ordnete bei Originalpräparaten und bei Generika Preissenkungen an. Die durchschnittliche Preissenkung fiel bei den Generika etwas höher aus. Bei Originalpräparaten hat das BAG die meisten Preisanpassungen auf der Grundlage des APV angeordnet. Bei 107 Originalpräparaten, die auf dem ausländischen Markt nicht verfügbar sind, wurde versucht, einen TQV durchzuführen, was in 27 Fällen zu einer Preissenkung geführt hat. Bei den übrigen 80 Arzneimitteln konnte entweder kein Vergleichspräparat gefunden werden oder der bestehende Preis wurde als angemessen beurteilt. Tabelle 1 Preisanpassungen aufgrund der Überprüfung 2012 Fabrikabgabepreis (FAP) Anzahl Preissenkungen Durchschnittliche Differenz 1 512 –20,1% Quelle: Auswertung J. Hunkeler basierend auf SL (Stand 1. April 2013) Bei der Überprüfung der Aufnahmebedingungen kann ein maximaler Zuschlag (Toleranzmarge) von 5 % gewährt werden. Für den APV wurde beim Anfang 2012 geltenden Wechselkurs von 1.23 Franken/Euro eine Toleranzmarge von 5 % berücksichtigt. Dies ergab einen Wechselkurs von 1.29 Franken/Euro, der für die Überprüfungs-APV im Jahr 2012 massgebend war. Bei der letzten grossen Überprüfung, der ausserordentlichen Überprüfung im Jahr 2009, galt ein Wechselkurs von 1.58 Franken/Euro.46 Bei Neuaufnahmen und Überprüfungen seit Oktober 2009 wurden jeweils aktuelle und dadurch tiefere Wechselkurse angewendet. Der Preis der Generika wurde bei der Überprüfung im Jahr 2012 dagegen basierend auf dem Wechselkurs von 1.23 Franken/Euro (ohne Toleranzmarge) berechnet, was den Abstand zum Original vergrössert. Der neue Wechselkurs für Originalpräparate liegt rund 18 % tiefer als der verwendete Wechselkurs bei der ausserordentlichen Überprüfung im Jahr 2009, was in etwa der durchschnittlichen angeordneten Preissenkung entspricht. Im Ergebnis führte die Überprüfung somit zu einer (abgefederten) Anpassung an die veränderten Wechselkursrelationen. Die rund zwei Drittel der Arzneimittel, die im Jahr 2012 noch nicht überprüft wurden, behalten bis zu ihrer Überprüfung im Herbst 2013 oder 2014 weiterhin den Preis, der auf dem Wechselkurs von 1.58 Franken/Euro basiert. Hängige Beschwerden Einzelne Arzneimittelhersteller haben gegen die angeordneten Preissenkungen rekurriert. Vier Arzneimittelhersteller haben Beschwerden eingereicht, weil sie mit 46 Wechselkurs 1.52 Franken/Euro plus Toleranzmarge von 4%. 7823 der Durchführung der Überprüfung und dem Abstellen alleine auf den APV nicht einverstanden waren.47 Um die Preissenkungen dennoch durchzusetzen, versuchte das BAG, die aufschiebende Wirkung der Beschwerden aufzuheben, was das Bundesgericht am 20. Dezember 2012 jedoch als rechtswidrig einstufte.48 Aufgrund einer Einigung zwischen dem EDI und der Pharmabranche vom 11.4.2013 setzen sich die Verbände dafür ein, dass ihre Mitglieder die bei Gericht hängigen Beschwerden gegen Medikamentenpreissenkungen wegen Nichtberücksichtigung des TQV zurückziehen und keine neuen einreichen. 6.3 Zweckmässigkeit des Verfahrens Die Überprüfung garantiert einzig, dass die Preisdifferenz zu den Vergleichsländern nicht zunimmt. Sie garantiert jedoch nicht, dass die Krankenversicherung nur wirksame und zweckmässige Arzneimittel mit dem grössten Nutzen vergütet. Da im Rahmen der dreijährlichen Überprüfung bei Originalpräparaten in der Regel einzig die Auslandpreise betrachtet werden, bleibt der Nutzen eines Arzneimittels gänzlich unbeachtet. Bei der Aufnahme ist eine Nutzenbeurteilung zumindest indirekt durch den TQV vorgesehen Die Preise sinken, wenn der durchschnittliche Preis in den Vergleichsländern tiefer liegt. Die Preise müssten gemäss dem Kriterium der Wirtschaftlichkeit aber auch dann sinken, wenn das Kosten-Nutzen-Verhältnis gegenüber vergleichbaren Arzneimitteln abgenommen hat. Das beste KostenNutzenverhältnis wird durch die Überprüfung deshalb nicht garantiert. Bei gewissen auf der SL aufgeführten Arzneimitteln sind nach Auffassung von EAK-Mitgliedern wie auch BAG-Mitarbeitenden die Aufnahmebedingungen auch in Bezug auf die Wirksamkeit und Zweckmässigkeit nicht mehr erfüllt (z.B. Badezusätze, Salben, homöopathische Arzneimittel). Dennoch hat das BAG in den letzten 10–15 Jahren kein Arzneimittel aus der SL gestrichen. Eine Ausnahme bilden Arzneimittel, welchen Swissmedic aufgrund von neuer Evidenz zur Medikamentensicherheit die Marktzulassung entzieht und die in der Folge auch von der SL gestrichen werden. Ansonsten streichen höchstens die Hersteller selber ihre Arzneimittel von der SL, in der Regel weil sie deren Produktion einstellen. Die Beweislast für eine Streichung durch das BAG liegt beim Amt, was eine Streichung von der SL faktisch verunmöglicht. Dass in der KVV für die Überprüfung lediglich Preisanpassungen vorgesehen sind, liegt nach Aussage des BAG an den fehlenden Ressourcen für eine weitergehende Kontrolle. Die erneute Überprüfung der Kassenzulassung wird in den europäischen Ländern sehr unterschiedlich gehandhabt. Die Spannbreite reicht von der Überprüfung einzelner Produkte über bestimmte Produktegruppen bis hin zu einer systematischen Überprüfung aller kassenpflichtigen Medikamente (beispielsweise in Frankreich). In 47 48 In der Regel ergibt die Berücksichtigung des therapeutischen Nutzens im Rahmen des TQV einen tieferen Vergleichswert als der APV (vgl. Abschnitt 4.3), was grundsätzlich nicht im Interesse der Hersteller liegen dürfte. Da gegenwärtig jedoch noch zwei Drittel der Preise von Medikamenten der SL, welche für den TQV beigezogen werden, auf einem Wechselkurs von 1.58 Franken/Euro beruhen, ergibt sich zur Zeit oftmals ein TQV-Niveau, das über dem mit aktuellen Kursen berechneten APV-Niveau liegt. BGE 9C 986/2012, 9C 987/2012, 9C 988/2012 7824 Deutschland werden beispielsweise im Zuge der Zulassung neuer Medikamente mit deutlichem Zusatznutzen die Preise für bestehende Arzneimittel gesenkt. 7 Auswirkungen auf die SL In den vorherigen Abschnitten wurde das Verfahren für die Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung schrittweise durchleuchtet. Was bedeutet dies im Ergebnis nun für die SL? Dieser Frage nähert sich die Evaluation an, indem sie die Veränderungen der SL untersucht. Dabei lässt sich feststellen, dass sich die Zahl der kassenpflichtigen Arzneimittel in den vergangenen 15 Jahren verdoppelt und ihr durchschnittlicher Preis vervierfacht hat. Die Ausgestaltung der Verfahren hat diese Entwicklung sicherlich nicht verhindert, sondern eher begünstigt. Die Ergebnisse der vorherigen Abschnitte geben zahlreiche Hinweise darauf, während für diese Entwicklung jedoch verschiedene Faktoren von Relevanz sein dürften. 7.1 Anzahl kassenpflichtiger Medikamente Abbildung 2 zeigt die Entwicklung der SL bezüglich der Zahl der vergüteten Medikamente und ihres Preises. Der Umfang der SL hat sich seit der Einführung des KVG im Jahr 1996 fast verdoppelt. Die SL umfasste im Jahr 2012 rund 2800 Medikamente bzw. − da ein Medikament oft in verschiedenen Dosierungen, Darreichungsformen und Packungsgrössen aufgenommen wird − 9281 Preispositionen. Der Umfang der Liste ist somit seit 1996 klar gewachsen. Abbildung 2 Entwicklung des Umfangs der Spezialitätenliste Quelle: Auswertung J. Hunkeler basierend auf SL (Stand Dez. 2012) 7825 Jährlich werden durchschnittlich rund 580 neue Packungen in die SL aufgenommen, was ungefähr 8 % der gesamten kassenpflichtigen Packungen entspricht. Gleichzeitig werden jedes Jahr rund 5 % der Packungen von der Liste gestrichen − namentlich, weil die Hersteller ihre Produktion einstellen. Damit nimmt der Umfang der SL jährliche durchschnittlich um etwa 3 % zu.49 7.2 Preisentwicklung Der durchschnittliche Preis einer Medikamentenpackung auf der SL betrug 2012 rund 130 Franken. Dieser ungewichtete Durchschnittswert hat sich seit 1996 rund vervierfacht (siehe Abbildung 3). Im selben Zeitraum haben sich die durchschnittlichen Preise für ein Generikum auf der SL verdoppelt und kosteten im Jahr 2012 rund 42 Franken. Abbildung 3 Preisentwicklung Spezialitätenliste Legende: Preise entsprechen dem ungewichteten Durchschnittsfabrikabgabepreis (FAP). Quelle: Auswertung J. Hunkeler basierend auf SL (Stand Dez. 2012) Diese Preisentwicklung wird teilweise durch die so genannte Umsteigeteuerung erklärt. Dabei nehmen Hersteller ältere Präparate aus der Liste und ersuchen gleichzeitig um die Zulassung neuer Arzneimittel mit dem gleichen Anwendungszweck, jedoch mit einem höheren Preis. Ob die neuen Medikamente tatsächlich qualitativ besser sind, wird von verschiedener Seite kritisch beurteilt, kann aufgrund des mangelhaften TQV jedoch nicht abschliessend beurteilt werden. Der Anteil der kassenpflichtigen Medikamente am Umsatz des gesamten Medikamentenmarktes ist von knapp 70 % im Jahr 2000 auf rund 78 % im Jahr 2011 ange49 Siehe Vollzugsevaluation Tabelle 4 7826 stiegen (Tabelle 2). Von den rund 25 Milliarden Franken, die 2011 für Leistungen der obligatorische Krankenpflegeversicherung bezahlt wurden, betrug der Anteil für Medikamente rund 5.5 Milliarden (22 % der Gesamtkosten). Dieser Anteil blieb in den vergangenen Jahren in etwa konstant. Die Kostensteigerung bei den Arzneimitteln entspricht folglich dem Anstieg der Kosten in der gesamten obligatorischen Krankenpflegeversicherung. Tabelle 2 Anteil der kassenpflichtigen Arzneimittel am Medikamentenmarkt Jahr Bruttoleistungen OKP in Mio. Fr. Medikamentenkosten OKP in Mio. Fr. Medikamentenkosten SL-Medikamente in % OKP in % an den gesamten an OKP-Total Medikamentenkosten 1998 14 024 2 721 19 2000 15 478 3 241 21 69.5 2005 20 348 4 597 23 77.9 2010 24 292 5 395 22 78.1 2011 24 932 5 459 22 77.7 Legende: Massgebend sind die Publikumspreise (PP). Die Spalte «Medikamentenkosten» beinhalten die durch Ärzte, Apotheken und ab 2005 auch die ambulant in Spitälern abgegebenen Arzneimittel. Die im stationären Bereich abgegebenen Arzneimittel werden weder vom BAG noch vom BFS ausgewiesen.50 Quelle: BAG Statistik der obligatorischen Krankenversicherung, «SL-Medikamente in % der gesamten Medikamentenkosten» basiert auf einer Auswertung von J. Hunkeler, siehe Vollzugsevaluation. Für die steigenden Kosten gibt es verschiedene Gründe. Wie sich am konstanten Anteil der Medikamentenkosten an den gesamten vom KVG gedeckten Kosten zeigt, handelt es sich beim Kostenwachstum eher um einen generellen Trend im Gesundheitswesen – basierend u. a. auf der Demographie – als um eine spezifische Problematik des Arzneimittelmarktes. Der Kostenanstieg kann zu einem Teil auch mit der Entwicklung der Todesursachen (z.B. Krebs) und auch aufgrund neuer Indikationen für Arzneimittel erklärt werden.51 Der Gesundheitsmarkt ist zumindest im kassenpflichtigen Bereich sehr stark reguliert, so dass wenig Marktdynamik herrscht. Dies zeigt sich beispielsweise darin, dass für neue Medikamente zur Abgeltung der Innovation höhere Preise bezahlt werden, jedoch die Preise für bestehende Arzneimittel mit dem gleichen Einsatzzweck, die als Referenz beim TQV dienen, gleich bleiben. Im freien Markt dagegen werden die herkömmlichen Produkte beim Erscheinen einer Innovation in der Regel günstiger, damit sie gegenüber der Innovation zumindest im Preis einen Vorteil besitzen. Die in der Schweiz hohen Preise werden zudem oftmals damit erklärt, dass der Parallelimport von patentgeschützten Medikamenten, die im Ausland tendenziell 50 51 Eine Berechnung zu den stationär abgegebenen Arzneimitteln ist in der Vollzugsevaluation im Anhang (Tabelle 10) zu finden und beträgt mit den ambulant abgegebenen Arzneimitteln nach einer Schätzung im Jahr 2011 rund 900 Mio. Franken. Im Jahr 2005 gab es z.B. 3 Indikationen mit Orphan Drug Status (seltene Krankheiten). Im Jahr 2011 gab es deren 144 (Interpharma 2012, S. 29). 7827 billiger sind, untersagt ist.52 In den EU-Mitgliedstaaten wie Deutschland und Österreich, können Versicherer, Apotheken und Spitäler ausserdem preislich günstige Angebote von Grosshändlern in Anspruch nehmen, während in der Schweiz nur originalverpackte Arzneimittel in oftmals kleinen Packungen zugelassen sind. 8 Schlussfolgerungen Wiederholt werden in den Medien die hohen Preise für Arzneimittel in der Schweiz bemängelt. Die Medikamente machen rund einen Viertel der gesamten Kosten der obligatorischen Krankenpflegeversicherung aus. Vergütet werden jene Medikamente, die vom BAG auf die Spezialitätenliste (SL) gesetzt werden. In der vorliegenden Evaluation wurde das Verfahren für die Aufnahme von Medikamenten auf diese SL (Zulassung) und die Überprüfung der SL vertieft durchleuchtet, indem sowohl die rechtlichen Grundlagen als auch der Vollzug analysiert und beides in eine internationale Perspektive gestellt wird. In diesem Schlusskapitel werden aus der Vielzahl der Ergebnisse die vier Haupterkenntnisse der Evaluation herausgegriffen. Daneben stellte die Evaluation bei allen Verfahrensschritten weitere Probleme fest, wie etwa die ungenügende Definition des Beurteilungskriteriums der Wirksamkeit bei komplementärmedizinischen Arzneimitteln oder die nicht spezifizierte Gewichtung der beiden Preisvergleiche APV und TQV im Rahmen des Entscheids. 8.1 Unpräzise Beurteilungskriterien und unsystematische Nutzenbewertung Damit Medikamente von der obligatorischen Krankenpflegeversicherung vergütet werden, müssen sie nach Artikel 32 KVG die drei Kriterien der Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit (WZW) erfüllen. Diese Kriterien wurden von den Behörden jedoch nicht genügend präzisiert. Der Nutzen von Medikamenten fliesst gegenwärtig nur unsystematisch in die Beurteilung ein. Deshalb garantiert das System nicht, dass mit einem höheren Preis auch eine entsprechend höhere Wirksamkeit und Zweckmässigkeit von Arzneimitteln verbunden ist. Unpräzise Beurteilung des Nutzens Die Vorgaben zur Beurteilung der WZW-Kriterien, welche die Behörden in Form von Verordnungen und Weisungen (Handbuch SL) erlassen haben, sind nicht präzise. Dies hat einerseits zur Folge, dass eine einheitliche Anwendung nicht garantiert ist. Andererseits werden die Beurteilungen durch die Arzneimittelhersteller häufig in Frage gestellt. Es ist für das BAG als Zulassungsbehörde schwierig, Gesuche auf der Basis dieser unklaren Kriterien abzulehnen, weshalb es diesbezüglich eher zurückhaltend ist. Eine systematische Nutzenanalyse die entweder gegenüber klar festgelegten Indikatoren (z. B Steigerung der Lebensqualität) oder bei welcher die Wirkung eines Medikaments mit jener eines bestehenden Arzneimittel verglichen wird, ist nicht 52 Ausnahme vom Cassis-de-Dijon-Prinzip nach Art. 16a Abs. 2 des Bundesgesetzes über die technischen Handelshemmnisse (THG), SR 946.51. 7828 verlangt. Deshalb werden entsprechende Studien oftmals auch nicht eingereicht. Zwar stellt das BAG zuweilen aufgrund bestehender Studien indirekte Vergleiche an, doch sind diese mit Unsicherheiten behaftet und dementsprechend nicht belastbar. Schliesslich können Synergien zwischen dem BAG und Swissmedic als Marktzulassungsbehörden aufgrund von gesetzlichen Restriktionen (Art. 63 HMG) nicht optimal genutzt werden, namentlich steht der Evaluationsbericht von Swissmedic nicht zur Verfügung. Aufgrund von oftmals noch nicht vorliegenden Daten fordern Arzneimittelhersteller, dass Arzneimittel vermehrt befristet (und in der Folge schneller) aufgenommen werden sollen. Dies ermöglicht dem Hersteller, in gegebener Frist bessere Daten zu erheben. Die Problematik von befristeten Aufnahmen liegt aber darin, dass nach der erteilten Frist oftmals weiterhin klare Wirksamkeitsbelege fehlen, gleichzeitig jedoch einige Patientinnen und Patienten bereits auf das Medikament eingestellt sind und eine Absetzung für sie problematisch sein könnte. Dies erschwert es dem BAG im gegebenen Rahmen, ein Arzneimittel wieder von der SL zu streichen. Unpräzise Beurteilung der Wirtschaftlichkeit Die Mängel bei der Beurteilung der Wirksamkeit haben auch auf die Beurteilung der Wirtschaftlichkeit einen Einfluss. Ein Medikament gilt dann als wirtschaftlich, wenn sein Preis in einem günstigeren Verhältnis zum angestrebten therapeutischen Nutzen steht. Letzterer wird im gegenwärtigen System über den therapeutischen Quervergleich (TQV) beurteilt, bei dem die Kosten des Medikaments mit jenen anderer Arzneimittel mit ähnlichem Anwendungszweck verglichen werden. Im Gegensatz zu anderen Ländern, in welchen klare Produktegruppen definiert wurden, ist in der Schweiz unklar, mit welchen Arzneimitteln ein bestimmtes Medikament verglichen werden muss. Der Auslandpreisvergleich (APV) ist jedoch noch weniger für eine KostenNutzenbewertung geeignet. Der APV basiert einzig auf ausländischen Listenpreisen, die teilweise höher liegen als die tatsächlich bezahlten Preise. Weil der APV aber auf klaren Vorgaben beruht, spielt er für die Durchsetzung der Preisvorstellungen des BAG eine viel wichtigere Rolle als der TQV. International besteht der Trend zu Versorgungsstudien sowie zu umfassenden «Health Technology Assessments», die gesundheitsökonomische, rechtliche, ethische und soziale Aspekte systematisch einbeziehen. Der Nutzen von Arzneimitteln wird dabei auch mit jenem anderer medizinischer Leistungen (Operationen, Hilfsmittel usw.) verglichen. Solche umfassende Prüfungen würden deutlich mehr Ressourcen, aber auch Wissen voraussetzen, das gegenwärtig fehlt. 8.2 Unklare Verfahrensstruktur und Kompetenzen Das Verfahren zur Zulassung von kassenpflichtigen Medikamenten läuft in der Schweiz nicht nach klar vorgegebenen Schritten ab. Auch institutionell fehlt eine Aufteilung der verschiedenen Aufgaben auf die beiden beteiligten Akteure, das BAG und die EAK. Zudem verfügen beide für ihre Aufgabe im Bereich der kassenpflichtigen Medikamente über sehr bescheidene Ressourcen. Die Ergebnisse des Verfahrens werden des Weiteren weder gegenüber den Gesuchstellern noch gegenüber der Öffentlichkeit transparent gemacht. 7829 International werden Verfahren der Zulassung in drei Schritte unterteilt: Assessment (medizinisch-therapeutische Beurteilung), Appraisal (gesundheitspolitisch-gesellschaftliche Beurteilung) und Decision (Entscheid). Für jeden Schritt ist jeweils ein anderer Akteur zuständig. In der Schweiz dagegen fehlen eine klare Strukturierung des Verfahrens und eine Aufteilung der Schritte auf verschiedene Akteure. Überschneidung bei der Beurteilung zwischen BAG und EAK Für die Beurteilung sind sowohl das BAG als auch die EAK zuständig, wobei eine klare Unterscheidung zwischen Assessment und Appraisal fehlt. Das BAG sieht sich für beides zuständig, während unter den Mitgliedern der EAK kein Konsens herrscht, aus welcher Sicht sie die Gesuche zu beurteilen haben. Die unklaren Kompetenzen führen offensichtlich zu Doppelspurigkeiten und erhöhen zudem das Risiko, dass gewisse Aspekte nicht systematisch beurteilt werden. Die EAK sollte die Medikamente gemäss den rechtlichen Vorgaben im Sinne einer Empfehlung nach ihrem erwarteten Nutzen einstufen. Dies wird jedoch in der Praxis nicht gemacht, sondern es ist das BAG selber, das die Zuordnung aufgrund der Diskussion in der EAK vornimmt. Dieses ist gleichzeitig auch für den Entscheid zuständig, womit Beurteilungs- und Entscheidinstanz entgegen internationalen Gepflogenheiten zusammenfallen. Die Entscheidung vom BAG basiert demnach teilweise auf der eigenen Beurteilung. Mangelnde Transparenz Während in anderen Ländern wie z.B. Deutschland nach jedem Verfahrensschritt die Berichte mit Vorbehalt von Geschäftsgeheimnissen veröffentlicht werden, muss die Transparenz im Schweizer System als ungenügend taxiert werden. Weder die Beurteilung durch das BAG noch die Erwägungen der EAK werden systematisch und nachvollziehbar dokumentiert. Weil die EAK die Medikamente zudem keiner Kategorie zuordnet, ist ihre Empfehlung an das BAG wenig explizit. Den Gesuchstellern wird der Entscheid in Form einer Verfügung oder, sofern die Kriterien nicht erfüllt werden, in Form einer Mitteilung mit Angabe von Gründen kommuniziert. Darin ist nicht ausgewiesen, ob es sich um Beurteilungen des BAG oder der EAK handelt. Für die Öffentlichkeit ist schliesslich einzig ersichtlich, zu welchem Preis ein neues Medikament in die SL aufgenommen wurde. Ebenfalls bleibt unklar, welche Institution ein Gesuch wie beurteilt hat. Knappe Ressourcen Allerdings zeigt sich gerade im internationalen Vergleich, dass das System der Zulassung von Medikamenten in der Schweiz mit sehr bescheidenen Ressourcen ausgestattet ist. Während in anderen Ländern mehrere Evaluationseinrichtungen mit jeweils ansehnlichen eigenen Mitteln vorhanden sind, ist die zuständige Sektion im BAG relativ klein und die EAK ist eine Milizkommission, bei der nur die Sitzungen vergütet werden. Gerade die EAK stösst mit ihrer Aufgabe an Grenzen. 8.3 Eingeschränkte und wenig wirksame Überprüfung Die kassenpflichtigen Medikamente werden neu drei Jahre dahin gehend überprüft, ob sie die Vergütungskriterien weiterhin erfüllen. Eine erste Überprüfung fand 2012 statt. Sie zeigt, dass nur der Preis geprüft wird, und zwar in der Regel lediglich 7830 anhand eines Auslandpreisvergleichs, was beschränkte Preissenkungen zur Folge hatte. Das Überprüfungsverfahren trägt nicht dazu bei, dass die Preise in der SL das Kosten-Nutzen-Verhältnis korrekt widerspiegeln, worauf international mehr Wert gelegt wird. Einschränkung auf den Auslandpreisvergleich Bei der Überprüfung im Jahr 2012 wurde nur der Preis einbezogen, und zwar ausschliesslich der APV, obwohl dieses Instrument, wie oben erwähnt, von überhöhten Ansätzen ausgeht. Nur falls der APV nicht durchführbar ist, wird der Versuch eines TQV unternommen. Dies bedeutet, dass die Wirtschaftlichkeit nur in einem sehr eingeschränkten Sinne überprüft wird. Wie wirksam und zweckmässig die Medikamente sind, wird überhaupt nicht erneut beurteilt, obwohl hierzu möglicherweise neue Erkenntnisse vorliegen würden. Eine umfassendere Überprüfung erfordert allerdings erheblich grössere Ressourcen. Anhand der Überprüfung ordnete das BAG Preissenkungen von rund 20 % an, was in etwa der Anpassung des für Auslandpreisvergleiche geltenden Wechselkurses entspricht. Das Überprüfungsverfahren anhand des APV garantiert somit lediglich, dass Medikamente in der Schweiz im Vergleich zum Ausland nicht noch teurer werden, als sie bereits sind, die Preisschere sich also nicht weiter öffnet. Preisspirale gegen oben kann nicht verhindert werden Die Preise von kassenpflichtigen Arzneimitteln werden bei der ausschliesslichen Betrachtung des APV nicht im Gesamtkontext der SL beurteilt. Bei Innovationen sinken die Preise der bestehenden Arzneimittel nicht. Da das bestehende Überprüfungsverfahren nur auf den APV abstützt, vermag es dieses Defizit nicht zu korrigieren. Die steigende Preisspirale kann damit nicht gebannt werden. Überprüfung im internationalen Vergleich In anderen Ländern (z.B. in Frankreich) werden die Preise kassenpflichtiger Arzneimittel regelmässig überprüft. Dies kann dann geschehen, sobald kostengünstigere Behandlungsalternativen (allenfalls auch nicht medikamentöser Art) oder neue Medikamente mit einem Zusatznutzen zugelassen werden. Damit gehen andere Länder über eine reine Preisbetrachtung hinaus, indem auch die Frage des Nutzens im Sinne der Wirksamkeit und Zweckmässigkeit berücksichtigt wird. Im internationalen Vergleich zeigt sich somit, dass die in der Schweiz alle drei Jahre vorgesehene Überprüfung des Preises der Medikamente anhand eines Auslandpreisvergleichs ein sehr beschränktes Instrument darstellt, um eine wirksame, zweckmässige und wirtschaftliche Arzneimittelversorgung der Bevölkerung zu gewährleisten. 8.4 Preisreglung bei Generika schafft Widerspruch zur Wirtschaftlichkeit Namentlich das Ziel der Wirtschaftlichkeit wird bei den kassenpflichtigen Medikamenten aufgrund der gegenwärtigen Preisregelung für Generika nicht erreicht, weil das Konzept nur bedingt verhindert, dass Originalpräparate nach Patentablauf billiger werden. In den Ausführungsbestimmungen zum Krankenversicherungsgesetz (Art. 65c KVV) ist festgeschrieben, dass der Preis eines Generikums dem Preis des zugehöri7831 gen Originalpräparats minus einer fixen Marge entspricht. Diese Regel des fixen Preisabstands führt dazu, dass zwei austauschbare Produkte mit dem gleichen therapeutischen Nutzen − Original und Generikum – von der Krankenversicherung zu unterschiedlichen Preisen vergütet werden. Die Krankenversicherung bezahlt somit nicht nur das kostengünstigste, sondern auch das teurere Präparat, was im Widerspruch zum Ziel der Wirtschaftlichkeit steht. Die Regel des fixen Preisabstands verhindert zudem, dass sich der Preis des Originals dem günstigeren Generikum annähert. Während der Preis des Originals bei Einführung eines Generikums in anderen Ländern gesenkt wird, bleibt er in der Schweiz weiterhin gleich hoch, ausser der Originalhersteller senkt ihn freiwillig. Indem die Behörden den Selbstbehalt für Originale, zu welchen es ein Generikum gibt, erhöht haben, werden deren Preise teilweise gesenkt, um dem höheren Selbstbehalt auszuweichen. Die Wirkung dieses differenzierten Selbstbehaltes kann noch nicht eindeutig eruiert werden. Der grundsätzliche Widerspruch zum gesetzlichen Ziel der Wirtschaftlichkeit wird dadurch nicht korrigiert. 7832 Abkürzungsverzeichnis APV BAG EAK EDI FAP GDK GPK HMG HTA IQWIG KLV KVG KVV OKP PP PVK SL SR THG TQV WZW Auslandpreisvergleich Bundesamt für Gesundheit Eidgenössische Arzneimittelkommission Eidgenössisches Departement des Innern Fabrikabgabepreis Schweizerische Konferenz der kantonalen Gesundheitsdirektorinnen und -direktoren Geschäftsprüfungskommissionen der eidgenössischen Räte Bundesgesetz vom 15. Dezember 2000 über Arzneimittel und Medizinprodukte (Heilmittelgesetz, HMG; SR 812.21) Health-Technology-Assessment Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Verordnung des EDI vom 29. September 1995 über Leistungen in der obligatorischen Krankenpflegeversicherung (KrankenpflegeLeistungsverordnung, KLV; SR 832.112.31) Bundesgesetz vom 18. März 1994 über die Krankenversicherung (Krankenversicherungsgesetz, KVG; SR 832.10) Verordnung vom 27. Juni 1995 über die Krankenversicherung (KVV; SR 832.102) Obligatorische Krankenpflegeversicherung Publikumspreis Parlamentarische Verwaltungskontrolle Spezialitätenliste Systematische Rechtssammlung Bundesgesetzes vom 6. Oktober 1995 über die technischen Handelshemmnisse (THG; SR 946.51) Therapeutischer Quervergleich Wirksamkeit, Zweckmässigkeit und Wirtschaftlichkeit 7833 Literaturverzeichnis Zitierte Literatur BAG, 2012, Handbuch betreffend die Spezialitätenliste (SL),1. Januar 2012. www.sl.bag.admin.ch. European Federation of Pharmaceutical Industries and Associations, 2010, Patients W.A.I.T. Indicator. Online: www.efpia.eu/patients-wait-indicator-report-2010. Interpharma, 2012, Pharma-Markt Schweiz. Basel. Interpharma 2013, Internationale Auswirkungen der schweizerischen Arzneimittelregulierung, Basel. PVK, 2008, Bestimmung und Überprüfung ärztlicher Leistungen in der obligatorischen Krankenpflegeversicherung, 21.08.2008. Weitere Literatur Weitere Literatur, die verwendeten Dokumente und die Online-Datenquellen sind in den Materialien aufgeführt. Evaluation der Zulassung und Überprüfung von Medikamenten in der obligatorischen Krankenpflegeversicherung, Materialien zum Bericht der Parlamentarischen Verwaltungskontrolle zuhanden der Geschäftsprüfungskommission des Ständerates vom 13. Juni 2013. 7834 Zusammenhang Bericht und Materialien Wie aus unten stehender Tabelle ersichtlich ist, fasst ein Berichtskapitel Erkenntnisse aus allen drei Evaluationsteilen zusammen. Kapitel im Bericht Kapitel in den Materialien (RG=Rechtsgutachten, VE=Vollzugsevaluation, IV=Internationaler Vergleich) 1 1.1 1.2 Einleitung Anlass der Evaluation Vorgehen und Methodik – – RG VE IV – – 1.III 1.3 1.3 2 Die Zulassung und Überprüfung von Medikamenten RG VE 2.III 1.1 3 – – 3.1 3.2 Verfahrensstruktur, Kompetenzaufteilung und Ressourcen Verfahrensstruktur Kompetenzaufteilung IV RG VE 3.3 Ressourcen 3.4 Verfahrensdauer VE IV VE 1.4; 4 6.I 2.2.1; 2.3.1.3; 2.3.2 2.1.3; 2.3.1. 4 2.3.3 4 WZW-Kriterien 4.1 Wirksamkeit 4.2 Zweckmässigkeit 4.3 Wirtschaftlichkeit 4.4 WZW-Kriterien bei Generika 4.5 WZW-Kriterien bei kompl. Arzneimitteln RG IV RG VE IV RG VE RG VE IV RG VE IV RG VE IV 3.II; 4II; 5.II 4 4.II.1 2.1 3.1 4.II.2 2.1 4.II.3 2.1 2.2 4.II.1; 4.II.3 2.1.3.2 4 4.II.1 2.1.3.2 4 5 5.1 Entscheid Rechtliche Grundlagen 5.2 5.3 5.4 Entscheidpraxis Nichterfüllung der Bedingungen Transparenz – VE IV VE VE RG VE IV – 2.3.2.1 4 2.3.2.2; 2.3.2.3 2.3.2.4 5.II.B 2.3.2.5 4 7835 Kapitel im Bericht Kapitel in den Materialien (RG=Rechtsgutachten, VE=Vollzugsevaluation, IV=Internationaler Vergleich) 6 6.1 6.2 Verfahren der Überprüfung Rechtliche Grundlagen Erstmalige Überprüfung 2012 6.3 Zweckmässigkeit des Verfahrens 7 7.1 7.2 Auswirkungen auf die SL Umfang der SL Preisentwicklung 7836 – RG VE IV VE – 2.II.E. 2.1.2.3; 2.4.3 3.5 2.1.3.3 – VE VE IV – 2.4.1 2.4.2 3.6 Verzeichnis der Interviewpartnerinnen und -partner Ayoubi, Semya Fachreferentin Gesundheit, Eidgenössisches Departement des Innern (EDI) Binder, Thomas Generalsekretär, Vereinigung Pharmafirmen in der Schweiz (VIPS) Brun, Anita Pharmazeutin Sektion Medikamente, Bundesamt für Gesundheit (BAG) Christen, Thomas Persönlicher Mitarbeiter des Departementsvorstehers, Eidgenössisches Departement des Innern (EDI) Cueni, Thomas B. Generalsekretär, Interpharma Dörr, Petra Direktionsmitglied, Swissmedic Eggenberger, Marianne Projektleiterin Medikamente, Santésuisse Frey, Andrea Stv. Leiterin Sektion Medikamente, Bundesamt für Gesundheit (BAG); seit Okt. 2012 Leiterin der Sektion Gasche, Urs P. Vertretung Versicherte, Eidgenössische Arzneimittelkommission (EAK) Giger, Max Präsident der Eidgenössischen Arzneimittelkommission (EAK) und Vertretung Ärzteschaft Gnädinger, Cornelia Juristin Sektion Medikamente, Bundesamt für Gesundheit (BAG) Hölzle, Walter Präsident, Vereinigung Pharmafirmen in der Schweiz (VIPS) Huber, Peter Geschäftsführer, Intergenerika Meier, Christoph Q. Direktor, Santésuisse Mennet-von-Eiff, Mónica Vertretung Komplementärmedizin, Eidgenössische Arzneimittelkommission (EAK) Montandon, Jean-Blaise Vertretung in der EAK, Schweizerische Konferenz der kantonalen Gesundheitsdirektorinnen und -direktoren (GDK) Kessler, Margrit Präsidentin, SPO Patientenschutz Klaus, Guido Vertretung Versicherungen, Eidgenössische Arzneimittelkommission (EAK) Krayenbühl, Jean Christian Leiter Sektion Medikamente, Bundesamt für Gesundheit (BAG); bis Okt. 2012 Martinelli, Enea Vertretung Spitäler, Eidgenössische Arzneimittelkommission (EAK) Ruggli, Martine Vertretung Apothekerschaft, Eidgenössische Arzneimittelkommission (EAK) Sandmeier, Heiner Stv. Generalsekretär, Interpharma Schneider, Sandra Leiterin Abteilung Leistungen, Bundesamt für Gesundheit (BAG) Zwahlen, Roland Leiter Zulassung, Swissmedic 7837 Impressum Durchführung der Untersuchung Dr. Felix Strebel, PVK (Projektleitung) Dr. Simone Ledermann, PVK (wissenschaftliche Mitarbeit) Christoph Bättig, PVK (wissenschaftliche Mitarbeit) Quentin Scherrer, PVK (wissenschaftliche Mitarbeit) Dr. Josef Hunkeler (externe Beratung) Externer Expertenbericht «Rechtsgutachten» Prof. Dr. Thomas Gächter, Lehrstuhl für Staats-, Verwaltungs- und Sozialversicherungsrecht der Universität Zürich (Projektleitung) Arlette Meienberger (wissenschaftliche Mitarbeit) Externer Expertenbericht «Internationaler Vergleich» Prof. Dr. Tilman Slembeck, School of Economics & Political Science der Universität St. Gallen (Projektleitung) Dank Die PVK bedankt sich bei allen Gesprächspartnerinnen und Gesprächspartnern für ihre bereitwillige Teilnahme an den Gesprächen. Ein Dank geht ebenfalls an die Mitarbeitenden des BAG für die gute Zusammenarbeit und die Bereitstellung aller gewünschten Informationen. Abschliessend dankt die PVK den externen Experten für ihre wertvolle Unterstützung. Kontakt Parlamentarische Verwaltungskontrolle Parlamentsdienste CH-3003 Bern Tel. +41 58 322 97 99 Fax +41 58 322 96 63 E-Mail: [email protected] www.parlament.ch > Organe und Mitglieder > Kommissionen > Parlamentarische Verwaltungskontrolle Originalsprache des Berichts: Deutsch 7838