Fischer Kompakt: Entropie - ReadingSample - Beck-Shop
Werbung

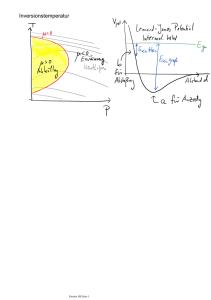
Fischer Kompakt: Entropie Bearbeitet von H. Dieter Zeh 1. Auflage 2005. Taschenbuch. 128 S. Paperback ISBN 978 3 596 16127 0 Format (B x L): 12,5 x 19 cm Weitere Fachgebiete > Mathematik > Stochastik > Mathematische Statistik schnell und portofrei erhältlich bei Die Online-Fachbuchhandlung beck-shop.de ist spezialisiert auf Fachbücher, insbesondere Recht, Steuern und Wirtschaft. Im Sortiment finden Sie alle Medien (Bücher, Zeitschriften, CDs, eBooks, etc.) aller Verlage. Ergänzt wird das Programm durch Services wie Neuerscheinungsdienst oder Zusammenstellungen von Büchern zu Sonderpreisen. Der Shop führt mehr als 8 Millionen Produkte. GRUNDRISS Die Freie Energie und ihre Verwandten ..................................................113 Hohlraumwellen und Quantengase ....................................................... 116 ANHANG Glossar ................................................................................................................ 120 Häufig benutzte Zeichen ..............................................................................124 Literaturhinweise ............................................................................................ 127 1. VON DER DAMPFMASCHINE ZUM UNIVERSUM Der Entropiebegriff hat sich ursprünglich aus einer rein technischen Fragestellung bei der Konstruktion von Wärmekraftmaschinen (»Dampfmaschinen«) entwickelt. Dabei entstand eine ganz neue physikalische Disziplin, die Thermodynamik oder Wärmelehre, deren allgemeine Bedeutung bald offenbar wurde. Während ihr zentraler Begriff, die bis dahin nur unzureichend definierte Temperatur, auf praktisch alle makroskopischen Objekte wie Gase, Flüssigkeiten, feste Körper und Stahlungsfelder, aber auch auf biologische Systeme anwendbar ist, überwindet der Entropiebegriff selbst Grenzen zwischen ganz unterschiedlichen Wissenschaften. Er hat sich nicht nur in anderen Naturwissenschaften wie Chemie, Biologie, Astronomie, Kosmologie und insbesondere für das Konzept der Evolution als bedeutsam erwiesen, sondern lässt sich als ein Maß für Unordnung sehr viel weitergehend anwenden – auch unabhängig von Begriffen wie Wärme und Dynamik. So wird er etwa in der Linguistik, Soziologie, Ökonomie, Ökologie und in der Kunsttheorie verwendet, insbesondere aber in der formalen Informationstheorie. Seine wichtigste Bedeutung erlangt der Entropiebegriff aber zweifellos in den dynamischen Disziplinen, und zwar durch den universellen Anspruch des empirisch begründeten zweiten Hauptsatzes der Thermodynamik. Dieser besagt, dass die Entropie eines abgeschlossenen Systems niemals abnehmen kann, und er charakterisiert durch ihre Zunahme die meisten (wenn nicht alle) zeitgerichteten Phänomene in der Natur, wie etwa Reibung, Diffusion, Zerfall, Strahlung, Gedächtnis, Altern oder ganz allgemein eine strukturelle Asymmetrie zwischen Ursachen und Wirkungen. Die Entropiezunahme ist auch die treibende Kraft hinter allen Evolutionsprozessen. Jedoch ist 3 S. 110 1. Von der Dampfmaschine zum Universum diese zeitliche Asymmetrie gerade für Physiker ein Problem, da die von ihnen entdeckten Naturgesetze die zeitliche Umkehrung aller Vorgänge erlauben würden. Zwar kann nur ein Teil der nach diesen Gesetzen möglichen Vorgänge in der Natur vorkommen, aber offenbar sind grundsätzlich solche ausgeschlossen, bei denen die Entropie abnimmt. Die Universalität und Einzigartigkeit des zweiten Hauptsatzes legt nahe, dass dieser auch die aller Erfahrung zugrunde liegende »Richtung der Zeit«, also den Unterschied zwischen Vergangenheit und Zukunft, begründet. Das für die dynamische Beschreibung verwendete Zeitkonzept lässt sich nämlich durch die reellen Zahlen darstellen, deren Vorzeichen keine absolute Bedeutung hat. Eine solche Begründung der von uns so drastisch erlebten Richtung in der Zeit setzt voraus, dass auch alle geistigen Vorgänge auf einer physiologischen und somit thermodynamischen Grundlage beruhen, wofür auch ein gewichtiges Konsistenzargument mit Hilfe von Maxwells Dämon spricht (s. Kap. 3.4). Auf diese Weise muss sich dann verstehen lassen, warum wir (Computer eingeschlossen) uns nur an die Vergangenheit, nicht aber an die Zukunft erinnern, und warum uns letztere auch in einer deterministischen Welt »offen« – und damit ein freier Wille möglich – erscheinen kann. Grob versteht man Entropie heute als ein Maß für die Zahl der mikroskopischen Zustände, in denen sich ein nur makroskopisch beschriebenes System infolge deren praktisch unkontrollierbarer (chaotischer) Natur befinden könnte. Mikroskopische Zustände werden etwa für ein Gas durch die Positionen und Geschwindigkeiten aller Moleküle dargestellt. Wenn diese Zustände deterministischen Gesetzen gehorchen (was erst im Rahmen der Quantentheorie in Frage gestellt wird), muss jeder von ihnen zwar genau einen bestimmten Nachfolger zu jeder späteren Zeit haben, infolge unkontrollierbarer Störungen aber weit mehr mögliche Nachfolger, wodurch die Entropie – wie es scheint – zunehmen muss. Nähme sie irgendwann ab, 4 1. Von der Dampfmaschine zum Universum könnten nicht alle anfangs angenommenen Zustände tatsächlich möglich gewesen sein. Man würde vielmehr schließen müssen, dass diese »konspirativ« (das heißt, ohne erkennbare Ursache) eingeschränkt waren. Diese sehr vorläufige und vage Beschreibung lässt allerdings noch viele Fragen offen, deren Beantwortung ein genaueres Verständnis der Natur im Kleinen wie im Großen erfordert. Zur Zeit als die Thermodynamik entstand, wurden Dampfmaschinen rein handwerklich schon seit hundert Jahren gebaut. James Watts Patent von 1769 betrifft bereits technische Details. Damals wurde Wärme, auf aristotelischen Vorstellungen beruhend, noch als eine eigenständige und unzerstörbare »Substanz« angesehen. Erst nachdem sie als eine spezielle Form von Energie, die sich in andere Formen umwandeln lässt, erkannt worden war, begann man sich zu wundern, warum das nicht vollständig möglich ist. Denn umgekehrt lassen sich etwa mechanische und elektrische Energie vollständig in Wärme transformieren. Die Antwort sollte sich später als die gleiche erweisen wie jene auf die Fragen, warum wir unwiderruflich altern oder warum wir nur Einfluss auf die Zukunft nehmen können. Die Entdeckung der Äquivalenz von Wärme und Energie wird dem Mediziner Julius Robert Mayer zugeschrieben. Der Erhaltungssatz für ihre Summe wurde später als erster Hauptsatz der Thermodynamik bezeichnet. Ähnlich wie kurz nach ihm Hermann von Helmholtz wurde Mayer im Jahre 1842 durch Stoffwechselvorgänge im Organismus zu seiner Erkenntnis geführt. Sie ist bezeichnend für den damals aufkommenden, noch romantischen Grundgedanken einer Vereinheitlichung aller Naturbeschreibung. Die Idee von Wärme als einer Energieform lag aber bereits in der Luft. Der Anglo-Amerikaner Benjamin Rumford hatte beim Bohren von Kanonenrohren für das bayrische Kriegsministerium schon um 1814, wenn auch noch ungenau, eine Beziehung zwischen mechanisch aufzuwendender Energie und der dabei entstehenden Reibungswärme beobachtet. James P. Joule fand als Mitarbeiter von Lord Kelvin (vormals William Thomson) kurz 5 1. Von der Dampfmaschine zum Universum nach Mayer, aber wohl unabhängig, ein sehr präzises Wärmeäquivalent zu der in Widerständen verloren gehenden elektrischen Energie. Elektrische und mechanische Energie lassen sich mit Hilfe eines Dynamos auch technisch ineinander umwandeln. Der Zusammenhang zwischen der nach Joule benannten Energieeinheit und der in Kalorien gemessenen Wärmemenge, 1. Von der Dampfmaschine zum Universum T1 ®Q 1 ® A =®Q 1 – ®Q 2 T2 ®Q 2 1 Joule = 1 Wsec = 1 kg m 2 / sec 2 = 10 7 erg = 0,2388 cal , S. 108 ist dem Laien heute vor allem aus Nahrungsmitteltabellen bekannt und kann ihm zum Beispiel verraten, dass die Nahrungsaufnahme von 2000 kcal im Tagesmittel ungefähr dem Energieverbrauch einer Glühbirne von 100 W entspricht. Aber »helle« macht uns diese Energie nur dann, wenn wir sie gezielt einzusetzen vermögen – und das ist zunächst eine Frage der Entropie. Als Ausgangspunkt für den physikalischen Entropiebegriff erwies sich aber ein schon 1824 von dem Franzosen Sadi Carnot während seines vorübergehenden Exils in Magdeburg diskutierter Modellprozess zur reversiblen (umkehrbaren) Umwandlung von Wärme in geordnete mechanische Energie. Dazu nahm er an, dass eine thermodynamisch genutzte Substanz (z. B. Dampf) Wärme aus einem Reservoir der Temperatur T1 (einem »Wärmebad«) aufnimmt, während sie durch Expansion gegen einen äußeren Druck mechanische Arbeit leistet. Die Wärme wird gewöhnlich durch Verbrennungsvorgänge, also chemisch, erzeugt. Später wird das Volumen unter Arbeitsaufwand bei einer geringeren Temperatur T2 wieder komprimiert, wobei (weniger) Wärme abgegeben wird. Zum Zwecke der Abkühlung von T1 auf T2 und der späteren Wiedererhitzung auf T1 sind zwei Zwischenschritte nötig, bei denen je eine weitere Expansion bzw. Kompression, aber diesmal unter thermischer Isolation, erfolgt. Dieser Carnot-Prozess ist nicht besonders praxisnah, aber da jeder seiner vier Schritte reversibel ist, beschreibt er das Maximum an 6 Abbildung 1: Schema der Carnot-Maschine unter Berücksichtigung des erst später entdeckten ersten Hauptsatzes. Die Differenz zwischen zugeführter und abgegebener Wärme wird in mechanische Arbeit verwandelt (oder umgekehrt). mechanischer Energie (geleisteter Arbeit) ∆ A, das sich durch Nutzung einer vorgegebenen Wärmemenge ∆Q1 aus einem Bad der Temperatur T1 unter Verwendung einer Kühlsubstanz der Temperatur T2 gewinnen lässt. (Das griechische Delta steht üblicherweise für ∆A eine Differenz oder einen Zuwachs.) Das Verhältnis — ∆Q 1 wird allgemein als Wirkungsgrad eines thermodynamischen Prozesses bezeichnet, sein im Carnot-Prozess erreichbares Maximum als C. Erst nachdem sich Wärme als eine Energieform herausgestellt hatte, ergab sich dieser Wirkungsgrad als eine reine Zahl, die wegen der beim Kühlen verlorenen Wärme kleiner als eins sein muss. Der Carnotsche Wirkungsgrad C ist unabhängig von der thermodynamischen Substanz und daher nur eine Funktion von T1 und T2. Mit der zuerst für ideale Gase (s. Kap. 2.1) eingeführten absoluten Temperatur ergab er sich explizit zu Q Q ∆Q1 T2 . ∆ A=∆ 1 – ∆ 2 T1 – T2 — =— =1–— C = — T T ∆Q1 1 1 Die Nutzung von Wärme verlangt daher eine möglichst große Temperaturdifferenz – ähnlich wie auch Wasserkraftwerke einen Höhenunterschied benötigen. 7 1. Von der Dampfmaschine zum Universum Die Umkehrbarkeit des Carnot-Prozesses kann man technisch in der Form von Wärmepumpen mit einem maximalen Wirkungsgrad 1 – C > 1 nutzen. In diesen wird mehr Wärmeenergie gewonnen als man an mechanischer oder elektrischer Energie aufwendet. Das ist möglich, weil man dabei einem kühleren Wärmebad T2 (etwa Grundwasser) Wärme entzieht. Dagegen ist es Verschwendung, »hochwertige« Energie (z. B. Elektrizität) durch direkte Umwandlung in Wärme zum Heizen zu verwenden, denn man muss zu ihrer Erzeugung in Wärmekraftwerken wegen des beschränkten Wirkungsgrades eine größere Menge an Wärme aufwenden. Jeder Kühlschrank ist eine Wärmepumpe, da er die Umgebung heizt, indem er Wärme von innen nach außen »pumpt«. (Auch bei einer Luftpumpe muss man in einem Kreisprozess Arbeit gegen die Druckdifferenz leisten.) Da reale thermodynamische Prozesse aber mehr Wärme abgeben und somit einen schlechteren Wirkungsgrad als der Carnot-Prozess haben ( ≤ C), sind sie grundsätzlich irreversibel, auch wenn man mit heutiger Technik einem reversiblen Prozess nahekommen kann. Rudolf Clausius erkannte im Jahre 1865 die Bedeutung der TatsaQ2 ∆Q1 che, dass die Quotienten ∆– T2 und – T1 (und nicht – wie Carnot und anfangs auch Kelvin noch glaubten – die Wärmemengen ∆Q selber) im Q Carnot-Prozess gleich sind. Die durch die Beziehung ∆S = ∆— T bis auf eine Konstante definierte Größe S ist also ähnlich einer Substanz unzerstörbar; sie kann nicht verschwinden – im Gegensatz zu einer eigentlichen Substanz aber entstehen. Clausius nannte sie Entropie (griechisch en tropei für umwandeln). In einem realen Kreisprozess gibt das System also netto Entropie ab, so dass diese während des Prozesses erzeugt worden sein muss. Beide Konsequenzen sind ganz ungewöhnlich: sowohl die Existenz einer »Pseudosubstanz« S nur für reversible Prozesse, als auch deren Zunahme in irreversiblen Prozessen. Clausius sah in der Unzerstörbarkeit der von ihm entdeckten, aber noch rätselhaften Entropie den eigentlichen Grund für den begrenzten Wirkungsgrad, was dann 8 2. Statistische Mechanik aber sehr viel weitergehende Bedeutung haben muss. So ist das aktuelle Energieproblem unserer Tage in Wirklichkeit ein Entropieproblem, denn Meer und Luft enthalten sehr große Mengen thermischer Energie, jedoch bei Temperaturen, die sie für eine Nutzung wertlos machen. Auch ist jede Art von Evolution, insbesondere die biologische, ein lokaler Kampf gegen die Entropiezunahme, der, wie bei einer Wärmepumpe, den Einsatz von hochwertiger äußerer Energie voraussetzt, die für die Evolution (relativ hochwertig) von unserer sehr heißen Sonne dargeboten wird. Aus dem irreversiblen Anwachsen der Entropie schlossen Kelvin und Clausius, dass jegliche Energie sich im Laufe der Zeit in Wärme verwandeln und die Welt schließlich einen »Wärmetod« sterben muss, wodurch jede mechanische Bewegung zum Stillstand kommt. Einem ähnlichen Argument war schon Newton wegen der Existenz von Reibungskräften begegnet, ohne dass er deren thermodynamischen Hintergrund kannte. Er beantwortete ihn mit der Bemerkung, dass »Gott die Welt gelegentlich wieder in Bewegung setzt«, weshalb Leibniz ihn der Blasphemie zieh, da er Gott mit einem schlechten Uhrmacher vergleiche. 2. STATISTISCHE MECHANIK Die obige Beschreibung thermodynamischer Vorgänge ist rein phänomenologisch. Weder die Natur der Wärme als eine Energieform noch die Entropie werden erklärt. Clausius und spätere »Energetiker« glaubten in der Tat, dass die der Materie innewohnende Energie und Entropie nicht weiter erklärbare »Grundsubstanzen« seien. Diese, wie auch der Begriff der Temperatur, haben sich dagegen als ableitbar erwiesen – nämlich durch Anwendung statistischer Argumente auf atomistische Vorstellungen. Dabei sind Atome und Moleküle wegen ihrer großen Zahl aber nur das am besten untersuchte »Parade9