Chemie - Schulbuchzentrum Online
Werbung

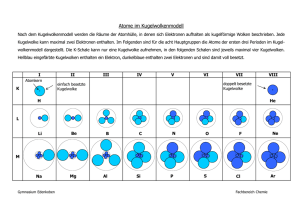
Brenneke ■ Buchmann ■ Hesse ■ Mebus ■ Schmidt Chemie Eine systematische Einführung 1. Auflage Bestellnummer 45847 45847_001_00.indb 1 29.09.2009 14:00:28 Haben Sie Anregungen oder Kritikpunkte zu diesem Produkt? Dann senden Sie eine E-Mail an [email protected] Autoren und Verlag freuen sich auf Ihre Rückmeldung. www.bildungsverlag1.de Bildungsverlag EINS GmbH Sieglarer Straße 2, 53842 Troisdorf ISBN 978-3-427-45847-0 © Copyright 2010: Bildungsverlag EINS GmbH, Troisdorf Das Werk und seine Teile sind urheberrechtlich geschützt. Jede Nutzung in anderen als den gesetzlich zugelassenen Fällen bedarf der vorherigen schriftlichen Einwilligung des Verlages. Hinweis zu § 52a UrhG: Weder das Werk noch seine Teile dürfen ohne eine solche Einwilligung eingescannt und in ein Netzwerk eingestellt werden. Dies gilt auch für Intranets von Schulen und sonstigen Bildungseinrichtungen. 45847_001_00.indb 2 29.09.2009 14:00:50 Inhaltsverzeichnis 1 Ordnung der Elemente und Aufbau ihrer Atome 1.1 1.2 1.3 1.3.1 1.3.2 1.4 1.5 2 32 32 33 35 38 41 41 44 44 48 52 Stöchiometrische Wertigkeit ............................................................. 53 Wertigkeiten und Periodensystem .................................................... 54 Benennung von Verbindungen aus zwei verschiedenen Elementen 4.1 4.2 5 Elektronenpaarbindung ..................................................................... Bindungsmechanismus ....................................................................... Strukturformel, Summenformel ........................................................... Polarität in der Elektronenpaarbindung ............................................... Stoffe mit Elektronenpaarbindung ........................................................ Ionenbindung .................................................................................... Bindungsmechanismus ....................................................................... Summenformel .................................................................................... Stoffe mit Ionenbindung ...................................................................... Metallbindung.................................................................................... Übergänge zwischen den Bindungsarten ......................................... Wertigkeit 3.1 3.2 4 6 10 14 14 16 23 25 Chemische Bindungen 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.2 2.2.1 2.2.2 2.2.3 2.3 2.4 3 Elemente............................................................................................. Bausteine der Atome.......................................................................... Atommodelle ...................................................................................... Atommodell nach Bohr ........................................................................ Kugelwolkenmodell nach Kimball ........................................................ Atommassen ....................................................................................... Periodensystem der Elemente ........................................................... Benennung unter Angabe der Wertigkeit ........................................ 57 Benennung auf der Grundlage der stöchiometrischen Verhältnisse 59 Chemische Reaktionen 5.1 5.2 5.3 5.4 5.5 Wesen chemischer Reaktionen .......................................................... Reaktionsgleichungen ........................................................................ Chemisches Gleichgewicht ................................................................ Aktivierungsenergie ........................................................................... Aufstellen von Reaktionsgleichungen ............................................... 61 62 64 66 69 3 45847_001_00.indb 3 29.09.2009 14:00:50 Inhaltsverzeichnis 6 Berechnung von Menge und Energie bei chemischen Reaktionen 6.1 6.2 6.3 6.4 6.5 7 Oxidation und Reduktion ................................................................... 89 Oxidationszahlen ............................................................................... 91 Redoxreaktionen ................................................................................ 95 Säuren, Laugen, Salze 8.1 8.2 8.3 8.4 8.5 8.6 8.6.1 8.6.2 8.6.3 8.7 8.8 8.8.1 8.8.2 9 74 76 78 80 85 Redoxreaktionen 7.1 7.2 7.3 8 Das Mol .............................................................................................. Berechnung der Stoffanteile.............................................................. Berechnung der Masse ..................................................................... Berechnung des Gasvolumens .......................................................... Berechnung der Reaktionsenthalpie ................................................. Säuren ................................................................................................ 100 Laugen ................................................................................................ 104 Stärke von Säuren und Laugen .......................................................... 106 pH-Wert .............................................................................................. 108 Neutralisation ..................................................................................... 113 Salze .................................................................................................. 114 Aufbau und Eigenschaften ................................................................... 114 Chemische Formeln und Bezeichnung von Salzen ................................ 118 Möglichkeiten der Salzbildung ............................................................. 120 Saure oder basische Reaktion von Salzlösungen (Hydrolyse) .......... 122 Lösungen ............................................................................................ 125 Löslichkeit ............................................................................................ 125 Konzentrationsmaße für Lösungen ....................................................... 126 Elektrochemie 9.1 9.2 9.3 9.4 9.4.1 9.4.2 9.5 Grundlagen ........................................................................................ 132 Normalpotenzial ................................................................................ 133 Spannungsreihe der Metalle.............................................................. 135 Galvanische Elemente ........................................................................ 137 Primärelemente.................................................................................... 137 Sekundärelemente ............................................................................... 139 Elektrolyse .......................................................................................... 141 4 45847_001_00.indb 4 29.09.2009 14:00:50 Inhaltsverzeichnis 10 Grundlagen der organischen Chemie 10.1 10.1.1 10.1.2 10.1.3 10.1.4 10.1.5 10.2 10.3 10.4 10.4.1 10.4.2 10.4.3 10.5 10.5.1 10.5.2 10.6 10.6.1 10.6.2 10.6.3 Struktur von Kohlenstoffverbindungen ............................................ 147 Gesättigte und ungesättigte Verbindungen .......................................... 147 Ketten- und ringförmige Verbindungen................................................ 147 Derivate ............................................................................................... 150 Radikale ............................................................................................... 151 Funktionelle Gruppen .......................................................................... 152 Formelschreibweise organischer Verbindungen ............................... 153 Isomerie .............................................................................................. 156 Homologe Reihen kettenförmiger Kohlenwasserstoffe .................... 157 Alkane.................................................................................................. 157 Alkene.................................................................................................. 159 Alkine .................................................................................................. 160 Systematische Benennung der Kohlenwasserstoffe und ihrer Derivate .............................................................................................. 161 Benennung kettenförmiger Kohlenwasserstoffe .................................... 161 Benennung ringförmiger Kohlenwasserstoffe ....................................... 166 Eigenschaften einiger Derivate der Kohlenwasserstoffe ................. 168 Alkohole (Alkanole) .............................................................................. 168 Aldehyde und Ketone (Alkanale und Alkanone) .................................... 168 Carbonsäuren (Alkansäuren) ................................................................ 169 11 Chemische Verfahren 11.1 11.1.1 11.1.2 11.1.3 11.2 11.2.1 11.2.2 11.2.3 11.3 11.3.1 11.3.2 Metallgewinnung ............................................................................... 171 Allgemeines ......................................................................................... 171 Eisen- und Stahlerzeugung ................................................................... 172 Aluminiumerzeugung .......................................................................... 178 Säureherstellung ................................................................................ 181 Allgemeines ......................................................................................... 181 Schwefelsäureherstellung nach dem Kontaktverfahren ......................... 182 Herstellung von Salpetersäure .............................................................. 185 Erdöl und Erdölverarbeitung ............................................................. 187 Zusammensetzung des Erdöls .............................................................. 187 Verarbeitung des Erdöls........................................................................ 188 5 45847_001_00.indb 5 29.09.2009 14:00:50 1 Ordnung der Elemente und Aufbau ihrer Atome 1.1 Elemente Jedes Wort, das wir schreiben, ist aus Buchstaben zusammengesetzt. Aus 26 Buchstaben können wir eine Vielzahl von Wörtern zusammenstellen. Ähnlich wie die Wörter unserer Sprache aus Buchstaben zusammengesetzt sind, so sind die Stoffe, aus denen unsere Umwelt und auch wir selbst bestehen, entweder Grundstoffe („Buchstaben“) oder aus Grundstoffen aufgebaut („Wörter“). In der Natur gibt es 92 Grundstoffe. Man bezeichnet sie als chemische Elemente. Alle Stoffe sind Grundstoffe oder aus Grundstoffen, chemischen Elementen, aufgebaut. Wichtige chemische Elemente sind zum Beispiel: Wasserstoff, Kohlenstoff, Stickstoff, Sauerstoff, Aluminium, Eisen und Kupfer. Zur vereinfachten Schreibweise verwendet man in der Chemie Symbole für die Kennzeichnung chemischer Elemente. Diese Symbole leiten sich aus den lateinischen oder griechischen Namen der Elemente ab. Beispiele deutscher Name des Elements lateinischer Name des Elements chemisches Symbol Wasserstoff Hydrogenium H Kohlenstoff Carboneum C Stickstoff Nitrogenium N Sauerstoff Oxygenium O Aluminium Aluminium Al Phosphor Phosphoros P Schwefel Sulfur S Chlor Chlorum Cl Eisen Ferrum Fe Kupfer Cuprum Cu 6 45847_001_00.indb 6 29.09.2009 14:00:50 1.1 Elemente Chemische Elemente werden durch Symbole gekennzeichnet. Die Verbreitung der chemischen Elemente in dem für uns zugänglichen Teil der Erde, also der Erdrinde, der Luft, dem Wasser und den Lebewesen ist sehr unterschiedlich. 2,2 % 1,3 % 1,0 % 1,4 % 2,6 % 2,8 % 3,4 % 27,5 % 7,3 % 50,5 % Silicium Eisen Natrium 83 übrige Elemente Sauerstoff Calcium Magnesium Aluminium Kalium Wasserstoff Verteilung der Elemente in der Erdrinde Die chemischen Elemente lassen sich in verschiedener Weise unterteilen. Eine Unterteilung ist z. B. die Unterscheidung in Metalle und Nichtmetalle. Metalle sind chemische Elemente, die folgende gemeinsame Eigenschaften besitzen: gute elektrische Leitfähigkeit, gute Wärmeleitfähigkeit, typischer Glanz, Lichtundurchlässigkeit, gute Formbarkeit. ● ● ● ● ● Beispiele Eisen Kupferrohre Silbermünze 7 45847_001_00.indb 7 29.09.2009 14:00:50 1 Ordnung der Elemente und Aufbau ihrer Atome Zur zeichnerischen Darstellung der Atome nach dem bohrschen Atommodell vereinfacht man die Schalen zu Kreisen, in deren Mittelpunkt der Atomkern liegt. H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar Elemente 1 bis 19 nach dem Atommodell von Bohr Dieses bohrsche Atommodell reicht noch heute oft aus, um chemische Vorgänge zu verstehen. Besser lassen sich der Aufbau von Stoffen und die chemischen Vorgänge jedoch an dem Kugelwolkenmodell darstellen, das der Amerikaner Kimball von 1951 bis 1958 erarbeitete. 1.3.2 Kugelwolkenmodell nach Kimball Nach dem Kugelwolkenmodell bewegen sich Elektronen so, dass der Eindruck entsteht, sie erfüllten einen kugelförmigen Raum. Diesen kugelförmigen Bewegungsraum bezeichnet man als Kugelwolke. Eine solche Kugelwolke wird von höchstens 2 Elektronen gebildet. Die Elektronen bewegen sich jedoch nicht nur innerhalb ihres Aufenthaltsbereichs – der Kugelwolke – sondern rotieren auch um ihre eigene Achse. Diese Eigenrotation nennt man Spin. Elektronen, die eine Kugelwolke bilden, haben gegensätzlichen Spin. Ein Elektron rotiert dabei rechtsherum, das andere linksherum. Bewegungsrichtung des Elektrons Spin Spin Eigenrotation (Spin) der Elektronen ■ ■ Die Elektronen bewegen sich in Kugelwolken. Eine Kugelwolke enthält höchstens zwei Elektronen. 16 45847_001_00.indb 16 29.09.2009 14:01:17 1.3 Atommodelle ● Das H-Atom (Ordnungszahl 1) Ein Wasserstoffatom enthält im Atomkern: 1 Proton in der Hülle: 1 Elektron Das Elektron bildet eine Kugelwolke um den Kern. Atomkern 1p + Kugelwolke aus 1 Elektron Wasserstoffatom ● Das He-Atom (Ordnungszahl 2) Ein Heliumatom enthält im Atomkern: 2 Protonen und 2 Neutronen in der Hülle: 2 Elektronen Die 2 Elektronen bilden eine Kugelwolke um den Kern. Atomkern (2p+2n) Kugelwolke aus 2 Elektronen Heliumatom Mit einem Elektron besetzte Kugelwolken sind hier hellrot, mit zwei Elektronen besetzte Kugelwolken dunkelrot dargestellt. ● Das Li-Atom (Ordnungszahl 3) Ein Lithiumatom enthält im Atomkern: 3 Protonen und 4 Neutronen in der Hülle: 3 Elektronen Die 2 Elektronen bilden eine Kugelwolke um den Kern. Das 3. Elektron bildet eine neue Kugelwolke, die um den Kern kreist. Kugelwolke aus 2 Elektronen Atomkern (3p+4n) Kugelwolke aus 1 Elektron Lithiumatom Dieser Vorgang wird hier – und in allen weiteren Atomdarstellungen – durch eine gestrichelte Außenlinie gekennzeichnet. ● Das Be-Atom (Ordnungszahl 4) Ein Berylliumatom enthält im Atomkern: 4 Protonen und 5 Neutronen in der Hülle: 4 Elektronen Die 2 Elektronen bilden eine Kugelwolke um den Kern. Die 2 anderen Elektronen bilden je eine Kugelwolke (insgesamt 3 Kugelwolken). Berylliumatom 17 45847_001_00.indb 17 29.09.2009 14:01:18 5.5 Aufstellen von Reaktionsgleichungen 3. Um zu frühes Zünden von Vergaserkraftstoffen zu vermeiden, setzt man dem Kraftstoff Bleitetraethyl zu. Ist dieser Zusatz ein positiver oder ein negativer Katalysator? 4. Wie führt man in den folgenden chemischen Vorgängen Aktivierungsenergie zu? a) Papier soll entzündet werden. b) Knallplättchen in einer Spielzeugpistole sollen zur explosionsartigen Reaktion gebracht werden. c) Das Luft-Treibstoff-Gemisch im Ottomotor soll verbrannt werden. Experiment Versuchen Sie ein Stück Würfelzucker mit einem Streichholz anzuzünden. Geben Sie etwas Zigarettenasche auf den Würfelzucker und versuchen Sie erneut zu zünden. Beschreiben Sie Ihre Beobachtung unter Verwendung der Begriffe Aktivierungsenergie und Katalysator. 5.5 Aufstellen von Reaktionsgleichungen Voraussetzung für das Aufstellen einer Reaktionsgleichung ist, dass die Edukte und Produkte der Reaktion bekannt sind. Die Aufstellung der Gleichung erfolgt dann in zwei Schritte: 1. Aufstellung der Formeln oder Symbole für Edukte und Produkte in Gleichungsform. 2. Ermittlung der Faktoren (Mindestzahlen) von Atomen oder Molekülen, welche miteinander reagieren. Bei einfachen Gleichungen geschieht die Ermittlung der Faktoren durch Vergleich der Anzahl der Atome auf beiden Seiten der Gleichung, denn auf beiden Seiten muss die gleiche Zahl von Atomen der gleichen Elemente stehen. 69 45847_001_00.indb 69 29.09.2009 14:02:16 5 Chemische Reaktionen Beispiel 1 Für die Verbrennung von Propan (C3H8) ist die Reaktionsgleichung aufzustellen: Propan reagiert bei der Verbrennung mit Sauerstoff zu Kohlendioxid und Wasser. 1. Symbole bzw. Formeln in Gleichungsform aufstellen + ? C3H8 ? O2 + ? CO2 3 C-Atome in den Edukten führen zu 3 CO2-Molekülen in den Produkten. 3 CO2 8 H-Atome in den Edukten führen zu 4 H2O-Molekülen in den Produkten. 2. Faktoren ermitteln 5 O2 ? H2O 4 H2O 6 O-Atome im Produkt CO2 verlangen 3 O2 in den Edukten. 4 O-Atome im Produkt H2O verlangen 2 O2 in den Edukten. 3. Gleichung schreiben C3H8 4. Probe 3C 8H 5 O2 + 3 CO2 + 4 H2O 3C 10 O 8H 4O 6O Beispiel 2 Mangan(V)-oxid reagiert mit Salzsäure (HCl) zu Mangan(IV)-chlorid und Wasser. 1. Symbole bzw. Formeln in Gleichungsform aufstellen ? MnO2 + ? HCl ? MnCl4 + ? H2O 4 HCl 2. Faktoren ermitteln 2 H2O 3. Gleichung schreiben MnO2 4. Probe 1 Mn 2O + 4 HCl MnCl4 + 2 H2O 1 Mn 2O 4 Cl 4 Cl Die Ermittlung der Faktoren durch Vergleich der Zahl der Atome ist bei umfangreichen Reaktionsgleichungen schwierig. In vielen Fällen lassen sich die Faktoren für eine Reaktionsgleichung dann einfacher aus mathematischen Gleichungen mit mehreren Unbekannten errechnen. 70 45847_001_00.indb 70 29.09.2009 14:02:16 5.5 Aufstellen von Reaktionsgleichungen Beispiel 1 Für die Verbrennung von Propan (C3H8) ist die Reaktionsgleichung aufzustellen: Propan reagiert bei der Verbrennung mit Sauerstoff zu Kohlendioxid und Wasser. 1. Symbole bzw. Formeln in Gleichungsform aufstellen ? C3H8 + ? O2 ? CO2 + ? H2O 2. Faktoren ermitteln 2.1 Faktoren in Form von Variablen eintragen a C3H8 + b O2 c CO2 + d H2O 2.2 Gleichungen für jedes Element aufstellen durch Vergleich der Atome auf beiden Seiten Gleichung für Kohlenstoff: Überlegung: In 1 C3H8-Molekül sind 3 C-Atome, demnach sind in a C3H8-Molekülen 3a C-Atome. In 1 CO2-Molekül ist ein C-Atom, demnach sind in c CO2-Molekülen c C-Atome. Gleiche Zahle von C-Atomen auf beiden Seiten ergibt: 3a = c (1) Gleichung für Sauerstoff: Gleichung für Wasserstoff: 2b = 2c + d (3) 8a = 2d (2) 2.3 Eine Unbekannte frei wählen Gewählt: a = 6 2.4 Die übrigen Unbekannten berechnen a = 6 in (1) eingesetzt: 3a = c 3·6=c 18 = c a = 6 in (2) eingesetzt: 8a = 2d 8 · 6 = 2d 24 = d c = 18; d = 24 in (3) eingesetzt: 2b = 2c + d 2b = 2 · 18 + 24 2b = 60 b = 30 a=6 b = 30 c = 18 d = 24 :6 3. Gleichung schreiben C3H8 + 4. Probe 3C 8H 2.5 Errechnete Werte auf kleinste ganzzahlige Werte bringen a=1 b=5 c=3 d=4 5 O2 3 CO2 + 4 H2O 3C 10 O 6O 8H 4O 71 45847_001_00.indb 71 29.09.2009 14:02:16 7 Redoxreaktionen Beispiele MgIIO–II Mg hat die Oxidationszahl +II, da Magnesium in der Ionenbindung zweifach positiv geladen ist. 1 · (+2) + 1 · (–2) = 0 O hat die Oxidationszahl -II, da der Sauerstoff in der Ionenbindung zweifach negativ geladen ist. Fe2IIIO3–II Fe hat die Oxidationszahl +III, da Eisen in der Ionenbindung dreifach positiv geladen ist. 2 · (+3) + 3 · (–2) = 0 O hat die Oxidationszahl –II, da der Sauerstoff in der Ionenbindung zweifach negativ geladen ist. CIVO2–II C hat die Oxidationszahl +IV, d. h., wäre CO2 eine Ionenbindung, dann wäre das Kohlenstoffatom vierfach positiv geladen. 1 · (+4) + 2 · (–2) = 0 O hat die Oxidationszahl –II, d. h., wäre CO2 eine Ionenbindung, wäre jedes der beteiligten Sauerstoffatome zweifach negativ geladen. In einer chemischen Verbindung ist die Summe der Oxidationszahlen gleich Null. Zur Ermittlung der Oxidationszahlen der Elemente geht man bei einfachen Verbindungen streng nach folgenden Schritten vor. Dabei ist zu beachten: Sollten sich zwei Schritte widersprechen, dann hat der vorherige Schritt Vorrang. Beispiel H2SO4 SiO2 NaH 1. Bei Metallen sind die Oxidationszahlen positiv. Das Vorzeichen (+) wird normalerweise nicht geschrieben. Na+H 2. Ionen erhalten die Oxidationszahl, die Art und Größe ihrer Ladung entspricht. Na+IH 3. Die Halbmetalle Bor und Silicium erhalten positive Oxidationszahlen. Auch hier wird das Vorzeichen (+) nicht geschrieben. Si+O2 92 45847_001_00.indb 92 29.09.2009 14:02:27 7.2 Oxidationszahlen 4. Folgende Elemente erhalten in einer Verbindung in der angeführten Reihenfolge ihre Oxidationszahlen: Fluor -I; Wasserstoff +I; Sauerstoff -II; Chlor, Brom und Iod je -I. 5. Für eine Verbindung werden die noch fehlenden Oxidationszahlen nach der folgenden Regel errechnet: „Die Summe der Oxidationszahlen einer elektrisch neutralen Verbindung ist gleich Null.“ H2ISO4–II H = +I entfällt, da sonst Verstoß gegen Schritt 1 bei Anwendung von Schritt 5. Si+O2–II H2ISxO4–II SixO2–II 2 · (+1) + x + 2 · (–2) NaHx x + 4 · (–2) =0 +1 + x = 0 =0 x = +4 x = –1 x = +6 H2ISVIO4–II SiIVO2–II NaIH–I Ein Element kann in verschiedenen Verbindungen unterschiedliche Oxidationszahlen haben. Beispiel Oxidationszahlen des Mangans in verschiedenen Manganoxiden MnIIO–II; Mn2IIIO3–II; MnIVO2–II; Mn2VIIO7–II Ag I Fe II, III, IV, V, VI Ra II Al III H -I, I S -II, I, IV, VI As -III, III,V Hg I, II Sb -III, III, IV, V Au III I -I, I, III, V, VII Se -II, I, IV, VI B III K I Si IV Ba II Mg II Sn II, IV Bi -III, III, V Mn II, III, IV, V, VI, VII Sr II Br -I, I, III, V N -III, -II, -I, I, II, III, IV, V Te -II, IV, VI C -IV, -II, II, IV Na I Ti III, IV Ca II Ni II, IV U IV, VI Cl -I, I, III, IV, V, VI, VII O -II W VI Co II, III P -III, III, V Zn II Cr II, III, IV Pb II, IV Cu I, II Pt II, IV, V, VI Oxidationszahlen der wichtigsten Elemente An der Änderung der Oxidationszahl eines Elements lassen sich Oxidation oder Reduktion des Elements in einer Reaktion erkennen. Die Oxidationszahl eines Elements nimmt bei der Oxidation des Elements zu, bei der Reduktion des Elements ab. 93 45847_001_00.indb 93 29.09.2009 14:02:27 8 Säuren, Laugen, Salze 8.1 Säuren Gibt man Nichtmetalloxide in Wasser, so bilden sich Verbindungen, welche sauer schmecken und typische Reaktionen aufweisen. Diese Verbindungen bezeichnet man als Säuren. Beispiele H2O + SO3 H2SO4 H2O + CO2 H2CO3 H2O + N2O5 2 HNO3 3 H2O + P2O5 2H3PO4 Schwefel(VI)-säure Kohlenstoffsäure Stickstoff(V)-säure Phosphor(V)-säure Herkömmlicher Name: Schwefelsäure Kohlensäure Salpetersäure Phosphorsäure Wasser + Nichtmetalloxid → Säure Als Säure wirken auch die Halogenwasserstoffverbindungen (Halogene: Elemente der 7. Hauptgruppe), wenn man sie in Wasser einleitet. Diese Gruppe der Säuren nennt man die Halogenwasserstoffsäuren. Beispiele HF Fluorwasserstoff in Wasser: HCl Chlorwasserstoff in Wasser: HBr Bromwasserstoff in Wasser: Fluorwasserstoffsäure Chlorwasserstoffsäure Bromwasserstoffsäure Herkömmlicher Name: Flusssäure Salzsäure Halogenwasserstoffverbindung in Wasser → Halogenwasserstoffsäure Bringt man eine Säure in Wasser, so reagiert sie mit dem Wasser. Dabei wandert der Atomkern des Wasserstoffs (H+) der Säure an ein Wassermolekül und bildet mit diesem ein positiv geladenes H3O+-Ion. Das H3O+-Ion bezeichnet man als Hydroniumion. Der Rest der Säure wird durch den Verlust des Wasserstoffkerns zum negativ geladenen Ion – man spricht vom Säurerestion. 100 45847_001_00.indb 100 29.09.2009 14:02:28 8.1 Säuren Beispiel Chlorwasserstoff reagiert mit Wasser zu Salzsäure: H2O + HCl H3O+ + Cl-. Das Chlorwasserstoffmolekül (HCl) ist wie das Wassermolekül (H2O) ein Dipolmolekül, denn Wasserstoff und Chlor unterscheiden sich in ihrer Elektronegativität. Wasserstoff hat eine Elektronegativität von 2,2; Chlor hat eine Elektronegativität von 2,83. Wassermolekül + Chlorwasserstoffmolekül Hydroniumion + Chloridion Kern des H-Atoms Kerne der H-Atome + + H H positive Seite H O + negative Seite H positive Seite Cl H O H + + Cl – negative Seite Bildung des Hydroniumions Wegen der elektrostatischen Anziehungskräfte zwischen Dipolmolekülen lagert sich jeweils ein Wassermolekül mit seiner negativ geladenen Seite an die positiv geladene Seite eines Chlorwasserstoffmoleküls an. Infolge der Anlagerung wandert der Kern des Wasserstoffs der Säure in eine mit zwei Elektronen besetzte Kugelwolke des Wassermoleküls. So entsteht ein H3O+-Ion, das durch den aufgenommenen H-Kern (Proton) positiv geladen ist. Es bleibt ein negativ geladenes Cl–-Ion zurück. Zur Vereinfachung schreibt und spricht man meist nicht von dem Hydroniumion (H3O+-Ion), sondern nur von einem Wasserstoffion (H+-Ion). Die Trennung des Wasserstoffions von der Verbindung ist eine Dissoziation. Man sagt darum: Säuren dissoziieren in Wasser in positiv geladene Wasserstoffionen und negativ geladene Säurerestionen. Beispiele Säuremolekül HCl HNO3 H2SO4 Wasserstoffion + Säurerestion H+ + Cl– H+ + NO3– + 2H + SO42– 101 45847_001_00.indb 101 29.09.2009 14:02:28 8 Säuren, Laugen, Salze Die Dissoziation der Säuren in Wasser ist Ursache für die typischen Eigenschaften der Säuren, wie z. B. ihr Lösungsverhalten für Metalle und die Leitung des elektrischen Stroms. Säuren sind Stoffe, die in Wasser in positiv geladene Wasserstoffionen und negativ geladene Säurerestionen dissoziieren: Säuremoleküle → Wasserstoffionen + Säurerestionen. Säuren, welche mehrere Wasserstoffatome in einem Molekül besitzen, nennt man mehrwertige Säuren. Mehrwertige Säuren dissoziieren in mehreren Stufen. Beispiele H3PO4 H2PO4– HPO42– H+ + H+ + H+ + H2PO4– HPO42– PO43– Mehrwertige Säuren dissoziieren in mehreren Stufen. Wasserstoffionen verursachen in verschiedenen organischen Verbindungen Reaktionen, welche mit starken Farbveränderungen verbunden sind. Diese Verbindungen nutzt man zum Nachweis von Säuren. Die Verbindungen werden als Indikatoren bezeichnet. Ein bekannter Indikator ist der Farbstoff Lackmus. Säuren färben mit blauem Lackmus getränktes Papier (Lackmuspapier) rot. blaues Lackmuspapier Salzsäure blaues Lackmuspapier Wasser Nachweis einer Säure mit Lackmuspapier ■ ■ Säuren können mit Indikatoren nachgewiesen werden. Säuren färben blaues Lackmus rot. 102 45847_001_00.indb 102 29.09.2009 14:02:30 8 Säuren, Laugen, Salze Aufgaben 1. Bei einem Versuch wird ein Salz in Wasser gelöst. a) Zunächst löst sich nicht alles Salz auf. Es bleibt ein Bodensatz. b) Durch Erhitzen gelingt es, alles Salz aufzulösen. Der Bodensatz verschwindet. c) Die Lösung wird noch weiter erhitzt. d) Man gibt in die hoch erhitzte Lösung noch etwas Salz, das sich ebenfalls auflöst. Danach kühlt man vorsichtig ab. Es scheidet sich noch kein Salz aus. Wie bezeichnet man in den Fällen a) bis d) die Lösung hinsichtlich ihrer Sättigung? 2. Benutzen Sie zur Lösung der folgenden Aufgaben das Diagramm aus Kapitel 8.8.1. a) 60 g KNO3 werden in 100 g Wasser gelöst. Auf welche Temperatur muss die Lösung erhitzt werden, damit alles KNO3 gelöst wird? b) Wie bezeichnet man die Lösung bei 80 °C in Bezug auf die Sättigung? 140 NO 3 Na 80 O 100 3 120 KN Löslichkeit des Salzes in Gramm je 100 g Wasser 3. a) Bestimmen Sie anhand des Diagramms, wie viel Gramm Kaliumnitrat 5 kg einer gesättigten Kaliumnitratlösung bei einer Temperatur von 40 °C enthalten. Berechnen Sie den Massenanteil in %. b) 240 g Natriumnitrat sollen vollständig in 200 g Wasser gelöst werden. Bestimmen Sie anhand des Diagramms die Mindesttemperatur, bei der das gesamte Natriumnitrat gelöst ist. Berechnen Sie den Massenanteil in %. KBr NH 4C 60 l KCl NaCl 40 20 0 0 10 20 30 40 50 60 70 Temperatur in °C 80 90 100 4. 80 g NaNO3 werden in 900 g Wasser gelöst. Wie hoch ist der Massenanteil der Lösung in %? 5. Wie viel g Kupfer enthält eine 3 %ige Kupfer(II)-sulfatlösung? 6. Zur Bekämpfung der Reblaus in den Weinbergen setzten die Winzer alljährlich eine Kupfer(II)-sulfatlösung ein. Wie viel Kilogramm Kupfer bringt ein Winzer in seinen Weinberg, wenn er 150 kg einer 5 %igen Kupfer(II)-sulfatlösung versprüht? 130 45847_001_00.indb 130 29.09.2009 14:02:41 8.8 Lösungen 7. 500 g einer 10 %igen Kochsalzlösung werden mit 800 g einer 20 %igen Kochsalzlösung gemischt. Wie groß ist der Massenanteil der neuen Lösung? 8. Es werden 250 g einer 22 %igen Natronlauge und eine 350 g einer 15 %igen Natronlauge vermischt. Berechnen Sie den Massenanteil der neuen Lauge. 9. Wie viel Gramm einer 8 %igen Natriumsulfatlösung müssen mit 400 g einer 12 %igen Natriumsulfatlösung zusammengeschüttet werden, damit eine 10 %igen Natriumsulfatlösung entsteht? 10. Wie viel Liter Ethanol enthalten 2 Liter eines Alkohols, der 32 Vol.-% Ethanol hat? 11. Bestimmen Sie für die folgenden Angaben die Stoffmengenkonzentration. gelöster Stoff Volumen der Lösung 10 g CaCl2 0,9 l 20 g FeSO4 1,5 l 40 g NH4NO3 3,0 l 30 g NO3 Stoffmengenkonzentration 800 ml 12. Welche der folgenden Arbeitsanweisungen zur Herstellung einer 1 molaren KBrLösung ist richtig? (M(KBr) = 119,01 g/mol) a) Es werden 119,01 g KBr abgewogen und in genau 1 l Wasser, das in einem Messkolben abgemessen wurde, gelöst. b) Es werden 119,01 g KBr abgewogen, in einen Messkolben von 1 l gegeben und mit Wasser zu genau 1 l aufgefüllt. 131 45847_001_00.indb 131 29.09.2009 14:02:42