Grundwissen 9. Klasse NTG - humboldt
Werbung

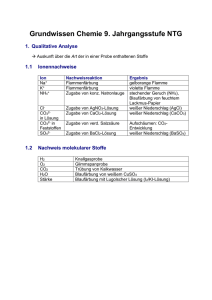
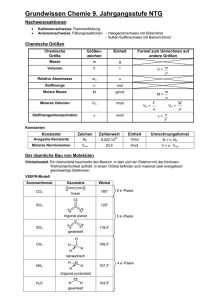
Grundwissen 9. Klasse NTG 9.1 Qualitative Analysemethoden • • • • • gibt Antwort auf Fragen nach der stofflichen Zusammensetzung Sauerstoff: Glimmspanprobe Wasserstoff: Knallgasprobe: 2 H2 + O2 → 2 H2O Alkalimetall-Kationen: Flammenfärbung (Vorprobe) Kohlenstoffdioxid: Fällungsreaktion mit Kalkwasser: Ca(OH)2 + CO2 → CaCO3 + H2O 9.2 Quantitative Aspekte chemischer Reaktionen: m g n= M g / mol Masse Stoffmenge n Volumen n= V l VM l / mol n= N NA M lässt sich aus dem Periodensystem ermitteln: Summe der Atommassen, dazu die Einheit g/mol VM = 22,4 [l/mol] (bei Normbedingungen) Teilchenzahl 1 1 / mol NA = 6,022 · 1023 [1/mol] Vorgehen zur Berechnung stöchiometrischer Aufgaben: 1. 2. 3. 4. gegebene und gesuchte Größen notieren Reaktionsgleichung aufstellen Stoffmengenverhältnis notieren Gleichung nach gesuchter Größe auflösen und gesuchte Größe berechnen 9.3 Molekülstruktur und Stoffeigenschaften Orbitalmodell: Die Elektronen in der Atomhülle befinden sich in Orbitalen (Ort mit der höchsten Aufenthaltswahrscheinlichkeit). Die Atomorbitale nehmen je nach Energiestufe und Schale verschiedene Gestalten an. Orbitale stellen vereinfacht gesehen Elektronenwolken dar, die mit je maximal zwei Elektronen besetzt sein können. Elektronenpaarabstoßungsmodell: Die negativ geladenen Elektronenwolken stoßen sich gegenseitig ab, so dass sie den größtmöglichen Abstand zueinander annehmen. Es ergeben sich folgende Molekülgestalten: Bindungen 4 Einfachbindungen Struktur Beispiel Tetraeder H C H H H CH4 3 Einfachbindungen, 1 freies Elektronenpaar pyramidal N H H 2 Einfachbindungen, 2 freie Elektronenpaare gewinkelt 1 Einfachbindung, 3 freie Elektronenpaare 2 Doppelbindungen linear O H2O linear H NH3 H H HF CO2 H O F C O Elektronegativität: Unter der Elektronegativität versteht man die Fähigkeit eines Atoms, die Elektronen innerhalb einer Elektronenpaarbindung an sich zu ziehen. Zwischenmolekulare Kräfte: • van-der-Waals-Wechselwirkungen: zwischen unpolaren Molekülen; beruhen auf spontanen und induzierten Dipolen; schwache Wechselwirkungen • Dipol-Dipol-Wechselwirkungen: zwischen Dipol-Molekülen oder zwischen Dipol-Molekülen und Ionen; relativ starke Wechselwirkung • Wasserstoffbrücken: Voraussetzungen: eine stark polare Bindung und ein stark elektronegatives Atom mit mindestens einem freien Elektronenpaar (z.B. H2O) 9.4 Protonenübergänge Säuren und saure Lösungen: Definition nach Brönsted: Säuren sind Verbindungen, die Wasserstoff-Ionen abspalten können (Protonendonatoren). Es bleibt ein Säurerest-Anion zurück. Saure Lösungen entstehen, wenn eine Säure ein Proton an ein Wassermolekül überträgt. Es entstehen ein Oxonium-Ion (H3O+) und ein Säurerest-Anion. Basen und alkalische Lösungen: Definition nach Brönsted: Basen sind Verbindungen, die Wasserstoff-Ionen aufnehmen können (Protonenakzeptoren). Alkalische Lösungen sind wässrige Lösungen, die Hydroxid-Ionen (OH-) enthalten. Säure-Base-Reaktionen: Säure-Base-Reaktionen sind Protonenübertragungsreaktionen (Protolysen). Sie laufen nach dem Donator-Akzeptor-Prinzip ab: Protonen werden von Säure-Teilchen auf Base-Teilchen übertragen. Ampholyte: Stoffe, die sowohl als Protonendonator (Säure) als auch als Protonenakzeptor (Base) wirken können; z.B. H2O → OH- + H+ H2O + H+ → H3O+ Neutralisation: Reaktion zwischen einer Säure und einer Base zu einer neutralen Lösung. Allgemein: Säure + Base → Wasser + Salz Beispiel: HCl + NaOH → H2O + NaCl Indikatoren: Stoffe, die durch ihre Farbe anzeigen, ob Lösungen sauer, alkalisch oder neutral sind. z.B.: Lackmus: sauer: rot; neutral: violett; alkalisch: blau Phenolphthalein: sauer: farblos; neutral: farblos; alkalisch: pink pH-Wert: Der pH-Wert ist ein Maß für den Gehalt einer Lösung an Oxonium-Ionen und Hydroxid-Ionen. Er gibt damit die Stärke der sauren bzw. alkalischen Lösung an. 1-6: sauer 7: neutral 8-14: alkalisch Stoffmengenkonzentration: n( X ) V (X ) Titration: c( X ) = Einheit: mol l Methode zur Ermittlung der Stoffmengenkonzentration. Dabei tropft man eine Maßlösung genau bekannter Konzentration zu einem bestimmten Volumen an Probelösung bis ein Indikator umschlägt. Die wichtigsten Säuren und Basen: Säuren: NAME FORMEL SÄUREREST NAME Salzsäure HCl Cl- Chlorid-Ion Schwefelsäure H2SO4 HSO4- Hydrogensulfat-Ion SO42- Sulfat-Ion H2PO4- Dihydrogenphosphat-Ion HPO42- Hydrogenphosphat-Ion PO43- Phosphat-Ion NO3- Nitrat-Ion Phosphorsäure H3PO4 Salpetersäure HNO3 Basen: Ammoniak NH3 Natronlauge NaOH Kalilauge KOH Kalkwasser (Calciumhydroxid) Ca(OH)2 9.5 Elektronenübergänge Redoxreaktionen: Redoxreaktionen sind Elektronenübertragungsreakionen. Sie laufen nach dem Donator-Akzeptor-Prinzip ab: • Oxidation: Abgabe von Elektronen; die Oxidationszahl wird erhöht • Reduktion: Aufnahme von Elektronen; die Oxidationszahl wird erniedrigt • Oxidationsmittel: Elektronenakzeptor • Reduktionsmittel: Elektronendonator z.B. Oxidation Reduktionsmittel: Fe 2 Fe+ 3 Br2 → 2 FeBr3 Reduktion Oxidationsmittel: Br2 Oxidationszahl: Oxidationszahlen sind gedachte Ladungszahlen, die Atomen in Elementen, Verbindungen und Ionen zugeordnet werden. Zur Bestimmung der Oxidationszahlen werden die Bindungselektronen dem elektronegativeren Bindungspartner zugeschrieben. Elektrolyse: Elektronlysen sind elektrisch erzwungene, endotherme Redoxreaktionen. • Voraussetzung: geschlossener Stromkreis: in den Kabeln fließen Elektronen, in der Lösung oder in der Schmelze findet Ionenwanderung statt • Kationen wandern zur Kathode (Minus-Pol) und werden dort reduziert. • Anionen wandern zu Anode (Plus-Pol) und werden dort oxidiert. Galvanische Elemente: Eine Zusammenstellung aus zwei verschiedenen, räumlich getrennten Redoxsystemen nennt man Galvanisches Element. Galvanische Elemente verwandeln chemische Energie in elektrische Energie.