Übungen zur Physik II PHY 121, FS 2017
Werbung

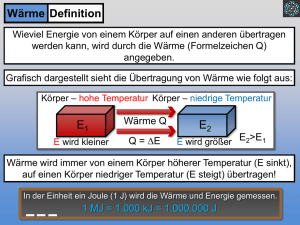
Übungen zur Physik II PHY 121, FS 2017 Abgabe: Dienstag, 14. März 1200 Serie 2 English terms: Innere Energie = internal energy Siedepunkt = boiling point Wahrscheinlichkeit = probability, likelihood Geschwindigkeitsverteilung = velocity distribution Wärme = heat Mechanisches Wärmeäquivalent = Joule’s equivalent Viskosität = viscosity Freie Weglänge = mean free path Wahrscheinlichkeitsdichte = probability density Brown’sche Bewegung = Brownian motion Wärmeenergie = heat/thermal energy Wärmekapazität = heat capacity Allgemeine Fragen 1. Was beschreiben die Begriffe Isotherme, Isochore und Isobare? Antwort: - Isotherme: Gesetz von Boyle-Mariotte: T = konst. ⇒ p · V = konst. ⇒ p ∝ V1 (Hyperbel) dQ = p · dV Beschreibt eine Änderung des Volumens und des Druckes, wenn die Temperatur konstant bleibt z.B.: aufsteigende Gasblasen eines Tauchers - Isochore: Gesetz von Gay-Lussac: V = konst. ⇒ Tp = konst. ⇒ p ∝ T (erscheint im pV-Diagramm als vertikale Gerade) dQ = dU = Cv · dT Eine Änderung des Drucks und der Temperatur, während das Volumen konstant bleibt zB: Erwärmung eines geschlossenen Gefässes: Dampfkochtopf; Abkühlung: dichter Kühlschrank - Isobare Gesetz von Amontons: p = konst. ⇒ VT = konst. ⇒ V ∝ T (erscheint im pV-Diagramm als horizontale Gerade) dQ = dU + p · dV = Cp · dT Beschreibt eine Änderung des Volumens und der Temperatur, bei der der Druck konstant bleibt z.B.: Gasballon, auf den die Mittagssonne scheint. 2. Was ist die Brown’sche Bewegung, was beschreibt die Maxwell-Boltzmann-Verteilung, was ist die freie Weglänge und was die mittlere Flugzeit? Antwort: Brownsche Bewegung: Temperaturabhängige, zufällige Zitterbewegung der Moleküle (random walk) hervorgerufen durch Stösse untereinander. 1 MB-Verteilung: Sie beschreibt die statistische Verteilung des Betrags v = |~v | der Teilchengeschwindigkeiten in einem idealen Gas. Die Wahrscheinlichkeit ein Teilchen im Intervall [v, v+dv] zu finden ist gegeben durch: 3/2 2 m − mv v 2 e 2kB T dv, (0.1) p(v)dv = 4π 2πkB T bzw. für die Wahrscheinlichkeit P ein Teilchen im Intervall [v1 , v2 ] zu finden: 3/2 Z v2 2 m − mv P = 4π v 2 e 2kB T dv. (0.2) 2πkB T v1 R∞ Da es sich um eine Wahrscheinlichkeitsdichte handelt, gilt 0 p(v)dv = 1 für alle Temperaturen. Das heisst die Fläche unter der Kurve ist immer 1! Für grössere Temperaturen wird die Verteilung breiter, somit niedriger und das Maximum liegt bei einem höheren Wert von v (siehe Abb. 1). Abbildung 1: Maxwell-Boltzmann-Verteilung für Stickstoff bei 100, 300 und 800 K [Grafik von http://de.wikipedia.org/] Beachte, dass für die Geschwindigkeit am p Maximum der Verteilung vmax , die mittlere Geschwindigkeit v̄ und die RMS Geschwindigkeit vRM S = v 2 gilt: Boltzmann-Faktor: vmax < v̄ < vRM S . (0.3) E W (E; T ) = exp − kB T (0.4) Wahrscheinlichkeit W , dass ein Teilen eines Systems mit Temperatur T die Energie E hat. Mittlere freie Weglänge: Die mittlere freie Weglänge ist die Länge die ein Teilchen in einem Material zurücklegen kann ohne Stoss mit anderen Teilchen. Somit hängt die Länge von der Teilchendichte n = N/V und dem totalen Wirkungsquerschnitt σ ab. Speziell in einem Gas erlauben Gleichgewichtsbetrachtungen der Moleküle unter Annahme einer Maxwellschen Geschwindigkeitsverteilung die Abschätzung λ= √ 2 1 2 2N V πd (0.5) wobei d dem Durchmesser des Gasmoleküls entspricht. Mittlere freie Flugzeit: Die mittlere freie Flugzeit für ein Molekül in einem Gas berechnet sich aus der mittleren freien Weglänge und der mittleren Geschwindigkeit der Moleküle (Maxwell-Boltzmann Geschwindigkeitsverteilung): τ=√ λ . 2 hvi (0.6) 3. Was ist innere Energie und was ist Wärme? Antwort: Innere Energie U (extensive Zustandsgrösse): Gesamte Energie aller N Moleküle in einem System. (Translationsenergie; evtl. Rotationsenergie und Vibrationsenergie; potentielle Energie) Im idealen Gas mit f Freiheitsgraden: U= f f N · kB · T = n · R · T 2 2 (0.7) Wärme Q (Prozessgrösse): Wärme Q ist Energie, die aufgrund eines Temperaturunterschieds zwischen zwei Systemen übertragen wird. Die Richtung der Energieübertragung ist dabei eindeutig. Die Wärme(energie) fliesst stets in die Richtung der niedrigen Temperatur. Der Wärmeübergang ist also ein irreversibler Prozess. 4. Was beschreibt der erste Hauptsatz der Thermodynamik? Antwort: Die Summe der einem System von aussen zugeführten Wärme und der zugeführten Arbeit ist gleich der Zunahme seiner inneren Energie. (Energieerhaltungssatz) dU = δQ + δW. (0.8) Beachte, dass oft auch einfach dU = dQ + dW geschrieben wird. Der Unterschied zwischen δ und d wird spätestens in der Thermodynamik Vorlesung klarer werden. Hier soll nur soviel gesagt werden, dass die innere Energie U eine Zustandsgrösse ist und damit ein totales Differential (dU ). Die rechten Grössen sind keine Zustandsgrössen und damit keine totalen Differentiale. Um diesen Unterschied herauszustreichen, wird in der Physik ein δ benutzt und kein d. Wichtig wird dies vor allem bei der Rechnung mit den entsprechenden Grössen. Konvention: Zugeführte Energie: positives Vorzeichen. Im Falle eines idealen Gases gilt δW = −p · dV und somit: dU = δQ − p · dV. 3 (0.9) Aufgaben 1 1. Hauptsatz [4P] Ein Gas-System geht vom Zustand a in den Zustand d über, und zwar auf drei verschiedenen Wegen, wie in der nebenstehenden Abbildung gezeigt. 1.5pi Die Wärme, die beim Prozess 1 dem Gas zugeführt wird ist 10pi Vi . Berechnen Sie für die Prozesse 2 und 3 die Änderung der inneren Energie, die geleistete Arbeit und daraus die dazu notwendigerweise zuzuführende Wärme (in Einheiten von pi Vi ). pi b 2 2 0.5pi a 1 3 3 d c Vi 5Vi Lösung Es gilt allgemein: dU = δQ + δW Z V2 W1→2 = − p(V )dV (1.1) (1.2) V1 und für ein ein-atomiges, ideales Gas: ∆U = 3 nR∆T 2 pV = nRT → T = (1.3) pV nR (1.4) Prozess 1:a → d Z Vb Wa→d, direkt = − p(V )dV = −4pi Vi (1.5) Va Prozess 2: a → b 1.5 · 5pi Vi 1pi Vi 39 − = pi Vi nR nR 4 0.5pi W = −(5 − 1)Vi · pi + = −5pi Vi 2 3 3 ∆U = nR∆T = nR 2 2 (1.6) (1.7) Der Ausdruck für W beschreibt die Fläche des oberen Dreiecks und des darunter liegenden Rechtecks mit der Höhe pi . Prozess 2: b → d 4 3 3 ∆U = nR∆T = nR 2 2 5pi Vi 1.5 · 5pi Vi − nR nR =− 15 pi Vi 4 W = 0 pi Vi (1.8) (1.9) Damit folgt für die totale zugeführte Wärme (beachte, dass negative innere Energie bedeutet, dass Wärme abgegeben wird): 39 59 ∆Qzu = ∆U − W = − (−5) pi Vi = pi Vi (1.10) 4 4 Mit derselben Strategie ergibt sich für Prozess 3: Prozess 3: a → c: 3 ∆U = − pi Vi 4 W = 0 pi Vi (1.11) (1.12) Prozess 3: c → d: 27 pi Vi 4 W = −3pi Vi ∆U = (1.13) (1.14) und somit Qzu = 39 pi Vi . 4 (1.15) 2 Gas-Statistik [4P] Ein Zylinder mit einem Volumen von 400 dm3 enthält Sauerstoff der Temperatur 25 ◦ C. Der Druck beträgt 15 bar. (a) [1P] Berechnen Sie die Dichte des Gases. (b) [1P] Wie gross ist die Wurzel der mittleren quadratischen Geschwindigkeit der Moleküle? (c) [1P] Wie gross ist die mittlere freie Weglänge der Sauerstoff-Moleküle? (d) [1P] Wieviele Stösse zwischen den Molekülen finden im Mittel pro Sekunde statt? Lösung Nehme Sauerstoff als ideales Gas an. MO2 = 2 · 16 g/mol. (a) Dichte pV = nRT m m V M ρ= = / = V n n V /n Mp ⇒ρ= RT kg = 19.4 3 . m 5 (2.1) (2.2) (2.3) (2.4) (b) Mittlere quadratische Geschwindigkeit Beachte den Unterschied zwischen der wahrscheinlichsten Geschwindigkeit (Maximum der Kurve) vmax , mittleren Geschwindigkeit hvi, mittleren quadratische Geschwindigkeit v 2 und deren Wurzel vRMS . s vmax = s hvi = 2kB T mO2 (2.5) 8kB T πmO2 (2.6) 2 3kB T v = mO s 2 3kB T vRMS = . mO2 (2.7) (2.8) O2 hat zwar f = 5 Freiheitsgrade und damit eine innere Energie von U = 25 nRT , davon sind aber nur f = 3 Freiheitsgrade der Translation, d.h. nur diese f = 3 tragen zur vRMS bei: r p hv 2 i = f RT m ≈ 482 . M s (2.9) Beachte, dass O2 theoretisch auch oszillieren könnte, was zwei Freiheitsgrade mehr bedeuten würde. Aus quantenmechanischen Betrachtungen (siehe z.B. Physik für Hochschulanfänger) findet man jedoch, dass die thermische Energie nicht ausreicht, um diese Schwingungen anzuregen. Ähnlich lässt sich der fehlende Freiheitsgrad um die Verbindungsachse des Moleküls erklären. (c) Mittlere freie Weglänge λ λ= √ 1 2 2N V πd (2.10) mit Durchmesser1 d = 0.29 nm für O2 . Mit Hilfe der idealen Gasgleichung (pV = N kB T ) eingesetzt folgt: kB T λ= √ ≈ 7.34 nm. 2πd2 p (2.11) (d) Anzahl Stösse pro Sekunde Die mittlere freie Flugzeit für ein Molekül ergibt sich dann aus hvi und λ: τ=√ λ . 2 hvi (2.12) Für die Anzahl Stösse aller Moleküle pro Sekunde ergibt sich dann: Z= 1 NA n 1 NA pV 1 N · = · = · τ 2 τ 2 τ 2RT ≈ 6.3 · 1036 s−1 (beachte den Faktor 1/2: Zähle Stoss von A mit B und B mit A nicht doppelt). 1 Halliday (p = 1.01 bar, T = 300 K) 6 (2.13) (2.14) 3 Mechanisches Wärmeäquivalent [2P] Wir wollen in einer etwas altmodischen Variante das mechanische Wärmeequivalent bestimmen. Als Einheit der Wärmemenge wurde 1 cal als diejenige Wärmemenge definiert, die 1 g Wasser von 14.5 0 C auf 15.5 0 C bei konstantem Druck erwärmt. Die Äquivalenz von Wärme und Energie wird mit dem Versuch von R. Mayer bestimmt (Seil reibt auf Trommel und erzeugt Wärme). Im Hörsaalversuch waren: Trommeldurchmesser = 46.5 mm, Trommelmasse = 103 g, Wärmekapazität der Trommel = 9.5 cal/K, Wasserfüllung = 50 cm3 , gemessene Temperaturänderung =23.2 ◦ C → 29 ◦ C bei n = 200 Umdrehungen, Masse m = 5 kg. Man bestimme mit diesen Daten das mechanische Wärmeäquivalent und vergleiche mit dem Literaturwert WAeq,mech = 4.1868 J/cal. Lösung Das mechanische Wärmeäquivalent kann durch das Verhältnis der geleisteten Arbeit ∆W zur aufgenommenen Wärmeenergie des Systems ∆Q bestimmt werden. Die Arbeit wird dabei in Einheiten von Joule und die Wärmeenergie in Einheiten von Kalorien bestimmt. Durch die Reibungskraft wird folgende Energie in das System geführt: ∆W = F ·s (3.1) = m·g·d·π·n (3.2) 2 = 5 kg · 9.81 m/s · 0.0465 m · π · 200 (3.3) = 1432.8 J. (3.4) Die Wärmeenergie, die Wasser (mit spez. Wärmekapazität cH2O = 1 cal/g/K nach Definition der Kalorie) und Kupferbehälter (mit Wärmekapazität CCu in [cal/K]) aufgenommen haben ergibt sich aus dem Temperaturanstieg: ∆Q = = (cH2O · mH2O + CCu ) · ∆T (3.5) (cH2O · VH2O · ρH2O + CCu ) · ∆T = (1000 cal/kg/K · 50 · 100 = 345.1 cal. −3 3 (3.6) 3 m · 1000 kg/m + 9.5 cal/K) · 5.8 K (3.7) (3.8) Somit ergibt sich für das mechanische Wärmeäquivalent WAeq,mech : ∆W ∆Q ≈ 4.15 J/cal, WAeq,mech = was sehr gut mit dem Literaturwert von WAeq,mech = 4.186 J/cal übereinstimmt. 7 (3.9) (3.10) 4 Thermodynamisches Gleichgewicht [2P] Betrachten Sie das skizzierte System und überlegen Sie, welches jeweils der thermodynamische Gleichgewichtszustand sein wird. Gezeichnet ist der Anfangszustand des Systems, das sich dann selbst überlassen bleibt. In den Volumina V1 und V2 befinden sich zwei verschiedene ideale Gase, am Anfang sind die Werte von p, V und T für die beiden Gase alle unterschiedlich. Am Ende des Prozesses bezeichnen wir die Grössen mit p0 , V 0 und T 0. Durch die Zwischenwand sind die beiden Teilsysteme in Wärmekontakt, aber das ganze System ist nach aussen isoliert. Es werden vier verschiedene Fälle unterschieden. Welche Grössen werden im Gleichgewicht gleich, welche bleiben verschieden (nicht rechnen, nur überlegen!). Begründen Sie Ihre Antworten in je einem Satz. p1 , T1 , V1 p2 , T2 , V2 Bezeichnen Sie in der folgenden Tabelle die Grössen, die im Gleichgewichtszustand auf beiden Seiten der Wand denselben Wert annehmen. Endzustand (i) Die Zwischenwand bleibt fest (ii) Die Zwischenwand ist beweglich (iii) Die Zwischenwand ist fest, aber für alle Teilchensorten durchlässig (iv) Die Zwischenwand ist fest, aber für die Teilchensorte links undurchlässig und für die Teilchensorte rechts durchlässig. T10 = T20 p01 = p02 V10 = V20 Endzustand (i) Die Zwischenwand bleibt fest (ii) Die Zwischenwand ist beweglich (iii) Die Zwischenwand ist fest, aber für alle Teilchensorten durchlässig (iv) Die Zwischenwand ist fest, aber für die Teilchensorte links undurchlässig und für die Teilchensorte rechts durchlässig. T10 = T20 X X X p01 = p02 V10 = V20 X ∗ Lösung X X ∗ : Das Gas 2 diffundiert nach links, da es das Gas 1 nicht ’sieht’. Der Gesamtdruck in der Kammer 1 ist dann die Summe der beiden Partialdrücke von Gas 1 und 2. Der Partialdruck von Gas 2 ist in beiden Kammern gleich. 24. März 2017 8