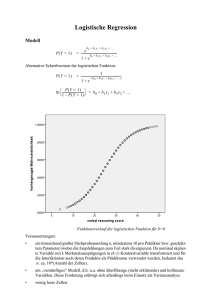
Fall-Kontroll-Studie zur Identifizierung von Risikofaktoren für den
Werbung

Aus der Abteilung für Medizinische Mikrobiologie der Ruhr-Universität Bochum Leiter: Prof. Dr. med. Sören Gatermann Fall-Kontroll-Studie zur Identifizierung von Risikofaktoren für den Erwerb von ESBL-E. coli und K. pneumoniae Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Tjorven Katharina Förster aus Bochum 2010 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. S. Gatermann Korreferent: Prof. Dr. rer. nat. H. J. Streckert Tag der Mündlichen Prüfung: 13.12.2011 Abstract Förster Tjorven Katharina Fall-Kontroll-Studie zur Identifizierung von Risikofaktoren für den Erwerb von ESBL-K. pneumoniae bzw. –E. coli Problem: Im Raum Bochum kam es seit 2005 zu einem dramatischen Anstieg von Infektionen mit ESBLproduzierenden E. coli- und Klebsiella pneumoniae-Stämmen. Die Bedeutung von Infektionen mit ESBL wurde bereits in einigen Studien durch eine signifikant höhere Letalität verdeutlicht. Ziel dieser Studie war es, Risikofaktoren für den Erwerb einer ESBL-Infektion zu identifizieren, insbesondere sollte untersucht werden, ob eine Antibiotika-Exposition einen signifikanten Risikofaktor darstellt. Methode: Zur Identifizierung der Risikofaktoren wurde eine Fall-Kontroll-Studie durchgeführt. Die Datenerhebung wurde retrospektiv im Zeitraum von Januar bis Dezember 2007 mittels eines strukturierten Datenerhebungsbogens durchgeführt. Insgesamt wurden die Daten von 120 Fällen und 120 Kontrollen aus dem Marienhospital Herne und der Transplantationsstation sowie der Transplantatambulanz des Knappschaftskrankenhauses Bochum ausgewertet. Beide Standorte sind als Universitätskliniken Krankenhäuser der Maximalversorgung. Univariate Berechnungen wurden mit die Mantel-Haenzel-Methode durchgeführt; Confounding Effekte wurden durch eine konditionale logistische Regression getestet. Dabei blieb die Paarung von Fällen und Kontrollen erhalten. Das Studiendesign bzgl. der Kontrollgruppenauswahl wurde im Gegensatz zu vielen anderen Studien entsprechend nach Harris et al. in optimaler Weise ausgesucht. Ebenfalls erfolgte eine Adjustierung bzgl. Komorbiditäten sowie „time at risk“. Ergebnis: Eine Antibiotikaexposition innerhalb von 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) konnte sowohl in der uni- als auch in der multivariaten Analyse mit einem Odds Ratio von 9,14 [95 % KI 1,59 - 52,43] eindeutig als signifikanter Risikofaktor zum Erwerb einer ESBL-Infektion festgestellt werden. Weitere Risikofaktoren sind Harnwegskatheter (Odds Ratio 2,807 [95% KI 1,235-6,381]), rezidivierende Harnwegsinfekte (Odds Ratio 4,043 [95% KI 1,870-8,739]), Lebererkrankungen (Odds Ratio 3,188 [95% KI 1,141-8,902]) und chronische Wunden (Odds Ratio 2,981 [95% KI 1,238-7,177]). Diskussion: Die Inzidenz an Infektionen mit ESBL-produzierenden Bakterien ist weltweit steigend [9], mittlerweile besonders in den osteuropäischen Ländern sowie in Asien und Südamerika. Die Therapieoptionen einer ESBL-Infektion sind stark eingeschränkt, da ESBL-produzierende Bakterien oft auch zusätzlich Resistenzen gegen andere Antibiotikaklassen aufweisen. Die Ursache der im Ergebnis dieser Studie identifizierten Risikofaktoren liegt hierbei wahrscheinlich im Selektionsdruck durch Cephalosporine und Penicilline als auch durch andere Antibiotikaklassen bei häufig gleichzeitig vorkommender Parallelresistenz. Die weiteren Risikofaktoren können durch eine höhere Wahrscheinlichkeit einer ESBL-Übertragung erklärt werden. Als Konsequenz dieser Ergebnisse leitet sich neben der Empfehlung der Vermeidung einer Übertragung durch präventive Hygienemaßnahmen die Empfehlung zur Antibiotikarestriktion und einem rationalen Einsatz von Antibiotika ab. Inhaltsverzeichnis 1. Einführung ...................................................................................................... 7 2. Methoden ..................................................................................................... 14 2.1. Definitionen von Fällen und Kontrollen ................................................. 14 2.2. Datenauswahl ....................................................................................... 15 2.3. Datenerhebung ..................................................................................... 16 3. Ergebnisse ................................................................................................... 21 3.1. Analyse aller 120 Fall-Kontroll-Paare: ................................................... 21 3.1.1. Demographische Daten ............................................................. 21 3.1.2. Antibiotikaexposition .................................................................. 23 3.1.3. Multivariate Berechnungen der Variable 'Antibiotika-Exposition' 25 3.1.4. medizinische Maßnahmen und Diagnostik ................................ 27 3.1.5. Komorbiditäten .......................................................................... 33 3.1.6. Multivariate Berechnungen weiterer Risikofaktoren................... 35 3.2. Subgruppenanalyse der 53 Fall-Kontroll-Paare der Transplantations- ..... patienten:............................................................................................. 36 3.2.1. Demographische Daten ............................................................. 36 3.2.2. Antibiotikaexposition .................................................................. 37 3.2.3. Multivariate Berechnungen der Variable 'Antibiotika-Exposition' 38 3.2.4. Medizinische Maßnahmen und Diagnostik ................................ 41 3.2.5. Komorbiditäten .......................................................................... 41 3.2.6. Multivariate Berechnungen der weiteren Risikofaktoren............ 45 3.3. Subgruppenanalyse der 67 Fall-Kontroll-Paare aus dem ........................ Marienhospital Herne .......................................................................... 47 3.3.1. Demographische Daten ............................................................. 47 3.3.2. Antibiotikaexposition .................................................................. 48 3.3.3. Multivariate Berechnungen der Variablen 'Antibiotika-Exposition' . ..................................................................................................... 49 3.3.4. Medizinische Maßnahmen und Diagnostik ................................ 51 3.3.5. Komorbiditäten .......................................................................... 52 3.3.6. Multivariate Berechnungen der weiteren Risikofaktoren............ 53 1 3.4. Subgruppenanalyse der Fälle mit ESBL-E. coli und deren ....................... zugehörige Kontrollen (77 Fall-Kontroll-Paare) ................................... 54 3.4.1. Demographische Daten ............................................................. 55 3.4.2. Antibiotikaexposition .................................................................. 56 3.4.3. Multivariate Berechnungen der Variable 'Antibiotika-Exposition' 57 3.4.4. medizinische Maßnahmen und Diagnostik ................................ 59 3.4.5. Komorbiditäten .......................................................................... 60 3.4.6. Multivariate Berechnungen weiterer Risikofaktoren................... 61 3.5. Subgruppenanalyse der Fälle mit ESBL-Klebsiella pneumoniae und ....... deren zugehörige Kontrollen (43 Fall-Kontroll-Paare): ........................ 63 3.5.1. Demographische Daten ............................................................. 63 3.5.2. Antibiotikaexposition .................................................................. 64 3.5.3. Multivariate Berechnungen der Variable 'Antibiotika-Exposition' 65 3.5.4. medizinische Maßnahmen und Diagnostik ................................ 68 3.5.5. Komorbiditäten .......................................................................... 70 3.5.6. Multivariate Berechnungen der weiteren Risikofaktoren............ 70 4. Diskussion .................................................................................................... 72 4.1. Hintergrund ........................................................................................... 72 4.2. Konzeption der Studie ........................................................................... 72 4.3. Ergebnisse ............................................................................................ 77 4.4. Konsequenzen ...................................................................................... 83 5. Zusammenfassung....................................................................................... 84 5.1. Allgemeines zu ESBL ........................................................................... 84 6. Literaturverzeichnis ...................................................................................... 86 Tabellenverzeichnis Tabelle 1: Klassifikation der Betalaktamasen [24] ..................................................... 8 Tabelle 2: Mittelwerte des Lebensalters in Jahren der Fall- und Kontrollgruppe aller 240 Patienten .................................................................................................. 23 Tabelle 3: univariate Berechnungen nach der Methode von Mantel-Haenszel zu Geschlecht und Alter aller 240 Patienten ................................................................ 23 Tabelle 4: Univariate Berechnungen der Antibiotikaexposition aller 240 Patienten nach Antibiotikagruppen nach der Methode von Mantel-Haenszel ......................... 24 2 Tabelle 5: Antibiotikaexposition aller 240 Patienten in paarweiser Auswertung durch „Match Sets“ .................................................................................................. 24 Tabelle 6: Univariate Berechnungen der Antibiotikaexposition aller 240 Patienten nach einzelnen Antibiotikagruppen nach der Methode von Mantel-Haenszel ......... 25 Tabelle 7: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 5.6 (95 %-Konfidenzintervall von 2.16 bis 14.5) bezogen auf alle 240 Patienten ................................................................................................................. 26 Tabelle 8: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der aller 240 Patienten ................................................................................................................. 27 Tabelle 9: Mittelwerte des Zeitraumes auf der Intensivstation in Tagen/ vorherige Krankenhausaufenthalte der Fall- und Kontrollgruppe aller 240 Patienten ............. 28 Tabelle 10: Mittelwerte der Dauer der Beatmung, zentralvenöser-/Shaldonkatheter (ZVK) und Harnwegskatheter (HWK) der Fall- und Kontrollgruppe aller 240 Patienten ................................................................................................................. 29 Tabelle 11: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik aller 240 Patienten nach der Methode von Mantel-Haenszel ................ 31 Tabelle 12: Mittelwerte des Zeitraumes 'time at risk' der Fall- und Kontrollgruppe aller 240 Patienten in Tagen ................................................................................... 32 Tabelle 13: univariate Berechnungen der Komorbiditäten aller 240 Patienten nach der Methode von Mantel-Haenszel................................................................. 33 Tabelle 14: Anteil der Patienten mit neurologischen Erkrankungen und Diabetes mellitus berechnet nach der Methode des Risikoschätzers (SPSS)........................ 34 Tabelle 15: Patientenanteil aller 240 Patienten mit vorherigem Aufenthalt auf der Intensivstation im Zusammenhang mit verschiedenen Komorbiditäten, medizinischen Maßnahmen und Antibiotika berechnet nach der Methode des Risikoschätzers (SPSS) .......................................................................................... 35 Tabelle 16: Multivariate Berechnungen aller 240 Patienten zur Identifizierung von Risikofaktoren durch die binominale logistische Regression ............................ 35 Tabelle 17: univariate Berechnungen zu Geschlecht, Alter und Verlegungen der Subgruppe der Transplantationspatienten nach der Methode von MantelHaenszel ................................................................................................................. 37 Tabelle 18: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe der Transplantationspatienten .............................................................. 37 Tabelle 19: Univariate Berechnungen der Antibiotikaexposition der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel ................ 38 Tabelle 20: Konditionale logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 2.67 (95 %-Konfidenzintervall von 0.71 bis 10.05) bez. auf Subgruppe der Transplantationspatienten .............................................................. 39 Tabelle 21: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotika-Exposition' durch die konditionale logistische Regression der Subgruppe der Transplantationspatienten .............................................................. 40 3 Tabelle 22: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel ..................................................................................................... 41 Tabelle 23: univariate Berechnungen der Komorbiditäten der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel....................... 42 Tabelle 24: Zeitraum zwischen der letzten Transplantation und der Erstisolierung (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) aus der Subgruppe der Transplantationspatienten berechnet nach der Methode des Risikoschätzers (SPSS) .......................................................................................... 43 Tabelle 25: Patienten mit einer Transplantation vor weniger als 30 Tagen und verschiedenen medizinischen Maßnahmen bzw. Antibiotikaexposition in univariater Berechnung nach der Methode des Risikoschätzers (SPSS)................ 44 Tabelle 26: Immunsuppressive Therapie der Subgruppe der Transplantationspatienten berechnet nach der Methode des Risikoschätzers (SPSS) .................................................................................................................... 45 Tabelle 27: Multivariate Berechnungen der Subgruppe der Transplantationspatienten zur Identifizierung von Risikofaktoren durch die binominale logistische Regression .......................................................................... 46 Tabelle 28: univariate Berechnungen nach der Methode von Mantel-Haenszel zu Geschlecht und Alter der Subgruppe des Marienhospitals ................................. 47 Tabelle 29: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe des Marienhospitals .............................................................................. 47 Tabelle 30: Univariate Berechnungen der Antibiotikaexposition der Subgruppe des Marienhospitals nach der Methode von Mantel-Haenszel ................................ 49 Tabelle 31: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 10 (95 % KI-Konfidenzintervall von 2.34 bis 42.78) bezogen auf Subgruppe des Marienhospitals ......................................................... 50 Tabelle 32: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der Subgruppe des Marienhospitals .............................................................................. 51 Tabelle 33: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe des Marienhospitals nach der Methode von MantelHaenszel ................................................................................................................. 52 Tabelle 34: univariate Berechnungen der Komorbiditäten der Subgruppe des Marienhospitals nach der Methode von Mantel-Haenszel....................................... 53 Tabelle 35: Multivariate Berechnungen der Subgruppe des Marienhospitals zur Identifizierung von Risikofaktoren durch die binominale logistische Regression ..... 54 Tabelle 36: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe mit ESBL- E. coli ................................................................................... 55 Tabelle 37: univariate Berechnungen zu Geschlecht und Lebensalter der Subgruppe mit ESBL- E. coli nach der Methode von Mantel-Haenszel .................. 55 Tabelle 38: Univariate Berechnungen der Antibiotikaexposition der Subgruppe mit ESBL-E. coli nach der Methode von Mantel-Haenszel ...................................... 57 4 Tabelle 39: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 3,0 (95 %-Konfidenzintervall von 1,09 bis 8,25) bezogen auf die Subgruppe mit ESBL-E. coli ......................................................... 58 Tabelle 40: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der Subgruppe mit E. coli .............................................................................................. 59 Tabelle 41: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe mit ESBL-E. coli nach der Methode von MantelHaenszel ................................................................................................................. 60 Tabelle 42: univariate Berechnungen der Komorbiditäten der Subgruppe mit ESBL-E. coli nach der Methode von Mantel-Haenszel............................................ 61 Tabelle 43: Multivariate Berechnungen der Subgruppe mit ESBL-E. coli zur Identifizierung von Risikofaktoren durch die binominale logistische Regression ..... 62 Tabelle 44: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe mit ESBL-K. pneumoniae ..................................................................... 63 Tabelle 45: univariate Berechnungen zu Geschlecht und Lebensalter der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell ... 63 Tabelle 46: Univariate Berechnungen der Antibiotikaexposition der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell...................... 65 Tabelle 47:konditionale logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 1615474835 (95 %-Konfidenzintervall von 0 bis ∞) bez. auf Subgruppe mit ESBL-K. pneumoniae ..................................................................... 66 Tabelle 48: logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 20.28 (95 %-Konfidenzintervall von 2.52 bis 162.82) bez. auf Subgruppe mit ESBL-K. pneumoniae.............................................................................................. 67 Tabelle 49: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' der Subgruppe mit K. pneumoniae durch die logistische Regression mit einem generalisierten linearen Modell ............................................ 68 Tabelle 50: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell ........................................................................................................ 69 Tabelle 51: univariate Berechnungen der Komorbiditäten der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell ........................... 70 Tabelle 52: Multivariate Berechnungen der Subgruppe mit ESBL- K pneumoniae zur Identifizierung von Risikofaktoren durch die binominale logistische Regression .............................................................................................................. 71 5 Abbildungsverzeichnis Abbildung 1:Geschlechterverteilung aller 240 Patienten in Prozent und Anzahl in der Fall- und Kontrollgruppe ................................................................................ 22 Abbildung 2:Verteilung des Lebensalters in Jahren aller 240 Patienten getrennt nach Fall- und Kontrollgruppe ................................................................................. 22 Abbildung 3:Anzahl an Krankenhausaufenthalten in den letzten 12 Monaten sortiert nach Fällen und Kontrollen.......................................................................... 28 Abbildung 4:Anzahl der Patienten mit der Aufenthaltsdauer auf der Intensivstation vor Erstisolierung (bei Fällen) und bis zur Entlassung (bei Kontrollen); gemessen in Tagen................................................................................................. 29 Abbildung 5:Anzahl der Patienten mit mechanischer Beatmung vor Erstisolierung (bei Fällen) / Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen ...................................................................................................................... 30 Abbildung 6:Anzahl der Patienten mit ZVK /Shaldonkatheter vor Erstisolierung (bei Fällen)/ Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen ...................................................................................................................... 30 Abbildung 7:Anzahl der Patienten mit HWK vor Erstisolierung (bei Fällen)/ Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen .............. 31 Abbildung 8:Häufigkeitsverteilung des Zeitraumes 'time at risk' in Prozent im Vergleich von Fall- und Kontrollgruppe nach der Anzahl der Tage ......................... 32 Abbildung 9:Duale Kombination und Tripple- Kombination der immunsuppressiven Therapie ............................................................................................ 45 6 1. Einführung Im Raum Bochum ist seit einigen Jahren eine Zunahme von E. coli und K. pneumoniae-Isolaten mit sogenannten Extended-spectrum betalactamasen (ESBLs) zu verzeichnen. K. pneumoniae-Isolate mit ESBLAktivität sind seit 2005 auf mittlerweile 20% angestiegen, bei ESBLE. coli kam es zu einer etwas geringeren Zunahme auf 11%. ESBLs sind Enzyme, die bei gram negativen Bakterien vorkommen und eine Resistenz gegen die meisten Betalaktam-Antibiotika wie Penicilline, Cephalosporine und Monobactame vermitteln, nicht jedoch gegen Carbapeneme und Cephamycine. ESBLs lassen sich durch Betalaktamaseinhibitoren wie Clavulansäure inhibieren. Enterobacteriaceae manifestieren eine Resistenz gegen BetalaktamAntibiotika hauptsächlich über Betalaktamasen, welche den Betalaktamring spalten und somit die Betalaktam- Antibiotika inaktivieren [21]. Andere Resistenzmechanismen wie Porinverlust spielen demgegenüber für die Resistenz gegen Betalaktame bei Enterobacteriaceae nur eine untergeordnete Rolle. Betalaktamasen wirken im periplasmatischen Raum, wo sie die Antibiotika attackieren, bevor diese an ihre Zielstrukturen binden können [11]. Betalaktamasen sind eine heterogene Gruppe von Enzymen, von denen mittlerweile ca. 700 verschiedene beschrieben worden sind. Sie zeichnen sich aus durch eine gemeinsame Grundstruktur von Alphahelices und Beta-Faltblättern, zeigen jedoch eine große Variabilität in ihren Aminosäure-Sequenzen [24]. Die Einteilung der Betalaktamasen erfolgt durch die Klassifizierung nach Ambler sowie nach Bush-Medeiros-Jacoby (Tabelle 1). 7 Tabelle 1: Klassifikation der Betalaktamasen [24] Bush-Medeiros-Jacoby Hauptuntergruppen AmblerSystem Hauptcharakteristika bzw. wichtige Vertreter C Resistenz gegen alle Betalaktame außer Carbapenemen; nicht durch Clavulansäure inhibiert Beispiel: AmpC-Betalaktamasen 2a A hydrolysieren Penicilline; Clavulansäure; Beispiele: Staphylokokken 2b A hydrolysieren Penicilline und Cephalosporine der ersten Generation; hemmbar durch Clavulansäure; Beispiele: TEM-1, TEM-2, SHV-1 2be A hydrolysieren Penicilline, Monobactame und Cephalosporine der ersten, zweiten und dritten Generation; hemmbar durch Clavulansäure; Beispiele: ESBLs vom Typ TEM-3, SHV-2, CTX-M 2br A Beispiele: inhibitorresistente TEM 2c A hydrolysieren Carbenicilline; hemmbar durch Clavulansäure; Beispiele: PSE-1, PSE-3, PSE-4 2e A Beispiel: induzierbare Proteus vulgaris 2f A hydrolysieren Penicilline, Carbapeneme; hemmbar Beispiele: KPC, GES-2 2d D Cloxacillin- bzw. Oxacillin-hydrolysierend; Beispiele: OXA-Enzyme 3 B zinkabhängige Metalloenzyme; hydrolysieren Penicilline, Cephalosporine und Carbapeneme, nicht jedoch Monobactame (Aztreonam); hemmbar durch EDTA; Beispiele: Metallo-Betalaktamasen VIM oder IMP Gruppe 1 Cephalosporinasen Gruppe 2 Penicillinasen Gruppe 3 Metallobetalaktamasen hemmbar durch Penicillinasen bei Cephalosporinase von Cephalosporine und durch Clavulansäure; Das Ambler-Schema wird nach Proteinhomologien der verschiedenen Enzyme in die Gruppen A bis D unterteilt. Die Gruppen A, C und D umfassen Serin-Betalaktamasen, Gruppe B hingegen MetalloBetalaktamasen [22]. Das Klassifikationssystem nach Bush-MedeirosJacoby gliedert sich nach funktioneller Ähnlichkeit der Enzyme in ihrem Substrat- und Inhibitorprofil in 4 Hauptgruppen sowie mehreren Subgruppen [22]. Die Enzyme der Gruppe 1 hydrolysieren Penicilline und Cephalosporine und werden nur in einem geringen Maße durch Clavulansäure inhibiert, wohingegen die der Gruppe 2 eine gute Inhibition aufweisen. In Gruppe 2 gehören z.B. die Enzyme TEM-1 und TEM-2 sowie SHV-1, die zu einer Resistenz gegen Penicillin und Ampicillin führen [22]. In Gruppe 3 werden die Metallo-Enzyme 8 eingeordnet, die zusätzlich auch Carbapeneme hydrolysieren und ebenfalls durch Clavulansäure nicht inhibiert werden [33]. ESBLEnzyme gehören zur Klasse A nach Ambler oder zur Gruppe 2be nach Bush-Medeiros-Jacoby [24]. Einige ESBLs haben ihren Ursprung in den Betalaktamasen vom TEMund SHV-Typ [21]. ESBLs vom TEM-Typ sind Derivate von TEM-1 und TEM-2. Letztere hydrolysieren Ampicillin, Carbenicillin, Oxacillin oder Cephalothin und werden durch Clavulansäure gehemmt [22]. TEMEnzyme sind erstmals in E. coli gefunden worden und sind meistens plasmidkodiert oder mit Transposons assoziiert, wodurch TEM-1 auf andere Spezies übertragen werden konnte. SHV-1 ist bei K. pneumoniae vorwiegend chromosomalkodiert, wurde plasmidkodiert seit den 60er Jahren aber auch bei E. coli und anderen Enterobacteriaceae gefunden [11]. Es sind bisher ca. 160 TEMSubtypen, mehr als 100 SHV-Subtypen und ca. 60 CTX-M-Subtypen unter den ESBL-produzierenden Bakterien bekannt [21]. ESBLs, die sich zum Teil nur um wenige Aminosäuren von den ursprünglichen Betalaktamasen TEM-1, TEM-2 oder SHV-1 unterscheiden, spalten auch Cephalosporine der zweiten und dritten Generation mit einer Oxyminoseitenkette. Im Gegensatz zu den ESBLs vom TEM- und SHV-Typ, die durch Mutationen aus Betalaktamasen mit schmalem Spektrum wie TEM-1, TEM-2 oder SHV-1 hervorgegangen sind, entstammen ESBLs vom CTX-M-Typ chromosomalkodierten und nur gering exprimierten intrinsischen Betalaktamasen aus verschiedenen Spezies der Gattung Klyuvera [21]. ESBL-Enzyme vom CTX-M-Typ hydrolysieren Cefotaxim und Ceftriaxon besser als Ceftazidim. Bestimmte Insertionssequenzen (ISEcp1) und Transposasen (ISCR1) ermöglichten die Mobilisation der chromosomal kodierten intrinsischen Betalaktamasen von Klyuvera spp. auf Plasmide 9 und schließlich die Ausbreitung dieser Gene in zahlreichen Enterobacteriaceae-Spezies. CTX-M-ESBLs werden in fünf große Cluster, nämlich CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 und CTX-M25 eingeteilt. Die Gene für ESBL liegen fast immer auf Plasmiden. Ferner sind sie assoziiert mit mobilisierenden Elementen wie Transposons und können somit innerhalb einer Bakterienzelle von einem Plasmid auf ein anderes übertragen werden. Somit kann die Ausbreitung von ESBLproduzierenden Bakterien über zwei Mechanismen erfolgen. Einerseits können ESBL-Gene über Plasmidtransfer zwischen unterschiedlichen Bakterienspezies oder klonal unterschiedlichen Stämmen der gleichen Spezies übertragen werden. Andererseits können aber auch klonal identische ESBL-tragende Bakterien von Patient zu Patient übertragen werden [22]. Viele ESBL-produzierende Organismen haben eine minimale Hemmkonzentration (MHK-Werte), die unter dem CLSI-Grenzwert (Clinical and Laboratory Standards Institute) für Resistenz oder intermediäre Empfindlichkeit liegen [24]. Die Detektion von ESBL ist daher nicht trivial und erfordert spezielle Testverfahren. Alle phänotypischen Testverfahren beruhen darauf, dass eine Aktivität von ESBL gegen Drittgenerationscephalosporine und Aztreonam durch Clavulansäure oder andere Betalaktamaseinhibitoren gehemmt werden kann. Diese Eigenschaft kann mittels verschiedener Methoden getestet werden. Zu nennen sind hierbei der Disk-diffusion Synergy Test (DDST), der Etest sowie die automatisierte Resistenztestung, z. B. durch den VITEK 2. ESBL-produzierende Bakterien wurden erstmals 1983 in Deutschland isoliert. Seitdem steigt die Inzidenz weltweit und hat sich in den letzten 10 Jahren noch weiter erhöht [15]. In der ersten Dekade nach der Entdeckung stammten die weiteren Berichte hauptsächlich aus Frankreich. Mittlerweile steigt die ESBL-Inzidenz auch in den osteuropäischen Ländern sowie in Asien und Südamerika. Ausbrüche von Infektionen mit ESBL-Organismen sind mittlerweile aus jedem europäischen Land berichtet worden [22]. In Spanien zeigte sich ein Anstieg der Prävalenz an ESBL-E.coli von 2000 bis 2006 um das 8fache. 72 % davon sind vom CTX-M-Typ [7]. ESBLs vom Typ CTX-M überwiegen mittlerweile weltweit [21]. In den 1990er Jahren waren demgegenüber noch die Betalaktamasen vom TEM- und SHV-Typ dominant. Die Verteilung der verschiedenen CTX-M-Typen zeigt geographische Unterschiede. In Spanien dominiert CTX-M-9 und CTXM-14; in Südamerika und Japan ist CTX-M-2 am häufigsten, in Italien eher CTX-M-1; CTX-M-3 ist in Polen häufig. CTX-M-15 kommt häufig in Großbritannien und Indien vor und ist mittlerweile der ESBL-Typ mit der ausgeprägtesten Ausbreitungstendenz. CTX-M-15 wurde mittlerweile weltweit gefunden [3]. Im Raum Bochum sind CTX-M-15 und CTX-M-1 die mit Abstand häufigsten ESBL-Typen. Die Therapieoptionen einer Infektion mit ESBL-produzierenden Bakterien sind stark eingeschränkt, denn ESBL-Isolate zeigen häufig eine Parallelresistenz auch gegen Nicht-Betalaktam-Antibiotika. Diese kann dadurch bedingt sein, dass ESBL-Plasmide auch andere Resistenzgene tragen. Außerdem finden sich bei ESBL-Stämmen häufig auch Mutationen in chromosomalkodierten Genen, die beispielsweise eine Resistenz gegen Fluorochinolone bedingen können. Eine schnelle und korrekte Therapie von ESBL-Infektionen ist entscheidend, da eine inadäquate Therapie mit erhöhter Letalität und längerer Liegedauer assoziiert ist [25]. Zur Therapie von ESBLInfektionen werden häufig Carbapeneme eingesetzt. 11 Aufgrund der großen klinischen Bedeutung von ESBL ist es wichtig, Risikofaktoren für den Erwerb von ESBL-Isolaten zu kennen, um Präventionsstrategien entwickeln zu können. Infektionen mit ESBL-produzierenden Bakterien sind sowohl nosokomial als auch ambulant erworben. Potentielles Reservoir sind oft Kliniken und Pflegeeinrichtungen. Zu den am häufigsten berichteten Risikofaktoren für den Erwerb einer Infektion mit ESBL-produzierenden Bakterien gehören u.a. die Länge des Krankenhausaufenthaltes, das Vorhandensein eines intravasalen Katheters sowie eines Harnwegskatheters, Beatmung, vorherige Operationen sowie der Einsatz von Antibiotika, besonders Drittgenerationscephalosporinen, schwere Erkrankungen und invasive medizinische Untersuchungen. Bekannt ist ferner, dass es durch Hygienemängel zu einer klonalen Ausbreitung kommen kann. Zur Identifizierung von Risikofaktoren für den Erwerb einer Infektion mit ESBL-produzierenden Bakterien wurde eine Fall-Kontroll-Studie durchgeführt. Die Untersuchung fand im Marienhospital Herne und in der Transplantationsstation sowie der Transplantatambulanz des Knappschaftskrankenhauses Bochum statt. Beide Standorte sind als Universitätskliniken Krankenhäuser der Maximalversorgung. Ziel dieser Fall-Kontroll-Studie war es, Risikofaktoren für den Erwerb einer ESBL- Infektion zu identifizieren. Das Hauptziel war, herauszufinden, ob Antibiotika-Exposition einen signifikanten Risikofaktor darstellt. Eine solche Studie war notwendig, weil es zu ESBL- Risikofaktoren keine Studie aus Deutschland gibt, sich aber Unterschiede in den Risikofaktoren durch eine lokal variable Verbreitung von ESBLStämmen ergeben können. 12 So stammen die meisten Fall-Kontroll-Studien aus einer Zeit, als CTXM-Betalaktamasen noch nicht weit verbreitet waren, sondern TEM- und SHV-ESBLs dominierten. Andere Fall-Kontroll-Studien stammen aus Regionen, in denen andere CTX-M-Typen als in Deutschland dominieren, wie Spanien mit hoher Prävalenz von CTX-M-9 und CTXM-14. Ferner war in zahlreichen publizierten Fall-Kontroll-Studien zur Untersuchung eines vorherigen Antibiotika-Einsatzes als Risikofaktor das Studiendesign nicht korrekt gewählt. So wurde in etlichen Studien eine falsche Kontrollgruppe gewählt oder das Konzept der 'time at risk' nicht beachtet. Die meisten Studien wählten eine Kontrollgruppe mit dem sensiblen Zielkeim. Eine Adjustierung nach „time at risk“ durch Integrierung in die multivariaten Berechnungen wurde nur bei wenigen Studien beschrieben. 13 2. Methoden 2.1. Definitionen von Fällen und Kontrollen Als Fälle wurden Patienten definiert, die im Marienhospital Herne oder im Knappschaftskrankenhaus Bochum auf der Transplantationsstation aufgenommen wurden bzw. sich in der Transplantationsambulanz vorstellten, bei denen ein E. coli oder eine Klebsiella pneumoniae mit ESBL bei diesem Krankenhausaufenthalt, -kontakt isoliert worden ist. Jeder Patient wurde dabei nur einmal als Fall in die Studie aufgenommen. Zu jedem Fall wurde ein einziger Kontrollpatient ausgewählt, sodass das „Matching-Verhältnis“ 1:1 beträgt. Als Kontrollen wurden die Patienten ausgewählt, die in einem Zeitraum von 14 Tagen vor oder nach Erstisolierung des ESBL der zugehörigen FallPatienten auf derselben Station behandelt worden waren und bei denen keine ESBL-produzierenden E. coli oder Klebsiella pneumoniae nachgewiesen wurden. Entsprechend der Empfehlung von Harris et al. [13] für die Durchführung von Fall-Kontroll-Studien zur Untersuchung von Antibiotika-Exposition als Risikofaktor wurden die Kontrollpatienten nicht aus den Patienten mit E. coli oder K. pneumoniae ohne ESBL gewählt, sondern aus allen Patienten ohne ESBL-produzierende E. coli oder K. pneumoniae unabhängig davon, ob bei ihnen ein E. coli, K. pneumoniae oder überhaupt kein Bakterium in mikrobiologischen Proben isoliert wurden. Da eine Auflistung aller Patienten, die in einem bestimmten Zeitraum stationär waren, über die Krankenhaus- EDV nicht erstellt werden konnte, wurde ersatzweise eine Auflistung der Patienten erstellt, von denen irgendein Material zur mikrobiologischen Untersuchung in das Institut für Medizinische Mikrobiologie (IMM) geschickt wurde. Aus dieser Liste wurden zufällig Kontrollpatienten nach den bereits genannten Kriterien ausgewählt. 14 2.2. Datenauswahl Über die Labor-EDV des Instituts für Medizinische Mikrobiologie (IMM) in Bochum wurde eine Liste aller Patienten aus den oben genannten Bereichen erstellt, bei denen ein E. coli oder eine K. pneumoniae mit ESBL isoliert wurde. Die Detektion von ESBL im IMM erfolgte über die automatische Resistenzbestimmung mit dem VITEK 2 oder den DDST. Ein Teil dieser Isolate wurde asserviert und im Rahmen einer anderen Studie näher charakterisiert. Die Datenerhebung wurde im Zeitraum von Januar 2006 bis Dezember 2007 durchgeführt. Es wurden insgesamt 120 Fälle und 120 Kontrollen ausgewertet. Zur Erhebung der Daten wurde anhand der Liste der Fallpatienten vom IMM aus der EDV des Marienhospitals in Herne sowie des Knappschaftskrankenhauses in Bochum Patientenakten, Stationen und Aufenthaltszeiträume der entsprechenden Fälle herausgesucht. Im Archiv des Knappschaftskrankenhauses und des Marienhospitals wurden dann die Akten der Fälle und Kontrollen herausgesucht. Dabei erfolgte die Datenerhebung anhand eines strukturierten Erhebungsbogens bzgl. demographischer und epidemiologischer Daten sowie medizinischer und therapeutischer Maßnahmen. Zur Eingabe und Auswertung dieser Daten wurde die „SPSS 11.5“Software genutzt. Dazu wurden vorab die Variablen im System festgelegt und codiert. Nominal skalierte Variablen wurden unter „Ja / Nein“ determiniert und metrisch skalierte Merkmale je nach entsprechender Zahleneinheit. Zur einfacheren Auswertung wurden zusätzlich zu einigen metrisch skalierten Merkmalen nominal skalierte Variablen festgelegt. Die Daten der Fall- und Kontrollpatienten wurden 15 paarweise in diese Liste mit eindeutiger Nummernzuordnung eingegeben. 2.3. Datenerhebung Mittels eines strukturierten Erhebungsbogens wurden die folgenden Informationen aus den Krankenakten erfasst: Demographische Daten Lebensalter in Jahren Geschlecht Komorbiditäten wie: Diabetes mellitus koronare Herzkrankheit Herzrhythmusstörungen Niereninsuffizienz mit entsprechendem Stadium maligne Erkrankungen (solide und hämatologische) Lebererkrankungen; aktuelle oder frühere Virushepatitis Lungenerkrankungen neurologische Erkrankungen chronische Wunden Neutropenie Z. n. Transplantation sowie aktuelle Transplantation während des aktuellen Krankenhausaufenthaltes 16 Infektionen in den letzten 30 Tagen vor Erstisolierung (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) rezidivierende Harnwegsinfekte (symptomatische Harnwegsinfektionen mindestens 3 mal pro Jahr) Anzahl von Krankenhausaufenthalten in den letzten 12 Monaten vor Erstisolierung (bei Fällen) bzw. vor Beginn des aktuellen Krankenhausaufenthaltes (bei Kontrollen). Der aktuelle Aufenthalt wurde nicht mitgezählt. Time-at-risk definiert als Dauer des Krankenhausaufenthaltes bis zur Erstisolierung des ESBL (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Aufenthaltsdauer auf der Intensivstation vor Erstisolierung des ESBL (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Entnahmeort der Probe mit dem ESBL–Erstisolat Verlegung aus einer medizinischen Einrichtung bezüglich des aktuellen Krankenhausaufenthaltes Verlegung aus einem Pflegeheim bezüglich des aktuellen Krankenhausaufenthaltes Medizinische Maßnahmen Beatmung innerhalb von 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Zentralvenöse Katheter (ZVK) sowie Shaldonkatheter innerhalb von 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) 17 Harnwegskatheter (HWK) innerhalb von 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) invasive medizinische Eingriffe innerhalb von 72 Stunden vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) operative Eingriffe innerhalb von 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Verabreichung von Immunsuppressiva in den letzten 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Verabreichung von Antibiotika den letzten 30 Tagen vor Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen) Die Daten der Antibiotika-Expositionen wurden erhoben zu verschiedenen Betalaktam-, Aminoglykosid-, Glycopeptid-, Makrolid-, Lincosamid-, Tetracyclin-, Oxazolidinon-, Fluorchinolon-, Sulfonamid-, und Nitroimidazol-Antibiotika. Unter den Betalaktamantibiotika wurden die Einnahmehäufigkeiten von Penicillin, Flucloxacillin, den Aminopenicillinen Ampicillin, Ampicillin in Kombination mit dem Betalaktamaseinhibitor Sulbactam sowie Amoxicillin in Kombination mit dem Betalaktamaseinhibitor Clavulansäure, den Acylaminopenicillinen Piperacillin, Piperacillin in Kombination mit dem Betalaktamaseinhibitor Tazobactam, den Cephalosporinen der 2. Generation mit Cefuroxim und der 3. Generation mit Ceftriaxon und Ceftazidim sowie Cefpodoxim-Proxetil, den Carbapenemen Imipenem, Meropenem und Ertapenem aufgezeichnet. Unter den weiteren Antibiotikaklassen wurden folgende 18 ausgewertet: Vancomycin, Gentamicin, Tobramycin, Erythromycin, Clarithromycin, Clindamycin, Doxycyclin, Linezolid, Ciprofloxacin, Levofloxacin, Moxifloxacin, Cotrimoxazol in therapeutischer sowie in prophylaktischer Anwendung, Nitrofurantoin und Metronidazol. Der Beobachtungszeitraum der Kontrollgruppe bezieht sich jeweils auf den gesamten Krankenhausaufenthalt des jeweiligen Kontrollpatienten, in dem dieser dem Risiko ausgesetzt war, eine Infektion mit einem ESBL-Keim zu bekommen. Dieser Zeitraum wurde als „time at risk“ bezeichnet. Entsprechend bezieht sich der Zeitraum „time at risk“ für die Fallgruppe auf das Intervall zwischen der stationären Aufnahme bzw. Vorstellung des Patienten in der Transplantatambulanz und der ersten Isolierung des ESBL-Keimes des jeweiligen Fall- Patienten. Die Datenverarbeitung erfolgte computergestützt sowohl mit der SPSS 11.5 Software als auch mit der freien Statistik-Software R (http://www.cran.r-project.org/) und dem Zusatzpaket epicalc. Die Berechnung der Odds Ratio erfolgte in der univariaten Analyse durch die Mantel-Haenzel-Methode mit dem Programm matchTab aus dem epicalc-Paket oder durch eine konditionale logistische Regression mit jeweils einer Variablen mit dem epicalc-Paket clogit. Erwartunsgemäß waren beide Ergebnisse identisch. Inwieweit die Variable 'Antibiotika-Exposition' durch Confounding Effekte beeinflußt wird, wurde durch eine konditionale logistische Regression getestet. Dazu wurde zunächst eine konditionale logistische Regression einer jeden erfassten Variable zusammen mit der Variablen 'Antibiotika-Exposition' durchgeführt. Variablen, die in diesem Test eine Veränderung der Odds Ratio der Variablen 'Antibiotika-Exposition' um >5 % bewirkten, wurden in die konditionale logistische Regression aufgenommen. 19 Bei allen obigen Analysen blieb die Paarung von Fällen und Kontrollen erhalten. Bei einer Subgruppenanalyse war dies bedingt durch eine geringe Fallzahl jedoch nicht möglich. In diesen Fällen wurde die Analyse mit dem epicalc Programm cc oder dem R-Programm glm durchgeführt. Außerdem wurde eine weitere Datenanalyse mit dem SPSS 11.5 Software-System durchgeführt. Hierbei wurden die univariaten und multivariaten Berechnungen ohne eine Paarung von Fällen und Kontrollen durchgeführt. Diese Analyse wurde zur Bestätigung herangezogen, wenn eine Analyse unter Erhaltung der Fall-KontrollZuordnungen nicht möglich war. Die Ergebnisse waren erwartungsgemäß identisch mit den Ergebnissen der Analyse mit dem epicalcProgramm cc oder dem R-Programm glm. 20 3. Ergebnisse Zunächst wurden die Daten aller 120 Fall-Kontroll-Paare ausgewertet. Anschließend erfolgten folgenden Subgruppenanalysen: (a) 67 FallKontroll-Paare aus dem Marienhospital Herne; (b) 53 Fall-KontrollPaare aus der Transplantationsstation bzw. -ambulanz des Knappschaftskrankenhauses Bochum; (c) Fälle mit ESBL-E. coli und deren zugehörige Kontrollen (77 Fall-Kontroll-Paare); (d) Fälle mit ESBL-K. pneumoniae und deren zugehörige Kontrollen (43 FallKontroll-Paare). 3.1. Analyse aller 120 Fall-Kontroll-Paare: 3.1.1. Demographische Daten Von den insgesamt 240 Patienten waren 53,3 % (n = 128) männlich. Der Vergleich der Geschlechterverteilung in der Fall- und Kontrollgruppe zeigt ein leichtes Überwiegen der männlichen Patienten unter den Fällen im Verhältnis zu den weiblichen. In der Fallgruppe befanden sich 57,5 % (n = 69) Männer. Von den Kontrollen waren 49.2 % (n = 59) männlich (Tabelle 2). Abbildung 1 zeigt den Geschlechteranteil der Fälle und Kontrollen in Anzahl und Prozent bezogen auf alle 240 Patienten der insgesamt 120 Fall-Kontroll-Paare. 21 Geschlecht maennlich weiblich 25% Balken zeigen Prozent Prozente 20% 15% 10% 5% n=69 n=51 n=59 Fall n=61 Kontrolle Fall/Kontrolle Abbildung 1:Geschlechterverteilung aller 240 Patienten in Prozent und Anzahl in der Fall- und Kontrollgruppe Der Mittelwert des Lebensalters der Patienten beträgt 60,4 Jahre, der Median liegt bei 63 Jahre. Zur Verteilung des Lebensalters siehe Abbildung 2. Fall Kontrolle 15 Anzahl 10 5 0 20 40 60 Lebensalter 80 20 40 60 80 Lebensalter Abbildung 2:Verteilung des Lebensalters in Jahren aller 240 Patienten getrennt nach Fall- und Kontrollgruppe Die Altersverteilung ist in beiden Gruppen ähnlich und symmetrisch. Der Mittelwert des Alters beträgt 61,4 Jahre unter den Fällen sowie 59,4 Jahre unter den Kontrollen. In der Fallgruppe liegt der Median bei 64 22 Jahren und die Spannweite zwischen dem Altersminimum und maximum bei 65 Jahren. Die Kontrollgruppe zeigt ein medianes Alter von 62,5 Jahren sowie eine Spannweite von 77 Jahren (siehe Tabelle 2). Weder das Geschlecht noch das Alter unterscheiden sich signifikant (Tabelle 3). Tabelle 2: Mittelwerte des Lebensalters in Jahren der Fall- und Kontrollgruppe aller 240 Patienten Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 61,39 120 64,0 25 90 65 Kontrolle 59,39 120 62,5 20 97 77 Insgesamt 60,39 240 63,0 20 97 77 Tabelle 3: univariate Berechnungen nach der Methode von Mantel-Haenszel zu Geschlecht und Alter aller 240 Patienten Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Geschlecht männlich 69 57,5 59 49,2 1,435 0,843 2,443 Alter größer als 50 Jahre 95 79,2 83 69,2 1,923 0,984 3,759 Alter größer als 80 Jahre 18 15,0 13 10,8 1,455 0,675 3,134 Ratio unterer Wert oberer Wert 3.1.2. Antibiotikaexposition Die Fall-Kontroll-Studie ist in ihrem Studiendesign entsprechend der Hauptfragestellung darauf ausgerichtet zu untersuchen, ob eine Antibiotikaexposition einen Risikofaktor für ESBL darstellt. In der univariaten Analyse unterscheiden sich Fälle und Kontrollen bezüglich der Variable ‘Antibiotika-Exposition‘ signifikant, die Odds Ratio betrug 5,600 mit einem 95 %-Konfidenzintervall zwischen 2,162 und 14,503 (Tabelle 4). 86 Fall-Kontroll-Paare hatten eine Antibiotika-Exposition, nur 1 Fall-Kontroll-Paar hatte keine Antibiotikaexposition. Die übrigen Fall-Kontroll-Paare waren hinsichtlich einer Antibiotika-Exposition diskordant. Es gab 28 Fall-Kontroll-Paare, bei denen nur die Fälle sowie 5 Fall-Kontroll-Paare, bei denen nur die Kontrollen eine Antibiotika- 23 Exposition hatten (Tabelle 5). 95,0 % der Fälle und 75,8 % der Kontrollen hatten eine Antibiotika-Exposition (Tabelle 4). Tabelle 4: Univariate Berechnungen der Antibiotikaexposition aller 240 Patienten nach Antibiotikagruppen nach der Methode von Mantel-Haenszel Fall Kontrolle Odds Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen 114 95,0 91 Exposition gegenüber Penicillinen 45 52,5 Exposition gegenüber Cephalosporinen 79 Exposition gegenüber Carbapenemen Exposition gegenüber Fluorchinolone Antibiotikaexposition 95 % Konfidenzintervall Ratio unterer Wert Oberer Wert 75,8 5,600 2,162 14,503 52 42,9 1,316 0,725 2,389 65,8 64 53,3 1,696 1,013 2,839 21 17,5 28 23,4 0,722 0,354 1,474 58 48,4 61 50,8 0,929 0,544 1,584 Eine Exposition gegenüber Cephalosporinen stellte sich in der univariaten Analyse als signifikanter Risikofaktor für ESBL dar mit einer Odds Ratio von 1,696 und einem 95 % Konfidenzintervall von 1,013 bis 2,839. Demgegenüber stellte sich in der univariaten Analyse eine Exposition gegenüber Penicillinen, Carbapenemen und Fluorochinolonen nicht als signifikanter Risikofaktor dar (Tabelle 4). Fasst man Antibiotikawirkstoffe nicht in größere Gruppen zusammen, zeigen sich für die einzelnen Wirkstoffe keine signifikanten Unterschiede zwischen Fällen und Kontrollen (Tabelle 6). Tabelle 5: Antibiotikaexposition aller 240 Patienten in paarweiser Auswertung durch „Match Sets“ Kontrollen ohne Antibiotikaexposition Kontrollen mit Antibiotikaexposition Fälle ohne Antibiotikaexposition 1 5 Fälle mit Antibiotikaexposition 28 86 Tabelle 6 demonstriert die Ergebnisse der Auswertungen der einzelnen Antibiotikaexpositionen. 24 Tabelle 6: Univariate Berechnungen der Antibiotikaexposition aller 240 Patienten nach einzelnen Antibiotikagruppen nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert 114 95,0 91 75,8 5,600 2,162 14,503 Penicillin 3 2,5 1 0,8 Flucloxacillin 3 2,5 4 3,3 0,750 0,168 3,351 Ampicillin 9 7,5 7 5,8 1,400 0,444 4,411 Ampicillin/ Sulbactam 1 0,8 2 1,7 0,500 0,045 5,514 19 15,8 13 10,5 1,667 0,729 3,808 5 4,2 4 3,3 1,500 0,251 8,977 Piperacillin/ Tazobactam 23 19,2 21 17,5 1,200 0,518 2,777 Cefuroxim 22 18,3 21 17,5 1,077 0,506 2,291 Ceftriaxon 48 40,0 36 30,0 1,522 0,899 2,575 Ceftazidim 6 5,0 6 5,0 1,000 0,323 3,101 Cefpodoxim- proxetil 3 2,5 1 0,8 20 16,7 26 21,7 0,684 0,338 1,385 Meropenem 1 0,8 2 1,7 0,500 0,045 5,514 Vancomycin 19 15,8 13 10,8 1,750 0,734 4,172 Tobramycin inhalativ 1 0,8 2 1,7 Erythromycin 9 7,5 8 6,7 1,200 0,366 3,932 Clarithromycin 9 7,5 7 5,8 1,286 0,479 3,452 Clindamycin 2 1,7 6 5,0 0,200 0,023 1,712 Doxycyclin 7 5,8 5 4,2 1,400 0,444 4,411 Linezolid 5 4,2 6 5,0 0,833 0,254 2,731 Ciprofloxacin 53 44,2 55 45,8 0,929 0,544 1,548 Levofloxacin 0 0 1 0,8 Moxifloxacin 5 4,2 5 4,2 1,000 0,290 3,454 Cotrimoxazol therapeutisch 14 11,7 7 5,8 2,400 0,846 6,812 Cotrimoxazol prophylaktisch 35 29,2 25 20,8 2,000 0,936 4,273 Nitrofurantoin 3 2,5 1 0,8 1,500 0,251 8,977 Metronidazol 24 20,0 23 19,2 1,053 0,562 1,972 1 0,8 2 1,7 0,333 0,035 3,205 Exposition gegenüber Antibiotika Amoxicillin/ Clavulansäure Piperacillin Imipenem Rifampicin 3.1.3. Multivariate Berechnungen der Variable 'AntibiotikaExposition' Zur Vorbereitung der multivariaten Analyse wurde zunächst eine konditionale logistische Regression jeder erfassten Variable zusammen 25 mit der Variablen 'Antibiotika-Exposition' durchgeführt. Die Ergebnisse dieser Vortestung sind in Tabelle 7 dargestellt. Tabelle 7: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 5.6 (95 %-Konfidenzintervall von 2.16 bis 14.5) bezogen auf alle 240 Patienten Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert Alter 5,66 2,17 14,74 Nein Geschlecht 5,39 2,07 14,02 Nein Verlegung aus Pflegeheimen 6,09 2,29 16,16 Ja Verlegung aus med. Einrichtung 5,69 2,19 14,77 Nein Niereninsuffizienz 5,14 1,96 13,43 Ja Diabetes mellitus 5,58 2,12 14,67 Nein maligne Erkrankung 6,00 2,26 15,91 Ja Lungenerkrankung 5,12 1,96 13,37 Ja neurologische Erkrankung 4,91 1,87 12,91 Ja Immunsuppression 4,88 1,86 12,81 Ja Chronische Wunden 4,71 1,79 12,43 Ja vorhergehende Infekte 6,29 2,33 17,02 Ja rezidivierende Harnwegsinfekte 6,32 2,20 18,13 Ja Beatmungsdauer 6,14 2,33 16,22 Ja Dauer ZVK/ Shaldonkatheter 6,12 2,30 16,33 Ja ZVK / Shaldonkatheter 4,75 1,79 12,59 Ja Harnwegskatheter 3,99 1,48 10,74 Ja vorhergehende Operationen 5,29 2,03 13,80 Ja time at risk 6,83 2,54 18,35 Ja Relevante Variablen oberer Wert Aufnahme in log. Regression Variablen, die in diesem Test eine Veränderung der adjustierrten Odds Ratio der Variablen 'Antibiotika-Exposition' um >5 % bewirkten, wurden in die konditionale logistische Regression aufgenommen. Durch dieses Vorgehen wurden gezielt Variablen mit Confounding Effekt für die logistische Regression ausgewählt. Aus grundsätzlichen methodischen Erwägungen wurde die Variable 'time-at-risk' unabhängig vom Ergebnis der Vortestung in die logistische Regression mit aufgenommen. Das Ergebnis der konditionalen logistischen Regression mit diesen Variablen ist in Tabelle 8 aufgelistet. Auch nach der logistischen Regression ist somit die Variable 'Antibiotika-Exposition' mit einer Odds 26 Ratio von 9,14 bei einem 95 %-Konfidenzintervall von 1,59 bis 52,43 noch ein signifikanter Risikofaktor für den Erwerb von ESBL. Tabelle 8: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der aller 240 Patienten unjustiertes 95 % Konfidenzintervall adjustierter 95 % Konfidenzintervall Odds Ratio Unterer Wert Oberer Wert Odds Ratio unterer Wert oberer Wert Antibiotikaexposition 5,60 2.16 14.50 9,14 1.59 52,43 Verlegung aus Pflegeheimen 1,50 0,42 5,32 2,14 0,23 20,25 Niereninsuffizienz 2,22 1,01 3,84 3,84 0,86 17,24 maligne Erkrankung 1,82 0,87 3,79 1,74 0,40 7,64 Lungenerkrankung 1,94 1,08 3,48 2,12 0,69 6,54 neurologische Erkrankung 2,10 1,23 3,58 1,95 0,76 4,97 chronische Wunde 3,86 1,68 8,86 4,74 1,02 22,13 Immunsuppression 2,50 1,20 5,21 5,06 1,07 23,85 vorhergehende Infekte 1,14 0,64 2,02 0,16 0,04 0,58 rezidivierende Harnwegsinfekte 7,75 2,74 21,95 32,2 5,80 178,74 Beatmungsdauer 0,98 0,95 1,02 0,88 0,77 1,02 Dauer ZVK/ Shaldonkatheter 1,00 0,98 1,03 1,05 0,93 1,19 ZVK / Shaldonkatheter 2,31 1,20 4,42 0,46 0,10 2,12 Harnwegskatheter 3,07 1,68 5,61 2,91 0,85 9,97 vorhergehende Operationen 1,65 0,90 3,01 2,29 0,74 7,12 time at risk 0,99 0,98 1,01 0,97 0,94 1,00 3.1.4. medizinische Maßnahmen und Diagnostik Bei der Anzahl der Krankenhausaufenthalte in den letzten 12 Monaten ergibt sich in der Fallgruppe ein Mittelwert von 1,31 sowie ein Median von 1,0. In der Kontrollgruppe zeigt sich ein Mittelwert von 1,11 und ein medianer Wert von 1,0 (siehe Abbildung 3). Diese Werte ergeben keinen signifikanten Unterschied in der Fall- und Kontrollgruppe. 27 Fall/Kontrolle Fall Kontrolle 40 Balken zeigen Häufigkeiten Anzahl 30 20 10 0 2 4 6 Anzahl von Krankenhausaufenthalten in den letzen 12 Monaten Abbildung 3:Anzahl an Krankenhausaufenthalten in den letzten 12 Monaten sortiert nach Fällen und Kontrollen Bei der Auswertung der Aufenthaltsdauer auf der Intensivstation ergeben sich folgende Werte: ein Mittelwert von 4,28 Tagen in der Fallgruppe sowie ein Mittelwert von 6,04 Tagen in der Kontrollgruppe (siehe Abbildung 4 und Tabelle 9). Die Werte beziehen sich auf den Zeitraum bis zur Erstisolierung (bei Fällen) und bis zur Entlassung (bei Kontrollen). Hierbei wurde kein signifikanter Unterschied festgestellt. Tabelle 9: Mittelwerte des Zeitraumes auf der Intensivstation in Tagen/ vorherige Krankenhausaufenthalte der Fall- und Kontrollgruppe aller 240 Patienten Fall/Kontrolle Mittelwert Anzahl Median Spannweite Anzahl an Krankenhausaufenthalten letzten 12 Monaten Aufenthaltsdauer auf der Intensivstation Fall 1,31 120 1 7 Kontrolle 1,11 120 1 7 Fall 4,28 120 0 135 Kontrolle 6,04 120 0 103 28 Abbildung 4:Anzahl der Patienten mit der Aufenthaltsdauer auf der Intensivstation vor Erstisolierung (bei Fällen) und bis zur Entlassung (bei Kontrollen); gemessen in Tagen Weiterhin wurden medizinische Maßnahmen und Diagnosen von den Patientendaten erfasst. Die Berechnungen der Beatmungsdauer, die Dauer von ZVK sowie Shaldonkatheter und HWK zeigen keine signifikanten Werte im Vergleich von Fällen und Kontrollen (Tabelle 10). Die Verteilungen sind in den Abbildung 5, Abbildung 6 und Abbildung 7 dargestellt. Zu beachten ist hierbei, dass sich der Zeitraum bei den Fällen jeweils auf 30 Tage vor Erstisolierung des Zielkeimes bezieht, bei den Kontrollen auf den Zeitraum bis zur Entlassung. Tabelle 10: Mittelwerte der Dauer der Beatmung, zentralvenöser-/Shaldonkatheter (ZVK) und Harnwegskatheter (HWK) der Fall- und Kontrollgruppe aller 240 Patienten Fall/Kontrolle Beatmungsdauer Dauer ZVK-/ Shaldonkatheter Dauer der HWK Mittelwert Anzahl Median Spannweite Fall 2,75 120 0 30 Kontrolle 3,44 120 0 54 Fall 6,46 120 2 30 Kontrolle 6,07 120 0 94 Fall 8,78 120 6 30 Kontrolle 7,58 120 0 94 29 Abbildung 5:Anzahl der Patienten mit mechanischer Beatmung vor Erstisolierung (bei Fällen) / Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen Abbildung 6:Anzahl der Patienten mit ZVK /Shaldonkatheter vor Erstisolierung (bei Fällen)/ Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen 30 Abbildung 7:Anzahl der Patienten mit HWK vor Erstisolierung (bei Fällen)/ Zeitraum bis zur Entlassung (bei Kontrollen); Dauer gemessen in Tagen Signifikante Unterschiede zwischen Fall- und Kontrollgruppe zeigen sich bei ZVK oder Shaldonkatheter und HWK, sodass es sich hierbei um mögliche Risikofaktoren handelt. Die weiteren Variablen zeigen keine signifikanten Unterschiede (Tabelle 11). Tabelle 11: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik aller 240 Patienten nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Beatmung 27 22,5 24 20,0 1,500 0,534 4,214 ZVK /Shaldonkatheter 67 55,8 50 41,7 2,308 1,204 4,424 Invasive Untersuchung 30 25,2 38 31,7 0,727 0,413 1,280 Verlegung aus medizinischer Einrichtung 19 15,8 17 14,2 1,200 0,518 2,777 Harnwegskatheter 87 72,5 58 48,3 3,071 1,680 5,614 vorhergehende Operationen 63 52,5 52 43,4 1,647 0,902 3,009 Verlegung aus Pflegeheimen 6 5,0 4 3,3 1,500 0,423 5,315 Es besteht ein signifikanter Zusammenhang zwischen dem Aufenthalt auf der Intensivstation und zentralem Venen- und Shaldonkatheter sowie Harnwegskatheter (siehe Tabelle 15). Diese Daten zeigen, dass hier der Aufenthalt auf der Intensivstation als Confounder wirken könnte und somit der Zusammenhang von ZVK oder Shaldonkatheter sowie 31 HWK zu Risikofaktoren zum Erwerb einer ESBL-Infektion nicht eindeutig gestellt werden kann. Der Zeitraum 'time at risk' bezieht sich bei den Fällen auf die Dauer von der stationären Aufnahme bis zur Erstisolierung des ESBL-Keimes, entsprechend bei den Kontrollen bis zur Entlassung des Patienten. In der Fallgruppe liegt der Mittelwert des Zeitraumes 'time at risk' bei 20 Tagen, der Median bei 15,5 Tagen. In der Kontrollgruppe zeigt sich ein ähnlicher Mittelwert von 22,8 Tagen und Median von 17 Tagen (Tabelle 12). Tabelle 12: Mittelwerte des Zeitraumes 'time at risk' der Fall- und Kontrollgruppe aller 240 Patienten in Tagen Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 20,04 120 15,50 1 139 138 Kontrolle 22,84 116 17,00 1 150 149 Insgesamt 21,42 236 16,00 1 150 149 Die Häufigkeitsverteilung des Zeitraumes 'time at risk' in der Fall- und Kontrollgruppe ist in Abbildung 8 dargestellt. Fall Kontrolle 30% Prozente 20% 10% 0% 25 50 75 100 Time at Risk 125 25 50 75 100 125 Time at Risk Abbildung 8:Häufigkeitsverteilung des Zeitraumes 'time at risk' in Prozent im Vergleich von Fall- und Kontrollgruppe nach der Anzahl der Tage 32 3.1.5. Komorbiditäten Signifikante Werte zeigen sich bei Diabetes mellitus, Lungenerkrankungen, Lebererkrankungen, neurologischen Erkrankungen, Niereninsuffizienz, chronischen Wunden, rezidivierenden Harnwegsinfekten sowie der Anwendung von Immunsuppressiva in den letzten 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) im Vergleich von Fall- und Kontrollgruppe (siehe Tabelle 13). Bei diesen Variablen kann es sich daher ebenfalls um Risikofaktoren handeln. Tabelle 13: univariate Berechnungen der Komorbiditäten aller 240 Patienten nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Diabetes mellitus 45 37,5 30 25,0 1,882 1,045 3,390 Herzinsuffizienz 32 26,7 30 25,0 1,095 0,606 1,979 koronare Herzkrankheit 30 25,0 33 27,5 0,850 0,445 1,623 Herzrhythmusstörungen 46 38,3 41 34,2 1,217 0,701 2,113 Lebererkrankungen 20 16,7 10 8,3 3,000 1,090 8,254 4 3,3 4 3,3 1,000 0,250 3,998 gastrointestinale Erkrankungen 61 50,8 54 45,0 1,259 0,760 2,087 Lungenerkrankungen 54 45,0 38 31,7 1,941 1,081 3,485 maligne Erkrankungen 23 19,2 14 11,7 1,818 0,87 3,795 maligne solide Erkrankungen 20 16,7 13 10,8 1,700 0,779 3,713 5 4,2 2 1,7 2,500 0,485 12,886 neurologische Erkrankungen 58 48,3 36 30,0 2,100 1,233 3,577 Niereninsuffizienz 95 79,2 85 70,8 2,222 1,012 4,880 Transplantationen 56 46,7 53 44,2 Immunsuppression 84 70,0 69 57,5 2,500 1,201 5,205 chronische Wunden 33 27,5 13 10,8 3,857 1,680 8,857 vorhergehender Infekt 81 67,5 78 65,0 1,136 0,641 2,015 rezidivierende Harnweginfekte 42 35,0 15 12,5 7,750 2,736 21,955 Hepatitis maligne hämatologische Erkrankungen Prozent der Ratio Unterer Wert Kontrollen Oberer Wert Die Berechnung des Zusammenhanges zwischen dem Aufenthalt auf der Intensivstation der entsprechenden Patienten und dem Auftreten von Lungenerkrankungen und chronischen Wunden zeigen signifikante Ergebnisse (Tabelle 15). Dies lässt darauf schließen, dass die 33 Patienten, die auf der Intensivstation lagen, vermehrt auch Lungenerkrankungen und chronische Wunden aufwiesen. Es ergibt sich also, dass der Aufenthalt auf der Intensivstation einen Confounder bei der Beurteilung der Risikofaktoren Lungenerkrankungen und chronische Wunden in Bezug auf den Erwerb einer ESBL- Infektion darstellen könnte. Nach den multivariaten Berechnungen zeigten Lungenerkrankungen keine signifikanten Werte, hingegen konnten chronische Wunden unabhängig anderer Faktoren weiterhin als potentieller Risikofaktor herausgestellt werden (Tabelle 16). Weiterhin kann nach den univariaten Daten angenommen werden, dass es sich bei Diabetes mellitus, neurologischen Erkrankungen und der Anwendung von Immunsuppressiva um Risikofaktoren, eine ESBLInfektion zu bekommen, handeln könnte. Hierbei muss jedoch weiterhin berücksichtigt werden, dass ein großer Anteil von 53,3 % der Diabetiker auch neurologische Erkrankungen hatten, wobei die Berechnungen dieses Zusammenhangs signifikante Werte vorweisen (siehe Tabelle 14). Der Stellenwert neurologischer Erkrankungen als Risikofaktor einer ESBL-Infektion ist somit nicht eindeutig beurteilbar. Tabelle 14: Anteil der Patienten mit neurologischen Erkrankungen und Diabetes mellitus berechnet nach der Methode des Risikoschätzers (SPSS) Diabetes mellitus Anzahl Prozent der Patienten Prozent der Patienten mit p-Wert mit Diabetes mellitus neurologischen Erkrankungen Odds Ratio Neurologische Erkrankungen der transplantierten Patienten 18 60,0 46,2 0,002 3,929 Neurologische Erkrankungen aller 240 Patienten 40 53,3 42,6 0,002 2,349 Rezidivierende Harnwegsinfektionen zeigen keinen Zusammenhang zu Aufenthalten auf Intensivstationen und können somit zum Erwerb einer ESBL-Infektion beigetragen haben. Die Berechnungen sind der Tabelle 13 zu entnehmen. 34 Tabelle 15: Patientenanteil aller 240 Patienten mit vorherigem Aufenthalt auf der Intensivstation im Zusammenhang mit verschiedenen Komorbiditäten, medizinischen Maßnahmen und Antibiotika berechnet nach der Methode des Risikoschätzers (SPSS) Intensivstationsaufenthalt innerhalb von 30 Tagen vor Erstisolierung (bei Fällen)/ im Zeitraum bis zur Entlassung (bei Kontrollen) Anzahl Prozent der Patienten mit Intensivaufenthalt Prozent der Patienten mit Komorbiditäten p-Wert Odds Ratio Diabetes mellitus 24 32,4 32,0 0,792 1,082 Lebererkrankungen 10 13,5 33,3 0,751 1,141 Lungenerkrankungen 39 52,7 42,4 0,002 2,376 neurologische Erkrankungen 35 47,3 37,2 0,085 1,628 Immunsuppression 35 47,3 22,9 0,000 0,365 chronische Wunden 24 32,4 52,2 0,000 3,142 ZVK /Shaldonkatheter 65 87,8 55,6 0,000 15,833 Harnwegskatheter 68 91,9 46,9 0,000 13,100 rezidivierende Harnwegsinfektionen 16 21,6 28,1 0,605 0,841 Antibiotikaexposition 68 91,9 33,2 0,058 2,399 3.1.6. Multivariate Berechnungen weiterer Risikofaktoren Die multivariate Berechnungen der weiteren Risikofaktoren zum Erwerb einer ESBL-Infektion wurde mit der binominalen logistischen Regression durchgeführt ohne Berücksichtigung der Paarung von Fällen und Kontrollen. Die Ergebnisse sind in Tabelle 16 dargestellt. Tabelle 16: Multivariate Berechnungen aller 240 Patienten zur Identifizierung von Risikofaktoren durch die binominale logistische Regression adjustierter Odds Ratio 95 % Konfidenzintervall unterer Wert oberer Wert Antibiotikaexposition 4,044 1,397 11,709 ZVK / Shaldonkatheter 1,092 0,471 2,532 Harnwegskatheter 2,807 1,235 6,381 Diabetes mellitus 1,172 0,583 2,357 Lebererkrankungen 3,188 1,141 8,902 Lungenerkrankungen 1,560 0,800 3,043 neurologische Erkrankungen 1,651 0,869 3,138 Niereninsuffizienz 1,072 0,464 2,477 Immunsuppression 1,909 0,885 4,116 rezidivierende Harnwegsinfekte 4,043 1,870 8,739 chronische Wunden 2,981 1,238 7,177 time at risk 1,028 1,009 1,047 35 Aus Tabelle 16 ist somit ersichtlich, dass ebenfalls mit diesem Analyseverfahren die Variable 'Antibiotika-Exposition' einen signifikanten Risikofaktor darstellt. Daneben zeigen die Variablen Harnwegskatheter, chronischen Wunden, Lebererkrankungen und rezidivierende Harnwegsinfekte signifikante Unterschiede zwischen Fällen und Kontrollen sowohl in der univariaten wie auch in der multivariaten Analyse. Die Variablen Immunsuppression, Diabetes mellitus, Niereninsuffizienz, Lungenerkrankungen, neurologische Erkrankungen, ZVK sowie Shaldonkatheter stellen im Gegensatz zur univariaten Analyse in den multivariaten Berechnungen keine signifikanten Risikofaktoren für ESBL mehr da. 3.2. Subgruppenanalyse der 53 Fall-Kontroll-Paare der Transplantationspatienten: Analog zur Erhebung der Daten aller 240 Patienten wurde die entsprechende Analyse der Subgruppe der Transplantationspatienten aus dem Knappschaftskrankenhaus Bochum in gleicher Weise durchgeführt. 3.2.1. Demographische Daten Die Anzahl der Geschlechter in der Fall- und Kontrollgruppe ist mit 54,7 % (n = 29) Männern unter den Fällen und 56,6 % (n = 30) unter den Kontrollen ähnlich verteilt (Tabelle 17). Der Mittelwert des Lebensalters liegt in der Fallgruppe bei 52,0 und in der Kontrollgruppe bei 51,1 Jahren; der Median wurde in der Fallgruppe mit 52 Jahren und einer Spannweite zwischen maximalem und minimalem Lebensalter von 46 Jahren berechnet. In der Kontrollgruppe ergibt sich ein medianes Lebensalter von 50 Jahren und einer Spannweite von 52 Jahren. Es 36 zeigt sich also eine ähnliche Altersverteilung in beiden Gruppen, welche auch annähernd symmetrisch ist (Tabelle 18). Tabelle 17: univariate Berechnungen zu Geschlecht, Alter und Verlegungen der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Geschlecht männlich 29 54,7 30 56,6 0,917 0,404 2,077 Lebensalter größer als 50 Jahre 33 62,3 29 54,7 1,364 0,626 2,969 Tabelle 18: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe der Transplantationspatienten Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 52,02 53 52,0 29 75 46 Kontrolle 51,11 53 50,0 21 73 52 Insgesamt 51,57 106 51,5 21 75 54 3.2.2. Antibiotikaexposition Die Fall-Kontroll-Studie ist in ihrem Studiendesign entsprechend der Hauptfragestellung darauf ausgerichtet zu untersuchen, ob eine Antibiotikaexposition einen Risikofaktor für ESBL darstellt. In der univariaten Analyse gibt es keinen signifikanten Unterschied zwischen Fälle und Kontrollen bezüglich der Variable 'Antibiotika-Exposition'; die Odds Ratio betrug 2,667 mit einem 95 %-Konfidenzintervall von 0,707 und 10,052. Die Patienten der Fallgruppe nahmen zu 92,5 % und die der Kontrollgruppe zu 83 % Antibiotika in diesem Zeitraum ein. Allerdings zeigen sich signifikante Unterschiede bei der Exposition gegenüber Ceftriaxon. In der univariaten Analyse stellt sich diese mit einer Odds Ratio von 2,500 und einem 95 % Konfidenzintervall von 1,101 bis 5,676 als signifikanter Risikofaktor dar. Diese Werte deuten auf die Möglichkeit hin, dass die Anwendung von Ceftriaxon einen Risikofaktor zum Erwerb einer ESBL-Infektion darstellen könnte. 37 Weiterhin ergeben sich keine signifikanten Unterschiede in der Antibiotika-exposition der verschiedenen Antibiotikagruppen im Vergleich von Fall- und Kontrollgruppe. Tabelle 19 gibt die Daten und Berechnungen der Antibiotikaexpositionen an. Tabelle 19: Univariate Berechnungen der Antibiotikaexposition der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert 49 52,5 44 83,0 2,667 0,707 10,052 Penicillin 1 1,9 0 0 Ampicillin 4 7,5 1 1,9 Ampicillin/Sulbactam 1 1,9 1 1,9 12 22,6 11 20,8 1,125 0,434 2,916 Piperacillin/Tazobactam 0 0 1 1,9 Cefuroxim 2 3,8 5 9,4 0,250 0,028 2,237 Ceftriaxon 32 60,4 20 37,7 2,500 1,101 5,676 Imipenem 5 9,4 7 13,2 0,667 0,188 2,362 Meropenem 0 0,0 2 3,8 Vancomycin 4 7,5 1 1,9 Erythromycin 4 7,5 2 3,8 2,000 0,366 10,919 Clarithromycin 3 5,7 0 0 Clindamycin 2 3,8 2 3,8 Doxycyclin 2 3,8 3 5,7 0,667 0,111 3,990 Ciprofloxacin 18 34,0 20 37,7 0,833 0,360 1,929 Moxifloxacin 2 3,8 4 7,5 0,500 0,092 2,730 Cotrimoxazol therapeutisch 2 3,8 1 1,9 Cotrimoxazol prophylaktisch 31 58,5 25 47,2 1,600 0,726 3,526 Nitrofurantoin 3 5,7 2 3,8 1,500 0,251 8.977 Metronidazol 10 18,9 8 15,1 1,286 0,479 3,452 Exposition gegenüber Antibiotika Amoxicillin/Clavulansäure 3.2.3. Multivariate Berechnungen der Variable 'AntibiotikaExposition' Analog zur Analyse aller 240 Patienten wurden zur Vorbereitung der multivariaten Analyse zunächst eine konditionale logistische Regression jeder erfassten Variable zusammen mit der Variablen 'AntibiotikaExposition' durchgeführt. Die Ergebnisse dieser Vortestung sind in Tabelle 20 dargestellt. 38 Tabelle 20: Konditionale logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 2.67 (95 %Konfidenzintervall von 0.71 bis 10.05) bez. auf Subgruppe der Transplantationspatienten Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert Alter größer als 70 Jahre 2,28 0,58 8,90 Ja Anzahl an Krankenhausaufenthalten 3,17 0,79 12,73 Ja Verlegung aus Pflegeheimen 2,81 0,72 11,02 Ja Verlegung aus med. Einrichtung 2,28 0,58 8,90 Ja Diabetes mellitus 3,04 0,68 13,61 Ja Herzinsuffizienz 2,35 0,60 9,18 Ja Herzrhythmusstörung 3,15 0,75 13,22 Ja maligne Erkrankung 2,51 0,66 9,54 Ja Lungenerkrankung 2,74 0,71 10,48 Nein neurologische Erkrankung 2,47 0,62 9,82 Ja Chronische Wunden 2,32 0,60 8,99 Ja vorhergehende Infekte 2,47 0,63 9,63 Ja rezidivierende Harnwegsinfekte 2,82 0,55 14,53 Ja Dauer ZVK/ Shaldonkatheter 1,52 0,37 6,29 Ja ZVK / Shaldonkatheter 1,70 0,42 6,88 Nein Harnwegskatheter 1,60 0,39 6,57 Nein Dauer Harnwegskatheter 2,22 0,57 8,56 Ja vorhergehende Operationen 1,84 0,46 7,41 Ja time at risk >15 Tage 2,47 0,63 9,63 Ja Relevante Variablen oberer Wert Aufnahme in log. Regression Variablen, die in diesem Test eine Veränderung der adjustierten Odds Ratio der Variablen 'Antibiotika-Exposition' um >5 % bewirkten, wurden in die konditionale logistische Regression aufgenommen. Durch dieses Vorgehen wurden gezielt Variablen mit Confounding Effekt für die logistische Regression ausgewählt. Aus grundsätzlichen methodischen Erwägungen wurde die Variable 'time-at-risk' unabhängig vom Ergebnis der Vortestung in die logistische Regression mit aufgenommen. Das Ergebnis der konditionalen logistischen Regression mit diesen Variablen ist in Tabelle 21 aufgelistet. Auch nach logistischer Regression zeigt somit die Variable Antibiotika-Exposition mit einer Odds Ratio von 301,64 bei einem 95 % Konfidenzintervall von 0,11 bis 39 808763 keine signifikanten Ergebnisse und verdeutlicht, dass die Antibiotika-Exposition auch nach Adjustierung durch die aufgelisteten Variablen keinen signifikanten Risikofaktor zum Erwerb eines ESBLKeimes darstellt. Auffallend ist weiterhin, dass sich bei einigen Variablen wie auch bei der Antibiotikaexposition sehr hohe Odds Ratio Werte ergeben, deren Konfidenzinterwalle unendliche Ausmaße annehmen. Tabelle 21: Multivariate Berechnung zu Confounding-Faktoren der Variable 'AntibiotikaExposition' durch die konditionale logistische Regression der Subgruppe der Transplantationspatienten unjustierte 95 % Konfidenzintervall adjustierter 95 % Konfidenzintervall Odds Ratio unterer Wert oberer Wert Odds Ratio unterer Wert oberer Wert Antibiotikaexposition 2,67 0,71 10,05 301,64 0,11 808763 Alter grösser als 70 Jahre 4,00 0,45 35,79 18870 0 4,4 Bill Anzahl Krankenhausaufenthalte 0,70 0,50 1,00 0,03 0 2,42 Verlegung aus med. Einrichtung 0,25 0,03 2,24 0,09 0 1,83 Verlegung aus Pflegeheimen 1,00 0,06 15,99 49,53 0 1,55 Diabetes mellitus 3,80 1,42 10,18 0,55 0,01 21,37 Herzinsuffizienz 2,00 0,60 6,64 9,73 0,07 1303 Herzrhythmusstörungen 1,00 0,38 2,66 0,03 0 8,06 Malignom 2,50 0,49 12,89 23739 0 374 Mrd. neurologische Erkrankungen 2,44 1,13 5,31 890 0,04 21 Mio. chronische Wunden 3,00 0,61 14,86 50,29 0,29 8793 vorhergehender Infekt 1,44 0,62 3,38 0 0 2,69 rezidivierende Harnwegsinfekte 9,50 2,21 40,78 1709 0,38 7,7 Mio. Dauer ZVK/ Shaldonkatheter 1,17 1,06 1,30 1,23 0,76 2,00 Dauer d. Harnwegskatheter 1,07 0,99 1,14 1,17 0,80 1,71 Vorhergehende Operationen 2,83 1,12 7,19 0,06 0 49,78 time at risk 1,02 0.98 1,06 0,89 0,76 1,05 40 3.2.4. Medizinische Maßnahmen und Diagnostik Signifikante Unterschiede zwischen Fall- und Kontrollgruppe zeigen sich bezüglich zentralem Venen- und Shaldonkatheter, Harnwegskatheter und Operationen innerhalb von 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen). Diese Werte zeigen durch ihre Signifikanz, dass es sich bei diesen Variablen um Risikofaktoren handeln könnte. Die weiteren Variablen ergeben keine signifikanten Unterschiede. In Tabelle 22 sind die Daten und Berechnungen ersichtlich. Tabelle 22: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe der Transplantationspatienten nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert 4 7,5 1 1,9 ZVK/ Shaldonkatheter 35 66,0 20 37,7 3,500 1,413 8,672 Harnwegskatheter 38 71,7 22 41,5 4,200 1,584 11,138 Vorhergehende Operationen 36 67,9 25 47,2 2,833 1,117 7,186 Invasive Untersuchung 7 13,2 14 26,4 0,424 0,156 1,155 Verlegung aus medizinischer Einrichtung 1 1,9 4 7,5 0,250 0,028 2,237 Verlegung aus Pflegeheim 1 1,9 1 1,9 Beatmung 3.2.5. Komorbiditäten Eine Signifikanz bezüglich unterschiedlichen Komorbiditäten zwischen der Fall- und Kontrollgruppe weisen neurologische Erkrankungen, Diabetes mellitus und rezidivierende Harnwegsinfekte auf. Im Gegensatz zur gesamten Patientengruppe konnte sich in der Transplantationsgruppe bei Lungenerkrankungen, Lebererkrankungen, chronischen Wunden und der Anwendung von Immunsuppressiva keine Signifikanz herausstellen. Lediglich die Werte von neurologischen Erkrankungen, Diabetes mellitus und rezidivierenden Harnwegsinfekte deuten in der Transplantationsgruppe auf die Möglichkeit hin, Risikofaktoren zum Erwerb einer ESBL-Infektion darzustellen. Die Werte und 41 Berechnungen der Daten sind in Tabelle 23 dargestellt. Es muss allerdings berücksichtigt werden, dass ein positiver Zusammenhang zwischen dem Auftreten von Diabetes und neurologischen Erkrankungen besteht. Ein großer Teil der Diabetiker hat auch neurologische Erkrankungen (siehe Tabelle 14). Diese beiden Risikofaktoren müssen also im Zusammenhang betrachtet werden. Die Bewertung der neurologischen Erkrankungen als Risikofaktor zum Erwerb einer ESBLInfektion ist also nicht klar zu stellen. Tabelle 23: univariate Berechnungen der Komorbiditäten Transplantationspatienten nach der Methode von Mantel-Haenszel Fall Kontrolle der Odds Subgruppe der 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Diabetes mellitus 22 41,5 8 15,1 3,800 1,419 10,177 Herzinsuffizienz 10 18,9 6 11,3 2,000 0,602 6,642 koronare Herzkrankheit 13 24,5 9 17,0 1,800 0,603 5,371 Herzrhythmusstörung 9 17,0 9 17,0 1,000 0,375 2,664 Lebererkrankung 2 3,8 2 3,8 1,000 0,141 7,099 Hepatitis 3 5,7 4 7,5 0,750 0,168 3,351 gastrointestinale Erkrankungen 23 43,4 25 47,2 0,867 0,412 1,821 Lungenerkrankungen 11 20,8 11 20,8 1,000 0,351 2,851 maligne Erkrankungen 5 9,4 2 3,8 2,500 0,485 12,886 maligne Erkrankungen solide 5 9,4 2 3,8 2,500 0,485 12,886 neurologische Erkrankungen 26 49,1 13 24,5 2,444 1,126 5,309 7 13,2 3 5,7 3,000 0,606 14,864 vorhergehende Infekte 33 62,3 29 54,7 1,444 0,617 3,379 rezidivierende Harnwegsinfekte 26 49,1 9 17,0 9,500 2,213 40,785 chronische Wunden Der Zeitraum zwischen der letzten Transplantation und der Isolierung des ESBL-Keimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) ist bei den Kontrollen zu 50 % kleiner als 60 Tage, davon 37,7 % kleiner als 30 Tage und zu 50 % länger als 60 Tage, davon 41,5 % länger als 6 Monate. Der Zeitraum ist bei den Fällen zum größeren Teil kleiner als 60 Tage und bei den Kontrollen zum größeren Teil länger als 60 Tage (siehe Tabelle 24). 42 Tabelle 24: Zeitraum zwischen der letzten Transplantation und der Erstisolierung (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) aus der Subgruppe der Transplantationspatienten berechnet nach der Methode des Risikoschätzers (SPSS) Fall Transplantation Entlassung <30 Tage bis Erstisolierung/ Transplantation Entlassung <60 Tage bis Erstisolierung/ Transpl. >60 Tage;<6 Monate bis Erstisolierung/ Entlassung Transplantation Entlassung >60 Tage bis Erstisolierung/ Transplantation >6 Monate bis Erstisolierung/ Entlassung Kontrolle Anzahl Prozent der Fälle Anzahl Prozent der Odds p-Wert Kontrollen Ratio 24 45,3 16 30,2 0,109 1,914 33 62,3 20 37,7 0,012 2,723 3 5,7 6 11,3 0,488 0,470 20 37,7 33 62,3 0,012 0,367 17 32,1 27 50,9 0,049 0,455 Es besteht ein positiver Zusammenhang zwischen dem Zeitraum von der letzten Transplantation bis zur Isolierung des ESBL- Keimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) von weniger als 30 Tagen und zentralvenösem Katheter bzw. Shaldonkatheter, Harnwegskatheter, Operationen und Ceftriaxon-Anwendung innerhalb von 30 Tagen. Diese Risikofaktoren sind darauf zurückzuführen, dass es sich bei diesen Patienten um „Frisch-transplantierte“ handelt, was als Confounder gewertet werden könnte (siehe Tabelle 25). Jedoch liegt der Anteil an „Frischtransplantierten“ (Intervall zwischen Transplantation und Isolierung/ Entlassung weniger als 30 Tage) nur bei 38 %. Dieser Confounder bezieht sich also nur auf diesen Anteil und kann nicht auf die gesamte Menge der Transplantationspatienten bezogen werden. 43 Tabelle 25: Patienten mit einer Transplantation vor weniger als 30 Tagen und verschiedenen medizinischen Maßnahmen bzw. Antibiotikaexposition in univariater Berechnung nach der Methode des Risikoschätzers (SPSS) Zeitraum der letzten Transplantation bis zur Erstisolierung (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) weniger als 30 Tage („Frischtransplantierte“) Anzahl Prozent der „Frischtransplantierten“ Prozent der Patienten mit med. Maßnahmen p-Wert Odds Ratio ZVK / Shaldonkatheter < 30 Tage bis Erstisolierung / Entlassung 34 85,0 61,8 0,000 12,143 Harnwegskatheter < 30 Tage bis Erstisolierung / Entlassung 39 97,5 65,0 0,000 83,571 Operationen < 30 Tage bis Erstisolierung / Entlassung 40 100,0 64,5 0,000 Ceftriaxon-Exposition < 30 Tage bis Erstisolierung / Entlassung 35 87,5 67,3 0,000 20,176 rezidivierende Harnwegsinfekte 10 25,0 28,6 0,172 0,547 Aus den Patientendaten wurden die verschiedenen Immunsuppressiva ausgewertet. Als duale Therapie wird eine Therapie mit Steroiden und einem der Immunsuppressiva Tacrolimus, Mucophenolatmotefil, Ciclosporin oder Sirolimus. Eine Triple-Therapie besteht dann entsprechend aus einem Steriod sowie zwei der oben angeführten Immunsuppressiva. Bei der immunsuppressiven Therapie zeigen sich keine signifikanten Ergebnisse bei der Triple-Therapie und dualer Therapie zwischen Fällen und Kontrollen (siehe Abbildung 9). 44 Immunsuppessive Therapie in tripple-Kombination ja nein 40 Immunsuppessive Therapie in dualer Kombination ja nein Anzahl 30 Balken zeigen Häufigkeiten 20 10 Fall Kontrolle Fall/Kontrolle Abbildung 9:Duale Kombination und Tripple- Kombination der immunsuppressiven Therapie Die Fälle bekamen zu 88,7 % eine Triple-Therapie, die Kontrollen zu 79,2 % (siehe Tabelle 26). Es zeigt sich hier also kein signifikanter Unterschied. Tabelle 26: Immunsuppressive Therapie der Subgruppe der Transplantationspatienten berechnet nach der Methode des Risikoschätzers (SPSS) Fall Kontrolle Anzahl Prozent der Fälle Prozent der Therapieform Anzahl Prozent der Kontrollen Prozent der p-Wert Therapieform Odds Ratio Trippletherapie 47 88,7 52,8 42 79,2 47,2 0,186 2,052 Dualtherapie 6 11,3 40,0 9 17,0 60,0 0,403 0,624 Steriod single Therapie 0 0,0 0,0 2 3,8 100,0 0,495 3.2.6. Multivariate Berechnungen der weiteren Risikofaktoren Die multivariate Berechnungen der weiteren Risikofaktoren zum Erwerb einer ESBL-Infektion wurde mit der binominalen logistischen Regression durchgeführt ohne Berücksichtigung der Paarung von Fällen und Kontrollen. Dabei wurden die Variablen ausgewählt, die in 45 den univariaten Berechnungen signifikante Ergebnisse zeigten. Die multivariaten Ergebnisse sind in Tabelle 27 dargestellt. Tabelle 27: Multivariate Berechnungen der Subgruppe der Transplantationspatienten zur Identifizierung von Risikofaktoren durch die binominale logistische Regression Adjustierter Odds Ratio 95 % Konfidenzintervall unterer Wert Oberer Wert Antibiotikaexposition 1,273 0,243 6,681 Ceftriaxon-Exposition 2,239 0,634 7,916 ZVK/ Shaldonkatheter 1,638 0,377 7,115 Harnwegskatheter 2,733 0,643 11,617 Vorhergehende Operationen 1,312 0,364 4,738 Diabetes mellitus 3,492 1,071 11,387 neurologische Erkrankungen 2,808 0,971 8,117 rezidivierende Harnwegsinfekte 4,869 1,647 14,394 time at risk 1,018 0,981 1,056 Die Antibiotikaexposition ergibt somit in der Subgruppe der Transplantationspatienten weder in der univariaten noch in den multivariaten Analysen in gepaarter und ungepaarter Berechnung signifikannte Werte und stellt somit keinen Risikofaktor zum Erwerb einer ESBL-Infektion dar. Daneben zeigt die multivariate Berechnung (Tabelle 27) der weiteren Variablen signifikante Werte für Diabetes mellitus und rezidivierende Harnwegsinfekte, sodass es sich hierbei um mögliche Risikofaktoren zum Erwerb einer Infektion mit ESBL-Keimen handelt. 46 3.3. Subgruppenanalyse der 67 Fall-Kontroll-Paare aus dem Marienhospital Herne: Analog zur Erhebung der Daten aller 240 Patienten wurde die entsprechende Analyse der Subgruppe des Marienhospitals in gleicher Weise durchgeführt. 3.3.1. Demographische Daten In der Verteilung der männlichen und weiblichen Patienten auf die Fallbzw. Kontrollgruppen überwiegen in der Fallgruppe die Männer mit 59,7 % (n = 40). In der Kontrollgruppe befinden sich 43,3 % (n = 29) Männer. Die Altersverteilung ist annähernd symmetrisch. Der Mittelwert beträgt 68,8 Jahre in der Fall- sowie 65,9 Jahre in der Kontrollgruppe. Unter den Fällen ergibt sich ein Median von 69 Jahren und einer Spannweite zwischen Minimum und Maximum der Alterswerte von 65 Jahren; bei den Kontrollen beträgt das mediane Alter 72 Jahre sowie 77 Jahre in der Altersspannweite (Tabelle 28 und Tabelle 29). Dies ergibt somit eine ähnliche Verteilung in der Fall- und Kontrollgruppe bezüglich des Alters. Tabelle 28: univariate Berechnungen nach der Methode von Mantel-Haenszel zu Geschlecht und Alter der Subgruppe des Marienhospitals Fall Kontrolle Anzahl Prozent der Fälle Anzahl Geschlecht männlich 40 59,7 Lebensalter größer 50 Jahre 62 Lebensalter größer 80 Jahre 18 Odds 95 % Konfidenzintervall Prozent der Kontrollen Ratio Unterer Wert Oberer Wert 29 43,3 2,000 0,970 4,124 92,5 54 80,6 5,000 1,096 22,820 26,9 13 19,4 1,455 0,675 3,134 Tabelle 29: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe des Marienhospitals Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 68.81 67 69,0 25 90 65 Kontrolle 65,94 67 72,0 20 97 77 Insgesamt 67,37 134 69,5 20 97 77 47 Weiterhin zeigen diese Ergebnisse, dass das Lebensalter größer als 50 Jahre ein Risikofaktor zum Erwerb einer ESBL-Infektion darstellen könnte, da sich hierbei signifikannte Odds Ratio zeigen. 3.3.2. Antibiotikaexposition Die Fall-Kontroll-Studie ist in ihrem Studiendesign entsprechend der Hauptfragestellung darauf ausgerichtet zu untersuchen, ob eine Antibiotikaexposition einen Risikofaktor für ESBL darstellt. In der univariaten Analyse unterscheiden sich Fälle und Kontrollen bezüglich der Variable 'Antibiotika-Exposition' signifikant, die Odds Ratio betrug 10,0, das 95 %-Konfidenzintervall lag zwischen 2,337 und 42,783. 97,0 % der Fälle und 70,1 % der Kontrollen hatten eine AntibiotikaExposition und stellt daher einen Risikofaktor zum Erwerb einer ESBLInfektion dar. Es ergeben sich keine signifikanten Unterschiede im Vergleich von Fallund Kontrollgruppe gegenüber der Exposition durch verschiedene Antibiotikagruppen. Tabelle 30 zeigt die Daten und Berechnungen hierzu. 48 Tabelle 30: Univariate Berechnungen der Antibiotikaexposition der Subgruppe des Marienhospitals nach der Methode von Mantel-Haenszel Fall Kontrolle Odds Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen 65 97,0 47 70,1 Penicillin 2 3,0 1 1,5 Flucloxacillin 3 4,5 4 Ampicillin 5 7,5 Ampicillin/ Sulbactam 0 Amoxicillin/ Clavulansäure Piperacillin 95 % Konfidenzintervall Ratio unterer Wert oberer Wert 10,00 2,337 42,783 6,0 0,750 0,168 3,351 6 9,0 0,750 0,168 3,351 0 1 1,5 7 10,4 2 3,0 5 7,5 4 6,0 1,500 0,251 8,977 Piperacillin/ Tazobactam 23 34,3 20 29,9 1,333 0,562 3,164 Cefuroxim 20 29,9 16 23,9 1,444 0,617 3,379 Ceftriaxon 16 23,9 16 23,9 1,000 0,489 2,064 Ceftazidim 6 9,0 6 9,0 1,000 0,323 3,101 Cefpodoxim- Proxetil 3 4,5 1 1,5 15 22,4 19 28,4 0,692 0,296 1,620 Meropenem 1 1,5 0 0 Vancomycin 15 22,4 12 17,9 1,429 0,544 3,753 Tobramycin inhalativ 1 1,5 2 3,0 0,500 0,045 5,514 Erythromycin 5 7,5 6 9,0 0,667 0,111 3,990 Clarithromycin 6 9,0 7 10,4 0,857 0,288 2,550 Clindamycin 0 0 4 6,0 Doxycyclin 5 7,5 2 3,0 2,500 0,485 12,886 Linezolid 5 7,5 6 9,0 0,833 0,254 2,731 Ciprofloxacin 35 52,2 35 52,2 1,000 0,500 2,000 Levofloxacin 0 0 1 1,5 Moxifloxacin 3 4,5 1 1,5 Cotrimoxazol therapeutisch 12 17,9 6 9,0 2,500 0,784 7,971 Cotrimoxazol prophylaktisch 4 6,0 0 0 14 20,9 15 22,4 0,917 0,404 2,077 1 1,5 3 4,5 0,333 0,035 3,205 Exposition gegenüber Antibiotika Imipenem Metronidazol Rifampicin 3.3.3. Multivariate Berechnungen der Variablen 'AntibiotikaExposition' Analog zur Analyse aller 240 Patienten wurde zur Vorbereitung der multivariaten Analyse zunächst eine konditionale logistische Regression jeder erfassten Variable zusammen mit der Variablen 'Antibiotika- 49 Exposition' durchgeführt. Die Ergebnisse dieser Vortestung sind in Tabelle 31 dargestellt. Tabelle 31: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 10 (95 % KI-Konfidenzintervall von 2.34 bis 42.78) bezogen auf Subgruppe des Marienhospitals Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert 11,69 2,60 52,59 Ja 8,94 2,06 38,88 Ja Verlegung aus Pflegeheimen 11,05 2,49 49,00 Nein Intensivaufenthalt 11,67 2,57 52,93 Nein Niereninsuffizienz 8,99 2,07 38,96 Ja maligne Erkrankung 12,09 2,62 55,73 Ja Lungenerkrankung 9,14 2,08 40,05 Nein neurologische Erkrankung 9,40 2,13 41,49 Nein Immunsuppression 8,24 1,89 35,98 Ja chronische Wunden 8,47 1,93 37,22 Ja vorhergehende Infekte 15,68 3,18 77,25 Ja Beatmungsdauer 12,53 2,76 56,93 Ja Dauer ZVK/ Shaldonkatheter 16,19 3,24 80,88 Ja ZVK / Shaldonkatheter 13,20 2,75 63,40 Ja 8,46 1,88 38,14 Ja Dauer Harnwegskatheter 13,26 2,86 61,39 Nein time at risk 14,53 3,09 68,23 Ja Relevante Variablen Alter Geschlecht Harnwegskatheter oberer Wert Aufnahme in log. Regression Variablen, die in diesem Test eine Veränderung der adjustierten Odds Ratio der Variablen 'Antibiotika-Exposition' um >5 % bewirkten, wurden in die konditionale logistische Regression aufgenommen. Durch dieses Vorgehen wurden gezielt Variablen mit Confounding Effekt für die logistische Regression ausgewählt. Aus grundsätzlichen methodischen Erwägungen wurde die Variable 'time-at-risk' unabhängig vom Ergebnis der Vortestung in die logistische Regression mit aufgenommen. Das Ergebnis der konditionalen logistischen Regression mit diesen Variablen ist in Tabelle 32 aufgelistet. Auch nach logistischer Regression ist somit die Variable 'Antibiotika-Exposition' mit einer Odds 50 Ratio von 43,78 bei einem 95 % Konfidenzintervall von 2,83 bis 677,59 noch ein signifikanter Risikofaktor für den Erwerb von ESBL. Tabelle 32: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der Subgruppe des Marienhospitals unjustierte 95 % Konfidenzintervall adjustierte 95 % Konfidenzintervall Odds Ratio Unterer Wert Obere r Wert Odds Ratio Unterer Wert Oberer Wert 10,00 2,34 42,78 43,78 2,83 677,59 Alter 1,02 0,99 1,04 0,98 0,93 1,04 Geschlecht 2,00 0,97 4,12 3,76 0,77 18,43 Niereninsuffizienz 2,11 0,96 4,67 4,58 0,90 23,29 Malignom 1,67 0,73 3,81 5,15 0,65 40,63 chronische Wunde 4,20 1,58 11,14 12,31 2,00 75,75 Immunsuppression 2,50 1,20 5,21 3,79 0,77 18,54 Vorhergehende Infekt 0,92 0,42 2,02 0,08 0,01 0,63 Dauer der Beatmung 0,98 0,94 1,02 1,02 0,90 1,16 ZVK / Shaldonkatheter 1,29 0,48 3,45 0,77 0,08 7,82 Dauer ZVK/ Shaldonkatheter 0,99 0,96 1,02 0,89 0,76 1,03 Harnwegskatheter 2,44 1,13 5,31 1,52 0,33 7,06 time at risk 0,99 0,98 1,00 1,00 0,97 1,02 Antibiotikaexposition 3.3.4. Medizinische Maßnahmen und Diagnostik Signifikante Unterschiede zwischen Fall- und Kontrollgruppe ergeben sich für die Existenz von Harnwegskatheter innerhalb von 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen). Diese Variabel könnte aufgrund dieser signifikanten Ergebnisse zum Erwerb einer ESBL-Infektion beigetragen haben. Hierbei muss jedoch berücksichtigt werden, dass ein positiver Zusammenhang zwischen einem Aufenthalt der Patienten auf der Intensivstation und dem Vorhandensein von Harnwegskatheter innerhalb von 30 Tagen besteht. Dieser Zusammenhang zeigt, dass es sich bei dem Aufenthalt auf der Intensivstation um einen Confounder handeln könnte und der Harnwegskatheter als Risikofaktor nicht unein- 51 geschränkt bewertet werden kann. Die weiteren Variablen zeigen keine signifikanten Unterschiede. Die Daten und Berechnungen sind aus Tabelle 33 zu entnehmen. Tabelle 33: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe des Marienhospitals nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anza hl Prozent der Fälle Anzahl Prozent der Kontrollen Beatmung 23 34,3 23 34,3 1,000 0,290 3,454 ZVK/ Shaldonkatheter 32 47,8 30 44,8 1,286 0,479 3,452 Harnwegskatheter 49 73,1 36 53,7 2,444 1,126 5,309 Vorhergehende Operationen 27 40,3 27 40,3 1,000 0,434 2,307 invasive Untersuchung 23 34,8 24 35,8 0,958 0,471 1,952 Verlegung aus medizinischer Einrichtung 18 26,9 13 19,4 1,833 0,678 4,957 Verlegung aus Pflegeheimen 5 7,6 3 4,5 1,667 0,398 6,974 Ratio Unterer Wert Oberer Wert 3.3.5. Komorbiditäten Signifikante Unterschiede zwischen Fall- und Kontrollgruppe ergeben sich für Lebererkrankungen, Lungenerkrankungen, Anwendung von Immunsuppressiva in den letzten 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen), rezidivierende Harnwegsinfekte sowie chronische Wunden. Diese Werte deuten auf die Möglichkeit hin, dass es sich bei diesen Variabeln um Risikofaktoren zum Erwerb einer ESBL-Infektion handelt. Die weiteren Variablen zeigen keine signifikanten Unterschiede. Die Daten und Ergebnisse sind in Tabelle 34 aufgelistet. 52 Tabelle 34: univariate Berechnungen der Komorbiditäten der Subgruppe des Marienhospitals nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Ratio Kontrollen Unterer Wert Oberer Wert Diabetes mellitus 23 34,3 22 32,8 1,083 0,494 2,374 Herzinsuffizienz 22 32,8 24 35,8 0,882 0,441 1,767 koronare Herzkrankheit 17 25,4 24 35,8 0,533 0,226 1,258 Herzrhythmusstörung 37 55,2 32 47,8 1,333 0,683 2,604 Lebererkrankung 18 26,9 8 11,9 4,333 1,235 15,206 1 1,5 0 gastrointestinale Erkrankung 38 56,7 29 43,3 1,750 0,861 3,557 Lungenerkrankung 43 64,2 27 40,3 2,600 1,254 5,391 maligne Erkrankung 18 2,9 12 17,9 1,667 0,729 3,808 neurologische Erkrankung 32 47,8 23 34,3 1,818 0,871 3,795 Niereninsuffizienz 42 62,7 33 49,3 2,111 0,955 4,666 3 4,5 1 Immunsuppression 31 46,3 16 23,9 2,500 1,201 5,205 chronische Wunden 26 38,8 10 14,9 4,200 1,584 11,138 Vorhergehende Infekt 48 71,6 49 73,1 0,923 0,421 2,023 rezidivierende Harnwegsinfekte 16 23,9 6 9,0 6,000 1,343 26,808 Hepatitis Transplantation 0 1,5 3.3.6. Multivariate Berechnungen der weiteren Risikofaktoren Die multivariate Berechnungen der weiteren Risikofaktoren zum Erwerb einer ESBL-Infektion wurde mit der binominalen logistischen Regression durchgeführt ohne Berücksichtigung der Paarung von Fällen und Kontrollen. Dabei wurden die Variablen ausgewählt, die in den univariaten Berechnungen signifikante Ergebnisse zeigten. Die multivariaten Ergebnisse sind in Tabelle 35 dargestellt. 53 Tabelle 35: Multivariate Berechnungen der Subgruppe des Marienhospitals zur Identifizierung von Risikofaktoren durch die binominale logistische Regression adjustierte Odds Ratio 95 % Konfidenzintervall unterer Wert Oberer Wert 10,869 2,073 56,986 Harnwegskatheter 2,081 0,776 5,581 Lebererkrankungen 2,818 0,913 8,696 Lungenerkrankungen 2,172 0,845 5,580 Immunsuppression 2,191 0,867 5,534 rezidivierende Harnwegsinfekte 3,709 1,100 12,508 chronische Wunden 3,778 1,281 11,142 Lebensalter größer 50 Jahre 1,064 0,260 4,364 time at risk 1,033 1,011 1,054 Antibiotikaexposition Die multivariate Berechnung dieser Variablen ergibt somit signifikante Werte für chronischen Wunden, rezidivierende Harnwegsinfektionen und die Anwendung von Antibiotika in den letzten 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen), sodass es sich hierbei um wahrscheinliche Risikofaktoren zum Erwerb einer Infektion mit ESBL-Keimen handelt. Die Antibiotikaexposition ist somit sowohl in der paarweisen und in der ungepaarten multivariaten Auswertung als auch in der gesamten Gruppe aller 240 Patienten als ein signifikannter Risikofaktor zum Erwerb einer ESBL-Infektion zu bewerten. 3.4. Subgruppenanalyse der Fälle mit ESBL-E. coli und deren zugehörige Kontrollen (77 Fall-Kontroll-Paare) Analog zur Erhebung der Daten der gesamten Patientengruppe wurde die entsprechende Analyse der Patientenmenge mit E. coli in gleicher Weise durchgeführt. 54 3.4.1. Demographische Daten Die Verteilung der Geschlechter in der Fall- und Kontrollgruppe zeigt ein Überwiegen der männlichen Patienten unter den Fällen im Verhältnis zu den weiblichen. In der Fallgruppe befanden sich 54,4 % (n = 42) Männer. Von den Kontrollen waren 42,9 % männlich (n = 33) (Tabelle 37). Die Altersverteilung ist in beiden Gruppen ähnlich und symmetrisch. Der Mittelwert des Alters beträgt 62,4 Jahre unter den Fällen sowie 59,0 Jahre unter den Kontrollen. In der Fallgruppe liegt der Median bei 65 Jahren und die Spannweite zwischen dem Altersminimum und – maximum bei 65 Jahren. Die Kontrollgruppe zeigt ein medianes Alter von 63 Jahren sowie eine Spannweite von 73 Jahren (Tabelle 36). Tabelle 36: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe mit ESBL- E. coli Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 62,44 77 65,0 25 90 65 Kontrolle 58,95 77 63,0 20 93 73 Insgesamt 60,69 154 64,5 20 93 73 Tabelle 37: univariate Berechnungen zu Geschlecht und Lebensalter der Subgruppe mit ESBL- E. coli nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Geschlecht männlich 42 54,4 33 42,9 1,833 0,907 3,704 Lebensalter größer 50 Jahre 65 84,4 53 68,8 2,571 1,191 7,558 Lebensalter größer 80 Jahre 11 14,3 9 11,7 1,286 0,479 3,452 Wie in Tabelle 37 ersichtlich besteht bei der Variabel 'Lebensalter größer als 50 Jahre' ein signifikantes Ergebnis, wobei es sich um einen Risikofaktor handeln könnte. 55 3.4.2. Antibiotikaexposition Die Fall-Kontroll-Studie ist in ihrem Studiendesign entsprechend der Hauptfragestellung darauf ausgerichtet zu untersuchen, ob eine Antibiotikaexposition einen Risikofaktor für ESBL darstellt. In der univariaten Analyse unterscheiden sich Fälle und Kontrollen bezüglich der Variable 'Antibiotika-Exposition' signifikant; die Odds Ratio betrug 3,0 mit einem 95 %-Konfidenzintervall von 1,090 bis 8,254. 93,5 % der Fälle und 81,8 % der Kontrollen hatten eine Antibiotika-Exposition. Diese stellt daher einen Risikofaktor zum Erwerb einer ESBL-Infektion dar (Tabelle 38). Bei der Auswertung der Betalaktamantibiotika zeigen sich keine signifikanten Unterschiede zwischen Fall- und Kontrollgruppe in der Einnahmehäufigkeit, jedoch bei der Einnahme von Cotrimoxazol in therapeutischer Anwendung, so dass es sich hierbei um einen Risikofaktor zum Erwerb einer Infektion mit ESBL-E. coli handeln könnte. Die Daten und Berechnungen sind der Tabelle 38 zu entnehmen. 56 Tabelle 38: Univariate Berechnungen der Antibiotikaexposition der Subgruppe mit ESBLE. coli nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert 72 93,5 63 81,8 3,000 1,090 8,254 Penicillin 2 2,6 1 1,3 Flucloxacillin 1 1,3 3 3,9 0,333 0,035 3,205 Ampicillin 8 10,4 5 6,5 2,000 0,500 7,997 Ampicillin/ Sulbactam 1 1,3 2 2,6 0,500 0,045 5,514 15 19,5 12 15,6 1,333 0,562 3,164 4 5,2 3 3,9 Piperacillin/ Tazobactam 13 16,9 12 15,6 1,143 0,414 3,152 Cefuroxim 17 22,1 14 18,2 1,143 0,414 3,152 Ceftriaxon 26 33,8 24 31,2 1,188 0,611 2,309 Ceftazidim 3 3,9 6 7,8 0,600 0,143 2,511 Cefpodoxim- proxetil 1 1,3 0 0 13 16,9 18 23,4 0,643 0,278 1,485 Meropenem 0 0 2 2,6 Vancomycin 12 15,6 7 9,1 2,200 0,764 6,332 Tobramycin inhalativ 0 0 2 2,6 Erythromycin 4 5,2 6 7,8 0,750 0,168 3,351 Clarithromycin 5 6,5 5 6,5 1,000 0,290 3,454 Clindamycin 2 2,6 4 5,2 0,333 0,035 3,205 Doxycyclin 4 5,2 4 5,2 0,750 0,168 3,351 Linezolid 4 5,2 2 2,6 2,000 0,366 10,919 Ciprofloxacin 38 49,4 34 44,2 1,188 0,611 2,309 Moxifloxacin 5 6,5 3 3,9 1,667 0,398 6,974 Cotrimoxazol therapeutisch 12 15,6 4 5,2 5,000 1,096 22,820 Cotrimoxazol prophylaktisch 22 28,6 19 24,7 1,400 0,622 3,152 Nitrofurantoin 1 1,3 1 1,3 0,500 0,045 5,514 Metronidazol 15 19,5 17 22,1 0,857 0,396 1,853 Exposition gegenüber Antibiotika Amoxicillin/ Clavulansäure Piperacillin Imipenem 3.4.3. Multivariate Berechnungen der Variable 'AntibiotikaExposition' Analog zur Analyse aller 240 Patienten wurde zur Vorbereitung der multivariaten Analyse zunächst eine konditionale logistische Regression jeder erfassten Variable zusammen mit der Variablen 'AntibiotikaExposition' durchgeführt. Die Ergebnisse dieser Vortestung sind in Tabelle 39 dargestellt. 57 Tabelle 39: Konditionale logistische Regression zur Vortestung relevanter Variablen zusammen mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 3,0 (95 %-Konfidenzintervall von 1,09 bis 8,25) bezogen auf die Subgruppe mit ESBL-E. coli Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert Geschlecht 2,71 0,97 7,58 Ja Anzahl an Krankenhausaufenthalten 2,75 0,98 7,69 Nein Niereninsuffizienz 2,59 0,91 7,35 Ja Diabetes mellitus 3,27 1,15 9,27 Ja Herzrhythmusstörung 3,22 1,14 9,08 ja maligne Erkrankung 3,23 1,14 9,14 Ja Lungenerkrankung 2,60 0,92 7,29 Ja neurologische Erkrankung 2,71 0,97 7,59 Ja Immunsuppression 2,21 0,77 6,34 Ja chronische Wunden 2,83 1,01 7,97 Ja rezidivierende Harnwegsinfekte 3,95 1,17 13,37 Ja Beatmung 2,82 1,01 7,85 Ja Dauer ZVK/ Shaldonkatheter 2,72 0,94 7,85 Nein ZVK / Shaldonkatheter 2,42 0,84 6,96 Ja Harnwegskatheter 2,33 0,81 6,69 Ja time at risk 3,18 1,14 8,86 Ja Relevante Variablen oberer Wert Aufnahme in log. Regression Variablen, die in diesem Test eine Veränderung der adjustierrten Odds Ratio der Variablen 'Antibiotika-Exposition' um >5 % bewirkten, wurden in die konditionale logistische Regression aufgenommen. Durch dieses Vorgehen wurden gezielt Variablen mit Confounding Effekt für die logistische Regression ausgewählt. Aus grundsätzlichen methodischen Erwägungen wurde die Variable 'time-at-risk' unabhängig vom Ergebnis der Vortestung in die logistische Regression mit aufgenommen. Das Ergebnis der konditionalen logistischen Regression mit diesen Variablen ist in Tabelle 40 aufgelistet. Es zeigt sich hier, dass nach logistischer Regression die Variable 'Antibiotika-Exposition' mit einer Odds Ratio von 1,25 bei einem 95 % Konfidenzintervall von 0,18 bis 8,41 kein signifikanter Risikofaktor für den Erwerb von ESBL ist. 58 Tabelle 40: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' durch die konditionale logistische Regression der Subgruppe mit E. coli unjustierte 95 % Konfidenzintervall adjustierte 95 % Konfidenzintervall Odds Ratio unterer Wert oberer Wert Odds Ratio unterer Wert oberer Wert Antibiotikaexposition 3,00 1,09 8,25 1,25 0,18 8,41 Geschlecht 1,83 0,91 3,70 1,98 0,41 9,52 Diabetes mellitus 1,83 0,91 3,70 1,82 0,35 9,48 Herzrhythmusstörungen 0,88 0,43 1,79 0,10 0,01 0,85 Niereninsuffizienz 3,50 1,15 10,63 34,65 1,63 737,13 Malignom 1,67 0,73 3,81 3,89 0,52 28,97 Lungenerkrankungen 2,33 1,07 5,09 8,79 0,97 79,69 neurologische Erkrankungen 1,92 0,95 3,85 0,44 0,10 1,98 chronische Wunden 3,50 1,15 10,63 4,39 0,70 27,68 Immunsuppression 4,50 1,52 13,30 35,97 1,78 728,52 rezidivierende Harnwegsinfekte 11,0 2,59 46,78 154,27 2,96 8040,9 Beatmung 2,00 0,60 6,64 0,17 0,02 1,68 ZVK-/Shaldonkatheter 2,22 1,01 4,88 3,40 0,34 34,34 Harnwegskatheter 2,55 1,27 5,11 6,53 1,05 40,66 time at risk 1,00 0,98 1,01 0,94 0,90 0,99 3.4.4. medizinische Maßnahmen und Diagnostik Im Vergleich von Fall- und Kontrollgruppe zeigen sich signifikante Unterschiede in folgenden Punkten: zentraler Venen- bzw. Shaldonkatheter sowie Harnwegskatheter und ein Krankenhausaufenthalt länger als 15 Tage. Die Werte und Berechnungen sind in Tabelle 41 dargestellt. Bei der Anzahl der Krankenhausaufenthalte in den letzten 12 Monaten ergibt sich bei der Fallgruppe ein Mittelwert von 1,27 sowie ein Median von 1,0. In der Kontrollgruppe konnte ein Wert von 1,32 und ein medianer Wert von 1,0 berechnet werden. Diese Daten ergeben keinen signifikanten Unterschied in der Fall- und Kontrollgruppe. 59 Tabelle 41: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe mit ESBL-E. coli nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Beatmung 16 20,8 12 15,6 2,000 0,602 6,642 ZVK /Shaldonkatheter 41 53,2 30 39,0 2,222 1,012 4,880 Harnwegskatheter 51 66,2 33 42,9 2,545 1,267 5,113 Vorhergehende Operationen 34 44,2 31 40,3 1,364 0,626 2,969 invasive Untersuchung 21 27,3 22 28,6 0,938 0,464 1,896 Krankenhausaufenthalt länger als 15 Tage 54 71,1 36 46,8 4,800 1,831 12,580 Verlegung aus med. Einrichtung 11 14,3 9 11,7 4 5,3 1 1,3 4,222 0,461 38,677 Verlegung aus Pflegeheimen Bei der Auswertung der Aufenthaltsdauer auf der Intensivstation ergeben sich folgende Werte: ein Mittelwert von 4,57 Tagen mit einer Spannweite von 135 Tagen in der Fallgruppe sowie ein Mittelwert von 4,45 Tagen mit einer Spannweite von 54 Tagen in der Kontrollgruppe. Diese Werte beziehen sich auf den Zeitraum bis zur Erstisolierung (bei Fällen) bzw. bis zur Entlassung (bei Kontrollen). Hierbei handelt es sich um keinen signifikanten Unterschied. 3.4.5. Komorbiditäten Signifikante Werte zeigen sich bei Lungenerkrankungen, der Anwendung von Immunsuppressiva, rezidivierenden Harnwegsinfekten und Niereninsuffizienz. Daher könnte es sich hierbei um Risikofaktoren zum Erwerb einer ESBL-Infektion handeln. Tabelle 42 gibt die Daten und Berechnungen an. 60 Tabelle 42: univariate Berechnungen der Komorbiditäten der Subgruppe mit ESBL-E. coli nach der Methode von Mantel-Haenszel Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Diabetes mellitus 30 39,0 20 26,0 1,833 0,907 3,704 Herzinsuffizienz 15 19,5 17 22,1 0,857 0,396 1,853 koronare Herzkrankheit 23 29,9 23 29,9 1,000 0,464 2,157 Herzrhythmusstörung 24 31,2 25 32,5 0,875 0,427 1,793 Lebererkrankung 12 15,6 7 9,1 2,250 0,693 7,306 4 5,2 4 5,2 1,000 0,250 3,998 gastrointestinale Erkrankung 38 49,4 35 45,5 1,167 0,622 2,190 Lungenerkrankung 33 42,9 20 26,0 2,333 1,069 5,095 maligne Erkrankung 17 22,1 11 14,3 1,667 0,729 3,808 maligne solide Erkrankung 16 20,8 10 13,0 1,750 0,734 4,172 neurologische Erkrankung 33 42,9 22 28,6 1,917 0,954 3,852 chronische Wunden 19 24,7 8 10,4 3,500 1,152 10,633 Niereninsuffizienz 63 81,8 53 68,8 3,500 1,152 10,633 Transplantation 37 48,1 36 46,8 2,000 0,181 22,056 Immunsuppressiva 58 75,3 44 57,1 4,500 1,523 13,296 5 6,5 5 6,5 1,500 0,251 8,977 Vorhergehende Infekte 52 67,5 50 64,9 1,077 0,506 2,291 rezidivierende Harnwegsinfekte 29 37,7 10 13,0 11,000 2,587 46,779 Hepatitis Neutropenie 3.4.6. Multivariate Berechnungen weiterer Risikofaktoren Die multivariate Berechnungen der weiteren Risikofaktoren zum Erwerb einer ESBL-Infektion wurde mit der binominalen logistischen Regression durchgeführt ohne Berücksichtigung der Paarung von Fällen und Kontrollen. Dabei wurden die Variablen ausgewählt, die in den univariaten Berechnungen signifikante Ergebnisse zeigten (siehe Tabelle 43). 61 Tabelle 43: Multivariate Berechnungen der Subgruppe mit ESBL-E. coli zur Identifizierung von Risikofaktoren durch die binominale logistische Regression adjustierte Odds Ratio 95 % Konfidenzintervall unterer Wert Oberer Wert Antibiotikaexposition 2,025 0,540 7,593 Cotrimoxazol therapeutisch 6,995 1,473 33,228 ZVK / Shaldonkatheter 1,360 0,464 3,986 Harnwegskatheter 3,189 1,147 8,861 Lungenerkrankungen 3,455 1,288 9,265 chronische Wunden 3,137 1,023 9,614 Niereninsuffizienz 1,164 0,385 3,520 Immunsuppression 1,752 0,617 4,975 rezidivierende Harnwegsinfekte 7,417 2,677 20,549 Lebensalter größer als 50 Jahre 2,110 0,821 5,422 time at risk 1,050 1,023 1,078 In Tabelle 43 ist es erkennbar, dass sich für die Variablen Cotrimoxazol, Harnwegskatheter, Lungenerkrankungen, chronische Wunden und rezidivierende Harnwegsinfekte signifikannte Werte ergeben, sodass diese Risikofaktoren darstellen. Weiterhin stellt sich die Antibiotikaexposition sowohl in der binominalen logistischen Regression (Tabelle 43) wie auch in der konditionalen logistischen Regression zur multivariaten Berechnung zu Confounding-Faktoren der Variable 'Antibiotika-Exposition' (Tabelle 40) als nicht signifikant dar und kann daher nicht als Risikofaktor identifiziert werden. Bei allen weiteren Variablen ergaben die multivariaten Berechnungen keine signifikanten Werte. Die Antibiotikaexposition ergibt also in der Patientengruppe mit ESBLE. coli nur in der univariaten Analyse, jedoch nicht in den multivariaten Analysen in gepaarter als auch in ungepaarter Berechnung signifikannte Werte und stellt somit keinen Risikofaktor zum Erwerb einer ESBL-Infektion dar. 62 3.5. Subgruppenanalyse der Fälle mit ESBL-Klebsiella pneumoniae und deren zugehörige Kontrollen (43 Fall-Kontroll-Paare): Analog zur Erhebung der Daten aller 240 Patienten wurde die entsprechende Analyse der Subgruppe mit ESBL-K. pneumoniae in gleicher Weise durchgeführt. 3.5.1. Demographische Daten Die Verteilung der Geschlechter in der Fall- und Kontrollgruppe zeigt ein Überwiegen der männlichen Patienten unter den Fällen im Verhältnis zu den weiblichen. In der Fallgruppe befanden sich 62,8 % (n = 27) Männer. Von den Kontrollen waren 60,5 % (n = 26) männlich (Tabelle 45). Die Altersverteilung ist in beiden Gruppen ähnlich und symmetrisch. Der Mittelwert des Alters beträgt 60,4 Jahre unter den Fällen sowie 60,8 Jahre unter den Kontrollen. In der Fallgruppe liegt der Median bei 61 Jahren und die Spannweite zwischen dem Altersminimum und – maximum bei 60 Jahren. Die Kontrollgruppe zeigt ein medianes Alter von 63 Jahren sowie eine Spannweite von 70 Jahren (Tabelle 44 und Tabelle 45). Tabelle 44: Mittelwerte des Lebensalters der Fall- und Kontrollgruppe der Subgruppe mit ESBL-K. pneumoniae Fall/Kontrolle Mittelwert Anzahl Median Minimum Maximum Spannweite Fall 60,44 43 61 29 89 60 Kontrolle 60,77 43 63 27 97 70 Insgesamt 60,60 86 62 27 97 70 Tabelle 45: univariate Berechnungen zu Geschlecht und Lebensalter der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio unterer Wert oberer Wert Geschlecht männlich 27 62,8 26 60,5 1,100 0,467 2,590 Lebensalter größer 50 Jahre 30 69,8 30 69,8 1,000 0,351 2,851 Lebensalter größer 80 Jahre 7 16,3 4 9,3 1,750 0,512 5,978 63 3.5.2. Antibiotikaexposition Die Fall-Kontroll-Studie ist in ihrem Studiendesign entsprechend der Hauptfragestellung darauf ausgerichtet zu untersuchen, ob eine Antibiotikaexposition einen Risikofaktor für ESBL darstellt. In dieser Subgruppe war eine paarweise Analyse unter Erhaltung der Fall-Kontroll-Zuordnungen mit dem Programm 'matchTab' bedingt durch eine geringe Fallzahl jedoch nicht möglich. Daher wurde diese Analyse mit dem epicalc-Programm cc oder dem R-Programm glm durchgeführt. In dieser univariaten Analyse unterscheiden sich Fälle und Kontrollen bezüglich der Variable Antibiotika-Exposition signifikant, die Odds Ratio betrug 20,28 mit einem 95 %-Konfidenzintervall von 2,525 bis 162,82. 93,5 % der Fälle und 81,8 %. der Kontrollen hatten eine AntibiotikaExposition und stellt daher einen Risikofaktor zum Erwerb einer ESBLInfektion dar (Tabelle 46). Bei der Auswertung der weiteren Antibiotikaklassen zeigen sich keine signifikanten Unterschiede zwischen Fall- und Kontrollgruppe in der Antibiotikaexposition (Tabelle 46). 64 Tabelle 46: Univariate Berechnungen der Antibiotikaexposition der Subgruppe mit ESBLK. pneumoniae nach dem generalisierten linearen Modell Fall Kontrolle Odds Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen 42 97,7 29 67,4 Penicillin 1 2,3 0 0 Flucloxacillin 2 4,7 1 Ampicillin 1 2,3 Amoxicillin/ Clavulansäure 4 Piperacillin Exposition gegenüber Antibiotika 95 % Konfidenzintervall Ratio Unterer Wert Oberer Wert 20,276 2,525 162,82 2,3 2,049 0,179 23,476 2 4,7 0,500 0,045 5,514 9,3 1 2,3 4,308 0,461 40,231 1 2,3 1 2,3 1,000 0,061 16,521 10 23,3 9 20,9 1,333 0,298 5,957 Cefuroxim 6 14,0 7 16,3 0,833 0,254 2,731 Ceftriaxon 22 51,2 13 30,2 2,286 0,940 5,556 Ceftazidim 3 7,0 0 0 Cefpodoxim- proxetil 2 4,7 1 2,3 2,049 0,179 23,476 Imipenem 7 16,3 8 18,6 0,800 0,215 2,979 Meropenem 1 2,3 0 0 Vancomycin 7 16,3 6 14,0 1,500 0,251 8,977 Tobramycin inhalativ 1 2,3 1 2,3 1,000 0,061 16,521 Erythromycin 4 9,3 2 4,7 2,103 0,364 12,137 Clarithromycin 4 9,3 2 4,7 2,000 0,366 10,919 Clindamycin 0 0 2 4,7 Doxycyclin 3 7,0 1 2,3 3,150 0,314 31,552 Linezolid 1 2,3 4 9,3 0,250 0,028 2,237 Levofloxacin 0 0 1 2,3 Ciprofloxacin 15 34,9 21 48,8 0,500 0,188 1,332 Moxifloxacin 0 0 2 4,7 Cotrimoxazol therapeutisch 2 4,7 3 7,0 0,667 0,111 3,990 Cotrimoxazol prophylaktisch 12 27,9 6 14,0 2,387 0,803 7,100 Nitrofurantoin 2 4,7 0 0 Metronidazol 9 20,9 6 14,0 1,600 0,523 4,891 Rifampicin 1 2,3 2 4,7 0,500 0,045 5,514 Piperacillin/ Tazobactam 3.5.3. Multivariate Berechnungen der Variable 'AntibiotikaExposition' Analog zur Analyse aller 240 Patienten wurde zur Vorbereitung der multivariaten Analyse zunächst eine konditionale logistische Regression jeder erfassten Variable zusammen mit der Variablen 'AntibiotikaExposition' durchgeführt. Die Ergebnisse sind in Tabelle 47 dargestellt. 65 Hierbei ergaben sich allerdings unplausible hohe Werte für die Odds Ratio der Antibiotikaexposition. Tabelle 47:konditionale logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 1615474835 (95 %-Konfidenzintervall von 0 bis ∞) bez. auf Subgruppe mit ESBL-K. pneumoniae Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert oberer Wert Alter größer als 70 Jahre 1762252110 0 ∞ Anzahl an Krankenhausaufenthalte 1525355778 0 ∞ 54099932462495592 0 ∞ Marienhospital periphere Station 1615474865 0 ∞ Intensivaufenthalt 1615474865 0 ∞ Dauer Intensivaufenthalt 2144612237 0 ∞ Diabetes mellitus 1615474864 0 ∞ Lebererkrankung 1331940499 0 ∞ Neurologische Erkrankung 1325565519 0 ∞ Immunsuppression 1872730117 0 ∞ chronische Wunden 1219315693 0 ∞ vorhergehende Infekte 1615474835 0 ∞ Beatmung 6918633530653956 0 ∞ Beatmungsdauer 6918633530653956 0 ∞ Dauer ZVK/ Shaldonkatheter 1441057803 0 ∞ Harnwegskatheter 1157089282 0 ∞ Dauer Harnwegskatheter 2198292501 0 ∞ vorhergehende Operationen 1465571235 0 ∞ 27449216977 0 ∞ Relevante Variablen Verlegung aus Pflegeheimen time at risk Daher wurde diese Auswertung ohne Fall-Kontroll-Paarung durchgeführt. Es werden die Variablen erfasst, die einen möglichen Confounding Effekt auf die Variable 'Antibiotika-Exposition' als signifikanten Risikofaktor zum Erwerb einer ESBL-Infektion darstellen. Variablen, die in diesem Test eine Veränderung der Odds Ratio der Variablen 'Antibiotika-Exposition' um > 5 % bewirkten, wurden in die logistische Regression aufgenommen. Die Ergebnisse dieser Vortestung sind in Tabelle 48 dargestellt. 66 Tabelle 48: logistische Regression zur Vortestung relevanter Variablen zus. mit der Variablen 'Antibiotika-Exposition' mit einer unjustierten Odds Ratio von 20.28 (95 %-Konfidenzintervall von 2.52 bis 162.82) bez. auf Subgruppe mit ESBL-K. pneumoniae Adjustierte Odds Ratio der Variablen 'Antibiotika-Exposition' 95 % Konfidenzintervall unterer Wert Alter größer als 70 Jahre 22,48 2,72 185,60 Ja Anzahl an Krankenhausaufenthalte 17,47 2,16 141,58 Ja Verlegung aus Pflegeheimen 26,64 2,64 268,50 Ja Marienhospital periphere Station 22,19 2,69 182,80 Ja Intensivaufenthalt 21,84 2,68 178,21 Ja Dauer Intensivaufenthalt 27,01 3,30 220,98 Ja Diabetes mellitus 19,22 2,37 155,58 Ja Lebererkrankung 18,48 2,28 150,05 Ja Neurologische Erkrankung 18,16 2,23 148,18 Ja Immunsuppression 21,63 2,64 177,26 Ja chronische Wunden 17,72 2,18 144,12 Ja vorhergehende Infekte 22,93 2,72 192,97 Ja Beatmung 23,49 2,86 192,73 Ja Beatmungsdauer 25,63 3,14 208,98 Ja Dauer ZVK/ Shaldonkatheter 26,59 3,22 219,61 Ja Harnwegskatheter 14,75 1,74 125,41 Ja Dauer Harnwegskatheter 22,34 2,72 183,36 Ja vorhergehende Operationen 18,49 2,28 150,09 Ja time at risk 30,48 3,67 253,23 Ja Relevante Variablen oberer Wert Aufnahme in log. Regression Aus grundsätzlichen methodischen Erwägungen wurde die Variable 'time-at-risk' unabhängig vom Ergebnis der Vortestung in die logistische Regression mit aufgenommen. Die Ergebnisse sind in Tabelle 49 ersichtlich. Die Variablen beeinflussen somit die Variable 'AntibiotikaExposition' als Confounding-Faktor, da der adjustierte Odds Ratio für 'Antibiotika-Exposition' bei 19,36 mit einem 95 % Konfidenzintervall von 0,640 bis 584,25 liegt und nach Adjustierung durch die aufgelisteten Variablen keine signifikanten Werte ergibt. 67 Tabelle 49: Multivariate Berechnung zu Confounding-Faktoren der Variable 'Antibiotikaexposition' der Subgruppe mit K. pneumoniae durch die logistische Regression mit einem generalisierten linearen Modell unjustierte 95 % Konfidenzintervall adjustierte 95 % Konfidenzintervall Odds Ratio unterer Wert oberer Wert Odds Ratio unterer Wert oberer Wert 23,52 2,91 189,83 19,36 0,64 584,25 Alter größer als 70 Jahre 0,86 0,35 2,11 2,7 0,34 21,33 Anzahl der Krankenhausaufenthalte 1,42 0,97 2,08 2,18 1,13 4,19 Marienhospital periphere Station 0,87 0,34 2,20 0,05 0 1,13 Intensivstationsaufenthalt 0,85 0,35 2,07 1,12 0,06 22,05 Dauer auf der Intensivstation 0,96 0,92 1,01 0,82 0,66 1,00 Verlegung aus Pflegeheim 0,59 0,09 3,70 0,48 0,01 41,77 Diabetes mellitus 1,51 0,59 3,83 1,60 0,31 8,14 Lebererkrankungen 3,18 0,79 12,73 18,88 1,11 320,55 neurologische Erkrankungen 2,78 1,13 6,83 4,98 0,88 28,30 chronische Wunde 3,28 1,06 10,21 11,98 0,94 152,08 Immunsuppressiva 1,31 0,55 3,15 0,66 0,08 5,49 Vorhergehender Infekt 1,03 0,40 2,63 0,61 0,08 4,60 Beatmung 0,77 0,29 2,03 15,45 0,48 493,61 Dauer der Beatmung 0,96 0,92 1,01 0,79 0,59 1,07 Dauer ZVK/ Shaldonkatheter 0,98 0,95 1,02 1,09 0,90 1,31 Harnwegskatheter 3,97 1,42 11,11 1,56 0,07 36,61 Dauer Harnwegskatheter 1,00 0,97 1,03 1,08 0,95 1,23 Operationen 2,18 0,90 5,30 3,98 0,55 28,89 time at risk 0,99 0,97 1,01 0,98 0,92 1,04 Antibiotikaexposition Es stellt sich somit heraus, dass die adjustierten Odds Ratio für Antibiotikaexposition keinen Risikofaktor zum Erwerb eines ESBLKeimes mehr darstellt. Dieses Ergebnis könnte dabei darauf zurückgeführt werden, dass bei dieser Berechnung auf das „matching“, d.h. auf die paarweise Auswertung der Fall-Kontroll-Zuordnungen, verzichtet werden mußte. 3.5.4. medizinische Maßnahmen und Diagnostik Im Vergleich von Fall- und Kontrollgruppe zeigen sich signifikante Unterschiede bei dem Vorhandensein von Harnwegskatheter innerhalb von 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im 68 Zeitraum bis zur Entlassung (bei Kontrollen) sowie bei einem gesamten Krankenhausaufenthalt länger als 15 Tage. In Tabelle 50 sind die Daten und Berechnungen aufgezeigt. Tabelle 50: Univariate Berechnungen der medizinischen Maßnahmen und Diagnostik der Subgruppe mit ESBL-K. pneumoniae nach dem generalisierten linearen Modell Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Beatmung 11 25,6 12 27,9 0,500 0,045 5,514 ZVK /Shaldonkatheter 26 60,5 20 46,5 2,500 0,784 7,971 Harnwegskatheter 36 83,7 25 58,1 4,667 1,341 16,239 vorhergehende Operationen 28 65,1 21 48,8 2,167 0,824 5,700 9 21,4 16 37,2 0,460 0,176 1,204 36 94,7 25 64,1 6,000 1,343 26,808 Verlegung aus med. Einrichtung 9 20,9 8 18,6 1,200 0,366 3,932 Verlegung aus Pflegeheimen 2 4,7 3 7,0 0,667 0,111 3,990 Invasive Untersuchung Krankenhausaufenthalt länger als 15 Tage Bei der Anzahl der Krankenhausaufenthalte in den letzten 12 Monaten ergibt sich in der Fallgruppe ein Mittelwert von 1,37 sowie ein Median von 1,0 und eine Spannweite von 7. In der Kontrollgruppe jedoch zeigt sich ein Mittelwert von 0,77 und ein medianer Wert von 1,0 und eine Spannweite von 4. Diese Werte ergeben einen signifikanten Unterschied zwischen der Fall- und Kontrollgruppe mit einem p-Wert von 0,040. Bei der Auswertung der Aufenthaltsdauer auf der Intensivstation ergeben sich folgende Werte: ein Mittelwert von 3,77 Tagen mit einer Spannweite von 36 Tagen in der Fallgruppe sowie ein Mittelwert von 8,88 Tagen mit einer Spannweite von 103 Tagen in der Kontrollgruppe. Diese Werte beziehen sich auf den Zeitraum innerhalb von 30 Tagen vor Erstisolierung des Zielkeimes (bei Fällen) bzw. im Zeitraum bis zur Entlassung (bei Kontrollen) und zeigen keinen signifikanten Unterschied. 69 3.5.5. Komorbiditäten Signifikante Werte zeigen sich bei neurologischen Erkrankungen und chronischen Wunden, die einen Hinweis auf einen Risikofaktor zum Erwerb einer ESBL-Infektion geben. Die Daten und Berechnungen sind der Tabelle 51 zu entnehmen. Tabelle 51: univariate Berechnungen der Komorbiditäten der Subgruppe mit ESBLK. pneumoniae nach dem generalisierten linearen Modell Fall Kontrolle Odds 95 % Konfidenzintervall Anzahl Prozent der Fälle Anzahl Prozent der Kontrollen Ratio Unterer Wert Oberer Wert Diabetes mellitus 16 37,2 11 25,6 2,000 0,684 5,851 Herzinsuffizienz 17 39,5 13 30,2 1,571 0,609 4,054 7 16,3 10 23,3 0,571 0,167 1,952 22 51,2 16 37,2 1,857 0,741 4,655 9 20,9 4 9,3 gastrointestinale Erkrankung 23 53,5 19 44,2 1,444 0,617 3,379 Lungenerkrankung 22 51,2 19 44,2 1,375 0,553 3,418 maligne Erkrankung 7 16,3 4 9,3 2,500 0,485 12,886 maligne solide Erkrankung 5 11,6 4 9,3 1,500 0,251 8,977 neurologische Erkrankung 25 58,1 14 32,6 2,375 1,040 5,425 chronische Wunden 14 32,6 5 11,6 4,000 1,129 14,175 Niereninsuffizienz 32 74,4 32 74,4 1,200 0,366 3,932 Transplantation 18 41,9 16 37,2 Immunsuppression 26 60,5 25 58,1 1,167 0,392 3,471 2 4,7 1 2,3 Vorhergehende Infekte 30 69,8 28 65,1 1,222 0,506 2,949 rezidivierende Harnwegsinfekte 12 27,9 5 11,6 4,500 0,972 20,827 koronare Herzkrankheit Herzrhythmusstörung Lebererkrankung Neutropenie 3.5.6. Multivariate Berechnungen der weiteren Risikofaktoren Die multivariaten Berechnungen der weiteren Risikofaktoren zum Erwerb einer ESBL-Infektion wurde mit der binominalen logistischen Regression durchgeführt ohne Berücksichtigung der Paarung von Fällen und Kontrollen. Dabei wurden die Variablen ausgewählt, die in den univariaten Berechnungen signifikante Ergebnisse zeigten (sieheTabelle 52). 70 Tabelle 52: Multivariate Berechnungen der Subgruppe mit ESBL- K pneumoniae zur Identifizierung von Risikofaktoren durch die binominale logistische Regression adjustierte Odds Ratio 95 % Konfidenzintervall unterer Wert Oberer Wert 17,279 1,935 154,339 Harnwegskatheter 2,216 0,649 7,571 neurologische Erkrankungen 2,011 0,711 5,691 chronische Wunden 2,821 0,755 10,543 time at risk 1,022 0,998 1,048 Antibiotikaexposition In der Berechnung der binominalen logistischen Regression zeigt im Gegensatz zur konditionalen logistischen Regression zur Bestimmung der Confounding-Faktoren der Variable 'Antibiotika-Exposition' (siehe Tabelle 49) die Antibiotikaexposition signifikante Werte, sodass diese als Risikofaktor in Betracht gezogen werden kann (Tabelle 52). Weiterhin konnten keine weiteren signifikanten Risikofaktoren zum Erwerb einer Infektion mit ESBL-Klebsiella pneumoniae festgestellt werden. 71 4. Diskussion 4.1. Hintergrund Ziel dieser Arbeit war es, Risikofaktoren zu identifizieren, die zum Erwerb einer Infektion mit ESBL-produzierenden E. coli oder K. pneumoniae führen. Da im Raum Bochum die Rate an ESBLInfektionen drastisch angestiegen war, ist diese Studie initiiert worden. Die Bedeutung von Infektionen mit ESBL wurde bereits in einigen Studien durch eine signifikant höhere Letalität verdeutlicht. Hierbei spielt eine inadäquate initiale antimikrobielle Therapie sowie eine Verzögerung einer effektiven Therapie eine wichtige Rolle [28; 36]. Weltweit gibt es viele verschiedene Artikel und Studien zu dem Erwerb von ESBL-Infektionen sowie deren Risikofaktoren. Die meisten Studien zu den Risikofaktoren stammen aus Spanien, Asien und Italien. Hierbei ist die Bedeutung der weltweiten Ausbreitung der ESBL-Keime vom CTX-M-Typ bedeutsam, insbesondere von CTX-M-15. In Deutschland bzw. im größeren Umkreis von Bochum sind in den letzten Jahren nur wenige Studien zu ESBL-Infektionen veröffentlicht worden. Die Bedeutung der Identifizierung von Risikofaktoren ist essentiell, um Präventionsstrategien entwickeln zu können. Dies bezieht sich besonders auf eine effektive initiale antimikrobielle Therapie, um die Letalität zu senken [36], aber auch auf Risikofaktoren, die bereits früh in der Behandlungsphase berücksichtigt werden können. 4.2. Konzeption der Studie Da die Infektionsrate mit ESBL- Keimen zwar ansteigt, jedoch noch immer eine eher seltene Erkrankung ist, wurde eine Fall-Kontroll-Studie als Studiendesign ausgewählt. Vorteile liegen in der schnellen und anhand der Patientendokumentation leicht erfassbaren Durchführung ohne ein Risiko für den Patienten, der relativ gering erforderlichen Anzahl an Patienten und einer kostengünstigen Realisierung. 72 Es ist beschrieben worden, dass die optimale Kontrollgruppenauswahl aus der Kohorte hospitalisierter Patienten bestehen sollte [13]. Die Kontrollgruppe wurde in der vorliegenden Arbeit dementsprechend aus derselben Populationsbasis wie die der Fallgruppe gewählt. Der Kontrollpatient wurde von derselben Station wie der Fallpatient gewählt, um einen Einfluss bereichsabhängiger ESBL-Raten sowie hygienische Bedingungen zu minimieren. Die Kontrollgruppe sollte nach Harris et al. so ausgesucht werden, dass die Keime, die bei den Kontrollen isoliert wurden, nicht der sensiblen Form des Zielkeimes entsprechen, da diese nicht die Basispopulation repräsentiert und dies einen Bias ergeben würde, wodurch eine Antibiotikaexposition fälschlicherweise als Risikofakor dargestellt werden kann [13]. Diese Kontrollgruppenauswahl ist nur von Pena et al. [23], Schwaber et al. [29] und Skippen et al.[31] in der Beschreibung nach Harris et al. [13] durchgeführt worden. Die meisten Studien wählten eine Kontrollgruppe mit dem sensiblen Zielkeim. In der hier vorliegenden Arbeit wurden den Ergebnissen von Harris et al. [13] entsprechend als Kontrollpatienten nicht die Patienten gewählt, die mit einem sensiblen E. coli bzw. einer sensiblen Klebsiella pneumoniae infiziert waren, sondern die Patienten, die keine Infektion mit ESBL- produzierenden Keimen unabhängig von einer bestimmten Spezies aufwiesen. Hierbei wurden nur Kontrollpatienten einbezogen, von denen mindestens eine mikrobiologische Kultur angelegt wurde, um eine „Misclassification Bias“ auszuschließen. Bei Harris et al. [12] wird dieses Problem ebenfalls beschrieben. Eine „Misclassification Bias“ kann demnach dadurch entstehen, dass eine Kontrolle ohne klinischer Kultur einen unidentifizierten Fall darstellen könnte. Weiterhin wird das Problem des „Severity of illness Bias“ beschrieben. Nach Harris et al. [12] kommt es zu einer Eliminierung von Patienten mit nur leichten Erkrankungen, indem nur die Patienten als Kontrollen eingeschlossen werden, von denen eine klinische Kultur 73 angezüchtet wurde. In der hier vorliegenden Arbeit wurden daher alle Komorbiditäten der Patienten registriert und ausgewertet. Einige der häufigsten Komorbiditäten sind in die multivariaten Analysen integriert worden, um diese zu adjustieren. Dies ist bedeutsam, weil Komorbiditäten auf die Antibiotikaexposition als Confounder wirken können, da sie häufiger mit einer höheren Übertragungswahrscheinlichkeit resistenter Erreger sowie einem häufigeren Einsatz an Antibiotika assoziiert sind. Zur Identifizierung solcher Confounder mit einem Einfluss auf die Antibiotikaexposition wurden multivariate Analysen angefertigt, wodurch dann gezielt diese „confoundingFaktoren“ in die logistische Regression zur Identifizierung einer Antibiotikaexposition als Risikofaktor aufgenommen werden konnten. Der Zeitraum zwischen Aufnahme der Patienten und der Isolierung des Zielkeimes bei den Fällen bzw. der Entlassung des Patienten bei den Kontrollen wurde als Expositionszeitraum festgelegt und als „time at risk“ bezeichnet. Wichtig ist hierbei, dass der Zeitraum nach der ESBLKeimisolierung nicht mit einbezogen wird. Die Länge des Zeitraumes „time at risk“ beeinflusst das Risiko des Antibiotikaeinsatzes, die Übertragungsrate resistenter Keime und ist mit der Schwere der Komorbiditäten assoziiert. Die Bedeutsamkeit der Adjustierung bzgl. Komorbiditäten sowie „time at risk“ wird von Harris et al. in dieser Weise beschrieben [13]. Daher wurde der Zeitraum „time at risk“ in der vorliegenden Arbeit ebenfalls durch Integration in die multivariate Analyse adjustiert. Diese statistischen Besonderheiten sind in ähnlichen Artikeln verschiedener Autoren nicht vollständig umgesetzt worden. Eine Adjustierung nach „time at risk“ durch Integrierung in die multivariaten Berechnungen wurden nur bei Tumbarello et al. [35] beschrieben. Bei den weiteren Studien ist die Anwendung dieses Verfahrens unklar. Es wurde also von vielen publizierten Fall-KontrollStudien nicht das korrekte Studiendesign bezüglich dieser o.g. Faktoren 74 angewandt [2; 5; 8; 10; 19; 27; 29; 30; 34; 35]. Die Adjustierung nach den Komorbiditäten wurde bei dem Großteil der beobachteten Studien durchgeführt. Weiterhin blieb in der vorliegenden Arbeit die FallKontroll-Zuordnung in den wichtigsten statistischen Analysen erhalten, da die Auswahl der Kontrollpatienten nach den o.g. Kriterien sorgfältig erfolgte. Die Bedeutsamkeit zeigt sich durch einen „Bias“ des Odds Ratio in Richtung OR=1, wenn diese Fall-Kontroll-Zuordnung nicht berücksichtigt wird. In Deutschland gab es bisher keine Fall-Kontroll-Studien zu Risikofaktoren einer ESBL-Infektion. Hierbei ist zu berücksichtigen, dass es regional unterschiedlich vorherrschende ESBL-Stämme, unterschiedliche Eigenschaften sowie folglich auch unterschiedliche Risikofaktoren geben kann. Interessant sind hierbei die Verteilung und zeitliche Entwicklung der ESBL-Typen. In einigen älteren Artikeln, die zwischen 1999 und 2005 erarbeitet wurden, wird ausschließlich von den Subtypen SHV und TEM berichtet [6; 10; 37]. In weiteren Artikeln treten aber immer häufiger die CTX-M-Subtypen auf, besonders in neueren Studien zu einem hohen Anteil. Nach Tian et al. liegt der CTXM-Anteil an ESBL-E. coli- Isolaten bei 100 % [34], bei Rodriguez-Bano et al. wird ein Anteil von 70 % [27] sowie in einer späteren Studie von 66,6 % vom CTX-M-Typ angegeben [26]. Nach einer neueren Studie von Diaz et al besteht ein Anteil von 72 % von allen ESBL vom CTX-MTyp [7]. Bei Tumbarello et al. zeigt sich ein CTX-M-Anteil von 52 % an ESBL-E. coli [35] und nach Pena et al. wurde ein Anteil von 54 % festgestellt [23]. Nach Coque et al. breitet sich ESBL-CTX-M-15 mittlerweile in Skandinavien, aber auch in der UK aus. In den östlichen Staaten Europas wurde vermehrt CTX-M-3 gefunden, in Frankreich und Spanien wird häufiger CTX-M-1 und CTX-M-9 gefunden [4]. In Deutschland, Giessen wurde 2009 eine Studie zum Plasmidtransfer bei ESBL-E.coli veröffentlicht, in welcher der CTX-M-Typ über 90 % lag. 75 Dort konnte ein Anteil an CTX-M-15 von 57 % identifiziert werden [20]. Dies zeigt, dass die Prävalenz des CTX-M-Typen auch in Deutschland in den letzten Jahren steil angestiegen ist. In geographischer Hinsicht kommen die CTX-M-Subtypen sehr häufig in spanischen Artikeln vor, wobei es sich dabei allerdings meistens um CTX-M-9 oder CTX-M-14 handelt [23; 27]. Viele Studien, die sich mit den Risikofaktoren beschäftigt haben, führten gar keine molekulargenetische Untersuchung der ESBL-produzierenden Stämme zur Identifizierung der Subtypen durch. Die Anzahl an Fällen differiert in den verschiedenen Artikeln zu den Risikofaktoren zwischen ca. 19 und 133. Die hier vorliegende Arbeit liegt mit einer gesamten Fallanzahl von 120 im Vergleich zu den anderen Studien im oberen Bereich. Dabei wurden 2 ESBL-Spezies untersucht: Klebsiella pneumoniae und E. coli. In den meisten anderen veröffentlichten Studien wurden ebenfalls beide Spezies untersucht. Ausnahmen sind die Studien von Tumbarello et al. [37] sowie von Silva et al. [30], welche nur ESBL-K. pneumoniae sowie Pena et al. [23], Rodriguez-Bano et al. [26; 27], Tian et al. [34], Ena et al. [8] und Tumbarello et al. [35] deren Studien nur ESBL-produzierende E. coli beinhalten. Nur wenige der betrachteten Studien integrierten zusätzlich andere Enterobacteriaceae mit ESBL-Aktivität, wie Schwaber et al. [29], Graffunder et al. [10] sowie Moor et al. [19]. Diese große Übereinstimmung mit den beobachteten Studien macht somit einen Vergleich möglich. Allerdings setzt sich eine geringe Anzahl der Vergleichsstudien aus ambulant erworbenen ESBL-Infektionen zusammen, die meisten jedoch aus nosokomialen Infektionen. In der vorliegenden Arbeit handelt es sich bei dem Großteil der Infektionen um nosokomial erworbene. 76 4.3. Ergebnisse In der vorliegenden Arbeit konnte in der Analyse aller 240 Patienten eine Antibiotikaexposition sowohl in der univariaten als auch in der multivariaten Analyse durch eine konditionale logistische Regression signifikant als Risikofaktor identifiziert werden. Durch das gewählte Studiendesign wurden mögliche Faktoren, die als Bias das Ergebnis verzerren könnten, kontrolliert, sodass die vorhergehende Antibiotikaexposition wirklich einen Risikofaktor darstellt. Ein ähnliches Ergebnis konnte auch bei einigen anderen publizierten Studien wie Pena et al., Tumbarello et al., Rodríguez-Baño et al., Goyal et al., Kuo et al., Azap et al. oder Silva et al. herausgestellt werden [1; 9; 17; 23; 27; 30; 37]. In einigen Studien wurde keine Antibiotikaexposition als Risikofaktor angegeben [5; 26; 34]. In weiteren Studien konnte eine vorhergehende Antibiotikaexposition nur in univariaten Analysen als Risikofaktor identifiziert werden [19; 29], bei anderen nur bestimmete Antibiotikagruppen [2; 8; 10; 14; 15; 18; 31; 32]. In der vorliegenden Arbeit konnte in der Analyse aller 240 Patienten kein Effekt einer bestimmten Antibiotikagruppe nachgewiesen werden. Da die Expositionen gegenüber bestimmter einzelner Antibiotika jedoch nur bei einer geringen Anzahl der Patienten vorlag, könnte dies eine Ursache für diese nicht signifikanten Ergebnisse einzelner Antibiotika darstellen. In einigen Artikeln konnten bestimmte Antibiotikaklassen als Risikofaktoren herausgearbeitet werden. Nach Graffunder et al. wurden die vorherige Anwendung von Aminoglykosiden, Drittgenerationscephalosporinen sowie Cotrimoxazol als signifikante Risikofaktoren eingestuft [10]. In der hier vorliegenden Analyse erwies sich Cotrimoxazol in therapeutischer Anwendung in der Subgruppe der Patienten mit E. coli–Infektionen als signifikanter Risikofaktor sowohl in den univariaten als auch in den multivariaten Auswertungen. Weiterhin ergaben keine anderen Antibiotikaklassen signifikante Ergebnisse. 77 Lediglich in der univariaten Auswertung der Transplantationspatienten zeigte die Anwendung von Ceftriaxon signifikante Ergebnisse, was aber nicht als Risikofaktor gewertet werden kann, da die Patienten, die 'frisch-transplantiert' wurden, zu einem hohen Anteil während der Operation Ceftriaxon erhalten hatten. Dieser Zusammenhang zeigt, dass hier die „frischen“ Transplantationen als „Confounder“ wirken. Ein ähnliches Ergebnis zeigt sich nach Tumbarello et al. beim Auftreten von ESBL-bedingter Sepsis [37]. In Tumbarello´s Studie stellten sich ebenfalls keine bestimmten Antibiotikaklassen als Risikofaktoren heraus, sondern nur der allgemeine Gebrauch an anitbiotischer Therapie [37]. Ena et al. fand in seiner Studie, dass die Anwendung von Fluorchinolonen signifikante Risikofaktoren darstellen. Dabei handelte es sich allerdings bei 62 % der ESBL- Infektionen um ambulant Erworbene [8]. Fluorchinolone konnten in der hier vorliegenden Arbeit weder in den multivariaten noch in den univariaten Berechnungen als signifikante Risikofaktoren identifiziert werden. Vergleichbare Werte zu Ena et al. wurden ebenfalls von Rodriguez-Bano et al. beschrieben. Dort konnte ebenfalls der vorheriger Gebrauch von Fluorchinolonen als auch die vorherige Anwendung von Betalactamen als signifikante Risikofaktoren festgestellt werden [27]. Nach Martinez et al. wurde die vorherige Verwendung von Carbapenemen als Risikofaktoren herausgestellt [18]. Die vorherige Anwendung von 2.-Generationscephalosporinen wurde ebenfalls von Calbo et al. als Risikofaktor angegeben, wobei es sich dort um ESBL- E. coli-Infektionen handelt, die ambulant erworben wurden [2]. Bei Tian et al. handelt es sich ebenso um ambulante Patienten, wobei sich hier nur eine Antibiotikaexposition in den vorherigen 3 Monaten als Risiko für eine Keimübertragung herausstellte [34]. Auch bei Azap et al. handelt es sich um ambulant erworbene ESBL-Infektionen, wobei sich die vorherige Anwendung von Batalaktamantibiotika sowie Prostataerkrankungen als 78 Risikofaktoren herausstellten [1]. In der vorliegenden Arbeit setzt sich der größte Anteil aus nosokomialen Infektionen zusammen. Hier ist somit ein direkter Vergleich der Studienergebnisse nicht eindeutig möglich. In den Subgruppen zeigt sich eine vorherige Antibiotikaexposition in der multivariaten Analyse als Risikofaktor in der Subpopulation des Marienhospitals, in der Subpopulation mit ESBL-E. coli jedoch nur in der univariaten Analyse. Bei Infektionen mit ESBL- K. pneumoniae konnte in der ungepaarten, nicht jedoch in der gepaarten Analyse die Antibiotikaexposition mit einem erhöhten Risiko bestimmt werden. Hierbei ist zu beachten, dass die Auswertung in der Fall-KontrollPaarung unplausible Werte ergab, sodass bei dieser Subgruppe auf diese Auswertungsmethode der Paarung verzichtet werden musste. Es ist somit vorstellbar, dass das Ergebnis der konditionalen logistischen Regression, welches also die Antibiotikaexposition nicht als Risikofaktor identifizieren konnte, auf Grund dieser Ignorierung des „Matching“ entstanden ist. Es kann sich hierbei somit um einen „Bias“ handeln, wodurch das Odds Ratio nach 1 tendiert. In der Subgruppe der Transplantationspatienten ergaben sich für eine Antibiotikaexposition keine signifikanten Werte. Das Resultat, dass es sich bei der Antibiotikaexposition in der Analyse aller 240 Patienten sowie der Subgruppe des Marienhospitals um einen tatsächlichen Risikofaktor handelt, ist bedeutsam. Die Ursache könnte im Selektionsdruck durch Penicilline und Cephalosporine liegen, da ESBL-Keime dagegen eine Resistenz aufweisen. Die Ursache der rapiden Ausbreitung der ESBL-CTX-M-Typen in den letzten Jahren könnte auf einen haufigen Einsatz von Ceftriaxon zurück geführt werden, da der ESBL-CTX-M-Typ stärker gegen Cefotaxim und Ceftriaxon wirkt als ESBLs vom SHV-Typ und TEM-Typ, sodass der 79 CTX-M-Typ selektioniert wurde. Zusätzlich sind ESBL-Keime häufig parallelresistent gegen andere Antibiotikaklassen, da diese Resistenzgene oft auf denselben ESBL-Plasmiden liegen oder durch Ausbreitung der ESBLs als klonal verwandte Stämme mit Resistenzen in den chromosomalen Genen. Diese Coselektion mit anderen Resistenzen, z.B. gegen Fluorchinolone oder Aminoglykoside wurde in anderen Publikationen vermutet [4]. Als weitere Risikofaktoren stellen sich in der multivariaten Analyse aller 240 Patienten Harnwegskatheter, Lebererkrankungen, rezidivierende Harnwegsinfekte sowie chronische Wunden heraus. Allerdings wurde ein Zusammenhang zwischen der Anwendung eines Harnwegskatheters und dem Aufenthalt auf der Intensivstation festgestellt, sodass dieser als „Confounder“ wirken könnte. Die Anwendung von Harnwegskathetern kann somit nicht uneingeschränkt als Risikofaktor beurteilt werden. Hinsichtlich der beiden unterschiedlichen Subgruppen, zum einen aus dem Marienhospital Herne, die sich hauptsächlich aus Patienten der Inneren Medizin zusammen setzt, und zum anderen aus Patienten der Transplantationsstation des Knappschaftskrankenhauses in Bochum, müssen die Ergebnisse entsprechend differentiell betrachtet werden. Aus den multivariaten Berechnungen des Marienhospitals stellten sich chronische Wunden sowie rezivierende Harnwegsinfekte als weitere Risikofaktoren heraus. In der Transplantationsgruppe konnten nur rezidivierende Harnwegsinfektionen sowie Diabetes mellitus als Risikofaktoren identifiziert werden. Dabei ist allerdings zu beachten, dass in dieser Transplantationsgruppe der größte Teil der Patienten an Diabetes mellitus erkrankt war und gerade deshalb eine Nierentransplantation erforderlich wurde. Daher ist der Stellenwert des Diabetes mellitus als Risikofaktor einer ESBL-Infektion in Frage zu stellen. Bei der differenzierten Betrachtung der Subgruppen nach Infektionen mit ESBL-E. coli-Infektionen ergaben sich in der 80 multivariaten Analyse Harnwegskatheter, Lungenerkrankungen, chronische Wunden, die Anwendung von Cotrimaxazol und rezidivierende Harnwegsinfekte als signifikante Risikofaktoren. In anderen publizierten Studien wurden diese Risikofaktoren nur selten angegeben. Nach Ena et al. und Goyal et al. stellen ebenso Harnwegskatheter ein erhöhtes Risiko einer ESBL-Infektion dar [8; 9]. In weiteren Studien wurden andere Faktoren als Risikofaktoren angeführt. Kuo et al. berichtet von einem langen Krankenhausaufenthalt, vorhergehende Operationen, Beatmung und nasogastrale Sonden, die sich als Risikofaktoren herausstellten [17]. Pena et al. konnte ebenfalls nasogastrale Sonden sowie das weibliche Geschlecht als Risikofaktoren identifizieren [23]. In der vorliegenden Arbeit wurden nasogastrale Sonden nicht gesondert evaluiert und ausgewertet, weiterhin ergaben sich keine Hinweise auf ein signifikantes Überwiegen des männlichen oder weiblichen Geschlechtes, sodass dies nicht als Risikofaktor bestätigt werden kann. Silva et al. gibt ebenso neben einer vorherigen Antibiotikaexposition Diabetes mellitus und maligne Erkrankungen als potentielle Risikofaktoren an [30]. In der hier vorliegenden Arbeit wurde der Diabetes mellitus nur in der Transplantationsgruppe als Risikofaktor erkannt, maligne Erkrankungen konnten in keiner Subgruppe als solcher identifiziert werden. Nach Skippen konnte ein vorheriger Krankenhausaufenthalt von mehr als 15 Tagen sowie ein vorheriger Aufenthalt auf einer Intensivstation als signifikante Risikofaktoren erkannt werden [31]. Die letzten beiden Variabeln wurden in der vorliegenden Arbeit nicht als Risikofaktoren identifiziert. Hierbei ist zu berücksichtigen, dass bei Skippen et al. die Kontollgruppenauswahl nach einer Infektion mit dem sensiblen Zielkeim erfolgte und somit der Expositionszeitraum „time at risk“ anders definiert wurde als in der vorliegenden Arbeit. Ähnliche Ergebnisse zeigten sich bei Schwaber et al., in dessen Studie sich ebenfalls die Länge des 81 Krankenhausaufenthaltes als Risikofaktor herausstellte. Dabei wurde ebenfalls keine Adjustierung nach „time at risk“ vorgenommen sowie mit einer Kontrollgruppe des sensiblen Keimes gearbeitet [29]. Weiterhin konnte bei Khanfar et al. das Alter über 60 Jahre als Risikofaktor identifziert werden [16]. Ähnliche Ergebnisse zeigten sich in der vorliegenden Arbeit ebenfalls, allerdings ergaben sich diese nur bei der univariaten Analyse in zwei der 4 Subgruppen bei einem Alter über 50 Jahre. Bei Tumbarello et al. wurden ebenfalls das Alter der Patienten als auch die Krankenhausaufenthaltsdauer als Risikofaktoren beschrieben, wobei dies nach „time at risk“ berechnet wurde [37]. Ferner gab er renale Transplantationen, ernste Komorbiditäten als auch eine ehemalige Infektion mit ESBL- produzierenden Organismen als erhöhtes Risiko einer ESBL- Infektion an [18]. In der hier vorliegenden Arbeit zeigten sich ebenfalls in den Subgruppen einige Komorbiditäten mit einem erhöhten Risiko. Die weiteren Risikofaktoren nach Martinez et al. konnten in der hier vorliegenden Arbeit nicht bestätigt werden. Bei Moor et al. wurden nur ambulant erworbene Infektionen in die Studie einbezogen [19]. Dort ergaben nur das Leben in einem Altenpflegeheim sowie COPD ein erhöhtes Risiko zum Erwerb einer ESBL-Infektion. Die Ursache der in der hier vorliegenden Arbeit gefundenen weiteren Risikofaktoren könnte damit erklärt werden, dass das Übertragungsrisiko eines ESBL-Keimes durch diese Risikofaktoren ansteigt, wie z.B. durch häufige oder längere Verweildauer eines Harnwegskatheters oder ähnlichen Manipulationen am Patienten. Rezidivierende Harnwegsinfekte, chronische Wunden und Komorbiditäten führen dazu, dass ein Patient häufiger Arztpraxen oder Krankenhäuser aufsucht und somit ein erhöhtes Risiko der Übertragung resistenter Keime entsteht. Hiermit assoziiert ist folglich auch die Antibiotikaexposition, die bei diesen Faktoren häufiger erhöht ist. 82 4.4. Konsequenzen Aus den Ergebnissen zeigt sich, dass eine Antibiotikaexposition einen Risikofaktor darstellt. Demzufolge ist eine Antibiotikarestriktion in Kombination mit Hygienemaßnahmen zur Prävention einer Infektion mit ESBL als eine sinnvolle Strategie anzusehen. Dieses Ziel stellt sich allerdings mit der Problematik dar, dass bei einigen schweren Erkrankungen wie z.B. einer Sepsis eine frühe kalkulierte Therapie mit breit wirksamen Antibiotika nötig ist, um die Letalität zu senken, wodurch eine Antibiotikarestriktion schwierig durchzuführen ist. Um dies zu vermeiden, sollte die Antibiotikatherapie nach Leitlinien erfolgen, die Therapieindikation im Verlauf weiterhin überprüft und die Therapiedauer so kurz wie möglich gehalten werden. Eine De-Eskalation nach erstelltem Antibiogramm erscheint daher im Rahmen einer verantwortungsvollen Anwendung von Antibiotika sinnvoll. 83 5. Zusammenfassung 5.1. Allgemeines zu ESBL Seit einigen Jahren nehmen Enterobacteriaceae, die eine Aktivität mit Extended-spectrum-betalactamasen (ESBL) aufweisen, im Raum Bochum zu. Diese zeigen eine Resistenz gegen die meisten Betalaktam-Antibiotika wie Penicilline, Cephalosporine und Monobactame, nicht jedoch gegen Carbapeneme und Cephamycine und werden durch Betalaktamaseinhibitoren wie Clavulansäure inhibiert. Die Inzidenz an Infektionen mit ESBL-produzierenden Bakterien ist weltweit steigend [15], mittlerweile besonders in den osteuropäischen Ländern sowie in Asien und Südamerika. Ausbrüche von Infektionen mit ESBL-Organismen sind mittlerweile von jedem europäischen Land berichtet worden [22]. Potentielles Reservoir sind oft Kliniken und Pflegeeinrichtungen. Es sind weltweit viele verschiedene Risikofaktoren für den Erwerb einer Infektion mit ESBLproduzierenden Bakterien identifiziert worden. Die Therapieoptionen einer ESBL-Infektion sind stark eingeschränkt, da ESBL-produzierende Bakterien oft auch zusätzlich Resistenzen gegen andere Antibiotikaklassen aufweisen. Als Therapie der Wahl werden hauptsächlich Carbapeneme eingesetzt. Die Wahrscheinlichkeit, dass Oxyminobetalactame bei ernsten Erkrankungen nicht ansprechen, ist hoch, auch wenn die Isolate auf die Antibiotika in vitro empfindlich reagieren [21]. Ziel dieser Arbeit war es, Risikofaktoren zu identifizieren, die zum Erwerb einer Infektion mit ESBL-produzierenden E. coli oder K. pneumoniae führen. Die hier vorliegende Arbeit wurde sorgfältig konzipiert, sodass häufige Fehler eliminiert werden konnten. Es erfolgte somit die optimale Kontrollgruppenauswahl nicht nach der sensiblen Variante der ESBL-Spezies, sondern nach Patienten, bei denen keine ESBL-Keime isoliert werden konnten, die auf derselben Station wie der Fallpatient lagen. Weiterhin wurde der Zeitraum „time at risk“ und 84 Komorbiditäten in die multivariaten Analysen, die unter Erhalt der FallKontroll-Paarung durchgefürht wurden, zur Identifizierung von Confoundern integriert. Es wurden die Daten der Patienten aus dem Marienhospital Herne und der Transplantationsstation sowie der Transplantatambulanz des Knappschaftskrankenhauses Bochum herangezogen. Das Ergebnis zeigt, dass eine vorherige Antibiotikaexposition mit einem Odds Ratio von 9,14 [95 %-KI 1,59 - 52,43] als signifikanter Risikofaktor einer ESBL-Infektion in der multivariaten Analyse identifiziert werden konnte. Weiterhin stellen sich Harnwegskatheter (Odds Ratio 2,807 [95%-KI 1,235 - 6,381]), rezidivierende Harnwegsinfekte (Odds Ratio 4,043 [95% KI-1,870 - 8,739]), Lebererkrankungen (Odds Ratio 3,188 [95% KI 1,141 - 8,902]) und chronischen Wunden (Odds Ratio 2,981 [95%-KI 1,238 - 7,177]) als potentielle Risikofaktoren in einer multivariaten Analyse dar. Die Ursache liegt hierbei wahrscheinlich im Selektionsdruck durch Cephalosporine, Penicilline und andere Antibiotikaklassen bei häufiger Parallelresistenz. Die weiteren Risikofaktoren können durch eine höhere Wahrscheinlichkeit einer ESBL-Übertragung erklärt werden. Als Konsequenz dieser Ergebnisse leitet sich neben der Empfehlung der Vermeidung einer Übertragung durch präventive Hygienemaßnahmen die Empfehlung zur Antibiotikarestriktion und einem rationalen Einsatz von Antibiotika ab. 85 6. Literaturverzeichnis [1] Azap, O. K., Arslan, H., Serefhanoglu, K., Colakoglu, S., Erdogan, H., Timurkaynak, F., Senger, S. S. (2010). Risk factors for extended-spectrum beta-lactamase positivity in uropathogenic Escherichia coli isolated from community-acquired urinary tract infections. Clinical microbiology and infection 16, 147 [2] Calbo, E., Romaní, V., Xercavins, M., Gómez, L., Vidal, C. G., Quintana, S., Vila, J, Garau, J. (2006). Risk factors for communityonset urinary tract infections due to Escherichia coli harbouring extended-spectrum beta-lactamases. The Journal of antimicrobial chemotherapy 57, 780 [3] Cantón, R., Coque, T. M. (2006). The CTX-M beta-lactamase pandemic. Current opinion in microbiology 9, 466 [4] Coque, T. M., Baquero, F., Canton, R. (2008). Increasing prevalence of ESBL-producing Enterobacteriaceae in Europe. Euro surveillance 13 (47), 1-11 [5] Cordery, R. J., Roberts, C. H., Cooper, S. J., Bellinghan, G., Shetty, N. (2008). Evaluation of risk factors for the acquisition of bloodstream infections with extended-spectrum beta-lactamaseproducing Escherichia coli and Klebsiella species in the intensive care unit; antibiotic management and clinical outcome. The Journal of hospital infection 68, 108 [6] Crivaro, V., Bagattini, M., Salza, M. F., Raimondi, F., Rossano, F., Triassi, M., Zarrilli, R. (2007). Risk factors for extended-spectrum beta-lactamase-producing Serratia marcescens and Klebsiella pneumoniae acquisition in a neonatal intensive care unit. The Journal of hospital infection 67, 135 86 [7] Díaz, M. A., Hernández-Bello, JR, Rodríguez-Baño, J., MartínezMartínez, L., Calvo, J., Blanco, J., Pascual, A. (2010). The Diversity of Escherichia coli Producing Extended-Spectrum sslactamases in Spain: Second Nationwide Study. Journal of clinical microbiology 10,1128 [8] Ena, J., Arjona, F., Martínez-Peinado, C., López-Perezagua, M. M., Amador, C (2006). Epidemiology of urinary tract infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Urology 68, 1169 [9] Goyal, A., Prasad, K. N., Prasad, A., Gupta, S., Ghoshal, U., Ayyagari, A. (2009). Extended spectrum beta-lactamases in Escherichia coli & Klebsiella pneumoniae & associated risk factors. The Indian journal of medical research 129, 695 [10] Graffunder, E. M., Preston, K. E., Am Evans, Venezia, R. A. (2005). Risk factors associated with extended-spectrum betalactamase- producing organisms at a tertiary care hospital. The Journal of antimicrobial chemotherapy 56, 139 [11] Gupta, V. (2007). An update on newer beta-lactamases. The Indian journal of medical research 126, 417 [12] Harris, A. D., Carmeli, Y., Samore, M. H., Kaye, K. S., Perencevich, E. (2005). Impact of severity of illness bias and control group misclassification bias in case-control studies of antimicrobial- resistant organisms. Infection control and hospital epidemiology 26, 342 [13] Harris, A. D., Karchmer, T. B., Carmeli, Y., Samore, M. H. (2001). Methodological principles of case-control studies that analyzed risk factors for antibiotic resistance: a systematic review. Clinical infectious diseases 32, 1055 87 [14] Harris, A. D., McGregor, J. C., Johnson, J. A., Strauss, S. M., Moore, A. C., Standiford, HC, Hebden, J. N., Morris, J. G., JR (2007). Risk factors for colonization with extended-spectrum betalactamase- producing bacteria and intensive care unit admission. Emerging infectious diseases 13, 1144 [15] Huang, Y., Zhuang, S., Du, M. (2007). Risk factors of nosocomial infection with extended-spectrum beta-lactamase-producing bacteria in a neonatal intensive care unit in China. Infection 35, 339 [16] Khanfar, H. S., Bindayna, K. M., Senok, A. C., Botta, G. A. (2009). Extended spectrum beta-lactamases (ESBL) in Escherichia coli and Klebsiella pneumoniae: trends in the hospital and community settings. Journal of infection in developing countries 3, 295 [17] Kuo, K. C., Shen, Y. H., Hwang, K. P. (2007). Clinical implications and risk factors of extended-spectrum beta- lactamase-producing Klebsiella pneumoniae infection in children: a case-control retrospective study in a medical center in southern Taiwan. Journal of microbiology, immunology, and infection 40, 248 [18] Martínez, J. A., Aguilar, J., Almela, M., Marco, F., Soriano, A., López, F., Balasso, V., Pozo, L., Mensa, J. (2006). Prior use of carbapenems may be a significant risk factor for extendedspectrum beta-lactamase-producing Escherichia coli or Klebsiella spp. in patients with bacteraemia. The Journal of antimicrobial chemotherapy 58, 1082 88 [19] Moor, C. T., Roberts, S. A., Simmons, G., Briggs, S., Morris, A. J., Smith, J., Heffernan, H. (2008). Extended-spectrum betalactamase (ESBL)-producing enterobacteria: factors associated with infection in the community setting, Auckland, New Zealand. The Journal of hospital infection 68, 355 [20] Mshana, S. E., Imirzalioglu, C., Hossain, H., Hain, T., Domann, E., Chakraborty, T (2009). Conjugative IncFI plasmids carrying CTXM-15 among Escherichia coli ESBL producing isolates at a University hospital in Germany. BMC infectious diseases 9, 97 [21] Munoz-Price, S. M. D., Jacoby, G. A. M. D., Snydman, D. R. M. D. (2007). (Zugriff vom 21.02.2008). Official reprint from UpToDate® www.uptodate.com, Extended-spectrum beta-lactamases. http://www.utdol.com/utd/content/topic.do?topicKey=antibiot/1188 3&view=print [22] Paterson, D. L., Bonomo, R. A. (2005). Extended-spectrum betalactamases: a clinical update. Clinical microbiology reviews 18, 657 [23] Peña, C., Gudiol, C., Tubau, F., Saballs, M., Pujol, M., Dominguez, M. A., Calatayud, L., Ariza, J., Gudiol, F. (2006). Risk-factors for acquisition of extended-spectrum beta-lactamaseproducing Escherichia coli among hospitalised patients. Clinical microbiology and infection 12, 279 [24] Perez, F., Endimiani, A., Hujer, K. M., Bonomo, R. A. (2007). The continuing challenge of ESBLs. Current opinion in pharmacology 7, 459 [25] Pitout, J. D., Laupland, K. B. (2008). Extended-spectrum betalactamase-producing Enterobacteriaceae: an emerging publichealth concern. The Lancet infectious diseases 8, 159 89 [26] Rodríguez-Baño, J., López-Cerero, L., Navarro, M. D., Díaz de Alba P, Pascual, A. (2008). Faecal carriage of extended-spectrum beta-lactamase-producing Escherichia coli: prevalence, risk factors and molecular epidemiology. The Journal of antimicrobial chemotherapy 62, 1142 [27] Rodríguez-Baño, J., Navarro, M. D., Romero, L., Muniain, M. A., Cueto, M., Gálvez, J, Perea, E. J., Pascual, A. (2008). Riskfactors for emerging bloodstream infections caused by extendedspectrum beta-lactamase-producing Escherichia coli. Clinical microbiology and infection 14, 180 [28] Schwaber, M. J., Carmeli, Y. (2007). Mortality and delay in effective therapy associated with extended- spectrum betalactamase production in Enterobacteriaceae bacteraemia: a systematic review and meta-analysis. The Journal of antimicrobial chemotherapy 60, 913 [29] Schwaber, M. J., Navon-Venezia, S., Kaye, K. S., Ben-Ami, R., Schwartz, D., Carmeli, Y. (2006). Clinical and economic impact of bacteremia with extended- spectrum- beta-lactamase-producing Enterobacteriaceae. Antimicrobial agents and chemotherapy 50, 1257 [30] Silva, N., Oliveira, M., Bandeira, A. C., Brites, C. (2006). Risk factors for infection by extended-spectrum beta-lactamase producing Klebsiella pneumoniae in a tertiary hospital in Salvador, Brazil. The Brazilian journal of infectious diseases 10, 191 90 [31] Skippen, I., Shemko, M., Turton, J., Kaufmann, M. E., Palmer, C., Shetty, N. (2006). Epidemiology of infections caused by extendedspectrum beta- lactamase-producing Escherichia coli and Klebsiella spp.: a nested case-control study from a tertiary hospital in London. The Journal of hospital infection 64, 115 [32] Superti, S. V., Augusti, G., Zavascki, A. P. (2009). Risk factors for and mortality of extended-spectrum-beta-lactamase- producing Klebsiella pneumoniae and Escherichia coli nosocomial bloodstream infections. Revista do Instituto de Medicina Tropical de São Paulo 51, 211 [33] Theuretzbacher, U. (2004). Beta-Lactamasen und BetaLactamase-Inhibitoren. Neue Erkenntnisse. Chemotherapie Journal 13, 206-217 [34] Tian, S. F., Chen, B. Y., Chu, Y. Z., Wang, S. (2008). Prevalence of rectal carriage of extended-spectrum beta-lactamaseproducing Escherichia coli among elderly people in community settings in China. Canadian journal of microbiology 54, 781 [35] Tumbarello, M. (2008). Bloodstream infections caused by extended-spectrum-beta-lactamase- producing Escherichia coli: risk factors for inadequate initial antimicrobial therapy. Antimicrobial agents and chemotherapy 52, 3244 [36] Tumbarello, M., Sanguinetti, M., Montuori, E., Trecarichi, E. M., Posteraro, B., Fiori, B., Citton, R., D'Inzeo, T., Fadda, G., Cauda, R., Spanu, T. (2007). Predictors of mortality in patients with bloodstream infections caused by extended-spectrum-betalactamase-producing Enterobacteriaceae: importance of inadequate initial antimicrobial treatment. Antimicrobial agents and chemotherapy 51, 1987 91 [37] Tumbarello, M., Spanu, T., Sanguinetti, M., Citton, R., Montuori, E., Leone, F., Fadda, G., Cauda, R. (2006). Bloodstream infections caused by extended-spectrum-beta-lactamaseproducing Klebsiella pneumoniae: risk factors, molecular epidemiology, and clinical outcome. Antimicrobial agents and chemotherapy 50, 498 92 Danksagung An dieser Stelle möchte ich allen danken, die mir mein Studium und die Vollendung meiner Promotion ermöglichten: Herrn Prof. Dr. med. Gatermann danke ich für die Möglichkeit, in seinem Arbeitskreis meine Promotionsarbeit anfertigen zu dürfen. Mein besonderer Dank gilt Herrn Dr. Kaase und Frau Dr. Schieren, die mich bei der Konzeption und Durchführung der Arbeit sowie der Erstellung der Dissertationsschrift betreuten und mir in allen fachlichen Fragen stets zur Seite standen. Für die Bereitstellung aller zur Durchführung meiner Promotion erforderlichen Daten und materiellen Voraussetzungen danke ich der Direktion des Universitätsklinikums Marienhospital Herne, des Universitätsklinikums Knappschaftskrankenhaus Bochum sowie der Abteilung für Medizinische Mikrobiologie des Institutes für Hygiene und Mikrobiologie der Ruhr-Universität Bochum. Bedanken möchte ich mich darüber hinaus auch bei den Mitarbeitern des Krankenhausarchivs für ihre unkomplizierte Hilfe bei fachlichen und organisatorischen Problemen. Ganz besonders danke ich natürlich meinen Eltern und Großeltern, die mir das Studium erst ermöglichten und mich jederzeit unterstützten, sowie meiner Familie und meinem Freund, die meiner Arbeit viel Verständnis und Geduld entgegenbrachten. Lebenslauf Tjorven Katharina Förster Persönliche Daten: Geburtsdatum: Geburtsort: Familienstand: Staatsangehörigkeit: Eltern: 21.08.1980 Bochum ledig deutsch Paul-Rüdiger und Ute Förster Schulausbildung: 1987 – 1991 Gemeinschaftsgrundschule, Haydnstr.1-3, in 44805 Bochum 1991 – 2000 Heinrich-von Kleist-Gymnasium, Heinrichstr., in 44805 Bochum; Schulabschluss mit dem Abitur Berufsausbildung: 2000 – 2003 Berufsausbildung zur Medizinisch-technischen Laboratoriumsassistentin an der staatlich anerkannten Lehranstalt für Technische Assistenten in der Medizin an den Berufsgenossenschaftlichen Kliniken Bergmannsheil in Bochum; Abschluss der Berufsausbildung durch das Staatsexamen Hochschulausbildung: 10/2003 Beginn des Studiums der Humanmedizin an der Ruhr-Universität-Bochum 09/2005 Abschluss des 1. Staatsexamens 10/2005 Beginn des klinischen Studienabschnittes an der Ruhr-UniversitätBochum Famulaturen: 03/2006 09/2006 03/2007 09/2007 Praktisches Jahr: 08/2008 11/2009 01/2010 Famulatur im St. Josef-Hospital in Bochum in der Inneren Medizin Famulatur in der Praxis für Allgemeinmedizin, Frau Dr. Lorenz Famulatur im St. Josef-Hospital in Bochum in der Chirurgischen Klinik Famulatur im Flinders Medical Centre in Adelaide, Australien, Orthopädische Chirurgie Marienhospital Herne, Universitätsklinik der RuhrUniversität Bochum; Chirurgie, Innere Medizin und Anästhesie Abschluss des Studiums der Humanmedizin mit dem 2. Staatsexamen Assistenzärztin in der Medizinischen Klinik III des Marienhospitals Herne, Universitätsklinik der Ruhr-Universität Bochum