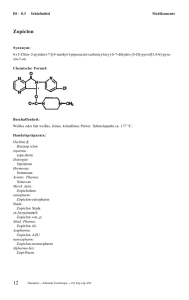
Imovane®: Zopiclon – Dosierung, Wirkung & Nebenwirkungen
Werbung

Fachinformation des Arzneimittel-Kompendium der Schweiz® Imovane® Sanofi-Aventis (Suisse) SA AMZV Zusammensetzung Wirkstoff: Zopiclonum. Hilfsstoffe Tablettenkern: Lactosum monohydricum, Calcii hydrogenophosphas dihydricus, Triciti amylum, Carboxymethylamylum natricum A, Magnesii stearas. Tablettenüberzug: Hydroxypropylmethylcellulosum, Titanii dioxidum, Macrogolum 6000. Galenische Form und Wirkstoffmenge pro Einheit Tabletten zu 7,5 mg (teilbare Filmtabletten). Indikationen/Anwendungsmöglichkeiten Imovane wird für die Kurzzeitbehandlung (in der Regel weniger als 10 Tage) von Schlafstörungen verwendet. Wie alle Hypnotika soll es nur bei Schlafstörungen von klinisch signifikantem Schweregrad eingesetzt werden. Dosierung/Anwendung Imovane muss als Einmalgabe verabreicht werden. In derselben Nacht darf keine erneute Verabreichung erfolgen. Imovane ist unmittelbar vor dem Schlafengehen einzunehmen. Die Dosierung muss dem Patienten individuell angepasst werden. Zur Vermeidung dosisabhängiger Nebenwirkungen wird jeweils die niedrigstwirksame Dosis verabreicht. Die maximal empfohlenen Dosierungen dürfen nicht überschritten werden. Imovane dient zur Kurzzeittherapie von Schlafstörungen (in der Regel nicht länger als 10 Tage). Wenn dennoch eine längere Behandlung erwogen wird, muss der weitere Bedarf erneut sorgfältig abgeklärt und dann periodisch überprüft werden. Die Behandlungsdauer einschliesslich der Ausschleichphase sollte 4 Wochen nicht überdauern. Anwendung bei Erwachsenen Die Dosierung beträgt 1 Tablette Imovane (7,5 mg) unmittelbar vor dem Schlafengehen. Diese Dosis soll nicht überschritten werden. Ältere Patienten Bei älteren und im Allgemeinzustand reduzierten Patienten, die nicht mit Schlafmitteln vorbehandelt sind, soll die Behandlung mit ½ Tablette Imovane (3,75 mg) begonnen werden. Bei Bedarf kann auf 1 Tablette (7,5 mg) erhöht werden. Kinder und Jugendliche Über die Sicherheit und Wirksamkeit von Imovane bei Patienten unter 18 Jahren liegen keine ausreichenden Daten vor. Imovane soll deshalb bei Kindern und Jugendlichen unter 18 Jahren nicht verabreicht werden. Patienten mit eingeschränkter Leberfunktion Bei schwerer Leberfunktionsstörung ist Imovane kontraindiziert. Es liegen keine pharmakodynamischen Studien und keine klinischen Erfahrungen bei Patienten mit eingeschränkter Leberfunktion vor. Die Dosierung soll vorsichtig mit ½ Tablette erfolgen. Patienten mit eingeschränkter Nierenfunktion Bisher wurde bei Patienten mit eingeschränkter Nierenfunktion keine Akkumulierung des Wirkstoffes im Organismus festgestellt, dennoch wird empfohlen, bei dieser Patientengruppe die Behandlung ebenfalls mit ½ Tablette Imovane täglich (entsprechend 3,75 mg Zopiclon) zu beginnen. Patienten mit chronischer Ateminsuffizienz Bei Patienten mit chronischer Ateminsuffizienz wird empfohlen, die Behandlung mit ½ Tablette Imovane (3,75 mg) zu beginnen. Patienten mit schwerer Ateminsuffizienz dürfen nicht mit Imovane behandelt werden (siehe «Kontraindikationen»). Kontraindikationen Imovane ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Zopiclon oder einen der Hilfsstoffe in der Zusammensetzung des Arzneimittels sowie bei schwerer Leberinsuffizienz, schwerer respiratorischer Insuffizienz, Myasthenia gravis, bei schwerem Schlafapnoe-Syndrom und bei Patienten mit vorbestehenden schweren psychiatrischen Erkrankungen. Warnhinweise und Vorsichtsmassnahmen Bei Patienten mit eingeschränkter Leberfunktion, bei älteren Patienten und bei Patienten mit chronisch-obstruktiven Lungenerkrankungen ist die Verordnung von Imovane sorgfältig abzuwägen und die Dosis zu reduzieren. Aufgrund einer möglichen Atemdepression durch Hypnotika ist Imovane bei Patienten mit eingeschränkter Atemfunktion mit Vorsicht zu verabreichen. Über die Sicherheit und Wirksamkeit von Imovane bei Patienten unter 18 Jahren liegen keine ausreichenden Daten vor. Imovane soll deshalb bei Kindern und Jugendlichen unter 18 Jahren nicht verabreicht werden. Grundsätzlich soll auf den gleichzeitigen Genuss von Alkohol verzichtet werden. Bei Patienten mit Suchtgefährdung, insbesondere bei vorbestehender Medikamenten-, Drogen- oder Alkoholabhängigkeit, besteht oft auch die Gefahr des Hypnotikamissbrauchs. Psychomotorische Störungen Wie andere Hypnotika/Sedativa hat Zopiclon eine dämpfende Wirkung auf das Zentralnervensystem (ZNS). Das Risiko psychomotorischer Störungen, einschliesslich der Beeinträchtigung der Verkehrstüchtigkeit, ist erhöht, wenn: Zopiclon weniger als 12 Stunden vor der Durchführung von Aktivitäten, die die volle Reaktionsfähigkeit erfordern, eingenommen wird, eine höhere als die empfohlene Dosis eingenommen wird oder Zopiclon zusammen mit anderen zentral dämpfenden Arzneimitteln, Alkohol oder anderen Arzneimitteln, die die Blutspiegel von Zopiclon erhöhen, eingenommen wird (siehe «Kontraindikationen»). Die Patienten müssen darauf hingewiesen werden, dass nach der Einnahme von Zopiclon und insbesondere während der ersten 12 Stunden nach der Einnahme des Arzneimittels Situationen, die ein gutes Reaktionsvermögen und eine gute motorische Koordination erfordern, zum Beispiel das Bedienen von Maschinen oder das Führen motorisierter Fahrzeuge, riskant sind. Risiken bei gleichzeitiger Anwendung von Opioiden und Benzodiazepinen Die gleichzeitige Anwendung von Benzodiazepinen, einschliesslich Zopiclon und Opioiden kann zu Sedierung, Atemnot, Koma und Tod führen. Aufgrund dieser Risiken ist die gleichzeitige Verschreibung von Benzodiazepinen und Opioiden auf Patienten zu beschränken, für die keine geeigneten anderen therapeutischen Alternativen zur Verfügung stehen. Bei einer gleichzeitigen Verordnung von Zopiclon und Opioiden sind die niedrigsten wirksamen Dosen zu verwenden, und die Behandlungsdauer ist so kurz wie möglich zu wählen. Ferner sind die Patienten engmaschig zu überwachen, damit jedes Anzeichen oder Symptom einer Atemnot oder Sedierung erkannt wird. Abhängigkeit Obwohl Zopiclon chemisch nicht mit den Benzodiazepinen verwandt ist, entfaltet es seine Wirkung über eine Interaktion mit dem gleichen GABAA-RezeptorKomplex. Deshalb sind bis zum Vorliegen weiterer Erfahrungen mit Imovane im Hinblick auf ein mögliches Abhängigkeitspotential folgende Vorsichtsmassnahmen zu beachten: Die Einnahme von Sedativa/Hypnotika wie Zopiclon kann zu physischer und psychologischer Abhängigkeit oder zu Missbrauch führen. Dieses Risiko ist erhöht bei längerer Einnahme, hoher Dosierung und bei Patienten mit Anamnese Alkohol- oder Drogen-Abhängigkeit und bei Kombination mit Alkohol oder anderen Psychopharmaka. Wenn eine Abhängigkeit entstanden ist, geht das plötzliche Absetzen der Behandlung mit Entzugssymptomen einher. Diese variieren und können sich z.B. äussern in Schlafstörungen («rebound insomnia»), Angst, Tremor, Schwitzen, Ruhelosigkeit, Konfusion, Kopfschmerzen, Herzklopfen, Tachykardie, Delirium, Alpträume, Halluzinationen und Reizbarkeit. In seltenen Fällen können zerebrale Krampfanfälle auftreten. Um das Risiko von Entzugserscheinungen zu reduzieren, wird empfohlen Imovane ausschleichend abzusetzen. Bei Auftreten von Entzugserscheinungen ist eine engmaschige ärztliche Überwachung und Unterstützung des Patienten erforderlich. Um das Risiko einer Abhängigkeit auf ein Minimum zu reduzieren, sollten Benzodiazepine und ähnliche Wirkstoffe nur nach sorgfältiger Prüfung der Indikation verschrieben und über möglichst kurze Dauer (das Hypnotikum Zopiclon zum Beispiel in der Regel nicht länger als 10 Tage) eingenommen werden. Ob eine Seite 1 Fachinformation des Arzneimittel-Kompendium der Schweiz® Weiterführung der Behandlung notwendig ist, muss periodisch überprüft werden. Rebound-Schlaflosigkeit Beim Absetzen der Therapie können die Schlafstörungen für einige Nächte wieder auftreten («rebound-insomnia»), was sich durch ausschleichendes Absetzen reduzieren lässt. Es wird empfohlen, den Patienten/die Patientin darüber zu informieren. Amnesie Eine anterograde Amnesie kann insbesondere dann auftreten wenn der Schlaf unterbrochen wird oder das Schlafengehen nach der Tabletteneinnahme verspätet wird. Um das Risiko einer anterograden Amnesie zu beschränken, sollten die Patienten sicherstellen, dass sie ihre Tablette genau vor dem Schlafengehen einnehmen und die Möglichkeit haben, die ganze Nacht durchzuschlafen. Sonstige paradoxe und psychiatrische Reaktionen Sonstige paradoxe und psychiatrische Reaktionen wurden berichtet wie Rastlosigkeit, Unruhe, Verwirrung, Reizbarkeit, Aggressivität, Zorn, Alpträume, Halluzinationen, Psychosen, unangemessenes Verhalten und sonstige im Zusammenhang mit dem Gebrauch von Sedativa und Hypnotika wie Zopiclon bekannte Verhaltensstörungen. In solchen Fällen muss Imovane abgesetzt werden. Bei älteren Personen treten Reaktionen dieser Art häufiger auf. Somnambulismus und damit verbundene Verhaltensweisen Schlafwandeln und damit assoziierte Verhaltensweisen wurden von Patienten berichtet, die Zopiclone (Imovane) oder mit diesem Präparat verwandte Schlafmittel eingenommen hatten und nicht vollständig wach waren. Dazu zählten unter anderem Auto fahren im Schlaf, Zubereiten und Verzehren von Mahlzeiten, Telefonieren, Geschlechtsverkehr, ohne dass sich die Betroffenen später daran erinnern konnten (Amnesie). Es wurden auch Einzelfälle von selbstverletzendem Verhalten in diesem Zusammenhang berichtet. Alkohol und andere zentral dämpfende bzw. zentral wirksame Substanzen scheinen das Risiko für solches Verhalten im Zusammenwirken mit Zopiclone (Imovane) zu erhöhen. Gleiches gilt für die Anwendung von Imovane in Dosierungen, die über der empfohlenen Maximaldosis liegen. Bei Patienten, die solche Reaktionen berichten, sollte Imovane abgesetzt werden. Depression und Suizidneigung Imovane, wie andere Hypnotika, ist keine Behandlung der Depression und kann sogar die Symptome maskieren. Erhöhte Vorsicht ist bei der Verschreibung von Imovane an Patienten geboten, die Symptome einer Depression aufweisen, welche durch Hypnotika verstärkt werden können. Mehrere epidemiologische Untersuchungen haben sowohl bei depressiven als auch bei nicht depressiven Patienten, die mit Benzodiazepinen und anderen Hypnotika (einschliesslich Zopiclon) behandelt wurden, eine höhere Suizidrate bzw. Suizidversuchsrate gezeigt. Ein kausaler Zusammenhang wurde nicht nachgewiesen. Interaktionen Die zentraldämpfende Wirkung von Imovane wird verstärkt durch gleichzeitige Verabreichung von andern zentral dämpfenden Wirkstoffen wie z.B. Analgetika, Antidepressiva, Neuroleptika (z.B. Chlorpromazin), Hypnotika, Anxiolytika/Sedativa, Antiepileptika, Anästhetika, sedierende H1-Antihistaminika sowie Alkohol. Da keine entsprechenden Interaktionsstudien vorliegen, soll Imovane (Zopiclon) nicht zusammen mit diesen Wirkstoffen verabreicht werden. Bei gleichzeitiger Einnahme von narkotisierenden Analgetika kann es zu einer Potenzierung der euphorisierenden Wirkung kommen und die psychische Abhängigkeit verstärkt werden. Wird Zopiclon mit Erythromycin verabreicht, so ist die Plasmakonzentration von Zopiclon erhöht (Zunahme der AUC um 80%). In der Folge kann die hypnotische Wirkung von Imovane verstärkt sein. Da Zopiclon durch das Isoenzym CYP3A4 metabolisiert wird (siehe «Pharmakokinetik»), können die Plasmaspiegel von Zopiclon erhöht sein, wenn gleichzeitig CYP3A4-Inhibitoren verabreicht werden, wie z.B. Erythromycin, Valproinsäure, Cimetidin, Amiodaron, Verapamil, Ciclosporin, Clarithromycin, Ketoconazol, Itraconazol und Ritonavir. Eine Dosisreduktion von Imovane kann erforderlich sein, wenn gleichzeitig CYP3A4-Inhibitoren gegeben werden. Umgekehrt können die Plasmaspiegel von Zopiclon vermindert sein, wenn gleichzeitig CYP3A4-Induktoren (z.B. Rifampicin, Carbamazepin, Phenobarbital, Phenytoin, Johanniskraut, Oxcarbazepin, Primidon, Topiramat) verabreicht werden. Dadurch kann eine Dosiserhöhung von Imovane erforderlich werden. Benzodiazepine und Opioide: Die gleichzeitige Anwendung von Benzodiazepinen, einschliesslich Zopiclon und Opioiden erhöht aufgrund der zusätzlichen dämpfenden Wirkungen auf das zentrale Nervensystem das Risiko für Sedierung, Atemnot, Koma und Tod. Daher ist bei Patienten, die gleichzeitig Benzodiazepine und Opioide einnehmen, die Dosis und die Behandlungsdauer zu beschränken. Schwangerschaft/Stillzeit Reproduktionsstudien bei Tieren haben für Imovane keine teratogenen oder embryotoxischen Risiken für die Föten gezeigt, aber man verfügt über keine kontrollierten Studien bei schwangeren Frauen. Es gibt klare Hinweise auf Risiken für den Fötus durch Benzodiazepine, weshalb diese nur bei vitalen Indikationen eingesetzt werden sollten. Aus Vorsichtsgründen soll deshalb Imovane bei schwangeren Frauen nicht verwendet werden. Frauen, die während einer Behandlung mit Imovane schwanger werden wollen oder glauben, schwanger zu sein, sind anzuhalten, Ihren Arzt bzw. Ärztin davon in Kenntnis zu setzen, damit dieser entscheiden kann, ob die Behandlung fortgesetzt oder geändert werden soll. Die Einnahme von Imovane während des letzten Schwangerschaftsdrittels und vor oder bei der Geburt kann beim Neugeborenen Hypothermie, niedrigen Blutdruck, Atemdepression, einen verminderten Muskeltonus und Saugstörungen hervorrufen («Floppy-Infant-Syndrom»). Kinder von Müttern unter chronischer Einnahme von Sedativa und/oder Hypnotika in der Spätphase der Schwangerschaft können eine physische Abhängigkeit entwickeln. Es besteht die Gefahr, dass sie in der pospartalen Periode unter Entzugserscheinungen leiden. Auch wenn nur ein geringer Teil von Zopiclon in die Muttermilch übertritt (ca. 0,1-0,2% der von der Mutter absorbierten Dosis), soll eine Verabreichung während der Stillzeit nicht erfolgen. Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Wie bei allen zentral dämpfenden Mitteln kann auch nach Einnahme von Imovane die Reaktionsfähigkeit beeinträchtigt sein. Dies ist im Strassenverkehr und beim Bedienen von Maschinen zu beachten. Das Risiko psychomotorischer Störungen, einschliesslich der Beeinträchtigung der Verkehrstüchtigkeit, ist erhöht, wenn: Zopiclon weniger als 12 Stunden vor der Durchführung von Aktivitäten, die die volle Reaktionsfähigkeit erfordern, eingenommen wird, eine höhere als die empfohlene Dosis eingenommen wird oder Zopiclon zusammen mit anderen zentral dämpfenden Arzneimitteln, Alkohol oder anderen Arzneimitteln, die die Blutspiegelvon Zopiclon erhöhen, eingenommen wird (siehe «Kontraindikationen»). Die Patienten müssen darauf hingewiesen werden, dass nach der Einnahme von Zopiclon und insbesondere während der ersten 12 Stunden nach der Einnahme des Arzneimittels Situationen, die ein gutes Reaktionsvermögen und eine gute motorische Koordination erfordern, zum Beispiel das Bedienen von Maschinen oder das Führen motorisierter Fahrzeuge, riskant sind. Unerwünschte Wirkungen Die unerwünschten Wirkungen sind nach Organ und Häufigkeitskategorie gemäss folgender Einteilung aufgelistet: sehr häufig: (≥1/10); häufig: (≥1/100, <1/10); gelegentlich: (≥1/1000, <1/100); selten: (≥1/10'000, <1/1000); sehr selten: (<1/10'000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Unerwünschte Wirkungen von Imovane sind in der Regel abhängig von der eingenommenen Dosis und der individuellen Empfindlichkeit. Erkrankungen des Immunsystems Sehr selten: Angioödem, anaphylaktische Reaktionen. Psychiatrische Erkrankungen Gelegentlich: Alpträume, Unruhe. Selten: Verwirrungszustand, Libidostörungen, Reizbarkeit, Aggressionen, Halluzinationen. Nicht bekannt: Rastlosigkeit, Trugbilder, Zorn, abnormes Verhalten, möglicherweise begleitet von einer Amnesie und Somnambulismus (siehe «Warnhinweise und Vorsichtsmassnahmen, Somnambulismus und damit verbundene Verhaltensweisen»), Abhängigkeit, Entzugssyndrom, depressive Verstimmung, Maskierung depressiver oder paranoider Zustandsbilder besonders bei längerfristigem Gebrauch. Entzugserscheinungen sind variabel und können bestehen in Rebound-Schlaflosigkeit, Muskelschmerzen, Angst, Tremor, Schwitzen, Unruhe, Verwirrung, Kopfschmerzen, Herzklopfen, Tachykardie, Delirium, Alpträumen und Reizbarkeit. In schweren Fällen können folgende Symptome auftreten: Derealisation, Depersonalisation, Hyperakusis, Taubheitsgefühl und Kribbeln in den Gliedmassen, Überempfindlichkeit gegen Licht, Geräusche und Berührung, Halluzinationen. In sehr seltenen Fällen können Krämpfe auftreten. Erkrankungen des Nervensystems Seite 2 Fachinformation des Arzneimittel-Kompendium der Schweiz® Häufig: Geschmackstörungen (bittere Geschmacksempfindung), Restschläfrigkeit. Gelegentlich: Schwindel, Kopfschmerzen. Selten: Anterograde Amnesie, Nicht bekannt: Ataxie, Parästhesien, kognitive Störungen wie Gedächtnisverlust, Aufmerksamkeitsstörung und Sprachstörung. Augenerkrankungen Nicht bekannt: Diplopie. Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Dyspnoe. Nicht bekannt: Atemdepression. Erkrankungen des Gastrointestinaltrakts Häufig: Mundtrockenheit. Gelegentlich: Übelkeit. Nicht bekannt: Dyspepsie. Affektationen der Leber und Gallenblase Sehr selten: schwacher oder mässiger Anstieg der Serumtransaminasen und/oder der alkalischen Phosphatase. Erkankungen der Haut und des Unterhautzellgewebes Selten: Allergische Reaktionen (Hauterscheinungen wie z.B. Pruritus, Erythem, Urtikaria). Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Nicht bekannt: Muskelhypotonie. Allgemeine Erkrankungen Gelegentlich: Müdigkeit. Durch die Einnahme bedingte Verletzungen, Vergiftungen und Komplikationen Selten: Stürze (besonders bei älteren Patienten). Überdosierung Eine Überdosierung ist gewöhnlich – in Abhängigkeit der aufgenommenen Dosis – durch verschiedene Stadien der zentralen Dämpfung gekennzeichnet. In leichteren Fällen treten Symptome wie Schläfrigkeit, geistige Verwirrung und Lethargie auf; in schwereren Fällen auch Ataxie, Methämoglobinämie, Atem-und Kreislaufdepression und Koma. Intoxikationen sind im Allgemeinen nicht lebensbedrohlich, ausser in Kombination mit anderen ZNS-dämpfenden Substanzen (einschliesslich Alkohol). Zusätzliche Risikofaktoren, wie Begleiterkrankungen und schlechter Allgemeinzustand können den Schweregrad der Symptome erhöhen und in sehr seltenen Fällen auch zum Tod führen. Es wurden von sehr seltenen Fällen von AV-Block berichtet, insbesondere bei absichtlicher Intoxikation in Kombination mit anderen Substanzen. Bei der Behandlung einer Überdosierung steht die symptomatische Therapie im Vordergrund, insbesondere ist auf Erhaltung der Atem- und Kreislauffunktionen zu achten. Auf Grund des grossen Verteilungsvolumens ist eine Hämodialyse nur von geringem Nutzen. Eine Magenspülung und die Anwendung von Aktivkohle sind nur nützlich, wenn sie sehr schnell nach der Ingestion erfolgen. Flumazenil kann als nützliches Antidot eingesetzt werden. Eigenschaften/Wirkungen ATC-Code: N05CF01 Zopiclon (Imovane) gehört zur chemischen Stoffgruppe der Cyclopyrrolone und ist ein Hypnotikum. Es besitzt eine hohe Affinität zu Bindungsstellen am makromolekularen GABAA-Rezeptor-Komplex im Zentralnervensystem. Pharmakodynamische Studien zeigten, dass die Bindungsstelle von Cyclopyrrolonen an diesem GABAA-Rezeptor-Komplex nicht in jeder Hinsicht mit jener von Benzodiazepinen identisch ist. Die beiden Wirkstoffgruppen haben jedoch ein über weite Bereiche vergleichbares pharmakologisches Wirkungsspektrum. Im Tierversuch zeigt Zopiclon hypnotische, sedative, antikonvulsive und muskelrelaxierende Wirkungen. Zopiclon wird jedoch ausschliesslich als Hypnotikum eingesetzt. Es zeichnet sich durch einen raschen Wirkungseintritt aus und beeinflusst den Schlaf in mehrfacher Weise: es verkürzt die Einschlafzeit, vermindert die Häufigkeit nächtlichen Erwachens und verlängert die Schlafdauer insgesamt, ohne im allgemeinen die Dauer des REM-Schlafes zu beeinflussen. Die Schlafqualität wird subjektiv verbessert. Pharmakokinetik Absorption Zopiclon wird nach oraler Verabreichung schnell resorbiert. Zopiclon unterliegt wahrscheinlich einem First-pass-Effekt. Die Bioverfügbarkeit liegt bei 75-80%. Der maximale Plasmaspiegel wird innerhalb von 1,5-2 Stunden erreicht und beträgt nach Einnahme von 7,5 mg Zopiclon etwa 60 ng/ml. Auch nach wiederholter Einnahme wird praktisch keine Kumulation beobachtet. Distribution Zopiclon wird zu ca. 45% an Plasmaproteine gebunden und verteilt sich rasch aus dem Gefässsystem. Metabolismus Bei der Metabolisierung von Zopiclon enstehen im Wesentlichen zwei Metaboliten: das im Tiermodell pharmakologisch aktive N-Oxid-Zopiclon (Plasmahalbwertszeit 4,4 Stunden) und das nicht aktive N-Desmethyl-Zopiclon (Plasmahalbwertszeit 7,3 Stunden). In vitro Studien haben gezeigt, dass die Metabolisierung hauptsächlich über das Isoenzym CYP3A4 erfolgt. An der Bildung von N-Desmethyl –Zopiclon scheint CYP2C8 ebenfalls beteiligt zu sein. In Tierversuchen wurde, selbst bei hohen Zopiclon-Dosierungen, keine Enzyminduktion beobachtet. Elimination Die Eliminations-Halbwertszeit liegt bei ca. 5 Stunden. Die renale Clearance beträgt etwa 8 ml/min., die Plasmaclearance etwa 232 ml/min. Zopiclon wird nur zu einem geringen Teil unverändert ausgeschieden; 80% werden in Form von freien Metaboliten über den Urin, 16% über die Fäzes ausgeschieden. Kinetik spezieller Patientengruppen In Studien bei älteren Personen wurde auch nach wiederholter Applikation keine Kumulation von Zopiclon im Plasma beobachtet. Die geringe Erhöhung der Eliminations-Halbwertszeit von Zopiclon auf ca. 7 Stunden und der Bioverfügbarkeit ist durch eine Reduktion der hepatischen Metabolisierungsrate bedingt. Bei Patienten mit Nierenfunktionsstörungen wurden keine Veränderungen der pharmakokinetischen Parameter festgestellt. Bei Patienten mit Leberzirrhose verringert sich wegen der verlangsamten Demethylierung von Zopiclon die plasmatische Clearance um ca. 40% und verlängert sich die t½ auf mehr als 10 Stunden. Es liegen keine Studien zur Pharmakodynamik bei Leberinsuffizienz vor. Präklinische Daten Zopiclon hat im Tierversuch weder mutagene noch teratogene Effekte gezeigt. Sonstige Hinweise Haltbarkeit Imovane darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden. Besondere Lagerungshinweise Bei Raumtemperatur (15-25 °C) an einem trockenen Ort, und in der Originalpackung aufbewahren. Zulassungsnummer 47111 (Swissmedic). Zulassungsinhaberin sanofi-aventis (schweiz) ag, 1214 Vernier/GE. Stand der Information Mai 2017. Packungen Seite 3 Fachinformation des Arzneimittel-Kompendium der Schweiz® Menge IMOVANE Filmtabl 7.5 mg 10 Stk CHF Abgabekat. Rückerstattungskat. 7.25 B 30 Stk B 100 Stk B SL O Publiziert am 30.06.2017 Seite 4