Tyrosinkinase
Werbung
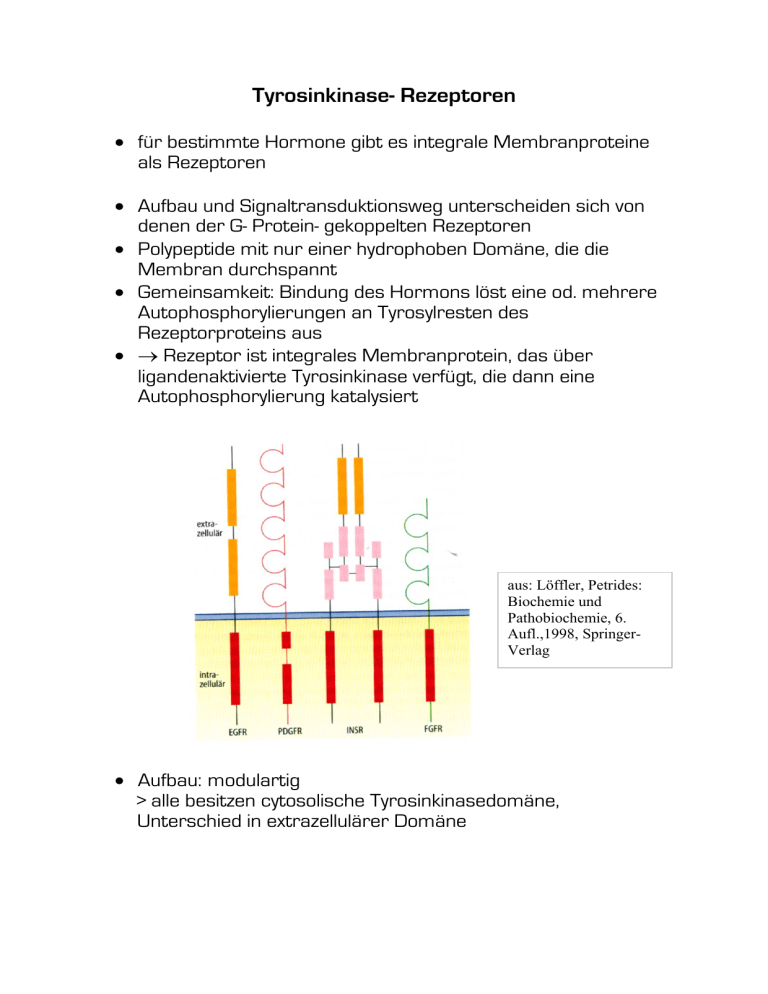
Tyrosinkinase- Rezeptoren • für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren • Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren • Polypeptide mit nur einer hydrophoben Domäne, die die Membran durchspannt • Gemeinsamkeit: Bindung des Hormons löst eine od. mehrere Autophosphorylierungen an Tyrosylresten des Rezeptorproteins aus • → Rezeptor ist integrales Membranprotein, das über ligandenaktivierte Tyrosinkinase verfügt, die dann eine Autophosphorylierung katalysiert aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, SpringerVerlag • Aufbau: modulartig > alle besitzen cytosolische Tyrosinkinasedomäne, Unterschied in extrazellulärer Domäne Hormone, deren Rezeptoren Tyrosinkinaseaktivität zeigen: Insulin Insulinähnlicher Wachstumsfaktor I (IGF-I) Plättchen- Wachstumsfaktor (PDGF) α2β2 (tetrameres Molekül) α2β2 monomer (Dimerisierung erst nach Ligandenbindung) Epidermaler Wachstumsfaktor monomer (EGF) Transformierender monomer Wachstumsfaktor β (TGF-β) Fibroblasten Wachstumsfaktor monomer (FGF) Mechanismus: • phosphorylierte Tyrosylreste dienen als Erkennungssignale für die Anlagerung einer Adapterproteinreihe aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag • Umgebung des phosphorylierten Tyrosylrest entscheidet, welches Protein gebunden wird Beispiel Insulinrezeptor • tetrameres Molekül aus je zwei identischen Untereinheiten → α2β2 • einzelne Untereinheiten durch Disulfidbrücken verknüpft • ein tetramerer Rezeptor bindet jeweils ein Insulinmolekül aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag • • • • Bindung des Insulins führt zu Konformationsänderung der βUntereinheit dies führt zu Autophosphorylierung spezifischer Tyrosylreste an der cytosolischen Domäne des Rezeptors Autophosphorylierung des Insulinrezeptors löst Assoziation eines spezifischen Proteins an Rezeptor aus an diesen kann wiederum eine Reihe von Proteinen andocken, die die intrazelluläre Signaltransduktion des Insulins übernehmen aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag • Insulin wird im endokrinen Teil des Pankreas synthetisiert und gespeichert, speziell in B-Zellen der Langerhans´schen Inseln • steigert die Aufnahme von Glucose aus dem Blut in die Zelle • fördert Abbau von Glucose, senkt Blutzuckerspiegel • Anstieg der Glucosekonzentration im Blut steigert Insulinfreisetzung, Abfall hemmt sie aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag Primärstruktur des Humaninsulins: aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag Na+/ K+-Pumpe • aktives Ionentransportsystem • wird als Pumpe bezeichnet, da Natrium aus Zelle heraus und Kalium in Zelle hinein gepumpt wird • dient zur Aufrechterhaltung einer hohen extrazellulären Natrium- und intrazellulären Kaliumkonzentration • Na+/ K+-ATPase katalysiert aktiven Transport von Na+- und K+-Ionen, d.h. Transport ist ATP- verbrauchend • Energie für Transport der Kationen durch Hydrolyse von ATP • Aktivität des Enzyms auch von Magnesiumionen abhängig • tetrameres Protein → zwei α- und zwei β- Untereinheiten • α-Untereinheit: drei Bereiche aus: Löffler, Petrides: Biochemie und Pathobioche mie, 6. Aufl.,1998, SpringerVerlag • mittlerer Teil: cytosolischer Anteil • N- und C- terminale Stücke in Plasmamembran eingebaut • enthält Bindungsstellen für Natrium, Kalium, ATP über Lysylrest sowie Aspartylseitenkette, die reversibel phosphoryliert wird aus: Löffler, Petrides: Biochemie und Pathobiochemie, 6. Aufl.,1998, Springer-Verlag • Natriumionen stimulieren Phosphorylierung des Aspartylrestes durch das an Lysylrest gebundene ATP • 3 Natriumionen werden in Pumpe aufgenommen • Konformationsänderung → Abgabe in Extrazellulärraum • zwei gleichzeitig gebundene Kaliumionen führen zu Dephosphorylierung des Enzyms → Vorraussetzung für neue ATP-Bindung


