Molekulare Masse
Werbung

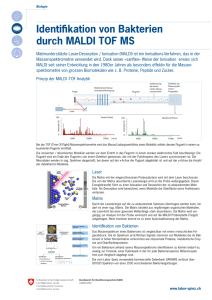
Bestimmung der Molekularen Masse von Makromolekülen Größenausschlußchromatographie Gelfiltration, SEC=size exclusion chromatography Größenausschlußchromatographie Gelfiltration, SEC=size exclusion chromatography log MW [kDa] BSA Carboanhydrase Lysozym 10 Aprotinin Elutionsvolumen [ml] Größenausschlußchromatographie Vorteile: Sehr oft ist Gelfiltration ein Schritt bei der Isolation des Proteins. Somit ist die Information über die native Größe schon vorhanden. Genauigkeit: +/- 10% im optimalen Fall bis zu +/-50% Abweichung Nachteile: Das Elutionsvolumen kann durch die Form des Proteins oder auch durch Interaktionen des Proteins mit der Säulenmatrix stark beeinflusst werden. Schwache Komplexe zerfallen auf Gelfiltration. Protein Hydrodynamischer Radius Massenspektrometrie Massenspektrometrie •Prinzip: Moleküle werden ionisiert und im elektrischen Feld beschleunigt • Hauptmethoden: ESI = Electrospray Ionisation MALDI = Matrix Assisted Laser Desorption Ionisation Massenspektrometrie • Detektion der ionisierten Moleküle z.B. mittels TOF = Time Of Flight • Prinzip Alle Moleküle haben nach der Beschleunigung im el. Feld die gleiche kinetische Energie = E = ½ mv2. Es gilt Ekin (Molekül 1) = Ekin (Molekül 2) ½ m1v12 = ½ m2v22 Ist nun die Masse m1 größer als die Masse m2 ist also die Geschwindigkeit v1 entsprechend kleiner als v2 d.h. das “leichtere” Molekül 2 kommen zuerst an. Massenspektrometrie • Latest: Detektion der ionisierten Moleküle Orbitrap Massenspektrometrie Vorteile: Sehr wenig Probe wird benötigt. Sehr präzise Messungen. Genauigkeit bis +/- 0.1 Da Nachteile: Da die Proteien ionisiert werden müssen, kommt es oft zur Deanturierung der Proteine; d.h. Multimere oder Komplexe zerfallen sehr oft bei der Ionisation und können nicht detektiert werden. Dynamische Lichtstreuung • DLS, Dynmaic Light Scattering auch “quasielastische” Streuung genannt. • Grundprinzip: Ist das Molekül sehr viel größer als die Wellenlänge des eintreffende Lichts, werden die Photonen elastisch - d.h. ohne Änderung Wellenlänge - gestreut (Rayleigh Scattering). (Analogie zum elastischen Stoß, bei dem ein Partikel, der sehr viel kleiner als der Stoßpartner ist, zwar eine andere Richtung erhält aber die Geschwindigkeit vollständig erhalten bleibt) Dynamische Lichtstreuung Gestreutes Licht Einfallendes Licht Moleküle in Lösung Moleküle in Bewegung Dynamische Lichtstreuung D Auslöschung n tio ek et Einfallendes Laserlicht Verstärkung Dynamische Lichtstreuung Auslöschung t itä ns ne n r I t vo de kei n g ig g ru ng un de hä eg Än Ab ew in r B de Einfallendes Laserlicht Verstärkung Dynamische Lichtstreuung Änderung der Lichtintensität gibt Rückssschlüsse auf Bewegung der Moleküle und über den Diffusionskoeffizienten auf die Größe der Moleküe. Brown’sche Molekülbewegung abhängig von Diffusionskoeffizient Diffussionskoeffizient kB = Boltzmann Konstante T= Temperatur η = Viskosität R0= Hydrodynamischer Radius des diffundierenden Teilchens Dynamische Lichtstreuung Vorteile: Wenig Probenvolumen, in der Regel geringe Proteinkonzentration Benötigte Proteinkonzentration von der Größe des Proteins abhängig. Nachteile: Methode extrem anfällig auf Partikel, wie z.B. aggregiertes Protein,Staub, etc, geringe Präzision. Achtung bei Glycerin oder andere Substanzen im puffer, die Viskosität stark ändern. Analytische Ultrazentrifugation • Grundprinzip: Bewegung der Moleküle während Sedimentation oder Sedimentationsgleichgewicht wird gemessen => Rückschlüsse auf Größe. Analytische Ultrazentrifugation Analytische Ultrazentrifugation Analytische Ultrazentrifugation Analytische Ultrazentrifugation t=0 t=x Analytische Ultrazentrifugation Sedimentation Analytische Ultrazentrifugation Lamm Gleichung Analytische Ultrazentrifugation Analytische Ultrazentrifugation