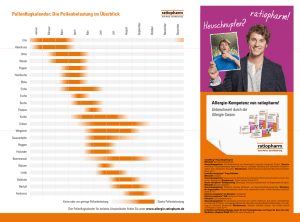
Desloratadine ratiopharm, INN-desloratadine
Werbung

ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Desloratadine ratiopharm 5 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Tablette enthält 5 mg Desloratadin. Sonstige Bestandteile: Jede Tablette enthält 15 mg Lactose-Monohydrat. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Filmtablette. Runde, bikonvexe, blaue Filmtabletten. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Desloratadin ratiopharm ist angezeigt für die Besserung der Symptomatik bei: allergischer Rhinitis (siehe Abschnitt 5.1) Urtikaria (siehe Abschnitt 5.1) 4.2 Dosierung, Art und Dauer der Anwendung Erwachsene und Jugendliche (12 Jahre und älter): Eine Tablette einmal täglich, mit einer oder ohne eine Mahlzeit, zur Linderung der Symptome bei allergischer Rhinitis (einschließlich intermittierender und persistierender allergischer Rhinitis) und Urtikaria (siehe unter Abschnitt 5.1). Es gibt eingeschränkte Erfahrung aus klinischen Studien zur Wirksamkeit bei der Anwendung von Desloratadin bei Jugendlichen von 12 bis 17 Jahren (siehe Abschnitte 4.8 und 5.1). Die Behandlung der intermittierenden allergischen Rhinitis (Auftreten der Symptome für weniger als 4 Tage pro Woche oder weniger als 4 Wochen) sollte entsprechend des bisherigen Krankheitsverlaufes erfolgen und kann nach dem Abklingen der Symptome beendet und bei deren Wiederauftreten wieder aufgenommen werden. Bei der persistierenden allergischen Rhinitis (Auftreten der Symptome an 4 oder mehr Tagen pro Woche und mehr als 4 Wochen) kann den Patienten während der Allergiezeit eine andauernde Behandlung empfohlen werden. 4.3 Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile oder gegen Loratadin. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Die Wirksamkeit und Unbedenklichkeit von Desloratadin Tabletten bei der Behandlung von Kindern unter 12 Jahren wurden bisher nicht nachgewiesen. 2 Bei schwerer Niereninsuffizienz sollte Desloratadin ratiopharm nur mit Vorsicht angewendet werden (siehe unter Abschnitt 5.2). Patienten mit den seltenen hereditären Problemen Galaktose-Intoleranz, Lapp-Lactase- Mangel oder Glukose-Galaktose-Malabsorption sollten dieses Arzneimittel nicht einnehmen. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Klinisch relevante Wechselwirkungen wurden im Rahmen klinischer Studien mit Desloratadin Tabletten nicht festgestellt, bei denen Erythromycin oder Ketoconazol zusätzlich verabreicht wurden (siehe unter Abschnitt 5.1). In einer klinisch-pharmakologischen Studie wurde bei gleichzeitiger Einnahme von Desloratadin und Alkohol die leistungsmindernde Wirkung von Alkohol nicht verstärkt (siehe unter Abschnitt 5.1). 4.6 Schwangerschaft und Stillzeit Im Tierversuch war Desloratadin nicht teratogen. Die Unbedenklichkeit der Anwendung dieses Arzneimittels während der Schwangerschaft ist nicht gesichert. Daher wird die Anwendung von Desloratadin ratiopharm während der Schwangerschaft nicht empfohlen. Desloratadin wird in die Muttermilch ausgeschieden, daher wird die Anwendung von Desloratadin ratiopharm bei stillenden Müttern nicht empfohlen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen In klinischen Studien zur Beurteilung der Verkehrstüchtigkeit wurde bei Patienten, die Desloratadin erhielten, keine Beeinträchtigung festgestellt. Die Patienten sollten jedoch darüber aufgeklärt werden, dass es in sehr seltenen Fällen zu Benommenheit kommen kann, die zu einer Beeinträchtigung der Verkehrstüchtigkeit oder der Fähigkeit zum Bedienen von Maschinen führen kann. 4.8 Nebenwirkungen Bei klinischen Studien in verschiedenen Indikationen, einschließlich allergischer Rhinitis und chronisch idiopathischer Urtikaria, wurden bei der empfohlenen Dosis von 5 mg täglich 3 % mehr Nebenwirkungen bei Patienten mit Desloratadin berichtet, als bei Patienten, die mit Placebo behandelt wurden. Die am häufigsten aufgetretenen Nebenwirkungen, über die häufiger als bei Placebo berichtet wurde, waren Müdigkeit (1,2 %), Mundtrockenheit (0,8 %) und Kopfschmerzen (0,6 %). Bei einer klinischen Studie mit 578 jugendlichen Patienten von 12 bis 17 Jahren war die häufigste Nebenwirkung Kopfschmerzen, diese trat bei 5,9 % der Patienten auf, die mit Desloratadin behandelt wurden und bei 6,9 % der Patienten, die mit Placebo behandelt wurden. Weitere Nebenwirkungen, über die sehr selten nach der Markteinführung berichtet wurde, sind in der folgenden Tabelle aufgeführt. Halluzinationen Schwindel, Somnolenz, Schlaflosigkeit, psychomotorische Hyperaktivität, Anfälle Tachykardie, Herzklopfen Abdominalschmerzen, Übelkeit, Erbrechen, Dyspepsie, Diarrhoe Leberenzymerhöhungen, erhöhtes Bilirubin, Hepatitis Myalgie Psychiatrische Erkrankungen Erkrankungen des Nervensystems Herzerkrankungen Erkrankungen des Gastrointestinaltrakts Leber- und Gallenerkrankungen Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Allgemeine Erkrankungen Überempfindlichkeitsreaktionen (wie Anaphylaxie, 3 Angioödem, Dyspnoe, Pruritus, Hautausschlag und Urtikaria) 4.9 Überdosierung Im Falle einer Überdosierung sind die Standardmaßnahmen zur Entfernung des nicht resorbierten arzneilich wirksamen Bestandteils in Erwägung zu ziehen. Es werden symptomatische und unterstützende Maßnahmen empfohlen. In einer Mehrfachdosis-Studie, bei der bis zu 45 mg Desloratadin (neunfache klinische Dosis) verabreicht wurden, wurden keine klinisch relevanten Wirkungen beobachtet. Desloratadin wird durch eine Hämodialyse nicht entfernt; es ist nicht bekannt, ob Desloratadin durch eine Peritonealdialyse eliminiert wird. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antihistaminika – H1-Antagonist; ATC-Code: R06A X27 Desloratadin ist ein nicht-sedierender, langwirksamer Histaminantagonist mit einer selektiven, peripheren H1-Rezeptor-antagonistischen Aktivität. Nach oraler Applikation hemmt Desloratadin selektiv die peripheren Histamin-H1-Rezeptoren, da die Substanz nicht in das zentrale Nervensystem übertritt. Desloratadin zeigte antiallergische Eigenschaften bei in vitro-Studien. Dies schließt sowohl die Hemmung der Freisetzung von proinflammatorischen Zytokinen wie IL-4, IL-6, IL-8 und IL-13 aus menschlichen Mastzellen/Basophilen ein als auch die Hemmung der Expression des Adhäsionsmoleküls P-Selektin auf Endothelialzellen. Die klinische Relevanz dieser Beobachtungen ist noch zu bestätigen. Im Rahmen einer klinischen Studie mit Mehrfachdosen, in der Desloratadin in einer Dosierung von bis zu 20 mg täglich über 14 Tage verabreicht wurde, wurde keine statistisch signifikante oder klinisch relevante kardiovaskuläre Wirkung beschrieben. In einer klinisch-pharmakologischen Studie, in der Desloratadin in einer Dosierung von 45 mg täglich (das Neunfache der klinischen Dosis) über zehn Tage verabreicht wurde, zeigte sich keine Verlängerung des QTc-Intervalls. In Wechselwirkungsstudien mit Mehrfachdosen an Ketoconazol und Erythromycin wurden keine klinisch relevanten Veränderungen der Desloratadin-Plasmakonzentrationen beobachtet. Desloratadin geht in nur geringen Mengen in das zentrale Nervensystem über. In kontrollierten klinischen Studien wurde bei der empfohlenen Dosierung von 5 mg täglich keine erhöhte Häufigkeit von Schläfrigkeit im Vergleich zu Placebo festgestellt. Bei einer Einzel-Tagesdosis von 7,5 mg führte Desloratadin in klinischen Studien zu keiner Beeinträchtigung der Psychomotorik. Bei einer Einzeldosis-Studie mit Erwachsenen zeigte Desloratadin 5 mg keinen Einfluss auf StandardMessgrößen der Flugleistung einschließlich der Verstärkung subjektiver Schläfrigkeit oder den Aufgaben, die mit dem Fliegen verbunden sind. In klinisch-pharmakologischen Studien kam es durch die gleichzeitige Einnahme von Alkohol weder zu einer Verstärkung der Alkohol-induzierten Leistungsbeeinträchtigung noch zu einer Erhöhung der Schläfrigkeit. Bei den Ergebnissen des psychomotorischen Tests konnten keine signifikanten Unterschiede zwischen den mit Desloratadin und den mit Placebo behandelten Patienten festgestellt werden, unabhängig davon, ob Desloratadin alleine oder mit Alkohol eingenommen wurde. 4 Bei Patienten mit allergischer Rhinitis war Desloratadin wirksam bei der Linderung der Symptome wie Niesen, Nasensekretion und Juckreiz der Nase, Juckreiz, Tränenfluss und Rötung der Augen sowie Juckreiz am Gaumen. Desloratadin zeigte 24 Stunden lang eine effektive Kontrolle der Symptome. Die Wirksamkeit von Desloratadin Tabletten wurde in Studien mit jugendlichen Patienten von 12 bis 17 Jahren nicht eindeutig gezeigt. Zusätzlich zu der etablierten Klassifizierung in saisonal und perennial, kann allergische Rhinitis in Abhängigkeit von der Dauer der Symptome alternativ auch in intermittierende allergische Rhinitis und persistierende allergische Rhinitis eingeteilt werden. Intermittierende allergische Rhinitis wird als Auftreten der Symptome für weniger als 4 Tage pro Woche oder weniger als 4 Wochen definiert. Persistierende allergische Rhinitis wird als Auftreten der Symptome an 4 oder mehr Tagen pro Woche und mehr als 4 Wochen definiert. Wie anhand des Gesamtscores des Fragebogens zur Lebensqualität bei Rhino-Konjunktivitis gezeigt wurde, vermindert Desloratadin effektiv die durch saisonale allergische Rhinitis hervorgerufene Belastung. Die größte Verbesserung wurde im Bereich der gewohnten Aufgaben und der durch die Symptome eingeschränkten alltäglichen Tätigkeiten festgestellt. Die chronisch idiopathische Urtikaria wurde stellvertretend für weitere Formen der Urtikaria untersucht, da die zugrunde liegende Pathophysiologie ungeachtet der Ätiologie bei den unterschiedlichen Formen ähnlich ist und chronische Patienten einfacher prospektiv rekrutiert werden können. Da die Histaminfreisetzung ein ursächlicher Faktor bei allen urtikariellen Erkrankungen ist, wird erwartet, dass Desloratadin außer bei der chronisch idiopathischen Urtikaria auch bei anderen Formen der Urtikaria zu einer Verbesserung der Symptome führt; dies wird durch die Empfehlungen der klinischen Leitlinien bestätigt. In zwei Placebo-kontrollierten Studien über 6 Wochen bei Patienten mit chronisch idiopathischer Urtikaria war Desloratadin wirksam bei der Verbesserung von Pruritus und der Herabsetzung von Größe und Anzahl von Quaddeln am Ende des ersten Dosisintervalls. Bei jeder Studie hielten die Wirkungen über das 24-Stunden-Dosisintervall hinaus an. Wie in anderen Studien mit Antihistaminika bei chronisch idiopathischer Urtikaria wurde die Minderheit der Patienten, die nicht auf Antihistaminika reagierten, aus der Studie ausgeschlossen. Eine Verbesserung des Juckreizes um mehr als 50 % wurde bei 55 % der mit Desloratadin behandelten Patienten im Vergleich zu 19 % der mit Placebo behandelten Patienten beobachtet. Die Behandlung mit Desloratadin reduzierte die Störung des Schlafes und des Wachseins bedeutend, wie durch eine 4-Punkte-Skala zur Bewertung dieser Variablen gemessen wurde. 5.2 Pharmakokinetische Eigenschaften Desloratadin ist innerhalb von 30 Minuten nach Verabreichung im Plasma nachweisbar. Desloratadin wird gut resorbiert, wobei Plasmaspitzenkonzentrationen nach ungefähr 3 Stunden erreicht werden; die terminale Halbwertzeit beträgt ungefähr 27 Stunden. Der Grad der Kumulation von Desloratadin entsprach seiner Halbwertzeit (ungefähr 27 Stunden) und einer Anwendungshäufigkeit von einmal täglich. Die Bioverfügbarkeit von Desloratadin war bei Dosierungen von 5 mg bis 20 mg dosisproportional. In einer Pharmakokinetik-Studie, bei der die Patienten-Demographien mit der allgemeinen saisonalen allergischen Rhinitis -Population vergleichbar waren, wurde bei 4 % der Patienten eine höhere Konzentration von Desloratadin erreicht. Dieser Prozentsatz kann je nach ethnischer Herkunft variieren. Die maximale Desloratadin-Konzentration war nach ca. 7 Stunden etwa 3mal höher mit einer terminalen Halbwertzeit von ungefähr 89 Stunden. Das Sicherheitsprofil dieser Patienten war von dem der allgemeinen Bevölkerung nicht abweichend. Desloratadin bindet mäßig (83–87 %) an Plasmaproteine. Es liegen keine Anhaltspunkte für eine klinisch relevante Kumulation nach einmal täglicher Anwendung von Desloratadin (5–20 mg) über 14 Tage vor. 5 Das für den Metabolismus von Desloratadin verantwortliche Enzym wurde jedoch noch nicht identifiziert, so dass Wechselwirkungen mit anderen Arzneimitteln nicht ganz ausgeschlossen werden können. Desloratadin hemmt in-vivo nicht CYP3A4 und in-vitro-Studien haben gezeigt, dass das Arzneimittel CYP2D6 nicht hemmt und weder ein Substrat noch ein Inhibitor des P-Glykoproteins ist. In einer Einzeldosisstudie mit Desloratadin in einer Dosierung von 7,5 mg wirkten sich Mahlzeiten (fetthaltiges, kalorienreiches Frühstück) nicht auf die Verfügbarkeit von Desloratadin aus. In einer anderen Studie hatte Grapefruit-Saft keine Auswirkung auf die Verfügbarkeit von Desloratadin. 5.3 Präklinische Daten zur Sicherheit Bei Desloratadin handelt es sich um den wirksamen Hauptmetaboliten von Loratadin. Die mit Desloratadin und Loratadin durchgeführten präklinischen Studien zeigten, bei einem vergleichbaren Grad der Exposition von Desloratadin, keine qualitativen oder quantitativen Unterschiede hinsichtlich des Toxizitätsprofils von Desloratadin und von Loratadin. Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zur Reproduktionstoxizität lassen die präklinischen Daten mit Desloratadin keine besonderen Gefahren für den Menschen erkennen. Das Fehlen eines kanzerogenen Potentials wurde in Studien gezeigt, die mit Desloratadin und Loratadin durchgeführt wurden. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Tablettenkern Poloxamer Typ 188 Citronensäure-Monohydrat Mikrokristalline Cellulose Maisstärke Croscarmellose-Natrium Lactose-Monohydrat Talkum Filmüberzug Poly(vinylalkohol) Titandioxid (E 171) Macrogol/PEG 3350 Talkum Indigocarmin, Aluminiumsalz (E 132) 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre HDPE Flaschen mit PP Verschluss: Haltbarkeit nach Öffnen des Behältnisses: 6 Monate 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung PVC/PVdC/Aluminiumblister: 6 In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen. HDPE Flaschen mit PP Verschluss: Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. 6.5 Art und Inhalt des Behältnisses PVC/PVdC/Aluminium Blister: Packungen mit 7, 10, 14, 15, 20, 30, 40, 50, 60, 90 und 100 Filmtabletten. HDPE Flaschen mit PP Verschluss: Packungen mit 250 Filmtabletten. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNG ratiopharm GmbH Graf-Arco-Straße 3 89079 Ulm Deutschland [email protected] 8. ZULASSUNGSNUMMERN 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Zulassung: 10. STAND DER INFORMATION Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 7 ANHANG II A. HERSTELLER, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN 8 A. HERSTELLER, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Name und Anschrift des Herstellers, der für die Chargenfreigabe verantwortlich ist Merckle GmbH Ludwig-Merckle-Straße 3 89143 Blaubeuren Deutschland TEVA Pharmaceutical Works Private Limited Company Pallagi út 13 4042 Debrecen Ungarn TEVA UK Ltd Brampton Road, Hampden Park, Eastbourne East Sussex, BN22 9AG Vereinigtes Königreich Pharmachemie B.V. Swensweg 5 2031 GA Haarlem Niederlande TEVA Santé Rue Bellocier 89100 Sens Frankreich Teva Czech Industries s.r.o Ostravska 29, c.p. 305 74770 Opava-Komarov Tschechische Republik Teva Operations Poland Sp. Z o.o. ul. Mogilska 80 31-546 Krakow Polen Teva Operations Poland Sp. Z o.o. ul. Sienkiewicza 25 99-300 Kutno Polen In der Druckversion der Packungsbeilage des Arzneimittels müssen Name und Anschrift des Herstellers, der für die Freigabe der betreffenden Charge verantwortlich ist, angegeben werden. B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH Arzneimittel, das der Verschreibungspflicht unterliegt. 9 C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN Pharmakovigilanz-System Der Inhaber der Genehmigung für das Inverkehrbringen muss sicherstellen, dass das Pharmakovigilanz-System, wie in Modul 1.8.1 der Zulassung dargelegt, vorhanden und funktionsfähig ist, bevor und während das Arzneimittel in den Verkehr gebracht wird. Risikomanagement-Plan (RMP) Nicht zutreffend. PSURs Der PSUR Einreichungs-Zyklus muss dem PSUR Einreichungs-Zyklus für das Referenzarzneimittel folgen. • BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE SICHERE UND WIRKSAME ANWENDUNG DES ARZNEIMITTELS Nicht zutreffend. 10 ANHANG III ETIKETTIERUNG UND PACKUNGSBEILAGE 11 A. ETIKETTIERUNG 12 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG UND AUF DEM BEHÄLTNIS FALTSCHACHTEL/FLASCHE 1. BEZEICHNUNG DES ARZNEIMITTELS Desloratadine ratiopharm 5 mg Filmtabletten Desloratadin 2. WIRKSTOFF(E) Jede Filmtablette enthält 5 mg Desloratadin. 3. SONSTIGE BESTANDTEILE Enthält Lactose. Packungsbeilage beachten. 4. DARREICHUNGSFORM UND INHALT 7 Filmtabletten 10 Filmtabletten 14 Filmtabletten 15 Filmtabletten 20 Filmtabletten 30 Filmtabletten 40 Filmtabletten 50 Filmtabletten 60 Filmtabletten 90 Filmtabletten 100 Filmtabletten 250 Filmtabletten 5. HINWEISE ZUR UND ART(EN) DER ANWENDUNG Die Tablette ganz (unzerkaut) mit Wasser schlucken. Packungsbeilage beachten. Zum Einnehmen. 6. WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND NICHT SICHTBAR AUFZUBEWAHREN IST Arzneimittel für Kinder unzugänglich aufbewahren. 7. WEITERE WARNHINWEISE, FALLS ERFORDERLICH 8. VERFALLDATUM 13 Verwendbar bis: 9. BESONDERE LAGERUNGSHINWEISE <PVC/PVdC/Aluminiumblister:> In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen. <HDPE Flaschen mit PP Verschluss: > Haltbarkeit nach Öffnen des Behältnisses: 6 Monate 10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON STAMMENDEN ABFALLMATERIALIEN 11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS ratiopharm GmbH Graf-Arco-Straße 3 89079 Ulm Deutschland [email protected] 12. ZULASSUNGSNUMMER(N) 13. CHARGENBEZEICHNUNG Ch.-B.: 14. VERKAUFSABGRENZUNG Verschreibungspflichtig. 15. HINWEISE FÜR DEN GEBRAUCH 16. INFORMATION IN BRAILLE-SCHRIFT Desloratadine ratiopharm 5 mg 14 MINDESTANGABEN AUF BLISTERPACKUNGEN ODER FOLIENSTREIFEN BLISTER 1. BEZEICHNUNG DES ARZNEIMITTELS Desloratadine ratiopharm 5 mg Filmtabletten Desloratadin 2. NAME DES PHARMAZEUTISCHEN UNTERNEHMERS ratiopharm 3. VERFALLDATUM Verw. bis 4. CHARGENBEZEICHNUNG Ch.-B.: 5. WEITERE ANGABEN 15 B. PACKUNGSBEILAGE 16 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Desloratadine ratiopharm 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker. Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker. Diese Packungsbeilage beinhaltet: 1. Was ist Desloratadine ratiopharm und wofür wird es angewendet? 2. Was müssen Sie vor der Einnahme von Desloratadine ratiopharm beachten? 3. Wie ist Desloratadine ratiopharm einzunehmen? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Desloratadine ratiopharm aufzubewahren? 6. Weitere Informationen 1. WAS IST DESLORATADINE RATIOPHARM UND WOFÜR WIRD ES ANGEWENDET? Desloratadine ratiopharm enthält als Wirkstoff das Antihistaminikum Desloratadin. Desloratadine ratiopharm verbessert die Symptome bei allergischer Rhinitis (durch eine Allergie hervorgerufenen Entzündung der Nasengänge, beispielsweise Heuschnupfen oder HausstaubmilbenAllergie). Diese Symptome beinhalten Niesen, laufende oder juckende Nase, Juckreiz am Gaumen und juckende, gerötete oder tränende Augen. Desloratadine ratiopharm wird ebenfalls angewendet zur Beseitigung von mit Urtikaria (durch eine Allergie hervorgerufener Hautzustand) zusammenhängenden Symptomen. Diese Symptome beinhalten Juckreiz und Quaddeln. Desloratadine ratiopharm ist bei Erwachsenen und Jugendlichen (12 Jahre und älter) angezeigt. Die Beseitigung dieser Symptome hält einen ganzen Tag an und hilft Ihnen, Ihre normale tägliche Aktivität und Ihren Schlaf wiederzufinden. 2. WAS MÜSSEN SIE VOR DER EINNAHME VON DESLORATADINE RATIOPHARM BEACHTEN? Desloratadine ratiopharm darf nicht eingenommen werden wenn Sie überempfindlich (allergisch) gegen Desloratadin oder einen der sonstigen Bestandteile von Desloratadine ratiopharm oder gegen Loratadin sind. Besondere Vorsicht bei der Einnahme von Desloratadine ratiopharm ist erforderlich wenn Sie eine eingeschränkte Nierenfunktion haben. Wenn dies auf Sie zutrifft, oder Sie sich nicht sicher sind, fragen Sie bitte Ihren Arzt, bevor Sie Desloratadine ratiopharm einnehmen. 17 Kinder Desloratadine ratiopharm sollte nicht bei Kindern unter 12 Jahren angewendet werden. Bei Einnahme von Desloratadine ratiopharm mit anderen Arzneimitteln Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen bzw. vor kurzem eingenommen haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Schwangerschaft und Stillzeit Fragen Sie während der Schwangerschaft und Stillzeit vor der Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat. Von einer Anwendung von Desloratadine ratiopharm in der Schwangerschaft und Stillzeit wird abgeraten. Verkehrstüchtigkeit und das Bedienen von Maschinen Bei Anwendung in der empfohlenen Dosierung ist nicht damit zu rechnen, dass Desloratadine ratiopharm zu einer Beeinträchtigung der Verkehrstüchtigkeit oder der Fähigkeit zum Bedienen von Maschinen führt. Sehr selten entwickeln jedoch manche Personen Benommenheit, welche die Aufmerksamkeit herabsetzen kann. Sollte dies bei Ihnen zutreffen, fahren Sie nicht Auto und bedienen Sie keine Maschinen. Wichtige Informationen über bestimmte sonstige Bestandteile von Desloratadine ratiopharm Desloratadine ratiopharm enthält Lactose. Bitte nehmen Sie Desloratadine ratiopharm daher erst nach Rücksprache mit Ihrem Arzt ein, wenn Ihnen bekannt ist, dass Sie unter einer Unverträglichkeit gegenüber bestimmten Zuckern leiden. 3. WIE IST DESLORATADINE RATIOPHARM EINZUNEHMEN? Erwachsene und Jugendliche (12 Jahre und älter): Eine Tablette einmal täglich einnehmen. Die Tablette ganz (unzerkaut) während oder zwischen den Mahlzeiten mit Wasser schlucken. Bezüglich der Behandlungsdauer wird Ihr Arzt die Art der allergischen Rhinitis feststellen, unter der Sie leiden und wird danach festlegen, wie lange Sie Desloratadine ratiopharm einnehmen sollen. Wenn Ihre allergische Rhinitis intermittierend ist (die Symptome seltener als 4 Tage pro Woche auftreten oder weniger als 4 Wochen andauern), wird Ihr Arzt Ihnen ein Behandlungsschema empfehlen, das abhängig von Ihrem bisherigen Krankheitsverlauf ist. Wenn Ihre allergische Rhinitis persistierend ist (die Symptome an 4 oder mehr Tagen pro Woche auftreten und mehr als 4 Wochen andauern), kann Ihr Arzt Ihnen eine länger dauernde Behandlung empfehlen. Bei Urtikaria kann sich die Behandlungsdauer von Patient zu Patient unterscheiden. Deshalb sollten Sie die Anweisungen Ihres Arztes befolgen. Wenn Sie eine größere Menge von Desloratadine ratiopharm eingenommen haben, als Sie sollten Nehmen Sie Desloratadine ratiopharm nur in der Ihnen verschriebenen Menge ein. Bei einer versehentlichen Überdosis ist mit keinen schweren Problemen zu rechnen. Wenn Sie mehr Desloratadine ratiopharm eingenommen haben, als Sie sollten, wenden Sie sich an Ihren Arzt oder Apotheker. Wenn Sie die Einnahme von Desloratadine ratiopharm vergessen haben Wenn Sie vergessen haben, Ihre Dosis rechtzeitig einzunehmen, nehmen Sie sie so bald wie möglich ein, und folgen Sie dann wieder dem normalen Behandlungsplan. Nehmen Sie nicht die doppelte Dosis ein, wenn Sie die vorherige Einnahme vergessen haben. Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker. 18 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann Desloratadine ratiopharm Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Sehr selten (bei weniger als 1 Behandelten von 10.000 auf) wurde über Fälle von schweren allergischen Reaktionen (Schwierigkeiten beim Atmen, pfeifendes Atmen, Jucken, Nesselausschlag und Schwellungen) berichtet. Treten diese Reaktionen bei ihnen auf, sollten Sie sofort medizinische Hilfe in Anspruch nehmen. Bei Erwachsenen waren die Nebenwirkungen ähnlich wie mit Placebo. Jedoch wurden Müdigkeit, Mundtrockenheit und Kopfschmerzen öfter berichtet als mit Placebo. Bei Jugendlichen waren Kopfschmerzen die am häufigsten berichtete Nebenwirkung. Nach Markteinführung von Desloratadin wurden sehr selten (treten bei weniger als 1 Behandelten von 10.000 auf) folgende weitere Nebenwirkungen berichtet: - Hautausschlag - Herzklopfen - Herzjagen - Bauchschmerzen - Übelkeit - Erbrechen - Magenverstimmung - Durchfall - Schwindel - Benommenheit - Schlaflosigkeit - Muskelschmerzen - Halluzinationen - Anfälle - Rastlosigkeit mit vermehrter körperlicher Aktivität - Leberentzündung - ungewöhnliche Leberfunktionswerte. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind. 5. WIE IST DESLORATADINE RATIOPHARM AUFZUBEWAHREN? Arzneimittel für Kinder unzugänglich aufbewahren. Sie dürfen Desloratadine ratiopharm nach dem auf der Faltschachtel und der Blisterpackung bzw. der Flasche angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats. PVC/PVdC/Aluminiumblister: In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen. HDPE Flaschen mit PP Verschluss: Nach dem ersten Öffnen der HDPE Flaschen, ist Desloratadine ratiopharm 6 Monate haltbar. Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Informieren Sie Ihren Apotheker, wenn Sie eine Veränderung des Aussehens der Tabletten bemerken. 19 Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen. 6. WEITERE INFORMATIONEN Was Desloratadine ratiopharm enthält Der Wirkstoff ist Desloratadin 5 mg. Die sonstigen Bestandteile sind: Tablettenkern: Poloxamer Typ 188, Citronensäure-Monohydrat, Mikrokristalline Cellulose, Maisstärke, Croscarmellose-Natrium, Lactose-Monohydrat, Talkum, Filmüberzug: Poly(vinyl)alkohol, Titandioxid (E 171), Macrogol/PEG 3350, Talkum, Indigocarmin, Aluminiumsalz (E 132). Wie Desloratadine ratiopharm aussieht und Inhalt der Packung Runde, bikonvexe, blaue Filmtabletten. Desloratadine ratiopharm 5 mg Filmtabletten stehen in Packungen mit 7, 10, 14, 15, 20, 30, 40, 50, 60, 90, 100 und 250 Filmtabletten zur Verfügung. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Pharmazeutischer Unternehmer ratiopharm GmbH Graf-Arco-Straße 3 89079 Ulm Deutschland [email protected] Hersteller Merckle GmbH Ludwig-Merckle-Straße 3 89143 Blaubeuren Deutschland Teva Pharmaceutical Works Private Limited Company Pallagi út 13 4042 Debrecen Ungarn Teva UK Limited Brampton Road, Hampden Park, Eastbourne East Sussex, BN22 9AG Vereinigtes Königreich Pharmachemie B.V. Swensweg 5 2031 GA Haarlem Niederlande Teva Santé Rue Bellocier 89107 Sens Frankreich 20 Teva Czech Industries s.r.o. Ostravaská 29, c.p. 305 74770 Opava-Komárov Tschechische Republik Teva Operations Poland Sp. z o.o. ul. Mogilska 80 31-546 Kraków Polen Teva Operations Poland Sp. z o.o. ul. Sienkiewicza 25 99-300 Kutno Polen Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem örtlichen Vertreter des Pharmazeutischen Unternehmers in Verbindung. België/Belgique/Belgien Teva Pharma Belgium N.V./S.A. Tél/Tel: +32 3 820 73 73 Luxembourg/Luxemburg ratiopharm S.A. Luxemburg Tél/Tel: +35 2 40 37 27 България Тева Фармасютикълс България ЕООД Teл: +359 2 489 95 82 Magyarország Teva Magyarország Zrt. Tel: +36 1 288 64 00 Česká republika ratiopharm CZ s.r.o. Tel: +420 251 007 101 Malta Drugsales Ltd Tel: +356 21 419 070/1/2 Danmark Teva Denmark A/S Tlf.: 44 98 55 11 Nederland Teva Nederland B.V. Tel.: +31 (0) 800 0228400 Deutschland ratiopharm GmbH Tel: +49 731 402 02 Norge ratiopharm AS Tlf: +47 66 77 55 90 Eesti UAB „Sicor Biotech“ Eesti filiaal Tel: +372 661 0801 Österreich ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1 97 007 Ελλάδα Teva Ελλάς Α.Ε. Τηλ: +30 210 72 79 099 Polska Teva Pharmaceuticals Polska Sp.z.o.o Tel: +48 22 345 93 00 España ratiopharm España, S.A. Tel: +34 91 567 29 70 Portugal ratiopharm, Comércio e Indústria de Produtos farmacêuticos Lda Tel: +351 21 424 80 00 France Teva Santé Tél: +33 01 55 91 78 00 România Teva Pharmaceuticals S.R.L Tel: +40 21 230 65 24 Ireland Slovenija 21 Teva Pharmaceuticals Ireland Tel: +353 42 939 58 92 Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390 Ísland Teva UK Limited, Bretland Sími: +44 1323 501 111 Slovenská republika TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 2 57 267 911 Italia Teva Italia s.r.l. Tel: +39 02 8917981 Suomi/Finland ratiopharm Oy Puh/Tel: +358 20 180 5900 Κύπρος Teva Ελλάς Α.Ε., Ελλάδα Τηλ: +30 210 72 79 099 Sverige Teva Sweden AB Tel: +46 42 12 11 00 Latvija UAB "Sicor Biotech" filiāle Latvijā Tel: +371 677 849 80 United Kingdom Teva UK Limited Tel: +44 1323 501 111 Lietuva UAB "Sicor Biotech" Tel: +370 5 266 0203 Diese Gebrauchsinformation wurde zuletzt genehmigt im Ausführliche Informationen zu diesem Arzneimittel sind auf der Website der Europäischen Arzneimittel Agentur http://www.ema.europa.eu/ verfügbar. 22