Blatt 8 - Uni Ulm
Werbung

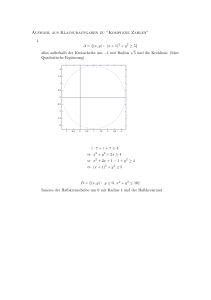
Seminar Physikalische Chemie II für Biochemie und Lehramt WS 05/06 8. Übungsblatt Besprechungstermin Biochemie : 21.12.2005, Lehramt: 09.01.2006 15. Dezember 2005 Die Übungsblätter gibt es auch online unter: www.pctheory.uni-ulm.de Aufgabe 1: Rechnen mit komplexen Zahlen (2 + 1 + 2 + 2 Punkte) a) Veranschaulichen Sie die Bedeutung i) von Re(z), Im(z), |z| , Arg(z), z ∗ , für ein beliebiges z ∈ C ii) der Addition, Subtraktion, Multiplikation, Division zweier komplexer Zahlen geometrisch anhand von geeigneten Skizzen in der komplexen Zahlenebene C. b) Sei z = a + ib, a, b ∈ R. Berechnen Sie z + z ∗ , z − z ∗ und z · z ∗ . c) Bestimmen Sie für z1 = (1 − i)n , n ∈ N, |z1 | und Arg(z1 ) sowie für z2 = Re(z2 ), Im(z2 ), |z2 | , Arg(z2 ) und z2∗ . √ 1+i 3 2 d) Vereinfachen Sie die folgenden Brüche soweit wie möglich, d.h. bringen Sie sie insbesonderen in eine Form, in der der Nenner reell ist, und bestimmen Sie jeweils Re(z), Im(z), |z| , Arg(z) und z ∗ : i) ii) iii) 1 i 4−8i 3+4i (1+i)4 (1−i)3 − (1−i)4 (1+i)3 (Hinweis: vereinfachen und dann Teilaufgabe c) beachten) Aufgabe 2: Knoten der wasserstoffähnlichen Orbitale (2 + 2 Punkte) Die Orbitale der wasserstoffähnlichen Atome besitzen die allgemeine Form ψn, l, ml = Rn, l · Yl, ml , wobei die Rn, l als radiale Wellenfunktionen bezeichnet werden und die Yl, ml die bekannten Kugelflächenfunktionen darstellen. Einige radiale Wellenfunktionen lauten: Orbital n l 1s 1 0 2s 2 0 2p 2 1 3s 3 0 Rn, l 32 1 2 aZ0 e− 2 ρ 23 1 Z 1 √ (2 − ρ)e− 2 ρ 2 2 a0 23 1 1 Z √ ρe− 2 ρ 2 6 a0 32 1 1 Z √ (6 − 6ρ + ρ2 )e− 2 ρ 9 3 a0 Dabei ist a0 = 52, 9pm der Bohr’sche Radius, Z die Kernladungszahl und ρ = 2Z r . n a0 a) Bestimmen Sie das Minimum und den Knoten der 2s-Radialwellenfunktion für das H-Atom. b) Wo liegen die radialen Knoten des 3s-Orbitals des Wasserstoffatoms? - 1 von 1 -