Prüfung des Urins auf antimikrobielle Stoffe im Hemmstofftest
Werbung

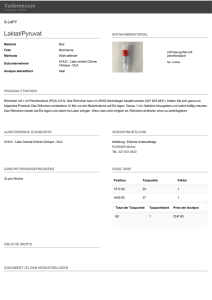
Kurs 4 Themen: E.coli Proteus Klebsiella Pseudomonas Serratia Keimzahlbestimmung Resistenzbestimmung HWI Blutkulturen SS2007 Aufgaben: 1. Beschreiben Sie im Protokollbogen die Keime auf den Kulturen und im Präparat. 2. Führen Sie den Oxydasetest beim Pseudomonas und Proteus im Team durch. 3. Zur Ansicht pro Reihe: Bunte Reihe, Api`s 4. Führen Sie den Indol-Nachweis im Team durch. 5. Resistenzbestimmung von der Isolierung des Bakteriengemisches. 6. Eigenaktivitäten, Keimzahlplatten, Uriculte (pro Team zur Ansicht ) 7. Bestimmen Sie die Keime auf den Wiederholungsplatten 1 – 4. 8. Zur Ansicht Blutkulturen. Bunte Reihe: Damit werden hauptsächlich Leistungen von Enzymen des Kohlenhydrat (z.B. Dextrose) und Aminosäurestoffwechsels (z.B. Decarboxylasen, Desaminasen,Ureasen) nachgewiesen. Farbumschläge spezieller Indikatoren, die bereits in den Nährmedien vorhanden sind, oder nachträglich zugegeben werden, lassen positive Ergebnisse sichtbar werden .Ein gebräuchliches System dieser Art sind die Api´s. O/F-Test Oxydations- Fermentationstest: (enthält Dextrose, Bromthymolblau ) Kohlenhydrate werden von Bakterien mit Sauerstoff ( =oxydativer Abbau ) und ohne Sauerstoff (=fermentativer Abbau ) abgebaut. Durchführung: Zwei Hochschichtagar wurden mit dem fraglichen Stamm an der Oberfläche und im Stich beimpft. Ein Agar wird mit Vaseline luftdicht verschlossen. Die Röhrchen wurden 18 Stunden bei 37°C bebrütet. Oxydativer Abbau: nur Röhrchen ohne Vaseline gelb Fermentativer Abbau: beide Röhrchen gelb Kein Abbau: beide Röhrchen unverändert Indol – Nachweis: Gewisse Bakterien haben die Fähigkeit, aus dem Tryptophan Indol zu bilden. Diese Substanz lässt sich im Medium mit einer Testlösung nachweisen, dem Kovács Reagenz. Durchführung: Auf Ihrem Arbeitsplatz finden Sie pro Team zwei Reagenzgläser. Fügen Sie jeweils einen Tropfen Kovàcs Reagenz hinzu. Die Röhrchen bitte nicht schütteln! Positiv: Das zur Oberfläche aufsteigende Reagenz ist rot verfärbt. Negativ: Keine Verfärbung des gelblichen Reagenz. Resistenzbestimmung: Mit dem Blättchendiffusionstest wird die Resistenz von Bakterien gegenüber Antibiotika getestet. Durchführung: Auf ihrem Arbeitsplatz befindet sich eine Müller – Hinton – Platte ohne Blut, eine Pipette, ein Spatel und ein kurzes NaCl – Röhrchen. Arbeiten Sie im Team. 1. 1 – 2 gelbe Kolonien Ihrer Isolierungsplatte, bzw. ¼ weiße Kolonie in das NaCl – Röhrchen einreiben. 2. Mit der Plastikpipette gut mischen. 3. Ca. zwei Tropfen der Suspension auf die Agarplatte geben und mit dem Glasstab verteilen. 4. Pro Platte je 4 Antibiotika Blättchen auflegen ( in Schälchen ausgeteilt auf den Zentrifugen). -Penicillin -Vancomycin -Cefazolin -Cefotaxim 5. Vergessen Sie nicht, die Platte zu beschriften. Stellen Sie die Platte zur Bebrütung oben auf die Bank bereit. Bakteriologische Diagnostik von Harnwegsinfekten Fehler, die bei der Entnahme und beim Transport von Untersuchungsmaterial gemacht werden, können auch durch die beste Labortechnik nicht mehr korrigiert werden. Untersuchung auf bakterielle Erreger unspezifischer Harnwegsinfektionen: Nur Mittelstrahl- und Katheterurin, der unmittelbar, höchstens aber 2 Stunden nach der richtig durchgeführten Entnahme entweder in einem bakteriologischen Labor zur Untersuchung gelangt oder vor einer solchen Untersuchung möglichst ununterbrochen bei Temperaturen zwischen 4 C und maximal 6 C nicht länger als 24 Stunden aufbewahrt wurde, kann zu diagnostisch verwertbaren Ergebnissen führen. Als Alternative sind nähragarbeschichtete Objektträger-Eintauchkulturen = Urikulte (pro team ausgeteilt )anzusehen, mit deren Hilfe die Keimmenge zum Zeitpunkt der Uringewinnung festgehalten werden kann. Wird mit der Eintauchkultur nicht gleichzeitig der Urin eingesandt, können das Vorhandensein von Leukozyten und die Anwesenheit antibakterieller Stoffe nicht festgestellt werden. Die Gewinnung von Urin für die bakteriologische Untersuchung mittels eines nur zu diesem Zwecke gelegten Katheters sollte, wegen der Gefahr einer Keimverschleppung in die Blase, Fällen vorbehalten bleiben, in denen die Gewinnung eines sauberen Mittelstrahlurins nicht möglich ist. Die Katheterisierung der Harnblase muß unter Einhaltung aller Regeln der Asepsis erfolgen. Der Urin muß vor der antibakteriellen Chemotherapie gewonnen werden. Therapieerfolgskontrollen sind frühestens 3 Tage nach Absetzen des Therapeutikums sinnvoll. Blasenkatheterspitzen sind für die Diagnostik eines Harnwegsinfekts völlig ungeeignet. Urinentnahme bei einem Dauerkatheter sollte nur aus dem proximalen Katheterteil erfolgen, nie aus dem Urinbeutel. Bewertung der Untersuchungsergebnisse von Mittelstrahl- bzw. Katheterurin Für die Keimzahlbestimmung ( im Team an Sie ausgeteilt )werden 0,01 ml des aufgeschüttelten Urins auf eine Blut – Platte aufgebracht und möglichst gleichmäßig ausgespatelt. Zusätzlich wird in die Mitte der Platte ein Colistin Blättchen aufgelegt zur Differenzierung von Enterokokken, welche aufgrund ihrer Resistenz an das Blättchen heranwachsen. Nach mindestens 16 Stunden Bebrütung bei 36 C werden die Kolonien ausgezählt. Die Keimzahl wird in KBE (= koloniebildende Einheiten) pro ml Urin angegeben. Weniger als 103 KBE: Es liegt keine Bakteriurie vor; eine im Urin vorhandene bakteriostatisch bzw. bakterizid wirkende Substanz verhindert das Keimwachstum (siehe Ergebnis der Untersuchung auf antimikrobielle Wirkstoffe) oder der Erreger kann sich auf den angebotenen Nährmedien in der angebotenen Atmosphäre nicht vermehren. 103 - 104 KBE: Eine Bakteriurie mit Krankheitswert ist kaum anzunehmen, im Einzelfall aber nicht auszuschließen. 104 - 105 KBE: Das Vorliegen einer Bakteriurie mit Krankheitswert ist nicht ausgeschlossen. Keimzahlen über 104 im Katheterurin zeigen meistens eine Infektion an. Eine Kontrolleinsendung vor Therapiebeginn ist zu empfehlen. 105 KBE und mehr: Bei Mittelstrahlurin von Frauen ist auch bei guter Entnahmetechnik in ca. 20 % der Fälle mit einem falsch-positiven Ergebnis zu rechnen. Erst eine zweite Mittelstrahlurinprobe mit mehr als 105 KBE der gleichen Keimart zeigt mit 95 %iger Wahrscheinlichkeit eine Harnwegsinfektion an. Blasenpunktionsurin (sicher kontaminationsfrei) wird unter aseptischen Bedingungen entnommen, in ein steriles Röhrchen gefüllt und entweder sofort in das bakteriologische Labor gebracht oder im Kühlschrank bei 4 C höchstens 24 Stunden aufbewahrt. Bei Verdacht auf einen durch Anaerobier verursachten Harnwegsinfekt (gut dokumentierte Fälle sind in der Literatur eine Rarität) sind nur dann brauchbare Ergebnisse zu erwarten, wenn der Punktionsurin in der Spritze belassen und sofort in das Labor gebracht wird. Die Nadel wird durch einen aufgesteckten Kork- oder Gummistopfen gesichert. Für die Beurteilung des Untersuchungsergebnisses eines Blasenpunktionsurins gilt: Jeder Bakteriennachweis muss primär als pathologisch angesehen werden. Beispiel einer Instruktion für Patientinnen zur Gewinnung des Mittelstrahlurins Urin, der in irgendeinem Behälter von zu Hause mitgebracht wird, ist ungeeignet. Die Urinentnahme soll möglichst morgens, mindestens 3 Stunden nach dem letzten Wasserlassen erfolgen. Hände waschen mit Wasser und Seife, abtrocknen mit einem Einweghandtuch. Schamlippen spreizen und bis zum Abschluß der Uringewinnung geöffnet halten. Harnröhrenöffnung und deren Umgebung dreimal mit je einer frischen nassen Kompresse durch Wischen von vorn nach hinten säubern. Danach diesen Bereich durch Abtupfen mit trockenen Kompressen trocknen. Beim anschließenden Wasserlassen die erste Urinportion (ca. 30 ml) in die Toilette laufen lassen und erst dann wenigstens 10 ml Urin in einem sterilen Becher mit ausreichend großer Öffnung auffangen. Beispiel einer Instruktion für Patienten zur Gewinnung des Mittelstrahlurins Hände vorher sorgfältig mit Wasser und Seife waschen, mit Einweghandtuch trocknen. Vorhaut mit einer Hand vollständig zurückstreifen und mit der anderen die Umgebung der Harnröhrenöffnung mittels eines unter fließendem Wasser angefeuchteten Tupfers reinigen. Schließlich die Harnröhrenöffnung mit einem trockenen Tupfer trocknen. Die erste Urinportion (ca. 50 ml) in die Toilette entleeren, dann - ohne den Harnstrahl zu unterbrechen - ca. 5 ml Urin mit dem vorher griffbereit abgestellten Transportröhrchen auffangen. Das Röhrchen verschließen, ohne den Gefäßrand durch Hand, Kleidung usw. zu verunreinigen. Erst nachdem das Röhrchen verschlossen ist, äußere Verunreinigungen beseitigen. Prüfung des Urins auf antimikrobielle Stoffe im Hemmstofftest Sterile Filterblättchen von 6 mm Durchmesser werden auf Nähragarplatten aufgelegt, welche ca. 104 Sporen von Bacillus subtilis ATCC 6633 pro ml enthalten.Danach wird die Urinprobe auf das Blättchen pipettiert. In Abwandlung dieser Versuchsmethode können auch kleine Löcher in diese Platten gestanzt werden, in die 0,01 ml Urin getropft wird. Nach 18-stündiger Bebrütung der Platten wird die Ausbildung einer Hemmzone, unabhängig von ihrer Größe, als Nachweis antibakterieller Stoffe beurteilt. Proteus Kolonieform und –farbe Mikroskopisches Bild P. vulgaris: Indol O/ F Test Oxydase P.mirabilis: Klebsiella Pseudomonas Serratia E. coli Blutkulturen: Indikation: Nachweis von pathogenen Bakterien / Pilzen in physiologischerweise sterilen Körperflüssigkeiten ( z. B. Blut / Punktate ) sowie Sterilkontrolle von Blutprodukten und Nährmedien. Prinzip: Das BacT/Alert System ( Kulturautomat ) misst mit einem kolorimetrischen Sensor Farbänderungen des am Boden der Kulturflasche eingebrachten Indikators. Die Farbreaktion des Indikators wird durch CO2 ,das bei Wachstum von Bakterien bzw. Pilzen freigesetzt wird, hervorgerufen ( Verfärbung von grün nach gelb). Material Entnahmetechnik Transport/Lagerung Bemerkungen Blutkultur 1. Hautdesinfektion mit gelistetem Mittel (z.B. Skinsept). 30 sek. Einwirkzeit einhalten (palpierenden Finger auch desinfizieren!) Sofortiger Transport im Thermobehälter zum Labor. Bei Verzögerung Wärmeschrank 37C Entnahmezeitpunkt: Besonderheiten des jeweiligen Systems sind zu beachten Nach Möglichkeit vor Beginn der Antibiotikatherapie, mindestens zwei Proben entnehmen Wichtig: Ein einziges Blutkulturset ist nicht aussagekräftig! 2. Entnahmemenge: Erwachsene 20 ml pro BK-Set Kinder 2-5 ml pro BK-Set, Neugeborene 1-2 ml Blutentnahme aus zentralen Zugängen vermeiden Entnahmehäufigkeit: 2 Proben innerhalb von 24 h entnehmen. Bei antibiotisch vorbehandelten Patienten oder Fieber unklarer Genese sollten 4 Blutkulturen innerhalb von 48 h entnommen werden. Bei Verdacht auf Endokarditis 2 bis 3 Proben vor Beginn der Antibiotikatherapie. Mehr als 3 Proben-Sets pro Tag erhöhen nicht die Isolierungsrate! 3. Die entnommene Blutmenge in die zwei Flaschen anaerob und aerob injizieren (Stopfen vorher desinfizieren, Kanülen wieder entfernen). Verhältnis Blut zu Nährmedium 1:5-1:10. Immer zuerst anaerobe Flasche beimpfen (max. 10 ml/Flasche) Serum 5-10 ml Venenblut entnehmen und ohne Zusätze in steriles Blutröhrchen füllen Bis zum Transport Aufbewahrung bei 4C empfehlenswert, besonders in der warmen Jahreszeit Bei langem Transport Trennung des Serums vom Blutkuchen durch Zentrifugieren und Einsendung des Serums allein empfehlenswert Für Ihre Notizen: