Höchste Präzision mit Protonen
Werbung
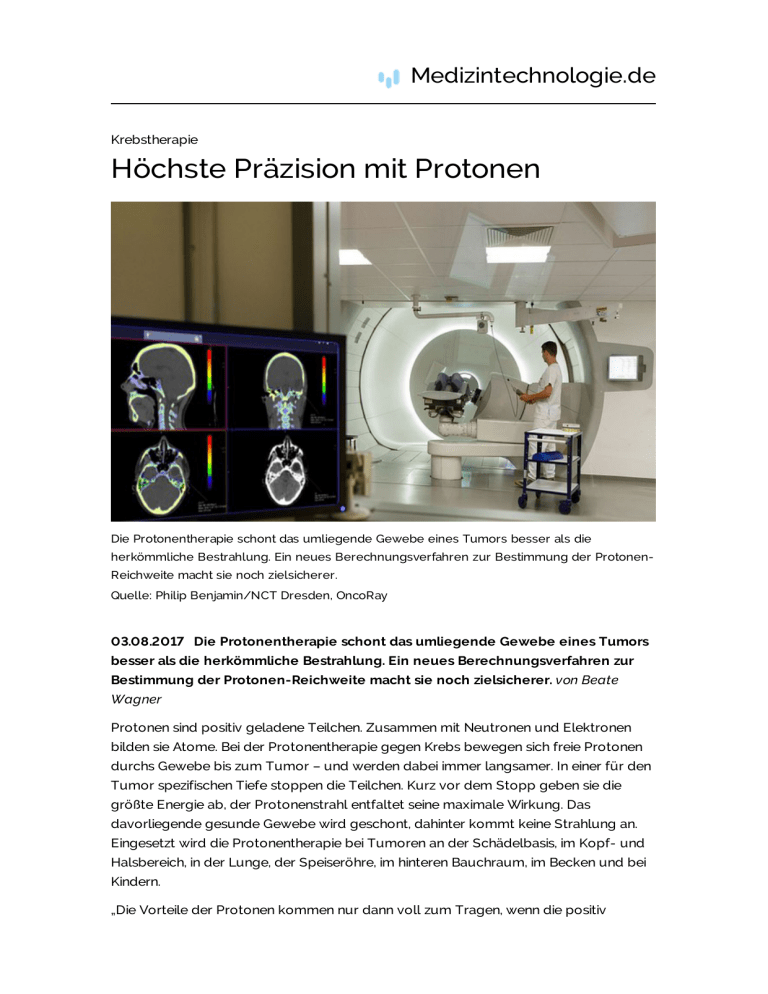
Medizintechnologie.de Krebstherapie Höchste Präzision mit Protonen Die Protonentherapie schont das umliegende Gewebe eines Tumors besser als die herkömmliche Bestrahlung. Ein neues Berechnungsverfahren zur Bestimmung der ProtonenReichweite macht sie noch zielsicherer. Quelle: Philip Benjamin/NCT Dresden, OncoRay 03.08.2017 Die Protonentherapie schont das umliegende Gewebe eines Tumors besser als die herkömmliche Bestrahlung. Ein neues Berechnungsverfahren zur Bestimmung der Protonen-Reichweite macht sie noch zielsicherer. von Beate Wagner Protonen sind positiv geladene Teilchen. Zusammen mit Neutronen und Elektronen bilden sie Atome. Bei der Protonentherapie gegen Krebs bewegen sich freie Protonen durchs Gewebe bis zum Tumor – und werden dabei immer langsamer. In einer für den Tumor spezifischen Tiefe stoppen die Teilchen. Kurz vor dem Stopp geben sie die größte Energie ab, der Protonenstrahl entfaltet seine maximale Wirkung. Das davorliegende gesunde Gewebe wird geschont, dahinter kommt keine Strahlung an. Eingesetzt wird die Protonentherapie bei Tumoren an der Schädelbasis, im Kopf- und Halsbereich, in der Lunge, der Speiseröhre, im hinteren Bauchraum, im Becken und bei Kindern. „Die Vorteile der Protonen kommen nur dann voll zum Tragen, wenn die positiv geladenen Wasserstoffkerne genau an der richtigen Stelle im Körperinneren stoppen“, sagt Christian Richter, Medizinphysiker und Leiter der Gruppe „Hochpräzisionsstrahlentherapie“ am OncoRay-Zentrum und am Helmholtz-Zentrum Dresden-Rossendorf. „Um einen Tumor im Körperinnern so präzise wie möglich zu bestrahlen, müssen wir die genauen Gewebeeigenschaften vor der Bestrahlung analysieren, daraus resultiert die exakte Eindringtiefe der Protonen.“ Dual-Energy Computertomografie ist genauer Bisher nutzen Experten für diese Bestrahlungsplanung standardmäßig eine Computertomografie (CT). Weltweit erstmals ändern die Fachleute des OncoRayZentrums aufgrund konkreter Forschungsergebnisse nun dieses Vorgehen: Richters Team konnte belegen, dass die sogenannte Dual-Energy Computertomografie (DECT) weitaus konkretere Informationen liefert. Die Grauwerte der Standard-CTs lassen sich zwar in ein Bremsvermögen übersetzen. „Wir können aber beispielsweise bestimmte Gewebe nicht voneinander unterscheiden“, so Richter. Anders die Dual-Energy-Methode: Das Verfahren liefert jeweils zwei CT-Aufnahmen, die mit unterschiedlichen Röntgen-Energien erzeugt werden. „Aus den DECT-Scans erkennen wir unterschiedliche Wechselwirkungen der Röntgenstrahlung – und können so auf spezifische Gewebeeigenschaften zurückschließen“, sagt Richter. Er ist überzeugt: „Durch die gewonnenen Zusatzinformationen aus der Dual-Energy-CT kann die Planung und Behandlung präziser und patientenindividueller werden.“ Aufwendige Verifizierung Zunächst musste das Verfahren aber in einem aufwendigen Verifizierungsprozess getestet werden, das mit der Einführung der DECT-Methode 2015 begann. „Anfangs erfolgte die Reichweiteberechnung, das heißt, wie tief die Protonen ins Körperinnere vordringen, noch basierend auf der Standard-CT“, sagt Patrick Wohlfahrt. Der Doktorand aus Richters Team hat den Verifizierungsprozess maßgeblich durchgeführt. „Im nächsten Schritt haben wir die Daten dann mit denen der hochpräzisen DECTMethode verglichen.“ Insgesamt standen in der Datenbank rund 2.000 Aufnahmen aus dem Patienteninnern zur Verfügung. Zur Auswertung der DECT-Bilder nutzten die Wissenschaftler ein neues präzises Berechnungsverfahren, das Forscher des Deutschen Krebsforschungszentrums (DKFZ) als Teil des Heidelberger Instituts für Radioonkologie (HIRO) entwickelten. Mit diesem Algorithmus lässt sich das Bremsvermögen des Gewebes in jedem Bildpunkt bestimmen. Protonen dringen vier Millimeter weiter vor Der Vergleich der Daten hat sich gelohnt: Mithilfe der DECT zeigte sich deutlich, dass die Bestrahlungsplanung basierend auf der herkömmlichen CT-Aufnahme klinisch relevante Abweichungen erzeugt. „Die Protonen dringen bei tief liegenden Tumoren etwa vier Millimeter weiter in den Körper ein, als es unsere bisherigen Berechnungen voraussagen. Dies berücksichtigen wir derzeit in Form eines zusätzlichen Sicherheitssaumes um den Tumor“, erklärt Richter. „Mit DECT können wir diesen in Zukunft sehr wahrscheinlich verringern und somit mehr gesundes Gewebe schonen.“ Von den Erkenntnissen der DECT-Forschung profitieren seit Juli 2017 rund Dreiviertel aller Patienten an der Dresdner Protonentherapie. Außerdem konnten die Dresdner Forscher zeigen, dass auch die individuelle Gewebezusammensetzung einzelner Patienten für die Strahlentherapie relevante Unterschiede mit sich bringt. Die DECT-basierte Reichweitenvorhersage kann dies berücksichtigen – und die Therapie passgenau machen. Ein in Zusammenarbeit mit Siemens entwickelter Prototyp, der den innovativen Algorithmus klinisch anwendbar macht, soll in Dresden 2018 eingeführt werden.