K3101_P_isotope - HMTC - Halbmikrotechnik Chemie GmbH
Werbung
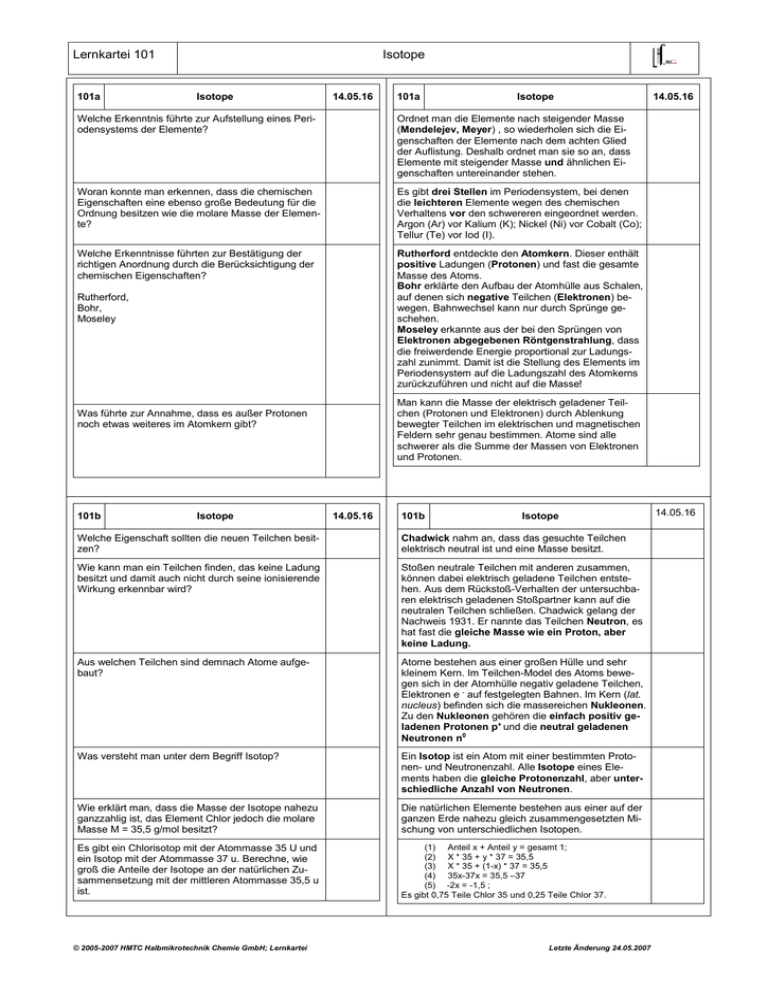
Lernkartei 101 101a Isotope Isotope 14.05.16 101a Isotope Welche Erkenntnis führte zur Aufstellung eines Periodensystems der Elemente? Ordnet man die Elemente nach steigender Masse (Mendelejev, Meyer) , so wiederholen sich die Eigenschaften der Elemente nach dem achten Glied der Auflistung. Deshalb ordnet man sie so an, dass Elemente mit steigender Masse und ähnlichen Eigenschaften untereinander stehen. Woran konnte man erkennen, dass die chemischen Eigenschaften eine ebenso große Bedeutung für die Ordnung besitzen wie die molare Masse der Elemente? Es gibt drei Stellen im Periodensystem, bei denen die leichteren Elemente wegen des chemischen Verhaltens vor den schwereren eingeordnet werden. Argon (Ar) vor Kalium (K); Nickel (Ni) vor Cobalt (Co); Tellur (Te) vor Iod (I). Welche Erkenntnisse führten zur Bestätigung der richtigen Anordnung durch die Berücksichtigung der chemischen Eigenschaften? Rutherford entdeckte den Atomkern. Dieser enthält positive Ladungen (Protonen) und fast die gesamte Masse des Atoms. Bohr erklärte den Aufbau der Atomhülle aus Schalen, auf denen sich negative Teilchen (Elektronen) bewegen. Bahnwechsel kann nur durch Sprünge geschehen. Moseley erkannte aus der bei den Sprüngen von Elektronen abgegebenen Röntgenstrahlung, dass die freiwerdende Energie proportional zur Ladungszahl zunimmt. Damit ist die Stellung des Elements im Periodensystem auf die Ladungszahl des Atomkerns zurückzuführen und nicht auf die Masse! Rutherford, Bohr, Moseley Man kann die Masse der elektrisch geladener Teilchen (Protonen und Elektronen) durch Ablenkung bewegter Teilchen im elektrischen und magnetischen Feldern sehr genau bestimmen. Atome sind alle schwerer als die Summe der Massen von Elektronen und Protonen. Was führte zur Annahme, dass es außer Protonen noch etwas weiteres im Atomkern gibt? 101b Isotope 14.05.16 101b Isotope Welche Eigenschaft sollten die neuen Teilchen besitzen? Chadwick nahm an, dass das gesuchte Teilchen elektrisch neutral ist und eine Masse besitzt. Wie kann man ein Teilchen finden, das keine Ladung besitzt und damit auch nicht durch seine ionisierende Wirkung erkennbar wird? Stoßen neutrale Teilchen mit anderen zusammen, können dabei elektrisch geladene Teilchen entstehen. Aus dem Rückstoß-Verhalten der untersuchbaren elektrisch geladenen Stoßpartner kann auf die neutralen Teilchen schließen. Chadwick gelang der Nachweis 1931. Er nannte das Teilchen Neutron, es hat fast die gleiche Masse wie ein Proton, aber keine Ladung. Aus welchen Teilchen sind demnach Atome aufgebaut? Atome bestehen aus einer großen Hülle und sehr kleinem Kern. Im Teilchen-Model des Atoms bewegen sich in der Atomhülle negativ geladene Teilchen, Elektronen e - auf festgelegten Bahnen. Im Kern (lat. nucleus) befinden sich die massereichen Nukleonen. Zu den Nukleonen gehören die einfach positiv geladenen Protonen p+ und die neutral geladenen Neutronen n0 Was versteht man unter dem Begriff Isotop? Ein Isotop ist ein Atom mit einer bestimmten Protonen- und Neutronenzahl. Alle Isotope eines Elements haben die gleiche Protonenzahl, aber unterschiedliche Anzahl von Neutronen. Wie erklärt man, dass die Masse der Isotope nahezu ganzzahlig ist, das Element Chlor jedoch die molare Masse M = 35,5 g/mol besitzt? Die natürlichen Elemente bestehen aus einer auf der ganzen Erde nahezu gleich zusammengesetzten Mischung von unterschiedlichen Isotopen. Es gibt ein Chlorisotop mit der Atommasse 35 U und ein Isotop mit der Atommasse 37 u. Berechne, wie groß die Anteile der Isotope an der natürlichen Zusammensetzung mit der mittleren Atommasse 35,5 u ist. (1) Anteil x + Anteil y = gesamt 1; (2) X * 35 + y * 37 = 35,5 (3) X * 35 + (1-x) * 37 = 35,5 (4) 35x-37x = 35,5 –37 (5) -2x = -1,5 ; Es gibt 0,75 Teile Chlor 35 und 0,25 Teile Chlor 37. © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei 14.05.16 Letzte Änderung 24.05.2007 14.05.16 Lernkartei 101 101c Isotope Isotope 14.05.16 101c Isotope Um für Isotope auch Symbole benutzen zu können, werden die chemischen Symbole mit zwei Zahlen ergänzt. Das Symbol Cl steht für die chemische Bezeichnung eines Chlor-Atoms. Die vor dem Symbol tief gestellte Zahl ist die Protonenzahl. Welche Angaben kann man aus diesem Symbol ablesen? Die vor dem Symbol hoch gestellte Zahl gibt die Anzahl der Nukleonen im Kern an. Dieses ChlorAtom besitzt 35 Nukleonen. 14.05.16 Die Differenz der Nukleonenzahl und der Protonenzahl gibt die Anzahl der Neutronen an. Dieses Chlor-Atom besitzt also 15 Neutronen. Außerdem besitzt dieses Chloratom in seiner Atomhülle noch 17 Elektronen, weil es sich um ein elektrisch neutrales Atom handelt. Die Anzahl der Protonen, hier 17, ist auch die Ordnungszahl des Elements Chlor in seiner Stellung im Periodensystem. Alle Chlor-Atome besitzen 17 Protonen im Kern. Die drei Isotope des Wasserstoffs haben eigenen Namen? Wie heißen sie und wodurch unterscheiden sie sich? Der „leichte Wasserstoff“ besteht aus Atomen mit nur einem Proton im Kern (selten „Protium“ genannt). Der „schwere Wasserstoff“, auch Deuterium genannt, hat einen Atomkern mit einem Proton und einem Neutron (0,015% in der Natur). Der „überschwere Wasserstoff“, Tritium genannt, hat einen Atomkern mit einem Proton und zwei Neutronen. Was versteht man unter „schwerem Wasser“? Als „schweres Wasser“ bezeichnet man Wasser, das zwei Deuterium-Atome besitzt: D2O 101d Isotope 14.05.16 101d Isotope Welche Bedeutung hat das Deuterium in der Chemie? Deuterium ist ein stabiles Isotop des Wasserstoffs. Man kann gezielt leichte Wasserstoffatome gegen Deuterium austauschen. Im weiteren Verlauf chemischer Reaktionen kann man dann mit einem Massenspektrometer den Verbleib des Deuteriums untersuchen. Das macht man zum Beipiel bei Medikamenten. Diese wirken dann chemisch normal weiter, lassen sich aber mit einem Massenspektrometer im Stoffwechsel wiederfinden. Auf diese Art kann man den Wirkungsmechanismus und Nebenwirkungen besser abschätzen. Welche Bedeutung hat das Deuterium und Tritium in der Physik? Mit Deuterium und Tritium wird zur Zeit untersucht, ob mit diesen beiden Isotopen die Energieproduktion der Sonne (Kernverschmelzung, „Wasserstoff-Bombe“) technisch beherrschbar in Kernkraftwerken nutzbar ist. Welche militärische Bedeutung haben die Wasserstoffisotope? Besonders das Wasserstoffisotop Deuterium wird für die sogenannte Wasserstoff-Bomben eingesetzt. Man bringt dazu in das Zentrum einer Atombombe eine kleine Portion Lithiumdeuterid LiD. Durch die ungeheuer großen Temperatur und Drucke werden die Lithium und Deuterium-Atome zu Helium-Atomen umgewandelt. Dabei wird etwa das 1000fache der Atombomben-Energie zusätzlich frei. © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei Letzte Änderung 24.05.2007 14.05.16 Lernkartei 101 101e Isotope Uran-Isotope 14.05.16 101e Uran-Isotope Aus welchen natürlichen Isotope besteht das Uran? Wie ist die Zusammensetzung der Urankerne? Uran hat die Ordnungszahl 92. Es besteht demnach aus 92 Protonen im Kern. Natürliche Uran-Isotope haben die Nukleonenzahl U-238 (99,2%) und U-235 (0,8%). Das U-238 besitzt daher (239-92) = 147 Neutronen, das U-235 besitzt (235-92) = 143 Neutronen. Wer entdeckte die Kernspaltung schwerer Atomkerne? Unter welchen Bedingungen tritt die Kernspaltung auf? Otto Hahn und Hugo Strassmann entdeckten, das langsame (thermische) Neutronen vom U-235 eingefangen werden. Daraufhin bildet sich das instabile U236-Isotop. Dieses zerfällt in einigen Minuten bis Stunden zu zwei Bruchstücken, die in der Regel aus einem Bruchstück mit der Masse um 140 und einem mit der Masse um 90 bestehen. Hahn und Strassmann identifizierten durch Mitfällung von Barium, den Zerfall in Barium-139 und Kryton-94. Hierbei werden drei Neutronen und erhebliche Mengen Energie frei. Was versteht man unter Mitfällung? Wenn man zu einer homogenen Lösung, in der man wenige Erdalkali-Atome von Radium vermutet, größere Mengen des homologen Elements Barium hinzugibt und dann mit Schwefelsäure das Barium als Sulfat fällt, sollten die wenigen Radiumatome mit gefällt werden und sich dabei anreichern. Unter welchen Bedingungen entwickelt sich eine Kettenreaktion? U-235 zerfällt nach einem Einfang thermischer Neutronen in kurzer Zeit, U-238 zerfällt dagegen nur sehr langsam. Um eine Kettenreaktion in Gang zu setzten, sollte das U-235 zu einem Anteil von mehr als 4% um Uran angereichert sein. Auch muss man die freiwerdenden schnellen Neutronen durch Stöße abgebremst werden, damit sie von U-235 absorbiert werden können. Das geschieht durch Paraffin (Hahn und Strassmann), schweres Wasser oder Graphit. 101f Isotope Wie wird das Uran-235 angereicht? Welche chemische Reaktion wird zur Herstellung von Uranhexafluorid verwendet? Warum ist das Element Fluor für Zentrifugentrennung des Urans besonders gut geeignet? © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei 14.05.16 101f Uran-Isotope Die Anreicherung von U-235 von 0,8% auf über 4% geschieht in Gaszentrifugen, die ähnlich gebaut sind wie Zetrifugenstaubsauger. Das Gas Uranhexafluorid UF6 wird zusammen mit Wasserstoff H2 in Zentrifugen in schnelle Rotation versetzt. Dabei tritt das etwas schwerere 238UF6 durch die größeren Fliehkräfte an der Wand häufiger auf, das leichtere 235UF6 wird dagegen in der Mitte angereichert. Da der Masseunterschied relativ klein ist (weniger 1%), müssen sehr viele Zentrifugen hintereinander geschaltet werden , um die Anreicherung auf 4% zu erhalten. Das natürliche Uran wird zunächst in Urantrioxid UO3 umgewandelt und greinigt. Anschließend wird das feste Uranoxid mit Flusssäure (HF,aq) in gasförmiges Uranhexafluorid umgesetzt. UO3 + 6HF --> UF6 + 3 H2O Das natürliche Element Fluor besteht zu fast 100% aus dem Isotop 19F. Dadurch wird die Massedifferenz von UF6 ausschlißlich durch die Uranisotope bestimmt. Letzte Änderung 24.05.2007 14.05.16 14.05.16











