Übungsfragen zur Lernzielkontrolle Kleinste Teilchen
Werbung

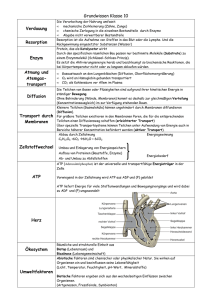
Übungsfragen zur Lernzielkontrolle Kleinste Teilchen, Stoffumwandlung 1. Warum bedient man sich in der Chemie Modellen? 2. Warum erhalten wir beim Mischen von reinem Alkohol mit Wasser im Volumenverhältnis 1:1 weniger als das doppelte Gesamtvolumen? 3. Beschreibe, wie wir uns ein kleinstes Teilchen vorstellen müssen. 4. Wie kommt es zur Diffusion? 5. Welches ist der absolute Nullpunkt? 6. Warum lassen sich feste Stoffe nur sehr schwer zusammendrücken? Erkläre dies anhand des Modells der kleinsten Teilchen. 7. Warum halten die Feststoffe besser zusammen als die flüssigen Stoffe? 8. Erkläre, warum beim Schmelzen eines Stoffes die Temperatur erst dann wieder ansteigt, wenn der gesamte Stoff flüssig ist. 9. Erkläre anhand des Teilchenmodells die Verdunstung. 10. Warum lösen sich Stoffe in warmen Lösungsmitteln rascher als in kälteren? (Erkläre anhand des Teilchenmodells.) Stoffumwandlung 11. Was zeichnet eine chemische Reaktion im Vergleich zu einem physikalischen Vorgang aus? 12. Was ist die „Analyse“ in der Chemie? 13. Wie wird folgendes Reaktionsschema korrekt ausgesprochen? Na+ClNaCl 14. Wie nennt man das Reaktionsprodukt von Blei Pb mit Schwefel S? 15. Was ist eine exotherme Reaktion? 16. Was ist eine Aktivierungsenergie? Nenne 3 verschiedene Aktivierungsenergien und je ein Beispiel einer chemischen Reaktion, die dadurch gestartet wird. ©Chemie M. Hügli Lösungen 1. Die chemischen Reaktionen passieren auf einer Ebene, die auch mit technischen Mitteln nicht sichtbar gemacht werden kann. Um sich aber trotzdem vorstellen zu können, wie sich die kleinsten Teilchen miteinander verbinden oder trennen, arbeitet man in der Chemie mit Modellen. 2. Wir stellen uns vor, dass die kleinsten kugelförmigen Teilchen des Wassers kleiner sind als diejenigen des Alkohols. So füllen die kleinsten Teilchen des Wassers bis zu einem bestimmten Grad die Lücken des Alkohols aus. Dadurch verringert sich das Volumen der beiden gemischten Flüssigkeiten um etwa 2%. 3. Wir stellen uns die kleinsten Teilchen als ganz kleine Kugeln vor, die innerhalb eines gleichen Stoffes die gleiche Masse und auch die gleiche Grösse haben. 4. Die kleinsten Teilchen eines jeden Stoffes bewegen sich dauernd, sofern die Temperatur des Stoffes über dem absoluten Nullpunkt von -273°C liegt. Durch diese unsichtbare Bewegung der kleinsten Teilchen verteilen sich die einzelnen Stoffe. Dies geschieht zur Hauptsache in flüssigen und gasförmigen Stoffen, weil sich die kleinsten Teilchen der festen Stoffe weniger schnell bewegen und sehr dicht beieinander liegen. Das Verteilen von Stoffen im Raum oder in einer Flüssigkeit, ohne Einwirkung einer Kraft von aussen, bezeichnet man als Diffusion. 5. Der absolute Nullpunkt, also die Temperatur, bei der sich die kleinsten Teilchen nicht mehr bewegen, liegt bei -273°C. 6. Bei festen Stoffen liegen die kleinsten Teilchen sehr dicht beieinander, darum fällt es schwer, diese durch das Drücken auf den Stoff noch näher zueinander zubringen. Die Teilchen liegen sehr nah beisammen, weil erstens die Anziehungskräfte zwischen den Teilchen sehr gross sind und zweitens weil sich die kleinsten Teilchen bei festen Stoffen weniger schnell bewegen als bei flüssigen und gasförmigen Stoffen. 7. Die kleinsten Teilchen üben bei festen Stoffen stärkere Anziehungskräfte untereinander aus als bei flüssigen und gasförmigen Stoffen. Darum sind die kleinsten Teilchen bei festen Stoffen näher zusammen. Auch die geringere Bewegung der kleinsten Teilchen bei Feststoffen sorgt für einen besseren Zusammenhalt des Stoffes. 8. Der Unterschied zwischen einem festen und einem flüssigen Stoff besteht primär darin, dass sich die Abstände zwischen den kleinsten Teilchen unterscheiden. Die Abstände können dadurch vergrössert werden, dass die Teilchen erhitzt werden und sich somit schneller bewegen. Der feste Stoff wird also nun erhitzt. Die kleinsten Teilchen beginnen schneller zu schwingen und allmählich vergrössern einzelne Teilchen die Abstände untereinander, der Stoff wird an dieser Stelle also flüssig. Nun ist es aber nicht möglich, den Stoff weiter zu erwärmen, bis nicht der gesamte Stoff ©Chemie M. Hügli flüssig ist, weil die Energie (Wärmezufuhr) benötigt wird um die Abstände der kleinsten Teilchen des noch festen Teil des Stoffes zu vergrössern. Erst wenn alle Abstände der kleinsten Teilchen des gesamten Stoffes vergrössert wurden, der Stoff also komplett flüssig ist, kann die Temperatur des Stoffes wieder steigen. 9. Da die kleinsten Teilchen in dauernder Bewegung sind, können Teilchen von flüssigen Stoffen den Stoff verlassen. Sie werden in das andere Medium, zum Beispiel Luft, geschleudert und von diesem aufgenommen. 10. In wärmeren Stoffen bewegen sich die kleinsten Teilchen rascher als in kälteren. Diese Bewegung der Teilchen hilft nun zusätzlich beim Durchmischen des zu lösenden Stoffes im Lösungsmittel. 11. Um eine chemische Reaktion auszulösen benötigt man immer eine Aktivierungsenergie in Form von Wärme, Licht, elektrischem Strom etc. Bei einer chemischen Reaktion werden immer die Stoffeigenschaften der Ausgangsstoffe dauerhaft verändert. Das heisst, es entstehen neue Stoffe. Aggregatszustandsänderungen sind physikalische Vorgänge, weil sich die Stoffeigenschaften dabei nicht dauerhaft verändern. Liegt nämlich der Stoff wieder bei der gleichen Temperatur vor einem, hat er wieder die identischen Stoffeigenschaften wie vor dem Erwärmen oder abkühlen. Eventuelle Stoffeigenschaftsveränderungen, wie zum Beispiel die Farbe, sind also nur vorübergehend und nicht dauerhaft wie bei chemischen Reaktionen. 12. Als „Analyse“ bezeichnet man das Aufteilen eines Reinstoffes in die einzelnen Elemente. Der Reinstoff Zucker C12H22O11(mit einer für genau diesen Stoff typischen Stoffeigenschaftskombination) wird durch die Analyse in die Elemente Kohlenstoff C, Wasserstoff H und Sauerstoff O aufgeteilt. Diese drei Elemente haben alle für sich eine typische Stoffeigenschaftskombination, haben also mit dem Ausgangsstoff Zucker nichts mehr gemeinsam. 13. Natrium uns Chlor reagieren zu Natriumchlorid (Kochsalz) 14. Bleisufid 15. Bei einer „exothermen“ Reaktion wird während des Verlaufs der chemischen Reaktion mehr Energie zum Beispiel in form von Wärme und Licht freigegeben als für die Aktivierung der Reaktion benötigt wurde. Wenn man beispielsweise ein Lagerfeuer entzündet so benötigt man dafür nur während einer kurzen Zeit eine kleine Flamme (Wärmeenergie). Während der Reaktion (die Zeit während der das Feuer brennt) wird aber viel mehr Energie in Form von Wärme und Licht freigegeben. 16. Die Aktivierungsenergie wird benötigt um eine chemische Reaktion auszulösen. Durch diese Energie gelingt es uns, mehrere Stoffe miteinander zu verbinden oder voneinander zu trennen. Lichtenergie (Bei der analogen Fotografie wird eine dünne Schicht eines Stoffes (Silberhalogenid, Beispiel: Silberbromid) während einer kurzen Zeit dem Licht ausgesetzt ©Chemie M. Hügli (Belichtungszeit). In dieser Zeit verändert sich der Stoff an der Stelle an der Licht auf ihn gefallen ist. Wärmeenergie: Ein Papier wird durch ein Feuerzeug angezündet. Elektrische Energie: Ein Minus- und ein Pluspol eines Stromkreises wird ins Wasser gelegt. Durch die sogenannte Elektrolyse lässt sich nun Wasser H2O in die Elemente Wasserstoff H und Sauerstoff O aufteilen. ©Chemie M. Hügli