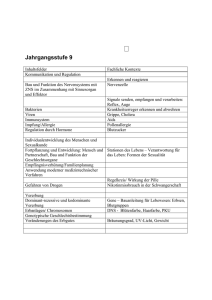
Dokument_28
Werbung

Identifizierung und funktionelle Charakterisierung von SGK1 als neues Zielgen der Wnt-Signaltransduktion Den Naturwissenschaftlichen Fakultäten der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades vorgelegt von Manuel Dehner aus Rothenburg o. d. Tauber Als Dissertation genehmigt von den Naturwissenschaftlichen Fakultäten der Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 11. April 2008 Vorsitzender der Prüfungskommission: Prof. Dr. Eberhard Bänsch Erstberichterstatter: Prof. Dr. Jürgen Behrens Zweitberichterstatter: PD. Dr. Robert Slany INHALTSVERZEICHNIS 1 Inhaltsverzeichnis 1 INHALTSVERZEICHNIS 3 2 SUMMARY 6 3 ZUSAMMENFASSUNG 7 4 EINLEITUNG 8 4.1 Der Wnt-Signaltransduktionsweg 8 4.1.1 Klassischer Wnt-Signalweg 4.1.2 Rolle des klassischen Wnt-Signalweges in der kolorektalen Karzinogenese 11 4.1.3 Nicht kanonische Wnt-Signalkaskaden 12 4.1.4 Der Wnt-Signalweg in anderen Spezies 12 4.2 SGK1 - Serum und Glucocorticoid induzierbare Kinase 1 8 13 4.2.1 Proteinkinasen und ihre Regulation 13 4.2.2 Funktion und Regulation von SGK 14 4.3 Die Transkriptionsfaktoren Forkhead Box O (FoxO) 16 4.3.1 Die Fox-Familie 16 4.3.2 Die Gruppe der FoxO-Proteine 17 4.3.3 Regulation von FoxO-Transkriptionsfaktoren 18 4.3.4 Aktivierung von Zielgenen durch FoxO3a 21 5 ZIELSETZUNG 22 6 ERGEBNISSE 23 6.1 Identifikation von SGK1 als neues Zielgen des Wnt-Signalweges 23 6.1.1 Regulation der Expression von SGK1 durch den Wnt-Signalweg 23 6.1.2 Regulation des SGK1-Promotors durch den Wnt-Signalweg 28 6.2 Regulation von Transkriptionsfaktoren der FoxO-Familie durch den Wnt-Signalweg 32 6.2.1 Einfluss des Wnt-Signalweges auf die Lokalisation von FoxO3a 32 6.2.2 Einfluss des Wnt-Signalweges auf die transkriptionelle Aktivität von FoxO3a 36 6.2.3 Regulation der transkriptionellen Aktivität von FoxO3a durch den Wnt-Signalweg in HEK293T und LS174T 40 3 INHALTSVERZEICHNIS 6.3 Regulation der FoxO3a Aktivität durch den Wnt-Signalweg über SGK1 6.4 Analyse der Spezifität von Regulatoren des Wnt-Signalweges in Bezug auf die Regulation der 6.5 transkriptionellen Aktivität von FoxO3a 47 Veränderung der Apoptoserate durch den Wnt-Signalweg 49 6.5.1 Einfluss des Wnt-Signalweges auf die Transkription der FoxO3a-Zielgene Bcl2-interacting 6.5.2 7 42 mediator (BIM) und p27KIP1 49 Inhibierung der FoxO3a-induzierten Apoptose durch den Wnt-Signalweg 51 DISKUSSION 53 7.1 Neues Zielgen des Wnt-Signalweges: SGK1 53 7.2 Direkte oder indirekte Regulation von SGK1 durch den Wnt-Signalweg 54 7.3 Regulation von FoxO3a durch den Wnt-Signalweg über SGK1 55 7.4 Einfluss des Wnt-Signalweges auf die FoxO3a-induzierte Apoptose 58 7.5 SGK1 und Tumorigenese 59 7.5.1 Möglicher Einfluss auf die Tumorigenese von SGK1 durch die Regulation von epithelialen 7.5.2 Natriumkanälen (ENaC) 59 Veränderungen des Expressionsprofils von SGK1 im Verlauf der Tumorigenese 60 7.6 Fox-Proteine und Tumorigenese 61 7.7 Der Wnt-Signalweg und Tumorigenese 63 8 MATERIAL UND METHODEN 8.1 Material 65 65 8.1.1 Puffer und Lösungen 65 8.1.2 Weitere Reagenzien und Enzyme 68 8.1.3 Verbrauchsmaterialien 70 8.1.4 Geräte 70 8.1.5 Oligonukleotide 71 8.1.5.1 Oligonukleotide zur Analyse der Expression von Genen 71 8.1.5.2 Oligonukleotide für Klonierungen 71 8.1.5.3 Oligonukleotide für Sequenzierungen 73 8.1.5.4 Small interfering RNA Oligonukleotide 73 8.1.6 Organismen 74 8.1.7 Antikörper 74 4 INHALTSVERZEICHNIS 8.1.8 8.2 Vektoren Methoden 75 80 8.2.1 Anzucht von Bakterien 80 8.2.2 Herstellung kompetenter Bakterien 80 8.2.3 Transformation von Bakterien 81 8.2.4 Plasmidisolierung aus Bakterien 81 8.2.5 Extraktion von DNA aus TAE-Agarosegelen 81 8.2.6 DNA-Reinigung und Fällung 82 8.2.7 Bestimmung der DNA- bzw. RNA-Konzentration 82 8.2.8 Sequenzierung von DNA-Fragmenten 82 8.2.9 Kultur und Transfektion von Säugerzellen 83 8.2.10 Zählen von Zellen und Anlegen von Dauerkulturen 83 8.2.11 Transiente Transfektion 83 8.2.12 Reporterassays 84 8.2.13 SDS-PAGE und Western Blot Analyse 84 8.2.14 RNA-Isolierung 85 8.2.15 Reverse Transkriptase-PCR (RT-PCR) 85 8.2.16 Polymerase-Ketten-Reaktion (PCR) für Klonierungen 86 8.2.17 Kolonie-PCR 87 8.2.18 DNA-Microarrays und Analyse der Expression von Genen 87 8.2.19 Quantitative Echtzeit-PCR (real time RT-PCR) 88 8.2.20 Immunfluoreszenzfärbung von Zellen 89 8.2.21 Apoptose Messung, TUNEL 89 9 ABKÜRZUNGSVERZEICHNIS 91 9.1 Abkürzungen 91 9.2 Aminosäuren 93 9.3 Dimensionen 93 9.4 Einheiten 94 10 ANHANG 95 10.1 Ergebnisse der DNA-Microarray Analyse im HCT116 (RNAi)-System 95 10.2 Ergebnisse der DNA-Microarray Analyse im DLD1-dnTCF4 (-/+dox)-System 96 11 LITERATURVERZEICHNIS 102 5 SUMMARY 2 Summary β-catenin is the major effector of the canonical Wnt signaling pathway. Mutations in components of the pathway that stabilize β-catenin result in augmented gene transcription and play a major role in human cancer. To clarify the role of stabilized β-catenin in colorectal carcinogenesis, the aim of this study was to search for genes involved in the β-catenin/Tcf signaling and analyze their role in tumorigenesis. Serum- and glucocorticoid-inducible kinase 1 (SGK1) was identified as a new target gene of the Wnt signaling pathway. When the pathway was superactivated by ablation of APC in HCT116 cells, which have a stabilized mutated form of β-catenin, SGK1 was one of the most upregulated genes as determined by DNA microarray analysis. Concomitant Knock-Down of β-catenin showed the specific regulation of SGK1 by β-catenin. The regulation of SGK1 by Wnt signaling was confirmed by quantitative real-time RT-PCR and Western blot analysis in several cellular systems in which the β-catenin signaling was activated or inhibited at different levels of the pathway. In addition promoter reporter experiments confirmed the βcatenin dependent regulation of SGK1. A known function of SGK1 is to negatively regulate the pro-apoptotic transcription factor FoxO3a via phosphorylation. In immunofluorescence experiments it was observed that Wnt signaling leads to the exclusion of FoxO3a out of the nucleus. Reportergen experiments showed that this Wnt mediated effect on FoxO3a localization has also an influence on the transcriptional activity of FoxO3a. Wnt signaling inhibits the transcriptional activity of FoxO3a, and also of the promoter reporter constructs of two FoxO target genes, BIM and p27KIP1. A FoxO3a mutant which cannot be regulated by SGK1 anymore was employed and compared with wild type FoxO3a in immunofluorescence and reporter analyses. The results indicate that the observed effects are mediated via the upregulation of SGK1 and subsequent phosphorylation of FoxO3a. Furthermore, to assess apoptosis TUNEL experiments were performed and could reveal the inhibition of FoxO3a-induced apoptosis by Wnt signaling. These results indicate that via the upregulation of SGK1 the Wnt signaling pathway contributes to colorectal cancer not only via activation of proliferation but also by inhibition ofapoptosis. 6 ZUSAMMENFASSUNG 3 Zusammenfassung β-Catenin ist das zentrale Signalmolekül innerhalb der kanonischen Wnt-Signaltransduktion. Mutationen von Komponenten dieses Signalweges, die eine Stabilisierung von β-Catenin und somit eine gesteigerte Transkription der Zielgene zur Folge haben, spielen eine entscheidende Rolle im humanen Krebs. Um die Rolle von stabilisiertem β-Catenin in der kolorektalen Karzinogenese weiter aufzuklären, war das Ziel dieser Arbeit nach neuen Zielgenen von βCatenin zu suchen und deren Funktion in der Tumorigenese zu erforschen. Serum- und Glucocorticoid induzierbare Kinase 1 (SGK1) wurde als neues Zielgen des Wnt-Signaltransduktionsweges identifiziert. In DNA Microarray Analysen war SGK1 eines der am stärksten regulierten Gene bei einer siAPC-vermittelten Superaktivierung des WntSignalweges in HCT116 Zellen, die bereits stabilisiertes β-Catenin haben. Die spezifische Regulation von SGK1 durch β-Catenin wurde durch einen simultanen Knock-Down von APC und β-Catenin nachgewiesen. Die Regulation von SGK1 durch die Wnt-Signaltransduktion wurde mittels quantitativer Echtzeit-PCR und Westernblot Analyse bestätigt. Diese Untersuchungen wurden in verschiedenen zellulären Systemen, in denen der Signalweg auf unterschiedlichen Ebenen aktiviert oder blockiert werden konnte, durchgeführt. Zusätzlich bekräftigen Promotorreportergen-Experimente eine β-Catenin/TCF abhängige Regulation von SGK1. Eine bekannte Funktion von SGK1 ist, den pro-apoptotischen Transkriptionsfaktor FoxO3a durch Phosphorylierung negativ zu regulieren. Nach Aktivierung der β-CateninSignaltransduktion konnte in Immunfluoreszenz- (IF-) Experimenten eine Translokation von FoxO3a aus dem Zellkern beobachtet werden. Reportergen-Experimente zeigten, dass ein aktivierter Wnt-Signaltransduktionsweg sowohl die FoxO3a-abhängige Transkription als auch die Aktivität von Promotorreporter-Konstrukten zweier FoxO3a-Zielgene, BIM und p27KIP1, inhibiert. Ein Vergleich in IF- und Reportergen-Experimenten von Wildtyp mit mutiertem FoxO3a, welches nicht mehr von SGK1 kontrolliert wird, deutet darauf hin, dass die beobachteten Effekte durch die Aktivierung von SGK1 vermittelt werden. Zusätzlich zeigen Apoptose/TUNEL-Messungen eine Inhibierung der FoxO3a-induzierten Apoptose durch den Wnt-Signaltransduktionsweg. Diese Ergebnisse deuten auf einen weiteren, die Tumorigenese fördernden, Mechanismus des Wnt/β-Catenin-Signaltransduktionweges hin: Zusätzlich zur Aktivierung der Proliferation wird aufgrund der Hochregulation von SGK1 die Apoptose supprimiert. 7 EINLEITUNG 4 4.1 Einleitung Der Wnt-Signaltransduktionsweg In der westlichen Welt ist Dickdarmkrebs eine häufig auftretende Erkrankung, die eine hohe Todesrate hat. Sie fordert innerhalb der Krebserkrankungen die meisten Todesopfer, nach den durch Rauchen verursachten Krebsformen. Der Krankheitsverlauf beginnt mit anormalen Auswüchsen von Adenompolypen aus dem Darmepithel, welche sich letztendlich zu aggressiven Karzinomen entwickeln (Kinzler and Vogelstein, 1996; Nathke, 2004a; Radtke and Clevers, 2005). In den meisten Fällen ist das Wachstum der Polypen mit einer Veränderung/Mutation zweier Gene des sogenannten kanonischen Wnt-Signalweges, den Genen von Adenomatous Polyposis Coli (APC) (Fearnhead et al., 2001; Sparks et al., 1998) und β-Catenin (Polakis, 2000; Sparks et al., 1998), assoziiert. Solche Mutationen können spontan auftreten oder auch erblich bedingt sein (familiäres adenomatöses Polyposis Syndrome, FAP). Neben dem „klassischen“ (kanonischen) Signalweg gibt es zwei weitere Wnt-Signalkaskaden, die am Ende dieses Kapitels noch kurz vorgestellt werden. 4.1.1 Klassischer Wnt-Signalweg Die physiologische Aufgabe dieses Signalweges ist es, durch Veränderung des transkriptionellen Programms Wachstum, Fortbestand und Differenzierung der Zelle zu regulieren (Seidensticker and Behrens, 2000). In Abbildung 1 ist die Signalweiterleitung des klassischen Wnt-Signalweges vereinfacht dargestellt. Eine Hauptrolle spielt β-Catenin, welches das Wnt-Signal übermittelt indem es im Zellkern an Transkriptionsfaktoren der Lef/TCF (T-cell Factor)-Familie bindet (Behrens et al., 1996). Solche Komplexe binden an definierte Sequenzen der DNA (TCF-Bindestellen) und aktivieren so die Transkription von Zielgenen. Der β-Catenin-Level wird mittels proteasomaler Degradation kontrolliert und durch einen Multiproteinkomplex (Abbaukomplex) gesteuert, der die Proteine APC, Glykogen Synthase Kinase 3β (GSK3β), Casein Kinase 1ε (CK1) und die Gerüstfaktoren Axin1 und Axin2/Conductin beinhaltet (Behrens et al., 1998; Lustig and Behrens, 2003; 8 EINLEITUNG Seidensticker and Behrens, 2000). In diesem Abbaukomplex wird β-Catenin durch GSK3β und CK1 an spezifischen, N-terimalen Serin- und Threoninresten phosphoryliert (Liu et al., 2002; Rubinfeld et al., 1996; Zeng et al., 1997), dadurch von der E3 Ubiquitin Ligase β-TrCP ubiquitiniert und anschließend im Proteasom degradiert. Eine andere Funktion von βCatenin in der Zelle ist die Beteiligung an der Vermittlung von Zell-Zell-Kontakten. Über αCatenin stellt es eine Verbindung vom Aktinzytoskelett zu dem Adhesionsmolekül ECadherin her (Ozawa et al., 1989). Eine Aktivierung des klassischen Wnt-Signalweges, zum Beispiel während der Embryonalentwicklung, geschieht durch Bindung von Wnt-Glykoproteinen an Frizzled Rezeptoren und LRP (Low-Density Lipoprotein-Receptor-Related)-Korezeptoren (Pinson et al., 2000; Tamai et al., 2000; Willert et al., 2002). Dadurch wird Dishevelled an die Plasmamembran rekrutiert, aktiviert und vermittelt eine Blockade des Abbaukomplexes, was zur Stabilisierung von β-Catenin führt (Behrens, 2005; Bhanot et al., 1996). Angereichertes βCatenin transloziert in den Zellkern und aktiviert die Transkription von Zielgenen. Zu diesen zählen auch Gene, die Tumorinvasion und Metastasenbildung fördern. Dazu gehören die Zellzyklus-regulierenden Faktoren Cyclin D1 (Tetsu and McCormick, 1999) und c-myc (He et al., 1998), das gegen den programmierten Zelltod (Apoptose) fungierende Survivin (Zhang et al., 2001b) sowie VEGF (Vascular Endothelial Growth Factor), das die Angiogenese vorantreibt (Zhang et al., 2001b) und die Matrix-abbauenden Proteasen MMP7 (Brabletz et al., 1999) und MMP26 (Marchenko et al., 2002). In ungefähr 80 % sporadischer, kolorektaler Tumore finden sich Mutationen im APC-Gen, wie auch in geringer Anzahl im Gen für βCatenin oder anderen Komponenten des Abbaukomplexes. Solche Mutation resultieren in einem stetig aktiven Signalweg, was die Krebsentstehung, insbesondere die kolorektale Karzinogenese, aber auch die anderer Krebsarten begünstigt (Morin et al., 1997). Dies wurde bereits durch viele Untersuchungen gezeigt (Fox and Lyon, 2006; Oliva et al., 2006; Roberts et al., 2006). Dennoch ist der genaue Mechanismus noch nicht aufgeklärt und so besteht weiterhin großes Interesse, beteiligte Faktoren zu identifizieren, um das Verständnis der Karzinogenese zu erweitern und zu vervollständigen. Der Fokus dieser Arbeit lag auf der Identifizierung neuer Zielgene des Wnt-Signalweges und der Untersuchung ihrer Funktion bei der Entstehung und Progression von Krebs. 9 EINLEITUNG Abbildung 1: Vereinfachte Darstellung des kanonischen Wnt-Signaltransduktionsweges (nach Behrens, 2005) β-Catenin wird in Abwesenheit von Wnt-Faktoren (-Wnt) in dem Abbaukomplex bestehend aus Axin und Axin2/Conductin und APC (adenomatous polyposis coli) durch GSK3β phosphoryliert (+P). Phosphoryliertes βCatenin wird ubiquitiniert (Ub) und im Proteasom abgebaut. Bindung von Wnt-Faktoren an Frizzled-Rezeptoren und LRP-Correzeptoren aktiviert Dishevelled, welches den Abbaukomplex blockiert. β-Catenin reichert sich an, transloziert in den Zellkern, komplexiert mit Transkriptionsfaktoren der TCF-Familie und aktiviert die Transkription von Zielgenen durch Bindung an spezifischen Promotorelementen - weitere Erläuterungen im Text. 10 EINLEITUNG 4.1.2 Rolle des klassischen Wnt-Signalweges in der kolorektalen Karzinogenese Wie bereits erwähnt, sind Mutationen im APC-Gen verantwortlich für die familiäre adenomatöse Polyposis coli (FAP) und in den meisten sporadischen Kolonkarzinomen nachweisbar. APC-Mutationen treten bereits früh während der kolorektalen Tumorigenese auf und scheinen eine entscheidende Rolle bei der Entstehung von Kolonkarzinomen zu spielen (Powell, 2002). Mausmodelle haben gezeigt, dass Mäuse, die heterozygot für Mutationen im APC-Gen sind, welche in einem verkürzten APC-Protein resultieren, unausweichlich Tumore entwickeln (Nathke, 2004b). Ein konditionaler Knock-Out beider APC-Allele im Kolorektum hat eine rasche Entwicklung von Adenomen zur Folge (Shibata et al., 1997). Die Hauptaufgabe des Tumorsuppressors APC scheint die Rolle als Antagonist des Wnt-Signalweges im Darmepithel zu sein (Fodde et al., 2001). Die Zellen des Darmepithels haben aufgrund der sehr feindlichen Umweltbedingungen im Darm durch chemischen und mechanischen Stress eine begrenzte Lebensdauer von etwa drei bis fünf Tagen. Es findet ein ständiger Austausch dieser Zellen statt. Am Grund der Krypten des Epithels befinden sich Stammzellen, die für die Nachbildung der Zellen sorgen. Durch assymetrische Zellteilung entstehen zunächst Vorläuferzellen, die nach weiteren Mitosen schließlich zu den vier Zelltypen (Becherzellen, enteroendokrinen Zellen, absorptiven Epithelzellen und Panethzellen) des Darmepithels ausdifferenzieren. Die Zellen wandern während dieses Prozesses an das obere Ende der Villi des Dünndarms bzw. des Oberflächenepithels der Krypten im Kolon. Dort durchlaufen sie schließlich den apoptotischen Zelltod und werden abgeschilfert. Eine Störung der Regulationsprozesse, die die Homöostase des Darmepithels steuern, kann zur Entstehung von Tumoren führen (Nathke, 2004b). Eine Schlüsselrolle bei der Aufrechterhaltung des Stammzellkompartiments in den Krypten spielt die Regulation von β-Catenin. Zu den Zielgenen der β-Catenin/TCF-vermittelten Transkription zählen unter anderen c-myc und CyclinD1, die eine wichtige Rolle bei der Zellproliferation, Apoptose und Zellzyklusregulation spielen und denen daher eine maßgebliche Bedeutung bei der Tumorentstehung zugesprochen wird. Im gesunden Darmepithel ist die Kernexpression von β-Catenin in den Stammzellen am Grund der Krypten erhöht und erhält die Proliferationskapazität des Stammzellenkompartiments aufrecht. Der Antagonist APC hingegen ist besonders im Bereich der differenzierenden Zellen im oberen Bereich der Krypten, aber kaum im Stammzellkompartiment nachzuweisen. Durch diese APC-vermittelten Gradienten von β-Catenin wird die Differenzierung der Vorläuferzellen ermöglicht. Wie schon angesprochen, können sowohl Mutationen im APC-Gen oder auch im 11 EINLEITUNG β-Catenin-Gen zur konstitutiven Aktivierung von β-Catenin führen. Dadurch wird das Stammzellkompartiment durch unangemessene Proliferation erweitert, was eine verminderte Differenzierung zur Folge hat und schließlich die Bildung von adenomatösen Polypen induziert (Fodde, 2003; Fodde and Smits, 2002; Radtke and Clevers, 2005). 4.1.3 Nicht kanonische Wnt-Signalkaskaden Die beiden anderen Kaskaden des Wnt-Signalweges sind der Wnt/PCP (Planar Cell Polarity)Signalweg und der Wnt-Calcium-Signalweg. Durch eine Aktivierung des Wnt-CalciumSignalweges wird intrazelluläres Calcium (Ca2+) erhöht und dadurch Ca2+-sensitive Signalkomponenten aktiviert, wie zum Beispiel die Protein Kinase C (PKC) und die Calmodulin Kinase II (CamKII) (Kuhl et al., 2000). Die Signalkaskade, die durch PKC aktiviert wird, kann auf Zell-Motilität, Morphogenese, Apoptose und auch Differenzierung Einfluss nehmen. Dieser nicht-kanonische Signalweg kann auch mit dem kanonischen interagieren, allerdings ist nicht klar, ob der Wnt-Calcium-Signalweg in Säugern konserviert ist und ob er in der Tumorigenese eine Rolle spielt. Der Wnt/PCP-Signalweg ist an der Etablierung der Zellpolarität beteiligt. Dieser Signalweg aktiviert die Kinasen RhoA und Jun und ist dadurch an der Gestaltung des Zytoskeletts, sowie der Morphologie und Polarität von Geweben beteiligt (Montcouquiol et al., 2006). Polarität ist während der Entwicklung ein wichtiges Merkmal, um manchen Zellen eine bestimmte Orientierung zu verschaffen. Beispiele für die Wichtigkeit einer solchen Orientierung finden sich bei den Haaren und auch bei den Federn von Vögeln. Hier ist eine richtige Orientierung für eine korrekte Funktion sehr entscheidend. Dies ist auch bei sensorischen Häarchen im Ohr von Vertebraten der Fall (Strutt, 2003). In kürzlich veröffentlichen Studien wurde auch eine wichtige Rolle dieses Signalweges bei der Regulation der konvergenten Extension während der Gastrulation der Embryonen von Vertebraten gezeigt (Moriguchi et al., 1999; Yamanaka et al., 2002). 4.1.4 Der Wnt-Signalweg in anderen Spezies Auch in anderen Organismen ist β-Catenin ein wichtiger Transkriptionsfaktor. In Zebrafisch und Xenopus bestimmen die β-Catenin-Signale die Ausbildung der Körperachse (Larabell et 12 EINLEITUNG al., 1997; Moon and Kimelman, 1998). Heasman und Kollegen (Heasman et al., 1994) zeigen als Folge der Überexpression von β-Catenin die Formierung einer zweiten Körperachse (Heasman et al., 1994). Auch in der Maus führt ein konstitutiv aktiver Wnt-Signalweg zu Fehlentwicklungen: Durch Überexpression von Wnt8 z. B. wird auch in der Maus eine zweite Körperachse ausgebildet (Popperl et al., 1997). Weiter sind in der Maus β-Catenin-Signale entscheidend für die Entwicklung der anterior-posterior Achse und der sich anschließenden Bildung des Mesoderms. Anteriore Markergene wie Cerberus-like und Lim1 sind in βCatenin Knock-Out Embryonen fehlerhaft lokalisiert. Dies hat zur Folge, dass kein Mesoderm und keine Kopfstrukturen gebildet werden. (Huelsken et al., 2000). 4.2 SGK1 - Serum und Glucocorticoid induzierbare Kinase 1 4.2.1 Proteinkinasen und ihre Regulation Proteinkinasen sind eine wichtige Klasse von regulatorischen Molekülen, die als Kommunikationskanäle fungieren, um Signale von der Zelloberfläche ins Innere und in den Zellkern zu übermitteln. Durch schnelle und reversible Phosphorylierung spezifischer Substrate kontrollieren sie eine große Bandbreite an komplexen, biologischen Prozessen (Hunter, 2000; Karin and Hunter, 1995). Die Mehrheit der Proteinkinasen wird durch posttranslationale Phosphorylierung und Dephosphorylierung reguliert, dadurch wird ihre Enzymaktivität gesteuert (Hunter, 2000; Karin and Hunter, 1995). Manche Kinasen können auch durch spezifische, blockierende oder stimulierende Moleküle, durch Kontrolle der Expression oder Veränderung der Lokalisation in der Zelle reguliert werden (Donohue et al., 1995; Hollister et al., 1997; Holtrich et al., 1994; Hunter, 2000; Simmons et al., 1992). SGK (Serum und Glucocorticoid induzierbare Kinase) ist in viele Signalwege von Oberflächenund Kernrezeptoren, sowie auch bei der Regulation von Zellen auf Stress-Stimuli eingebunden. 13 EINLEITUNG 4.2.2 Funktion und Regulation von SGK Die Verfügbarkeit und Funktion von SGK wird durch unterschiedliche, Stimulus-aktivierte Kaskaden auf drei verschiedenen Ebenen der zellulären Kontrolle reguliert. Erstens wird die Expression von SGK durch eine Vielzahl an extrazellulären, hormonellen und nichthormonellen Reizen stimuliert. Zweitens wird SGK als eine stromabwärts liegende Komponente der Phosphoinositol-3 Kinase-Kaskade phosphoryliert und enzymatisch aktiviert. Drittens wird die subzelluläre Lokalisierung von SGK durch den Zellzyklus, durch spezifische Hormone und durch Stress-Stimuli aus dem umgebenden Milieu kontrolliert. Auf der Suche nach Hormon-regulierten Genen, die bei der Kontrolle des Wachstums von Tumorzellen beteiligt sind, wurde SGK bei einer subtraktiven Hybridisierung aus Brusttumorzellen der Ratte isoliert (Webster et al., 1993a; Webster et al., 1993b). SGK wurde als Kinase beschrieben, die sowohl durch Serum als auch Glucocorticoide transkriptionell reguliert wird (Webster et al., 1993a; Webster et al., 1993b). Das SGK1-Gen kodiert ein 50 kDa Protein, das zur Familie der „AGC“-Serin/Threonin Proteinkinasen gehört. SGK besitzt eine katalytische Domäne, die ~ 45-55 % homolog zu katalytischen Domänen von mehreren gut charakterisierten, konstitutiv exprimierten Serine/Threonin Proteinkinasen ist, wie z. B. von PKB/Akt, Proteinkinase A oder Proteinkinase C-Zeta (Webster et al., 1993b). Eine Vielzahl von Veröffentlichungen weisen SGK eine Rolle bei der Weiterleitung von Signalen zu, die für das Überleben der Zelle wichtig sind. Auch bei der Signalübertragung für die Regulation der Proliferation wird SGK eine wichtige Funktion zugeordnet (Brunet et al., 2001; Buse et al., 1999; Mikosz et al., 2001; Webster et al., 1993b; Xu et al., 2001). Des Weiteren ist SGK in die Aktivitätskontrolle von epithelialen Natrium Kanälen (ENaC) und der Natrium-Homeostase involviert (Alvarez de la Rosa et al., 1999; Chen et al., 1999; Kamynina and Staub, 2002; Naray-Fejes-Toth et al., 1999; Shigaev et al., 2000). Die Transkription von SGK wird durch eine Vielzahl von externen Stimuli, zu denen Wachstumsfaktoren wie Insulin und HGF (hepatocyte growth factor) oder Steroidhormone zählen, aktiviert. Dies geschieht Zelltyp-spezifisch und Stimulus-abhängig durch hormonelle, Mitogen-vermittelte und zelluläre Stresssignale. (Bell et al., 2000; Brennan and Fuller, 2000; Chen et al., 1999; Cowling and Birnboim, 2000; Imaizumi et al., 1994; Maiyar et al., 1997; Mizuno and Nishida, 2001; Naray-Fejes-Toth et al., 1999; Shigaev et al., 2000; Waldegger et al., 1997; Webster et al., 1993a; Webster et al., 1993b). 14 EINLEITUNG Die enzymatische Aktivität und Phosphorylierung von SGK wird ebenfalls durch Wachstumsfaktoren (Buse et al., 1999), Insulin (Park et al., 1999) oder auch hyperosmotische Bedingungen (Bell et al., 2000) reguliert. Wie schon erwähnt ist SGK ein stromabwärtsliegender Faktor der Phosphoinositol-3 Kinase-Kaskade und wird durch die Phosphatidylabhängige Proteinkinase-1 (PDK1) und PDK2, am Aminosäurerest Serin422 phosphoryliert. Darauf folgt eine weitere Phosphorylierung der Aminosäure Threonin256, wodurch SGK enzymatisch aktiviert ist (Park et al., 1999). SGK und PKB/Akt weisen große Ähnlichkeiten in Bezug auf ihre katalytische Domäne auf. So konnten in einem Screen mit einer PeptidSammlung einige Proteine identifiziert werden, die für beide Kinasen Substrate darstellen (Park et al., 1999). Es konnte bisher für die folgenden PKB/Akt Substrate gezeigt werden, dass sie auch von SGK phosphoryliert werden: Glykogen Synthase Kinase-3 (GSK3), Raf Kinase und die Mitglieder der FoxO-Gruppe der Transkriptionsfaktoren der ForkheadProteinfamilie (Brunet et al., 2001; Zhang et al., 2001a). Ein anderer, wichtiger Mechanismus der Regulation von SGK ist die kontrollierte Verteilung und Lokalisierung von SGK in der Zelle, was in epithelialen Zellen stringent Stimulusabhängig geregelt ist (Alliston et al., 2000; Bell et al., 2000; Buse et al., 1999; GonzalezRobayna et al., 1999). In Serum-kultivierten, epithelialen Brustzellen pendelt SGK zwischen dem Nukleus und dem Zytoplasma synchron mit dem Zellzyklus. Während der G1-Phase ist SGK überwiegend im Zytoplasma und im Verlauf von S- und G2/M-Phasen vorwiegend im Kern lokalisiert (Buse et al., 1999). In vielen Veröffentlichungen wird SGK1 als SGK bezeichnet, obwohl es zwei weitere Isoformen (SGK2 und SGK3) gibt, die allerdings bisher sehr wenig untersucht worden sind. In dieser Arbeit wurde ausschließlich mit SGK1 gearbeitet, und somit ist im Folgenden die Bezeichnung SGK mit SGK1 gleichzusetzen. Für SGK3 gibt es Hinweise auf eine spezifische Funktion dieser SGK-Isoform: Sie ist offensichtlich beim Interleukin-3 vermittelten Überleben von hämatopoetischen Zellen involviert (Liu et al., 2000). Der Phänotyp einer SGK1 Knock-Out Maus ist nicht sehr ausgeprägter. Es ist nur eine Beeinträchtigung der Natriumkanäle in der Niere festzustellen. Zusätzlich zu den SGK-Formen in Mensch, Ratte und Maus wurden auch Homologe in den Genomen von diversen Spezies wie Frosch, Caenorhabditis elegans und auch Saccharomyces cerevisiae identifiziert (Casamayor et al., 1999; Chen et al., 1999; Sun et al., 2000). Ein wichtiger Grund für eine Konservierung von SGK ist wohl die Fähigkeit, dass sich ein Organismus dadurch besser auf umgebungsbedingten Stress, wie extreme Änderung des Nährstofflevels, Temperatur oder Osmolarität einstellen und so möglicherweise ein Überleben 15 EINLEITUNG sichern kann. Diese durch SGK vermittelte Fähigkeit kann sowohl für einzellige, wie auch vielzellige Organismen von großem Nutzen sein (Bell et al., 2000; Pearce, 2001). SGK ist eine Proteinkinase, die als Signalmolekül bei der Regulation vieler biologischer Prozesse beteiligt ist. Im Vergleich zu den meisten anderen Proteinkinasen unterscheidet sich SGK durch die stringente Stimulus-abhängige Regulation ihrer Transkription, subzellulärer Lokalisierung und enzymatischer Aktivität. Dadurch kann SGK als entscheidender Stimulusabhängiger Schalter fungieren, der zelluläre Reaktionen auf verschiedenste extrazelluläre Signale steuert. Für einige Untersuchungen dieser Arbeit stand die Fähigkeit von SGK1 im Vordergrund, die Mitglieder der Gruppe „O“ der Transkriptionsfaktoren der Forkhead Box Familie zu regulieren. 4.3 Die Transkriptionsfaktoren Forkhead Box O (FoxO) 4.3.1 Die Fox-Familie Forkhead Box (Fox)-Proteine sind eine Superfamilie von konservierten transkriptionellen Regulatoren, die durch eine DNA-Bindedomäne - die Forkhead Box - charakterisiert sind. Im Menschen umfasst die gesamte Proteinfamilie mehr als 100 Mitglieder, die von FoxA bis FoxS aufgrund ihrer Sequenzähnlichkeit klassifiziert sind. Fox-Proteine steigern oder unterdrücken die Transkription von Genen, indem sie Co-Faktoren oder Repressoren rekrutieren. Der Name „Forkhead“ entstand, weil Mutationen des begründenden Mitgliedes der gesamten Familie (jetzt FoxA), welches ursprünglich in Drosophila identifiziert wurde, zu untypischen - gabelförmigen Verformungen des Kopfes führen (Carter and Brunet, 2007). Manchmal werden Forkhead-Proteine auch als „winged helix“ Proteine bezeichnet, weil die DNA-Bindedomäne aus drei α-Helices von zwei charakteristischen Schleifen flankiert wird, welche wiederum einem Schmetterling ähneln (Carter and Brunet, 2007). Die Fox-Proteine sind an den unterschiedlichsten biologischen Prozessen, wie Metabolismus, Entwicklung, Differenzierung, Proliferation, Apoptose, Migration und Invasion beteiligt (Myatt and Lam, 2007). FoxE3 ist z. B. für eine korrekte Entwicklung des Auges nötig, wohingegen FoxP2 eine wichtige Rolle beim Erlernen von Sprachen spielt (Carter and Brunet, 2007). FoxM1 ist ein wichtiger Faktor für die Steuerung von Zellzyklus und mitotischem Spindelaufbau (Myatt and Lam, 2007). Bei der Beteiligung der Fox-Proteine an so vielen und unterschiedlichen 16 EINLEITUNG Prozessen ist es nicht überraschend, dass ein Verlust oder eine Steigerung der Aktivität von Fox-Proteinen den Zustand einer Zelle stark stören und dadurch zur Entstehung und Progression von Krebs beitragen kann. Für einige Unterfamilien, wie FoxO, FoxM, FoxP, FoxC und FoxA wurden bereits Nachweise erbracht, die eine direkte Verbindung zur Tumorigenese aufzeigen. Aufgrund dessen werden einige dieser Fox-Faktoren auch als Tumorsuppressor bzw. Onkogene bezeichnet (Myatt and Lam, 2007). 4.3.2 Die Gruppe der FoxO-Proteine Die Faktoren der FoxO-Gruppe sind an der Regulation von Zell-Zyklus, Apoptose, DNAReparatur und Entgiftung beteiligt (Carter and Brunet, 2007). In die Gruppe „O“ sind die Mitglieder eingeteilt, die durch den Insulin/PI3K-Signalweg reguliert werden. Die ersten Hinweise dafür wurden durch genetische Studien in C. elegans erbracht. Sie zeigten, dass PI3K die Funktion von DAF-16, einem homologen Transkriptionsfaktor der Forkhead „O“Gruppe in C. elegans, unterdrückt und dies zu erschwerter Kontrolle des Metabolismus und der Lebensdauer führt (Lin et al., 1997; Ogg et al., 1997). Durch Analyse der Aminosäuresequenz wurden drei Stellen in DAF-16 gefunden, die homolog zu AktPhosphorylierungsstellen sind. Das gab Anlass zur Vermutung, dass DAF-16 und andere FoxO-Proteine direkte Substrate von Akt sind, was auch bestätigt werden konnte (Greer and Brunet, 2005; Kops et al., 1999; Tran et al., 2003). Im Menschen wurden drei Homologe zu DAF-16 identifiziert, FKHR (Forkhead in rhabdomyosarcoma; FoxO1), FKHR-L1 (FKHR-like 1; FoxO3a) und AFX (acutelymphocytic-leukaemia-1; FoxO4). Diese Faktoren wurden schnell mit der Entstehung und Progression von Krebs in Verbindung gebracht, da sie interessanterweise zuerst an chromosomalen Bruchstellen (Translokationen) in menschlichen Tumoren identifiziert wurden (Anderson et al., 1998; Borkhardt et al., 1997; Davis et al., 1994; Galili et al., 1993; Hillion et al., 1997; Parry et al., 1994). In einigen Rhabdomyosarkomen sind die DNABindedomänen der Transkriptionsfaktoren PAX3 und PAX7, die für die neuromuskuläre Differenzierung wichtig sind, mit der Transaktivierungs-Domäne von FoxO1 fusioniert (Galili et al., 1993). Ganz ähnlich ist auch die DNA-Bindedomäne von MLL (mixed-linage leukemia) - ein positiver Regulator der Hox-Gene während der Embryonalentwicklung - in einigen Formen von Leukämie mit der Transaktivierungs-Domäne von FoxO3a oder FoxO4 verschmolzen (Anderson et al., 1998; Borkhardt et al., 1997). Solche Fusionen ändern das 17 EINLEITUNG eigentliche Transaktivierungsschema der ursprünglichen Proteine und fördern dadurch die Tumorigenese. Eine simultane Deletion von FoxO1, FoxO3a und FoxO4 verstärkt die Voraussetzungen für Krebs deutlich, was durch Lymphome des Thymus charakterisiert ist. Deswegen werden diese Faktoren auch als sogenannte „bona fide“ Tumorsuppressoren bezeichnet (Myatt and Lam, 2007). FoxO-Proteine können durch mehrere Kinasen, wie PKB/Akt, SGK1, JNK, DYRK1A, oder CDK2 phosphoryliert werden (Hu et al., 2004; Huang et al., 2006; Woods et al., 2001). Diese posttranslationale Modifikation führt zum Export aus dem Zellkern und dadurch zur transkriptionellen Inaktivierung von FoxO-Faktoren. In vielen humanen Krebsformen sind Fehlregulationen von diesen genannten Kinasen zu beobachten, die maßgeblich an der Tumorigenese beteiligt sind, da sie auch den nukleären Export und die Degradation von FoxOs fördern (Bader et al., 2005; Heasley and Han, 2006). In vielen Krebsarten ist auch der Wnt-Signaltransduktionsweg dahingehend beeinträchtigt, dass er konstitutiv aktiviert ist. Dadurch wird, wie in der vorliegenden Arbeit gezeigt, die Transkription von SGK1 erhöht, was wiederum eine Inhibierung von FoxO-Proteinen nach sich ziehen und die Tumorigenese begünstigen kann. Als letzter und daher noch am wenigsten untersuchte Faktor der FoxO Gruppe wurde FoxO6 identifiziert. Dieser enthält nur zwei der drei Akt/SGK-regulatorischen Stellen (Jacobs et al., 2003). Abweichend von den anderen Faktoren dieser Gruppe ist FoxO6 hauptsächlich im Kern lokalisiert. Einiges deutet darauf hin, dass sich FoxO6 in Regulation und Funktion von den anderen Mitgliedern dieser Untergruppe unterscheidet (van der Heide et al., 2005). 4.3.3 Regulation von FoxO-Transkriptionsfaktoren Die Regulation von FoxO-Proteinen geschieht durch Aktivierung der Transkription, Degradation des Proteins, Veränderung der subzellulären Lokalisation, vor allem aber durch Signal-vermittelte, posttranslationale Modifikationen, wie zum Beispiel Phosphorylierung, Acetylierung oder Ubiquitinierung (Van Der Heide et al., 2004). Durch die PI3K-Kaskade wird die direkte Phosphorylierung von FoxO-Proteinen vermittelt. Diese Regulation war in vorliegenden Arbeit von Interesse und soll deswegen genauer erklärt werden. Durch die PI3K-Kaskade wird die Lokalisierung von FoxO-Proteinen in der Zelle reguliert. Ohne Zellstimulation befinden sich FoxOs im Nukleus. Durch Stimuli, wie zum Beispiel Wachstumsfaktoren, wird die PI3K-Kaskade aktiviert. Deren Kinase PKB/Akt phosphoryliert die FoxO-Proteine, wodurch der Export dieser Faktoren aus dem Zellkern induziert und somit 18 EINLEITUNG ihre transkriptionelle Aktivität, das heißt die Expression von Zielgenen, inhibiert wird. PKB/Akt kann FoxOs an drei Serin- und Threonin-Resten phosphorylieren, die in dieser Untergruppe konserviert sind (Brunet et al., 1999; Kops et al., 1999). Wie bereits geschildert, wird auch SGK1 durch den PI3K-Signalweg aktiviert und kann FoxO3a phosphorylieren und inhibieren (Brunet et al., 2001). PKB/Akt und SGK1 phosphorylieren die gleichen Aminosäurereste, allerdings mit unterschiedlicher Effizienz. Thr32 wird von beiden Kinasen phosphoryliert, Ser253 vorwiegend durch PKB/Akt und Ser315 durch SGK1. Eine Phosphorylierung jeder der regulatorischen Stellen von FoxO3a scheint aber entscheidend für einen effizienten Ausschluss von FoxO aus dem Kern (Brunet et al., 2001). Wahrscheinlich arbeiten PKB/Akt und SGK1 bei der Regulation von FoxO-Transkriptionsfaktoren zusammen, um das Zellüberleben zu sichern. In Abbildung 2 ist die Regulation von FoxO durch PKB/Akt und SGK1 kurz skizziert. In den FoxO-Proteinen findet sich sowohl ein NES(nuclear export signal) als auch ein NLS- (nuclear localisation signal) Motiv (Biggs et al., 1999; Brunet et al., 2002). Es wurde gezeigt, dass phosphoryliertes FoxO mit 14-3-3 Proteinen interagiert, welche FoxO aus dem Nukleus eskortieren (Brunet et al., 1999). Eine Interaktion von 14-3-3 Proteinen mit FoxO fördert wohl aktiv den Export, möglicherweise durch eine Änderung der Konformation von FoxO, wodurch das NES-Motive freigelegt und eine Interaktion mit Exportin/Crm ermöglicht wird (Brunet et al., 2002). Die Komplexe aus FoxO und 14-3-3 bleiben im Zytoplasma, weil durch die Bindung mit 14-3-3 Proteinen wahrscheinlich das NLS-Motiv überdeckt und so ein Re-Import von FoxO in den Kern verhindert wird (Brownawell et al., 2001; Rena et al., 2001). Durch Mutationsanalysen der drei Phosphorylierungsstellen konnte gezeigt werden, dass eine Phosphorylierung jeder dieser Stellen zum Ausschluss von FoxO aus dem Kern beiträgt (Brunet et al., 2001). Möglicherweise spielt das eine Rolle bei der Regulation in verschiedenen Zelltypen und bei der Reaktion auf unterschiedliche Kombinationen von Signalen. Proteinphosphatasen, die FoxO-Transkriptionsfaktoren an den Zielstellen von Akt/SGK dephosphorylieren, sind noch nicht bekannt. Diese Phosphatasen hätten das Potential der Funktion von PKB/Akt und SGK1 entgegenzuwirken und könnten FoxO-Proteine schnell aktivieren, indem sie deren Wiedereintritt in den Kern induzieren. Andere Faktoren, die FoxO-Proteinen den Wiedereintritt in den Nukleus ermöglichen, sind Stress-Stimuli, wie zum Beispiel oxidativer Stress oder Hitzeschock. Durch sie werden die 14-3-3/FoxO-Komplexe gespalten und FoxO transloziert in den Kern (Brunet et al., 2004; Kobayashi et al., 2005). Beim Aufbrechen dieser Komplexe ist wahrscheinlich c-Jun NH2-terminale Kinase (JNK) involviert. JNK ist ein Mitglied der Gruppe von Mitogen-aktivierten Kinasen und wird durch Stress aktiviert, beispielsweise durch oxidativen Stress (Davis, 2000). Es ist möglich, dass 1419 EINLEITUNG 3-3 Proteine durch aktivierte JNK phosphoryliert werden, dadurch von FoxO dissoziieren und so den Wiedereintritt von FoxO in den Kern erlauben. Abbildung 2: Vereinfachte Darstellung der FoxO-Regulation durch PI3K/Akt/SGK1 Bei aktivem PI3K- (Phosphoinositol-3 Kinase) Signalweg werden Transkriptionsfaktoren der FoxO-Familie durch Akt/SGK1 phosphoryliert und dadurch über die Exportmaschinerie CRM1-abhängig aus dem Zellkern exportiert. In Komplexen mit 14-3-3 Proteinen verbleibt FoxO im Zytoplasma. Durch Lösen der Komplexe, z. B. durch Stress-Stimuli, transloziert FoxO wieder in den Kern und aktiviert durch Bindung an spezifische Promotorelemente (DBE) die Transkription von Zielgenen. 20 EINLEITUNG Wie bereits erwähnt, können FoxO-Proteine auch durch andere posttranslationale Modifikationen reguliert werden (Greer and Brunet, 2005; van der Horst et al., 2004). Durch Acetylierung und Deacetylierung wird die transkriptionelle Aktivität von nukleärem FoxO vor allem bei der zellulären Stress-Antwort gesteuert. Dies wird unter anderem durch CBP (CREB-binding protein) und p300 bzw. von Deacetylasen der Sir2 Familie vermittelt (Brunet et al., 2004; Daitoku et al., 2004; Fukuoka et al., 2003; Motta et al., 2004; Nasrin et al., 2000; van der Horst et al., 2004). Ein weiterer Regulationsmechanismus von FoxO-Proteinen erfolgt durch Ubiquitinierung. Hierbei ist eine Mono-Ubiquitinierung von Poly-Ubiquitinierung zu unterscheiden: Letztere führt zu Degradation von FoxOs, wohingegen eine MonoUbiquitinierung den Wiedereintritt in den Nukleus und damit die transkriptionelle Aktivität fördert (van der Horst et al., 2006). 4.3.4 Aktivierung von Zielgenen durch FoxO3a Im Nukleus binden FoxO-Transkriptionsfaktoren als Monomere über die „Forkhead-Box“ an eine Konsensus-Sequenz der DNA. Als optimale Sequenz für diese Interaktion wurde die Abfolge TTGTTTAC ermittelt (Biggs et al., 1999; Furuyama et al., 2000). Wie schon erwähnt, sind FoxO-Proteine unter anderem an der Regulation von Zellzyklus und Apoptose beteiligt. Zwei für diese Arbeit relevante Zielgene von FoxO sind p27KIP1 und BIM (Bcl-2 interacting mediator). Die Aktivierung von BIM induziert die Apoptose (O'Connor et al., 1998), p27KIP1 ist ein Inhibitor von CDKs (Cyclin-dependent kinases) und spielt eine wichtige Rolle bei der Steuerung des Zellzyklus (Toyoshima and Hunter, 1994). In den Promotoren dieser Gene befinden sich FoxO-Bindemotive und es wurde gezeigt, dass diese Gene durch FoxO aktiviert werden (Dijkers et al., 2002; Dijkers et al., 2000a; Dijkers et al., 2000b; Medema et al., 2000; Stahl et al., 2002). Es wurden noch viele weitere Zielgene von FoxOTranskriptionsfaktoren beschrieben, die je nach Kontext, also Zelltyp- und Stimulusabhängig, aktiviert werden (Arden, 2006; Furukawa-Hibi et al., 2005; Greer and Brunet, 2005). 21 ZIELSETZUNG 5 Zielsetzung Eine anormale Aktivität des Wnt/β-catenin-Signaltransduktionsweges ist direkt mit der Entstehung und Progression von Krebs assoziiert. Durch zahlreiche Untersuchungen konnte schon ein gutes Verständnis der Karzinogenese erreicht werden. Allerdings ist der genaue Mechanismus immer noch ungeklärt. Deshalb besteht weiterhin großes Interesse, involvierte Faktoren zu identifizieren und deren Funktion bei der Tumorigenese zu erforschen. Ziel dieser Arbeit war es neue Gene zu identifizieren, die durch β-Catenin reguliert werden und zu untersuchen, welche Rolle diese Faktoren bei der Karzinogenese spielen. 22 ERGEBNISSE 6 Ergebnisse 6.1 Identifikation von SGK1 als neues Zielgen des Wnt-Signalweges 6.1.1 Regulation der Expression von SGK1 durch den Wnt-Signalweg Zur Identifizierung von Wnt-regulierten Kandidatengenen wurden die beiden KolonkarzinomZelllinien HCT116 und DLD1 herangezogen, die beide einen stetig aktiven Wnt-Signalweg aufweisen. Bei HCT116 liegt dies an einer Mutation von β-Catenin, welches dadurch nicht mehr phosphoryliert und abgebaut werden kann. In DLD1 ist APC mutiert und es wird ein verkürztes APC-Protein synthetisiert, das β-Catenin nicht mehr bzw. nur noch schlecht binden kann. Dies führt zur Stabilisierung von β-Catenin, einem stetig aktiven Wnt-Signalweg und daraus resultierend zu der Aktivierung von Zielgenen. Diese beiden Zelllinien wurden so modifiziert, dass die Aktivität des Wnt-Signalweges verändert werden konnte. Im ersten System wurde der Wnt-Signalweg in HCT116 Zellen durch den Knock-Down von APC (Transfektion von siRNA gegen APC) überaktiviert (System und Funktionalität der siRNAs in Hadjihannas et al. 2006). Als Kontrolle wurden Zellen mit siRNA gegen GFP transfiziert, um die Grundaktivität bestimmen zu können (Ausgangswert). Zusätzlich wurden Zellen mit siRNA gegen APC und β-Catenin zugleich transfiziert, um Gene zu ermitteln, die spezifisch durch β-Catenin reguliert sind. Es sollten folglich solche Gene isoliert werden, die durch Transfektion von siAPC noch stärker aktiviert und durch zusätzliche Transfektion von siβCatenin wieder inaktiviert werden. Das zweite System wurde im Labor von Hans Clevers etabliert. In DLD1 Zellen wurde ein dominant-negativ wirkendes TCF4 (dnTCF4) Konstrukt, welches durch Doxycyclin induziert werden kann, stabil transfiziert und die neue Linie DLD1-dnTCF4 genannt (van de Wetering et al., 2002). Dominant-negatives TCF4 ist N-terminal verkürzt und kann deswegen β-Catenin nicht mehr binden. Es verhindert eine Aktivierung der Zielgene, da die DNA-Bindestellen für TCF4/β-Catenin Komplexe durch dnTCF4 besetzt werden und durch Überexpression ein dominanter Effekt erreicht wird. In den induzierten Zellen ist eine niedrige und in den nicht 23 ERGEBNISSE induzierten Zellen eine starke Expression von Zielgenen des Wnt-Signalweges zu erwarten. Im Folgenden werden die beiden Systeme als HCT116 (RNAi) und DLD1-dnTCF4 (-/+dox) bezeichnet. Von den Zellen mit inhibierten, aktivierten und superaktivierten Wnt-Signalweg wurde RNA isoliert, aufgereinigt, in cDNA umgeschrieben und die Genaktivität mittels DNA-Microarray Analysen untersucht. Die Funktionalität der Systeme wurde an dem bekannten Zielgen Axin2/Conductin durch RTPCR (Abb. 3A) und Westernblot-Analyse (Abb. 3B) überprüft. Axin2/Conductin steuert als eine zentrale Komponente des β-Catenin-Abbaukomplexes die Stabilität von β-Catenin (Behrens et al., 1998). Zusätzlich ist Axin2/Conductin ein gut charakterisiertes Wnt-Zielgen, dessen Expression durch Wnt-Signale erhöht wird. Damit bildet Axin2/Conductin eine Rückkopplungs-Schleife, die den Wnt-Signalweg negativ reguliert (Lustig et al., 2002). Die RNA- und Proteinlevel von Axin2/Conductin zeigen in beiden Systemen eine Regulation die der Aktivität des Wnt-Signalweges folgt. Die Level sind bei superaktiviertem bzw. aktiviertem im Vergleich zum nicht aktivierten bzw. geblockten Signalweg deutlich erhöht (vgl. HCT116: siAPC mit siGFP, DLD1-dnTCF4: –dox mit +dox). Im HCT116-System werden diese Steigerungen durch Kotransfektion von siβ-Catenin wieder gesenkt und damit die Spezifität auf den Wnt-Signalweg gezeigt. Damit ist bestätigt, dass die Systeme für die Identifikation neuer Zielgene des Wnt-Signalweges geeignet sind. 24 ERGEBNISSE Abbildung 3: Expressionsanalyse des β-Catenin Zielgenes Axin2/Conductin in Zellen mit unterschiedlichem Aktivitätsstatus des Wnt-Signalweges Stimulation des Wnt-Signalweges in den beiden zellulären Systemen HCT116 (RNAi) und DLD1-dnTCF4 (-/+dox) auf unterschiedliche Weise als Funktionalitätstest der Systeme zur Identifikation von Zielgenen; in HCT116 mittels transienter Transfektion von siAPC, siAPC/siβ-Catenin und siGFP als Kontrolle (je 100 nM) und in DLD1-dnTCF4 durch Zugabe von dox (1 µg/ml) A) semiquantitative RT-PCR Analyse, B) Westernblot-Analyse; β-Aktin diente jeweils als Kontrolle. Aus den Zellen beider beschriebener Systeme wurde RNA isoliert, aufgereinigt und in cDNA umgeschrieben, um DNA-Microarrays (Affymetrix) anzufertigen. Bei der Auswertung der Arrays wurden einige bereits bekannte Zielgene des Wnt-Signalweges bestätigt (wie z. B. Axin2, c-myc, BMP4, Cox-2; siehe Kap.10 Anhang.), was ein weiterer Beleg für die Zuverlässigkeit der gewählten Systeme ist. Axin2/Conductin diente hier, wie auch in folgenden Experimenten als Positivkontrolle. In den Arrays wurde neben einigen schwach regulierten Genen ein Gen beobachtet, das in beiden Systemen sehr stark und Wnt-spezifisch reguliert ist: Serum- und Glucocorticoid induzierbare Kinase 1 (SGK1). Im HCT116 (RNAi) System zeigen die Arraydaten eine Steigerung der Expression von SGK1 bei Überaktivierung des Signalweges (siAPC) um das 3,3-fache (Tab.1). Durch zusätzlich Wegnahme von βCatenin (Inhibierung des Signalweges) wird das Expressionslevel wieder von 3,3- auf 2,4fach in Bezug auf das Ausgangniveau gesenkt. Axin2/Conductin wird bei Überaktivierung des Wnt-Signalweges 8,1-fach hochreguliert und bei anschließender Inhibierung wieder auf 3,4-fach relativ zum Ausgangslevel gesenkt. Im zweiten System (DLD1-dnTCF4) zeigt SGK1 eine Steigerung von 5,9-fach beim Vergleich von aktivem (nicht induziertem) zu inaktivem (induziertem) Wnt-Signalweg (Tab.1). Hier konnte Axin2/Conductin nicht als Kontrolle herangezogen werden, da bei dieser Microarray Analyse der Chip HU-133 verwendet wurde, 25 ERGEBNISSE auf welchem sich keine Sonde für Axin2/Conductin befindet. Allerdings wurden andere bereits bestätigte Zielgene durch dnTCF4 herunterreguliert, wie z. B. c-myc (3,4-fach). Die deutliche Regulation von SGK1 in beiden Testsystemen war ein erster Hinweis, dass SGK1 ein neues Zielgen des Wnt-Signalweges darstellt. Um dies zu bestätigen, wurden weitere Untersuchungen durchgeführt. Tabelle 1: Regulation der Gene SGK1 und Axin2 durch den Wnt-Signalweg in der DNA Microarray Analyse Angeben sind die Quotienten der Signalwerte der Microarrays bei den angegebenen experimentellen Bedingungen. Zur Verifizierung der Ergebnisse der Microarrays wurde die Wnt-abhängige Regulation der mRNA Expression von SGK1 durch quantitative Echtzeit RT-PCR in den beiden bereits vorgestellten Zellsystemen analysiert. In Abb. 4 sind repräsentative Ergebnisse von mindestens zwei unabhängigen Experimenten dargestellt. Sie zeigen eine mRNA-Expression von SGK1, die in beiden Systemen durch einen aktiven bzw. superaktiven Wnt-Signalweg um mehr als das 14-fache im DLD1-dnTCF4 (Abb. 4B) bzw. um mehr als das 3-fache im HCT116-System (Abb. 4A) erhöht ist. In HCT116 wird dieses gesteigerte Level durch die zusätzliche Wegnahme von β-Catenin wieder auf ein Niveau von 2-fach im Vergleich zum Ausgangslevel gesenkt (Abb. 4A). Die mitgeführte Positivkontrolle Axin2/Conductin zeigt in diesen Experimenten sehr ähnliche Ergebnisse und stützt die Annahme, dass SGK1 ein Zielgen des Wnt-Signalweges ist. 26 ERGEBNISSE Abbildung 4: Regulation der Expression von SGK1 durch den Wnt-Signalweg Quantitative Echtzeit RT-PCR zur Analyse der Expression von SGK1 und Axin2 in den beiden Systemen A) HCT116 (RNAi) und B) DLD1-dnTCF4 (-/+dox); gezeigt sind, nach Normalisierung auf β-Aktin die relativen mRNA Expressionen im Verhältnis zu den auf eins gesetzten Ausgangswert (siGFP bzw. Kontrolle). In B) sind jeweils die Faktoren der Genexpression angegeben, d. h. nach Normalisierung auf β-Aktin wurde der Expressionswert von SGK1 von induzierten Zellen durch den Wert von nicht induzierten Zellen geteilt (-/+dox). Nach der Validierung der Arraydaten auf mRNA Ebene wurde die Regulation des Proteinlevels von SGK1 durch den Wnt-Signalweg untersucht. In der Westernblot-Analyse (Abb. 5A+B) ist in den beiden Systemen eine Wnt-abhängige Proteinregulation von SGK1 zu sehen. Bei aktivem bzw. superaktivem Signalweg sind die Proteinmengen im Vergleich zu dem nicht aktivierten Signalweg deutlich gesteigert. Die Regulation der Proteinlevel von Axin2/Conductin zeigt dasselbe Muster, allerdings in stärkerem Maße, denn bei nicht aktivem Wnt-Signalweg wird es im Gegensatz zu SGK1 kaum exprimiert. Daraus kann geschlossen werden, dass Axin2/Conductin sehr spezifisch für den Wnt-Signaltransduktionsweg ist, wogegen für SGK1 auch andere Funktionen in unterschiedlichen Zusammenhängen beschrieben sind (siehe Einleitung), und somit eine Regulation nicht exklusiv dem Wnt-Signalweg vorbehalten ist. Für die Analyse der Proteinregulation von SGK1 und Axin2/Conductin stand noch ein weiteres Zellsystem zur Verfügung: Rat2 Zellen, die stabil mit einem Wnt-1 Konstrukt transfiziert wurden und dadurch ein stetig aktiver Wnt-Signalweg erzeugt wurde (Giarre et al., 1998; Lustig et al., 2002). Als Kontrolle wurden Rat2 Zellen mit dem Leervektor MV7 stabil 27 ERGEBNISSE transfiziert. Auch hier sind die Proteinlevel von SGK1 und Axin2/Conductin beim Vergleich von Rat2-Wnt1 Zellen mit Rat2-MV7 Zellen stark erhöht (Abb. 5C) und zeigen damit eine Wnt-abhängige Regulation. Abbildung 5: Regulation von SGK1 durch den Wnt-Signalweg Westernblot-Analyse der Proteinregulation von SGK1 durch den Wnt-Signalweg in den Systemen A) HCT116 (RNAi), B) DLD1-dnTCF4 (+/-dox) und C) Rat2 (MV7/Wnt-1); Axin2 diente als Positiv- und β-Aktin als Ladekontrolle. Neben den DNA-Microarraydaten wurde in den verwendeten Zellsystemen eine Wnt-Signalweg-abhängige Regulation von SGK1 auch auf mRNA- und Proteinebene gezeigt. Diese ist der von Axin2/Conductin sehr ähnlich und untermauert die Annahme, dass SGK1 ein Zielgen des Wnt-Signalweges ist. 6.1.2 Regulation des SGK1-Promotors durch den Wnt-Signalweg Die Aktivierung der Transkription von Zielgenen des Wnt-Signalweges wird durch Bindung von β-Catenin/TCF4-Komplexen an definierte Sequenzen, TCF-Bindestellen, im Promotorbereich der Gene vermittelt. Eine genauere Betrachtung der Sequenz des putativen Promotorbereichs (~3000 bp stromaufwärts des Startcodons ATG, nach Sanger; www.sanger.ac.uk) von SGK1 und Untersuchungen dieses Bereichs durch Reporterassays sollten die Regulation durch den Wnt-Signalweg weiter bestätigen, und Aufschluss darüber 28 ERGEBNISSE geben, ob SGK1 ein direktes Zielgen von β-Catenin ist. In Abb. 6 ist der endogene Sequenzbereich des potentiellen humanen SGK1-Promotors skizziert. Dieser Bereich weist drei TCF-Bindemotive mit der definierten Sequenz CTTTGA/TA/T (Roose and Clevers, 1999; van de Wetering et al., 1997) an den Stellen -2806, -2513 und -1968 auf. Es wurden drei Promotorreporter-Konstrukte kloniert (Abb. 6; SGK1 I-III). Das längste Konstrukt enthält alle drei, das mittlere nur eine und das kürzeste keine der definierten TCFBindemotive. Diese drei Fragmente des SGK1-Promotors wurden mittels transienter Transfektion in mehreren zellulären Systemen auf eine β-Catenin-abhängige Regulation untersucht. Abbildung 6: Schematische Darstellung des putativen Promotorbereichs von humanem SGK1 und der klonierten Reporterkonstrukte (nach Sanger: www.sanger.ac.uk) schwarze Boxen (-2806, -2513 und -1968): TCF-Bindestellen (mit Positionsangabe des ersten Nukleotides der potentiellen Bindestelle relativ zum Transkriptionsstart), Pfeil (+1): Transkriptionsstart, ATG (+58): Translationsstart, luc: Luziferase-Reportergen, SGK1 I-III: Bezeichnung der Konstrukte mit Größenangabe der Fragmente in Klammern. Die Vermessung der Promotorreporter-Konstrukte von SGK1 wurde in den bereits verwendeten Zellsystemen HCT116 (RNAi) und DLD1-dnTCF4 (-/+dox) zusammen mit dem TOP/FOP-Reportersystem durchgeführt. Der TOP-Vektor trägt ein Luziferase-Gen unter Kontrolle eines Minimalpromotors mit TCF-Bindestellen und dient als Postitivkontrolle für eine TCF/β-Catenin-abhängige Transkription. In der Negativkontrolle FOP sind die TCFBindestellen mutiert und dadurch die TCF/β-Catenin-abhängige Aktivierung der 29 ERGEBNISSE Transkription verhindert. Als weitere Positivkontrolle (Ax2-luc) wurde ein Reporterkonstrukt eingesetzt, bei dem das Luziferase-Gen unter der Kontrolle des endogenen Promotors von Axin2/Conductin steht (Jho et al., 2002). Reporterexperimente mit den SGK1-Promotorkonstrukten, TOP und Ax2-luc zeigen in HCT116 Zellen eine Regulation durch den Wnt-Signalweg (Abb. 7). Die Luziferaseaktivitäten dieser Reporterkonstrukte steigen durch einen Knock-Down des Tumorsuppressors APC mittels RNAi deutlich und werden durch Transfektion von siRNA gegen β-Catenin unter das Ausgangsniveau (siRNA gegen GFP) gesenkt (Abb. 7A). Die Negativkontrolle FOP bleibt unverändert. Auch in DLD1-dnTCF Zellen kann eine Regulation der Promotorkonstrukte von SGK1 durch den Wnt-Signalweg beobachtet werden (Abb. 7B). Beim Vergleich der Aktivitäten von doxinduziertem (inaktivem) mit nicht induziertem (aktivem) Wnt-Signalweg sind die Luziferasewerte von den SGK1-Promotorkonstrukten und auch von den Kontrollen TOP und Ax2-luc deutlich erniedrigt, wohingegen die Negativkontrolle FOP nicht beeinflusst wird (Abb. 7B). Die SGK1-Promotorkonstrukte wurden auch in SW480 Zellen getestet. Dies ist ebenfalls eine Kolonkarzinom-Zelllinie, die durch eine Mutation im Gen für APC ein verkürztes Protein synthetisiert und dadurch einen stetig aktiven Wnt-Signalweg aufweist. In den Reporterexperimenten wurde durch Kotransfektion von Wildtyp APC (wtAPC) der Signalweg wieder inaktiviert. Die Aktivität der SGK1-Konstrukte und auch die der Kontrollen TOP und Ax2-luc wird durch die Kotransfektion von wtAPC in SW480 Zellen stark reduziert (Abb. 7C). FOP dagegen bleibt unverändert aktiv. Das bedeutet, dass auch in diesem System die Reporterkonstrukte von SGK1 eine β-Catenin-abhängige Regulation zeigen. Die Ergebnisse der Promotoranalyse von SGK1 durch Reporterexperimente korrelieren mit den bisherigen Untersuchungen und liefern weitere Hinweise zur Bestätigung von SGK1 als ein Zielgen des Wnt-Signalweges. 30 ERGEBNISSE Abbildung 7: Regulation von SGK1-Promotorfragmenten durch den Wnt-Signalweg Repräsentative Reportergen-Experimente mit je 20 ng der angegebenen Reporterkonstrukte A) in HCT116 bei Kotransfektion von je 100 nM siGFP (Kontrolle, hellgraue Balken), siAPC (graue) oder siβ-Catenin (schwarze); B) in DLD1-dnTCF4 (bei –dox: grau oder +dox: schwarz) und C) in SW480 bei Kotransfektion von je 50 ng Kontrollplasmid (grau) oder wtAPC (schwarz). Die Promotorkonstrukte SGK1 I und II beinhalten drei beziehungsweise eine der TCFBindemotive und werden auch β-Catenin-abhängig reguliert. Das Konstrukt SGK1 III hat keine dieser definierten Bindestellen, zeigt allerdings ebenfalls eine Wnt-abhängige Regulation. Eine Erklärung hierfür könnte eine indirekte Regulation, also eine Beteiligung 31 ERGEBNISSE weiterer Faktoren sein. Möglich ist aber auch, dass in der verbliebenen Sequenz von SGK1 III noch weitere, den definierten TCF-Motiven sehr ähnliche Sequenzen sind, die möglicherweise eine Bindung von TCF/β-Catenin-Komplexen erlauben. Innerhalb dieser Sequenz von SGK1 III befinden sich an den Positionen -1905, -1278 und +7 (ATG bei +58) noch weitere Motive mit der definierten Kernsequenz (CTTTG), bei denen nur eine der angrenzenden Basen von der definierten Sequenz abweicht. Es könnte möglich sein, dass auch an diesen Stellen eine - eventuell verminderte - Bindung von TCF/β-Catenin-Komplexen stattfindet. Wenn das der Fall ist, kann auch weiterhin eine Regulation vermittelt werden. Um genaueren Aufschluss über die direkte oder indirekte Regulation von SGK1 durch den Wnt-Signalweg zu bekommen, könnten Mutagenese-Experimente hilfreich sein, in denen die verschiedenen Bindestellen genauer untersucht werden. Mit den bisher durchgeführten Experimenten konnte auf mRNA- und Proteinebene die Wntabhängige Regulation von SGK1 gezeigt und anhand von Promotorreporter-Analysen weiter bestärkt werden. Daraufhin stellte sich die Frage, welche Rolle die Regulation von SGK1 durch den Wnt-Signalweg bei der Tumorigenese spielen kann. 6.2 Regulation von Transkriptionsfaktoren der FoxO-Familie durch den Wnt-Signalweg 6.2.1 Einfluss des Wnt-Signalweges auf die Lokalisation von FoxO3a Eine der in der Literatur beschriebenen Funktionen von SGK1 ist die Regulation des Transkriptionsfaktors FoxO3a, welcher unter anderem die Transkription von zellzyklusregulierenden und pro-apoptotischen Genen aktiviert (Carter and Brunet, 2007). Eine Unterbindung dieser Aktivierung geschieht durch Phosphorylierung der Aminosäuren Thr32, Ser253 und Ser315 von FoxO3a. Dies kann durch SGK1 oder auch Akt vermittelt werden (Brunet et al., 2001) und führt zur Inhibierung von FoxO3a durch aktiven Transport aus dem Zellkern ins Zytoplasma. Anhand von Immunfluoreszenz- (IF) Experimenten wurde die Lokalisierung von FoxO3a bei aktiven und inaktiven Wnt-Signalweg untersucht. Es sollte geprüft werden, ob die Wnt-vermittelte Aktivierung von SGK1 eine Auswirkung auf FoxO3a 32 ERGEBNISSE hat. Hierzu wurden HEK293T Zellen transient transfiziert. In Abbildung 8 sind die Lokalisierung von FoxO3a (YFP-gekoppelt), sowie der kotransfizierten Faktoren (entweder RFP-gekoppelt oder durch Antikörperfärbung mit Cy3-gekoppelten sekundärem Antikörper detektiert) und eine Kernfärbung (Hoechst) dargestellt. Unter normalen Bedingungen (Abb. 8A) ist transfiziertes FoxO3a ubiquitär in der Zelle verteilt, es findet sich sowohl im Zytoplasma als auch im Zellkern. Wie in Veröffentlichungen berichtet transloziert FoxO3a in den Zellkern, wenn die Zellen unter Stress stehen (Abb. 8B; Brunet et al., 2004). Hier wurde oxidativer Stress durch Zugabe von H2O2 (0,5 mM für eine Stunde ins Kulturmedium) simuliert. Wie ebenfalls in der Literatur beschrieben, ist FoxO3a fast ausschließlich im Zytoplasma zu finden, wenn SGK1 überexprimiert ist (Abb. 8C; Brunet et al., 2001; van der Horst et al., 2006). Die Pfeilspitzen in Abbildung 8C (Cy3) zeigen Zellen, die SGK1-Flag exprimieren und bei denen FoxO3a (YFP) aus dem Kern dieser Zellen ausgeschlossen ist. Dagegen ist in den dazwischenliegenden Zellen, in welchen kein SGK1 detektiert werden kann, FoxO3a überall in der Zelle verteilt, also auch im Kern lokalisiert. Bei einer Aktivierung des Wnt-Signalweges durch die Überexpression von Wnt3A-RFP (Abb. 8D), LRP6da-RFP (Abb. 8E) oder stabilisiertem β-Catenin (S33A; Abb. 8F) bzw. durch die Depletion von APC (siAPC; Abb. 8H) ist FoxO3a fast ausschließlich im Zytoplasma lokalisiert. Das bedeutet, eine Aktivierung des Wnt-Signalweges bewirkt ebenfalls wie SGK1 einen Ausschluss von FoxO3a aus dem Zellkern. Die Transfektion von siRNA gegen βCatenin (Abb. 8I) bzw. Überexpression von wtAPC (Abb. 8K) verändert nichts an der Lokalisation von FoxO3a. Es kann überall in der Zelle nachgewiesen werden. Mit Asef2-Flag (Abb. 8L) wurde eine Wnt-Signalweg unspezifische Kontrolle gewählt, die keinen Einfluss auf den Aktivitätsstatus des Wnt-Signalweges hat. In der IF ist zu sehen, dass Asef2-Flag die Lokalisierung von FoxO3a nicht verändert, was damit die Spezifität der vorher eingesetzten Faktoren zeigt. Die Transfektion von siGFP (Abb. 8G) wurde als Kontrolle der RNAiTransfektionen durchgeführt und zeigt wie die anderen Negativkontrollen keinen Einfluss auf die Verteilung von FoxO3a in der Zelle (vgl. Abb. 8G mit Abb. 8A). Vergleichbare Ergebnisse wurden auch mit FoxO4, einem weiteren Mitglied der FoxOGruppe, beobachtet (ohne Abb.). Die IF-Experimente zeigen einen Einfluss des Wnt-Signalweges auf die Lokalisation von FoxO3a. Die Aktivierung des Signalweges bewirkt den Ausschluss von FoxO3a aus dem 33 ERGEBNISSE Zellkern. Dagegen ist bei einer Inhibierung des Wnt-Signalweges kein offensichtlicher Einfluss auf die FoxO3a-Lokalisierung zu beobachten. Allerdings ist der Wnt-Signalweg in den verwendeten HEK293T Zellen nicht oder nur schwach konstitutiv aktiv und kann daher nicht wirklich inhibiert werden. 34 ERGEBNISSE Abbildung 8: Immunfluoreszenzfärbung in HEK293T Zellen zur Analyse des Einflusses von kotransfizierten Regulatoren des Wnt-Signalweges auf die Lokalisation von FoxO3a YFP: YFP-gekoppeltes FoxO3a, Cy3: Kotransfizierte Faktoren: nach Färbung der Proteine mit entsprechendem Erstantikörper wurde zur Visualisierung entsprechender Cy3-gekoppelter sekundärer Antikörper verwendet oder RFP-gekoppelte Proteine eingesetzt. Hoechst: Kernfärbung. 35 ERGEBNISSE 6.2.2 Einfluss des Wnt-Signalweges auf die transkriptionelle Aktivität von FoxO3a In den IF-Experimenten konnte beobachtet werden, dass bei aktiviertem Wnt-Signalweg FoxO3a aus dem Zellkern ins Zytoplasma transloziert. Es stellte sich die Frage, ob dieser Ausschluss von FoxO3a aus dem Zellkern auch eine Veränderung der transkriptionellen Aktivität von FoxO3a zur Folge hat. Zur Untersuchung dieses Sachverhaltes wurde ein Reportersystem verwendet, bei dem acht spezifische Bindemotive (DBEs = DNA binding elements) der FoxO-Transkriptionsfaktoren mit der Kernsequenz TTGTTTA - wie in Furuyama et al. beschrieben - vor das Reporter-Luziferasegen gesetzt wurden (Furuyama et al., 2000). Dadurch kann die FoxO-abhängige Transkription anhand der Luziferaseaktivität bestimmen werden. Die ersten Experimente mit diesem Reportersystem wurden in HCT116 durchgeführt. Sie dienten dazu, die aus der Literatur bekannten Ergebnisse (Brunet et al., 2001; Furuyama et al., 2000) zu reproduzieren, um die Funktionalität des Systems zu überprüfen. Abb. 9A zeigt eine sehr niedrige Grundaktivität des Reporterkonstruktes 8xDBE, die der des Ausgangsvektors pTA-luc entspricht. Durch Kotransfektion von FoxO3a wird die Aktivität des 8xDBE-Reporters stark und dosisabhängig gesteigert, wohingegen der Leervektor pTA-luc nicht reagiert. Die Menge an endogenem FoxO3a in HCT116 Zellen scheint niedrig zu sein, denn ohne exogen transfiziertes FoxO3a ist die Luziferaseaktivität des 8xDBE Konstruktes sehr niedrig. Die durch Kotransfektion von FoxO3a gesteigerte Aktivität des Reporters wird wiederum dosisabhängig durch SGK1 erniedrigt (Abb. 9B). Dieser Sachverhalt ist bereits bekannt (Brunet et al 2001 MCB) und bestätigt die Funktionalität des Systems zur Untersuchung der FoxO-abhängigen Transkription. In den anschließenden Untersuchungen zur transkriptionellen Aktivität von FoxO3a wurden jeweils, falls nicht anders angegeben, die Systemkomponenten 8xDBE-Reporterkonstrukt und FoxO3aExpressionsvektor mit den jeweils angegebenen Faktoren von Interesse kotransfiziert. 36 ERGEBNISSE Abbildung 9: Reportersystem zur Bestimmung der transkriptionellen Aktivität von FoxO3a Repräsentative Ergebnisse transienter Transfektionen in HCT116 mit je 20 ng der angegebenen Reporterkonstrukte zusammen mit in A) steigenden Mengen an FoxO3a (50-200 ng) bzw. in B) zu konstanter Menge (50 ng) FoxO3a steigende Mengen an SGK1 (50-200 ng). In den folgenden Reporterexperimenten wurde der Wnt-Signalweg durch einige bereits in den Immunfluoreszenzen verwendeten Faktoren aktiviert bzw. inhibiert, um deren Einfluss auf die transkriptionelle Aktivität von FoxO3a zu untersuchen. Wie bereits bekannt und geschildert, kann FoxO3a auch durch SGK1 reguliert werden (Brunet et al., 2001). Als interne Kontrolle zur Überprüfung des Systems bei Experimenten dieser Art (wie Abb. 10) wurde SGK1 verwendet. Wie zu erwarten, reduziert die Überexpression von SGK1 die transkriptionelle Aktivität von FoxO3a enorm (Abb. 10B). Ein Knock-Down von SGK1 mittels RNAi erhöht dagegen die Luziferaseaktivität deutlich (Abb. 10A; Funktionalitätstest von siSGK1 in Experiment Abb. 13B+C dargestellt). Durch Transfektion der Wnt-Signalweg aktivierenden Komponenten siAPC, β-Catenin bzw. S45A (stabilisiertes β-Catenin) wird die Luziferaseaktivität des 8xDBE-Reporterkonstrukts - verglichen mit der Grundaktivität der jeweiligen Kontrolle pcDNA3.1 bzw. siGFP (Abb. 10A+B) - deutlich erniedrigt. Im Falle von β-Catenin bzw. dominant aktiven S45A-β-Catenin erfolgt die Verringerung der Aktivität annähernd so stark wie durch die Postitivkontrolle SGK1. Im Gegensatz dazu erhöht eine Inhibierung des Wnt-Signalweges durch Transfektion von siβ-Catenin oder APC die FoxO3a- 37 ERGEBNISSE abhängige Transkription (Abb. 10A+B). siβ-Catenin erzielt einen fast so starken Effekt wie die Kontrolle siSGK1. Eine Blockierung des Wnt-Signalweges zeigt somit annähernd die gleiche Wirkung auf die FoxO3a-abhängige Transkription wie ein Knock-Down von SGK1. Bei einer simultanen Transfektion der siRNAs gegen APC und β-Catenin werden die gegensätzlichen Effekte weitgehend neutralisiert. Die Reporteraktivität von 8xDBE ist mit der der Kontrolle vergleichbar (Abb. 10A, siGFP+FoxO3a). Diese Ergebnisse korrelieren mit den Beobachtungen aus den IF-Experimenten. Folglich kann die Vermutung aufgestellt werden, dass durch die Aktivierung des Wnt-Signalweges die Translokation von FoxO3a aus dem Zellkern induziert wird. Dadurch wird die transkriptionelle Aktivität von FoxO3a gehemmt. Andererseits besteht die Möglichkeit, dass eine Kotransfektion der Wnt-Aktivatoren keinen spezifischen Einfluss auf die Regulation von FoxO3 hat. In diesem Fall könnte es sein, dass weniger FoxO3a in der Zelle ist oder vermehrt abgebaut wird und deswegen die Luziferaseaktivität sinkt. Diese Möglichkeit wurde mittels Westernblot-Analyse untersucht. Die FoxO3a-Proteinmengen wurden analysiert und das Resultat ist in Abb. 10B unter der dazugehörigen Transfektion dargestellt. Es sind vergleichbare Proteinlevel von FoxO3a in den verschiedenen Ansätzen zu beobachten. Das zeigt eine Regulation der transkriptionellen Aktivität, die nicht auf unterschiedliche FoxO3a Mengen beruht. Äquivalente Untersuchungen mit FoxO4, einem weiterem Mitglied der FoxO-Gruppe, lieferten vergleichbare Ergebnisse (Abb. 10C). Eine Aktivierung des Wnt-Signalweges erniedrigte FoxO4-abhängige Luziferaseaktivität des 8xDBE-Reporterkonstruktes. Die Aktivität wurde ebenso durch eine Inhibierung des Wnt-Signalweges über das Ausgangsniveau erhöht, wie dies auch bei einer Kotransfektion von FoxO3a zu beobachten war. Die Ergebnisse aus den IF- und den Reporterexperimenten zeigen eine Beteiligung des Wnt-Signaltransduktionsweges an der Regulation von FoxO3a. Dieser Einfluss schlägt sich sowohl auf die Lokalisation als auch auf die transkriptionelle Aktivität von FoxO3a nieder. Im weiteren Verlauf der vorliegenden Arbeit wurden dieser Einfluss und die Auswirkungen noch weiter untersucht. 38 ERGEBNISSE Abbildung 10: Einfluss des Wnt-Signalweges auf die Regulation der FoxO3a bzw. FoxO4abhängigen Transkription Repräsentative Ergebnisse transienter Transfektionen in HCT116: Transfektion des 8xDBE-Reporterkonstrukt (je 20 ng) zusammen mit -/+ je 10 ng FoxO3a in A) + B) bzw. FoxO4 in C) und den angegebenen Regulatoren (je 100 nM siRNA bzw. 50 ng Plasmid-DNA). B) unten: Westernblot zur Analyse der Proteinlevel in den jeweiligen Transfektionsansätzen wie angegeben, β-Aktin diente als Ladekontrolle. 39 ERGEBNISSE 6.2.3 Regulation der transkriptionellen Aktivität von FoxO3a durch den Wnt-Signalweg in HEK293T und LS174T Die β-Catenin-abhängige Regulation der FoxO Aktivität wurde auch in anderen Zelllinien getestet, um zu klären, ob dieser Effekt spezifisch für HCT116 Zellen ist. In Abbildung 11A+B sind Reporterassays gezeigt, die in den Zelllinien HEK293T (humane, embryonale Nierenzellen, keine Tumorlinie) und LS174T (kolorektale Tumorzelllinie) durchgeführt wurden. Die Experimente wurden genauso wie in HCT116 angelegt und zeigen ein vergleichbares Regulationsmuster des 8xDBE-Reporterkonstruktes. Ein durch Transfektion von siAPC, β-Catenin bzw. S45A aktivierter Wnt-Signalweg senkt die Luziferasewerte deutlich unter das Ausgangsniveau (pcDNA bzw. siGFP; Abb. 11A+B). Durch eine Inhibierung des Wnt-Signalweges (siβ-Catenin oder APC) wird die FoxO3aabhängige Transkription, genauso wie in HCT116, noch weiter erhöht. Das bedeutet, die Regulation der FoxO-abhängigen Transkription durch den Wnt-Signalweg ist nicht beschränkt auf HCT116 Zellen, sondern ist auch in den Zelllinien HEK293T und LS174T zu beobachten. 40 ERGEBNISSE Abbildung 11: Einfluss des Wnt-Signalweges auf die Regulation der FoxO3a-abhängigen Transkription in den Zelllinien HEK293T und LS174T Repräsentative Ergebnisse transienter Transfektionen; analog wie in Abb. 10. 41 ERGEBNISSE 6.3 Regulation der FoxO3a Aktivität durch den Wnt-Signalweg über SGK1 Die Ergebnisse der FoxO-Experimente aus Immunfluoreszenz und Reporterassays zeigen klar einen Effekt des Wnt-Signalweges auf die Regulation von FoxO3a, sowohl auf die Lokalisation als auch auf die transkriptionelle Aktivität von FoxO3a. Es stellte sich die Frage, ob der Einfluss durch die Faktoren des Wnt-Signalweges auf die Regulation von FoxO durch SGK1 vermittelt wird. Da SGK1 durch Aktivierung (Superaktivierung) des Wnt-Signalweges hochreguliert wird (Tab. 1 und Abb. 4-7) könnte die Folge daraus sein, dass FoxO3a mehr bzw. effektiver phosphoryliert wird. Dadurch könnte wiederum mehr FoxO3a aus dem Zellkern exportiert werden, wodurch die transkriptionelle Aktivität von FoxO3a gehemmt werden würde. Für den Test dieser Hypothese wurden einige Untersuchungen durchgeführt, die im Folgenden beschrieben sind. In IF- und Reporterexperimenten wurde eine Mutante von FoxO3a, FoxO3a-TM (Brunet et al., 2004), eingesetzt, die an drei Stellen mutiert ist. Es wurden die Aminosäuren Thr32, Ser253 und Ser315 zu Alaninen mutiert, was eine für den Export nötige Phosphorylierung durch SGK1/Akt an diesen Stellen nicht mehr erlaubt. Äquivalente Experimente, wie mit wtFoxO3a sollten beim Vergleich mit der Mutante Aufschluss darüber geben, ob der Wnt-Effekt auf FoxO durch SGK1 vermittelt wird. Abbildung 12 zeigt die IF-Färbung der Dreifach-Mutante FoxO3a-TM in HEK293T Zellen zusammen mit den schon bekannten, kotransfizierten Faktoren des Wnt-Signalweges. Transfiziertes FoxO3a-TM befindet sich vornehmlich im Kern der Zellen (Abb. 12A) und wird weder durch SGK1 (Abb. 12C) noch durch einen der verwendeten Aktivatoren des Wnt-Signalweges (Wnt3A, LRP6da, S45A und siAPC) aus dem Kern exportiert (Abb. 12D-F und H). Ebenso nehmen weder oxidativer Stress durch die Behandlung mit H2O2 (Abb. 12B) noch die Transfektion von siβ-Catenin (Abb. 12I) oder siGFP (als Kontrolle, Abb. 12G) einen Einfluss auf die Lokalisation von FoxO3a-TM. In den durchgeführten IF-Experimenten mit der FoxO3a-Mutante konnte durch keinen kotransfizierten Faktor ein FoxO-Export aus dem Kern beobachtet werden. FoxO3a-TM unterscheidet sich von wtFoxO3a nur durch den Austausch von drei Aminosäuren, die eine Phosphorylierung durch SGK1/Akt verhindern. Diese Mutante zeigt im Gegensatz zum Wildtyp keine Veränderung der Lokalisierung durch Kotransfektion der Aktivatoren des Wnt-Signalweges. Das bedeutet, dass die Regulation der FoxO3a 42 ERGEBNISSE Lokalisation durch den Wnt-Signalweg über die Phosphorylierung, welche auch durch SGK1 vermittelt werden kann, von FoxO3a abläuft. Abbildung 12: Immunfluoreszenzfärbung in HEK293T Zellen zur Analyse des Einflusses von kotransfizierten Regulatoren des Wnt-Signalweges auf die Lokalisation von FoxO3a-TM α-Flag: Flag-gekoppeltes FoxO3a-TM (sekundärer AB: Cy3 gekoppelt), YFP/RFP: kotransfizierte Faktoren mit YFP/RFP-Tag, Hoechst: Kernfärbung. 43 ERGEBNISSE Zur weiteren Bestätigung, dass SGK1 das Bindeglied der Wnt-vermittelten Regulation von FoxO3a darstellt, wurde die FoxO3a-Mutante auch in Reporterexperimenten, wie unter Punkt 6.2.2. (Experiment Abb. 10) beschrieben, anstelle von wtFoxO3a eingesetzt und der Einfluss des Wnt-Signalweges auf die transkriptionelle Aktivität von FoxO3a-TM analysiert. In den Reporterexperimenten mit der Dreifachmutante von FoxO3a (FoxO3a-TM, Abb. 13A) ist keine signifikante Regulation des 8xDBE-Reporterkonstrukts durch die kotransfizierten Regulatoren des Wnt-Signalweges zu beobachten. Im Gegensatz zu den Experimenten mit nicht mutiertem FoxO3a vermag weder SGK1 noch β-Catenin die transkriptionelle Aktivität von FoxO3a-TM zu verändern (Abb. 13A). Auch eine Kotransfektion von APC hat keinen Einfluss auf die Aktivität von FoxO3a-TM. Dieses Ergebnis korreliert genau mit den Beobachtungen aus den IF-Experimenten mit FoxO3a-TM (Abb. 12) und festigt die Theorie, dass der Wnt-Signalweg über SGK1 auf die FoxO3a-abhängige Transkription Einfluss nimmt. Für weitere Untersuchungen wurde siRNA gegen SGK1 gemeinsam mit Aktivatoren des Wnt-Signalweges in FoxO-Reporterassays eingesetzt. Zuvor wurde die Funktionalität der RNAi mittels Westernblot-Analyse und Reporterexperiment geprüft (Abb. 13B+C). Das verwendete siOligo gegen SGK1 ist sehr effizient im Abbau der SGK1-mRNA (Abb. 13B). Es wird exogenes, wie auch endogenes SGK1 abgebaut, da in Spur 2 und 3 SGK1 kotransfiziert wurde, und im Vergleich zu Spur 1 (endogenes SGK1) in Spur 3 die Proteinmenge von SGK1 deutlich geringer ist. Dagegen ist in Spur 2 eine deutliche Steigerung zu beobachtet, welche die Überexpression von SGK1 bestätigt. Die Funktionalität der siRNA gegen SGK1 kann auch in dem Reporterexperiment von Abbildung 13C beobachtet werden. Wie bereits in Abbildung 10 gezeigt, wird die FoxO3a-abhängige Reporteraktivität auch in dem vorliegenden Experiment durch Überexpression von SGK1 (Abb. 13C) gesenkt und durch Wegnahme (RNAi) von SGK1 gesteigert. Der hemmende Effekt von SGK1 auf die Aktivität von FoxO3a wird durch den RNAi vermittelten KnockDown von SGK1 wieder aufgehoben. Die transkriptionelle Aktivität steigt noch über das Ausgangsniveau (siGFP), was darauf hindeutet, dass auch endogenes SGK1 abgebaut wird. Diese beiden Experimente (Abb. 13B+C) zeigen, dass die verwendete siRNA gegen SGK1 sehr effektiv arbeitet und die mRNA von SGK1 (einschließlich exogenem SGK1) fast vollständig abgebaut wird. Gleiche Resultate wurden auch durch den Einsatz eines zweiten RNAi-Oligos gegen SGK1 erhalten (Daten nicht gezeigt). 44 ERGEBNISSE Im folgenden Experiment sollte untersucht werden, ob die Hemmung der FoxO3a Aktivität durch einen aktivierten Wnt-Signalweg (Transfektion von siAPC oder β-Catenin; Abb. 10A+B) bei einer Kotransfektion von siSGK wieder aufgehoben wird. Genau dies ist der Fall: Ein zusätzlicher Knock-Down von SGK1 hebt die durch siAPC oder β-Catenin vermittelte Erniedrigung der transkriptionellen Aktivität von FoxO3a wieder auf. Das Niveau wird deutlich über das Ausgangsniveau (siGFP) hinaus, annähernd bis zu dem Level des siSGK1/siGFP Kontroll-Ansatzes (Abb. 13D), gesteigert. Diese Ergebnisse spiegeln die Beobachtungen aus dem vorhergehenden Experiment (Abb. 10A+B und 13C) wider und zeigen, dass die Regulation von FoxO3a (und FoxO4, ohne Abb.) durch den Wnt-Signalweg weitgehend über SGK1 vermittelt wird. 45 ERGEBNISSE Abbildung 13: Regulation Wnt-Signalweg über SGK1 der transkriptionellen Aktivität von FoxO3a durch den A) Repräsentatives Ergebnis transienter Transfektionen in HCT116: Kotransfektion des 8xDBE-Reporterkonstrukt (je 20 ng) zusammen mit -/+ FoxO3a-TM (je 10 ng) und den angegebenen Regulatoren (je 50 ng). B) Test der RNAi gegen SGK1 in Westernblot Analyse, β-Aktin diente als Ladekontrolle, C) Test der RNAi gegen SGK1 im Reporterassay: Kotransfektion der siRNAs (je 100 nmol) bzw. Plasimd-DNA (je 50 ng) zu 8xDBE-Reporter (je 20 ng) und FoxO3a (je 10 ng), D) Repräsentatives Ergebnis transienter Transfektionen in HCT116 analog C). 46 ERGEBNISSE 6.4 Analyse der Spezifität von Regulatoren des Wnt-Signalweges in Bezug auf die Regulation der transkriptionellen Aktivität von FoxO3a Es wurden mehrere Kontrollexperimente durchgeführt, welche die Spezifität der eingesetzten Regulatoren des Wnt-Signalweges in Bezug auf die Regulation der FoxO-abhängigen Transkription prüfen sollten. Es könnte sein, dass diese Faktoren generell einen Einfluss auf Reportersysteme haben und somit in den Experimenten eine unspezifische Regulation dokumentiert wurde. Dazu wurden die Wnt-Regulatoren zusammen mit anderen Reportersystemen kotransfiziert. In diesen Systemen sollten die Wnt-Regulatoren keinen Einfluss auf die Aktivität der Reporter nehmen. Vorab ist in Abbildung 14A das spezifische Potential der verwendeten Faktoren bezüglich der Regulation des Wnt-Signalweges dargestellt. In transienten Transfektionen des TOP/FOP-Systems in HCT116 Zellen zeigen die Faktoren siAPC, β-Catenin und S45A (stabilisiertes β-Catenin) eine deutliche Aktivierung von TOP über FOP. Ein Knock-Down von β-Catenin vermindert die Aktivität unter das Ausgangsniveau der siGFP-Kontrolle. Eine Kotransfektion von wtAPC zeigt in diesem System eine geringe Verminderung von TOP/FOP. Diese Faktoren zeigen die bekannten und erwarteten Effekte auf den Wnt-Signalweg. Wie schon erwähnt wurden diese Faktoren nun auch noch in anderen Reportersystemen getestet, um eine eventuelle, unspezifische Regulation zu prüfen. Zum einen wurden die Reporter pTA-luc, pGL2-control und ein ca. 500 bp langes Fragment des putativen Promotors von c-fos (Dr. B. Mayr) mit den Faktoren kotransfiziert. Das Ergebnis der Experimente ist zusammengefasst in Abbildung 14B dargestellt: Die Luziferasewerte der drei Test-Reporter werden durch keinen der verwendeten Regulatoren signifikant verändert. Zum anderen wurden die Faktoren des Wnt-Signalweges in einem Reporter-System von STRATAGENE gestestet, mit dem die transkriptionelle Aktivität von c-Jun gemessen werden kann. Das Reporterkonstrukt pFR-luc dieses Systems wird durch c-Jun (pFA2Jun) aktiviert, ähnlich wie FoxO3a die Aktivität des 8xDBE-Reporters induziert. Keiner der kotransfizierten Wnt-Regulatoren nimmt Einfluss auf die Aktivität des c-Jun-Systems (Abb. 14C). Dagegen ist bei einer Kotransfektion der Positivkontrolle MEKK, wie zu erwarten, eine weitere und deutliche Steigerung der Luziferaseaktivität von pFR-luc zu beobachtet. 47 ERGEBNISSE Durch die Ergebnisse der Test-Experimente kann eine unspezifische Regulation der FoxO3aabhängigen Transkription durch die verwendeten Faktoren des Wnt-Signalweges ausgeschlossen werden, da diese in anderen, unabhängigen Systemen keinen regulatorischen Einfluss zeigen. Abbildung 14: Kontrollexperimente zur Überprüfung der Spezifität von Wnt-Regulatoren bezüglich der FoxO-abhängige Transkription Repräsentative Ergebnisse transienter Transfektionen in HCT116: A) Regulation von TOP/FOP durch die angegebenen Regulatoren des Wnt-Signalweges. Kotransfektionen der Regulatoren mit den angegebenen Reportern B) oder im cJun-System C) zeigen keine signifikanten Veränderungen der Reporteraktivitäten. MEKK ist ein bekannter Aktivator des c-Jun-Signalweges und diente als Positivkontrolle. 48 ERGEBNISSE 6.5 Veränderung der Apoptoserate durch den Wnt-Signalweg 6.5.1 Einfluss des Wnt-Signalweges auf die Transkription der FoxO3a-Zielgene Bcl2-interacting mediator (BIM) und p27KIP1 Bislang wurde ein Einfluss des Wnt-Signalweges auf die Lokalisation und die transkriptionelle Aktivität von FoxO3a gezeigt. Des Weiteren wurde nachgewiesen, dass dieser Einfluss über die Regulation von SGK1 vermittelt wird. Nun stellte sich die Frage, ob ein Nachweis einer Relevanz in vivo für diese Regulation von FoxO3a durch den Wnt-Signalweg erbracht werden kann. Dazu wurden im Folgenden in Reporterexperimenten zwei Zielgene von FoxO3a untersucht, sowie Apoptosemessungen durchgeführt. In der Literatur ist bekannt, dass eine Aktivierung von FoxO3a zu Zellzyklusarrest und Apoptose führen kann (Dijkers et al., 2002; Dijkers et al., 2000a; Dijkers et al., 2000b; Nakamura et al., 2000; Stahl et al., 2002; Takaishi et al., 1999). Dies wird durch die Induktion der Transkription von FoxO3a-Zielgenen erreicht, zu denen unter anderen auch die Gene p27KIP1 und BIM (Bcl2 interacting mediator) gehören. Die endogenen, putativen Promotoren von p27KIP1 und BIM wurden vor das Reportergen Luziferase kloniert (Motta et al., 2004) und freundlicherweise von Dr. R. H. Medema zur Verfügung gestellt. In transienten Transfektionen mit den bereits verwendeten Komponenten des Wnt-Signalweges konnte ein Regulationsmuster dieser Promotoren beobachtet werden, welches mit dem des artifiziellen 8xDBE Reporterkonstruktes vergleichbar ist. Beide Konstrukte zeigen eine Steigerung der Reporteraktivität durch FoxO3a. Bei einer zusätzlichen Kotransfektion der Aktivatoren des Wnt-Signalweges wird die Promotoraktivität von BIM (Abb. 15A) und p27KIP1 (Abb. 15B) verglichen mit der Kontrolle (FoxO3a + pcDNA3.1) erniedrigt. Wohingegen in Kombination mit dem Inhibitor APC des Wnt-Signalweges die Luziferaseaktivität der Reporter erhöht ist. Im Vergleich zu dem artifiziellen 8xDBE-Reporterkonstrukt sind die Grundaktivitäten der Promotoren deutlich höher (auch ohne kotransfiziertes FoxO3a). Das ist nicht ungewöhnlich, da Promotorfragmente oft eine gewisse Grundaktivität aufweisen. Durch die erhöhte Grundaktivität sind die regulatorischen Effekte nicht so stark wie mit dem 8xDBE-Reporter, aber dennoch signifikant. Vergleicht man die Werte der Kotransfektionen von β-Catenin und S45A mit denen von kotransfizierter SGK1, fällt auf, dass diese Regulatoren die Aktivität genauso stark und annähernd auf das Ausgangsniveau (Grundaktivität; pcDNA ohne FoxO3a) 49 ERGEBNISSE senken. Das heißt, die durch transfiziertes FoxO3a induzierte Aktivität wird wieder annähernd vollständig geblockt. Eine Kotransfektion von APC, also eine Inaktivierung des Wnt-Signalweges, erhöht die FoxO3a-induzierte Aktivität der Promotoren noch weiter. Das Regulationsmuster dieser Promotoren von FoxO3a-Zielgenen zeigt ein dem artifiziellen 8xDBE-Konstrukt vergleichbares Profil. Diese Experimenten dokumentieren, dass die Regulation von FoxO3a durch den Wnt-Signalweg Promotoren von FoxO3a-Zielgenen anspricht und geben damit einen ersten Hinweis auf eine in vivo Funktion. Abbildung 15: Einfluss des Wnt-Signalweges auf die Promotorenaktivität der FoxO3a-Zielgene BIM (Bcl2-interacting mediator) und p27KIP1 Repräsentative Ergebnisse transienter Transfektionen in HCT116 der Promotorreporter-Konstrukte der Gene A) BIM und B) p27KIP1 (je 20 ng); Kotransfektionen mit den angegebenen Regulatoren (je 50 ng) und -/+ FoxO3a (je 10 ng). 50 ERGEBNISSE 6.5.2 Inhibierung der FoxO3a-induzierten Apoptose durch den Wnt-Signalweg Es ist bekannt, dass eine Induktion der BIM-Expression den programmierten Zelltod einleiten kann (O'Connor et al., 1998). In den Reporterexperimenten wurde eine Inhibierung der Aktivität des BIM-Promotors beobachtet, als der Wnt-Signalweg aktiviert wurde. Eine Hemmung der Transkription von BIM durch aktivierten Wnt-Signalweg könnte eine Verminderung der Apoptoserate bewirken und würde so das Tumorwachstum begünstigen. Es sollte getestet werden, ob eine Aktivierung des Wnt-Signalweges durch die Regulation von BIM auch die Apoptose hemmen kann. Mittels TUNEL (TdT-mediated dUTP-biotin nick end labeling; TdT: terminal deoxynucleotidyl transferase) Experimente (Abb. 16) wurde getestet, ob ein Einfluss auf die Apoptoserate durch den Wnt-Signalweg besteht und gemessen werden kann. Während der Apoptose wird der DNA-Strang durch die Aktivität von Endonukleasen fragmentiert. Die an den Bruch-Enden frei werdenden 3'-OH-Gruppen werden durch das Enzym TdT mit markierten Nukleotiden versehen und können im Durchflusszytometer vermessen werden. Die vom Hersteller (Invitrogen) mitgelieferten Kontrollzellen mit induzierter Apoptose zeigen in der FACS-Messung 40 % apoptotische Zellen (pos. Kontrolle in Abb. 16A; neg. Kontrolle 1 %). Durch Transfektion von FoxO3a in HCT116 Zellen konnten 25 % bzw. durch die doppelte Menge FoxO3a 38 % apoptotische Zellen gemessen werden. Die pcDNA3.1 Kontrolltransfektion zeigte einen Wert von 9 % an apoptotischen Zellen, was einem normalen Wert in solchen Transfektionsexperimenten entspricht. Im folgenden Experiment (Abb. 16B) wurden Faktoren des Wnt-Signalweges kotransfiziert und die Rate von apoptotischen Zellen vermessen. In Abbildung 16B sind die durch FoxO3a induzierten, apoptotischen Zellen auf 100 % gesetzt. Die Ergebnisse der Kotransfektionen sind in Relation zu den FoxO3ainduzierten, apoptotischen Zellen dargestellt. Bei Kotransfektion von SGK1 wurde die FoxO3a-induzierte Apoptoserate um 70 % gesenkt (von den auf 100 % gesetzten, FoxO3a induzierten auf ca. 30 %). Bei Aktivierung des Wnt-Signalweges durch β-Catenin oder S33A wird die Zahl der durch FoxO3a-induzierten apoptotische Zellen deutlich erniedrigt. Die FoxO3a-induzierte Apoptoserate wird noch weiter gesteigert, wenn der Wnt-Signalweg durch Kotransfektion von APC inhibiert wird (Abb. 16B). Damit zeigen auch die Ergebnisse der TUNEL-Assays einen Einfluss des Wnt-Signalweges auf die FoxO3a induzierte Apoptose. 51 ERGEBNISSE Abbildung 16: Einfluss des Wnt-Signalweges auf den programmierten Zelltod Repräsentative Ergebnisse von TUNEL-Assays in HCT116: A) Test des Assays und Überprüfung des Potentials von FoxO3a Apoptose zu induzieren, B) Kotransfektion von FoxO3a und Regulatoren des Wnt-Signalweges, um dessen Einfluss auf die Apoptoserate zu untersuchen. Die Messungen der Apoptoserate korrelieren mit den vorherigen Ergebnissen und dadurch kann zusammenfassend folgendes Model aufstellt werden: SGK1 ist als Zielgen des Wnt-Signalweges das Bindeglied zur Regulation der Lokalisation und transkriptionellen Aktivität von FoxO3a. Das heißt, durch den Aktivitätsstatus des Wnt-Signalweges entsteht ein Einfluss auf die Transkription von FoxO3a-Zielgenen und dadurch auch auf den programmierten Zelltod. Das deutet daraufhin, dass ein aktivierter Signalweg die Apoptoserate senken kann und dadurch die Entstehung und das Wachstum von Tumoren begünstigen könnte. 52 DISKUSSION 7 Diskussion Im Rahmen dieser Arbeit wurde SGK1 als Zielgen des Wnt-Signalweges identifiziert. Dieses Gen zeigt wie andere schon bestätigte Zielgene, z. B. Axin2/Conductin, ein Regulationsmuster, das dem Aktivitätstatus des Wnt-Signaltransduktionsweges folgt. Weiter konnte gezeigt werden, dass diese Regulation von SGK1 durch den Wnt-Signalweg einen Einfluss sowohl auf die Lokalisation als auch auf die Aktivität des Transkriptionsfaktors FoxO3a hat. In anschließenden Experimenten wurde nachgewiesen, dass der Wnt-Signalweg an der Regulation der FoxO3a-induzierten Apoptose - vermutlich über SGK1 - beteiligt ist. Dadurch könnte die tumorigene Funktion des Wnt-Signalweges nicht nur über die Steigerung der Zellproliferation erfolgen, sondern auch über die Aktivierung von SGK1, welches durch FoxO3a anti-apoptotisch wirkt. 7.1 Neues Zielgen des Wnt-Signalweges: SGK1 Die ersten Hinweise auf eine Regulation von SGK1 durch den Wnt-Signalweg wurden durch DNA-Microarrays gewonnen und konnten durch weitere Untersuchungen - quantitative RTPCR, Westernblot-Analyse und Promotorreporter-Assays - bestätigt werden. Auch in der Literatur finden sich vereinzelte Publikationen, in denen eine Regulation von SGK1 durch den Wnt-Signalweg beobachtet, aber nicht weiter untersucht wurde. So zeigen Naishiro und Kollegen (Naishiro et al., 2005) erhöhte SGK1 Proteinmengen in Gewebeschnitten aus Dickdarmadenomen von FAP-Patienten, die wie schon erwähnt, mutiertes APC haben. Des Weiteren wird auch in der Veröffentlichung von Labbé (Labbe et al., 2007) eine Aktivierung von SGK durch Wnt3a-Stimulation in einem zellulären System erwähnt. Die Ergebnisse der vorliegenden Arbeit bestätigen eindeutig die β-Catenin/TCF-abhängige Regulation von SGK1. Die Superaktivierung des Wnt-Signalweges in HCT116 mittels RNAi-vermittelten Knock-Down von APC zeigte eine Aktivierung von SGK1. Da APC nicht nur ein Faktor in der Wnt-Signaltransduktion darstellt, sondern auch noch andere Funktionen hat, wurde durch eine zusätzliche, gleichzeitige Wegnahme von β-Catenin (siβ-Catenin) ausgeschlossen, dass die Regulation von SGK1 ein APC-spezifischer Effekt ist, der nicht durch den kanonischen Wnt-Signalweg vermittelt wird. Es stellte sich die Frage, ob die Regulation von SGK1 durch 53 DISKUSSION den Wnt-Signalweg spezifisch für einen superaktivierten Signalweg ist. Die Untersuchungen im DLD1-dnTCF (-/+dox) System erbrachten, dass SGK1 nicht nur bei superaktivierten Wnt-Signalweg β-Catenin/TCF-abhängig reguliert ist. Zusätzlich konnte beim Vergleich von Wnt1 exprimierenden Rat2 Zellen mit Rat2 MV7 Kontrollzellen auch die Wnt-abhängige Regulation von SGK1 nachgewiesen werden. Das bedeutet zum einen, dass die Regulation von SGK1 durch den Wnt-Signalweg nicht exklusive für Tumorzellen ist. Zum anderen entspricht die Stimulation mit Wnts einer generellen Regulation durch den Wnt-Signalweg und widerspricht zudem einer spezifischen Regulation von SGK1 nur bei superaktiviertem Wnt-Signalweg. Außerdem konnte durch Promotorreporter-Experimente in verschiedenen Systemen mit unterschiedlichen Stimuli, die den Wnt-Signalweg aktivierten oder inhibierten, die β-Catenin-abhängige Regulation von SGK1 untermauert werden. Ein weiterer Sachverhalt aus der Literatur der eine Regulation von SGK1 durch den Wnt-Signalweg in Beziehung setzt, ist: SGK1 stellt ein Ziel dar, welches durch Wachstumsfaktoren aktiviert wird, und der Wnt-Signaltransduktionsweg ist ein Signalweg, der Zellwachstum reguliert. 7.2 Direkte oder indirekte Regulation von SGK1 durch den Wnt-Signalweg Bei der Untersuchung der Regulation von SGK1 durch den Wnt-Signalweg sollte auch geklärt werden, ob dies eine direkte oder eine indirekte Regulation ist. Bei der Analyse des Promotors von SGK1 wurden Deletionskonstrukte angefertigt und in Reporterassays getestet. Alle Konstrukte zeigten eine starke Wnt-abhängige Regulation. Allerdings konnte kein Motiv identifiziert werden, das für die Regulation verantwortlich ist. Auch das kürzeste Promotorkonstrukt (SGK1 III) ohne eine der definierten Bindestellen ist noch durch βCatenin reguliert. Eine mögliche Erklärung hierfür ist, dass sich innerhalb dieser verbliebenen Sequenz des Promotorkonstruktes noch drei weitere Bereiche befinden, die den TCF-Motiven sehr ähnlich sind. Sie unterscheiden sich von diesen nur durch den Austausch von einer Base. Möglicherweise können auch diese Sequenzbereiche eine Regulation durch β-Catenin vermitteln. Eine genaue Untersuchung dieser potentiellen Bindemotive im SGK1-Promotor könnte zeigen, ob sich darunter eine für die Regulation durch β-Catenin relevante Bindestelle befindet. Eine Identifizierung von regulatorischen TCF-Bindestellen durch PromotorreporterAnalysen stellt sich häufig als schwierig dar, denn Deletions- und Mutationsanalysen liefern 54 DISKUSSION nicht immer eindeutige Erkenntnisse. Dies ist auch in der Publikation von Jho und Kollegen bei der Untersuchung des Promotors von Axin2/Conductin (Jho et al., 2002) zu beobachten. Die Autoren führten eine Deletions- und Mutationsanalyse des Promotors von Axin2 durch und erhielten kontroverse Ergebnisse. Die Wnt/β-Catenin-abhängige Luziferaseaktivität des Promotors wurde durch Deletion eines großen DNA-Bereichs, in dem sich sechs TCFBindestellen befinden, sehr stark gesenkt (>70 %). Allerdings wurde die Aktivität durch Einführung von Mutationen in alle TCF-Bindemotive um nicht einmal 30 % gesenkt. Das deutet darauf hin, dass die umliegende Sequenz für die Wnt-abhängige Regulation des Axin2 Promotors ebenfalls wichtige Elemente enthält und die Regulation nicht allein über die TCFBindestellen vermittelt wird. Dies kann auch für den SGK1 Promotor der Fall sein. Ein anderer Mechanismus der Regulation von SGK1 durch den Wnt-Signalweg könnte durch die Involvierung eines weiteren Faktors vonstatten gehen, also eine indirekte Regulation sein. Ein bekanntes Beispiel dafür ist die indirekte, negative Regulation des ZellzyklusKinaseinhibitors p21WAF1 durch den Wnt-Signalweg (van de Wetering et al., 2002; Ziegler et al., 2005). In Untersuchungen wurde gezeigt, dass die Expression von p21WAF1 durch den Faktor MIZ-1 (MYC interacting zink finger protein 1) und dem direkten Wnt-Zielgen MYC geregelt wird. In epithelialen Darmzellen dient diese MYC/MIZ-1/p21WAF1-Kaskade als Schalter zwischen Differenzierung und Proliferation. Als ein direktes Zielgen des Wnt-Signalweges nimmt MYC eine Sonderstellung ein, da MYC seinerseits die Transkription von sehr vielen Genen sowohl durch Aktivierung als auch durch Reprimierung steuert. Eine Regulation von SGK1 durch MYC oder einem anderen Zielgen des Wnt-Signalweges ist bisher nicht bekannt. Mit den in der vorliegenden Arbeit aufgeführten Ergebnissen konnte eindeutig nachgewiesen werden, dass SGK1 durch den Wnt-Signalweg reguliert wird. Ob dies eine direkte oder indirekte Regulation ist, bleibt noch zu klären und ist für die funktionelle Relevanz der SGK1 Induktion durch Wnt Signale nicht von Belang. 7.3 Regulation von FoxO3a durch den Wnt-Signalweg über SGK1 Ein in der Literatur beschriebenes Substrat von SGK1 ist der Transkriptionsfaktor FoxO3a. FoxO3a reguliert unter anderem die Transkription des Zellzyklus-regulierenden Genes p27KIP1 und des Apoptose-induzierenden Genes BIM. Eine Inhibierung der FoxO3a 55 DISKUSSION Aktivität geschieht weitgehend durch Phosphorylierung, die auch von SGK1 vermittelt werden kann (Brunet et al., 2001; Park et al., 1999). Die Ergebnisse der vorliegenden Arbeit zeigen einen repressiven Effekt des Wnt-Signalwegs auf FoxO3a, der über SGK1 vermittelt wird. In Immunfluoreszenz- (IF) Experimenten wurde ein Export von FoxO3a aus dem Zellkern beobachtet, der durch aktiven Wnt-Signalweg induziert wurde. Es wurde durch den Vergleich von Wildtyp FoxO3a mit einer FoxO3a-Mutante (FoxO3a-TM), die nicht mehr durch SGK1 phosphoryliert und reguliert werden kann, herausgearbeitet, dass für die Wnt-Signalweg-vermittelte Translokation von FoxO3a aus dem Zellkern diese Phosphorylierungen notwendig sind. Das Verwenden von siRNA gegen SGK1 in den IFExperimenten zeigte keinen homogenen Phänotyp. Es war nicht eindeutig zu detektieren, ob die Wnt-vermittelten Effekte auf die Lokalisation von FoxO3a durch einen Knock-Down von SGK1 wieder aufgehoben werden. Das Problem besteht einerseits darin, dass die Transfektionseffizienz nur bei etwa 50 % liegt und andererseits auch nicht nachgewiesen werden kann, welche Zellen die siRNA überhaupt aufgenommen haben. Transfizierte sowie endogene Proteine konnten gefärbt und genau analysiert werden, ob sie exprimiert wurden und wo sie in der Zelle lokalisiert waren. FoxO3a ist durch eine Aktivierung des Signalweges vorwiegend im Zytoplasma der Zellen zu finden, dagegen ist bei der Mutante keine Veränderung der nukleären Lokalisation festzustellen. Reportergen-Experimente bestätigten ebenfalls einen Einfluss des Wnt-Signalweges auf die transkriptionelle Aktivität von FoxO3a. In den Reportergen-Experimenten wurde sowohl durch das Verwenden der FoxO3a-Mutante als auch durch siRNA gegen SGK1 nachgewiesen, dass die Regulation von FoxO3a durch den Wnt-Signalweg über SGK1 abläuft. Dabei stellt sich die Frage, wie die Phosphorylierung von SGK1 vermittelt wird bzw. wie dies bei einer erhöhten Expression von SGK1 vonstatten geht. Dieser Sachverhalt wird auch in der Veröffentlichung von Mikosz und Kollegen (Mikosz et al., 2001) diskutiert. Die Autoren berichten von einer Steigerung der Expression von SGK1 - in ihrem Fall durch die Aktivierung von Glucocorticoid-Rezeptoren - und einem daraus resultierenden, SGK1-vermittelten anti-apoptotischen Effekt. Sie zeigen durch spezifische Inhibition der PI3-Kinase, dass die endogene PI3-Kinase Aktivität in den verwendeten Zellen (MEC = mammary epithelial cells) ausreichend für die Phosphorylierung des erhöhten SGK1 Levels ist (Mikosz et al., 2001). Diese Argumente können auch auf die in der vorliegenden Arbeit durchgeführten Experimente übertragen werden. Für den Großteil der Experimente wurden epitheliale Tumorzellen (HCT116) verwendet, für die außerdem eine erhöhte PI3-Kinaseaktivität aufgrund einer Mutation des PIK3CA-Gens gezeigt wurde 56 DISKUSSION (Samuels et al., 2005). Die endogene Kinaseaktivität von PI3-Kinase ist in dem verwendeten System offensichtlich ausreichend, um die erhöhten SGK1 Mengen zu phosphorylieren. Allerdings ist bisher der Einfluss von PKB/Akt in Bezug auf die Regulation von FoxOs durch den Wnt-Signalweg noch nicht geklärt. Wie bereits beschrieben, ist PKB/Akt ebenfalls ein negativer Regulator von FoxO3a (Brunet et al., 1999; Kops et al., 1999) und es gibt Hinweise, dass PKB/Akt ebenfalls durch den Wnt-Signalweg reguliert wird (Dihlmann et al., 2005). Die hier gezeigten Ergebnisse deuten darauf hin, dass der Wnt-Signalweg durch die Regulation von SGK1 und evtl. zusätzlich von PKB/Akt der FoxO3a-Aktivität entgegenwirkt. Eine Regulation von PKB/Akt durch den Wnt-Signalweg konnte in den für die vorliegende Arbeit durchgeführten DNA Microarrays nicht beobachtet werden. Die darauf folgenden Experimente wurden in denselben Systemen durchgeführt und es kann vermutet werden, dass PKB/Akt zumindest in diesen Systemen nicht oder nur schwach durch den Wnt-Signalweg reguliert ist. Ein Ausschluss von FoxO3a aus dem Zellkern und die daraus resultierende Hemmung der FoxO-Aktivität ist am effektivsten, wenn alle drei regulatorischen Aminosäurereste phosphoryliert sind (Thr32 durch beide Kinasen, Ser253 durch Akt und Ser315 durch SGK1). Brunet und Kollegen konnten ein vergleichbares Potential für PKB/Akt und SGK1 in Bezug auf die Phosphorylierung der jeweiligen Aminosäuren von FoxO3a messen (Brunet et al., 2001). Für eine effektive Regulation von FoxO3a vermuten sie ein Zusammenspiel der beiden Kinasen. Deswegen könnte man spekulieren, dass eine Regulation von SGK1 und PKB/Akt1 durch den Wnt-Signalweg sinnvoll wäre, um eine effektive Regulation von FoxO3a zu gewährleisten. Aber auch die Phosphorylierungen, die von einer der beiden Kinasen vermittelt werden, sind ausreichend für einen - etwas verminderten Einfluss auf die Regulation von FoxO3a (Brunet et al., 2001). Eine Regulation von FoxO3a durch jeweils nur eine der beiden Kinasen könnte aber auch durch unterschiedliche externe Reize induziert werden. Ob PKB/Akt durch den Wnt-Signalweg an der Regulation von FoxOs beteiligt ist, bleibt noch zu klären. Für SGK1 wurde in der vorliegenden Arbeit der Nachweis erbracht, dass es ein durch β-Catenin/TCF-reguliertes Gen ist und bei der Wnt-vermittelten Regulation der FoxO3a Aktivität involviert ist. Für den Einfluss von β-Catenin auf die FoxO3a-abhängige Transkription zeigen Essers und Kollegen in ihrer Veröffentlichung (Essers et al., 2005) Daten, die im Gegensatz zu den in der vorliegenden Arbeit erzielten Resultaten stehen. Die Autoren zeigen eine Regulation der FoxO3a-abhängigen Transkription, die durch β-Catenin nicht, wie in der vorliegenden Arbeit gezeigt, erniedrigt, sondern erhöht wird. Bisher konnte noch keine Begründung für diese 57 DISKUSSION Diskrepanz gefunden werden. Durch Titration von β-Catenin in Reporterexperimenten konnte nicht nachgewiesen werden, ob es eventuell einen Schwellenwert für β-Catenin gibt, an dem eine Repression von FoxO3a in eine Aktivierung umschlägt. Es wurde eine dosisabhängige Repression der Aktivität von FoxO3a durch β-Catenin beobachtet. Der Widerspruch zu den Beobachtungen von Essers und Kollegen könnte durch einen direkten Vergleich der experimentellen Durchführung (DNA-Mengen und Inkubationszeiten) oder auch durch Austausch und Kombination der jeweils verwendeten Materialien (Zelllinien und Plasmide) geklärt werden. 7.4 Einfluss des Wnt-Signalweges auf die FoxO3a-induzierte Apoptose Bekannte Zielgene von FoxO3a sind unter anderen auch die Gene BIM (Bcl-2 interacting mediator) und p27KIP1. In Reporterassays wurde der Einfluss des Wnt-Signalweges auf die Regulation der Transkription dieser Gene gezeigt. Eine Aktivierung von BIM induziert den programmierten Zelltod. Deshalb wurde ein möglicher Einfluss des Wnt-Signalweges auf die Regulation der FoxO3a-induzierten Apoptose untersucht. Mittels TUNEL-Messungen konnte eine Wnt-abhängige Regulation der FoxO3a-induzierten Apoptose nachgewiesen werden. Aufgrund der vorhergehenden Untersuchungen liegt die Vermutung nahe, dass dies über SGK1 vermittelt wird. Mit anderen Methoden zur Messung von Apoptose, wie AnnexinVoder Propidiumiodid (PI)- Färbung, konnte keine signifikante Regulation der FoxO3ainduzierten Apoptose nachgewiesen werden. Zwar konnte eine Induktion der Apoptose durch FoxO3a gemessen werden, allerdings war keine signifikante Änderung der Apoptoserate durch Koexpression der Regulatoren des Wnt-Signalweges zu beobachten. Auch eine Überexpression von SGK1, der „Positivkontrolle“ führte nicht zu einer Abnahme der FoxO3a-induzierte Apoptose. Offensichtlich sind diese Techniken nicht geeignet, um in den hier angewandten Systemen die Regulation der FoxO3a-induzierten Apoptose aufzuzeigen. Der TUNEL-Assay scheint für die vorliegende Fragestellung und das System die beste Messmethode zu sein, da sie sehr sensitiv ist. Mit dieser Methode konnte die FoxO3ainduzierte Apoptose gut bestimmt und auch der repressive Effekt von SGK1 nachgewiesen werden. 58 DISKUSSION 7.5 SGK1 und Tumorigenese 7.5.1 Möglicher Einfluss auf die Tumorigenese von SGK1 durch die Regulation von epithelialen Natriumkanälen (ENaC) In der vorliegenden Arbeit wurde eine mögliche Relevanz für die Aktivierung des SGK1Genes durch den Wnt-Signalweg auf die Tumorigenese untersucht: die Regulation des Transkriptionsfaktors FoxO3a durch SGK1. Eine weitere, auch in der Einleitung bereits angesprochene Funktion von SGK1 ist die Regulation der Aktivität von epithelialen Natriumkanälen (ENaC = epithelial Na+ channel). SGK1 kontrolliert über die Ubiquitin Ligase Nedd4-2 (neuronal expressed developmentally downregulated 4-2) die Aktivität von ENaC (Canessa et al., 1993; Naray-Fejes-Toth et al., 2004; Pearce, 2003). Dies ist eine wichtige Funktion von SGK1, denn in SGK1 Knock-Out Mäusen ist kein ausgeprägter Phänotyp festzustellen, außer einer Beeinträchtigung der Natriumkanäle in der Niere. Welche Folgen eine konstitutive Expression von SGK1 und damit eine erhöhte Aktivität der Natriumkanäle auf die Tumorigenese haben könnte, ist bisher nicht beschrieben. Allerdings finden sich in der Literatur etliche Berichte, in denen ein Einfluss von Ionenkanälen auf die Entstehung von Krebs diskutieren wird (Anderson et al., 2003; Fiske et al., 2006; Kunzelmann, 2005; Laniado et al., 2001; Monteith et al., 2007; Preussat et al., 2003; Prevarskaya et al., 2007a; Prevarskaya et al., 2007b). Die Ionenkanäle der Plasmamembran sind nahezu an allen grundlegenden zellulären Prozessen beteiligt, auch an solch kritischen wie Proliferation, Differenzierung und Apoptose. Erhöhte Proliferation, anomale Differenzierung und eine beeinträchtigte Regulation des programmierten Zelltodes sind die ersten Anzeichen von verändertem Gewebewachstum. Solche Eigenschaften können später in unkontrollierte Expansion und Invasion – Charakteristika von Krebs – resultieren (Prevarskaya et al., 2007a). Eine veränderte Aktivität von Ionenkanälen kann so möglicherweise das Tumorwachstum fördern (Kunzelmann, 2005). Beim Vergleich von gesunden Zellen mit Zellen aus Tumorgeweben wurde eine Korrelation mit einer Veränderung der Aktivität von Ionenkanälen beobachtet (Abdul and Hoosein, 2006; Kunzelmann, 2005). In Prostatakrebszellen wurde eine erhöhte Aktivität von Natriumkanälen beobachtet, welche mit einer erhöhten Resistenz gegenüber Apoptose einhergeht (Prevarskaya et al., 2007a). Somit gibt es Hinweise, die einen Einfluss der Ionenkanäle auf die 59 DISKUSSION Tumorentwicklung vermuten lassen. SGK1 ist ein Regulator von epithelialen Natriumkanälen. Eine Aktivierung von SGK1 durch den Wnt-Signalweg könnte über diesen Weg zusätzlich an der Tumorigenese beteiligt sein. Mit Hilfe von APCmin-Mäusen könnte diese Theorie untersucht werden. Durch das Kreuzen von APCmin-Mäusen mit SGK1 KnockOut Mäusen könnte man verfolgen, ob die Regulation von SGK1 durch den Wnt-Signalweg eine messbare Funktion in vivo hat. Ein Vergleich dieser gekreuzten Mäuse könnte zeigen, ob durch den Verlust von SGK1 ein Tumorwachstum schneller entstehen und fortschreiten kann. Sollte ein solcher Effekt zu beobachten sein, könnte im Anschluss durch weitere Untersuchungen geklärt werden, ob dies durch die Regulation der Natriumkanäle, der FoxOProteine oder durch beide Funktionen von SGK1 vermittelt wird. 7.5.2 Veränderungen des Expressionsprofils von SGK1 im Verlauf der Tumorigenese Im Verlauf dieser Arbeit konnten DNA-Microarraydaten (von Dr. F. Rödel, Strahlenklinik, Universität Erlangen) eingesehen werden, die aus Tumorgewebeproben von Patienten mit Darmkrebs generiert wurden. Es wurden die Expressionsprofile von normalem, gesundem Gewebe mit dem von Tumorgewebe jeweils aus dem Kolon von mehreren Patienten miteinander verglichen. Die genauen Entwicklungsstadien bzw. die Größe der Tumoren waren nicht angegeben, es scheint sich um weiterentwickelte Karzinome gehandelt zu haben, da diese operativ entfernt werden mussten. Es standen nur wenige Proben zur Verfügung (n=8), was keiner statistischen Aussagekraft entspricht. Für eine genauere und aussagekräftigere Untersuchung müssten wesentlich mehr Proben analysiert werden. Beim Vergleich von Tumor- mit Normalgewebe war für SGK1 in zwei dieser Proben eine erhöhte, in drei eine verminderte und in den restlichen drei keine veränderte Expression zu messen. Möglicherweise ändert sich das Expressionsprofil von SGK1 im Verlauf der Tumorigenese und SGK1 ist nicht fortwährend aktiviert. Eventuell wird SGK1 vor allem zu Beginn der Tumorigenese und weniger in späteren Stadien aktiviert und deswegen konnte in den meisten Patientenproben mit weiterentwickelten Karzinomen keine erhöhte Expression von SGK1 detektiert werden. Im Gegensatz dazu konnten aber, wie bereits erwähnt, erhöhte SGK1-Level in Dickdarmadenomen von FAP-Patienten detektiert werden (Naishiro et al., 2005). In einigen Veröffentlichungen wurden Expressionsanalysen von unterschiedlichen Stadien der 60 DISKUSSION kolorektalen Karzinogenese angefertigt. Die Expressionsprofile wurden miteinander und mit solchen aus gesundem, kolorektalem Gewebe verglichen. (Frederiksen et al., 2003; Friederichs et al., 2005; Habermann et al., 2007; Kleivi et al., 2007). Bei den Auswertungen wurden nicht nur Gene gefunden, die ständig aktiviert waren, sondern auch solche mit ansteigender oder abnehmender Expression im Verlauf der Karzinogenese. Möglicherweise ist auch die Expression von SGK1 in den verschiedenen Tumorstadien unterschiedlich. Dadurch wäre die Regulation von SGK1 (und FoxO3a) durch β-Catenin im Verlauf der Karzinogenese ebenfalls unterschiedlich intensiv. Eine Änderung des Expressionsmuster könnte dadurch erklärt werden, dass eine Aktivierung von manchen Faktoren nur in bestimmten Phasen der Tumorigenese besonders wichtig ist. Möglicherweise zählt SGK1 zu diesen Faktoren. Die Ergebnisse der vorliegenden Arbeit zeigen, dass der Wnt-Signalweg SGK1 aktiviert und dadurch einen Einfluss sowohl auf die Lokalisation von FoxO3a als auch auf die FoxO3aabhängige Transkription sowie die FoxO3a-induzierte Apoptose nimmt. Ein solcher Effekt des Wnt-Signalweges ist möglicherweise nur in bestimmten Phasen der Tumorigenese von besonderer Wichtigkeit. 7.6 Fox-Proteine und Tumorigenese Fox-Proteine sind bei sehr vielen unterschiedlichen zellulären Prozessen beteiligt. Vielen von ihnen wird eine wichtige Rolle bei der Entstehung und Progression von Krebs zugeschrieben, einige von ihnen werden auch als Tumorsuppressoren oder Oncogene bezeichnet (Myatt and Lam, 2007). Eine fehlerhafte Regulation von Fox-Proteinen kann in zahlreichen verschiedenen Tumoren beobachtet werden. In vielen Krebsarten ist auch der Wnt-Signaltransduktionsweg dahingehend beeinträchtigt, dass er konstitutiv aktiviert ist. Dadurch wird unter anderem, wie in der vorliegenden Arbeit gezeigt, die Transkription von SGK1 erhöht. Das zieht wiederum eine Inhibierung von FoxO-Proteinen nach sich und könnte durch Inhibierung der Apoptose die Tumorigenese begünstigen. Kürzlich wurde eine mögliche Funktion von FoxO-Faktoren bei der Entwicklung von KrebsStammzellen beschrieben (Coffer and Burgering, 2007). Die Beobachtung, dass FoxOs wichtige Regulatoren sind, um das „Stammzell-Potential“ von normalen Stammzellen aufrecht zu erhalten, warf die Frage auf, ob FoxOs auch eine Rolle in Krebs-Stammzellen 61 DISKUSSION spielen. Wie bereits erwähnt werden FoxO-Proteine als sog. „bona fide“ Tumorsuppressoren bezeichnet und es stellt sich die Frage, welche Aufgabe sie in Krebs-Stammzellen haben könnten. Der Verlust von FoxOs führt zur Abnutzung (Depletion) von normalen Stammzellen. Deswegen könnte man annehmen, dass ein Verlust von FoxO-Faktoren auch für Krebs-Stammzellen schädlich ist, was allerdings im Gegensatz zu einer TumorsuppressorFunktion von FoxO stünde (Coffer and Burgering, 2007). Tatsächlich scheint es aber für eine Krebs-Stammzelle nötig zu sein, neben PTEN auch FoxO „ruhig“ zu stellen. Interessanterweise wurde dies auch in C. elegans beobachtet, wo ein Keimzelltumor, der als aus Stammzellen entstanden betrachtet werden kann, sich durch die Aktivierung von Daf-16 (FoxO Homolog in C. elegans) wieder zurückentwickelte (Pinkston et al., 2006). Die Daten der vorliegenden Arbeit zeigen einen generellen repressiven Effekt des Wnt-Signalweges auf die Aktivität von FoxO. Da, wie bereits erwähnt, Krebs-Stammzellen offenbar eine „Ruhigstellung“ von FoxO benötigen, könnte der Wnt-Signalweg durch die Inhibierung von FoxO auch bei der Entstehung von Krebs-Stammzellen beteiligt sein. Zusätzlich ist für den Wnt-Signalweg eine wichtige Funktion bei der Aufrechterhaltung und Selbsterneuerung von normalen Stammzellen beschrieben (Pardal et al., 2003; Reya et al., 2003; van de Wetering et al., 2002; Willert et al., 2003). Signalwege, die bei der Aufrechterhaltung und Erneuerung von Stammzellen beteiligt sind, sind sehr wichtig bei der Regulation von Proliferation und Überleben der Zellen. Deswegen sind es diese Signalwege, die durch eine Fehlsteuerung, z. B. begründet durch Mutationen, direkt assoziiert sind mit der Entstehung und Progression von Krebs. Eventuell sind sie dadurch auch an der Entwicklung von Krebs-Stammzellen beteiligt. Eine Funktion des Wnt-Signalweges bei der Entstehung von Krebs-Stammzellen könnte so durch die Fehlregulation des Wnt-Signalweges selbst begründet sein. Aber auch der repressive Effekt des Wnt-Signalweges auf die FoxO-Proteine könnte einen Einfluss des Wnt-Signalweges auf die Entwicklung von Krebs-Stammzellen darstellen. Der genaue Mechanismus, auf welche Weise der Wnt-Signalweg bei der Entstehung von KrebsStammzellen beteiligt sein könnte, muss noch geklärt werden. Ebenso muss auch noch die Bedeutung der Phosphorylierung und Inaktivierung von FoxOs während der Tumorigenese in Bezug auf die Entwicklung von Krebs-Stammzellen genauer erforscht werden. 62 DISKUSSION 7.7 Der Wnt-Signalweg und Tumorigenese Eine Steigerung der Proliferation und die Hemmung der Apoptoserate sind Mechanismen, die die Entstehung und Progression von Krebs stark vorantreiben. Ein stetig aktiver Wnt-Signalweg fördert die Tumorigenese durch die Aktivierung von Genen, welche die Proliferation der Zellen steigern, wie z. B. MYC und CyclinD1. Weniger erforscht ist bisher das Potential des Wnt-Signalweges, die Apoptose zu hemmen. In der Literatur sind Berichte zu finden, aus denen sowohl eine anti- als auch eine pro-apoptotische Funktion des Wnt-Signalweges abgeleitet werden kann. Anti-apoptotisch wirkt der Wnt-Signalweg durch die Aktivierung von Survivin (Chen et al., 1999; Kim et al., 2003; Tapia et al., 2006; Torres et al., 2006). Es wurde auch eine β-Catenin-abhängige Resistenz gegenüber einer Krebstherapievermittelten Apoptose in Wnt-1 exprimierenden Zellen beobachtet (Chen et al., 2001). Eine pro-apoptotische Funktion durch den Wnt-Signalweg ist bisher noch nicht beschrieben, könnte aber durch die β-Catenin/TFC-abhängige Aktivierung von MYC ablaufen. Es wurde gezeigt, dass MYC unter bestimmten Voraussetzungen (z. B. Entzug von Serum, wt-p53 background) den programmierten Zelltod einleiten kann (Evan et al., 1992; Hermeking and Eick, 1994; Wagner et al., 1994). Allerdings wurde bisher in Zusammenhang mit βCatenin/TCF nichts von einer MYC-abhängigen Induktion der Apoptose berichtet, d. h. es gibt wenig Evidenz für einen pro-apoptotischen Effekt des Wnt-Signalweges. Ein weiterer Mechanismus durch den der Wnt-Signalweg in die Regulation der Apoptose eingreifen könnte, ist die Regulation von FoxO-Transkriptionsfaktoren. Eine direkte Interaktion von βCatenin und FoxO3a/4 kann die FoxO-Aktivität steigern (Essers et al., 2005), was eine Induktion der Apoptose zur Folge haben könnte. Durch die β-Catenin/TCF-abhängige Aktivierung von SGK1 wurde in der vorliegenden Arbeit gezeigt, dass ein aktiver Wnt-Signalweg die FoxO-Aktivität auch hemmen kann. Weiter wurde auch eine Inhibierung der FoxO3a-induzierten Apoptose durch eine Aktivierung des Wnt-Signalweges nachgewiesen. Diese Beobachtungen würden auf eine antagonistische Regulation von FoxOs durch den Wnt-Signalweg hindeuten. Dies könnte einen Mechanismus zur Feinabstimmung oder zur Kontrolle bei der Regulation von FoxO-Faktoren darstellen. Es könnte allerdings auch sein, dass eine Regulation von FoxO durch β-Catenin durch bestimmte zusätzliche Faktoren in einer Aktivierung oder Inhibierung der FoxO-Aktivität resultiert, um auf unterschiedliche Stimuli zu reagieren. Welche Faktoren einen solchen Einfluss auf die βCatenin-vermittelte Regulation von FoxO haben könnten, muss noch untersucht werden. 63 DISKUSSION Zusammenfassend zeigen die Daten der vorliegenden Arbeit, dass durch die β-Catenin/TCFabhängige Aktivierung von SGK1 der Wnt-Signalweg eine repressiven Effekt auf die FoxOAktivität ausübt und dadurch vermutlich zusätzlich die Entstehung und Progression von Krebs gefördert wird. 64 MATERIAL & METHODEN 8 Material und Methoden 8.1 Material 8.1.1 Puffer und Lösungen Acrylamid-Stammlösung I 30 % Acrylamid 0,8 % Bisacrylamid Alkalische Lyse Puffer I 50 mM Tris/ HCL, pH 7,5 10 mM EDTA, pH 8,0 100 µg/ml RNaseA Alkalische Lyse Puffer II 200 mM NaOH 1 % SDS Alkalische Lyse Puffer III 3,0 M Kalium-Acetat, pH 5,5 Ampicilin (1000x) 50 mg/ml Blockierlösung 1x PBS 5 % Magermilchpulver 0,1 % Tween-20 Bradford-Färbelösung (5x) 23,5 % Ethanol 42,5 % Phosphorsäure 0,05 % Coomassie Brilliant Blue R-250 Ethidiumbromid-Stammlösung 10 mg/ml gelöst in H2O Fixierlösung (IF) 3 % Paraformaldehyd in PBS Kanamycin (1000x) 15 mg/ml KH2PO4/ K2HPO4 Puffer, pH 7,8 84 ml 100 mM K2HPO4 16 ml 100 mM KH2PO4 LacZ-Puffer (5x) 100 mM KH2PO4/ K2HPO4, pH 7,5 10 mM KCl 1 mM MgSO4 65 MATERIAL & METHODEN 50 mM β-Mercaptoethanol L1-Puffer 20 mM Tris/ HCL pH, 7,4 (Lysepuffer für Säugerzellen) 150 mM NaCl 5 mM EDTA 1,0 % Triton-X-100 1 mM DTT 1 mM PMSF Ladepuffer (10x) 100 mM EDTA, pH 8,0 60 % Glyzerin 0,25 % Bromphenolblau 0,25 % Xylencyanol LB-Medium 0,5 % Bacto® Hefeextract 1 % Bacto® Pepton 1 % NaCl Luziferin Stammlösung (10x) 5 mM D-Luziferin 100 mM KH2PO4/ K2HPO4, pH 7,8 Glycylglycine, Free Base (Gly-Gly) 0,5 M Gly-Gly Lysepuffer 25 mM Gly-Gly (Luziferase-Experimente) 15 mM MgSO4 4 mM EGTA 1 % Triton X-100 1 mM DTT (frisch dazugegeben) Luziferinlösung (1x) 25 mM Gly-Gly 15 mM MgSO4 4 mM EGTA 2 mM DTT 1/10 Luziferin Stammlösung Mess-Puffer 25 mM Gly-Gly (Luziferase-Experimente) 15 mM MgSO4 15 mM KH2PO4/ K2HPO4, pH 7,8 4 mM EGTA 5 mM ATP 1 mM DTT 66 MATERIAL & METHODEN Moviol (Einbettungsmedium IF) 4,9 ml 87 % Glyzerin 2,4 g Moviol 6 ml H2O 12 ml 0,2 M Tris/HCl, pH 8,5 ONPG-Lösung 4 mg/ml ONPG in 1x LacZ-Puffer PBS (1x) 137 mM NaCL 3 mM KCl 6,5 mM Na2HPO4 1,5 mM KH2PO4 PBS-T (1x) 1x PBS 0,5 % Tween-20 Permeabilisierungslösung (IF) 0,5 % Triton-X-100 in PBS Ponceau-Färbelösung 2 % (w/v) Ponceau S in 1 % Essigsäure Sammelgel (Western-Blot) 4 % Bisacrylamid 4x Sammelgelpuffer 0,06 % APS 0,125 % Temed Sammelgelpuffer (4x) 500 mM Tris/ HCL, pH 6,8 0,4 % SDS SDS-Laufpuffer 25 mM Tris Base (Lämmli-Puffer) 192 mM Glycin 0,1 % SDS SDS-Probenpuffer (4x) 250 mM Tris/ HCL, pH 6,8 20 % Glyzerin 20 % β-Mercaptoethanol 8 % SDS 0,4 % Bromphenolblau TAE 40 mM Tris Base 20 mM Essigsäure 1 mM EDTA TE-Puffer (10x) 10 mM Tris/ HCl, pH 8,0 0,1 mM EDTA 67 MATERIAL & METHODEN Trenngel (Western-Blot) 6 – 8 % Acrylamid 4x Trenngelpuffer 0,06 % APS 0,16 % Temed Trenngelpuffer (4x) 1,5 mM Tris/ HCL, pH 8,8 0,4 % SDS Transferpuffer (Western Blot) 20 mM Tris/ HCl, pH 7,0 150 mM Glycin 10 % (v/v) Methanol 0,02 % SDS Zellkulturmedium DMEM mit 1g/l Glukose 10 % Fötales Kälberserum 1 % Penicillin/Streptomycin 8.1.2 Weitere Reagenzien und Enzyme β-Mercaptoethanol Roth, Karlsruhe Absolute SYBR Green Fluorescein Abgene Hamburg Agarose NEEO ultra ROTI®GAROSE Roth, Karlsruhe Ampicilllin Roche, Mannheim Bio-Magermilchpulver Töpfer GmbH, Dietmannsried BSA (Albumin Fraktion V) Roth, Karlsruhe Desoxynukleotide Fermentas, St. Leon-Roth Deferoxamine Mesylate Salz Sigma-Aldrich, Deisenhofen D-Luziferin P.J.K. GmbH, Kleinblittersdorf Dithiothreitol (DTT) Serva, Heidelberg Fötales Kälberserum (FKS) Biochrom AG, Berlin Perbio Science Deutschland GmbH, Bonn PAA Laboratories GmbH, Cölbe GeneRuler DNA Größenstandard Fermentas, St. Leon-Roth 68 MATERIAL & METHODEN Glycylglycine, Free Base (Gly-Gly) Calbiochem, San Diego, CA Hi-Di™ Formamidpuffer Applied Biosystems, Foster City, CA Kanamycin Roche, Mannheim Klenow Enzym BioLabs, Schwalbach Mowiol 4-88 Calbiochem, San Diego, CA NEB-Puffersystem für Restriktionsverdaus BioLabs, Schwalbach 4-Nitrophenyl phosphate dinatrium salz Sigma Aldrich, Deisenhofen hexahydrate Phosphatase, alkalische BioLabs, Schwalbach Phusion™ High-Fidelity DNA Polymerase Finnzymes, Espoo, Finnland PMSF Proteinase Inhibitor Sigma Aldrich, Deisenhofen Ponceau S Roth, Karlsruhe Protein Standard SDS-6H Sigma Aldrich, Deisenhofen Random Hexamer Primer Invitrogen GmbH, Karlsruhe Restriktionsenzyme BioLabs, Schwalbach Reverse Transkiptase SuperScript™ II Invitrogen GmbH, Karlsruhe RNase A Qiagen, Hilden RNase Inhibitor, RNase Out Invitrogen GmbH, Karlsruhe RNeasy Qiagen, Hilden Roti-Phenol Roth, Karlsruhe Sequenzier-Mix Big Dye® Terminator v1.1 Applied Biosystems, Foster City, CA Sequencing Standard Kit T4 DNA Ligase BioLabs, Schwalbach Taq-DNA-Polymerase Invitrogen GmbH, Karlsruhe TransIT T-KO Transfektions Reagenz MoBiTec GmbH, Göttingen Triton X-100 Sigma Aldrich, Deisenhofen Trizol peqGOLD Trifast™ Peqlab, Erlangen Tween®-20 Sigma Aldrich, Deisenhofen Western Lightning® Western Blot Chemiluminescence Reagent Plus Perkin Elmer, Wellesley, MA Nicht aufgeführte Chemikalien stammten von der Firma Roth, Karlsruhe. 69 MATERIAL & METHODEN 8.1.3 Verbrauchsmaterialien APO-BrdU™ TUNEL Assay Kit (A23210) Invitrogen GmbH, Karlsruhe CryoTube™ vials Nunc GmbH & Co. KG, Wiesbaden Nitrocellulose-Membran Hybond-C extra Amersham Pharmacia biotech, Freiburg NucleoSpin® Extract II Macherey – Nagel, Düren PCR-Reaktionsgefäße ultradünn Biolabs, Schwalbach PureLink™ HiPure Plasmid Maxiprep Kit Invitrogen GmbH, Karlsruhe QIAquick Gel Extraction Kit Qiagen, Hilden QIAquick PCR Purification Qiagen, Hilden Whatmanfilter Whatman International Ltd., Maidstone, England 96 Well Immuno Platten MaxiSorp Nunc GmbH & Co. KG, Wiesbaden Zellkulturschalen und 6-, 12-, 24- und 96- TPP AG, Trasadingen, Schweiz Well Platten 8.1.4 Geräte Neben in molekularbiologischen Laboratorien üblichen Geräten wurden folgende eingesetzt: Durchflusscytometer FACScan BD Biosciences, Heidelberg Elisa-Reader SpectraMAX190 Molecular Devices GmbH, Ismaning Fluoreszenzmikroskop Axioplan 2 Zeiss, Göttingen Fotoaufsatz für Mikroskop und Stereo- Visitron Systems, Puchheim Mikroskop RT monochrome Spot iCycler iQ Bio-Rad, München Luminometer DLReady CentroLB 960 Berthold Technologies,GmbH & Co. KG, Bad Wildbad Luminoimager LAS-3000 FujiFilm raytest Isotopenmessgeräte GmbH, 70 MATERIAL & METHODEN Straubenhardt Nuaire Biological Safety Cabinets Integra Bioscience GmbH, Fernwald PCR-Maschine Thermocycler T3 Biometra, Göttingen SDS-PAGE Apparatur Mini-Protean II Bio-Rad, München Sequencer ABI Prism™ 377 Perkin Elmer, Überlingen SmartSpec™ 3000 Photometer Bio-Rad, München Steri-Cult 200 Incubator Memmert GmbH & Co. KG, Schwabach Western Blotting Apparaturen Bio-Rad, München 8.1.5 Oligonukleotide 8.1.5.1 Oligonukleotide zur Analyse der Expression von Genen Gen Name Sequenz TA Zyklen SGK1 SGK Hu tqm for2 GATCTCCCAACCTCAGGAGCC 57°C 50 57°C 50 57°C 50 SGK Hu tqm rev2 CTGGAAAGAGAAGTGAAGGCCC Axin2 GAPDH 8.1.5.2 Ax2 Hu tqm for GCAAACTTTCGCCAACCGTG Ax2 Hu tqm rev CTCTGGAGCTGTTTCTTACTGCCC GAPDH for CCTGCTTCACCACCTTCTTG GAPDH rev CTTCACCACCATGGAGAAGG Oligonukleotide für Klonierungen Gen/Vektor Name SGK1/ mYF-N2 Sgk1_F_Xma Sequenz TA Zyklen TCCCCCCGGGACGGTGAAAACTGAG 58°C 35 58°C 35 GCTGC Sgk1_R_Bam CGCGGATCCGAGGAAAGAGTCCGTG GGAGG 71 MATERIAL & METHODEN SGK1/ pcDNA3.1Flag FoxO3a/ mYF-N2 FoxO4/ pcDNA3.1Flag n x DBE- Sgk1_F_Not ATAAGAATTGCGGCCGCTGACGGTG 57°C 35 57°C 35 57°C 35 AAAACTGAGGCTGC Sgk1_R_Not TTAGTTTAGCGGCCGCAATCAGAGG AAAGAGTCCGTGGGAGG FoxO3a_F_BspE1 TCCCTCCGGAGCAGAGGCACCGGCTT CC FoxO3a_R_Bam CGCGGATCCGCCTGGCACCCAGCTCTG 57°C 35 FoxO4_F_Not ATAAGAATTGCGGCCGCTGGATCCGG 57°C 35 57°C 35 GGAATGAGAATTC FoxO4_R_Not TTAGTTTAGCGGCCGCAATCAGGGAT CTGGCTCAAAGTTGAAGTC 2xDBE_for GATCAAGTAAACAACTATGTAAACAA - - 2xDBE_rev GATCTTGTTTACATAGTTGTTTACTT - - 56°C 35 56° 35 56°C 35 56° 35 56°C 35 56° 35 Reporterkonstrukte SGK1 I/ pGL3basic SGK1 II/ pGL3basic SGK_Hu_for1 SGK_Hu_rev1 SGK_Hu_for2 AAAAAGATCTGGGGAGACAGAAAGA CGTTAGCG AAAAAGATCTGGGGAGACAGAAAGAC GTTAGCG TTTTGCTAGCGCAAGAGGAAGCAGAC ATGGGC SGK_Hu_rev1 AAAAAGATCTGGGGAGACAGAAAGAC GTTAGCG SGK1 III/ pGL3basic SGK_Hu_for3 TTTTGCTAGCGCAAGTGGGGGTGGTTT TGC SGK_Hu_rev1 AAAAAGATCTGGGGAGACAGAAAGAC GTTAGCG 72 MATERIAL & METHODEN 8.1.5.3 Oligonukleotide für Sequenzierungen Name Sequenz TA CMV-Seq-F GCAGAGCTGGTTTAGTGAACCG 55°C EGFP-N Seq CGTCGCCGTCCAGCTCGACCAG 59°C T7 AATACGACTCACTATAG pcDNA3.1Flag/BGH_rev TAGAAGGCACAGTCGAGG RVprimer3 CTAGCAAAATAGGCTGTCC 54°C GLprimer2 CTTCCATGGTGGCTTTACC 54°C 8.1.5.4 Small interfering RNA Oligonukleotide Name Zielsequenz siGFP GCUACCUGUUCCAUGGCCA siAPC-C GACGTTGCGAGAAGTTGGA siβ-Catenin-B ACTGCTAAATGACGAGGAC siSGK1#1 CCCGUCGUCCAAUCCUCAUGCUAAA siSGK1#2 CCUGAGCUUAUGAAUGCCAACCCUU Alle Oligonukleotide sind in 5´-3´Orientierung angegeben. Die Synthese der Oligonukleotide erfolgte bei MWG oder bei Operon. Die siRNA-Oligonukleotide wurden von Eurogentec (siGFP, siAPC-C und siβ-Catenin-B) und von Invitrogen (siSGK1; SGK Validated Stealth™ RNAi DuoPak) erworben. 73 MATERIAL & METHODEN 8.1.6 Organismen Zelllinie Ursprung HEK293T Embryonale Nierenzellen (Homo sapiens) HCT116 Kolorektales Karzinom mit stablisierten β-Catenin (Homo sapiens) SW480 Kolorektales Karzinom mit trunkiertem APC (Homo sapiens) DLD-1dnTCF4 Kolorektales Karzinom mit trunkiertem APC (Homo sapiens) mit Doxycyclin-induzierbarer Expression von N-terminal trunkiertem (dominant negativ)TCF4 (van de Wetering et al., 2002) DLD1-TR7 Kolorektales Karzinom mit trunkiertem APC (Homo sapiens) Parentale Kontrollzelllinie von DLD1-dnTCF4 Rat2 (Giarre et al., 1998; Lustig et al., 2002) Bakterienstämme Genotyp Escherichia coli recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac XL1-blue 8.1.7 Antikörper Name Beschreibung Hersteller Anti-β-Aktin monoklonaler Anti-β-Aktin Antikörper aus Maus Sigma Anti-β-Catenin monoklonaler Anti-β-Catenin Antikörper aus Santa Cruz (H102) Kaninchen C/G7 monoklonaler Anti-Conductin Antikörper aus Maus Dr. Behrens Anti-SGK1 polyklonaler Anti-SGK1 Antikörper aus Kaninchen Biomol Anti-Flag monoklonaler Antikörper gegen den Flag-Tag aus Sigma Kaninchen Anti-GFP monoklonaler Antikörper gegen GFP aus Maus Roche Cy2, Cy3 und HRP markierte Sekundärantikörper wurden von Jackson Immuno Research erworben. 74 MATERIAL & METHODEN 8.1.8 Vektoren Vektor Beschreibung Referenz 8xDBE acht Bindestellen (DBEs) für FoxO diese Arbeit eingeführt in BglII–Schnittstelle von pTA-luc Reporterkonstrukt zur Messung der FoxO-abhängigen Transkription Asef2-FLAG Exoressionsplasmid für Asef2 mit A. Grohmann Flag-Tag myc-wt-β-Catenin myc-gekoppeltes (Krieghoff et al., 2006) Expressionplasmid für β-Catenin, BIM-luc Luziferasegen unter der Kontrolle (Motta et al., 2004) des BIM Pormotors, freundlicherweise von Dr. R. H. Medema erhalten c-fos Promoter c-fos Promoterfragment Dr. B. Mayr (ca. 500 bp) in pGL3basic kloniert mit den Oligos: Xho_fos+116R CCGCTCGAGGGAGACAGGTG GGCGCTGTG und Kpn_fos-385F GGGGTACCACTGCACCCTCGG TGTTGGC Dsh2-CFP cDNA für humanes, dominat (Krieghoff et al., 2006) actives Dsh2, KanR/NeoR FLAG-Asef2 FLAG-FoxO3a-TM A.Grohmann 3-fach mutiertes FoxO3a (T32A, (Brunet et al., 2004) S253A, S315A) in pECE Vektor, erworben von addgene (Krieghoff et al., 2006)Plasmid #8361) FoxO3a-YFP Expressionsplasmid von FoxO3a diese Arbeit mit YFP-Tag 75 MATERIAL & METHODEN pGL2-27KIP1 Luziferasegen unter der Kontrolle (Motta et al., 2004) des p27KIP1 Pormotors, freundlicherweise von Rene H. Medema erhalten pcDNA3.1(+) AmpR, G418 Invitrogen pcDNAflag Derivat von pcDNA3.1 mit Dr. Behrens eingefügtem Flag-Tag pcDNAflag-SGK1 cDNA für humanes SGK1 in diese Arbeit pcDNAflag pcDNAflag-FoxO4 cDNA für humanes FoxO4 in diese Arbeit pcDNAflag pcDNA-HA-Dvl2 Dishevelled2 in pcDNA-HA Dr. Behrens pCG-LEFΔBB humanes LEF ohne β-Catenin Dr. Behrens Bindedomäne, AmpR pCMV-APC Expressionsplasmid für APC (Kinzler et al., 1987) pCMV-Sport6-SGK1 cDNA von SGK1 im RZPD; Deutsches Expressionsvektor pCMV-Sport6 Ressourcenzentrum für AmpR Genomforschung; full length clone IRATp970E014D pEGFP-N1 KanR, G418 Clontech pFA2-cJun Aktivatorplasmid von c-Jun Trans- Stratagene #219000 Reporting system (Stratagene) pFC-MEKK Regulatorplasmid (Positiv- Stratagene #219000 Kontrolle von c-Jun TransReporting system (Stratagene) pFR-Luc Luziferasereporter für c-Jun Trans- Stratagene #219000 Reporting system (Stratagene) pGL2-Control AmpR Promega pGL3-Basic AmpR Promega pGL3Ax2luc Luziferasereporter unter Kontrolle (Jho et al., 2002) des Axin2-Promotor pTA-luc AmpR Clontech pTOPflash β-Catenin/TCF-abhängiger (van de Wetering et al., 76 MATERIAL & METHODEN pFOPflash pOTB7-FoxO3a Luziferasereporter, AmpR 1997) Kontrollplasmid für pTOPflash, (van de Wetering et al., AmpR 1997) Komplette cDNA von FoxO3a in dem Vektor pOTB7, Cap pRSV-βGal R β−Galaktosidase Vektor, AmpR RZPD full length clone IRAUp969FO851D (Stratford-Perricaudet et al., 1992) RFP-APC cDNA für APC, KanR/NeoR (Krieghoff et al., 2006) RFP-LRP6da cDNA für humanes, dominat (Krieghoff et al., 2006) actives LRP6, KanR/NeoR RFP-Wnt3A murine Wnt3a-cDNA, KanR/NeoR (Krieghoff et al., 2006) S45A-YFP (β- Expressionplasmid für stabilisiertes (Krieghoff et al., 2006) Catenin) β-Catenin durch mutiertes Serin45 mit YFP-Tag S33A (β-Catenin) Expressionplasmid für stabilisiertes (Kuphal and Behrens, 2006) β-Catenin durch mutiertes Serin33 SGK1fmY cDNA von SGK1 in mYF-N2 diese Arbeit SGK1 I (-2886/+48) Promotorfragment von SGK1, diese Arbeit Amp SGK1 II (-2484/+48) R Promotorfragment von SGK1, diese Arbeit AmpR SGK1 III (-1926/+48) Promotorfragment von SGK1, diese Arbeit AmpR 77 MATERIAL & METHODEN Plasmidkonstruktionen dieser Arbeit SGK1 I, II, III Die Klonierung der Promotorfragmente in pGL3basic erfolgte nach dem gleichen Schema und mit demselben reversen Oligo (SGK_Hu_rev1), das zusammen mit dem jeweiligen forward Oligo und genomischer DNA von 293T Zellen als Matrize in die PCR-Reaktion eingesetzt wurde. Die Oligos brachten Schnittstellen für die Restriktionsendonukleasen NheI und BglII in die PCR-Fragmente ein und nach einem Verdau mit diesen Enzymen, konnten die Fragmente in den Reportervektor pGL3basic einligiert werden. SGK1fmY Für die Klonierung eines Expressionsvektors für SGK1 wurde bei RZPD in Berlin ein Klon (ID: IRATp970E014D) bestellt, der die komplette cDNA von SGK1 in dem Vektor pCMVSport6 trägt. Nach der DNA-Präparation wurde die erhaltene DNA als Matrize eingesetzt um den entsprechenden offenen Leserahmen von SGK1 mit den Oligonukleotiden Sgk1_F_Xma und Sgk1_R_Bam zu amplifizieren. Die Oligos waren so gestaltet, dass die Schnittstellen XmaI und BamHI an die Enden des Amplikons eingeführt wurden. Das PCR-Produkt, wie auch der Vektor mYF-N2 wurden mit den Restriktionsendonukleasen XmaI und BamHI geschnitten und anschließend miteinander ligiert. pcDNAflag-SGK1 Der Vektor pCMV-Sport6-SGK1 wurde als Matrize gemeinsam mit den Oligonukleotiden Sgk1_F_Not und Sgk1_R_Not in die PCR für die ungerichtete Klonierung des Vektors pcDNAflag-SGK1 eingesetzt. Das Reaktionsprodukt sowie der Ausgangsvektor pcDNAflag wurden mit NotI verdaut, ligiert und anschließend anhand eines Kontrollverdaus der Minipräparation ein Klon mit richtiger Orientierung des Inserts isoliert. FoxO3afmY Die Erstellung des Vektors FoxO3afmY wurde identisch der Klonierung von SGK1fmY durchgeführt. Der PCR diente als Matrize DNA aus einem weitern Klon (ID: IRAUp969FO851D), der von RZPD in Berlin gekauft wurde und die cDNA von FoxO3a in dem Vektor pOTB7 trug. Durch eine PCR mit den Oligonukleotide FoxO3a_F_BspE1 FoxO3a_R_Bam wurde die DNA amplifiziert, die für FoxO3a kodiert. Mit Hilfe der 78 MATERIAL & METHODEN Restriktionsschnittstellen BspEI und BamHI die durch die Oligos eingeführt wurden, konnte das Fragment in den mit XmaI und BamHI verdauten Vektor mYF-N2 einligiert werden. Da das Insert (FoxO3a) zwei interne XmaI Schnittstellen trägt wurde BspEI als Restriktionsenzym verwendet, welches eine andere Zielsequenz erfordert aber identische Schnittstellen wie XmaI erzeugt. pcDNAflag-FoxO4 Die Matrize für die cDNA von FoxO4 wurde wiederum aus einem Klon von RZPD (IRAMp995HO213Q) durch DNA Präparation gewonnen und anschließend in die PCR gemeinsam mit den Oligonukleotiden FoxO4_F_Not und FoxO4_R_Not eingesetzt. Das PCR-Produkt und der Vektor pcDNAFlag wurden mit NotI verdaut und anschließend miteinander ligiert. Durch einen anschließenden PCR-Screen (Kolonie-PCR) konnte ein Klon identifiziert werden der das Insert mit der richtigen Orientierung trägt. DBE-Reporter Konstrukte Um Multimere des Bindemotivs (DBE) von FoxO3a und FoxO4 Transkriptionsfaktoren zu generieren wurden die Oligonukleotide 2xDBE_for und 2xDBE_rev wie in (Furuyama et al., 2000) beschrieben mit Hilfe der T4-Polynukleotidkinase (PNK) jeweils am 5’-Ende phosphoryliert und anschließend miteinander hybridisiert. Die Oligonukleotide wurden so gewählt, dass sie zwei der Bindemotive in sich tragen und nach dem Hybridisieren überlappende Enden („sticky ends“) bilden, die mit den durch einen BglII Verdau entstehenden Enden kompatibel sind. Die erhaltenen Fragmente wurden in den mit BglII verdauten Vektor pTA-luc ligiert. Hier konnte nicht vorhergesehen werden, wie viele Fragmente sich einlagern würden. Dies lies sich durch eine Kolonie-PCR überprüfen, wodurch Kandidaten gefunden wurden bei denen das Fragment ein, zwei und vier mal inseriert war, was zwei, vier, beziehungsweise acht spezifischen Bindestellen (DBEs) bedeutet. Dementsprechend wurden die Reporterkonstrukte nach der Anzahl der Bindestellen 2xDBE, 4xDBE und 8xDBE genannt. FLAG-FoxO3a-TM Die dreufach Mutante von FoxO3a wurde bei addgene (plasmid #8361) gekauft und nach einer DNA-Präparation verwendet. 79 MATERIAL & METHODEN 8.2 Methoden Molekularbiologische Standardmethoden wie z. B. Plasmid-DNA-Präparation, Spektrometrische Bestimmung der Menge und Reinheit von DNA und RNA, Fällung von Nucleinsäuren, DNA-Sequenzierung, DNA-Gelelektrophorese, enzymatische Spaltung mit spezifischen Restriktionsendonukleasen, Phospholyrierung, Dephosphorylierung und Ligation von DNA, RNA-Isolierung, cDNA-Synthese, Polymerase Kettenreaktion (PCR) und Transformation von E. coli wurden gemäß dem Handbuch „Molecular Cloning, A Laboratory Manual“ (Sambrook et al., 2001) durchgeführt. Im Folgenden sind nur Methoden beschrieben, die im Handbuch anderes oder gar nicht aufgeführt sind. Bei Methoden, für die Kits verwendet wurden, wurde den Angaben der Hersteller Folge geleistet. 8.2.1 Anzucht von Bakterien Die Kultivierung von E. coli erfolgte bei 37°C. Ein ständiges Schütteln gewährleistete bei der Anzucht von Flüssigkulturen eine optimale Belüftung und Durchmischung. Bei Selektion auf verschiedene Plamide wurde den Medien die entsprechenden Antibiotika (1 µl/ml Kulturmedium der Stocklösung Ampicilin oder Kanamycin) zugegeben. 8.2.2 Herstellung kompetenter Bakterien Zur Herstellung kompetenter Bakterien wurde eine Übernachtkultur von E. coli XL-blue in 500 ml LB-Medium angeimpft und bei 37°C bis zu einer optischen Dichte (OD) von 0,4 – 0,5 geschüttelt. Alle folgenden Arbeitsschritte wurden auf Eis oder im Kühlraum unter Verwendung einer 4°C Zentrifunge durchgeführt. Nach 10 min Abkühlung wurden die Bakterien bei 5000 rpm für 5 min pelletiert und in 45 ml kaltem CM-Puffer resuspendiert. Anschließend wurde erneut für 10 min inkubiert, 5 min bei 5000 rpm zentrifugiert und das Pellet in 17,5 ml CM-Puffer aufgenommen. Es folgte eine Inkubation von 10 min, die Zugabe von 625 µl DMSO, eine weiter Inkubation von 5 min und erneute Zugabe von 625 µl DMSO. 80 MATERIAL & METHODEN Nach einer abschließenden Inkubation von 5 min wurden die kompetenten Bakterien aliquotiert und bis zur Verwendung bei -80°C gelagert. 8.2.3 Transformation von Bakterien Es wurden 100 – 200 ng Plasmidllösung zu 100 µl kometenter Bakterien pipettiert und für 60 min auf Eis inkubiert. Nach dem anschließenden Hitzschock (90 sek. 42°C) wurde zu dem Ansatz 900 µl LB-Medium gegeben und dieser für 45 min bei 37°C geschüttelt. Daraufhin wurde der Ansatz abzentrifugiert, der Überstand abgekippt, die Zellen in dem zurückgelaufenen Restmedium resuspendiert, auf Selektivmedium ausplattiert und über Nacht bei 37°C inkubiert. 8.2.4 Plasmidisolierung aus Bakterien Die Isolierung von Plasmiden erfolgte aus E. coli unter Verwendung der alkalischen Lyse. 1,5 ml einer Übernachtkultur wurden bei 4500 rpm für 2 min bei RT pelletiert und in 100 µl Puffer I resuspendiert. Anschließend wurden 100 µl von Puffer II zugegeben, mehrmals invertiert und innerhalb von 5 min 100 µl Puffer III dazu pipettiert. Nach 10 min Inkubation auf Eis wurden bakterielle Proteine, Zellreste und chromosomale DNA abzentrifugiert (13.000 rpm, 10 min und RT). Die Plasmid-DNA im Überstand wurde durch Zugabe von 0,8 Volumenprozent Isopropanol gefällt und das erhaltene Pellet danach mit 70 % EtOH gewaschen, getrocknet und in H2O aufgenommen. 8.2.5 Extraktion von DNA aus TAE-Agarosegelen Nach elektrophoretischer Auftrennung wurde das betreffende DNA-Fragment unter UV-Licht aus dem Agarosegel ausgeschnitten, in ein 1,5 ml Reaktionsgefäß überführt und die DNA mit Hilfe des NucleoSpin® Extract II Kits (Machery-Nagel) nach Angabe des Herstellers 81 MATERIAL & METHODEN extrahiert. Zur Überprüfung der Qualität und Quantität der isolierten DNA, wurde ein Aliquot dieser DNA auf einem Agarosegel aufgetrennt. 8.2.6 DNA-Reinigung und Fällung Zur Aufreinigung der DNA wurde der „NucleoSpin® Extract II Kit“ verwendet. Die Fällung der DNA erfolgte mit 1/10 Vol 3 M NaOAc pH 4,8-5,2 und 2,5 Vol 100 % EtOH und wurde für 20 min bei 13.000 rpm zentrifugiert. Anschließend wurde das erhaltene Pellet mit 70 % EtOH gewaschen, bei 56°C für10 min getrocknet und in 20-30 µl Wasser aufgenommen. 8.2.7 Bestimmung der DNA- bzw. RNA-Konzentration Die DNA- bzw. RNA-Lösung wurde 1:100 bzw. 1:50 verdünnt und ihre Absorption zwischen 220 und 320 nm im Photometer bestimmt. Die Konzentration wurde mittels folgender Beziehung berechnet: DNA: 1 OD260 entspricht 50 µg DNA/ml RNA: 1 OD260 entspricht 40 µg RNA/ml 8.2.8 Sequenzierung von DNA-Fragmenten Die PCR für die Sequenzierung wurde mit ca. 500 ng gereinigte Plasmid-DNA, 5 pmol Primer, 3 µl Sequenziermix und ad 10 µl H2O durchgeführt. Für die Überprüfung der Sequenzen von DNA-Fragmenten wurde die Kettenabbruch-Methode in dem Kapillarsequenzer „Sequencer ABI Prism™ 377“ mit dem ABI PRISM BigDye® v1.1 Cycle Sequencing Kit (Applied Biosystems) nach Angaben des Herstellers angewandt. Zur Auswertung wurde die mitgelieferte Software ABI PRISM 377 Collection and Sequencing Analysis 3.0 verwendet. 82 MATERIAL & METHODEN 8.2.9 Kultur und Transfektion von Säugerzellen Alle verwendeten Zelllinien wurden in DMEM Medium (mit L-Glutamin und 4,5 g/l Glukose) mit 10 % fötalem Kälberserum (FKS) und 1 % Penicillin/ Streptomycin kultiviert. Die Zellen wuchsen bei 37°C, 90 % Luftfeuchtigkeit und 10 % CO2 und wurden alle 2-3 Tage unter Verwendung von Trypsin/ EDTA im Verhältnis 1:3 bis 1:20 passagiert. 8.2.10 Zählen von Zellen und Anlegen von Dauerkulturen Die Zellzahl wurde anhand einer Neubauer Zählkammer bestimmt. Für Dauerkulturen wurden 106 Zellen in 1 ml Kryoröhrchen (Nagene) mit 80 % DMEM, 20 % FKS und 10 % Dimethylsulfoxid versetzt und über Nacht auf -80°C gekühlt. Die dauerhafte Lagerung erfolgte anschließend in flüssigem Stickstoff. 8.2.11 Transiente Transfektion Transfektion von Plasmid-DNA erfolgte gemäß der Anleitung des Herstellers unter der Verwendung von 5 µl (1 mg/ml) Polyethylenimin (PEI) pro µg DNA über Nacht in Vollmedium. Für die jeweilige Transfektion wurde ein Mastermix erstellt, der sich pro Well einer 24 Well-Platte aus 50 µl Serum- und Antibiotika-freiem Medium und der korrespondierenden Menge PEI zusammensetzt und für 5-10 min inkubiert wurde bevor die DNA dazu gegeben wurde. Bei Verwendung von Platten mit 6 oder 12 Wells wurden die Mengen proportional erhöht. Der Transfektionsansatz wurde nochmals für 10 min bei RT inkubiert und anschließend auf die Zellen in Vollmedium gegeben. Darauf wurden diese für 4 min bei 1000 rpm und RT zentrifugiert. Die Transfektion von siRNA-Oligonukleotiden mit oder ohne zusätzlicher Plasmid-DNA wurde unter Verwendung von TransIt TKO (Mirus) und den Angaben des Herstellers durchgeführt. 24 bis 48 Stunden nach der Transfektion wurden die Zellen geerntet. 83 MATERIAL & METHODEN 8.2.12 Reporterassays Transfektionen für Reporterassays wurden normalerweise in 24 Well Platten durchgeführt, dabei wurden folgende DNA-Mengen pro Well eingesetzt: je 20 ng Reporter, 50 ng Regulator, bei FoxO-Experimenten zusätzlich 10-20 ng FoxO, sowie 50 ng RSVβ-Gal. Durch Auffüllen mit unspezifischer Plasmid-DNA (pcDNA3.1) wurde die Gesamt-DNA-Menge konstant gehalten. Bei der Verwendung von siRNA in transienten Transfektionen wurden pro 24 Well 1.5 µl siRNA (20 µM) zu der Plasmid DNA kotransfiziert und die Gesamt siRNA Menge durch siGFP angeglichen. Für Luziferase Assays (Luc-Assays) wurden die Zellen transient mit einem Luziferase Reporter Vektor, mit Effektorplasmiden und zur Normalisierung der Transfektionseffizienz einem konstitutiv exprimierenden β-Galaktosidase Vektor (RSVβ-Gal) transient transfiziert. Bei Transfektionen zur Untersuchung von FoxO-Effekten wurde zusätzlich ein FoxOExpressionsvektor kotransfiziert. 24 -48 Stunden nach der Transfektion wurden die Zellen in 50–75 µl Lysispuffer lysiert und 5 min bei 4°C zentrifugiert. Die Luziferaseaktivität wurde in einem Luminometer durch automatische Injektion von 50 µl Luziferinpuffer zu den vorgelegten 15 µl Zelllysat in 50 µl Luziferaseassaypuffer gemessen (Parametereinstellungen wurden wie folgt gewählt: Injektion mit mittlerer Geschwindigkeit Verzögerung: 3 s, Messung: 10 s). Die Luziferaseaktivität wurde auf die Transfektionseffizienz korrigiert indem die erhaltenen Werte durch die β-Galaktosidaseaktivität geteilt wurden. Zur Bestimmung der β-Galaktosidaseaktivität wurden 5-15 µl des Zelllysates mit 150 µl 1 x ONPG-Assaypuffer vermischt und die Reaktion solange ablaufen lassen bis die Proben gelb wurden. Die Reaktion wurde durch Zugabe von 100 µl Na2CO3 gestoppt und die optische Dichte in einem Mikrotiterplattenleser bei 420 nm gemessen. 8.2.13 SDS-PAGE und Western Blot Analyse Für das Erstellen von Proteinrohlysaten wurden die Zellen nach der Transfektion für 24h weiterkultiviert und dann mit 80-100 µl L1 Protein-Lysis-Puffer durch Inkubation für 10 min auf Eis lysiert. Anschließend wurden die Proben geklärt in dem sie für 10 min und 13000 rpm bei 4 °C zentrifugiert wurden. Die Proteinmengen wurden durch einen Bradford Test mit BioRad Reagenz grob bestimmt und gleiche Mengen an Protein aufgetragen, mittels SDS-PAGE 84 MATERIAL & METHODEN (7-10 %ige Polyacrylamidgele) aufgetrennt und auf HybondN Nitrozellulose Membranen bei 330 mA für 60 min transferiert (Burnette, 1981). Nach kurzer Färbung in Ponceau S und Übertragen des Standards wurde die Membran zuerst für 60 min in Blockierlösung und darauf über Nacht in Primärantikörperlösung langsam geschwenkt. Primäre sowie Peroxidasegekoppelte, sekundäre Antikörper wurden nach den Vorgaben der Hersteller verwendet. Die Signale wurden mit Western Lightning Reagenz (Perkin Elmer) visualisiert und mit dem Luminoimager LAS-3000 (Raytest) und dem Programm Image Reader Las-3000 Version 2.0 detektiert. 8.2.14 RNA-Isolierung Für die RNA Extraktion wurden Zellen in 6-Well-Schalen kultiviert und nach der für den experimentellem Ansatz durchgeführten Behandlung mit 750 µl peqGold® (Peqlab) für 5 min bei Raumtemperatur inkubiert. Nach der Überführung in ein 1,5 ml Reaktionsgefäß und der Zugabe von 200 µl Chloroform wurden die Ansätze durch Schütteln gemischt und anschließend für 10 min bei 13000 rpm und 4°C zentrifugiert. Die obere, RNA-haltige Phase wurde in ein neues Reaktionsgefäß überführt mit 500 µl Isopropanol vermengt, mehrmals invertiert für 10 min bei Rauftemperatur (RT) inkubiert und danach für 10 min bei 13000 rpm und 4°C zentrifugiert. Der Überstand wurde verworfen, das Pellet in 1 ml 75 % Ethanol gewaschen und für 5 min bei 13000 rpm und 4°C zentrifugiert. Nachdem das Pellet bei RT getrocknet war wurde es in 20 µl DNase- und RNase-freiem H2O (Gibco) aufgenommen und die Reinheit und Konzentration der RNA photometrisch bestimmt. RNA-Präparationen wurden bei -80°C gelagert. 8.2.15 Reverse Transkriptase-PCR (RT-PCR) Für die Herstellung von cDNA aus mRNA wurde die reverse Transkriptase Reaktion angewandt, bei der ein cDNA/RNA-Hybrid (first-strand-cDNA) entsteht, welches als Template in einer klassischen PCR eingesetzt werden kann. Dazu wurden 1,5 µg RNA in 9 µl H2O (DNase- und RNase-frei) aufgenommen und nach Zugabe von 2 µl Random Hexamer Primern (1 µg/µl) für 10 min bei 70°C inkubiert und auf Eis abgeschreckt (2 min). Nach der 85 MATERIAL & METHODEN Zugabe von 4 µl Reaktionspuffer (5x), 2 µl DTT (1 M), 1 µl dNTPs (je 10 mM), 1 µl RNaseOUT und 1 µl SuperScript™ II Reverse Transcriptase (reverse Transkriptase) folgte eine Inkubation von 60 min bei 42°C. Die Reaktion wurde anschließend für 15 min bei 75°C (Inaktivierung des Enzyms) gestoppt. Der Ansatz wurde mit 25 µl H2O (DNase- und RNasefrei) aufgefüllt. Für eine anschließende Kontroll-PCR wurde je 1 µl der synthetisierten cDNA als Matrize eingesetzt. Durch den Einsatz von spezifischen Primer für ein sog. Haushaltsgen (GAPDH oder β-Aktin), welche in der Regel in allen Zelltypen exprimiert wird, wurde ein erfolgreicher Verlauf der Reversen-Transkriptase-Reaktion kontrolliert. Bei dem Design von solchen Primern wurde darauf geachtet, dass diese, wenn möglich Exon-springend gewählt wurden. Dadurch konnte eine eventuelle Kontamination durch genomische DNA überprüft werden. Die PCR-Reaktion wurde stets in Ansätzen mit 20 µl Volumen durchgeführt, die sich wie folgt zusammensetzte: 1,0 µl cDNA aus RT-Reaktionsansatz 2,0 µl Taq-Polymerase-Inkubationspuffer (10x) 0,3 µl MgCl2 (50 mM) 0,3 µl dNTPs (10 mM) 0,4 µl 5’-Primer (10 pmol) 0,4 µl 3’-Primer (10 pmol) 1U Taq-DNA-Polymerase ad 20 µl H2O Die Amplifikate wurden auf einem Agarosegel ausgewertet. 8.2.16 Polymerase-Ketten-Reaktion (PCR) für Klonierungen Bei PCRs für Klonierungen wurden Proof-Reading-Polymerasen (Pfx oder Phusion) verwendet. Die Amplifikation mit den jeweiligen Oligonukleotiden und Plasmid-DNA oder cDNA als Matrize erfolgte nach Anleitung der Hersteller. 86 MATERIAL & METHODEN 8.2.17 Kolonie-PCR Bei Klonierungen wurden zum Teil auch erhaltene Liganten mittels Kolonie-PCR auf Einlagerung und Orientierung des Inserts überprüft. Dazu wurde der im Anschluss beschriebene Mastermix in ein Reaktionsgefäß vorgelegt und anschließend mit einer sterilen Spitze eine Kolonie von der Ligationsplatte gepickt und zuerst in dem Mix mehrmals hin- und hergedreht und anschließend mit derselben Spitze eine Übernachtkultur angeimpft. Für die PCR-Reaktion wurden spezifische Oligonukleotide eingesetzt, durch die anhand der resultierenden Amplifikate ausgewertet werden konnte, ob das Insert eingelagert ist, und gegebenenfalls in welcher Orientierung dies geschehen ist. Dafür wurden zusätzlich entsprechende Kontrollen mitgeführt, so dass durch unterschiedliches Laufverhalten der Amplifikate im Agarosegel die positiven Kandidaten identifiziert werden konnten. Am nächsten Tag wurden die entsprechenden Übernachtkulturen präpariert und durch Sequenzanalyse nochmals überprüft. Für die Amplifikation wurde Taq-Polymerase (Invitrogen GmbH, Karlsruhe) eingesetzt und den Angaben des Herstellers folge geleistet. Die PCR-Reaktion wurde stets in Ansätzen mit 20 µl Volumen durchgeführt, die sich wie folgt zusammensetzte: 2,0 µl Taq-Polymerase-Inkubationspuffer (10x) 0,6 µl MgCl2 (50 mM) 0,4 µl dNTPs (10 mM) 0,2 µl 5’-Primer (10 pmol) 0,2 µl 3’-Primer (10 pmol) 0,2 U Taq-DNA-Polymerase ad 20 µl H2O 8.2.18 DNA-Microarrays und Analyse der Expression von Genen Die gesamte RNA von Zellen wurde durch den Einsatz von TRIzol Reagenz präpariert, mit DNaseI verdaut und mittels RNeasy aufgereinigt, hierbei wurde den Angaben der Hersteller Folge geleistet. Microarrayanalyse der Zelllinien DLD1-TR7 und DLD1-dnTCF4 wurden mit 87 MATERIAL & METHODEN dem GeneChip HG-U133, die Analyse von HCT116 Zellen mit dem GeneChip HG-U133 Plus 2.0 von Affymetrix durchgeführt. Die erhaltenen Daten wurden mit den Softwareprogrammen Microarray Suite 5.0 (Affymetrix; statistischer Algorithmus), Data Mining Tool 3.0 (Affymetrix) und MS Excel und Access bearbeitet. Als unterschiedlich regulierte Gene wurden solche gewertet wenn die folgenden Kriterien erfüllt waren: (i) unter wenigstens einer Bedingung hatte das Transkript einen `present call`, was der Affymetrix Analyse folgend bedeutet das Gen ist mindestens in einer der Proben exprimiert; (ii) das Gen war mindestens um das 2-fache erhöht (I, increased) oder erniedrigt (D; decreased) gemessen an dem `difference call` der Affymetrix Software; (iii) der `change p-value` war ≤ 0,05 (difference call reliability); (iv) die Affymetrix-Signalintensität (`signal intensity`) war in mindestens einer Probe höher als 100. 8.2.19 Quantitative Echtzeit-PCR (real time RT-PCR) Von der umgeschriebene cDNA wurde je 1-3 µl bei der quantitativen Echtzeit-PCR als Matrize eingesetzt. Diese wurde zu dem vorgelegten Gemisch aus 12,5 µl „Absolute SYBRGreen Fluorescin“ und den entsprechenden Oligonukleotiden (0,25 µM) gegeben und das Gesamtvolumen auf 25 µl eingestellt. Der PCR-Lauf wurde im iCycler™ iQ (Bio-Rad) über 50 Zyklen und folgendem PCR-Programm durchgeführt: Hot-Start (Aktivierung der Taq-Polymerase): 12 min, 95°C Denaturierung: 15 sec, 95°C Hybridisierung: 20°sec, 57°C Elongation: 45 sec, 72°C Denaturierung: 1 min, 95°C Schmelzkurve: 30 sec, 55°C 50x 8 sek, 55°Χ 8 sek ΔT + 0,5°C (80 Cyklen) End: ∞, 4°C 88 MATERIAL & METHODEN Die generierten Daten wurden mit Hilfe der iCycler™ iQ Optical System Software Version 3.0 a von Bio-Rad ausgewertet. 8.2.20 Immunfluoreszenzfärbung von Zellen Ca. 1 x 105 293T Zellen wurden auf Deckgläschen in 6-Well Platen ausgesät und am folgenden Tag transfiziert. 24h nach der Transfektion wurden die Zellen mit PBS gewaschen, für 15 min mit 3 %igem PFA fixiert und durch Inkubation für 5 min in 0,5 %igem Triton X-100 permeabilisiert. Vor dem nächsten Schritt und allen folgenden wurden die Zellen mit 1 x PBS gewaschen. Zum Blockieren unspezifischer Bindungen wurden die Ansätze dann für mindestens 30 min mit 10 % FKS-haltigem DMEM inkubiert und anschließend 50 µl primärer Antikörper vorsichtig auf die Zellen pipettiert. Nach einstündiger Inkubation be RT wurde 45 min mit 50 µl Cy2- bzw. Cy3 gekoppelten sekundären Antikörper (1:200 verdünnt mit DMEM/ 10 % FKS) inkubiert. Anschließend wurden 4 µl Hoechst zum Färben der DNA auf die Deckgläschen gegeben. Nachdem 15 µl Moviol auf einen Objektträger pipettiert worden waren, wurden die Deckgläschen mit den Zelllen nach unten darauf gelegt. Die Mikroskopische Betrachtung erfolgte mit Hilfe eines Fluoreszenzmikroskops unter entsprechendem Anregungslicht. Bei Transfektionen in denen mit GFP- (green flourescence protein) oder RFP- (red flourescence protein) gekoppelten Proteinen gearbeitet wurde, ist keine Antikörperfärbung durchgeführt worden. 8.2.21 Apoptose Messung, TUNEL Für den Nachweis von apoptotischen Zellen wurde die TUNEL-Technik (TdT-mediated dUTP-biotin nick end labeling; TdT: terminal deoxynucleotidyl transferase) angewandt. Während der Apoptose, einer Form des „programmierten Zelltodes“, wird der DNA-Strang durch die Aktivität von Endonukleasen fragmentiert. Die an den Bruchenden freiwerdenden 3'-OH-Gruppen werden durch das Enzym TdT mit markierten Nukleotiden versehen, welche z. B aufgrund von Fluoreszenz mit entsprechenden Mikroskopen sichtbar gemacht werden können, oder im Durchflusszytometer vermessen werden können. HCT116 Zellen wurden in 89 MATERIAL & METHODEN 6-Well Platten transfiziert und nach 24 h wurde der TUNEL Assay mit Hilfe des APOBrdU™ TUNEL Assay Kit (A23210) nach den Vorgaben des Herstellers (Invitrogen) durchgeführt. Die Detektion der gefärbten Zellen erfolgte am Durchflusscytometer FACScan (BD Bioscience). 90 ABKÜRZUNGSVERZEICHNIS 9 9.1 Abkürzungsverzeichnis Abkürzungen A Abb. Ampr Amp APS AS ATP 3-AT bp BSA Cam C. elegans C. cDNA CMV COOH-Terminus Da DMEM DMSO DNA dNTPs DTT E. coli ECL EDTA EGTA ELISA EGFP EtBr FKS g GAPDH GDP GEF GST GTP H. sapiens H. simplex Deoxyadenosin-5'-phosphat Abbildung Ampicillin-Resistenzgen (β-Lactamase) Ampicillin Ammoniumpersulfat Aminosäure Adenosintriphosphat 3-Amino-1,2,4-triazol Basenpaare bovines Serumalbumin Chloramphenicol Caenorhabditis elegans familiaris Canis familiaris komplementäre DNA Cytomegalievirus Carboxyterminus eines Proteins Dalton, Einheit der relativen Molmasse Dulbecco's Modified Eagle Medium Dimethylsulfoxid Deoxyribonucleinsäure Deoxynucleotide Dithiothreitol Escherichia coli enhanced chemiluminescence Ethylendiamintetraessigsäure Ethylenglycoltetraessigsäure enzyme-linked immunosorbent assay enhanced green fluorescent protein Ethidiumbromid fötales Kälberserum Gravitationskonstante Glycerinaldehyd-3-Phosphat Dehydrogenase Guanosindiphosphat Guaninnukleotidaustauschfaktor (guanine nucleotide factor) Glutathion S-Transferase Guanosintripohsphat Homo sapiens Herpes simplex exchange 91 ABKÜRZUNGSVERZEICHNIS IF IL-6 IP Kan Kanr/Neor kb LB LiCl mRNA M. musculus NH2-Terminus OD ONPG p. a. PAA PAGE PBS PCR PFA pH PMSF RNA RNAi RNAse rpm SDS siRNA T Ta Taq TEMED Tris TRITC U UV-Licht vgl. (v/v) VP16 WB (w/v) x nach Zahlen: Immunfluoreszenz Interleukin 6 Immunpräzipitation Kanamycin Kanamycin/Neomycin-Resistenzgen Kilobasen Luria-Broth Lithiumchlorid messenger Ribonucleinsäure Mus musculus Aminoterminus eines Proteins optische Dichte o-Nitrophenyl-β-D-galactopyranosid pro analysi Polyacrylamid Polyacrylamidgelelektrophorese Posphat-gepufferte Salzlösung (phosphate buffered saline) Polymerasekettenreaktion (polymerase chain reaction) Paraformaldehyd negativer Logarhitmus der Wasserstoffionenkonzentration [H+] Phenylmethylsulphonylfluorid Ribonucleinsäure (ribonucleic acid) RNA-Interferenz Ribonuclease rotations per minute Natrium-Dodecylsulfat short interfering RNA Deoxythymidin-5'-monophosphat Hybridisierungstemperatur (annealing temperature) Thermus aquaticus N,N,N',N'-Tetramethylethylendiamin Tris(hydroxymethyl)-aminomethan Tetramethylrhodamin-B-isothiocyanat Uracil ultraviolettes Licht vergleiche Volumen/Volumen virales Protein 16 aus H. simplex Western Blot Gewicht/Volumen -fach 92 ABKÜRZUNGSVERZEICHNIS 9.2 Aminosäuren A C D E F G H I K L M N P Q R S T V W Y Ala Cys Asp Glu Phe Gly His Ile Lys Leu Met Asn Pro Gln Arg Ser Thr Val Ttp Tyr 9.3 Dimensionen k m μ n p Alanin Cystein Asparaginsäure Glutaminsäure Phenylalanin Glycin Histidin Isoleucin Lysin Leucin Methionin Asparagin Prolin Glutamin Arginin Serin Threonin Valin Tryptophan Tyrosin Kilo (103) Milli (10-3) Mikro (10-6) Nano (10-9) Piko (10-12) 93 ABKÜRZUNGSVERZEICHNIS 9.4 A °C Da g h l m M min sec Einheiten Ampère Grad Celsius Dalton Gramm Stunde Liter Meter mol/l; molar Minute Sekunde 94 ANHANG 10 Anhang 10.1 Ergebnisse der DNA-Microarray Analyse im HCT116 (RNAi)System HCT116 (RNAi): FC: fold change, A vs G: siAPC vs siGFP, Expressionswert vom siAPCChip geteilt durch den entsprechenden Wert (gleiche Probe Set ID) des Kontroll-Chips (siGFP), A+B vs G: Wert des Chips mit siAPC und siβ-Catenin geteilt durch den Wert vom Kontroll-Chip; Probe Set ID: Affymetrix Gene ID (www.affymetrix.com). Gen Symbol Gen Titel FC A vs G FC A+B vs G Probe Set ID AXIN2 axin 2 (conductin, axil) 8,11 3,42 224176_s_at KIAA0241 KIAA0241 protein 4,82 5,22 1563452_at RAB6A RAB6A 4,47 4,13 201045_s_at NFKBIB nuclear factor of kappa light polypeptide gene 3,66 4,30 214062_x_at SGK serum/glucocorticoid regulated kinase 3,32 2,41 201739_at LOC91752 similar to C630007C17Rik protein 2,89 1,84 215767_at AXIN2 axin 2 (conductin, axil) 2,85 1,64 222696_at RNASEH1 ribonuclease H1 2,64 1,66 241343_at FLJ12687 hypothetical protein FLJ12687 2,41 1,31 205238_at SSR3 signal sequence receptor, gamma 2,20 1,28 217790_s_at MGC52057 hypothetical protein MGC52057 2,11 2,10 227764_at TRIP TRAF interacting protein 2,07 1,15 205598_at HOOK3 hook homolog 3 (Drosophila) 9,45 23,59 1558315_s_at PRKAA2 protein kinase, AMP-activated 3,39 3,52 240349_at COPEB core promoter elementbinding protein 2,66 2,75 208960_s_at ADAM19 a disintegrin and metalloproteinase 2,39 2,33 209765_at NTSR1 neurotensin receptor 1 2,38 2,31 207360_s_at COPEB core promoter elementbinding protein 2,31 2,31 208961_s_at KRT6A keratin 6A /// keratin 6A 2,17 1,67 209125_at MAP4 microtubule-associated protein 4 2,01 2,20 33850_at BMP4 bone morphogenetic protein 4 2,01 1,78 211518_s_at 95 ANHANG 10.2 Ergebnisse der DNA-Microarray Analyse im DLD1-dnTCF4 (-/+dox)-System DLD1dnTCF(-/+dox) Genregulation > 4-fach: FC: fold change, Expressionswert von nicht induzierten Zellen (-dox) wurde geteilt durch den entsprechenden Wert (gleiche Probe Set ID) von induzierten Zellen (+dox); Probe Set ID: Affymetrix Gene ID (www.affymetrix.com). Gen Symbol Gen Titel FC Probe Set ID GPR49 G protein-coupled receptor 49 10,7 213880_at ELK3 ELK3, ETS-domain protein 9,4 221773_at PTGS2 prostaglandin-endoperoxide synthase 2 8,2 204748_at KIT v-kit Hardy-Zuckerman 4 feline 7,9 205051_s_at CYP1B1 cytochrome P450, family 1, subfamily B 7,7 202437_s_at ID2 inhibitor of DNA binding 2 6,7 201566_x_at ANXA1 annexin A1 6,6 201012_at OAS1 2',5'-oligoadenylate synthetase 1 6,4 205552_s_at CD24 CD24 antigen 6,4 209772_s_at TBX3 T-box 3 6,3 219682_s_at NEDD9 neural precursor cell expressed, developmentally down-regulated 9 6,2 202149_at IGSF4 immunoglobulin superfamily, member 4 5,9 209031_at BAG2 BCL2-associated athanogene 2 5,9 209406_at RORA RAR-related orphan receptor A 5,9 210426_x_at SGK serum/glucocorticoid regulated kinase 5,8 201739_at RORA RAR-related orphan receptor A 5,7 210479_s_at DOCK4 DOCK4 5,7 205003_at CPO coproporphyrinogen oxidase 5,6 204172_at LEF1 lymphoid enhancer-binding factor 1 5,5 221558_s_at DUSP6 dual specificity phosphatase 6 5,4 208893_s_at LOC58486 transposon-derived Buster1 transposase-like protein 5,4 218263_s_at KIAA1199 KIAA1199 protein 5,2 212942_s_at SPUVE protease, serine, 23 5,2 202458_at MARCKS myristoylated alanine-rich protein kinase C substrate 5,2 201669_s_at FLJ20315 hypothetical protein FLJ20315 5,2 218704_at MAP4K5 mitogen-activated protein kinase kinase kinase kinase 5 5,2 211081_s_at CD24 CD24 antigen 5,2 208650_s_at KITLG KIT ligand 5,0 207029_at OAZIN ornithine decarboxylase antizyme inhibitor 5,0 201772_at 96 ANHANG PHLDA1 pleckstrin homology-like domain, family A, member 1 5,0 217999_s_at RAB27B RAB27B, member RAS oncogene family 5,0 207017_at TGFB2 transforming growth factor, beta 2 4,9 209909_s_at LAMB1 laminin, beta 1 4,9 201505_at AMACR alpha-methylacyl-CoA racemase 4,8 209424_s_at ID2 inhibitor of DNA binding 2 4,8 201565_s_at CYP1B1 cytochrome P450, family 1, subfamily B, polypeptide 1 4,7 202436_s_at FLJ11155 hypothetical protein FLJ11155 4,6 219750_at CXCL5 chemokine (C-X-C motif) ligand 5 4,6 215101_s_at GLRX glutaredoxin (thioltransferase) 4,6 209276_s_at NR2F2 nuclear receptor subfamily 2, group F, member 2 4,5 215073_s_at PHLDA1 pleckstrin homology-like domain, family A, member 1 4,5 217996_at AREG amphiregulin 4,5 205239_at TGIF TGFB-induced factor (TALE family homeobox) 4,4 203313_s_at TM4SF3 transmembrane 4 superfamily member 3 4,3 203824_at CAD carbamoyl-phosphate synthetase 2 4,3 202715_at LAMB1 laminin, beta 1 4,3 211651_s_at SLC35D1 solute carrier family 35 4,2 209712_at GNAI1 guanine nucleotide binding protein (G protein) 4,2 209576_at DUSP6 dual specificity phosphatase 6 4,2 208892_s_at HMGA2 high mobility group AT-hook 2 4,1 208025_s_at CXCL5 chemokine (C-X-C motif) ligand 5 4,1 207852_at ABCC4 ATP-binding cassette, sub-family C (CFTR/MRP), member 4 4,1 203196_at BUP BUP protein 4,1 218048_at SLC12A2 solute carrier family 12, member 2 4,1 204404_at ANGPT1 angiopoietin 1 4,0 205608_s_at 97 ANHANG DLD1dnTCF(-/+dox) Genregulation < 4-fach: FC: fold change, Expressionswert von nicht induzierten Zellen (-dox) wurde geteilt durch den entsprechenden Wert (gleiche Probe Set ID) von induzierten Zellen (+dox); Probe Set ID: Affymetrix Gene ID (www.affymetrix.com). Gen Symbol Gen Titel FC Probe Set ID RRAD Ras-related associated with diabetes -86,8 204802_at MUC5AC mucin 5, subtypes A and C -85,6 214303_x_at GREB1 GREB1 protein -68,1 205862_at NK4 natural killer cell transcript 4 -48,8 203828_s_at FLJ10261 hypothetical protein FLJ10261 -44,6 218804_at RRAD Ras-related associated with diabetes -40,5 204803_s_at H11 protein kinase H11 -38,1 221667_s_at C3 complement component 3 -38,1 217767_at DEPP decidual protein induced by progesterone -36,8 209183_s_at SAA2 serum amyloid A2 -36,3 214456_x_at SERPINE1 serine (or cysteine) proteinase inhibitor -35,8 202628_s_at AQP3 aquaporin 3 -32,2 39248_at MUC1 mucin 1, transmembrane -32,2 213693_s_at EDN2 endothelin 2 -32,0 206758_at BF B-factor, properdin -30,3 202357_s_at MAOA monoamine oxidase A -27,9 204388_s_at CLIC3 chloride intracellular channel 3 -26,0 219529_at AQP3 aquaporin 3 -25,1 39249_at TCEA2 transcription elongation factor A (SII), 2 -24,6 203919_at S100A3 S100 calcium binding protein A3 -22,8 206027_at HSPG2 heparan sulfate proteoglycan 2 (perlecan) -22,8 201655_s_at S100A9 S100 calcium binding protein A9 (calgranulin B) -19,3 203535_at TPSB2 tryptase beta 2 -18,5 207134_x_at SAA2 serum amyloid A2 -17,9 208607_s_at PRKCD protein kinase C, delta -17,8 202545_at KRT14 keratin 14 (epidermolysis bullosa simplex) -17,3 209351_at LSS lanosterol synthase (2,3-oxidosqualene-lanosterol cyclase) -16,7 211018_at LGALS1 lectin, galactoside-binding, soluble, 1 (galectin 1) -16,3 201105_at TPSB2 tryptase beta 2 -16,2 215382_x_at AMY1A amylase, alpha 1A; salivary -15,8 208498_s_at LPAAT-delta lysophosphatidic acid acyltransferase-delta -15,5 219693_at UPK3B uroplakin 3B -15,5 206658_at PP1665 hypothetical protein PP1665 -15,3 213343_s_at 98 ANHANG TCF7L2 transcription factor 7-like 2 (T-cell specific, HMG-box) -15,2 212759_s_at C14orf78 chromosome 14 open reading frame 78 -14,9 212992_at SLC9A1 solute carrier family 9 (sodium/hydrogen exchanger), isoform) -14,9 209453_at PAEP progestagen-associated endometrial protein -14,7 206859_s_at TFEB transcription factor EB -14,6 50221_at FOSB FBJ murine osteosarcoma viral oncogene homolog B -14,5 202768_at DIO3 deiodinase, iodothyronine, type III -13,5 207154_at FLJ12921 hypothetical protein FLJ12921 -12,6 219804_at PRSS1 protease, serine, 1 (trypsin 1) -12,3 205869_at SLC2A6 solute carrier family 2, member 6 -12,1 220091_at AFAP actin filament associated protein -11,9 203563_at C20orf12 chromosome 20 open reading frame 12 -11,7 219951_s_at CACNA1G calcium channel, voltage-dependent, alpha 1G subunit -11,3 210380_s_at P2RY5 purinergic receptor P2Y, G-protein coupled, 5 -10,6 218589_at NFKB2 nuclear factor of kappa light polypeptide gene -10,6 209636_at FLJ13055 hypothetical protein FLJ13055 -10,4 64899_at CELSR3 cadherin, EGF LAG seven-pass G-type receptor 3 -10,4 205165_at ANGPTL4 angiopoietin-like 4 -10,1 221009_s_at ISG20 interferon stimulated gene 20kDa -9,7 204698_at HBS1L HBS1-like (S. cerevisiae) -9,5 209315_at AQP3 aquaporin 3 -9,4 203747_at HKR3 GLI-Kruppel family member HKR3 -9,3 205025_at P164RHOGEF Rho-specific guanine-nucleotide exchange factor 164 kDa -9,3 203756_at CDKN1A cyclin-dependent kinase inhibitor 1A (p21, Cip1) -8,8 202284_s_at MAOA monoamine oxidase A -8,5 212741_at MUC5AC mucin 5, subtypes A and C, tracheobronchial/gastric -8,4 214385_s_at SYNGR3 synaptogyrin 3 -8,4 205691_at ANXA8 annexin A8 -8,4 203074_at ICAM1 intercellular adhesion molecule 1 (CD54) -8,3 202638_s_at SERPINE1 serine (or cysteine) proteinase inhibitor, clade E -8,1 202627_s_at FLJ12178 hypothetical protein FLJ12178 -8,1 220586_at D2S448 Melanoma associated gene -7,7 212013_at PTGS1 prostaglandin-endoperoxide synthase 1 -7,7 205127_at POLR2J2 DNA directed RNA polymerase II polypeptide J-related gene -7,4 212706_at C6orf29 chromosome 6 open reading frame 29 -7,4 205597_at ASMTL acetylserotonin O-methyltransferase-like -7,3 209394_at TGM2 transglutaminase 2 -7,3 201042_at ISGF3G interferon-stimulated transcription factor 3, gamma 48kDa -6,8 203882_at APOL3 apolipoprotein L, 3 -6,6 221087_s_at IFIT1 interferon-induced protein with tetratricopeptide repeats 1 -6,6 203153_at FLJ22059 hypothetical protein FLJ22059 -6,6 218762_at PRODH proline dehydrogenase (oxidase) 1 -6,6 214203_s_at KIAA0157 KIAA0157 protein -6,6 212837_at LTB lymphotoxin beta (TNF superfamily, member 3) -6,4 207339_s_at 99 ANHANG ASMTL acetylserotonin O-methyltransferase-like -6,3 36554_at EMP3 epithelial membrane protein 3 -6,3 203729_at CSF1 colony stimulating factor 1 (macrophage) -6,2 209716_at PPL periplakin -6,2 203407_at TPSB2 tryptase beta 2 -6,1 216474_x_at PER1 period homolog 1 (Drosophila) -5,9 202861_at VEGF vascular endothelial growth factor -5,8 212171_x_at ISG20 interferon stimulated gene 20kDa -5,6 33304_at TRIM29 tripartite motif-containing 29 -5,6 202504_at ABCC3 ATP-binding cassette, sub-family C (CFTR/MRP), member 3 -5,6 208161_s_at SLC22A1L solute carrier family 22 (organic cation transporter), member 1-like -5,5 204981_at ABCG1 ATP-binding cassette, sub-family G (WHITE), member 1 -5,5 204567_s_at COL6A3 collagen, type VI, alpha 3 -5,5 201438_at MB myoglobin -5,5 204179_at D2S448 Melanoma associated gene -5,4 212012_at DEFB1 defensin, beta 1 -5,4 210397_at MAOA monoamine oxidase A -5,4 204389_at MUC1 mucin 1, transmembrane -5,3 207847_s_at MUC4 mucin 4, tracheobronchial -5,3 217109_at TENC1 tensin like C1 domain-containing phosphatase -5,3 212494_at TMP21 transmembrane trafficking protein -5,2 212352_s_at FLJ22671 hypothetical protein FLJ22671 -5,2 220149_at HMOX1 heme oxygenase (decycling) 1 -5,2 203665_at TCF7L2 transcription factor 7-like 2 (T-cell specific, HMG-box) -5,1 212762_s_at MCAM melanoma cell adhesion molecule -5,1 210869_s_at CTSL cathepsin L -5,1 202087_s_at ELF3 E74-like factor 3 (ets domain transcription factor, epithelial-specific ) -5,0 210827_s_at TPSB2 tryptase beta 2 -5,0 205683_x_at ADCY9 adenylate cyclase 9 -5,0 204497_at JUNB jun B proto-oncogene -5,0 201473_at ALDH3B1 aldehyde dehydrogenase 3 family, member B1 -4,9 205640_at NF1 neurofibromin 1 -4,9 216115_at KIAA0982 KIAA0982 protein -4,8 211383_s_at KIAA1609 KIAA1609 protein -4,8 65438_at ALDH8A1 aldehyde dehydrogenase 8 family, member A1 -4,8 220148_at S100A4 S100 calcium binding protein A4 -4,8 203186_s_at KIAA1164 hypothetical protein KIAA1164 -4,7 222111_at ICAM4 intercellular adhesion molecule 4, Landsteiner-Wiener blood group -4,7 207194_s_at ELF3 E74-like factor 3 (ets domain transcription factor, epithelial-specific ) -4,7 201510_at DMC1 DMC1 dosage suppressor of mck1 homolog -4,7 208382_s_at PRKCZ protein kinase C, zeta -4,7 202178_at HCF-2 host cell factor 2 -4,6 219484_at TSGA10 testis specific, 10 -4,6 220623_s_at NME7 non-metastatic cells 7, protein expressed in -4,6 219553_at 100 ANHANG KCNAB2 potassium voltage-gated channel -4,5 203402_at KIAA1609 KIAA1609 protein -4,5 221843_s_at PTK6 PTK6 protein tyrosine kinase 6 -4,5 206482_at VEGF vascular endothelial growth factor -4,4 210512_s_at TJP3 tight junction protein 3 (zona occludens 3) -4,4 213412_at TNNT1 troponin T1, skeletal, slow -4,4 213201_s_at SQSTM1 sequestosome 1 -4,4 213112_s_at TNF tumor necrosis factor (TNF superfamily, member 2) -4,4 207113_s_at MAP2K5 mitogen-activated protein kinase kinase 5 -4,3 211371_at EPS8L1 EPS8-like 1 -4,3 221665_s_at ZNF297B zinc finger protein 297B -4,3 204182_s_at SSH-3 slingshot 3 -4,3 219919_s_at KRT7 keratin 7 -4,3 209016_s_at PP1057 hypothetical protein PP1057 -4,2 220968_s_at AIM1L absent in melanoma 1-like -4,2 220289_s_at MKNK2 MAP kinase-interacting serine/threonine kinase 2 -4,2 218205_s_at BDKRB2 bradykinin receptor B2 -4,2 205870_at FLJ10490 hypothetical protein FLJ10490 -4,2 219760_at SLC22A1LS solute carrier family 22 (organic cation transporter) -4,2 206097_at COL6A2 collagen, type VI, alpha 2 -4,2 209156_s_at ARP5 angiopoietin-related protein 5 -4,1 53720_at FAXDC1 fatty acid hydroxylase domain containing 1 -4,1 219429_at FLJ23451 hypothetical protein FLJ23451 -4,1 219617_at HPCAL1 hippocalcin-like 1 -4,1 212552_at IL1RN interleukin 1 receptor antagonist -4,1 212657_s_at BDKRB1 bradykinin receptor B1 -4,1 207510_at RTP801 HIF-1 responsive RTP801 -4,1 202887_s_at VEGF vascular endothelial growth factor -4,0 211527_x_at APOL1 apolipoprotein L, 1 -4,0 209546_s_at KIAA0876 KIAA0876 protein -4,0 212492_s_at SOX30 SRY (sex determining region Y)-box 30 -4,0 207678_s_at ASS argininosuccinate synthetase -4,0 207076_s_at 101 LITERATURVERZEICHNIS 11 Literaturverzeichnis Abdul, M. and Hoosein, N. (2006) Reduced Kv1.3 potassium channel expression in human prostate cancer. J Membr Biol, 214, 99-102. Alliston, T.N., Gonzalez-Robayna, I.J., Buse, P., Firestone, G.L. and Richards, J.S. (2000) Expression and localization of serum/glucocorticoid-induced kinase in the rat ovary: relation to follicular growth and differentiation. Endocrinology, 141, 385-395. Alvarez de la Rosa, D., Zhang, P., Naray-Fejes-Toth, A., Fejes-Toth, G. and Canessa, C.M. (1999) The serum and glucocorticoid kinase sgk increases the abundance of epithelial sodium channels in the plasma membrane of Xenopus oocytes. J Biol Chem, 274, 37834-37839. Anderson, J.D., Hansen, T.P., Lenkowski, P.W., Walls, A.M., Choudhury, I.M., Schenck, H.A., Friehling, M., Holl, G.M., Patel, M.K., Sikes, R.A. and Brown, M.L. (2003) Voltage-gated sodium channel blockers as cytostatic inhibitors of the androgenindependent prostate cancer cell line PC-3. Mol Cancer Ther, 2, 1149-1154. Anderson, M.J., Viars, C.S., Czekay, S., Cavenee, W.K. and Arden, K.C. (1998) Cloning and characterization of three human forkhead genes that comprise an FKHR-like gene subfamily. Genomics, 47, 187-199. Arden, K.C. (2006) Multiple roles of FOXO transcription factors in mammalian cells point to multiple roles in cancer. Exp Gerontol, 41, 709-717. Bader, A.G., Kang, S., Zhao, L. and Vogt, P.K. (2005) Oncogenic PI3K deregulates transcription and translation. Nat Rev Cancer, 5, 921-929. Behrens, J. (2005) The role of the Wnt signalling pathway in colorectal tumorigenesis. Biochem Soc Trans, 33, 672-675. Behrens, J., Jerchow, B.A., Wurtele, M., Grimm, J., Asbrand, C., Wirtz, R., Kuhl, M., Wedlich, D. and Birchmeier, W. (1998) Functional interaction of an axin homolog, conductin, with beta-catenin, APC, and GSK3beta. Science, 280, 596-599. Behrens, J., von Kries, J.P., Kuhl, M., Bruhn, L., Wedlich, D., Grosschedl, R. and Birchmeier, W. (1996) Functional interaction of beta-catenin with the transcription factor LEF-1. Nature, 382, 638-642. Bell, L.M., Leong, M.L., Kim, B., Wang, E., Park, J., Hemmings, B.A. and Firestone, G.L. (2000) Hyperosmotic stress stimulates promoter activity and regulates cellular utilization of the serum- and glucocorticoid-inducible protein kinase (Sgk) by a p38 MAPK-dependent pathway. J Biol Chem, 275, 25262-25272. Bhanot, P., Brink, M., Samos, C.H., Hsieh, J.C., Wang, Y., Macke, J.P., Andrew, D., Nathans, J. and Nusse, R. (1996) A new member of the frizzled family from Drosophila functions as a Wingless receptor. Nature, 382, 225-230. Biggs, W.H., 3rd, Meisenhelder, J., Hunter, T., Cavenee, W.K. and Arden, K.C. (1999) Protein kinase B/Akt-mediated phosphorylation promotes nuclear exclusion of the winged helix transcription factor FKHR1. Proc Natl Acad Sci U S A, 96, 7421-7426. Borkhardt, A., Repp, R., Haas, O.A., Leis, T., Harbott, J., Kreuder, J., Hammermann, J., Henn, T. and Lampert, F. (1997) Cloning and characterization of AFX, the gene that fuses to MLL in acute leukemias with a t(X;11)(q13;q23). Oncogene, 14, 195-202. Brabletz, T., Jung, A., Dag, S., Hlubek, F. and Kirchner, T. (1999) beta-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer. Am J Pathol, 155, 1033-1038. 102 LITERATURVERZEICHNIS Brennan, F.E. and Fuller, P.J. (2000) Rapid upregulation of serum and glucocorticoidregulated kinase (sgk) gene expression by corticosteroids in vivo. Mol Cell Endocrinol, 166, 129-136. Brownawell, A.M., Kops, G.J., Macara, I.G. and Burgering, B.M. (2001) Inhibition of nuclear import by protein kinase B (Akt) regulates the subcellular distribution and activity of the forkhead transcription factor AFX. Mol Cell Biol, 21, 3534-3546. Brunet, A., Bonni, A., Zigmond, M.J., Lin, M.Z., Juo, P., Hu, L.S., Anderson, M.J., Arden, K.C., Blenis, J. and Greenberg, M.E. (1999) Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor. Cell, 96, 857-868. Brunet, A., Kanai, F., Stehn, J., Xu, J., Sarbassova, D., Frangioni, J.V., Dalal, S.N., DeCaprio, J.A., Greenberg, M.E. and Yaffe, M.B. (2002) 14-3-3 transits to the nucleus and participates in dynamic nucleocytoplasmic transport. J Cell Biol, 156, 817-828. Brunet, A., Park, J., Tran, H., Hu, L.S., Hemmings, B.A. and Greenberg, M.E. (2001) Protein kinase SGK mediates survival signals by phosphorylating the forkhead transcription factor FKHRL1 (FOXO3a). Mol Cell Biol, 21, 952-965. Brunet, A., Sweeney, L.B., Sturgill, J.F., Chua, K.F., Greer, P.L., Lin, Y., Tran, H., Ross, S.E., Mostoslavsky, R., Cohen, H.Y., Hu, L.S., Cheng, H.L., Jedrychowski, M.P., Gygi, S.P., Sinclair, D.A., Alt, F.W. and Greenberg, M.E. (2004) Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science, 303, 2011-2015. Burnette, W.N. (1981) "Western blotting": electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Anal Biochem, 112, 195-203. Buse, P., Tran, S.H., Luther, E., Phu, P.T., Aponte, G.W. and Firestone, G.L. (1999) Cell cycle and hormonal control of nuclear-cytoplasmic localization of the serum- and glucocorticoid-inducible protein kinase, Sgk, in mammary tumor cells. A novel convergence point of anti-proliferative and proliferative cell signaling pathways. J Biol Chem, 274, 7253-7263. Canessa, C.M., Horisberger, J.D. and Rossier, B.C. (1993) Epithelial sodium channel related to proteins involved in neurodegeneration. Nature, 361, 467-470. Carter, M.E. and Brunet, A. (2007) FOXO transcription factors. Curr Biol, 17, R113-114. Casamayor, A., Torrance, P.D., Kobayashi, T., Thorner, J. and Alessi, D.R. (1999) Functional counterparts of mammalian protein kinases PDK1 and SGK in budding yeast. Curr Biol, 9, 186-197. Chen, S., Guttridge, D.C., You, Z., Zhang, Z., Fribley, A., Mayo, M.W., Kitajewski, J. and Wang, C.Y. (2001) Wnt-1 signaling inhibits apoptosis by activating beta-catenin/T cell factor-mediated transcription. J Cell Biol, 152, 87-96. Chen, S.Y., Bhargava, A., Mastroberardino, L., Meijer, O.C., Wang, J., Buse, P., Firestone, G.L., Verrey, F. and Pearce, D. (1999) Epithelial sodium channel regulated by aldosterone-induced protein sgk. Proc Natl Acad Sci U S A, 96, 2514-2519. Coffer, P.J. and Burgering, B.M. (2007) Stressed marrow: FoxOs stem tumour growth. Nat Cell Biol, 9, 251-253. Cowling, R.T. and Birnboim, H.C. (2000) Expression of serum- and glucocorticoid-regulated kinase (sgk) mRNA is up-regulated by GM-CSF and other proinflammatory mediators in human granulocytes. J Leukoc Biol, 67, 240-248. Daitoku, H., Hatta, M., Matsuzaki, H., Aratani, S., Ohshima, T., Miyagishi, M., Nakajima, T. and Fukamizu, A. (2004) Silent information regulator 2 potentiates Foxo1-mediated transcription through its deacetylase activity. Proc Natl Acad Sci U S A, 101, 1004210047. Davis, R.J. (2000) Signal transduction by the JNK group of MAP kinases. Cell, 103, 239-252. 103 LITERATURVERZEICHNIS Davis, R.J., D'Cruz, C.M., Lovell, M.A., Biegel, J.A. and Barr, F.G. (1994) Fusion of PAX7 to FKHR by the variant t(1;13)(p36;q14) translocation in alveolar rhabdomyosarcoma. Cancer Res, 54, 2869-2872. Dihlmann, S., Kloor, M., Fallsehr, C. and von Knebel Doeberitz, M. (2005) Regulation of AKT1 expression by beta-catenin/Tcf/Lef signaling in colorectal cancer cells. Carcinogenesis, 26, 1503-1512. Dijkers, P.F., Birkenkamp, K.U., Lam, E.W., Thomas, N.S., Lammers, J.W., Koenderman, L. and Coffer, P.J. (2002) FKHR-L1 can act as a critical effector of cell death induced by cytokine withdrawal: protein kinase B-enhanced cell survival through maintenance of mitochondrial integrity. J Cell Biol, 156, 531-542. Dijkers, P.F., Medema, R.H., Lammers, J.W., Koenderman, L. and Coffer, P.J. (2000a) Expression of the pro-apoptotic Bcl-2 family member Bim is regulated by the forkhead transcription factor FKHR-L1. Curr Biol, 10, 1201-1204. Dijkers, P.F., Medema, R.H., Pals, C., Banerji, L., Thomas, N.S., Lam, E.W., Burgering, B.M., Raaijmakers, J.A., Lammers, J.W., Koenderman, L. and Coffer, P.J. (2000b) Forkhead transcription factor FKHR-L1 modulates cytokine-dependent transcriptional regulation of p27(KIP1). Mol Cell Biol, 20, 9138-9148. Donohue, P.J., Alberts, G.F., Guo, Y. and Winkles, J.A. (1995) Identification by targeted differential display of an immediate early gene encoding a putative serine/threonine kinase. J Biol Chem, 270, 10351-10357. Essers, M.A., de Vries-Smits, L.M., Barker, N., Polderman, P.E., Burgering, B.M. and Korswagen, H.C. (2005) Functional interaction between beta-catenin and FOXO in oxidative stress signaling. Science, 308, 1181-1184. Evan, G.I., Wyllie, A.H., Gilbert, C.S., Littlewood, T.D., Land, H., Brooks, M., Waters, C.M., Penn, L.Z. and Hancock, D.C. (1992) Induction of apoptosis in fibroblasts by c-myc protein. Cell, 69, 119-128. Fearnhead, N.S., Britton, M.P. and Bodmer, W.F. (2001) The ABC of APC. Hum Mol Genet, 10, 721-733. Fiske, J.L., Fomin, V.P., Brown, M.L., Duncan, R.L. and Sikes, R.A. (2006) Voltagesensitive ion channels and cancer. Cancer Metastasis Rev, 25, 493-500. Fodde, R. (2003) The multiple functions of tumour suppressors: it's all in APC. Nat Cell Biol, 5, 190-192. Fodde, R. and Smits, R. (2002) Cancer biology. A matter of dosage. Science, 298, 761-763. Fodde, R., Smits, R. and Clevers, H. (2001) APC, signal transduction and genetic instability in colorectal cancer. Nat Rev Cancer, 1, 55-67. Fox, S.W. and Lyon, D.E. (2006) Symptom clusters and quality of life in survivors of lung cancer. Oncol Nurs Forum, 33, 931-936. Frederiksen, C.M., Knudsen, S., Laurberg, S. and Orntoft, T.F. (2003) Classification of Dukes' B and C colorectal cancers using expression arrays. J Cancer Res Clin Oncol, 129, 263-271. Friederichs, J., Rosenberg, R., Mages, J., Janssen, K.P., Maeckl, C., Nekarda, H., Holzmann, B. and Siewert, J.R. (2005) Gene expression profiles of different clinical stages of colorectal carcinoma: toward a molecular genetic understanding of tumor progression. Int J Colorectal Dis, 20, 391-402. Fukuoka, M., Daitoku, H., Hatta, M., Matsuzaki, H., Umemura, S. and Fukamizu, A. (2003) Negative regulation of forkhead transcription factor AFX (Foxo4) by CBP-induced acetylation. Int J Mol Med, 12, 503-508. Furukawa-Hibi, Y., Kobayashi, Y., Chen, C. and Motoyama, N. (2005) FOXO transcription factors in cell-cycle regulation and the response to oxidative stress. Antioxid Redox Signal, 7, 752-760. 104 LITERATURVERZEICHNIS Furuyama, T., Nakazawa, T., Nakano, I. and Mori, N. (2000) Identification of the differential distribution patterns of mRNAs and consensus binding sequences for mouse DAF-16 homologues. Biochem J, 349, 629-634. Galili, N., Davis, R.J., Fredericks, W.J., Mukhopadhyay, S., Rauscher, F.J., 3rd, Emanuel, B.S., Rovera, G. and Barr, F.G. (1993) Fusion of a fork head domain gene to PAX3 in the solid tumour alveolar rhabdomyosarcoma. Nat Genet, 5, 230-235. Giarre, M., Semenov, M.V. and Brown, A.M. (1998) Wnt signaling stabilizes the dualfunction protein beta-catenin in diverse cell types. Ann N Y Acad Sci, 857, 43-55. Gonzalez-Robayna, I.J., Alliston, T.N., Buse, P., Firestone, G.L. and Richards, J.S. (1999) Functional and subcellular changes in the A-kinase-signaling pathway: relation to aromatase and Sgk expression during the transition of granulosa cells to luteal cells. Mol Endocrinol, 13, 1318-1337. Greer, E.L. and Brunet, A. (2005) FOXO transcription factors at the interface between longevity and tumor suppression. Oncogene, 24, 7410-7425. Habermann, J.K., Paulsen, U., Roblick, U.J., Upender, M.B., McShane, L.M., Korn, E.L., Wangsa, D., Kruger, S., Duchrow, M., Bruch, H.P., Auer, G. and Ried, T. (2007) Stage-specific alterations of the genome, transcriptome, and proteome during colorectal carcinogenesis. Genes Chromosomes Cancer, 46, 10-26. He, T.C., Sparks, A.B., Rago, C., Hermeking, H., Zawel, L., da Costa, L.T., Morin, P.J., Vogelstein, B. and Kinzler, K.W. (1998) Identification of c-MYC as a target of the APC pathway. Science, 281, 1509-1512. Heasley, L.E. and Han, S.Y. (2006) JNK regulation of oncogenesis. Mol Cells, 21, 167-173. Heasman, J., Crawford, A., Goldstone, K., Garner-Hamrick, P., Gumbiner, B., McCrea, P., Kintner, C., Noro, C.Y. and Wylie, C. (1994) Overexpression of cadherins and underexpression of beta-catenin inhibit dorsal mesoderm induction in early Xenopus embryos. Cell, 79, 791-803. Hermeking, H. and Eick, D. (1994) Mediation of c-Myc-induced apoptosis by p53. Science, 265, 2091-2093. Hillion, J., Le Coniat, M., Jonveaux, P., Berger, R. and Bernard, O.A. (1997) AF6q21, a novel partner of the MLL gene in t(6;11)(q21;q23), defines a forkhead transcriptional factor subfamily. Blood, 90, 3714-3719. Hollister, R.D., Page, K.J. and Hyman, B.T. (1997) Distribution of the messenger RNA for the extracellularly regulated kinases 1, 2 and 3 in rat brain: effects of excitotoxic hippocampal lesions. Neuroscience, 79, 1111-1119. Holtrich, U., Wolf, G., Brauninger, A., Karn, T., Bohme, B., Rubsamen-Waigmann, H. and Strebhardt, K. (1994) Induction and down-regulation of PLK, a human serine/threonine kinase expressed in proliferating cells and tumors. Proc Natl Acad Sci U S A, 91, 1736-1740. Hu, M.C., Lee, D.F., Xia, W., Golfman, L.S., Ou-Yang, F., Yang, J.Y., Zou, Y., Bao, S., Hanada, N., Saso, H., Kobayashi, R. and Hung, M.C. (2004) IkappaB kinase promotes tumorigenesis through inhibition of forkhead FOXO3a. Cell, 117, 225-237. Huang, H., Regan, K.M., Lou, Z., Chen, J. and Tindall, D.J. (2006) CDK2-dependent phosphorylation of FOXO1 as an apoptotic response to DNA damage. Science, 314, 294-297. Huelsken, J., Vogel, R., Brinkmann, V., Erdmann, B., Birchmeier, C. and Birchmeier, W. (2000) Requirement for beta-catenin in anterior-posterior axis formation in mice. J Cell Biol, 148, 567-578. Hunter, T. (2000) Signaling--2000 and beyond. Cell, 100, 113-127. 105 LITERATURVERZEICHNIS Imaizumi, K., Tsuda, M., Wanaka, A., Tohyama, M. and Takagi, T. (1994) Differential expression of sgk mRNA, a member of the Ser/Thr protein kinase gene family, in rat brain after CNS injury. Brain Res Mol Brain Res, 26, 189-196. Jacobs, F.M., van der Heide, L.P., Wijchers, P.J., Burbach, J.P., Hoekman, M.F. and Smidt, M.P. (2003) FoxO6, a novel member of the FoxO class of transcription factors with distinct shuttling dynamics. J Biol Chem, 278, 35959-35967. Jho, E.H., Zhang, T., Domon, C., Joo, C.K., Freund, J.N. and Costantini, F. (2002) Wnt/betacatenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Mol Cell Biol, 22, 1172-1183. Kamynina, E. and Staub, O. (2002) Concerted action of ENaC, Nedd4-2, and Sgk1 in transepithelial Na(+) transport. Am J Physiol Renal Physiol, 283, F377-387. Karin, M. and Hunter, T. (1995) Transcriptional control by protein phosphorylation: signal transmission from the cell surface to the nucleus. Curr Biol, 5, 747-757. Kim, P.J., Plescia, J., Clevers, H., Fearon, E.R. and Altieri, D.C. (2003) Survivin and molecular pathogenesis of colorectal cancer. Lancet, 362, 205-209. Kinzler, K.W., Bigner, S.H., Bigner, D.D., Trent, J.M., Law, M.L., O'Brien, S.J., Wong, A.J. and Vogelstein, B. (1987) Identification of an amplified, highly expressed gene in a human glioma. Science, 236, 70-73. Kinzler, K.W. and Vogelstein, B. (1996) Lessons from hereditary colorectal cancer. Cell, 87, 159-170. Kleivi, K., Lind, G.E., Diep, C.B., Meling, G.I., Brandal, L.T., Nesland, J.M., Myklebost, O., Rognum, T.O., Giercksky, K.E., Skotheim, R.I. and Lothe, R.A. (2007) Gene expression profiles of primary colorectal carcinomas, liver metastases, and carcinomatoses. Mol Cancer, 6, 2. Kobayashi, Y., Furukawa-Hibi, Y., Chen, C., Horio, Y., Isobe, K., Ikeda, K. and Motoyama, N. (2005) SIRT1 is critical regulator of FOXO-mediated transcription in response to oxidative stress. Int J Mol Med, 16, 237-243. Kops, G.J., de Ruiter, N.D., De Vries-Smits, A.M., Powell, D.R., Bos, J.L. and Burgering, B.M. (1999) Direct control of the Forkhead transcription factor AFX by protein kinase B. Nature, 398, 630-634. Krieghoff, E., Behrens, J. and Mayr, B. (2006) Nucleo-cytoplasmic distribution of betacatenin is regulated by retention. J Cell Sci, 119, 1453-1463. Kuhl, M., Sheldahl, L.C., Park, M., Miller, J.R. and Moon, R.T. (2000) The Wnt/Ca2+ pathway: a new vertebrate Wnt signaling pathway takes shape. Trends Genet, 16, 279283. Kunzelmann, K. (2005) Ion channels and cancer. J Membr Biol, 205, 159-173. Kuphal, F. and Behrens, J. (2006) E-cadherin modulates Wnt-dependent transcription in colorectal cancer cells but does not alter Wnt-independent gene expression in fibroblasts. Exp Cell Res, 312, 457-467. Labbe, E., Lock, L., Letamendia, A., Gorska, A.E., Gryfe, R., Gallinger, S., Moses, H.L. and Attisano, L. (2007) Transcriptional cooperation between the transforming growth factor-beta and Wnt pathways in mammary and intestinal tumorigenesis. Cancer Res, 67, 75-84. Laniado, M.E., Fraser, S.P. and Djamgoz, M.B. (2001) Voltage-gated K(+) channel activity in human prostate cancer cell lines of markedly different metastatic potential: distinguishing characteristics of PC-3 and LNCaP cells. Prostate, 46, 262-274. Larabell, C.A., Torres, M., Rowning, B.A., Yost, C., Miller, J.R., Wu, M., Kimelman, D. and Moon, R.T. (1997) Establishment of the dorso-ventral axis in Xenopus embryos is presaged by early asymmetries in beta-catenin that are modulated by the Wnt signaling pathway. J Cell Biol, 136, 1123-1136. 106 LITERATURVERZEICHNIS Lin, K., Dorman, J.B., Rodan, A. and Kenyon, C. (1997) daf-16: An HNF-3/forkhead family member that can function to double the life-span of Caenorhabditis elegans. Science, 278, 1319-1322. Liu, C., Li, Y., Semenov, M., Han, C., Baeg, G.H., Tan, Y., Zhang, Z., Lin, X. and He, X. (2002) Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell, 108, 837-847. Liu, D., Yang, X. and Songyang, Z. (2000) Identification of CISK, a new member of the SGK kinase family that promotes IL-3-dependent survival. Curr Biol, 10, 1233-1236. Lustig, B. and Behrens, J. (2003) The Wnt signaling pathway and its role in tumor development. J Cancer Res Clin Oncol, 129, 199-221. Lustig, B., Jerchow, B., Sachs, M., Weiler, S., Pietsch, T., Karsten, U., van de Wetering, M., Clevers, H., Schlag, P.M., Birchmeier, W. and Behrens, J. (2002) Negative feedback loop of Wnt signaling through upregulation of conductin/axin2 in colorectal and liver tumors. Mol Cell Biol, 22, 1184-1193. Maiyar, A.C., Phu, P.T., Huang, A.J. and Firestone, G.L. (1997) Repression of glucocorticoid receptor transactivation and DNA binding of a glucocorticoid response element within the serum/glucocorticoid-inducible protein kinase (sgk) gene promoter by the p53 tumor suppressor protein. Mol Endocrinol, 11, 312-329. Marchenko, G.N., Marchenko, N.D., Leng, J. and Strongin, A.Y. (2002) Promoter characterization of the novel human matrix metalloproteinase-26 gene: regulation by the T-cell factor-4 implies specific expression of the gene in cancer cells of epithelial origin. Biochem J, 363, 253-262. Medema, R.H., Kops, G.J., Bos, J.L. and Burgering, B.M. (2000) AFX-like Forkhead transcription factors mediate cell-cycle regulation by Ras and PKB through p27kip1. Nature, 404, 782-787. Mikosz, C.A., Brickley, D.R., Sharkey, M.S., Moran, T.W. and Conzen, S.D. (2001) Glucocorticoid receptor-mediated protection from apoptosis is associated with induction of the serine/threonine survival kinase gene, sgk-1. J Biol Chem, 276, 16649-16654. Mizuno, H. and Nishida, E. (2001) The ERK MAP kinase pathway mediates induction of SGK (serum- and glucocorticoid-inducible kinase) by growth factors. Genes Cells, 6, 261-268. Montcouquiol, M., Crenshaw, E.B., 3rd and Kelley, M.W. (2006) Noncanonical Wnt signaling and neural polarity. Annu Rev Neurosci, 29, 363-386. Monteith, G.R., McAndrew, D., Faddy, H.M. and Roberts-Thomson, S.J. (2007) Calcium and cancer: targeting Ca2+ transport. Nat Rev Cancer, 7, 519-530. Moon, R.T. and Kimelman, D. (1998) From cortical rotation to organizer gene expression: toward a molecular explanation of axis specification in Xenopus. Bioessays, 20, 536545. Moriguchi, T., Kawachi, K., Kamakura, S., Masuyama, N., Yamanaka, H., Matsumoto, K., Kikuchi, A. and Nishida, E. (1999) Distinct domains of mouse dishevelled are responsible for the c-Jun N-terminal kinase/stress-activated protein kinase activation and the axis formation in vertebrates. J Biol Chem, 274, 30957-30962. Morin, P.J., Sparks, A.B., Korinek, V., Barker, N., Clevers, H., Vogelstein, B. and Kinzler, K.W. (1997) Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC. Science, 275, 1787-1790. Motta, M.C., Divecha, N., Lemieux, M., Kamel, C., Chen, D., Gu, W., Bultsma, Y., McBurney, M. and Guarente, L. (2004) Mammalian SIRT1 represses forkhead transcription factors. Cell, 116, 551-563. 107 LITERATURVERZEICHNIS Myatt, S.S. and Lam, E.W. (2007) The emerging roles of forkhead box (Fox) proteins in cancer. Nat Rev Cancer, 7, 847-859. Naishiro, Y., Yamada, T., Idogawa, M., Honda, K., Takada, M., Kondo, T., Imai, K. and Hirohashi, S. (2005) Morphological and transcriptional responses of untransformed intestinal epithelial cells to an oncogenic beta-catenin protein. Oncogene, 24, 31413153. Nakamura, N., Ramaswamy, S., Vazquez, F., Signoretti, S., Loda, M. and Sellers, W.R. (2000) Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Mol Cell Biol, 20, 8969-8982. Naray-Fejes-Toth, A., Canessa, C., Cleaveland, E.S., Aldrich, G. and Fejes-Toth, G. (1999) sgk is an aldosterone-induced kinase in the renal collecting duct. Effects on epithelial na+ channels. J Biol Chem, 274, 16973-16978. Naray-Fejes-Toth, A., Helms, M.N., Stokes, J.B. and Fejes-Toth, G. (2004) Regulation of sodium transport in mammalian collecting duct cells by aldosterone-induced kinase, SGK1: structure/function studies. Mol Cell Endocrinol, 217, 197-202. Nasrin, N., Ogg, S., Cahill, C.M., Biggs, W., Nui, S., Dore, J., Calvo, D., Shi, Y., Ruvkun, G. and Alexander-Bridges, M.C. (2000) DAF-16 recruits the CREB-binding protein coactivator complex to the insulin-like growth factor binding protein 1 promoter in HepG2 cells. Proc Natl Acad Sci U S A, 97, 10412-10417. Nathke, I. (2004a) APC at a glance. J Cell Sci, 117, 4873-4875. Nathke, I.S. (2004b) The adenomatous polyposis coli protein: the Achilles heel of the gut epithelium. Annu Rev Cell Dev Biol, 20, 337-366. O'Connor, L., Strasser, A., O'Reilly, L.A., Hausmann, G., Adams, J.M., Cory, S. and Huang, D.C. (1998) Bim: a novel member of the Bcl-2 family that promotes apoptosis. Embo J, 17, 384-395. Ogg, S., Paradis, S., Gottlieb, S., Patterson, G.I., Lee, L., Tissenbaum, H.A. and Ruvkun, G. (1997) The Fork head transcription factor DAF-16 transduces insulin-like metabolic and longevity signals in C. elegans. Nature, 389, 994-999. Oliva, E., Sarrio, D., Brachtel, E.F., Sanchez-Estevez, C., Soslow, R.A., Moreno-Bueno, G. and Palacios, J. (2006) High frequency of beta-catenin mutations in borderline endometrioid tumours of the ovary. J Pathol, 208, 708-713. Ozawa, M., Baribault, H. and Kemler, R. (1989) The cytoplasmic domain of the cell adhesion molecule uvomorulin associates with three independent proteins structurally related in different species. Embo J, 8, 1711-1717. Pardal, R., Clarke, M.F. and Morrison, S.J. (2003) Applying the principles of stem-cell biology to cancer. Nat Rev Cancer, 3, 895-902. Park, J., Leong, M.L., Buse, P., Maiyar, A.C., Firestone, G.L. and Hemmings, B.A. (1999) Serum and glucocorticoid-inducible kinase (SGK) is a target of the PI 3-kinasestimulated signaling pathway. Embo J, 18, 3024-3033. Parry, P., Wei, Y. and Evans, G. (1994) Cloning and characterization of the t(X;11) breakpoint from a leukemic cell line identify a new member of the forkhead gene family. Genes Chromosomes Cancer, 11, 79-84. Pearce, D. (2001) The role of SGK1 in hormone-regulated sodium transport. Trends Endocrinol Metab, 12, 341-347. Pearce, D. (2003) SGK1 regulation of epithelial sodium transport. Cell Physiol Biochem, 13, 13-20. Pinkston, J.M., Garigan, D., Hansen, M. and Kenyon, C. (2006) Mutations that increase the life span of C. elegans inhibit tumor growth. Science, 313, 971-975. Pinson, K.I., Brennan, J., Monkley, S., Avery, B.J. and Skarnes, W.C. (2000) An LDLreceptor-related protein mediates Wnt signalling in mice. Nature, 407, 535-538. 108 LITERATURVERZEICHNIS Polakis, P. (2000) Wnt signaling and cancer. Genes Dev, 14, 1837-1851. Popperl, H., Schmidt, C., Wilson, V., Hume, C.R., Dodd, J., Krumlauf, R. and Beddington, R.S. (1997) Misexpression of Cwnt8C in the mouse induces an ectopic embryonic axis and causes a truncation of the anterior neuroectoderm. Development, 124, 2997-3005. Powell, S.M. (2002) Direct analysis for familial adenomatous polyposis mutations. Mol Biotechnol, 20, 197-207. Preussat, K., Beetz, C., Schrey, M., Kraft, R., Wolfl, S., Kalff, R. and Patt, S. (2003) Expression of voltage-gated potassium channels Kv1.3 and Kv1.5 in human gliomas. Neurosci Lett, 346, 33-36. Prevarskaya, N., Skryma, R., Bidaux, G., Flourakis, M. and Shuba, Y. (2007a) Ion channels in death and differentiation of prostate cancer cells. Cell Death Differ, 14, 1295-1304. Prevarskaya, N., Zhang, L. and Barritt, G. (2007b) TRP channels in cancer. Biochim Biophys Acta, 1772, 937-946. Radtke, F. and Clevers, H. (2005) Self-renewal and cancer of the gut: two sides of a coin. Science, 307, 1904-1909. Rena, G., Prescott, A.R., Guo, S., Cohen, P. and Unterman, T.G. (2001) Roles of the forkhead in rhabdomyosarcoma (FKHR) phosphorylation sites in regulating 14-3-3 binding, transactivation and nuclear targetting. Biochem J, 354, 605-612. Reya, T., Duncan, A.W., Ailles, L., Domen, J., Scherer, D.C., Willert, K., Hintz, L., Nusse, R. and Weissman, I.L. (2003) A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature, 423, 409-414. Roberts, A.B., Tian, F., Byfield, S.D., Stuelten, C., Ooshima, A., Saika, S. and Flanders, K.C. (2006) Smad3 is key to TGF-beta-mediated epithelial-to-mesenchymal transition, fibrosis, tumor suppression and metastasis. Cytokine Growth Factor Rev, 17, 19-27. Roose, J. and Clevers, H. (1999) TCF transcription factors: molecular switches in carcinogenesis. Biochim Biophys Acta, 1424, M23-37. Rubinfeld, B., Albert, I., Porfiri, E., Fiol, C., Munemitsu, S. and Polakis, P. (1996) Binding of GSK3beta to the APC-beta-catenin complex and regulation of complex assembly. Science, 272, 1023-1026. Samuels, Y., Diaz, L.A., Jr., Schmidt-Kittler, O., Cummins, J.M., Delong, L., Cheong, I., Rago, C., Huso, D.L., Lengauer, C., Kinzler, K.W., Vogelstein, B. and Velculescu, V.E. (2005) Mutant PIK3CA promotes cell growth and invasion of human cancer cells. Cancer Cell, 7, 561-573. Seidensticker, M.J. and Behrens, J. (2000) Biochemical interactions in the wnt pathway. Biochim Biophys Acta, 1495, 168-182. Shibata, H., Toyama, K., Shioya, H., Ito, M., Hirota, M., Hasegawa, S., Matsumoto, H., Takano, H., Akiyama, T., Toyoshima, K., Kanamaru, R., Kanegae, Y., Saito, I., Nakamura, Y., Shiba, K. and Noda, T. (1997) Rapid colorectal adenoma formation initiated by conditional targeting of the Apc gene. Science, 278, 120-123. Shigaev, A., Asher, C., Latter, H., Garty, H. and Reuveny, E. (2000) Regulation of sgk by aldosterone and its effects on the epithelial Na(+) channel. Am J Physiol Renal Physiol, 278, F613-619. Simmons, D.L., Neel, B.G., Stevens, R., Evett, G. and Erikson, R.L. (1992) Identification of an early-growth-response gene encoding a novel putative protein kinase. Mol Cell Biol, 12, 4164-4169. Sparks, A.B., Morin, P.J., Vogelstein, B. and Kinzler, K.W. (1998) Mutational analysis of the APC/beta-catenin/Tcf pathway in colorectal cancer. Cancer Res, 58, 1130-1134. Stahl, M., Dijkers, P.F., Kops, G.J., Lens, S.M., Coffer, P.J., Burgering, B.M. and Medema, R.H. (2002) The forkhead transcription factor FoxO regulates transcription of p27Kip1 and Bim in response to IL-2. J Immunol, 168, 5024-5031. 109 LITERATURVERZEICHNIS Stratford-Perricaudet, L.D., Makeh, I., Perricaudet, M. and Briand, P. (1992) Widespread long-term gene transfer to mouse skeletal muscles and heart. J Clin Invest, 90, 626630. Strutt, D. (2003) Frizzled signalling and cell polarisation in Drosophila and vertebrates. Development, 130, 4501-4513. Sun, Y., Taniguchi, R., Tanoue, D., Yamaji, T., Takematsu, H., Mori, K., Fujita, T., Kawasaki, T. and Kozutsumi, Y. (2000) Sli2 (Ypk1), a homologue of mammalian protein kinase SGK, is a downstream kinase in the sphingolipid-mediated signaling pathway of yeast. Mol Cell Biol, 20, 4411-4419. Takaishi, H., Konishi, H., Matsuzaki, H., Ono, Y., Shirai, Y., Saito, N., Kitamura, T., Ogawa, W., Kasuga, M., Kikkawa, U. and Nishizuka, Y. (1999) Regulation of nuclear translocation of forkhead transcription factor AFX by protein kinase B. Proc Natl Acad Sci U S A, 96, 11836-11841. Tamai, K., Semenov, M., Kato, Y., Spokony, R., Liu, C., Katsuyama, Y., Hess, F., SaintJeannet, J.P. and He, X. (2000) LDL-receptor-related proteins in Wnt signal transduction. Nature, 407, 530-535. Tapia, J.C., Torres, V.A., Rodriguez, D.A., Leyton, L. and Quest, A.F. (2006) Casein kinase 2 (CK2) increases survivin expression via enhanced beta-catenin-T cell factor/lymphoid enhancer binding factor-dependent transcription. Proc Natl Acad Sci U S A, 103, 15079-15084. Tetsu, O. and McCormick, F. (1999) Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature, 398, 422-426. Torres, V.A., Tapia, J.C., Rodriguez, D.A., Parraga, M., Lisboa, P., Montoya, M., Leyton, L. and Quest, A.F. (2006) Caveolin-1 controls cell proliferation and cell death by suppressing expression of the inhibitor of apoptosis protein survivin. J Cell Sci, 119, 1812-1823. Toyoshima, H. and Hunter, T. (1994) p27, a novel inhibitor of G1 cyclin-Cdk protein kinase activity, is related to p21. Cell, 78, 67-74. Tran, H., Brunet, A., Griffith, E.C. and Greenberg, M.E. (2003) The many forks in FOXO's road. Sci STKE, 2003, RE5. van de Wetering, M., Cavallo, R., Dooijes, D., van Beest, M., van Es, J., Loureiro, J., Ypma, A., Hursh, D., Jones, T., Bejsovec, A., Peifer, M., Mortin, M. and Clevers, H. (1997) Armadillo coactivates transcription driven by the product of the Drosophila segment polarity gene dTCF. Cell, 88, 789-799. van de Wetering, M., Sancho, E., Verweij, C., de Lau, W., Oving, I., Hurlstone, A., van der Horn, K., Batlle, E., Coudreuse, D., Haramis, A.P., Tjon-Pon-Fong, M., Moerer, P., van den Born, M., Soete, G., Pals, S., Eilers, M., Medema, R. and Clevers, H. (2002) The beta-catenin/TCF-4 complex imposes a crypt progenitor phenotype on colorectal cancer cells. Cell, 111, 241-250. Van Der Heide, L.P., Hoekman, M.F. and Smidt, M.P. (2004) The ins and outs of FoxO shuttling: mechanisms of FoxO translocation and transcriptional regulation. Biochem J, 380, 297-309. van der Heide, L.P., Jacobs, F.M., Burbach, J.P., Hoekman, M.F. and Smidt, M.P. (2005) FoxO6 transcriptional activity is regulated by Thr26 and Ser184, independent of nucleo-cytoplasmic shuttling. Biochem J, 391, 623-629. van der Horst, A., de Vries-Smits, A.M., Brenkman, A.B., van Triest, M.H., van den Broek, N., Colland, F., Maurice, M.M. and Burgering, B.M. (2006) FOXO4 transcriptional activity is regulated by monoubiquitination and USP7/HAUSP. Nat Cell Biol, 8, 10641073. 110 LITERATURVERZEICHNIS van der Horst, A., Tertoolen, L.G., de Vries-Smits, L.M., Frye, R.A., Medema, R.H. and Burgering, B.M. (2004) FOXO4 is acetylated upon peroxide stress and deacetylated by the longevity protein hSir2(SIRT1). J Biol Chem, 279, 28873-28879. Wagner, A.J., Kokontis, J.M. and Hay, N. (1994) Myc-mediated apoptosis requires wild-type p53 in a manner independent of cell cycle arrest and the ability of p53 to induce p21waf1/cip1. Genes Dev, 8, 2817-2830. Waldegger, S., Barth, P., Raber, G. and Lang, F. (1997) Cloning and characterization of a putative human serine/threonine protein kinase transcriptionally modified during anisotonic and isotonic alterations of cell volume. Proc Natl Acad Sci U S A, 94, 44404445. Webster, M.K., Goya, L. and Firestone, G.L. (1993a) Immediate-early transcriptional regulation and rapid mRNA turnover of a putative serine/threonine protein kinase. J Biol Chem, 268, 11482-11485. Webster, M.K., Goya, L., Ge, Y., Maiyar, A.C. and Firestone, G.L. (1993b) Characterization of sgk, a novel member of the serine/threonine protein kinase gene family which is transcriptionally induced by glucocorticoids and serum. Mol Cell Biol, 13, 2031-2040. Willert, J., Epping, M., Pollack, J.R., Brown, P.O. and Nusse, R. (2002) A transcriptional response to Wnt protein in human embryonic carcinoma cells. BMC Dev Biol, 2, 8. Willert, K., Brown, J.D., Danenberg, E., Duncan, A.W., Weissman, I.L., Reya, T., Yates, J.R., 3rd and Nusse, R. (2003) Wnt proteins are lipid-modified and can act as stem cell growth factors. Nature, 423, 448-452. Woods, Y.L., Rena, G., Morrice, N., Barthel, A., Becker, W., Guo, S., Unterman, T.G. and Cohen, P. (2001) The kinase DYRK1A phosphorylates the transcription factor FKHR at Ser329 in vitro, a novel in vivo phosphorylation site. Biochem J, 355, 597-607. Xu, J., Liu, D., Gill, G. and Songyang, Z. (2001) Regulation of cytokine-independent survival kinase (CISK) by the Phox homology domain and phosphoinositides. J Cell Biol, 154, 699-705. Yamanaka, H., Moriguchi, T., Masuyama, N., Kusakabe, M., Hanafusa, H., Takada, R., Takada, S. and Nishida, E. (2002) JNK functions in the non-canonical Wnt pathway to regulate convergent extension movements in vertebrates. EMBO Rep, 3, 69-75. Zeng, L., Fagotto, F., Zhang, T., Hsu, W., Vasicek, T.J., Perry, W.L., 3rd, Lee, J.J., Tilghman, S.M., Gumbiner, B.M. and Costantini, F. (1997) The mouse Fused locus encodes Axin, an inhibitor of the Wnt signaling pathway that regulates embryonic axis formation. Cell, 90, 181-192. Zhang, B.H., Tang, E.D., Zhu, T., Greenberg, M.E., Vojtek, A.B. and Guan, K.L. (2001a) Serum- and glucocorticoid-inducible kinase SGK phosphorylates and negatively regulates B-Raf. J Biol Chem, 276, 31620-31626. Zhang, T., Otevrel, T., Gao, Z., Ehrlich, S.M., Fields, J.Z. and Boman, B.M. (2001b) Evidence that APC regulates survivin expression: a possible mechanism contributing to the stem cell origin of colon cancer. Cancer Res, 61, 8664-8667. Ziegler, S., Rohrs, S., Tickenbrock, L., Moroy, T., Klein-Hitpass, L., Vetter, I.R. and Muller, O. (2005) Novel target genes of the Wnt pathway and statistical insights into Wnt target promoter regulation. Febs J, 272, 1600-1615. 111 Lebenslauf Persönliche Daten: Name: Manuel Dehner Geburtsdatum: 12. Dezember 1976 Geburtsort: Rothenburg ob der Tauber Staatsangehörigkeit: deutsch Familienstand: ledig Schulausbildung: 1983-1987: Grund- und Volksschule Uffenheim 1987-1997: Christian-von-Bomhard Gymnasium Uffenheim Abschluss: Abitur Hochschulausbildung: 11/1998-03/2003: Studium der Biologie an der Friedrich-Alexander-Universität Erlangen-Nürnberg Hauptfach: Mikrobiologie Nebenfächer: Virologie, organische Chemie, Botanik Diplomarbeit am Institut für Mikrobiologie, Biochemie und Genetik mit dem Thema: „Konstruktion und Charakterisierung von TetR-Transrepressoren“ (Betreuer. Prof. Dr. W. Hillen) Abschluss: Diplom-Biologe Berufstätigkeit: seit 05/2003: Beschäftigung am Lehrstuhl für Experimentelle Medizin II der Friedrich-Alexander-Universität Erlangen-Nürnberg als wissenschaftlicher Mitarbeiter (Doktorand) 112 Vielen Dank an -Prof. Dr. Jürgen Behrens für die Betreuung dieser Arbeit, die Möglichkeit in seinem Labor unter sehr guten Bedingungen an einem spannenden Thema arbeiten zu dürfen, sowie seine Begeisterung für die Wissenschaft und stetige Bereitschaft zu Diskussionen, die mich und diese Arbeit weit vorangebracht haben. -PD Dr. Robert Slany für die Übernahme des Zweitgutachtens. -Prof. Dr. Christian Koch für seine Bemühungen als Zweitprüfer. -Dr. Ludger Klein-Hitpass und sein Team für die Durchführung der Micro-Arrays, sowie seine Hilfe bei der Datenanlyse. -Dr. Bernhard Mayr und Dr. Martin Sachs für Computer-technische Unterstützung, sowie diverse Plasmide. -Eva für sehr viele wissenschaftliche und nicht wissenschaftliche Diskussionen, den gemeinsamen Gängen zur Palmeria und ein sehr angenehmes Nebeneinander an der Bench. -Martina für sehr viele Tipps und Tricks im Laboralltag, gute Unterhaltungen und ihre fachkompetenten Sportanalysen, die mir teilweise viel Angst eingejagt haben ;) „Griechenland wird Europameister!“ – Aussage vor dem Achtelfinale EM 2004. -Ingrid Wacker und Volker Stemmer für ihre Unterstützung während der ganzen Zeit und ihre vielen inhaltlichen und technischen Ratschläge beim Verfassen dieser Arbeit, das hat mir sehr weitergeholfen. -Michel Hadjihannas, Kristina Tanneberger, Shree Harsha Vijaya, Sandra Mattauch, Astrid Alzner für ihr wissenschaftliches Feedback und der Hilfe bei so manchen Problemen. -Gabi Daum, Birgit Saffer, Eugenia Schefler und Martina Brückner für die technische Assistenz. -Angela Döbler für ihre Hilfe bei bürokratischen Angelegenheiten und der Organisation von Dingen, mit denen man sich nicht so auskennt. -alle ehemaligen Mitarbeiter der Experimentellen Medizin II: Felix Kuphal, Eva Krieghoff, Dr. Martin Reichel, Annette Grohmann und Katja Bauer. -meine Eltern und meine Geschwister für ihre fortwährende bedingungslose und nicht selbstverständliche Unterstützung in jedweder Hinsicht. Corinna. Für alles was du mir gibst! 113