Erwartungshorizont Chemie-Klausur Galvanische Elemente 1
Werbung

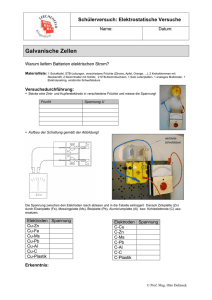
Erwartungshorizont Chemie-Klausur I. Galvanische Elemente 1) Skizze siehe Buch, mit Beschreibung, Angabe von Anode und Kathode (Plus- und Minuspol), zu erwartende Spannung 1,5 V. Reaktionsgleichung: Zn → MnO2 + H2O + e → Zn2+ + 2 eMnO(OH) + OH- Nachteile: Der Zinkbecher wird bei Gebrauch teilweise zersetzt, außerdem entsteht durch Alterung aus Zinkhydroxid Zinkoxid und Wasser, so dass diese Batterie auslaufen kann. Ein weiterer Nachteil ist die geringe Dauerbelastbarkeit. 2) Entwicklung der Alkaline, durch Änderung des Elektrolyten (KOH statt ZnCl2) nicht mehr die Gefahr des Auslaufens. Entwicklung der Lithium-Mangan-Batterie: sehr hohe Zellspannung, lange Lebensdauer, sehr geringe Baugröße. 3) Zn → Zn2+ + 2 eO2 + 2 H2O + 4 e → 4 OHErwartete Spannung: 1,55 V II. Brennstoffzelle, Blei-Akku 1) Brennstoffzelle Eine Brennstoffzelle besteht aus Elektroden, die durch eine Membran oder Elektrolyt (Ionenleiter) voneinander getrennt sind.Die Elektrodenplatten/Bipolarplatten bestehen meist aus Metall- oder Kohlenstoffnanoröhren. Sie sind mit einem Katalysator beschichtet, zum Beispiel mit Platin oder mit Palladium. Als Elektrolyten können beispielsweise gelöste Laugen oder Säuren dienen.Die Energie liefert eine Reaktion von Sauerstoff mit dem Brennstoff, der Wasserstoff sein kann, jedoch ebenso aus organischen Verbindungen wie z.B. Methan und Methanol bestehen kann. Beide Reaktionspartner werden über die Elektroden kontinuierlich zugeführt. Die gelieferte Spannung liegt theoretisch bei 1,23 V für die Wasserstoff-Sauerstoff-Zelle bei einer Temperatur von 25 °C. In der Praxis werden jedoch nur Spannungen von 0,5–1 V (experimentell auch darüber) erreicht. Die Spannung ist vom Brennstoff, von der Qualität der Zelle und von der Temperatur abhängig. Wichtig: Eine BSZ ist keine Spannungsquelle, sondern nur ein Energiewandler, da die Brennstoffe zugeführt werden müssen. 2) Sauerstoff wird durch die Glimmspanprobe nachgewiesen, Wasserstoff über die Knallgasprobe. 3) Blei-Akku Im Prinzip besteht der Bleiakkumulator aus einer Blei- und einer Bleidioxidelektrode und verdünnter Schwefelsäure (ca. 30%ig) als Elektrolyt. An den Elektroden treten folgende Reaktionen ein: Pb+SO42-⇌PbSO4+2e− E=−0,365V PbO2+4H++SO42−+2e−⇌PbSO4+2H2O E=1,68V Pb+PbO2+2H2SO4⇌ 2PbSO4+2H2O E≈2V Diese Reaktionen laufen beim Laden von rechts nach links ab. Die Elektroden bestehen zur Begünstigung der heterogenen Reaktionen aus Blei- bzw. Bleidioxidschwamm mit großer Oberfläche. Das gebildete Bleisulfat ist schwerlöslich; es setzt sich im Laufe der Entladung auf den Elektroden ab. Die Reaktionsgleichung zeigt, dass die Konzentration der Schwefelsäure im Verlauf der Entladung abnimmt. Man kann deshalb den Ladezustand der Batterie durch aräometrische Dichtemessung (Spindeln) kontrollieren. 4) Vorteile der Brennstoffzelle: umweltfreundlich, Wasserstoff kann aus Wasser gewonnen werden, Abgas ist Wasser, wenn der Wasserstoff regenerativ gespalten wird Photovoltaik, Windenergie), ist dieser Energieträger nahezu emmisionsfrei. Nachteile: sehr teuer, Risiko Wasserstoff. Vorteile Bleiakku: äußerst robust, aufgrund langer Entwicklung ausgereifte Technik, sehr hohe Regenerationsphasen, relativ günstig Nachteile: sehr schwer, Blei und Bleiverbindungen sind giftig, die Schwefelsäure ist kontaminiert, muss sonderentsorgt werden. Neuentwicklungen sind der Lithium-Ionen-Akku bzw. der Lithium-Polymer-Akku, die keinen Memoryeffekt mehr aufweisen, leicht und kompakt gebaut werden können. III. Korrosion 1) Feuerverzinken ist das Aufbringen eines metallischen Zinküberzugs auf Eisen oder Stahl durch Eintauchen in geschmolzenes Zink (bei ca. 450 °C). Dabei bildet sich an der Berührungsfläche eine widerstandsfähige Legierungsschicht aus Eisen und Zink und darüber eine sehr fest haftende reine Zinkschicht. Feuerverzinken ist eine von mehreren Methoden, um zu verzinken. Galvanisches Verzinken: Die Werkstücke werden nicht in eine Zinkschmelze, sondern in einen Zinkelektrolyten eingetaucht, dabei wird das zu verzinkende Werkstück als Kathode in die Lösung gehängt. Als Anode benutzt man eine Elektrode aus Überzugsmetall oder eine unlösbare Elektrode. Beim galvanischen Verzinken ist der Zinkverbrauch sparsam, wobei – unabhängig von der Werkstückgeometrie – sehr gleichmäßige Schutzschichten entstehen (Skizze siehe Heft). 2) Sauerstoffkorrosion Der Eiseneimer würde korrodieren, da allerdings der entstehende Rost nicht luftdicht ist, kommt es zum Lochfraß bis hin zu irreparablen Schäden. Fe O2 + 2 H2O + 4 eFe2+ + 2 OH4 Fe(OH)2 + O2 → → → → Fe2+ + 2 e4 OHFe(OH)2 4 FeO(OH) + 2 H2O 3) Verzinkung versus Verchromung Die Verzinkung ist kostengünstiger und schützt vor allem auch bei Oberflächenschäden vor Korrosion, da es in einem solchen Fall zu einem kurzgeschlossenen Lokalelement mit Zink als unedlerem Metall kommt. Das Zink würde so als Opferanode dienen und den Eimer über längere Zeit vor Korrosion schützen. Im Falle von Chrom würde genau das Gegenteil passieren, Chrom ist das edlere Metall und somit würde das Eisen die Opferanode darstellen. 4) Korrosionsschutz bei Pipelines Eine Möglichkeit für den kathodischen Korrosionsschutz – kurz KKS – kann mittels Fremdstrom und Fremdstrom-Anoden erreicht werden. Bei Erdöl-Pipelines werden dazu z. B. in Abständen von einigen Kilometern in einigen hundert Metern Abstand von der Leitung Elektroden im Boden versenkt, die mit einer Gegenspannung gespeist werden. Der andere Pol liegt an der Pipeline, so dass dieses Spannungsgefälle genau das galvanische Element aus Boden und Metallleitung ausgleicht, was sich konkret in der Größenordnung von wenigen Volt bewegt. Da dies von der chemischen Zusammensetzung des Bodens abhängt, muss dieser untersucht werden und die eingespeiste Gegenspannung an die örtlichen Gegebenheiten angepasst werden.