C 1
Werbung
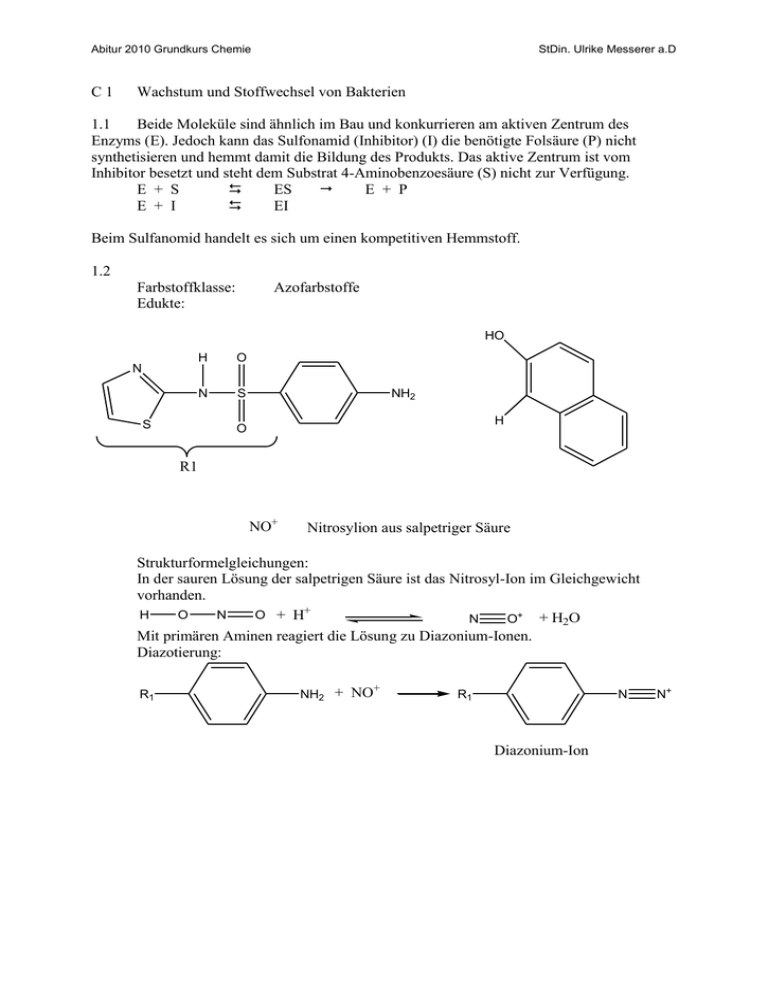
Abitur 2010 Grundkurs Chemie C1 StDin. Ulrike Messerer a.D Wachstum und Stoffwechsel von Bakterien 1.1 Beide Moleküle sind ähnlich im Bau und konkurrieren am aktiven Zentrum des Enzyms (E). Jedoch kann das Sulfonamid (Inhibitor) (I) die benötigte Folsäure (P) nicht synthetisieren und hemmt damit die Bildung des Produkts. Das aktive Zentrum ist vom Inhibitor besetzt und steht dem Substrat 4-Aminobenzoesäure (S) nicht zur Verfügung. E + S ES E + P E + I EI Beim Sulfanomid handelt es sich um einen kompetitiven Hemmstoff. 1.2 Farbstoffklasse: Edukte: Azofarbstoffe HO N S H O N S NH2 H O R1 NO+ Nitrosylion aus salpetriger Säure Strukturformelgleichungen: In der sauren Lösung der salpetrigen Säure ist das Nitrosyl-Ion im Gleichgewicht vorhanden. H O N O + H+ N O+ + H2O Mit primären Aminen reagiert die Lösung zu Diazonium-Ionen. Diazotierung: R1 + NH2 + NO R1 N Diazonium-Ion N+ Abitur 2010 Grundkurs Chemie StDin. Ulrike Messerer a.D Kupplungsreaktion: HO R1 N+ N +H H R1 N + H+ N Azo-Verbindung 2.1 Aus einem Molekül Ethanol gewinnen die Bakterien der Gattung Acetobacter entsprechend 2 Mol NADH/H+ 6 ATP Aus einem Molekül Glucose gewinnen die Bakterien der Gattung Clostridium entsprechend 3 Mol NADH/H+ 9 ATP 1 Mol FADH2 2 ATP 1 Mol GTP 1 ATP 12 ATP Beim aeroben Abbau der Hefezelle werden nur die Hälfte ATP pro Mol gewonnen wie beim anaeroben Abbau von Glucose. 2.2 C6H12O6 + 2 NAD+ + 2 ADP + 2 Pi 2 CH3─CO─COOH + 2 NADH/H+ + 2 ATP O H3C C O O + H2O C H - CO2 H3C + H2 C H Brenztraubensäure Ethansäure Bei dem angegebenen gasförmigen Produkt A handelt es sich um Wasserstoff (H2). 3.1 Bei dem Kunststoff handelt es sich um einen Thermoplast. Sie sind bei normalen Temperaturen spröde oder zähelastisch. Sie lassen sich beim langsamen Erwärmen ohne Zersetzung schmelzen und können so geformt, gespritzt oder gepresst werden und erhärten beim Abkühlen wieder zum plastischen Zustand. Sie sind schmelzbar, schweißbar, quellbar und löslich. Abitur 2010 Grundkurs Chemie StDin. Ulrike Messerer a.D 3.2 H O C C H O C C6H13 + OH- C6H13 Polyester H O C C C6H13 OH O H H O C C C C6H13 C6H13 O H + HO C C6H13 Alkohol, Alkanol Carboxylat-Ion Das Carboxylat-Anion wie auch die Hydroxygruppe sind polar und damit hydrophil. Die Reste beider Verbindungen haben einen langen unpolaren Rest, der sich hydrophob bzw. lipophil verhält. Somit können die entstandenen Substanzen grenzflächenaktiv sein.