Leitthema 2: Stoffwechsel & Energiefluss lebender Systeme
Werbung

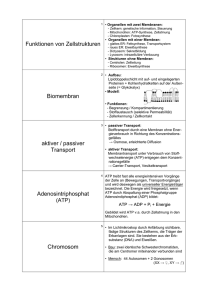
Leitthema 2: Stoffwechsel & Energiefluss lebender Systeme (ergänzt um Baustein „Bioenergetische Grundlagen“ aus dem Leitthema 1) 1. Wichtige Grundbegriffe 1.1 Chemisches Gleichgewicht Bei chemischen Reaktionen laufen meist Hin- und Rückreaktionen gleichzeitig ab. Wenn kein Stoff entnommen wird (geschlossenes System), stellt sich ein Gleichgewicht ein, bei dem Hin- und Rückreaktion mit gleicher Geschwindigkeit ablaufen und alle Stoffe in einer bestimmten Konzentration vorliegen. (Diese kann allerdings sehr unterschiedlich für Produkte und Edukte sein). Entnimmt man jedoch einen Stoff, so läuft die Reaktion immer in Richtung der Nachbildung dieses Stoffes. (Beispiel: Öffnen einer Flasche kohlensäurehaltigen Mineralwassers) 1.2 Energieumsatz Enthalpie = Wärmeänderung; ΔH (negativ = exotherm, positiv=endotherm) Entropie = Wahrscheinlichkeit (=Unordnung); ΔS (negativ=ordentlicher, positiv=unordentlicher) Freie Enthalpie = Gibbs-Enthalpie = Maß für die Triebkraft einer Reaktion Δ G = ΔH –T*ΔS Δ G negativ: Reaktion=exergonisch, d. h. spontan und freiwillig Δ G Positiv: Reaktion=endergonisch, d. h. läuft nur unter Energiezufuhr Δ G = 0: System ist im Gleichgewicht Merke! Auch die Zunahme der Unordnung (mehr Teilchen, anderer Aggregatzustand) kann die Triebkraft einer Reaktion bestimmen. 1.3 ATP als Energieüberträger 1.3.1 Das ATP-Prinzip: Exergonische Reaktionen liefern die Energie, um aus ADP (Adenosindiphosphat) und einem Phosphatrest (Pi) ATP (Adenosintriphosphat) zu bilden. ATP kann in einer exergonischen Reaktion Pi abspalten und somit endergonische Reaktionen ermöglichen. Δ G = -30 kJ/mol 1.3.2 Struktur von ATP, Buch, S. 102: Bausteine: - N-haltige Base: Adenin, - Pentose (Zucker aus 5 C-Atomen): Ribose - Phospatreste: drei bei ATP, zwei bei ADP und einer bei AMP (Adenosintri-, di- monophosphat); Bindung ist energiereich zum Namen: Adenin+Ribose= Adenosin 1.4 Oxidation und Reduktion Oxidation: -Abgabe von Elektronen - Abgabe von Wasserstoff (H, nicht H+), - Aufnahme von Sauerstoff (O) - Erhöhung der Oxidationszahl (H:+I; O: -II; CH3:0) Reduktion: - Aufnahme von Elektronen - Aufnahme von Wasserstoff - Abgabe von Sauerstoff - Erniedrigung der Oxidationszahl Ein gutes Oxidationsmittel nimmt leicht Elektronen auf und oxidiert dadurch andere Stoffe. Es selber wird also selber reduziert. Ein gutes Reduktionsmittel gibt leicht Elektronen ab und reduziert dadurch andere Stoffe. Es wird also selber oxidiert. 1.5 Der pH-Wert Definition: Der pH-Wert ist der negative dekadische Logarithmus des Zahlenwertes der in mol/l angegebenen H30+-Ionenkonzentration. Bsp.: c (H30+) = 10-2 mol/l → pH = 2 Wichtig! Wenn der pH niedrig ist, ist die Konzentration der H30+-Ionen hoch. pH 0-7: sauer, d. h. viele H+ -, bzw. H30+-Ionen pH 7: neutral, d. h. 10-7 mol/l H30+-Ionen pH 7-14: basisch, d. h. wenige H30+-Ionen, unter 10-7 mol/l Lebensvorgänge üblicherweise bei pH 4 bis pH 9 (in Ausnahmefällen bis pH 2) 1.6 Reaktionsgeschwindigkeit Definition: v=Δc/Δt Reaktionsgeschwindigkeit = Konzentrationsänderung durch Zeit Die Reaktionsgeschwindigkeit ist abhängig von: - Temperatur - Katalysator - Konzentration (je höher desto schneller) - Druck (bei Gasen) - Phasengrenzfläche (Je größer desto höhere Geschwindigkeit) 1.6.1 Einfluss der Temperatur: RGT-Regel (van`t Hoffsche Regel) Bei den meisten chemischen Reaktionen bewirkt eine Temperaturerhöhung um 10oC eine Verdopplung der Reaktionsgeschwindigkeit, d. h. eine Halbierung der Reaktionszeit. Der Q10-Wert liegt bei 2. Bei physikalischen Reaktionen liegt der Q10Wert bei 1,3. 1.6.2 Einfluss von Katalysatoren Definition: Ein Katalysator ist eine Substanz, die einen chemischen Vorgang beschleunigt, indem sie die Aktivierungsenergie herabsetzt ohne bei der Reaktion verbraucht zu werden. Merke! Katalysatoren beeinflussen nicht die Lage des Gleichgewichtes (auf Edukteseite oder auf Produkteseite) und nicht die Triebkraft der Reaktion (ΔG) Metastabile Stoffe sind Stoffe, die eigentlich sofort wieder zerfallen müssten, die aber dennoch vorhanden sind, da sehr hohe Aktivierungsenergie notwendig ist um die Zerfallsreaktion in Gang zu bringen. 1.7 Beeinflussung von Gleichgewichten: Prinzip des kleinsten Zwanges (le Chatelier) 1.7.1: Temperaturerhöhung verschiebt in Richtung der endothermen Reaktion Temperaturerniedrigung in Richtung der exothermen Reaktion 1.7.2: Druckerhöhung verschiebt in Richtung des geringeren Volumens (weniger Gasteilchen) 1.7.3: Konzentrationsänderungen verschieben in Richtung der verminderten Seite. Wenn ein in einer Reaktion entstehender Stoff sofort entnommen wird bzw. weiterreagiert, kann es nicht zur Einstellung eines Gleichgewichtes kommen. 2. Enzyme (en, griechisch = in, zyme, gr. = Hefe) (oder Fermente von fermentum, lat. = Sauerteig) 2.1 Definition Enzyme sind Katalysatoren im biochemischen Stoffwechselgeschehen der Zelle (=Biokatalysatoren). Sie sind meist Proteine mit dreidimensionalem Aufbau, die durch Herabsetzung der Aktivierungsenergie eine Reaktion bei der in den Zellen herrschenden Temperatur mit hinreichender Geschwindigkeit ablaufen lassen. 2.2 Nomenklatur und Einteilung der Enzyme 2.2.1 Nomenklatur a) historisch: häufig Endung -in - Pepsin (von gr. peptein= verdauen) : proteinspaltendes Enzym im Magen - Trypsin (von gr. tryptein = verdauen): proteinspaltendes Enzym im Darm b) Nomenklaturregeln seit 1968: allgemein: 1. Substrat (e) = Stoff, an dem angegriffen wird 2. chemischer Vorgang 3. Endung - ase Beispiel: E1 2H2O2 ------> 2 H2O + O2_ E1 = Wasserstoffperoxid-oxidoreduktase , Kurzform: Peroxidase 2.2.2 Einteilung der Enzyme 2.2.2.1 Hauptklassen (nach dem Reaktionstyp, vgl. Cornelsen S. 68) Nr. Hauptklassen Reaktionsschema 1. Oxidoreduktasen katalysieren eine A red + B ox Redoxreaktion 2. Transferasen übertragen A-B +Z 3. Hydrolasen spalten unter H2OEinlagerung 4. Lyasen lösen auf, spalten A-B + 5. Isomerasen stellen um A-B-C A-B-C-D 6. Ligasen verbinden 2.2.2.2 Nebenklassen (1. und 2. Untergruppe): Benennung nach dem Substrat z. B. Glukosidase, Lipase, Protease, Amylase.